摘要
背景
大米(栽培稻L.)垩白,由松散堆叠的淀粉和蛋白质形成的核胚乳中的不透明部分。白垩是由多种基因和各种环境因素调节的复杂量性状。植物激素在垩白形成的调节中起重要作用,但目前仍然不清楚的分子机制。
结果
本研究中,湘藻仙子24 (X24,纯系籼稻米饭用高垩白分)及其起源父母祥泽仙子11(X11,女性父母,纯线籼稻米饭用高垩白分)和Xiangzaoxian7(X7,雄性父母,纯线籼稻用低垩白分)用作材料。进行了联合转录组分析的表型,生理和生物化学性状以说明水稻粉状形成的动态过程和转录调节。在Chalky Caryopsis中令人印象深刻地,植物激情含量和多种植物型信号在显着不同,表明通过多种转录因子及其下游调节因子的相互作用,植物激素,特别是ABA和Auxin的参与。
结论
这些结果表明,垩白的形成是一个与多个基因相关的动态过程,形成了一个复杂的调节网络,植物激素在其中起着重要作用。这些结果为阐明水稻垩白形成的调控机制提供了重要线索。
背景
Chalkiness是大米质量的负面特质,代表了米饭中的白色/不透明部分(栽培稻l .)胚乳。大米的垩白度与蒸煮性能密切相关,因此是大米市场的关键特征[1].由于淀粉结构松散,垩白通常以白色呈现,因此垩白可以根据位置分为白腹,白核,白碱,白背和乳白色类型。其中,白核和白腹是最常见的垩白类型[2].扫描电子显微镜(SEM)研究表明,不透明部分松散地用淀粉颗粒和蛋白质(PBS)包装,使得在抛光过程中易受破裂的谷物[3.].
Chalkiness是一种由定量特质基因座(QTL)控制的复杂性状。在水稻基因组的所有12个染色体上映射了多个QTLS粉刺粉末粉状[4.].两个QTL控制谷物的百分比用垩白(PGWC),qPGWC-7型[5.] 和qPGWC-9型[6.],位于染色体7和9上。作为谷物宽度(GW)的主要QTL,GW2.显着提高了粉状水稻的百分比以及谷物宽度和重量[7.].作为Chalky谷物(PCG)百分比的QTL,QPCG1.位于139 kB区域,在染色体的长臂上[8.].在我们以前的研究中,4个QTLS(查尔1那查尔2, CHAL3.和查尔4)与粉状有关的)分别映射在染色体2和6上[9.].然而,在垩白的基础上,研究进展仍然相对较慢。虽然分离出几种粉状相关QTL和基因,但在功能上分析,米粉结的形成和调节机制远非清楚[10.那11.].
垩白的形成也受到各种环境因素的影响。恶劣的高温干旱环境条件强烈促进了垩白的形成。在籽粒灌浆期,高温胁迫可抑制淀粉合成基因的表达,如GBSSI公司和BES,减少直链淀粉含量和增加长链淀粉素[12.那13.]. 在高温胁迫下,α-淀粉酶基因的表达上调。Amy1C那淀粉3A那Amy3D公司和戊基)稻米胚乳中淀粉的降解和垩白的形成有促进作用[14.].干旱胁迫可以诱导抗氧化酶相关基因的表达,然后促进蔗糖合成酶的增加,这将导致粉状形成[15.那16.].此外,在阳光不足的光合产物下减少,过度阳光暴露下的缩短谷物灌装时间可能导致垩白分增加[17.].一般来说,高温、干旱和日照过多或不足是促进水稻垩白形成的主要原因,因为碳代谢相关基因的异常表达[18.那19.那20.那21.].
目前,通常承认水稻垩白是淀粉合成或过量降解后的不足的结果,然后松散淀粉颗粒。一些淀粉合成基因中的突变,例如蜡状[22.],ssiiia.[23.],BEIIb[24.],osapl2.[25.] 和OSPPDKB.[26.,导致垩白表型。此外,淀粉体发育的其他相关因素,如漂浮2 (27.],FLO6.[28.],散萨克[29.], 和isa1.[30.],在淀粉积累和垩白形成中发挥重要作用。储存蛋白是胚乳中的第二大组分,因此蛋白质代谢也会影响垩白形成。在粉状部分中发现千兆和球蛋白显着低于非白垩部分[31.].两个编码13kda脯蛋白的基因在一个缺口水稻突变体的垩白部分的所有发育阶段的表达都减少了[3.]并且两种基因也在高温引起的垩白颗粒中下调[18.那32.].
此外,垩白的形成涉及多种复杂的调控途径。转录因子NF-YB1[33.那34.],rsr1 [35.]和osbzip58 [36.据报道,涉及垩白形成。散航PK1.据报道,它影响淀粉的理化性质,并对籽粒大小、直链淀粉含量和胚乳外观起着关键的负调控作用[37.].粉笔5.[10.],Pdil1-1.[38.],BIP1.[39.那40],osvps9a.[41.],osrab5a.[42.] 和GPA3[43.据报道,涉及蛋白质代谢以介导白垩形成。
最近,发现植物激素涉及垩白酮。较高的养羊酸,细胞素(CKS)和胃纤维素(气体)水平可能导致更多的垩白,而黄玉类化合物(BRS)可以减少垩白分[44.].我们以前的研究表明,由高温引起的中谷灌装阶段的ABA水平增加更加负责白垩形成[45.].ABA / GA比与谷物填充显着相关,高ABA / GA比可以促进谷物填充并减少垩白[46.].然而,植物激素介导的调节网络仍不清楚。
在本研究中,使用具有稳定的粉状表型的水稻品种作为实验材料,以研究白垩形成过程中的转录调节,即湘昭·苏24(X24,纯线籼稻米饭用高垩白分)及其起源父母祥泽仙子11(X11,女性父母,纯线籼稻米饭用高垩白分)和Xiangzaoxian7(X7,雄性父母,纯线籼稻米饭用低垩白性)。在Caryopsis中分析了与转录体测序相结合的表型,生理和生物化学性状。结果表明,淀粉/蔗糖/蛋白质代谢,转录调节和激酶信号中涉及的许多基因在高(X11和X24)和低(X7)垩白多半之间差异表达。进一步的分析发现,植物激素可以通过转录因子和其他调节剂的相互作用介导水稻粉状形成。因此,垩白形成是与多种基因相关的动态过程,并由复杂的调节网络调节,其中植物激素发挥至关重要的作用。我们的研究将为说明米饭中垩白种的监管机制提供信息性的线索。
结果
X24及其两个起源亲本的特性
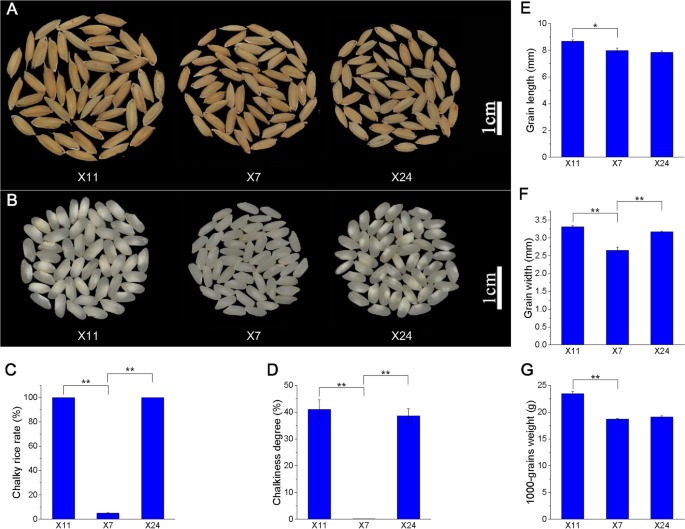
x24(纯线籼稻高垩白度水稻)及其源亲本X11(母本,纯系籼稻米饭用高垩白分)和x7(男性父母,纯线籼稻低垩白度的水稻)在湖南省广泛种植。X11、X7、X24全生育期分别为108 ~ 109 d、108 ~ 110 d、105 ~ 108 d;X11、X7和X24的平均株高分别为80 cm、75 cm和74.2 cm;X11、X7和X24的产量分别为7210、6300和6618 kg/ha [47.]. 成熟籽粒表型和垩白性状如图。1A-B。X11和X24的成熟水稻谷物显示出100%的粉碎米率,分别为40.99%和38.60%的垩白度,而X7显示粉碎度为0.127%的垩白率为5%(图。1C-D)。X11、X7和X24的粒长分别为8.67mm、7.97mm和7.83mm;X11、X7和X24的晶粒宽度分别为3.31mm、2.65mm和3.17mm;X11、X7和X24的千粒重分别为23.44g、18.73g和19.12g(图。1例如)。X11和X24的稳定垩白表型显示出与X7的显着差异。因此,这些水稻品种是研究水稻粉状形成的适当材料及其在转录水平的调节。
谷物灌装阶段的垩白度的动态形成
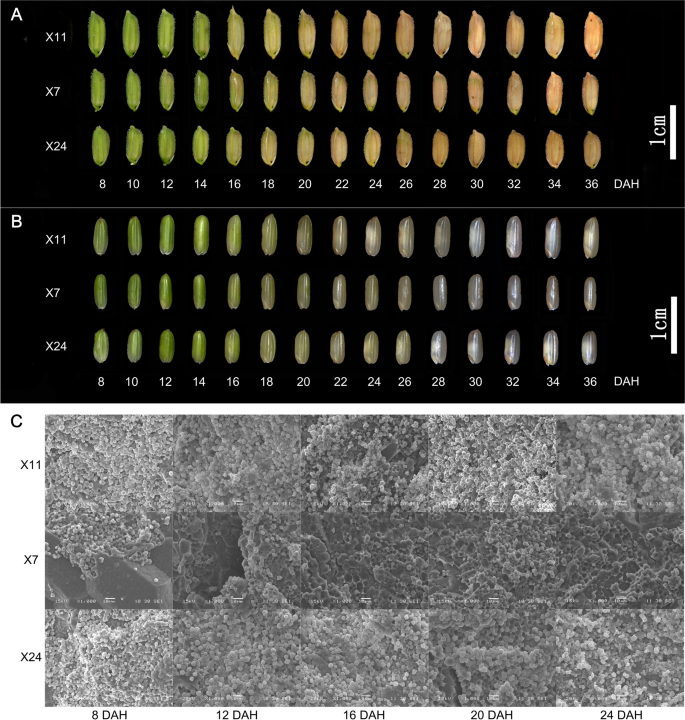
收集米科克斯以在航向(DAH)之后的8至36天后每2天分析谷物填充和垩白形成的动态。Caryopsis的困难是从8到14dah绿色的,并且由于16dAh直到成熟以来,膨胀的颜色变为黄色至黄色(图。2A).灌浆期X11、X24和X7籽粒颖片颜色变化差异不显著。8 ~ 12dah时,颖果仍为绿色,但从20dah开始,X7的颖果开始呈半透明状态,而X11和X24的颖果开始呈白色,腹部不透明。2B). 8 DAH时颖果灌满稀释的白色乳汁,12 DAH时颖果灌满浓缩的白色乳汁开始变硬。随着淀粉和蛋白质的不断积累,颖果的干鲜重持续增加,16 DAH后颖果逐渐变硬。随着籽粒灌浆,X7颖果呈半透明状,而X11和X24的垩白性更明显。
通过SEM分别观察到在8dAh,12dAh,16dah,20dah和24dah收集的Caryopses,以检查胚乳淀粉颗粒的形态是否在高低和低垩白科芥之间是不同的。SEM检查表明,X11和X24的胚乳携带圆形,小巧填充的淀粉颗粒,其中X7的胚乳在8dAh填充大而紧密填充的淀粉颗粒。SEM在12dAh,16dAh,20dAh和24dah的SEM的结果与8dah的相似(图。2C) 是的。自8dah以来,胚乳中积累了大量的淀粉和贮藏蛋白。因此,我们推测调控淀粉和贮藏蛋白代谢的基因在高垩白颖果和低垩白颖果之间存在差异表达。高垩白度和低垩白度颖果淀粉粒的大小、形状和排列方式不同,最终导致垩白度的形成。表型观察和扫描电镜结果表明,灌浆期的3个关键时期分别为8dah、12dah和16dah。因此,我们在8天、12天和16天取样进行植物激素测定和转录组分析。
Caryopsis的Degs分析
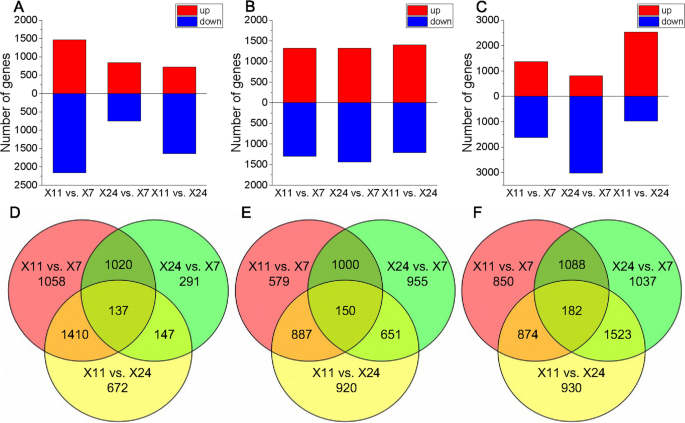
使用每百百万(FPKM)方法每千碱基(FPKM)方法估计基因表达。通过使用以下标准通过分析的样品的成对比较鉴定推定的差异表达基因(DEGS):P.-价值 ≤ 0.05和|对数2折叠更改(FC)|≥ 1.利用这些标准,获得了差异表达基因(DEG)的表达,结果如图所示。3..X11对X7的3625℃(1461调节,2164℃下调),X24与X7(841个上调和754个下调),X11与X24的2366次(724- 在X11与X7(1317调节和1299调节的1317个下调),2616℃,X24与X7(1320调节和1436次下调)中,2616°(1317℃下降)。在12dAh的X11与X24(上调和1209个下调)中的2608℃,X11与X7的2994℃(1368调节和1626次下调),3830℃,X24与X7(812)(812在16dAh在16dAh在X11与X24(2535次上调和974次下调)中占据上调和3018次下调)和3509摄氏度。
基因在X11与X7和X24与X7中差异表达,但不在X11对X24中,这些次数仅在高垩白度和低垩白之间差异表达(DEGHL.),它们可能与垩白有关。进一步分析表明,有1020℃HL.在8dah(491上调,529下调),1000℃HL.在12天(460个上调和540次下调)和1088°HL.在16dah(397个上调和691个下调)(补充图。1一种)。
基因本体(GO)和京都基因和基因组(KEGG)途径测绘的功能分类
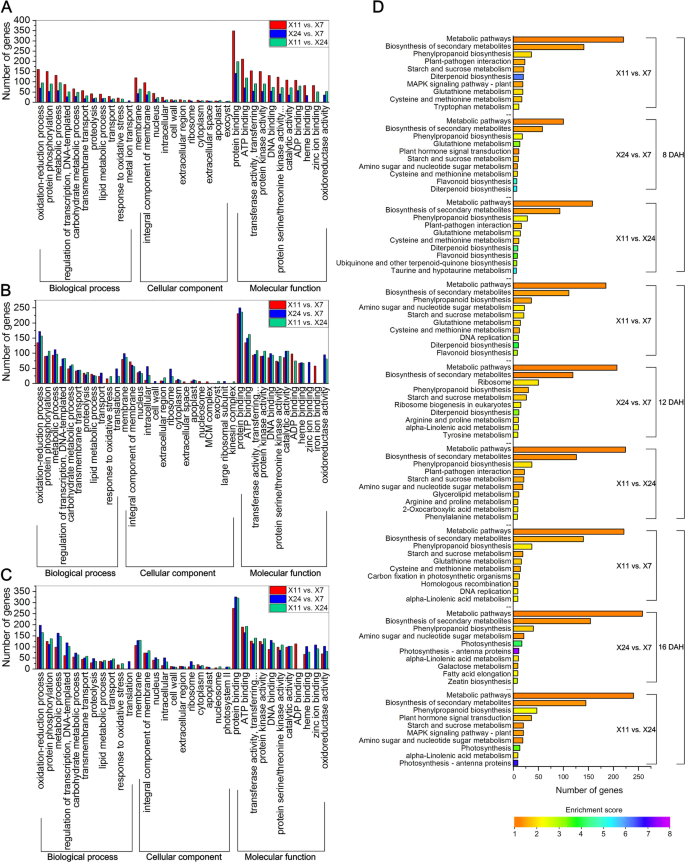
为了评估Caryopsis中这些次数的潜在功能,进行基因本体学(GO)分析。在X11与X7,X24和X11和X11对X24中,8550点,340点和399点,495次,588点,510点,581点,581点,602点和583°at 16 DAH, which were assigned to at least one term in ‘biological process’, ‘cellular component’ and ‘molecular function’ categories (Fig.4.A-C)。Degs的Go功能性富集分析表明,最富集的基因是“分子功能”,第二是“生物过程”,最少是“细胞组分”。在“生物过程”类别中,氧化还原过程(GO:0,055,114),蛋白质磷酸化(GO:0,006,468)和代谢过程(GO:0,008,152)突出地表示在8 DAH,12 DAH和16 DAH。In the ‘cellular component’ category, membrane (GO:0,016,020), integral component of membrane (GO:0,016,021) and nucleus (GO:0,005,634) were prominently represented at 8 DAH, 12 DAH and 16 DAH, while protein binding (GO:0,005,515), ATP binding (GO:0,005,524) and transferase activity, transferring phosphorus-containing groups (GO:0,016,772) dominated the ‘molecular function’ category at 8 DAH, 12 DAH and 16 DAH.
DEG的GO功能浓缩分析HL.showed that in the ‘biological’ process category, metabolic process (GO:0,008,152), oxidation–reduction process (GO:0,055,114), protein phosphorylation (GO:0,006,468), carbohydrate metabolic process (GO:0,005,975), regulation of transcription, DNA-templated (GO:0,006,355) and lipid metabolic process (GO:0,006,629) were prominently represented at 8 DAH, 12 DAH and 16 DAH. In the ‘cellular component’ category, integral component of membrane (GO:0,016,021), membrane (GO:0,016,020) and nucleus (GO:0,005,634) were prominently represented at 8 DAH, 12 DAH and 16 DAH, while protein binding (GO:0,005,515), ADP binding (GO:0,043,531), ATP binding (GO:0,005,524), transferase activity, transferring phosphorus-containing groups (GO:0,016,772) and protein kinase activity (GO:0,004,672) dominated the ‘molecular function’ category at 8 DAH, 12 DAH and 16 DAH (Supplementary Fig.1B) 是的。结果表明,酶活性和代谢调节影响垩白的形成。
为了确定DEGs参与和富集的代谢途径,利用KEGG途径数据库进行了基于途径的分析。如图。4.D,DEG主要属于以下KEGG途径:代谢途径(路径:DOSA01100),二次代谢物的生物合成(路径:DOSA01110),苯丙烷化生物合成(路径:DOSA00940),淀粉和蔗糖代谢(路径:DOSA00500)和氨基糖和氨基糖核苷酸糖代谢(路径:DOSA00520)。
DEG的KEGG路径分配分析HL.表明这很黯淡HL.主要属于代谢途径(路径:dosa01100),二次代谢物的生物合成(路径:dosa01110),在8 dah,主要属于代谢途径(路径:dosa01100),二次代谢物的生物合成(路径:dosa01110),苯丙醇化生物合成(路径:Dosa00940)和淀粉和蔗糖新陈代谢(路径:DOSA00500),在12dah和16dah(补充图。1C)。代谢途径表现出最常见的HL.暗示代谢途径在水稻谷物的生长和发展中起着重要作用。第二大次数HL.与次生代谢物的生物合成相关,表明次生代谢物的生物合成对水稻谷物也很重要,因为水稻谷物的生长和发育也是基于淀粉和蛋白质的积累。淀粉和蔗糖新陈代谢在12dah和16dah的大量中表示。这是不熟悉的,因为糖的代谢在水稻的生长和发展中起重要作用,因此淀粉和蔗糖与垩白形成紧密相关。在8天和12 dah,上调的舞台数量HL.在Kegg途径中的比低调HL.而在16dah时,DEG表达上调HL.明显低于下调的DEGHL..
粉状形成期间淀粉/蔗糖/蛋白质代谢中的基因表达谱
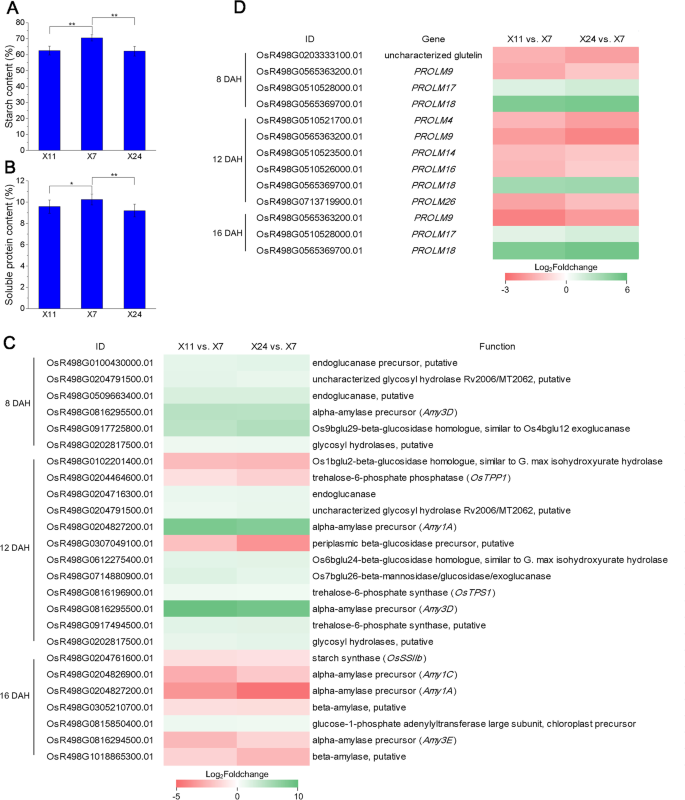
开花后,颖果中开始充满淀粉、蛋白质和脂质。为了分析高垩白度和低垩白度籽粒中物质含量的差异,我们测定了成熟籽粒中淀粉和可溶性蛋白质的含量。X7成熟籽粒淀粉和可溶性蛋白含量高于X11和X24。X7的总淀粉含量为70.53%,高于X11的62.53%和X24的62.15%。X7的可溶性蛋白含量为10.24%,高于X11和X24的9.58%和9.21%。5.a - b)。结果表明,淀粉和可溶性蛋白质含量的降低是垩白形成的原因之一。
由于X11和X24的谷物与X7相比含有较低的淀粉含量,因此我们推测淀粉和蔗糖代谢中涉及的基因可能在高低和低垩白科芥之间表达。转录组分析发现有6°HL.在8 DAH,12 DEGHL.在12天和7°HL.在参与淀粉和蔗糖代谢的16天(图。5.C). In these DEGHL.,在8 dah,α-淀粉酶基因Amy3D公司,2个糖基水解酶基因,2个内葡聚糖酶基因和1β-葡糖苷酶同源物基因进行上调。在12dah,2个α-淀粉酶的雄孢子Amy1A和Amy3D公司1个β -葡萄糖苷酶同源基因和1个β -葡萄糖苷酶基因均显著上调。2个β -葡萄糖苷酶同源基因表达下调,2个糖基水解酶基因表达上调。α -淀粉酶和糖基水解酶是淀粉水解的关键酶,内切葡聚糖酶是纤维素酶系统的主要组成部分,β -葡萄糖苷酶促进纤维素的降解。它们的差异表达表明,淀粉降解和纤维素代谢与灌浆前期和中期垩白的形成有关。此外,海藻糖合成的3个关键酶基因在12dah时有差异表达,表明海藻糖代谢也参与了垩白的形成。在16dah, α -淀粉酶基因Amy1C那Amy1A那戊基下调2个β-淀粉酶基因和淀粉合酶基因osssiib.也受到了下调。因此,我们推测淀粉合成和水解在高垩白科芥的谷物填充后期降低。结果表明,淀粉和糖代谢中的不同基因在谷物填充的不同阶段差异表达,这些动态调节过程最终导致垩白形成。
此外,淀粉粒之间的蛋白质积累是水稻胚乳中第二丰富的成分[48.].越来越多的证据表明蛋白质在垩白形成中的重要性。发现大量的储存蛋白,例如胶林蛋白,谬误和α-球蛋白,在成熟的水稻种子中积累[41.]. 结果表明,X24和X11的可溶性蛋白含量均低于X7。我们推测蛋白质代谢也是垩白形成的一个重要过程。在种子特异性贮藏蛋白中,有4HL.在8天,6°HL.12 DAH和3℃时HL.在16天(图。5.D)HL.,在8dah下仅下调一个胶林蛋白基因,并且在12dah和16dah中没有发现差异表达的谷蛋白基因。另外,表达了普洛尔M17在8天和16天的时间上调了脯氨酸18在8天,12天和16dah上调高,而其他洛霉素基因在8dah,12dah和16dah下调下调。这些结果表明,与储存蛋白质相关的洛霉素和谷蛋白可能与垩白形成有关。
垩白形成过程中植物激素含量及相关基因表达差异
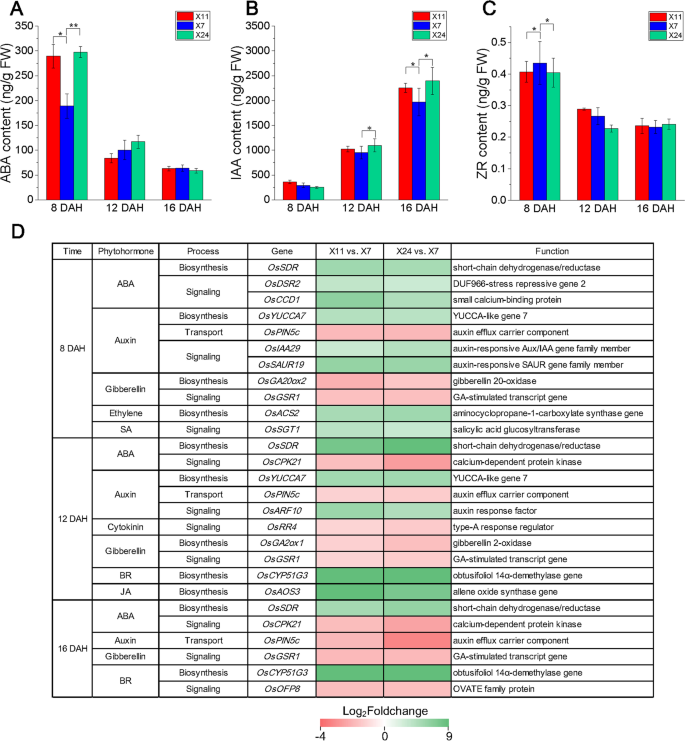
众所周知,植物激素扮演植物生长和发育中的信号分子[49.那50.].因此,我们测量了ABA,IAA和ZR含量(图。6.A-C)分别在Caryopsis,分别为8天,12天和16dAh。阿巴含量在Caryopsis的整体趋势是8天> 12天达> 16天。X11和X24中的ABA含量为289.34 ng / g和297.71ng / g,其低于888.88ng / g的888.88ng / g。在12天和16dAh的高低垩白科芥之间的ABA含量没有显着差异。Caryopsis的IAA内容的趋势是8 DAH <12 DAH <16 DAH。X11和X24中的IAA含量为1023.74ng / g和1097.86ng / g,其在12dah的x7中高于954.69 ng / g。在16dah,X11和X24中的IAA含量为2254.95ng / g和2395.91 ng / g,其高于X7中的1969.66ng / g。在8天的高低垩白科芥之间的IAA含量没有显着差异。Caryopsis中细胞因子Zeeatin核苷(Zr)含量的趋势是8天> 12dah> 16dah,没有显着差异。
为了分析嗜睡形成中植物激素的调节功能,我们分析了与植物主义生物合成和信号传导相关的基因的表达模式(图。6.D).它被发现许多DEGHL.与水稻中的植物激素有关(图。6.d)。OsSDR公司,与ABA生物合成相关的基因在三个取样日期上调。ABA信号相关基因osdsr2.和OsCCD1型在8天中调高。OSCPK21在12日龄和16日龄时下调。基因表达差异导致ABA含量发生显著变化,从8日龄到16日龄呈下降趋势(图1)。6.A) 是的。说明ABA在颖果发育过程中,特别是在灌浆早期起着重要的调控作用。生长素生物合成基因osuucca7.在8天和12天的时间上调。植物敏感响应基因Osiaa29.和奥梅尔19.在12天举行调控。蟾蜍响应因子(ARF)基因osarf10.在12dah时上调。生长素运输基因OSPIN5C.在三个采样日期被下调。这些结果表明生长素在颖果发育过程中,特别是在灌浆后期具有调节作用。赤霉素相关DEGHL.,阳性调节剂基因OSGSR1.在三个采样日期下被下调。吉布林素生物合成的速率限制酶基因,osga20ox2.在8天下被下调,osga2ox1.在12天时被下调。细胞分裂素相关基因在早、晚灌浆期颖果高、低垩白之间的差异较小,说明细胞分裂素在灌浆期中期可能起作用。另外,BR生物合成相关基因OSC751G3.在12dah和16dah时表达上调,在BR信号转导中为阳性调节基因OsOFP8被下调。我们推测,BR主要在谷物灌装的中期和晚期阶段的垩白形成中发挥监管作用。乙烯(Eth)生物合成相关基因osacs2.和水杨酸(SA)信号传导相关基因OsSGT1公司在8 dah上调节,茉莉酸盐(JA)生物合成相关基因OsAOS3在12天内调高,表明这三种植物激素可能在谷物填充的早期和中期发挥作用。植物激素水平和植物激素相关基因表达在8dah,12 dah和16dah的植物相关基因表达的差异揭示了在核苷酸发育过程中的复杂和不同的作用。显然,植物激素是垩白形成中的重要调节因子,因此需要进一步研究潜在的调节机制。
转录因子与植物激素相互作用调控垩白形成的差异基因表达
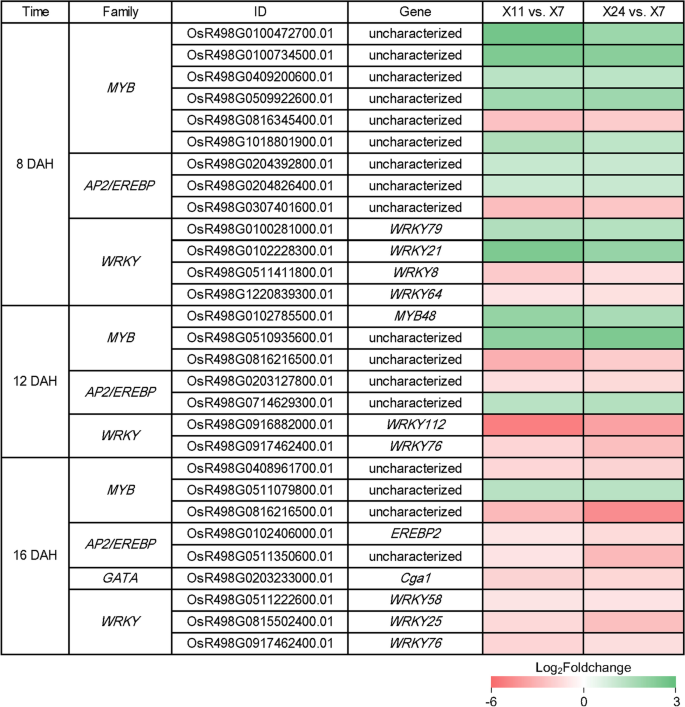
通常,植物激素调节植物生长和发育,并通过与多个调节器的互动介绍对环境的反应。其中,转录因子(TFS)已成为重点。为了筛选植物激素的杂于粉状形成的TFS,详细分析TFS的表达谱。结果表明73my,8 Gras,16bZIP,52岁AP2 / erebp.,7盖塔,2n,5疯狂的S,49怀疑9.TCP在至少一组成对比较中差异表达(表1)。
进一步分析发现13°HL.在8天,7°HL.在12天和9°HL.在16dah以不同的图案差异表达(图。7.),暗示他们在谷物填充的特定阶段的功能。5成员my上调,但1名成员在8天下下调;2成员my是上调的,但1名成员在12天下调了;1个成员my上调,但2名成员在16天下调。据报道,MYB系列是植物耐性强调和发展的重要调节因素[51.].OsMYB48,据报道,这是通过调节压力诱发的ABA合成来发挥抗旱和盐度耐受的积极作用[52.],在12天升上调控,表明其在谷物灌装阶段中期的潜在作用。2AP2 / erebp.8dah时上调1个,下调1个;1.AP2 / erebp.12dah时上调1个,下调1个;2AP2 / erebp.成员在16天下调。欧塞尔巴普2.对ABA有明显的诱导作用[53.],在16天下下调,表明这一点欧塞尔巴普2.可能在颖果转录网络中起重要作用,并对颖果的发育有贡献。据报道,AP2/EREBP成员RSR1通过调节淀粉合成参与水稻垩白形成[35.]. 提示AP2 / erebp.可能有助于开发Caryopsis。wr在8 ~ 16dah之间变化显著。WRKY102和WRKY21上调,和WRKY8公司和WRKY64号在8天时被下调。WRKY116.和WRKY72型在12天下下调,和WRKY58那WRKY25和WRKY76型在16天下调了下调。一些研究表明,大多数腕骨家庭成员都参与了生物和/或非生物应激的反应[54.那55.那56.那57.].oswrky8.据报道,这是由ABA引起的[58.,在8dah时下调。oswrky76.[59.[据报道,据报道,ABA诱导,在12dah和16dah下调。结果表明,OSWRKY8和OSWRKY76可能通过与ABA的相互作用来播放整个谷物灌装阶段的调节功能。Cga1(盖塔成员)被报道被赤霉素诱导表达[60.],它表现出16天的表达下降。这些结果表明,TFS在不同阶段显示不同的模式,以通过与植物激素的相互作用调节Caryopsis和Chinkiness地层的发展。
激酶的差异基因表达用植物激素与植物激素进行调节粉状形成
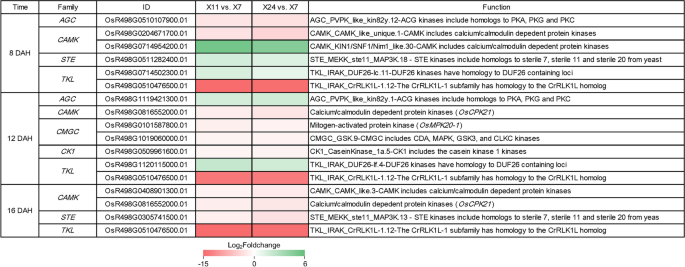
一些蛋白激酶(PKS)参与植物型信号传导[61.]. 植物AGC激酶介导生长素信号调节植物的生长和形态发生[62.].据报道,TKL在植物响应各种外部信号中起着至关重要的作用[63.].例如,富含亮氨酸的重复(LRR)受体样PKS Bri1和Bak1涉及BR信号转导拟南芥[64.那65.].此外,OSRPK1参加了ABA信令路径[66.].通过调节ABA信号传导并降低反应性氧物质的积累,若干CDPK已被证明是非生物胁迫耐受性的基本因素[67.].OSWNK9在ABA介导的应力耐受机制中起作用[68.].Degs的Go功能性富集分析表明,蛋白质磷酸化和蛋白质丝氨酸/苏氨酸激酶活性在8dah,12dah和16dah中富集(图。4.A-C)。进一步的分析表明5AGC.,32CAMK.,5CGMC,2CK1,17ste.30.TKL.在至少一组成对比较中差异表达(表2)。
在这些pks中,有6°HL.在8天,7°HL.在12天和4°HL.在16天(图。8.)。在8 dah,1CAMK.,1ste.和1TKL.上调,1AGC.,1CAMK.和1TKL.被抑制。在12dah, 1AGC.和1TKL.上调,2CAMK.,2CGMC,1CK1和1TKL.被抑制。16 dah,2CAMK.,1ste.和1TKL.被抑制。结果表明,微分表达式CAMK.和TKL.被发现在8天,12天和16天,和霜的数量HL.在这两组比其他组多。与此同时,TKL.成员 (OSR498G0510476500.01)显着下调(日志2在三个采样日期下折叠折叠<-10)。OSCPK21,参与了对ABA的反应[69.,在12dah和16dah下调。因此,我们推测,一些与植物激素相互作用的PKs可能是颖果发育和垩白形成的重要调控因素。
DEG验证HL.通过实时PCR分析
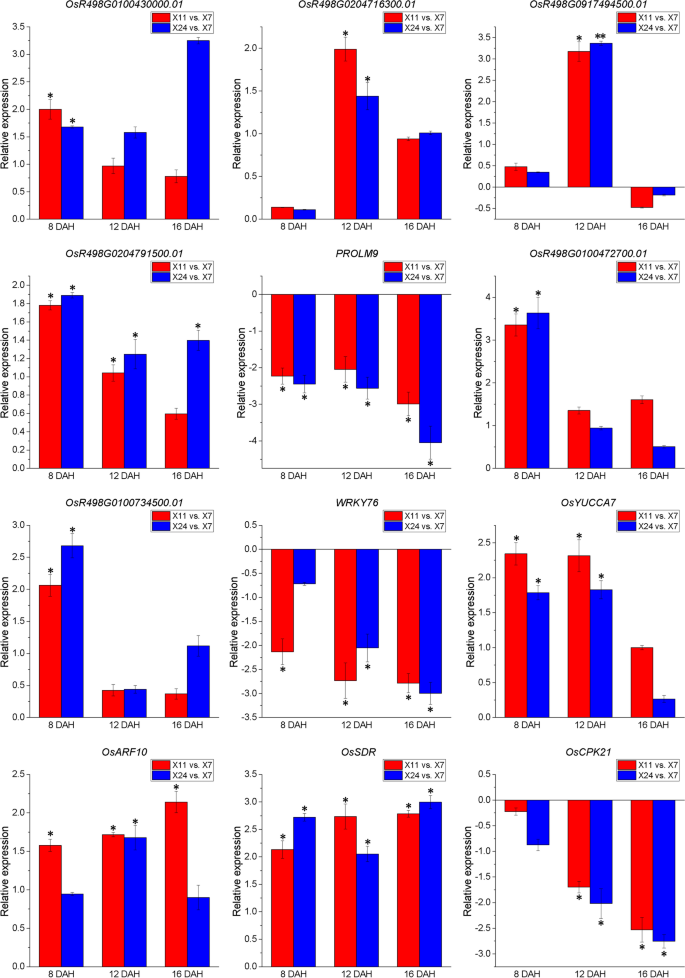
为了验证RNA-SEQ数据,12°HL.选择通过实时PCR分析确认表达,包括5°HL.参与淀粉/蔗糖和蛋白质代谢(OSR498G0100430000.01那OSR498G0204716300.01那OsR498G0917494500.01型那OSR498G0204791500.01和PROMM9),3°HL.编码TFS(OSR498G0100472700.01那OSR498G0100734500.01和WRKY76型),3°HL.与Phytohormonal Biosynthesis和信号(osuucca7.那osarf10.和OsSDR公司),1度HL.编码PKS(OSCPK21)。对于这12°HL.,实时PCR结果中的表达模式类似于RNA-SEQ数据(图。9.),结果还验证了RNA-SEQ数据的可靠性。在未来的研究中,我们将专注于这些DEGHL.调查他们对白垩形成的调节。
讨论
垩白形成是一种动态过程
垩白度与籽粒灌浆动力学密切相关,而灌浆动力学的无序是垩白形成的重要原因。在本研究中,颖果颖壳的颜色在16dah时由绿色变为黄色直至成熟,自16dah开始颖果皮逐渐变硬。自20dah以来,X7颖果开始呈半透明状态,X11和X24颖果的腹部开始形成垩白(图1)。2a - b)。说明颖果籽粒灌浆过程中垩白的形成是一个动态过程。X11和X24胚乳中携带有小的、圆形的、松散的、有空隙的淀粉颗粒,而X7胚乳在8 DAH时则充满了大的、紧密的淀粉颗粒(图1)。2C)。12天,16dAh,20dah和24dah的胚乳与8dah相似。它表明,在早期籽粒灌装阶段的高低垩白多半的淀粉颗粒的不同尺寸,形状和布置,导致对比的垩白形成。有1020°HL.8 DAH, 1000℃HL.在12天和1088°DegHL.在16天(补充图。1广告)。DEG的KEGG路径分析HL.表明这很黯淡HL.主要属于代谢途径,8 DAH时次生代谢物的生物合成和DEGHL.主要属于代谢途径,二次代谢物的生物合成,苯丙烷化生物合成,12dAh和16dah的蔗糖和蔗糖代谢(补充图。1F)。这些沼泽HL.与Caryopsis开发密切相关,表明垩白形成是由多种基因调节的动态过程。
淀粉/蔗糖/蛋白质代谢参与垩白形成
垩白形成由多个复杂的调节器控制。淀粉是光合作用的最终产物,作为水稻谷物的能量储备储存。直链淀粉和淀粉蛋白是淀粉的两个主要成分[70]. 直链淀粉由AGPase和GBSS合成,支链淀粉由AGPase、SS、BE和DBE合成[71.那72.].突变ssiiia.[23.] 和BEIIb[23.那24.[参与淀粉生物合成途径是否显示出缺陷的淀粉伞型发育和粉状表型。蔗糖对于Caryopsis开发也很重要,因为细胞壁和淀粉生物合成的能量和碳骨架来源73.那74.].UGPase1调节蔗糖的利用,致命葡萄糖氧化酶1基因导致支链淀粉长链减少,淀粉结构改变,导致垩白形成[75.].此外,还报告了与淀粉片的发展有关的其他因素,例如漂浮2 (27.],FLO6.[28.],FLO7.[76.],FLO10[77.],FLO16[78.],SSG4型[79.] 和SSG6型[80],osagpl2.[25.],散萨克[29.],isa1.[30.]. 在我们的结果中,α-淀粉酶基因在早期表达上调(Amy3D公司)及中期(Amy1A和Amy3D公司)籽粒填充,但在晚期下调(Amy1C那Amy1A和戊基)填充高垩白粒的谷物。淀粉合成基因(osssiib.)在晚谷灌装阶段下调。这些结果表明淀粉和蔗糖代谢与垩白形成密切相关。同时,糖基水解酶,淀粉水解中的关键酶,在8dah上调节(OSR498G0204791500.01和OSR498G0202817500.01)和12 dah(OSR498G0204791500.01和OSR498G0202817500.01)(图。5.C)。两个β-淀粉酶基因(OsR498G0305210700.01和OSR498G1018865300.01)在16天下调了下调。结果表明,在早期和中谷填充阶段的α-淀粉酶和糖基水解酶,淀粉合成和水解在高谷物灌装阶段的高粉末灌浆阶段下降。此外,与纤维素降解有关的内切葡聚糖酶和葡萄糖苷酶在8dah差异表达(OSR498G0100430000.01那OSR498G0509663400.01和OsR498G0917725800.01型)和12 dah(OSR498G0102201400.01那OSR498G0204716300.01那OSR498G0307049100.01那OSR498G0612275400.01和OSR498G0714880900.01)和海藻糖合成酶基因(OSR498G0204464600.01那OsR498G0816196900.01和OsR498G0917494500.01型)在12dah中也差异表达(图。5.C) 说明非淀粉多糖代谢也可能参与垩白的形成。
蛋白质代谢基因的异常表达,如Pdil1-1.[38.],BIP1.[39.那40],osvps9a.[41.] 和osrab5a.[42.],可以引起垩白。过度表达粉笔5.影响端膜蛋白贩运系统,导致蛋白质数量异常,并导致淀粉颗粒和蛋白质中的空气空间[10.].两个编码13kda蛋白的基因在垩白粒中被下调[3.那18.那32.[以前的研究还报道,在谷物中较低浓度的丙振素和球蛋白的较低浓度[31.].在这项研究中,PROMM9在8天,12天和16dah在8天,12天和16dah中被垩白曲调受到了下调;PROMM4那脯氨酸14那脯氨酸16和PROLM26在12dAh的垩白曲调被下调(图。5.B).这些结果表明,脯氨蛋白也可能在垩白的形成中起作用。
植物激素通过复杂的互动网络调节垩白的形成
复杂的垩白形成过程受到多种环境因素的影响,意味着一个复杂的监管网络在水稻中介导这些过程。以前的研究发现,水稻胚乳开发期间的植物形态动力学在谷物质量中起重要作用。其中,生长素和BRS对胚乳的发展很重要[81那82那83那84那85].最近,一项研究表明,生长素,CKS和气体水平的增加导致更高的垩白,而BRS减少了白垩[44.].在这项研究中,我们发现,在高垩白科芥16天的情况下,ABA含量较高,IAA含量较高(图。6.A-B)。ABA、生长素、GAs、ETH、SA、JA和BRs等生物合成和信号转导中的一些重要基因在高垩白颖果和低垩白颖果中的表达存在显著差异(图。6.D) ,尤其是OsSDR公司(aba生物合成),osuucca7.(营养生物合成),OSC751G3.(BR生物合成),Osaos.3(JA Biosynthesis),osdsr2.(aba信令),OsCCD1型(aba信令),Osiaa29.(助线信令),奥梅尔19.(助线信令)和osarf10.(助线信令)。植物激情信号传导中基因的差异表达还导致响应基因表达的变化,这可能是垩白形成的另一种原因。
TFS在植物生长和发展中非常重要,并且许多TFS通过与植物激素的相互作用。NF-YB1通过与ERF转录因子相互作用并直接结合蔗糖转运蛋白Sut1,Sut3和Sut4的三种基因表达调节区域来调节籽粒填充和胚乳的发育。33.那34.].与此同时,NF-YB1直接特异性地结合到G-boxWx公司发起人[86, G-box参与了对植物激素的反应[87].因此,植物激素也可能参与了NF-YB1调控籽粒灌浆和胚乳发育的网络。RSR1是一个AP2/EREBP转录因子,它负调控I型淀粉合成基因的表达(在种子中;),在I型共表达基因中,其中一些也参与了对GAs和ABA刺激的响应[35.]. OsbZIP58调控水稻胚乳淀粉合成[36.[奥斯洛尔1和OSBZIP58之间的相互作用通过激活来影响气体生物合成osko2.通过OSBZIP58 [88].有趣的是,突变NF-YB1[33.那34.],NF-YC12[89],rsr1.[35.],OsbZIP58[36.]导致垩白表型。在我们的测试中,几个编码TFs的基因在高垩白度颖果和低垩白度颖果之间存在差异表达,包括6个my,3亚太地区2,4怀疑在8 dah,3my,2亚太地区2和2怀疑在12 dah,3my,2亚太地区2,1盖塔和3.怀疑在16天(图。7.)。在这些TFS中,OSMYB48 [52.],奥塞佩布2 [53.],oswrky8 [58.],奥斯基76[59.据报道,据报道,参与ABA的合成或信号通路。因此,我们预测这些TFS可以通过与植物激素相互作用来调节晶粒发育和垩白形成。
PKS在真核细胞中几乎所有细胞过程中的主要调节组分[90]. 几种PKs参与植物激素信号转导。OsCDPK1在籽粒大小、直链淀粉含量和胚乳外观的负调控中起关键作用[37.]. 同时,OsCDPK1通过下调GAs的合成来抑制GAs生物合成的反馈GA3OX2和GA20Ox1[91].我们的结果表明,在高低和低垩白多半的核和低垩白多半的差异表达了几种编码PKS的基因(图。8.)。在这些PKS中,据报道,OSCPK21涉及对ABA的反应[69.[因此,它可能会通过参与ABA信号通路来影响Caryopsis的发展。植物AGC成员参与助长信号传导[62.],有些tkl [66.]还有卡姆[67.那68.]的成员参与ABA信号转导。因此,PKs可能通过与植物激素的相互作用参与颖果的发育和垩白的形成。
不同植物激素之间的相互作用调节垩白的形成
该报告显示,在不同的种子隔室中产生植物激素的梯度,它们的比率包括诱导/抑制种子发展中的特定方法的信号[92]. ABA能提高籽粒中ADP-葡萄糖焦磷酸化酶和淀粉酶的活性,从而促进淀粉的合成[93]. Z和ZR含量与胚乳细胞分裂率呈极显著正相关[94].在我们的研究中,早期籽粒灌装阶段的高ABA和ZR含量,这对籽粒灌装有益。CKS的活性与养肝剂一起与细胞分裂,开发和分化的生长促进相连[95[据报道,植物蛋白是负责通过反馈机制抑制CKS信号的抑制[96].在这项研究中,Caryopsis的IAA含量的趋势是8 dah <12 dah <16dah,而Zr含量的趋势是8dah> 12 dah> 16dah模式,因此IAA和Zr之间的相互作用可能在Caryopsis中发挥重要作用开发和垩白形成。此外,在8 dah,Aba / Iaa,Aba / Zr和IAA / Zr在高垩白科芥均高于低垩白孔Caryopsis,表明植物激素含量和动态变化,浓度梯度和不同植物激素的比例可以调节下游基因的表达,从而调节晶粒发育和垩白形成。
总的来说,垩白的形成是一个动态的过程,不仅受环境因素的影响,而且受多个基因的控制,从而形成一个复杂的调控网络。重要的是,垩白颖果的多种激素信号存在显著差异,尤其是ABA和生长素信号。因此,在垩白形成过程中,植物激素通过多个转录因子及其下游调控因子的相互作用发挥重要作用。
结论
米粉结是一种由多种基因控制的复杂性状。作为一个重要的稻米品质特质,垩白不仅影响水稻的质量,而且影响其价格。如何有效减少大米的垩白是水稻生产的紧急任务。在该研究中,X24及其起源父母X11和X7用作材料,并进行了从上述品种的Caryopsis中与转录组分析相结合的表型,以说明水稻粉状的动态形成和转录调控。与淀粉/蔗糖/蛋白质代谢和植物激烈调节有关的基因的表达谱,转录因子和PKS在8天,12dAh和16dah的PKS表明,垩白形成是与多种基因相关的动态过程,形成复杂的监管网络其中植物激素在其中发挥着至关重要的作用。我们的结果为说明粉状地层含量的监管机制提供了信息性的线索。
方法
植物材料及生长条件
X24、X11、X7各为纯线籼稻不同垩白性状的水稻。X11(纯线籼稻用高垩白分的米饭是通过穿过Zhefu802和Xiangzaoxian1作为起源父母,成立于F7.谱系方法的一代[47.那97].X7(纯线籼稻用低垩白分的米饭通过越过81-280和Ha79317-4作为原始父母,这是成立于F的5.谱系方法的一代[47.那98].x24(纯线籼稻通过作为女性父母和x7作为男性父母的X11繁殖米饭。它成立至f6.通过谱系方法产生哪种优越个体选自F.2一代 [47.那99].显然,X24的垩白是从女性父母X11继承的。将三种稻种子浸泡在37℃下浸入蒸馏水2天,然后在自然条件下洒在湿润土壤中撒上发芽的种子。30天后,将幼苗转移到盆中,每种盆栽的每种品种和3株植物。植物在天然条件下生长,每日平均温度32°C和夜平均温度24℃。
白垩度测量
收获成熟的晶粒并在37℃下干燥5天,然后通过微CT扫描和3D重建技术测量Chalky米率和垩白度[100].米粒嵌在超轻粘土中(从中国阿里巴巴订购)。将样品装入SkyScan 1172 Micro-CT (Bruker, Belgium)并进行三维扫描。然后,根据MIS的分割和三维重建原理,利用micro-CT系统采集的一系列横断面图像进行垩白定量。同时用MIS计算出垩白部分的体积,并对垩白度进行精确定量。三维重建后,横截面图像变成平滑的平面。这样就能很好地区分光滑的平面图像,并通过垩白2.0准确地量化垩白米率[101].
测量粒度和尺寸
收获成熟晶粒并在37℃下干燥5天,以测量粒度和尺寸。总共有1000个晶粒从每个样品中随机计数,并通过电子平衡(Aux220,Shimadzu,Kyoto,Japan)称重以测量粒度。使用Chalkiness 2.0软件测量每个样品的粒度和宽度[101].
扫描电子显微镜(SEM)
通过扫描电子显微镜(SEM)检查在8dah,12dah,16dah,20dah和24dah收集的凯富ORA。将Caryopsis脱滤并完全在低压下干燥,然后用剃刀叶片将脱落的Caryops脱落,作为样品,作为样品的样品,由离子溅射装置(JFC-1600)涂覆有金的切割表面(JFC-1600,Jeol,东京,日本)。观察到这些样品用扫描电子显微镜(JSM-6380LV,Jeol,Tokyo,Japan)拍摄。SEM分析基于安装标本的至少三种生物复制。所有程序根据制造商的议定书进行。
籽粒淀粉和可溶性蛋白质含量的测定
取样成熟的晶粒以测量淀粉和可溶性蛋白质含量。将晶粒在37℃干燥,并将脱水晶粒研磨成粉末以通过蒽酮方法分析淀粉含量[10.].加入50mg粉末2ml热蒸馏水,沸水15分钟,然后加入200μl高氯酸(9.2mol / L)提取淀粉10分钟,然后体积为10ml,4,000g(5415r,eppendorf,德国)加入10分钟,加入200μl上清液,加入100μl2%蒽酮试剂(溶解的乙酸乙酯),然后加入1ml H.2所以4.慢慢地。200μL蒸馏水加100μl2%蒽酮试剂加1ml H.2所以4.作为对照,在完全反应后沸水10分钟。使用酶标记的仪器(Spark,Tecan,Switzerland)在620nm下检测200μl溶液。使用0,40,80,120,160和200μg/ ml的淀粉溶液作为制备标准曲线的标准溶液,并且根据标准曲线计算每个样品中的淀粉含量。
根据Bradford测定测量可溶性蛋白质含量[102].将50mg粉末加入1ml 0.25%NaOH和震动萃取30分钟,然后在40℃下进行30分钟,然后体积为10mL,3,000g 10分钟,取出200μl上清液,加入1ml Coomassie亮蓝G-250(20将Mg Coomassie亮的蓝色粉末溶解在10ml 90%乙醇中,用20ml 85%磷酸和10ml蒸馏水),然后在室温下混合并设定静止2分钟,加入200μl蒸馏水1ml Coomassie辉煌的蓝色g-250作为ck。使用酶标记的仪器在595nm下检测200μl溶液。使用0,20,40,60,80和100μg/ mL的牛血清致密溶液制备标准曲线,并且根据标准曲线计算每个样品中的可溶性蛋白质的含量。
颖果中植物激素含量的测定
在X11、X7、X24的17:00-18:00时,于8、12、16 DAH时收集穗顶1-4茎部颖果,立即用铝箔包裹,液氮冷冻,然后在-80℃保存至测定植物激素含量为止。以3个穗粒的颖果为一个样品,在3个生物重复中进行测定。植物激素采用液相色谱-串联质谱(8030 +,岛津,京都,日本)定量[103].通过液氮将100mg Caryops冷冻,并且使用研钵溶液均匀化至粉末。加入1ml 80%甲醇(HPLC级,达摩尔,德国),通过超声波浴(KQ3200E,昆山超声波,中国)均匀均匀化并保持在4°C,12小时,100μL内部标准氘标记的植物激素(2H6.阿坝,2H5.-iaa,2H5.-ZR, Olchemim, Olomouc,捷克共和国)加入并混合。12000 g (5415R, Eppendorf, Germany)离心10分钟,收集上清液。然后加入80%甲醇(HPLC级,德国默克达姆施塔特公司)200 μL悬液沉淀,4℃保存4 h。12000 g离心10 min(4℃)后收集上清,与第一上清合并。将组合上清液在真空浓缩器(RCT 60, Jouan, France)中干燥,干燥后的提取液在100 μL的10%甲醇中溶解并混合。12000 g离心10 min(4℃)后,用液相色谱法纯化25 μL溶液。采用UPLC BEH C进行液相色谱分析18.柱下柱温40°C。流动相为A (0.02% [v/v]水乙酸)和B (100% [v/v]甲醇),流速为0.25 mL/min,梯度洗脱(时间/A浓度/B浓度[min/%/%]: 0/90/10、5/10/90、6/10/90和6.1/80/20)。再次抽真空将洗脱液吸干,用20 μL 10%甲醇溶解,然后注入液相色谱-串联质谱系统。IAA的碰撞能为-16 eV,质荷比(m/z)为174.2/130;ABA的碰撞能为11 eV, m/z为263.2/153.2;ZR的碰撞能为-19 eV, m/z为352.2/220.1。实验重复3次(3个生物重复),每个重复3次,均得到相似的结果。
总RNA提取,文库制备和DE Novo测序
在X11、X7和X24的17:00 ~ 18:00,于8dah、12dah和16dah收集穗顶1-4茎部颖果,立即用铝箔包裹,液氮冷冻,-80℃保存至用于转录组分析。3株颖果作为1个样品,在3个生物重复中采集。采用Trizol Reagent (Invitrogen, USA)从颖果中提取总RNA,用1%琼脂糖凝胶检测RNA降解和污染情况。使用NanoPhotometer®分光光度计(IMPLEN, CA, USA)检测RNA纯度,使用Qubit®RNA Assay Kit in Qubit®2.0 Flurometer (Life Technologies, CA, USA)检测RNA浓度。使用安捷伦生物分析仪2100系统(安捷伦技术,CA,美国)的RNA Nano 6000检测试剂盒评估RNA完整性。每个样品共1.5 μg RNA作为RNA样品制备的输入材料。使用美国NEB公司的NEBNext®UltraTMRNA Library Prep Kit for Illumina®(NEB, USA)构建测序文库,然后用Illumina Hiseq 4000 (Illumina, USA)测序,生成150 bp的对端reads。
de novo转录组装配和功能注释
使用NGS QC Toolkit [104[含有PLOY-N和低质量读取的读取以获得清洁读取。通过HTSEQ计数获得每个基因的读数[105]使用袖扣计算每个基因的FPKM值[106]. 使用DESeq(带重复)功能estimateSizeFactors和nbinomTest鉴定差异表达基因[107].P.-价值 ≤ 0.05和|对数2折叠更改(FC)|≥ 1通过GO(Gene Ontology)功能和KEGG(Kyoto Encyclopedia of genes and Genomes)途径富集,筛选并分析了DEGs基因的表达差异。
实时PCR分析
从X11,X7和X24的8dAh,12dAh和16dAh收集的Caryopsis中提取总RNA。通过GDNA污染纯化总RNA,并使用转肌型单步GDNA去除和cDNA合成超胶(Transgen,南京)的CDNA逆转录。在CFX96-CFX384实时PCR系统(BIO-RAD,USA)上以含有1μl的1μl稀释的cDNA模板的最终体积进行PCR程序,在20μL的1μl1/ 5稀释的cDNA模板,10μl的2×Chamq Sybr母版中混合(vazyme,中国)和0.5μl(10μm)的正向和反向引物。热循环仪设置由95℃的初始保持30 s,然后在95℃下为10 s,60°C循环30秒。进行三种生物复制和三种平行反应。actin基因籼稻米饭用作内标,基因引物显示在表中3..
统计分析
所有实验均在至少三个重复中进行。使用Microsoft Excel软件评估统计显着性。值表示为平均值±SE。
可用性数据和材料
本研究中使用和/或分析的数据集可根据合理要求从相应作者处获得。
缩写
- 扫描电镜:
-
扫描电子显微镜
- PBs:
-
蛋白质
- QTLS:
-
定量特质基因座
- PGWC:
-
谷物垩白的百分比
- PCG:
-
白垩粒百分率
- 阿坝:
-
脱盐酸
- 国际广告协会:
-
吲哚-3-乙酸
- CKS:
-
cytokinins.
- 气体:
-
赤霉素类
- Z:
-
扎丁
- zr:
-
扎丁核苷
- 青年成就组织:
-
茉莉酸盐
- eth:
-
乙烯
- SA:
-
水杨酸
- BRS:
-
Brassionosteroids公司
- 天:
-
标题后的几天
- 度:
-
差异表达基因
- deHL.:
-
Degs仅在高垩白度和低垩白之间差异表达
- TFS:
-
转录因素
- PKS:
-
蛋白激酶
- 去:
-
基因本体论
- KEGG:
-
Kyoto基因和基因组的百科全书
参考文献
- 1。
Kim SS,Lee SE,Kim OW,Kim DC。垩白米粒理化特性及其对米饭感官品质的影响。谷物化学。2000;77(3):376–9.
- 2。
Ishimaru T,Horigane Ak,Ida M,Iwasawa N,San-Oh Ya,Nakazono M,Nishizawa NK,Masumura T,Kondo M,yoshida M.形成在高温下生长的水稻Caryopses粮食粉状和水分布变化的形成压力。j麦片sci。2009; 50(2):166-74。
- 3.
林Z,王Z,张X,刘Z,李克,王某,丁Y.缺口腹水稻突变体显影粒子中的互补蛋白质和转录组谱揭示了垩白形成的关键途径。植物细胞生理。2017; 58(3):560-73。
- 4.
林Z,郑D,张X,王z,雷j,刘z,李g,王某,丁y。用白色缺口腹部突变体透露的粳稻谷物半透明部分的化学成分不同。-腹部。J SCI食物农业。2016; 96(11):3937-43。
- 5。
周磊,陈磊,姜磊,张伟,刘磊,刘鑫,赵智,刘松,张磊,王杰,等。水稻垩白性QTL qPGWC-7的精细定位(栽培稻l .)。理论苹果类型。2009; 118(3):581-90。
- 6。
刘捷,奎LM,朱泽,棕褐色仪表,孙CQ。鉴定QTLS与普通野生稻的加工质量和外观质量相关(oryza rufipogon.格里夫。)。JAgric Biotechnol。2007; 15:90-6。
- 7。
宋XJ,黄W,石门,朱MZ,林HX。用于水稻颗粒宽度和重量的QTL编码先前未知的环型E3泛素连接酶。NAT Genet。2007; 39(5):623-30。
- 8.
朱安,张勇,张震,王斌,薛鹏,曹勇,陈勇,李忠,刘强,程松,等。水稻垩白粒率数量性状位点qPCG1的遗传解剖(栽培稻l .)。前植物SCI。2018; 9:1173。
- 9.
水稻垩白相关生理特性研究及垩白性状QTL分析籼稻白饭。长沙:湖南农业大学;2002年。
- 10
李啊,风扇,邢y,yun p,罗l,yan b,彭b,谢w,王g,李x等。粉笔5.编码一个真空H.+- 影响焦磷酸酶影响水稻中的晶粒粉状。NAT Genet。2014; 46(4):398-404。
- 11.
Zhao X, Daygon VD, McNally KL, Hamilton RS, Xie F, Reinke RF, Fitzgerald MA。9个环境下水稻籽粒垩白稳定qtl的鉴定。中国生物医学工程学报,2015;
- 12.
关键词:水稻,支链淀粉,灌浆,温度,结构Starch-Starke。2010年,51(2 - 3):58 - 62。
- 13。
asaoka mm,Okuno K,Sugimoto Y,Kawakami J,Fuwa H.环境温度在水稻植物开发过程中的影响胚乳淀粉的一些性能。Starch-Starke。2010; 36(6):189-93。
- 14。
Hakata M,Kuroda M,Miyashita T,Yamaguchi T,Kojima M,Sakakibara H,Mitsui T,Yamakawa H.抑制α-淀粉酶基因的抑制改善了在高温下成熟的水稻谷物的质量。植物Biotechnol J. 2012; 10(9):1110-7。
- 15.
Lin Sk,Chang Mc,Tsai Yg,Lur HS。Caryopsis发育中水稻质量相关蛋白质表达及高温对表达的影响。蛋白质组学。2005; 5(8):2140-56。
- 16。
关键词:水稻,硫饥饿,光合作用,碳水化合物代谢,氧化应激杂志。2010;134(3):508 - 21所示。
- 17。
江W,周M,李T.早期籼稻白垩形成的解剖学研究。J浙江大学。2002; 29(4):459-63。
- 18。
Yamakawa H,Hirose T,Kuroda M,Yamaguchi T.使用DNA微阵列在高温下稻粒填充相关基因的综合表情谱。植物理性。2007; 144(1):258-77。
- 19.
Maccarrone M,Melinog,Finazzi-Agro A.脂氧基和它们参与编程的细胞死亡。细胞死亡有所不同。2001; 8(8):776-84。
- 20。
Gorantla M,Babu P,Lachagari V,Reddy A,Wusirika R,Bennetzen J,Reddy A.识别应激响应基因籼稻米饭(栽培稻L.)使用从干旱胁迫的幼苗产生的EST。j eporany。2007; 58:253-65。
- 21。
Cheng C, Yun K, Ressom H, Mohanty B, Bajic V, Jia Y, Yun S. de los Reyes B:低温和过氧化氢诱导的耐冷粳稻幼苗早期反应调控簇。BMC基因组学。2007;8:175 - 93。
- 22。
Mikami I,Aikawa M,Hirano Hy,Sano Y.改变了组织特异性表达Wx公司水稻不透明突变体的基因。Euphytica。1999; 105(2):91-7。
- 23。
富士田N,吉士达M,Kondo T,Saito K,Utsumi Y,Tokunaga T,Nishi A,Satoh H,Park JH,Jane JL等。水稻SSIIIA缺陷突变体的表征:SSIIIA缺乏水稻胚乳缺乏症的功能。植物理性。2007; 144(4):2009-23。
- 24。
水稻胚乳淀粉延长体突变效应的生化和遗传分析。植物杂志。2001;127(2):459 - 72。
- 25。
张D,吴j,张y,shi c.一种新的粉胚乳突变体的表型和候选基因分析(第2-3页))在米饭里。植物分子生物学报告。2012;30(6):1303–12.
- 26。
水稻白核胚乳花粉胚乳-4是通过敲除c4型丙酮酸正磷酸二激酶基因(OSPPDKB.)。工厂J. 2005; 42(6):901-11。
- 27。
她KC,Kusano H,Koizumi K,Yamakawa H,Hakata M,Imamura T,Fukuda M,Naito N,Tsurumaki Y,Yaeshima M等。一个新因素泛骨腹皮参与水稻粒度和淀粉质量的调节。植物细胞。2010; 22(10):3280-94。
- 28。
彭C,王义,刘F,任y,Zhou K,LV J,Zheng M,Zhao S,Zhang L,王C.泛滥的endosperm6.编码参与化合物颗粒形成和水稻胚乳中的淀粉合成的CBM48含域的蛋白质。工厂J. 2014; 77(6):917-30。
- 29。
Satoh H,Shibahara K,Tokunaga T,Nishi A,Tasaki M,Hwang Sk,okane Tw,Kaneko N,Fujita N,Yoshida M等人。水稻血浆α-葡聚糖磷酸化酶基因的突变会影响胚乳中淀粉的合成和结构。植物细胞。2008; 20(7):1833-49。
- 30
超顺丰,蔡玉成,冯宝波,焦嘎,盛志辉,罗娟,唐树青,王建林,宋海平,魏晓军。水稻同淀粉酶基因的编辑isa1.在淀粉形成中提供洞察力。米科。2019; 26(2):77-87。
- 31
林传杰,李春英,林士基,杨芳华,黄建军,刘永红,鲁海生。灌浆期高温对水稻贮藏蛋白质积累和籽粒品质的影响(栽培稻l .)。农业化学学报。2014;58(19):10545-52。
- 32
高温条件下水稻籽粒灌浆相关代谢图谱:代谢组和转录组联合分析表明,高温条件下水稻籽粒灌浆相关代谢抑制淀粉积累,诱导氨基酸积累。植物生理学杂志。2010;51(5):795-809。
- 33
白安,卢XD,李德克,刘杰,刘厘。NF-YB1调节蔗糖转运蛋白在阿列酮中的表达促进了糖负荷对水稻胚乳。细胞res。2016; 26(3):384-8。
- 34
徐杰,张XF,薛鹤。米梨酮层特异性OSNF-YB1通过与ERF转录因子相互作用来调节谷物填充和胚乳的开发。J Exp Bot。2016; 67(22):6399-411。
- 35。
Fu FF,Xue HW。共表达分析鉴定水稻淀粉调节器1,水稻AP2 / ereBP系列转录因子,作为新型水稻淀粉生物合成调节剂。植物理性。2010; 154(2):927-38。
- 36。
王建,徐立,朱y,刘QQ,蔡XL。OSBZIP58,一种基础亮氨酸拉链转录因子,调节水稻胚乳中的淀粉生物合成。J Exp Bot。2013; 64(11):3453-66。
- 37。
江jz,kuo ch,陈bh,陈mk,林cs,ho sl。效果散航PK1.论淀粉在稻米种子中的结构和物理化学特性。int j mol sci。2018; 19(10):3247-63。
- 38。
金yj,yeu sy,park bs,koh hj,song jt,seo hs。通过调节水稻种子蛋白的量和组成来控制蛋白质二硫化物异构酶样蛋白1-1对胚乳的发展进行控制。Plos一个。2012; 7(9):E44493。
- 39。
Wakasa Y,Yasuda H,Oono Y,Kawakatsu T,Hirose S,Takahashi H,Hayashi S,Yang L,Takaiwa F. ER质量控制相关基因的表达响应于稻瘟病水稻BIP1水平的变化。植物J 2011; 65(5):675-89。
- 40。
Yasuda H,Hirose S,Kawakatsu T,Wakasa Y,Takaiwa F.折衷BIP对稻米植物细胞中种子储存蛋白积累的抑制作用。植物细胞生理。2009; 50(8):1532-43。
- 41。
刘芙,任Y,王Y,彭C,周K,吕J,郭X,张X,钟M,赵S,等.OsVPS9A与OsRAB5A协同作用,调控高尔基体后致密囊泡介导的贮藏蛋白向水稻胚乳细胞蛋白质贮藏液泡的转运。摩尔植物。2013;6(6):1918–32.
- 42。
Fukuda M,Wen L,Satoh-Cruz M,Kawagoe Y,Nagamura Y,Okita Tw,Washida H,Sugino A,Ishino S,Ishino Y等。RAB5蛋白的鸟嘌呤核苷酸交换因子对于从GOLGI设备到水稻胚乳中蛋白质储液中的ProGlutelin的细胞内传输至关重要。植物理性。2013; 162(2):663-74。
- 43。
任y,王y,刘f,周k,丁y,周f,王y,liu k,gan l,ma w等。谷蛋白前体堆积3编码在水稻胚乳中真空蛋白质分选的后Golgi囊泡交通的调节器。植物细胞。2014; 26(1):410-25。
- 44。
张XF,童捷,白安,刘厘,小鹤,Xue HW。植物植物发育植物植物的动态影响水稻粒度和质量。J Intent Plant Biol。2020; 62(10):1-13。
- 45。
Kabir Mh,Liu Q,Su Y,Huang Zg,Xiao lt。植物激素的动态及其与早期白垩的关系籼稻水稻不同后性温度温度制度。孟加拉国JAgric Res。2017; 42(1):2408-8293。
- 46。
杨杰,王ZQ,朱QS,苏BL。水稻籽粒灌浆的ABA和GA调节。Acta Agron Sin。1999年; 25(3):341-8。
- 47。
中国大米约会中心。在。http://www.ricedata.cn/.
- 48。
段敏,孙SSM。稻米品质控制基因表达谱分析。中国生物医学工程学报,2005;
- 49。
Kyndt T,Denil S,Haegeman A,Trooskens G,Meyer D,Criekinge V,Gheysen G.通过大规模平行测序进行早期发育中水稻成熟根组织和根尖的转录组。J Exp Bot。2012; 63(5):2141。
- 50。
王D,潘y,zhao x,zhu l,李z.稻水稻干旱反应性的基因组宽时空基因表达谱。BMC基因组学。2011; 12(1):149-64。
- 51。
朱恩,程士,刘X,杜H,戴米,周DX,杨W,赵艳。R2R3型MYB基因OSMYB91具有在水稻中协调植物生长和盐胁迫耐受性的作用。植物SCI。2015; 236:146-56。
- 52。
杨华,熊华,李杰,刘平,段杰,赵勇,郭×,李勇,张勇,阿里杰,等.新型MYB相关转录因子OsMYB48-1的高表达增强水稻的耐旱耐盐性。公共科学图书馆一号。2014;9(3):e92913。
- 53。
Serra Ts,Figueiredo DD,Cordeiro Am,Almeida DM,Lourenco T,Abreu Ia,Sebastian A,Fernandes L,Contreras-Moreira B,Oliveira MM等。OSRMC是水稻中盐胁迫反应的负调节剂,由两个AP2 / ERF转录因子调节。植物mol biol。2013; 82(4-5):439-55。
- 54
Eulgem T, somsich IE。WRKY转录因子在防御信号中的网络。植物生物学杂志。2007;10(4):366-71。
- 55
Pandey SP,Somssch IE.WRKY转录因子在植物免疫中的作用。植物生理学。2009;150:1648–55.
- 56
彭勇,李永平,彭永平。OsWRKY IIa转录因子调节水稻先天免疫。大米。2010;3(1):36-42。
- 57
Koo Sc,Moon Bc,Kim JK,Kim Cy,Sung Sj,Kim Mc,Cho Mj,Cheong Yh。OSBWMK1通过激活转录因子OSWRKY33调解SA依赖的防御响应。Biochem Biophys Res Communce。2009; 387(2):365-70。
- 58
yu s,shaojuan j,diqiu yu。应激诱导的OSWRKY08的过度表达改善了渗透胁迫耐受性拟南芥.科学通报。2009;24:4671-8。
- 59。
Naoki Y,Yuko S,Shigeru T,Tetsuya C,Takafumi S,Kazunori O,Hisakazu Y,Masaki S,Shoji S,Hiroshi T等人。Wrky76是一种稻米转录压缩机,在抗癌性和冷应力耐受性中起相反应的作用。J Exp Bot。2013; 64(16):5085-97。
- 60。
哈德森D,Guevara Dr,Hand AJ,Xu Z,Hao L,Chen X,Zhu T,Bi Ym,Rothstein SJ。水稻细胞蛋白GATA转录因子1调节叶绿体开发和植物建筑。植物理性。2013; 162(1):132-44。
- 61。
Laurie S, Halford NG。蛋白激酶在植物生长发育调控中的作用。植物生长学报2001;34:53 - 65。
- 62。
植物进化:AGC激酶讲述了生长素的故事。植物科学学报,2007;
- 63。
莫里斯·埃尔,沃克·杰克。受体样蛋白激酶:反应的键。CurrOp植物BIOL。2003; 6:339-42。
- 64。
李杰,楚理J.富有的富含亮氨酸的重复受体激酶,涉及芸苔类固醇信号转导。细胞。1997; 90:929-38。
- 65。
李家,文士,租赁ka,doke jt,税收jt,walker jc。BAK1,拟南芥LRR受体样蛋白激酶与BRI1相互作用并调节芸苔类固醇信号传导。细胞。2002; 110(2):213-22。
- 66。
程y,齐y,朱q,陈x,张w.盐胁迫下水稻根膜相关蛋白质组的新变化。蛋白质组学。2010; 9(11):3100-14。
- 67。
asano t,hayashi n,kikuchi s,ohsugi r. cdpk介导的非生物应激信号。植物信号表现。2012; 7(7):817-21。
- 68。
Manuka R,Karle Sb,Kumar K.Swnk9通过诱导抗氧化系统来减轻盐和干旱胁迫效果拟南芥.植物physiol rep。2019; 24(2):168-81。
- 69。
asano t,hakata m,nakamura h,aoki n,小松S,ichikawa h,hirochika h,Ohssugi r.OSCPK21的功能表征,赋予水稻耐盐含钙蛋白激酶。植物mol biol。2011; 75(1-2):179-91。
- 70。
Ohdan T,Francisco PB,Sawada T,Hirose T,Terao T,Satoh H,Nakamura Y.参与淀粉合成的基因的表达谱系在水稻和烃源器官源器官中。J Exp Bot。2005; 56(422):3229-44。
- 71。
汉X,王y,刘x,姜l,ren y,liu f,peng c,li j,金x,wu f等。不表达蛋白质二硫化物异构酶样蛋白导致粉的胚乳和水稻中的内质网应激反应。J Exp Bot。2012; 63(1):121-30。
- 72。
球S,Morell M.从细菌糖原到淀粉:了解植物淀粉颗粒的生物发生。Annu Rev植物Biol。2003; 54:207-33。
- 73。
Patrick JW,Offler Ce。培养种子中运输和转移事件的隔间。J Exp Bot。2001; 52(356):551-64。
- 74。
张WH,周Y,Dibley Ke,Tyerman SD,Furbank RT,Patrick JW。综述:发展种子的营养加载。Funct植物Biol。2007; 34(4):314-31。
- 75。
呜呜,火腿,ji hs,choi ms,koh hj。灭活这一点葡萄糖氧化酶1基因引起水稻核雄性不育和胚乳垩白(栽培稻l .)。工厂J. 2008; 54(2):190-204。
- 76。
张L,任y,lu b,阳c,feng z,刘z,陈j,ma w,王y,yu x等。泛滥的endosperm7.编码淀粉合成的调节剂和淀粉伞淀粉苷催化剂在水稻中外周胚乳发育必不可少。J Exp Bot。2016; 67(3):633-47。
- 77。
吴米,任y,cai m,王y,zhu s,zhu j,hao y,teng x,zhu x,jing r等。米粉状的ENDOSPERM10编码一对戊庚二肽重复蛋白,对于线粒体NAD1内含子1和胚乳发育的抗碎片至关重要。新植物。2019; 223(2):736-50。
- 78
邓X,钟米,朱克,王C,任y,王y,张h,姜l,王d,hao y等。粉状的ENDOSPERM16编码NAD依赖性细胞源丙酸酯脱氢酶在水稻中淀粉合成和种子发育中起重要作用。植物Biotechnol J. 2019; 17(10):1914-27。
- 79
Matsushima R,Maekawa M,Kusano M,Kondo H,富士茯苓,Kawagoe Y,Sakamoto W.淀粉素局部化的不合标准淀粉粒4蛋白影响水稻胚乳中淀粉粒的大小。植物理性。2014; 164(2):623-36。
- 80。
Matsushima R,Maekawa M,Kusano M,Tomita K,Kondo H,Nishimura H,Crofts N,Fujita N,Sakamoto W.淀粉蛋白蛋白不分原料淀粉粒度6在水稻胚乳中控制淀粉粒度6。植物理性。2016; 170:1445-59。
- 81。
Tanabe S, Ashikari M, Fujioka S, Takatsuto S, Yoshida S, Yano M, Yoshimura A, Kitano H, Matsuoka M, Fujisawa Y.一个新的细胞色素P450与油菜素内酯生物合成有关。德沃夫11.,种子长度降低。植物细胞。2005; 17(3):776-90。
- 82。
桐树,刘升,金烨,杜尔,尹y,钱Q,朱L,朱·矮人和低分蘖作为一个GSK3 /毛虫样激酶的直接下游目标,用于介导水稻的芸苔类固醇反应。植物细胞。2012; 24(6):2562-77。
- 83。
yin ll,xue hw。MADS29转录因子调节水稻种子发育过程中核心和核心投影的降解。植物细胞。2012; 24(3):1049-65。
- 84。
Ishimaru K, Hirotsu N, Madoka Y, Murakami N, Hara N, Onodera H, Kashiwagi T, Ujiie K, Shimizu B, Onishi A, et al。iaa -葡萄糖水解酶基因功能的丧失TGW6.增强水稻粒重并增加产量。NAT Genet。2013; 45(6):707-11。
- 85。
Zuo J,Li J.分子遗传解剖定量性状轨迹调节水稻粒度。Annu Rev Genet。2014; 48(1):99-118。
- 86。
Bello Bk,Hou Y,Zhao J,Jiao G,Wu Y,Li Z,Wang Y,Tong X,Wang W,Yuan W等人。NF-YB1-YC12-BHLH144复合物直接激活Wx公司调节水稻的粒度(栽培稻l .)。植物生物技术学报(英文版);2019;
- 87。
Menkens AE。G盒:由Bzip蛋白的GBF系列植物中的植物中普遍的调节DNA元素。趋势Biochem SCI。1995年; 20(12):506-10。
- 88。
吴j,zhu c,pang j,张x,杨c,xia g,田y,他c. oslol1,c2c2型锌手指蛋白,与OSBzip58相互作用,促进胃蛋白酶生物合成的调制促进种子萌发栽培稻.工厂J. 2014; 80(6):1118-30。
- 89。
Xiong Y,Ren Y,Li W,Wu F,Yang W,Huang X,Yao J.NF-YC12是水稻种子储存物质积累的关键多功能调节器。J Exp Bot。2019; 70(15):3765-80。
- 90。
王培平,徐长春,杜云云,朱培平,赵传忠,付翔,张春春,Paez J, Macho AP, Taob WA,等。植物应激反应中蛋白激酶的蛋白质组靶标。Proc Natl academy Sci. 2020; 1:1-11。
- 91。
Ho sl,huang lf,鲁ca,他sl,王cc,yu sp,chen J,Yu Sm。糖饥饿和Ga-Imcucient钙依赖性蛋白激酶1反馈调节Ga生物合成,并激活14-3-3蛋白以在水稻幼苗中赋予耐旱性耐受性。植物mol biol。2013; 81(4-5):347-61。
- 92。
Locascio A,Roig-Villanova I,Bernardi J,Varotto S.目前关于拟南芥种子发育的激素控制的目录:玉米种子发育的激素控制:对养羊酸的关注。前植物SCI。2014; 5:412。
- 93。
Rook F,Corke F,Card R,Munz G,Smith C,Bevan MW。受损的蔗糖 - 感应突变体揭示了通过脱落酸信号传导的糖诱导淀粉生物合成基因表达的调节。工厂J.2010; 26(4):421-33。
- 94。
杨毒,张杰,王紫红,朱琦。谷物中的激素与水稻穗分布强度和训练发育。植物生长调节。2003; 41:185-95。
- 95。
Vanstraelen M、Benkova E。植物发育调控中的激素相互作用。植物生物学。2012;28:463–87.
- 96。
关键词:玉米,胚胎发育,激素反应,玉米abstract:生物化学学报,2014;42:25 - 31。
- 97。
曾德·彭我,李我,郑射,江XC。早期繁殖中期成熟的育种研究indic各种Xiangzaoxian11。湖南农业科学。1991;2:4-7。
- 98。
杨yz。新的早期indic品种湘昭县。庄稼。1990; 4:35。
- 99。
曾德,彭我,李我,郑射,江XC,太阳GH。早期繁殖中期成熟的育种研究indic品种湘昭县24。湖南农业科学。1997年; 2:16-8。
- 100。
苏y,xiao lt。通过使用高分辨率微型CT,体内米粉结的3D可视化和基于体积的量化。米。2020; 13(1):69。
- 101。
萧L,林WH,李德,洪B.客观地测量水稻核垩的方法。Chin Rice Res Newsl。2001; 9:12-3。
- 102。
布拉德福德。利用蛋白质染料结合原理,建立了一种快速、灵敏的微量蛋白质定量方法。分析生物化学。1976;72(1–2):248–54.
- 103。
周丽娟,肖丽玲,薛宏伟。水稻叶片联合发育的动态细胞学和转录调控。植物杂志。2017;174(3):1728 - 46所示。
- 104。
Patel RK,Mukesh J,Liu Z.NGS QC Toolkit:用于下一代测序数据的质量控制的工具包。Plos一个。2012; 7(2):E30619。
- 105。
htseq -一个用于高通量测序数据的Python框架。生物信息学。2015;2:166-9。
- 106。
Trapnell C,Roberts A,Goff L,Pertea G,Kim D,Kelley Dr,Pimentel H,Salzberg SL,RINN JL,Pachter L.差分基因和RNA-SEQ实验与Tophat和袖扣的实验分析。NAT PROTOC。2012; 7(3):562-78。
- 107。
Anders S HW:基因水平的RNA-SEQ数据的差异表达 - DESEQ封装。在。http://www.bioconductor.org/packages/release/bioc/vignettes/DESeq/inst/doc/DESeq;2016年。
致谢
感谢中国水稻研究所和湖南省水稻研究所提供水稻种子。
资金
本研究由中国国家自然科学基金(31570372),湖南省教育部(18B108),科技部的科学研究基金资助,早期籼稻湖南省省自然科学基金(2020JJ4037)水稻质量改良工程(0NKY1002)和湖南省农作物种质创新利用重点实验室(18KFXM06)开放项目。实验平台的建设和实验仪器的购置分别由00NKY1002、18KFXM06和31570372资助。转录组测序得到18B108和2020JJ4037的资助。
作者信息
隶属关系
贡献
概念化,Q.X.,W.L.和L.X.方法论,Q.X.,J.X.和K.H.软件,Q.X.,Y.S.,Z.H.和M.W.形式分析,Q.X.,Y.S.,W.L.和L.X.调查,Q.X.,J.T.和C.H.撰写初稿准备,Q.X.,J.X.和K.H.撰写评论和编辑,W.L.和L.X.可视化,Q.X.监督,W.L.和L.X.所有作者都阅读并批准了手稿的最终版本。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
所有作者审查和批准了此稿件。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:
补充图.1分析DEG.HL.在Caryopsis。(a)DegHL.在8dah,12dah和16dah获得,红塔代表基因上调,蓝柱表示基因的下调。(b)基因本体学(GO)的比较(GO)DEG的分类HL.在第8、12和16天。(C) DEG的KEGG通路分配HL.在8天,12 DAH和16 DAH,显示前10个类别。deHL.差异化表达统计学意义(P.-Value≤0.05和|日志2FOLDCHANGE(FC)|≥1)。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
谢,Q.,徐,J.,黄,K。等等。水稻垩白形成过程中激素介导的动态形成和转录调控。BMC植物BIOL.21,308(2021)。https://doi.org/10.1186/s12870-021-03109-z.
收到:
公认:
发表:
关键词
- 米
- 垩白志
- 动态形成
- 植物激素
- 转录调节