摘要
背景
种植大作物单作和大量使用农药促进了对农药不敏感的害虫和病原体的进化。为了减少农药在作物栽培中的使用,引发活性化合物(PrimACs)的应用是一个受欢迎的选择。PrimACs可以增强植物的免疫系统,因此可以用较少的杀虫剂来保护植物。例如,可以通过使用呼吸活性监测系统(RAMOS)或其小型化版本µRAMOS通过氧转移速率(OTR)来确定其在培养物中增强欧芹细胞呼吸活性的能力来识别原始细胞。后者设计用于细菌和酵母细胞悬浮在微量滴定板(mtp)中。迄今为止,RAMOS或µRAMOS尚未应用于成株或幼苗,这将克服(µ)RAMOS对植物悬浮细胞培养的限制。
结果
本文介绍了一种改良的用于植物幼苗分析的μ g - RAMOS。该新设备可以照亮48口MTP井的幼苗,并记录每口井的呼吸活动。验证了该方法在新型PrimAC识别中的适用性拟南芥蒂利亚纳,在MTP中培养7天,用已知的PrimAC水杨酸(SA;)和PrimAC候选甲基1-(3,4-二羟基苯基)-2-氧环戊烷-1-羧酸酯(Tyr020)。处理28 h后,用细菌鞭毛蛋白的22个氨基酸肽flg22诱导幼苗。诱导后,监测呼吸活动。对OTR过程的评估显示,Tyr020很可能是PrimAC。通过分子生物学分析证实了Tyr020的启动诱导活性答:芥幼苗。
结论
我们揭示了用µRAMOS鉴定植物幼苗中PrimACs的适用性。flg22诱导后,不同启动子和未启动子植株夜间OTR的差异明显。因此,该系统可以用于植物幼苗中PrimACs的可靠筛选。
背景
随着世界人口的不断增长,人们对粮食、饲料、纤维和生物能源的需求越来越大[29].这些储备主要来自玉米、水稻或小麦等农作物,这些作物通常在大型单一作物中种植。这些对生物和非生物胁迫非常敏感。合成农药被广泛应用于有效防治病虫害和病原体。然而,它们可以在土壤或植物中积累,从而引起生态和健康问题。此外,大量使用除害剂会导致对化学品不敏感的病虫害和病原体出现[29].为避免合成杀虫剂附带的风险,利用植物免疫系统作为支持且替代的环保植物保护的替代方法[8].
在受到病原体攻击或经某些化学物质处理后,植物可发展出抗病能力或增强抗病能力,以抵抗进一步的病原体攻击[3.].这种现象被称为致力于与防御引发有关的诱导抗性[8].该术语是指植物细胞能够激活防御反应的增强能力。引发相关的诱导电阻应答包括全身获得的阻力(SAR)[11].SAR是由水杨酸(SA)和N-羟基硫醇酸诱导的广谱免疫应答[15,33].因此,经过n -羟基酚酸、SA或具有类似作用模式的物质的处理后,植物细胞往往会被激活防御反应增强[20.,42],这通常伴随着SAR的建立[8,11].防御引发,无论是由SA诱导的,用另一种化学化合物治疗还是先前的病原体发作经常增强植物的能力也避免非生物应力,如盐度,干旱,洪水,冷却或加热[18,34,41].到目前为止,鉴定PRIMACs的一种常用方法测量mRNA转录物的累积WRKY6.和WRKY53号[19].WRKY6.和WRKY53号是人类防御启动的可靠标记基因答:芥[19].这些基因的mRNA转录物的积累在初步期间没有太多诱导[19]. 但是WRKY6/53低剂量flg22诱导的转录在有引物的植物中比无引物的植物更为稳定[19].已经证明,启动成本要低得多,而且很难适应害虫或病原体[26,44].因此,用环保化学物质触发引物是一种很有前途的可持续病虫害控制方法。然而,识别启动诱导化学是困难的,适用的启动活性筛选系统是罕见的。Conrath及其同事开发[20.]最近优化[36]在欧芹细胞悬浮培养物中筛选微生物模式诱导呋喃香豆素分泌的化合物。此外,使用呼吸活动监测系统(RAMOS),Schilling等人[37]结果表明,通过欧芹细胞培养物的氧转移速率(OTR)测定,它们的性质可以确定引发活性化合物(PrimACs)来增强呼吸活性[1,2]. 在这项研究中,“呼吸”一词包括生物体内的物理和生物化学过程的总和,通过这些过程氧气被输送到组织和细胞。先前已经讨论了引发过程中氧消耗增加的两种可能的解释。一种解释认为,线粒体选择性氧化酶(AOX)的激活可能导致耗氧量增加[13,14,28,32].另一种解释是NADPH氧化酶通过活性氧的合成引起了氧消耗的增强[6,13,21]. 这两种解释可以分开或结合起来考虑。
为了提高吞吐量,已经开发了一种µRAMOS装置,该装置利用48孔微量滴定板(MTP)中的parley悬浮细胞[16].RAMOS技术应用特定的阀门,在气体和密封生物反应器的阶段之间反复切换。在密封阶段,通过各自的传感器测量的氧分压由于栽培生物体的呼吸而降低[1].从气体到水相的OTR与在密封阶段期间的氧分压的确定的斜率成比例[1,16].μramos基于标准的48孔MTP。它使用与拉莫斯技术相同的测量原理,但是提供了另一个阀门和传感器技术[16]. RAMOS配备了电化学传感器,而µRAMOS使用固定的荧光传感器点来测量氧分压[16].
RAMOS和μramos都针对培养中的欧芹细胞进行了优化[16,38,40]. 为了克服(µ)RAMOS对欧芹细胞悬浮液的限制,在这项工作中,开发了在µRAMOS装置中使用完整植物的协议。在实验装置中,引入了一个发光二极管(LED)模块,使得48阱MTP的每一个阱都能被白光单独照射,以确保同步生长[5]. 在这项研究中,我们提出了一个LED-µRAMOS组合的设置和一个在植物幼苗上鉴定新原生质的标准程序。为了证明引入的LED-µRAMOS组合和标准程序的原理,使用Krug等人引入的新合成的1-(3,4-二羟苯基)-2-氧代环戊烷-1-羧酸甲酯(Tyr020)作为模型试验化合物对PrimACs进行了模型筛选[23].新设计的力量已经显示使用SA作为阳性对照和发现Tyr020作为一个新的PrimAC在答:芥. 通过分子生物学分析,证实Tyr020是一种初级化合物[10].
结果
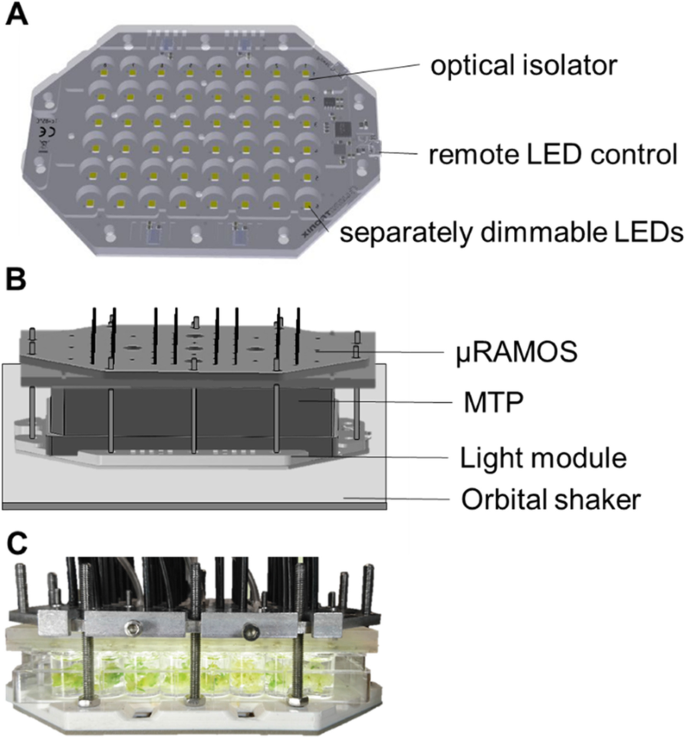
领导模块-µ拉莫斯的组合
开发了一个LED模块,使种子能够同时生长。如果需要的话,它可以调节光照条件,使种子萌发和生长,就像植物生长一样答:芥幼苗.在受控光条件下,植物幼苗在每个孔中生长48孔MTP。该模块由安装在商业48孔MTP的大小的板上的48个可单独可调光的LED(Lumitronix)组成(图。1一种)。光学隔离器确保光不能进入相邻井,提供黑色,清晰的MTP在LED模块的顶部上施加。由于所有孔被单独的LED照射,所以无论井位置如何,都能为每个孔保持相同的条件。在MTP上施加μramos装置(图。1b)并且能够测量每个板中的呼吸活动。数字1C显示一张带有答:芥幼苗位于LED模块的顶部,带有附加的µRAMOS设备。为了便于说明,在这里绘制了一个半透明的MTP。这种新引入的LED模块和µRAMOS (LED-µRAMOS)的结合是本协议识别新primac的基础。
使用μramos筛选植物中PRIMAC的标准程序
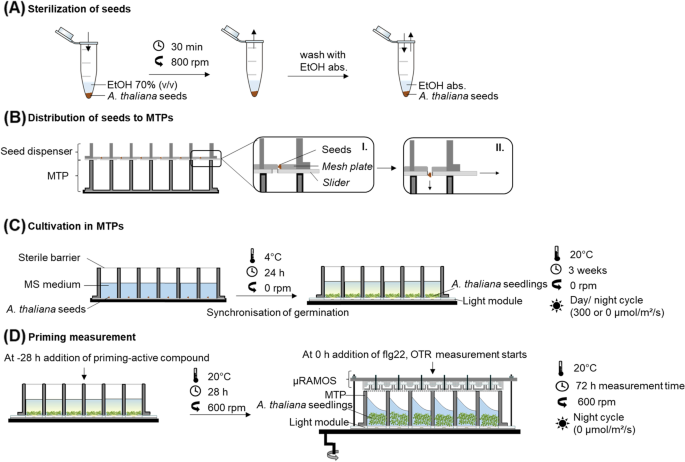
我们开发了一个标准程序,可以在引入的LED-µRAMOS组合中搜索PrimACs(图。2).一个。蒂利亚纳用70%(v/v)乙醇对种子进行表面灭菌。2A) 是的。使用种子分配器,将灭菌种子分别转移到MTP的孔中(图。2B).每孔加入无菌MS培养基(图。2C).为了保证种子的同步有效发芽,MTP在4℃下保存24 h。然后在20℃下孵育3周。在孵育期间,使用LED模块进行16小时白天/ 8小时夜晚的循环(图。2C). 3周后,用SA或Tyr020处理幼苗(图。2D),在生长条件下再孵育28 h。然后,在幼苗上喷洒50 pM的flg22。诱导后,用µRAMOS测定幼苗45 h的呼吸活性(图1)。2D) 在MTP的顶端。
工程的答:芥幼苗在LED-μramos组合中生长
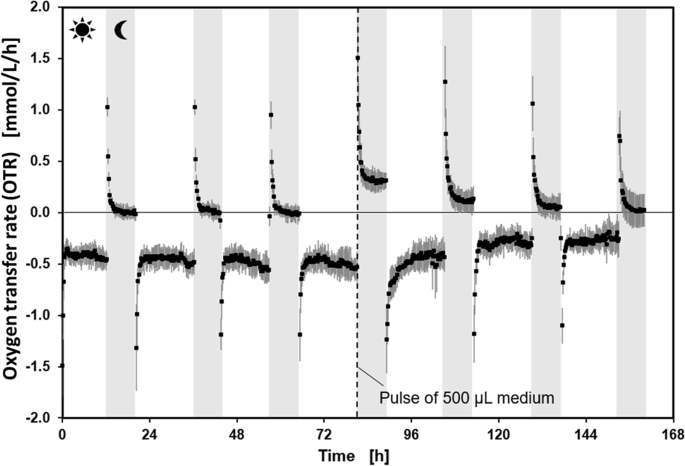
验证新型LED-µRAMOS装置测量呼吸活动的适用性答:芥幼苗,幼苗在上述条件下在MTP中在LED-µRAMOS装置中生长168小时。在16小时白天/8小时夜间期间监测OTR。在168h期间的OTR过程表明,白天产生的氧气由负的OTR值指示(图。3.). 在夜间,消耗的氧气量很低,这一点在正的OTR值中很明显(图。3.).然而,耗氧量相当低,在夜间大部分时间OTR接近0 mmol/L/h,表明饥饿。第4天结束时,每孔添加500µL无菌MS培养基,避免幼苗干燥。如图所示,这刺激了随后一晚的氧气消耗。3.在补充MS培养基后,第二天产生的氧气比前一天低。从这些结果可以看出,2.5 g/L的蔗糖不足以识别primac。因此,在MS培养基中添加20 g/L蔗糖,以确保幼苗不挨饿。通过这一改变,可以保证在较长的夜间时间内,OTR保持在0 mmol/L/h以上,用于下面的PrimAC识别测量。正OTR值是测定PrimACs对幼苗呼吸活性影响的必要条件。
工程的答:芥在LED-μramos组合中16 H日/ 8 H晚周期幼苗。白色和灰色背景分别说明日期和夜晚,并被阳光或月亮表示。三周的答:芥如图所示的幼苗。2C,被转移到LED-μramos组合并保持在600 rpm振动频率,3mm摇动直径,20°C,在1.5ml MS培养基中,初始pH 5.7,光模块照射强度300μmol/m2/白天的s,0µmol/m2/它在晚上。12个重复的标准差用数据点周围的灰色阴影表示
启动诱导活性的测定
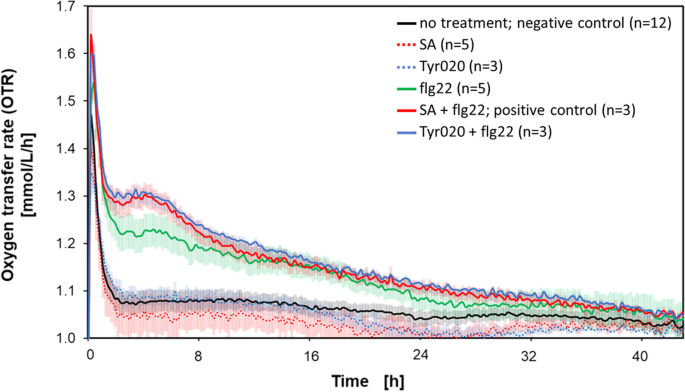
如图2所示进行了PRIMAC的筛选。2.答:芥将幼苗分成6组,在适当的情况下,在诱导前-28h用flg22处理,时间点为0h。诱导后立即开始OTR测量(图。4). 在记录的第一个小时,所有的测量结果都显示OTR值显著增加。这些是µRAMOS器件的各种磨合现象,例如,MTP需要首先达到系统的温度,然后才能测量稳定的OTR值。因此,第一个小时的这段时间与PrimACs的筛选无关,不作进一步讨论。12孔MTP既不预处理也不诱导获得阴性对照(图。4). 阴性对照组的OTR进程维持在较低水平(~ 1 mmol/L/h)。用100µM SA处理5个井中的幼苗,并在-28小时时用25µM Tyr020补充3个井中的幼苗。这8口井未配备50 pM flg22。我们这样做是为了记录经过预处理但未经处理的植物的OTR过程(图。4).该组的OTR曲线保持在〜1mmol / L / h,与阴性对照相当。
呼吸活动答:芥用有或没有flg22诱导的启动化合物处理后的幼苗,以及没有用化学品处理的参考培养。OTR随时间的变化答:芥用100μM SA和50μM flg22(红色)或25μM Tyr020和50μM flg22(蓝色)激发的幼苗。参考培养:不添加添加剂,阴性对照(黑色),仅添加100μM SA(红色虚线),25μM Tyr020(蓝色虚线),仅添加50μM flg22(绿线)。SA和Tyr020在相对于添加flg22的时间点(0 h)的-28 h时间点添加。三周大答:芥将幼苗转移到RAMOS设备上。2D,并以600rpm振动频率,3mm摇动直径培养,填充1.5ml,20°C,在MS培养基中填充20g / L蔗糖,初始pH 5.7。为图例中的每个条件指定副本(n)的数量。复制的标准偏差由数据周围的阴影表示
这些幼苗的OTR(红色和蓝色虚线)曲线的过程类似于阴性对照(黑色图形)。4).另外,5个井的幼苗没有预处理,而是用50pm的flg22诱导(绿色曲线)。诱导8 h后,幼苗的OTR显著高于阴性对照。在-28 h开始OTR测量前,用100µM SA(红色曲线,阳性对照)或25µM Tyr020(蓝色曲线)处理3孔幼苗。这些幼苗在0 h时间点用50 pM flg22诱导。sa预处理和flg22诱导后的幼苗的OTR值远远高于未预处理但诱导后的幼苗。tyr020处理和诱导的幼苗的OTR过程与阳性对照的OTR过程相似。因此,Tyr020被确定为PrimAC的候选基因答:芥.
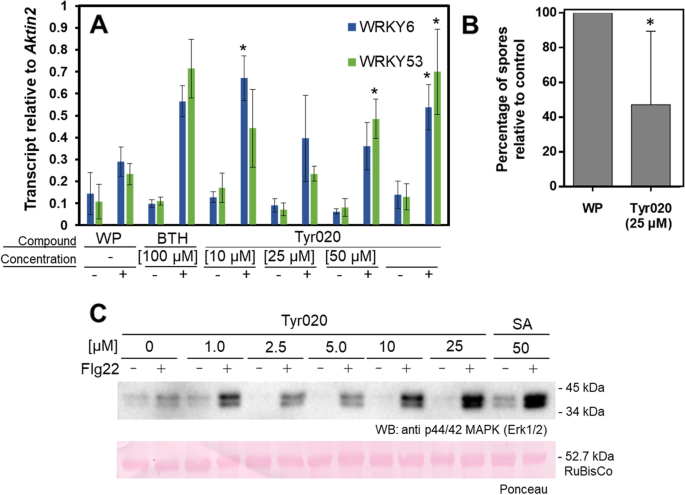
为了验证或拒绝Tyr020作为PRIMAC,我们研究了该化合物是否会诱发已知的防御灌注分子机制答:芥[8,9]. 为了做到这一点,我们测定了mRNA转录物的积累WRKY6.和WRKY53号转录因子基因处理不当的植物。调查Tyr020是否会引发答:芥为了增强积累WRKY6/53mRNA转录本,土壤生长答:芥幼苗被分成6组,每组6株。一组用可湿性粉剂(WP;阴性对照),用作S-甲基苯并[d][1,2,3]噻二唑-7-硫代甲酸盐(BTH)的润湿剂。第二组用BTH(阳性对照)的可湿性粉剂进行治疗,BTH是一种功能性SA类似物Friedrich et al[15,24]强烈触发防御启动答:芥[19,22].其余四组幼苗分别用不同浓度的Tyr020处理。处理48小时后,每组3株幼苗用flg22诱导。每组的其余三株幼苗仍然未受到诱导。flg22诱导3小时后,收获幼苗并分析其mRNA转录本的积累WRKY6.和WRKY53号通过QRT-PCR。如图所示。5A,WP组的FLG22引发的幼苗显示出积累的少量增加WRKY6.和WRKY53号mRNA转录与未涂覆的幼苗相比。巨大的BTH处理的幼苗组显示了这两种MRNA转录物积累的相似程度怀疑基因(图。5).与WP幼苗组相比,FLG22引发的BTH-Preatroped幼苗群体呈现出显着提高的积累WRKY6.和WRKY53号成绩单(图。5一种)。该结果证实了BTH中的防御灌注诱导活动答:芥幼苗并验证实验设置允许检测引发诱导活动。Tyr020治疗但积累了巨大的幼苗WRKY6.和WRKY53号在一定程度上与未被诱导的WP组相似(图。5一种)。与WP组相比,Tyr020预处理和后来引发的一组幼苗具有增加的MRNA转录物的增加的MRNA转录物。仅在100μmtyr020时,预处理的植物显示出显着的植物(p≤0.05)在积累中增加WRKY6.和WRKY53号与WP组相比mRNA转录物。用10或50μmtyr020处理的幼苗群体仅用于其中一个怀疑基因显示mRNA转录水平显著增加(图。5A) 是的。然而,总的来说,本实验的结果揭示了Tyr020在防御基因表达水平上的启动诱导能力,并且他们揭示了Tyr020似乎是平衡的WRKY6/53在进一步的挑战中提高转录能力。
土壤中已鉴定的引物的验证答:芥植物。一个Tyr020质数答:芥植物增强WRKY6.和WRKY53号防御基因激活。六周的植物仍然未经处理( - )或用可湿性粉末(+)或在可湿性粉末(WP)(+)中被培养的粉末(+)浓度的浓度喷射(+),然后用FLG22( - )。用作阳性对照100μM苯并噻唑(Bth)。积累WRKY6.和WRKY53号qRT-PCR检测mRNA转录产物。星号(*)表示对照组(WP; +) 和样品(p≤0.05)。B萝卜硫素(SFN)可减少霜霉病。用WP或ty020(25µM) WP配方处理植株。24小时后,我们用一种悬浮液喷雾接种植物Hyaloperonospora Arabidopsidis.(Hpa)分生孢子(4 × 104孢子每毫升水)。接种后的植株在短时间内保持高湿度。7d后测定Hpa释放的孢子数。数据通过学生问卷进行分析t测试。星号表示统计学上的差异,符合95%的信心。提出的数据是平均值±SD。n > 5.C答:芥用Tyr020预处理的幼苗在FLG22攻击时具有增强的丝裂剂活化蛋白激酶(MPK)活化基序的磷酸化。这表明Tyr020-预处理植物中强烈的MPK活化。作为积极的控制答:芥幼苗用50µM水杨酸(SA)处理
探讨ty020是否会影响答:芥被卵菌病原体感染Hyaloperonospora Arabidopsidis.(下丘脑-垂体-肾上腺轴的),答:芥(Col-0)在接种Tyr020之前,向植物喷洒可湿性粉末(WP)配方下丘脑-垂体-肾上腺轴的.noco种族的下丘脑-垂体-肾上腺轴的导致霜霉病疾病答:芥Col-0植物(Coates和Beynon)[12]). 数字5B显示预处理Tyr020似乎降低了答:芥令人沮丧的霉菌疾病,显而易见下丘脑-垂体-肾上腺轴的Tyr020-预处理植物的孢子花。这表明Tyr020激活防御引发并降低了易感性下丘脑-垂体-肾上腺轴的感染答:芥.
为了进一步研究Tyr020的作用模式,我们分析了磷酸化的丝裂原活化蛋白激酶(MPKs)的积累答:芥幼苗在适当的处理。Beckers等人。[4研究表明,在这种植物中,防御启动与潜在的MPK3和MPK6水平的增强有关。然而,在进一步刺激植物之前,这些酶保持催化活性[4].一旦具挑战,与未提生的植物相比,更多MPK分子在初步激活 - 激活 -4].研究tyr020处理后MPKs的磷酸化答:芥对适当处理过的幼苗进行western blotting分析,并使用磷酸化基序特异性抗体进行免疫检测(图。5C).两株未经处理的幼苗作为阴性对照,另外两株用50µM SA(阳性对照)激活防御启动。用1 ~ 25µM浓度的Tyr020处理10株幼苗。每一种条件下用flg22诱导出一株幼苗。如图所示。5在flg22诱导的所有幼苗中均检测到MPK磷酸化。对于未经预处理但诱导的幼苗,磷酸化信号与诱导的阳性对照相比非常低。在所有未激发的样本中均未发现或仅发现微弱的MPK磷酸化。除了1个µM外,Tyr020随浓度的增加强烈增强了flg22诱导的MPK磷酸化信号,在25个µM时,其磷酸化信号几乎与50个µM SA引物后以flg22为攻物的幼苗的磷酸化信号一样强(图1)。5C)。该结果支持来自μRamos和基因表达研究的上述结论,该研究要求Tyr020作为先前未知的PRIMac。
讨论
开发了一个LED模块,其允许在48孔MTP的每个孔中平均植物幼苗暴露。先前发布了类似的照明装置的开发[27].可以通过引入的LED模块再现单独照明的植物培养所得到的所得到的改进。第一次测量(图。3.)LED-μramos组合显示,补充有2.5g / L蔗糖的MS培养基不足以在夜间期间测量幼苗的呼吸活性,如接近0mmol / L / h的OTR值所示。Schilling等。已经表明,Primacs增强了植物细胞的呼吸活性[37].因此,为了应用LED-μramos组合,用于成功识别PRIMAC,需要可测量的幼苗呼吸。由于饥饿的问题,通过添加新的MS培养基,夜间没有测量呼吸活动。添加新鲜媒介答:芥在LED-µRAMOS中,在接下来的夜间循环中OTR增加,表明植物幼苗的代谢活性增加,这是由于添加了新的营养物质。添加蔗糖的MS培养基似乎满足了幼苗的碳需求,因此,光呼吸可能会降低,正如Lobo等人已经发表的关于甘蔗的研究[25].在加入新鲜培养基后的第二个和第三夜循环中,OTR仍然高于添加之前。总之,加入无菌培养基成功,因此在未来,也可以想到植物幼苗的较长培养。为了通过添加新鲜培养基来降低可能污染的风险,并尽量减少处理步骤,决定将补充蔗糖的初始浓度从2.5g / l增加到20g / l。
这一结果表明,在夜周期期间,植物幼苗的代谢变化似乎更加促进。作为先前对植物悬浮细胞培养物的研究已经显示出,呼吸活动给予其新陈代谢的重要信息[17,31,43].
因此,在细长的夜间期间,最佳地执行Primacs候选物的评估。使用LED模块进行8小时/ 16 H夜周期进行增长。细长夜间的开始只与添加FLG22相关联。同时,μRamos设备安装在MTP的顶部,并且OTR测量开始。在引出后,灌注植物幼苗比未预浸,但引发的植物幼苗更高的OTR值(图。4). 因此,PrimAC可以增强完整植物的呼吸活动能力。这种增强的容量可以用LED-µRAMOS组合来测量,但是其他基于氧气的测量系统也是可以想象的。Scafaro等人出版的测量系统[35],或O'Leary等人[30.]依靠Q2氧气传感器(Astec Global,荷兰),测量叶子和根的氧气消耗。然而,两个测量系统都可能用于PRIMAC识别。随着这种增强的呼吸活动能力刚刚在实验方案的这种阶段测量,需要施加μramos装置,而萌发,生长和引发可以分别在微量滴定板中进行。通过时移对微量滴定板中的培养开始,每40小时筛选48种植幼苗,可能是可能的。模型筛选的结果(图。4)结果表明,由于成功诱导的幼苗与相应的阴性对照之间的差异在诱导后的前8h最为明显,因此有可能将该测量周期缩短至8h。缩短测量周期将进一步提高筛选方法的吞吐量,使每个µRAMOS装置每8小时最多可获得48株幼苗。
结论
在本文中,对48孔MTP中的μramos用于完整的植物幼苗的使用。使用完整植物而不是细胞悬浮培养物的主要优点是分化状态并克服欧芹和一些其他植物物种的局限性。μramos可能与基本上任何作物相容,因此更接近申请。然而,与土壤生长的植物相反,可以在受控条件下的早期生长阶段进行测量,因为营养和光等参数变得可调节。通过从拉莫斯设备切换,这允许在八个摇瓶中同时筛选,以实现48个同时筛选的μRamos装置,每次实验的吞吐量大幅增加。基于引发后的OTR增加(图。4),Tyr020已被识别为先前未知的PRIMAC。
新引进的LED-μramos组合使每个孔的单个光强度和照射时段能够在线独立测量。这允许不同的辐射强度,这可能在一个实验中由不同的植物物种需要。在未来,对PRIMAC的候选者及其组合可以同时测试它们在不同作物中的引发诱导活性。
方法
化学制品
SA,BTH和可湿性粉末是可商购的,并且根据Krug等人合成Tyr020。[23].Krug等人将该化合物命名为化合物8a [23].将SA、BTH、Tyr020和可湿性粉剂按指示浓度用蒸馏水稀释。没有使用额外的溶剂。
LED模块
LED模组由Lumitronix®定制,由48个独立的可调光LED组成。1).板可以安装在透气介质的48孔MTP下面,导致每个孔下面的一个LED。为了允许在板内的光梯度,每个LED可单独调节。光学隔离器防止LED的杂散光进入相邻的井中。使用拉姆索斯在摇瓶中测定OTR [1,2]使用μramos的MTPS。两个设备都是开发和内置的[16,38].使用黑色透明底部微尺寸板进行测量。μRamos设备安装在MTP的顶部。测量在20℃下进行,振动频率为600rpm,摇动直径为3mm。每孔填充体积为1.6毫升。基于测量的氧气和注册设置的测量的部分压力计算OTR,包括顶空体积。将该计算调整为改变顶空体积,即添加Primacs或新鲜培养基后。
答:芥增长
拟南芥种子(拟南芥蒂利亚纳,Col-0)从欧洲拟南芥库存中心(诺丁汉拟南芥库存中心;NASC)。种子在70%(v/v)乙醇中洗涤30分钟,然后在100%(v/v)乙醇中洗涤两次1分钟,如图所示。2.干燥的种子通过种子分配器转移到MTP中,每孔15±5粒种子。种子加1.5 mL (MS)培养基。MS培养基,包括维生素(M0222;Duchefa Biochemie B.V. (Duchefa Biochemie B.V.),按制造商推荐的方法制备,添加2.5 g/L蔗糖。使用0.01 M氢氧化钾调节pH值至5.7,然后对培养基进行高压灭菌(121℃,20分钟)。
为了分层,装载种子的mtp在4℃下过夜以确保同步和有效的萌发[5]. 接下来的几天,这些平板在20°C下培养在LED模块上。3周后,将µRAMOS装置安装在顶部。
土壤种植的培养,启动和诱导答:芥幼苗
答:芥(加入COL-0; NASC)幼苗在土壤中生长,涂在害虫室内的16小时/ 8 H晚周期。当需要时,灌溉土壤。4-6周后,幼苗用于常规引发实验。叶子答:芥用1µM ~ 100µM的Tyr020稀释液喷洒幼苗。用100µM - BTH喷施另一株幼苗叶片作为阳性对照。用21% (w/v)可湿性粉剂喷施植物幼苗叶片作为阴性对照。每种条件分别应用于6株幼苗。植物幼苗继续生长48 h,每种条件下分别用1 nM的flg22溶液浸润3株。
的决心WRKY6.,WRKY53号和肌动蛋白2表达式
诱导五小时后,收获叶片并均质化。使用Trizol方法从冷冻叶中分离RNA,如[7].RT-QPCR反应以10μL体积进行。PCR混合物由2.7μL无核酸酶的水,5μLTakyonTM NO ROX SYBR MasterMix DTTP蓝色(Eurogentec),0.15μl正向引物,0.15μl反向引物和2.5μl模板。根据帖子列于表中1.扩增使用PCR机(Applied Biosystems)进行。95°C初始变性3 min, 95°C变性15 s, 60°C退火60 s, 95°C延伸15 s,共40个循环。最终延长温度设置为60°C,持续1分钟。
SDS-PAGE、免疫印迹分析及免疫检测
为了检测MPK磷酸化位点,收获土壤生长的幼苗的叶片并在诱导后在5小时内均化。使用精纤维24均化器(Bertin Instruments)进行冷冻组织。在手术过程中,所有管和缓冲剂都保持冷。将研磨植物材料用100%丙酮洗涤两次,并在4℃下以16,100g离心5分钟。将沉淀重悬于丙酮中的10%(w / v)TCA中,并将其转移到超声冰水浴10分钟后,然后再分析离心步骤(16,100g,4℃,5分钟)。然后,用10%(w / v)TCA在丙酮中用10%(w / v)TCA洗涤沉淀,用10%TCA(w / v),用80%(v / v)丙酮一次。弃去上清液,将沉淀在室温下重新悬浮在NERMED制备的致密SDS缓冲液(100mM TRIS-HCl pH 8.0,30%(w / v)蔗糖,2%(w / v)sds,5%(v / v)β-巯基乙醇)。向每个管中加入等体积的苯酚/三-HCl pH8.0(Applichem)。将样品在室温下以16,100g离心20分钟。将每个管的上阶段分成两个新的管,加入5体积100mM乙酸铵,在-20℃下沉淀总蛋白60分钟。 Proteins were collected by centrifugation at 16,100 g at 4 °C for 5 min. Pellets were washed once with 100 mM ammonium acetate in methanol and once with 80% (v/v) acetone, and the pellets were dried. To determine total protein concentration, pellets were resuspended in buffer (7.7 M urea, 2 M thiourea, 300 mM NaCl, 0.25% (w/v) CHAPS, 50 mM NaH2宝4pH 8,50mM Tris pH 8,20mM咪唑)并在妥福蛋白质测定(快速启动Bradford; Biorad)之前在室温下孵育1小时。将蛋白质样品重悬于加载缓冲液(10x样品还原剂,4×LDS样品缓冲液; NUPAGE)中以等浓度并在95℃下加热10分钟。将变性样品施加到两个分散的聚丙烯酰胺凝胶中,由4%收集凝胶和12%分离凝胶组成。用5μL样品加载袋,并在175V下进行凝胶电泳60分钟。MES,pH 7.3,用作运行缓冲区。
在随后的western blot中,将蛋白质从SDS凝胶中电泳转移到硝基纤维素膜(Carl Roth)上,在250 mA下应用60分钟。blotting后,用TBST缓冲液(20 mM tris;150毫米氯化钠;0.1% (v/v) Tween 20)。在TBST缓冲溶液中,用5% (w/v)脱脂奶粉(Nutricia Protifar)封闭60分钟。堵塞后,用TBST缓冲液冲洗膜2次,每次5 min。一抗p44/42 (Cell SignalingTechnologyR)用5% (w/v)牛血清白蛋白(Panreac AppliChem) 1:100稀释在TBST缓冲溶液中。膜在10℃下孵育12 h。孵育后,在TBST缓冲液中洗涤2次5 min。
作为二级抗体,应用抗兔IgG、HRP连接抗体#7074(细胞信号技术)。在5%(w/v)脱脂奶粉的TBST缓冲溶液中稀释1:2000。膜在室温下在溶液中培养1小时,然后在TBST中每5分钟洗涤两次。
蛋白质检测采用白光照射下的ChemiDocTMMP想象系统(BioRadR)。
胭脂红染色
为了检查相同的蛋白载量,膜被Ponceau S染色。染色时,使用Ponceau S溶液(Panreac AppliChem),并严格遵循生产商的协议。
决定答:芥敏感性Hyaloperonospora Arabidopsidis.(HPA)
答:芥用120µmol/m的短日照(8 h光照)培养col0植株2/秒1,22°C,相对湿度为65%)。用可湿性粉末(WP)(对照)或Tyr020的WP制剂喷洒两周的植物(终浓度为25μm)。治疗后24小时,通过用HPA的分析孢子悬浮液喷射植物(种族Noco; 4×104孢子每毫升水)。接种后的植物盖上透明的盖子,以确保高湿度,并保持在短日照条件下。7 d后,测定Hpa释放的孢子数,如Schmitz等[39].
数据和材料的可用性
在当前研究中产生和分析的数据集可从相应的作者索取。
参考文献
- 1.
Anderlei T, Büchs J.用于无菌在线测量摇瓶中氧气转移速率的设备。生物化学工程,2001;7:57 - 62。https://doi.org/10.1016/s1369-703x(00)00116-9..
- 2.
关键词:振动瓶,呼吸活性,在线测量,测量速率,测量速率生物化学工程2004;17:187-94。https://doi.org/10.1016/S1369-703X(03)00181-5.
- 3.
Beckers GJM,Conrath U.引发应力阻力:从实验室到现场。CurrOp植物BIOL。2007; 10:425-31。https://doi.org/10.1016/j.pbi.2007.06.002.
- 4.
拟南芥(Arabidopsis thaliana)中丝裂原激活蛋白激酶3 (Mitogen-activated protein kinase 3)和蛋白激酶6 (Conrath u)是诱导拟南芥(Arabidopsis thaliana)应激反应的关键。植物细胞。2009;21:944-53。https://doi.org/10.1105/tpc.108.062158.
- 5.
关键词:种子萌发,多路径,相似萌发行为拟南芥蒂利亚纳.新植物。2016; 209:1301-12。
- 6.
Chen Z、Silva H、Klessig D。水杨酸诱导植物系统获得抗性的活性氧物种。科学。1993;262(5141):1883–6.
- 7.
Chomczynski P.一种试剂,用于从细胞和组织样品中单步同时分离RNA,DNA和蛋白质的试剂。生物技术。1993; 15(532-4):536-7。
- 8.
Conrath U, Beckers GJM, Langenbach CJG, Jaskiewicz MR. Priming for enhanced defense。Annu Rev Phytopathol. 2015; 53:97-119。https://doi.org/10.1146/annurev-phyto-080614-120132.
- 9。
Conrath U.防御引发的分子方面。趋势植物SCI。2011; 16:524-31。https://doi.org/10.1016/j.tplants.2011.06.004.
- 10。
康拉思大学。全身获得性抵抗。电厂信号行为。2006;1:179–84.https://doi.org/10.4161/psb.1.4.3221.
- 11.
Conrath U,Pietersecm,Mauch-Mani B.植物病原体相互作用的启动。趋势植物SCI。2002; 7:210-6。https://doi.org/10.1016/S1360-1385(02)02244-6.
- 12.
Coates ME, Beynon JL。拟南芥Hyaloperonospora Arabidopsidis作为病原模型。Annu Rev Phytopathol. 2010; 48:329-45。https://doi.org/10.1146/annurev-phyto-080508-094422.
- 13.
Cvetkovska M, Alber NA, Vanlerberghe GC。线粒体超氧化物爆炸在应激过程中的信号作用。植物信号处理研究进展。2013;
- 14.
Cvetkovska M, Vanlerberghe GC。替代氧化酶通过影响活性氧线粒体的生成来影响植物对生物胁迫的响应。Plant Cell Environ. 2013;36(3): 721-32。
- 15.
陈建平,陈建平,陈建平,等。水杨酸在植物抗病中的核心作用。科学。1994;1247 - 1250。https://doi.org/10.1126/science.266.5188.1247.
- 16.
Flitsch D、Krabbe S、Ladner T、Beckers M、Schilling J、Mahr S等。48孔微量滴定板任何单孔的呼吸活动监测系统。生物工程杂志,2016;10:14.https://doi.org/10.1186/s13036-016-0034-3.
- 17
Geipel K、Socher ML、Haas C、Bley T、Steingroewer J。a的生长动力学向日葵A.鼠尾草悬浮细胞系:摇瓶培养,在线监测系统。工程生命科学。2013;13(6):593–602.
- 18
水杨酸水培处理降低了玉米冷害的影响(玉米植物。足底。1999;208:175–80.https://doi.org/10.1007/s004250050547.
- 19。
Jaskiewicz M、Conrath U、Peterhänsel C。染色质修饰在植物逆境反应中作为系统获得抗性的记忆。EMO代表,2011年;12:50–5.https://doi.org/10.1038/embor.2010.186.
- 20。
二氯异烟碱和水杨酸是系统获得性抗性的诱导物,增强了真菌诱导物在香菜细胞中的反应。植物j . 1992; 2:655-60。https://doi.org/10.1111/j.1365-313X.1992.tb00134.x.
- 21。
Kauss H,Jeblick W.欧芹悬浮培养物的预处理具有水杨酸的悬浮蛋白增强了H2O2的自发性和引发的产生。植物理性。1995年; 108(3):1171-8。
- 22。
科勒,Schwindling年代,Conrath美国Benzothiadiazole-induced启动强应对病原体感染,受伤,渗透水的叶子需要NPR1 / NIM1基因在拟南芥。植物杂志。2002;128:1046-56。https://doi.org/10.1104/pp.010744.
- 23。
Krug R,Schröderd,Gebauer J,Suljićs,Morimoto Y,Fujieda N等人。有机化学中的酪氨酸酶:用于β-二羰基化合物的α-芳基化合物的多功能工具。EUR J Org Chem。2018; 2018:1789-96。https://doi.org/10.1002/ejoc.201800188.
- 24.
Lawton Ka,Friedrich L,Hunt M,Weymann K,Delaney T,Kessmann H,等。苯并噻唑诱导抗病抗性拟南芥通过激活系统获得性耐药信号转导途径。植物J。1996;10:71–82.https://doi.org/10.1046/j.1365-313x.1996.10010071.x.
- 25.
Lobo AKM、de Oliveira MM、Costa Lima Neto M、Caruso Machado E、Vasconcelos Ribeiro R、Albensio Gomes Silveira J。外源蔗糖供应通过下调Rubisco丰度和活性,改变甘蔗糖代谢,降低光合作用。植物生理学。2015;173:113–21.
- 26.
Martinez Medina A、Flors V、Heil M、Mauch Mani B、Pieterse CMJ、Pozo MJ等,《认识植物防御启动》。植物科学趋势。2016;21:818–22.https://doi.org/10.1016/j.tplants.2016.07.009.
- 27.
Morschett H,Schiprowski D,Müller C,Mertens K,Felden P,Meyer J等。平行微型光生物反应器的设计和验证,使光营养生物过程在高通量下发展。生物技术生物工程。2017;114:122–31.https://doi.org/10.1002/bit.26051.
- 28.
Norman C,Howell Ka,Millar啊,Whelan JM,Day Da。水杨酸是鼻孔和线粒体电子传输的抑制剂。植物理性。2004; 134(1):492-501。
- 29
Oerke E.对害虫的作物损失。j农业sci。2006; 144:31-43。https://doi.org/10.1017/S0021859605005708..
- 30.
奥利里BM,噢,GGK,李CP,米勒啊。代谢调节相互作用通过雷帕霉素(TOR)激酶激活的靶点控制植物呼吸代谢。植物细胞。2020;32(3):666–82.
- 31。
Raval KN、Hellwig S、Prakash G、Ramos Plasencia A、Srivastava A、Büchs J。印楝素类柠檬苦素悬浮培养两步法生产的必要性Azadirachta indica. 生物科学杂志。2003;96(1):16–22.
- 32。
细胞色素和烟草的替代途径呼吸(水杨酸的影响)。植物杂志。1993;103(3):877 - 83。
- 33。
Ryals Ja,Neuenschwander Uh,Willit Mg,Molina A,Steiner Hy,Hunt MD。系统获得的阻力。植物细胞。1996年; 8:1809-19。https://doi.org/10.1105/tpc.8.10.1809.
- 34。
Svvides A,Ali S,Tester M,Fotopoulos V.植物的化学灌注对多种非生物应激:特派团可能吗?趋势植物SCI。2016; 21:329-40。
- 35。
Scafaro AP,Negrini Aca,O'Leary B等人。气相荧光团技术与自动化的组合,实现植物呼吸的高通量分析。植物方法。2017; 13:16。https://doi.org/10.1186/s13007-017-0169-3.
- 36.
席尔海姆B、詹森I、鲍姆S、比斯利A、博姆C、康拉思U。莱菔硫烷修饰组蛋白H3,解开染色质,启动防御。植物生理学。2018;176:2395–405.https://doi.org/10.1104/pp.17.00124.
- 37.
Schilling JV, Mahr S, Schillheim B, Conrath U, Büchs J.缩小欧芹细胞培养的规模,为农用工业筛选假定的引物。生物科技新》。2016;33:S38。https://doi.org/10.1016/j.nbt.2016.06.856.
- 38.
Schilling JV, Schillheim B, Mahr S, Reufer Y, Sanjoyo S, Conrath U, Büchs J.氧转移速率识别欧芹细胞中的引物。植物生物学杂志。2015;15:282。https://doi.org/10.1186/s12870-015-0666-3.
- 39.
Schmitz G, Reinhold T, Göbel C, Feussner I, Neuhaus HE, Conrath U.夜间进入叶绿体的ATP的限制似乎影响激素的干扰,主要防御,增强抗病能力拟南芥蒂利亚纳.植物微生物的相互作用。2010;23:1584-91。https://doi.org/10.1094/MPMI-02-10-0045.
- 40。
Schulte A,Schilling JV,Nolten J,Korona A,KrömkeH,VennekötterJ,等。通过改性的拉莫斯装置通过摇叫欧麦细胞培养物并行在线测定乙烯释放速率。BMC植物BIOL。2018; 18:101。https://doi.org/10.1186/s12870-018-1305-6.
- 41。
Senaratna T,Touchell D,Bunn E,Dixon K.乙酰水杨酸(阿司匹林)和水杨酸诱导豆类和番茄植物的多重胁迫耐受性。植物生长调节。2000; 30:157-61。https://doi.org/10.1023/A:1006386800974.
- 42。
Thulke O,Conrath U.水杨酸在欧芹中的防御相关基因中具有双重作用。工厂J. 1998; 14:35-42。https://doi.org/10.1046/j.1365-313X.1998.00093.x.
- 43。
关键词:聚类,聚类,聚类,聚类引用本文:综合表征两种不同尼科尼亚塔哈瓦姆细胞系通过培养基优化导致GFP和HA蛋白产量加倍。中国生物医学工程学报,2012;
- 44。
Van Hulten M,Pelser M,Van Loon LC,PieterseCmj,Ton J。拟南芥防御的成本和益处。Proc Natl Acad Sci U S A. 2006; 103:5602-7。
确认
我们感谢G.J.M.贝克斯提供的技术建议。
资金
开放访问资金支持,由Projekt交易组织。生物经济科学中心的科学活动受到NRW战略项目BIOSC的创新,科学和研究部的财务支持(No.313 / 323-400-00213)。
作者信息
隶属关系
贡献
所有作者都促成了研究的设计;上午,S.W.,A.B.K.S.和R.K.进行了研究;所有作者都分析并讨论了数据;J.L.起草了稿件。J.B. U.C.,U.S.和J.P.阅读,评论并修订了手稿。J.B.启动了该研究,协助数据分析和稿件准备。所有作者阅读并认可的终稿。
通讯作者
道德声明
伦理批准并同意参与
不适用。
同意出版
所有作者都同意本工作将发布。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版说明
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用本文
logen, J., Müller, A., Balzer, A.,et al。光照呼吸活性监测系统识别植物幼苗中的启动活性化合物。BMC植物杂志21,324(2021)。https://doi.org/10.1186/s12870-021-03100-8
已收到:
接受:
发表:
关键字
- 可持续农业
- 氧转移率
- 呼吸活动
- 防御引发化学
- 植物保护
- 植物免疫