抽象的
N.-末端乙酰化(NTA)是真核生物中由N-末端乙酰转移酶(NATs)催化的一种高度丰富的蛋白质修饰。然而,对植物NATs及其生物学功能的研究却很少。我们发现,拟南芥NatB的辅助亚基(Naa25)和催化亚基(Naa20)CKRC3和NBC-1的功能丧失分别导致了胚孔形成缺陷和乙烯的三重反应。蛋白质组分析和WB测试显示,1-氨基环丙烷-1-羧酸氧化酶(ACO,催化乙烯生物合成途径的最后一步)活性在小鼠体内显著下调NATB.突变体,导致内源性乙烯含量降低。缺陷的表型可以通过施加外源乙烯来完全救出,但较少的前体ACC。本结果揭示了在乙烯稳态的共转化蛋白质水平上的先前未知的调节机制,其中NATB介导的ACO介导的NTA使其具有维持乙烯稳态的细胞内稳定性以进行正常生长和反应。
介绍
N.-末端乙酰化(terminal acetylylation, NTA)是真核生物中一种高度丰富的共翻译或翻译后蛋白质修饰形式,在n端乙酰转移酶(NATs)的催化下,蛋白质n端氨基酸的α-氨基基发生乙酰化[1那2].NATs根据底物特异性和亚基组成分为NatA-NatH,它至少包含一个催化亚基和辅助亚基[3.那4.].辅助亚基可以用作核糖体锚,提供底物特异性,和/或与新生多肽的相互作用[5.]. NTA可以改变修饰N-末端的空间位阻或化学性质[6.]可能影响蛋白质相互作用[7.,亚细胞定位[8.,生长,发育和反应中正常细胞寿命所需的稳定性或降解。虽然普遍存在,但NTA的功能意义只有最近在植物中未发现,报告有限的关于其在胚胎发生中的作用[9.], 生长 [10],开花,再现[11], 压力 [12那13那14那15那16]和对病原体的免疫力[17].
乙烯是调节植物生长发育的经典激素。尽管已知的乙烯生物合成是一个相对简单的两步法,ACO酶催化ACC最后一步产生乙烯,但其调控机制仍不太清楚[18].几十年来,人们认为ACS是这一途径的限速酶,从而促进了对ACS在不同水平上的调控的研究。然而,近年来出现的证据表明,在某些情况下,ACO也可以限制乙烯生产的速率[19],这意味着ACOs也可能受到严格的调控,但其分子机制迄今为止几乎不为人知。的拟南芥治疗基因有不同的组织特异性表达模式。例如,ACO1.(AT2G19590型)在胚胎发生中高表达[20].ACO2.(AT1G62380)大多是在新兴幼苗下胚轴中表达,其中涉及形成顶端钩的形成[21].ACO3.(AT1G12010),ACO5.(AT177330)主要表达在根中[22),而ACO4.(AT1G05010)大多是在植物组织中表达的。
在这里,我们表明NAB的功能突变损失导致五个目前已知的功能ACO(ACO2,ACO3,ACO4)中的三种缩小,以影响乙烯稳态,用于正常生长和反应。因此,ACO的NATB介导的NTA使它们具有在体内维持乙烯稳态的细胞内稳定性。
结果
拟南芥的正常生长需要NATB
以前是一个名叫的拟南芥突变体ckrc3由编码推定的辅助亚单元(NAA25 / TCU2)的基因丧失的功能突变引起的α.- 在我们的实验室中分离出末端乙酰转移酶B(NATB)作为疾病缺陷的突变体。NATB是迄今为止发现的八个NAT(NATA - NATH)之一,其含有催化(NAA20)和辅助亚基(NAA25),通过共同翻译以MD /以MD /的NTA催化蛋白质的NTA来进行其全细胞内函数。E / N / Q,在我们以前的实验中确认(在其他地方修订版本[23])和其他人。除了生长素缺乏,ckrc3和NBC-1显示出铅发育缺陷,包括增长率显着降低(补充图S1),叶网状,开花早,胚珠脱落,短角果。
NATB耗尽导致ACO蛋白的下调
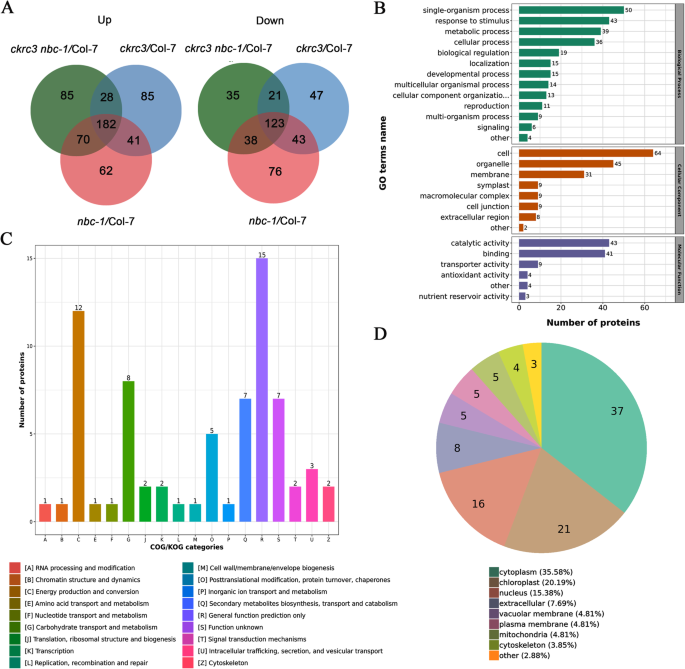
由于NatB的消耗可能会调节许多目标蛋白的丰度,我们在幼苗中进行了全局蛋白质组学分析ckrc3那NBC-1和双突变体ckrc3 nbc-1型并与野生型(Col-7)幼苗进行了比较。共鉴定出6969个蛋白质。以1.5倍作为差异表达的变化阈值P.-Value <0.05是作为统计T检验的意义阈值。在里面ckrc3 nbc-1型/ COL比较组,上调365个蛋白表达,下调217个蛋白质表达(图。1a),发现差异表达的蛋白质是响应于刺激,翻译后改性和次生代谢物生物合成,运输和分解代谢,主要位于根据GO分类的细胞质(图。1B), KEGG浓缩(图。1c)和聚类分析(图。1d)。
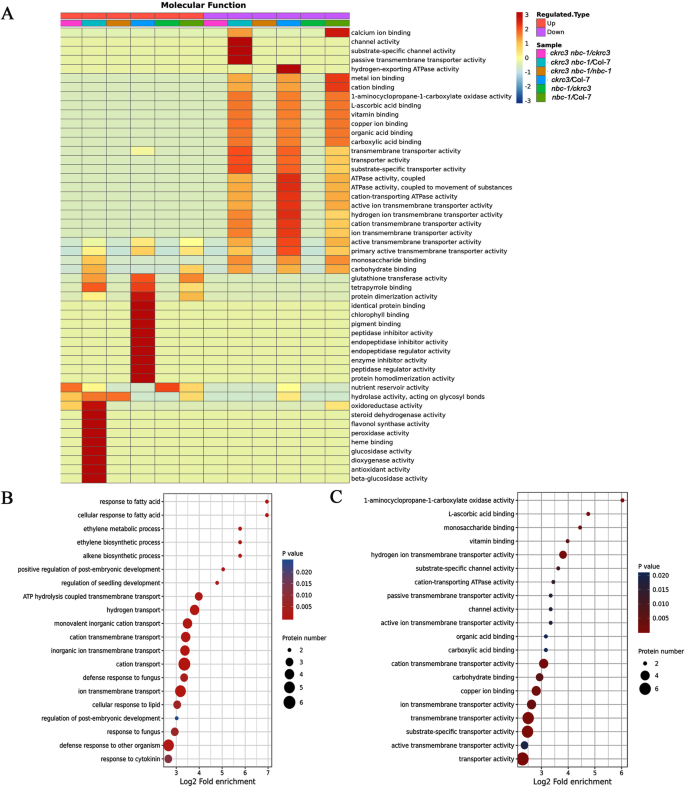
蛋白质注释富集分析显示,在许多生物过程中揭示了蛋白质的显着下调,包括免疫应答,光合作用,蛋白水解的调节,防御反应调节,水解酶活性的阴性调节,对宿主的反应,离子跨膜运输,氢气转运,和乙烯生物合成过程等(图。2A).有趣的是,我们注意到乙烯生物合成过程显著下调。特别是,在基于生物过程和分子功能的蛋白质富集分析中,几种1-氨基环丙烷-1-羧酸氧化酶(ACOs)显著下调(图。2B-C,图。3.B)。
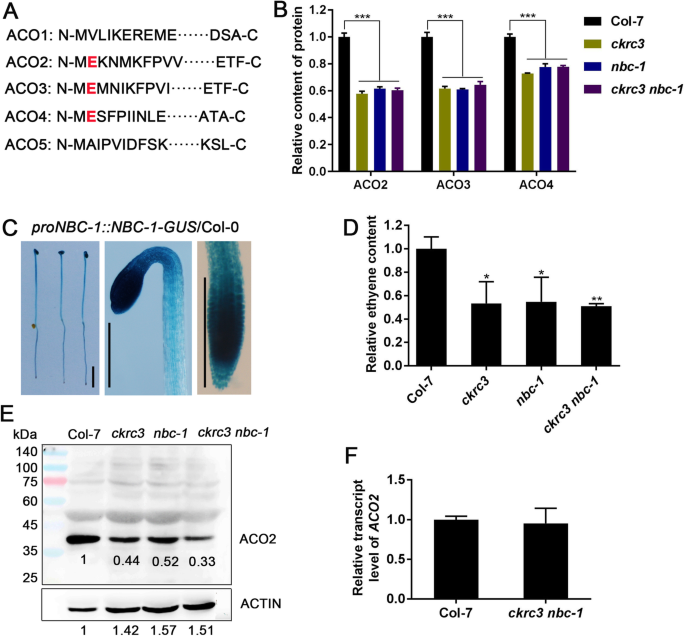
NTA由NAB介导的稳定ACOS。(一种)拟南芥乙烯生物合成中5个已知功能ACOs的N端肽,NatB底物的特异性氨基酸以红色显示(B.)从整个蛋白质组分析数据中提取的ACO2、ACO3、ACO4蛋白水平。(C)GUS的紧张2 :: NBC-1-GUS/ Col转基因幼苗,棒= 2毫米。(D.)乙烯含量的定量结果(E.通过WB试验检测使用ACO2抗体检测到深种幼苗的ACO2蛋白,COL-7中的带中的相对强度设定为1.0。(F)转录水平ACO2.在深色生长的Col-7和ckrc3 nbc-1型RT-QPCR幼苗。“*”,“**”和“***”表示根据ANOVA的显着差异,然后是Duncan的多重比较,P.< 0.05,P. < 0.01 andP. < 0.001, respectively
NatB催化NTA稳定ACO2
在拟南芥,目前已知的5个功能性ACOs中,有3个(ACO2、ACO3、ACO4)具有NatB底物特征(ME…,图)。3.A) 是的。它们的基因具有不同的组织特异性表达模式。例如,ACO2.(AT1G62380)主要表达于萌发的幼苗下胚轴,参与顶端钩的形成。我们也检测到相对高的表达水平NBC-1公司在子叶,根,顶钩,下胚轴转基因2 :: NBC-1-GUS行(无花果。3.C)。据报道,NAT2 / 4的NATB介导的ACO2 / 4的NTA通过乙酰胺分析在拟南芥中发生,在NATB耗尽突变体中显着降低[10]. 在我们的蛋白质组学分析数据中,ACO2/3/4丰度分别降低了40%、36%和30%ckrc3 nbc-1型与COL-7中的那些相比(图。3.B) WB实验也证实了这一点(图。3.E),而它们的转录无显著差异(图。3.f),表明NATB的ACOS的NTA可以使蛋白质突然转录蛋白质。这些结果与我们在我们的另一个调查中的YUC8的结果一致[everywhere修订版本]以及两份新的报告,其中SNC1的NATB介导的NTA [17]和sib1 [12稳定在植物中的这两个乙酰化蛋白质稳定。
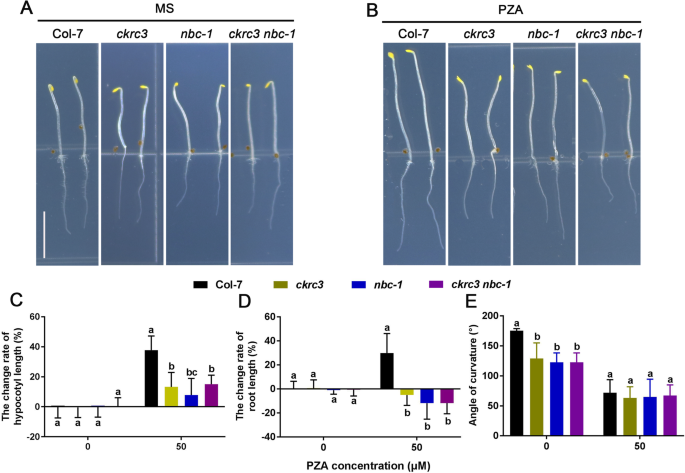
NATB.突变体对ACO抑制剂PZA不敏感
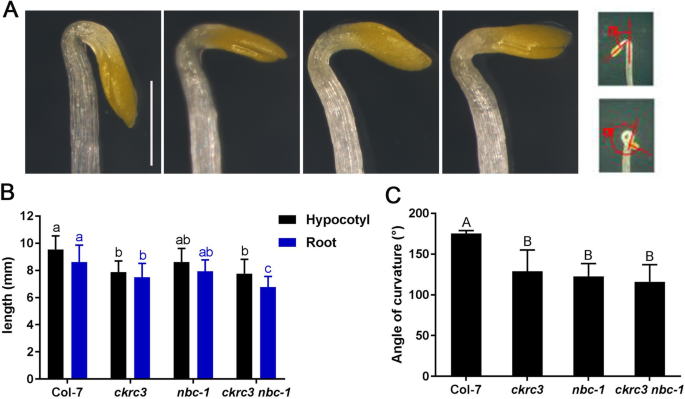
ACOS在拟南芥中的斯科麦粥和乙烯反应中发挥着重要作用,因此我们检查了Natb缺乏是否会影响胰岛膀胱,并发现这一点ckrc3, nbc-1和ckrc3 nbc-1型显示有缺陷的skotomorphogenesis,包括短的下胚轴和根,以及严重的顶端钩缺陷(图。5.A、 图。4.).说明NatB是拟南芥在黑暗中正常生长所必需的。为了进一步证明natb调控的ACOs通过ACOs催化的乙烯生物合成对skotomorphogenesis的影响,我们用ACO抑制剂吡嗪酰胺(PZA)处理黄化幼苗[24],野生型的下胚轴、根较长,顶端钩有缺陷。5.B-E),表明PZA抑制了乙烯生产的基础水平,而治疗NATB.与野生型相比,PZA突变体的下胚轴和根的长度略有增加。
NatB调节乙烯稳态
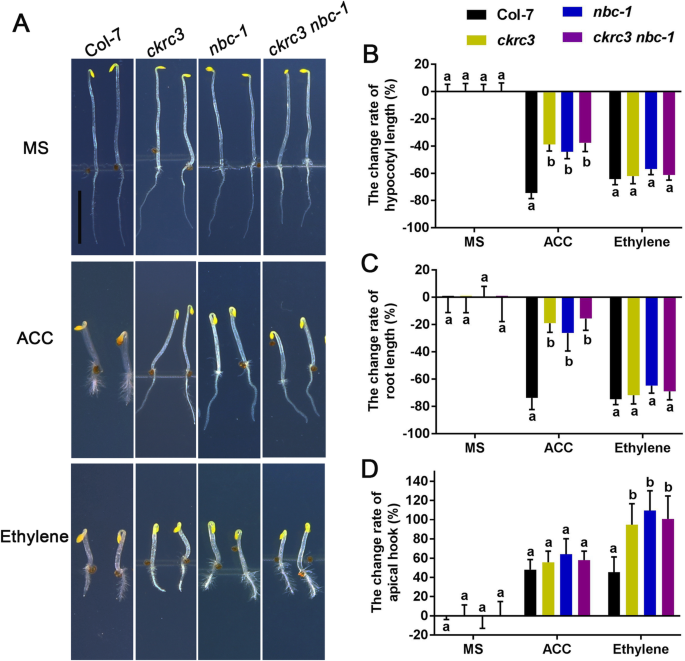
为了直接证实NatB介导的NTA在乙烯稳态中的作用,我们检测了乙烯含量,发现NatB介导的NTA在乙烯稳态中显著降低ckrc3 nbc-1型突变体(图。3.d)。乙烯需要适当的斯波托发生和黑暗中的三响应,这在养出土壤中的育苗之前,这起到了保护作用。由ACOS的下调引起的低乙烯水平将导致这些过程中的缺陷。为了检查,我们在黑暗中观察到3个突变体的表型。正如预期的那样,他们的三重响应中的缺陷(图。6.那补充图。S2)被观察到。接下来,我们检查了响应于口鼻炎的两个重要基因的表达,HLS1型和ERF1,检测他们在ckrc3 nbc-1型(补充图S3),确认NATB参与调节乙烯稳态和生理反应。值得注意的是,这些相关的表型可以通过施加外源乙烯来完全拯救,但通过其前体ACC较少(图。6.),与aco2 /3/ 4in的低稳态水平一致NATB.突变体(图。3.B)。
讨论
作为真核生物中最常见的蛋白质修饰方式之一,N-末端乙酰化以几种不同的方式影响底物的分子后果,包括蛋白质稳定性,蛋白质分选,亚细胞定位,蛋白质折叠和蛋白质相互作用[1那2那6.那25].将NATB推测为N-末端乙酰化物15%的所有酵母和18%的人类蛋白质[3.].NatB缺乏会限制不同蛋白质的细胞功能和生理功能,从而影响多种生物过程。例如,在酵母中naa20-δ和naa25-δ缺失突变体菌株显示出异常形态,线粒体分裂缺陷,以及真空偏析[26],它对减数分裂也是至关重要的,因为它调节突触复合体的组装秀丽隐杆线虫[27].人类细胞系中hNAA20或hNAA25的沉默会导致生长停滞[28].这些研究表明,NTA参与各种生物中的细胞过程,对更高的真核生物来说非常重要。
在植物中,Natb亚基的突变体,NAA20和NAA25,表现出几种发育缺陷。TCU2功能的丧失会导致脂肪发育缺陷表型,包括植被叶,弯曲到初级静脉,聚集的花外观,较短的花器官,较短的单片机[11].我们的研究表明,NAB在拟南芥的正常生长正常生长(图。4.,无花果。5.一种)。此外,NATB通过NTA促进ACO稳定性对母素质反应产生阳性作用(图。3.).徐等人。发现拟南芥的NAB耗尽导致免疫力下降,这是由植物免疫受体SNC1的稳定化引起的[17].NATB耗竭也导致高盐和渗透压力的敏感性[10那29].最近,据报道,NATB催化剂-NTA稳定应力/免疫相关蛋白SIB1,从而实现其迅速的功能和相关应力反应[12].这些结果表明,在植物中,NATB介导的蛋白NTA也在各种生长和反应过程中起重要作用。
传统上,作为压力激素的乙烯在果实成熟,组织和器官衰老中起重要作用。虽然ACO是乙烯生物合成中的速率限制酶[30那31],主要是由洪水等应激因素引起的[32氧气赤字[33那34]、渗透应力[35,以及水果成熟过程[36那37].越来越多的研究表明,乙烯在串联,甘蓝蛋白,芸苔类固醇和其他激素中对串幼苗生长起重要作用[38那39那40那41],特别是在顶端钩形成,缺杆子和根生长中[42那43那44那45]. 我们的研究还表明,ACOs的NTA通过提高蛋白质的稳定性,在根尖、下胚轴和根系生长中起着不可或缺的作用(图1)。3.);相反,它们的功能丧失,对ACC不敏感,但对乙烯正常反应(图。6.),会导致严重的生长缺陷。因此,我们提出催化亚基NBC-1和通过形成NATB络合物在核糖体中致助剂的辅助亚基CKRC3函数,其直接在细胞溶溶胶中直接致动胞质醇,通过这种方式将这些蛋白质的NTA改性更稳定催化乙烯生物合成,并维持其稳态造成植物的正常生长和反应。
结论
总之,我们的结果揭示了在乙烯稳态的共转化蛋白质水平的先前未知的调节机制,其中ACO的NATB介导的NTA使它们保持细胞内稳定性以维持乙烯稳态,以用于正常生长和反应。在拟南芥5个ACOs中有3个具有NatB底物签名(ME),其他2个不具有,在植物生长发育的各个组织/器官中催化乙烯生物合成途径的最后一步。由于NatB在植物发育过程中广泛表达,因此有必要研究NatB介导的ACOs NTA在植物生长发育的整个过程以及对胁迫的响应等方面的作用。
材料与方法
植物材料
突变体ckrc3在Col-7背景中在我们的实验室中孤立之前,突变图书馆购自欧洲亚洲乌斯西斯州乌斯西斯股票中心;http://arabidopsis.info/(NASC编号:N31400)。NBC-1在col0背景,来自NASC和双突变体ckrc3 nbc-1型通过在我们的实验室中交叉获得。
生长条件和表型特征
种子用0.1%HGCL灭菌2,用d彻底洗净2H2O三次,放置在含有1%琼脂和1%蔗糖的MS培养基上。4℃黑暗下培养2天,22℃转白光8 h促进萌发,20℃黑暗下培养3天。化学处理时,将1-氨基环丙烷羧酸(ACC)和吡嗪酰胺(PZA)加入MS培养基进行表型分析。乙烯处理是将无菌种子播种在MS培养基中,在10 cm × 10 cm的含乙烯气体的培养皿中。
RNA提取和实时荧光定量PCR
使用Trizol(Invitrogen)分离RNA(Invitrogen,http://www.invitro-gen.com/)并用逆转录试剂盒(Takara,http://www.takara-bio.com/).通过使用Tb绿色化学(Takara),在应用的生物系统实时PCR设备中进行定量RT-PCR。ACTIN8被用作内部控制。每个生物样本进行3个不同重复的定量PCR分析。每个实验进行3个生物重复。
SDS-PAGE和Western blot
通过SDS-PAGE分离蛋白质样品,然后将其转移到硝酸纤维素印迹膜中。在用5%牛血清白蛋白封闭后,将薄膜在4℃下夜间孵育一般抗体,然后用TBST洗涤三次10分钟,并在室温下与二抗孵育1小时。用TBST洗涤四次10分钟后,使用发光成像系统照射膜。
ACO2抗体的产生
将纯化的合成肽ATSLVESKDSSLVESKDSSLVESKDSSLVESKDSSLVESKDSSSLVESKDSSSLVESKDSSSLVESSSLVESKSSLVESKSSLVESSKDSSSSLVESKDSSSSSLVESKSSLVESKSSLVESKSSLVEYSPS作为抗体免疫兔抗体生产,由中国上海AIBO生物科技有限公司(https://ablebio.company.lookchem.cn/).
蛋白质组学分析
拟南芥幼苗在22℃下在MS培养基上生长,16/8小时光/暗循环10天,提取约0.5g(3个独立的生物复制)幼苗,用裂解缓冲液(8米尿素,1%Triton-100,10mM二硫代噻吩醇和1%蛋白酶抑制剂鸡尾酒)。胰蛋白酶在1:50胰蛋白酶 - 蛋白质质量比中消化蛋白质。用STRATA X C18(现象)和标记的TMT脱节胰蛋白酶肽。使用Highto Betasil C18柱(5μm颗粒,10mM ID,250mM长度),通过高pH反相HPLC分离胰蛋白酶肽分馏成级分。然后液相色谱(Easy-NLC 1000 UPLC系统) - 谱光谱法(Q精确遗料加热)分析。使用MaxQuant搜索引擎(v.1.5.2.8)处理生成的MS / MS数据。全蛋白质组学检验由中国杭州京杰生物有限公司完成(http://www.ptm-biolab.com.cn/).
NBC-1基因的表达分析
从Col-0中扩增出包含启动子和NBC-1全长基因组DNA的3924 bp片段,克隆到pBI101载体中进行生成PNBC-1 :: NBC-1-GUS/ col-0转基因系。对于GUS染色,在黑暗中在MS培养基上生长的3天龄幼苗在37℃下在1mM X-Gluc中孵育,通过使用立体显微镜观察GUS染色。
乙烯量化
拟南芥100毫克幼苗在黑暗中生长3天,用2mL MS培养基中加入5ml色谱仪(GC)小瓶(Agilent),在黑暗中为2d。从小瓶中取出0.5ml顶部空间,并注入气相色谱器(GC-7820A)中。色谱柱:在·Al2O.3./ s;载气:n2;气体压力:18.33 Kpa;离了;气化室温度:200°C。
统计分析
数据以均数±SD表示。采用方差分析(ANOVA)检验比较两组或两组以上治疗之间的差异。
数据和材料的可用性
支持本文结果的所有数据都包含在纸纸及其补充文件中作为数字或表格。
参考
- 1.
Aksnes H,Drazic A,Marie M,Arnesen T.首先:N-末端乙酰转移酶的重要蛋白质标记。趋势Biochem SCI。2016; 41(9):746-60。https://doi.org/10.1016/j.tibs.2016.07.005。
- 2.
AKSNES H,REE R,ARNESEN T. N-末端乙酰转移酶的共同转化,翻译和非催化作用。Mol细胞。2019; 73(6):1097-114。https://doi.org/10.1016/j.molcel.2019.02.007。
- 3.
Starheim Kk,Gevaert K,Arnesen T.蛋白质N-末端乙酰转移酶:当开始很重要时。趋势Biochem SCI。2012; 37(4):152-61。https://doi.org/10.1016/j.tibs.2012.02.003。
- 4.
林斯特E,维茨M。N端乙酰化:一种重要的蛋白质修饰,是应激反应的重要调节因子。J实验机器人。2018;69(19):4555–68.https://doi.org/10.1093/jxb/ery241。
- 5.
雷R,瓦兰S,阿内森T。聚焦于蛋白质N末端乙酰化。实验分子医学。2018;50(7):1–13.https://doi.org/10.1038/s12276-018-0116-z.。
- 6.
n -末端乙酰化的分子、细胞和生理意义。Int Rev Cell Mol Biol. 2015; 316:267-305。https://doi.org/10.1016/bs.ircmb.2015.01.001。
- 7.
Scott DC,Monda JK,Bennett Ej,Harper Jw,Schulman Ba。N-末端乙酰化用作互连的多蛋白复合物内的亲经增强剂。科学。2011; 334(6056):674-8。https://doi.org/10.1126/science.1209307。
- 8.
Aksnes H, Osberg C, Arnesen T. n端乙酰化不是酿酒酵母底物亚细胞定位的一般决定因素。《公共科学图书馆•综合》。2013;8 (4):e61012。https://doi.org/10.1371/journal.pone.0061012。
- 9.
冯军,李锐,于军,马胜,吴超,李勇,等。蛋白n端乙酰化是拟南芥胚胎发生所必需的。实验机器人。2016;67(15):4779-89。https://doi.org/10.1093/jxb/erw257。
- 10。
Huber M,Bienvenut WV,Linster E,Stephan I,Armbruster L,Sticht C等人。NATB介导的N-末端乙酰化影响生长和生物应激反应。植物理性。2020; 182(2):792-806。https://doi.org/10.1104/pp.19.00792。
- 11
Ferrandez-Ayela A,Micol-Ponce R,Sanchez-Garcia AB,Alonso-Peral MM,MICOL JL,PONCE MR。拟南芥NA-α-末端乙酰化复合组分的突变导致脂肪发育缺陷。Plos一个。2013; 8(11):E80697。https://doi.org/10.1371/journal.pone.0080697。
- 12
李Z,Dogra V,Lee Kp,Li R,Li M,Li M,等人。N-末端乙酰化稳定ΣIGMA因子结合蛋白1参与水杨酸 - 灌注细胞死亡。植物理性。2020; 183(1):358-70。https://doi.org/10.1104/pp.19.01417。
- 13
Armbruster L,Linster E,Boyer JB,Brunje A,EiriCh J,Stephan I等。NaA50是一种酶活性N(α) - 乙酰转移酶,对于显影和调节应力反应至关重要。植物理性。2020; 183(4):1502-16。https://doi.org/10.1104/pp.20.00222。
- 14
冯J,Hu J,Li Y,Li R,Yu H,MA L. N-末端乙酰转移酶NAA50调节拟南芥生长和渗透应激反应。植物与细胞生理学。2020; 61(9):1565-75。https://doi.org/10.1093/pcp/pcaaa081。
- 15
Linster E,第D层,Bienvenut WV,Dinh TV,Weyer Fa,Leemhuis W等人。拟南芥N(α) - 乙酰转移酶NAA60位于质膜上,对于高盐应激反应至关重要。新植物。2020; 228(2):554-69。https://doi.org/10.1111/nph.16747。
- 16
Linster E, Stephan I, Bienvenut WV, mape - grodem J, Myklebust LM, Huber M, et al.;拟南芥n -末端乙酰化下调触发aba介导的干旱反应。Nat Commun。2015;6(1):7640。https://doi.org/10.1038/ncomms8640。
- 17.
徐飞,黄勇,李玲,甘农P,林斯特E,胡柏M,等。拟南芥中两种n -末端乙酰转移酶拮抗调节一个点样受体的稳定性。植物细胞。2015;27(5):1547 - 62。https://doi.org/10.1105/TPC.15.00173。
- 18.
Pattyn J,Vaughan-Hirsch J,Van de Poel B.乙烯生物合成的调节:复杂的多级控制电路。新植物。2021; 229:770-782。https://doi.org/10.1111/nph.16873。
- 19.
Houben M,Van de Poel B。1-氨基环丙烷-1-羧酸氧化酶(ACO):制造植物激素乙烯的酶。前植物科学。2019;10:695.https://doi.org/10.3389/fpls.2019.00695。
- 20。
Park CH,Roh J,Youn JH,Son SH,Park JH,Kim SY,等。拟南芥ACC氧化酶1介导乙烯生物合成,参与根系发育。摩尔细胞。2018;41(10):923–32.
- 21。
拟南芥顶端钩的分化生长调控。发展。1999;126(16):3661 - 8。https://doi.org/10.1242/dev.126.16.3661。
- 22。
Brady Sm,奥兰多大,李Jy,王家,Koch J,Dinneny JR等人。高分辨率根时尚型图揭示了主导的表达模式。科学。2007; 318(5851):801-6。https://doi.org/10.1126/science.1146265。
- 23
H. QUU,D. W Di,Y.M Guo,J. L Wang,L. Zhang,P. Tian,Q. Hei,X. F Li,A. J Khaskheli,L. Wu和G.Q GUO,NATB介导的N-末端乙酰化在维持蟾蜍稳态中的生长生物合成酶的意义拟南芥蒂利亚纳那通信生物学修订版本。
- 24
孙鑫,李勇,何伟,季春,夏萍,王勇,等。吡嗪酰胺及其衍生物通过抑制ACC氧化酶阻断乙烯的生物合成。Nat Commun。2017;8(1):15758。https://doi.org/10.1038/ncomms15758。
- 25
关键词:细胞,n -末端乙酰化,细胞,降解信号科学。2010;327(5968):973 - 7。https://doi.org/10.1126/science.1183147。
- 26
Alves S,Neiri L,Chaves SR,Vieira S,Trindade D,Manon S等。N末端乙酰化调节Bax靶向线粒体。国际生物化学细胞生物学杂志。2017;95:35–42.
- 27
高静,张平,Kim HM,李松,Labrador L,等。n端乙酰化促进秀丽隐杆线虫突触复合体的组装。基因Dev。2016;30(21):2404 - 16。https://doi.org/10.1101/gad.277350.116。
- 28
Starheim Kk,Arnesen T,Gromyko D,Ryningen A,Varhaug Je,Lillehaug JR。人N(α) - 乙酰转移酶复合物B(HNATB)的鉴定:对细胞周期进展的重要性。Biochem J. 2008; 415(2):325-31。https://doi.org/10.1042/BJ20080658。
- 29
Van Damme P,Lasa M,Polevoda B,Gazquez C,Elosegui Artola A,Kim DS等。N末端乙酰基组分析和N末端乙酰转移酶NatB的功能见解。美国国家科学院学报。2012;109(31):12449–54.https://doi.org/10.1073/pnas.1210303109。
- 30.
Penrose DM,GLICK BR。调节乙烯水平 - 1-氨基环丙烷-1-羧酸(ACC)脱氨酶,ACC合酶和ACC氧化酶的酶。印度j exp biol。1997年; 35(1):1-17。
- 31。
摩尔德W,Barry CS,Tauriainen AA,Betz C,Tuomainen J,Utraiinen M等人。通过双相环丙烷-1-羧酸合酶和1-氨基环丙烷-1-羧酸氧化酶基因所需的乙烯合成是在臭氧暴露的番茄中的过氧化氢积累和细胞死亡所必需的。植物理性。2002; 130(4):1918-26。https://doi.org/10.1104/pp.009712。
- 32。
关键词:拟南芥,1-氨基环丙烷,1-羧酸氧化酶,泛洪能力生物化学与生物物理学报。2018;503(1):365-70。https://doi.org/10.1016/j.bbrc.2018.06.036。
- 33。
卖,Hehl R.番茄1-氨基环丙烷-1-羧酸(ACC)氧化酶基因家族的第五个成员患有亮氨酸拉链并厌氧诱导。DNA序列:DNA测序和测绘杂志。2005; 16(1):80-2。https://doi.org/10.1080/10425170500050817。
- 34。
英语PJ,Lycett GW,Roberts Ja,Jackson MB。淹没番茄植物芽中的1-氨基环丙烷-1-羧酸氧化酶活性增加,将乙烯产生促进到生理活性水平。植物理性。1995年; 109(4):1435-40。https://doi.org/10.1104/pp.109.4.1435。
- 35
贾H,陈某,刘D,Liesche J,Shi C,Wang J等。乙烯诱导的硫化氢通过在渗透胁迫下染色番茄中的丙焦灭菌来负化乙烯生物合成。前植物SCI。2018; 9:1517。https://doi.org/10.3389/fpls.2018.01517。
- 36
rombaldi c,lelievre jm,latche a,petitprez m,bouzayen m,pech jc。番茄和苹果果实1-氨基环丙烷-1-羧酸氧化酶的免疫细胞胶质化。Planta。1994年; 192(4):453-60。https://doi.org/10.1007/BF00203582。
- 37
Atkinson Rg,Gunaseelan K,Wang My,Luo L,Wang T,Norling Cl,等。用1-氨基环丙烷-1-羧酸氧化酶敲低线对猕猴桃(Actinidia chinensis)熟化的血液乙烯的作用。J Exp Bot。2011; 62(11):3821-35。https://doi.org/10.1093/jxb/Err063。
- 38
关键词:植物生长素,乙烯,油菜素内酯,拟南芥植物与细胞生理学。2005; 46(6): 827 - 36。https://doi.org/10.1093/pcp/pci111。
- 39
Mazzella Ma,Casal Jj,Muschietti JP,Fox Ar。荷尔蒙网络涉及黑暗中的顶端钩发育及其对光的反应。前植物SCI。2014; 5:52。
- 40。
Song S,Huang H,Gao H,Wang J,Wu D,Liu X,等.拟南芥MYC2和乙烯不敏感3之间的相互作用调节茉莉酸和乙烯信号的拮抗作用。植物细胞。2014;26(1):263–79.https://doi.org/10.1105/TPC.113.120394。
- 41。
张x,zhu z,f,hao d,li p,song j等。jasMonate-activated myc2抑制乙烯短暂敏感性3活性,以拮抗亚乙烯促进的乙烯促进的顶端钩形成。植物细胞。2014; 26(3):1105-17。https://doi.org/10.1105/TPC.113.122002。
- 42。
苗寨,赵px,毛泽东,yu lh,袁y,唐,等。Homeobox Protein52通过调节唾液素传输相关的基因表达,在原发性根伸长期间介导乙烯和养蛋白信号传导之间的串扰。植物细胞。2018; 30(11):2761-78。https://doi.org/10.1105/tpc.18.00584。
- 43。
Stepanova An,Hoyt Jm,汉密尔顿AA,Alonso JM。通过拟南芥中的两个根特异性乙烯不敏感突变体的表征筛选的乙烯和养肝之间的联系。植物细胞。2005; 17(8):2230-42。https://doi.org/10.1105/TPC.105.033365.。
- 44。
Vriezen WH,Achard P,Harberd NP,Van der Straeten D.亚乙基介导的丙烯橡皮蛋白植物中的顶端钩形成的增强含有嗜酸叶蛋白依赖性。植物杂志:用于细胞和分子生物学。2004; 37(4):505-16。https://doi.org/10.1046/j.1365-313x.2003.01975.x。
- 45。
Zadnikova P,Wabnik K,Abuzeineh A,Gallemi M,Van Der Straeten D,Smith RS,et al.植物中差异生长引导顶端钩形成的模型。植物细胞。2016;28(10):2464–77.https://doi.org/10.1105/tpc.15.00569。
致谢
作者感谢兰州大学生命科学学院实验中心提供的支持。谢谢瑞金陈教授,提供了乙烯和燃气游戏器设备。
基金
该研究得到了中国国家自然科学基金的补助金(Grant Numbers 3167080163和32070721);用于TCM质量控制的NMPA重点实验室的开放项目(NMPA重点实验室,TCM质量控制,授予No.2020GSMPA-KL02)。
作者信息
隶属关系
贡献
GQG指示实验;HQL进行了主要实验并写了稿件;YJZ进行了组织本地化;HQL,XFL,LW,GQG进行了统计分析。最终修订是由GQG完成的;所有作者均致力于修订的稿件并批准提交的版本。
通讯作者
道德宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者声明没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
刘,总部。,zou,yj。,李,xf。et al。乙烯稳态需要NATB介导的N-末端乙酰化的ACOS的稳定化。BMC植物生物学21,320 (2021). https://doi.org/10.1186/s12870-021-03090-7
已收到:
公认:
发表:
关键字
- 乙烯内稳态
- ACC氧化酶
- N端乙酰化
- NATB.