抽象的
背景
芥末(芥菜)是一种重要的经济蔬菜,有些品种叶片呈紫色,花青素的积累量大于绿色。芥菜紫色性状的遗传和进化尚未得到很好的研究。
结果
在这项研究中,甘露甘露叶片的液体叶片和代谢组织比绿色粘稠含量更多的花青素。控制芥末叶的基因,芥末紫色的叶子(MPL),遗传映射和一个myb113样将同源物鉴定为候选基因。我们确定了三个等位基因myb113样基因,bjmyb113a.来自紫色品种,BJMYB113B.和bjmyb113c.从绿色品种。在紫色等位基因的启动子序列之间发现了总共45种单核苷酸多态性(SNP)和8个诱导物bjmyb113a.绿色的等位基因BJMYB113B..另一方面,紫色等位基因之间的唯一序列变化bjmyb113a.绿色的等位基因bjmyb113c.是在3'的3'Region中插入1,033-BP片段bjmyb113c..转基因测定和启动子活性研究表明,启动子区的多态性是紫外等位基因的上调bjmyb113a.紫色栽培中的花青素高积累。上调bjmyb113a.增加花青素生物合成途径中的基因表达,包括BJCH公司那bjf3h.那bjf3'h.那BjDFR那Bjans.和BjUGFT从而导致花青素的大量积累。然而,上调BjMYB113在等位基因的3'区插入1033个碱基bjmyb113c..
结论
我们的结果有助于更好地理解遗传和进化BjMYB113控制紫叶的基因,为芥菜的进一步育种提供有用的信息。
背景
芥末(芥菜, 2n = 36, AABB)是世界上重要的经济蔬菜[1那2].这种栽培的物种包含几个不同的品种,表现出极端的形态多态性,与叶,茎,根,或种子作为收获器官。对于多叶芥菜品种来说,有些是绿叶的,而有些是紫色的。紫色是由于花青素在叶表皮细胞中积累所致[3.].
花青素是一类水溶性天然色素,广泛分布于高等植物中。它们主要负责花、果实、叶子、种子和其他植物器官的红色、紫色和蓝色[4.那5.].在植物中,花青素在吸引粉碎机和种子分销商中发挥重要作用[5.].花青素可以保护植物免受紫外线损伤,它们具有强大的能力来清除反应性氧(ROS),这对于生物和非生物耐受性至关重要[6.那7.那8.那9.那10那11].这组代谢物还能促进人体健康,对肥胖、炎症、冠状动脉硬化和癌症有明显的功效[12那13那14那15那16].
以往的许多研究表明,高等植物花青素生物合成的转录调控主要由包含MYB、bHLH和WD重复转录因子的MBW三元复合物控制[17那18].例如,AtMYB113与bHLH和WD40蛋白形成复合物,激活花青素生物合成途径中的基因,导致色素在拟南芥[19].MBW三元综合复杂性转型调节花青素生物合成途径中的基因,包括phenylalanine-ammonia裂合酶(朋友),查耳酮合酶(CHS公司),查尔酮异构酶(芝加哥),黄烷酮3-hydroxylase(F3H),二氢烷醇4-还原酶(DFR.),和花色素合成酶(答) [20.那21]. MBW复合物组分的上调已被广泛研究,并被证明是许多植物物种(如桃)花青素高积累的原因[22),苹果(23], 梨 [24],葡萄[25], 血橙 [26],矮牵牛[27], 白饭 [28],莴苣[29],颗翡翠[30.], 羽衣甘蓝 [31],菜花[32],炮筒医疗兵[33除了MBW复合物之外,还发现其他转录因子,例如NAC,HY5,ERF,BBX22和WRKY也参与了花青素生物合成。这些转录因子可以间接地或直接对MBW复合物的组分基因的启动子结合,以调节其表达,因此是花青素生物合成[22那34那35].
Brassica Harbors几个重要蔬菜作物,如白菜,花椰菜,大白菜和芥末,都是绿色和紫色的品种。紫色是一种吸引蔬菜的颜色,其潜在的代谢物为消费者提供了健康益处。在Brassica Rapa.,突变体ANL.轨迹和Anp位点未能产生花青素色素;布雷格3.1和布雷格3.2,两种编码BHLH转录因子的基因,促进大白菜中的花青素生物合成。激活的BoMYB2紫甘蓝和菜花花青素积累的基因研究[31那32].最近,使用F的芥末素遗传分析2源自紫色和绿色品种之间的交叉的群体表明,在编码MyB编码基因的第一个内含子中插入(BJPUR.)将紫色的叶子改为绿色[3.].然而,其功能BJPUR.紫芥的基因尚未得到证实,紫芥的遗传分子机制也不清楚。
与野生祖细胞相比,栽培的园艺作物显示着丰富的颜色多态性。花青素途径上的功能性突变主要发生在MBW复合体成员的编码基因中(见上文)。例如,BoMYB2基因Brassica oleracea.独立激活至少三次导致羽毛,花椰菜和白菜中的紫色。激活事件BoMYB2包括插入一个CACTA转座子,插入一个harbinger转座子和在其启动子区域的点突变[31那32]. 分别编码bHLH、R2R3-MYB、R3-MYB和WD40的4个基因在栽培生菜中表现出序列和功能多态性,其中3个基因的突变促进了生菜叶片花青素的积累[29].
在本研究中,我们使用块分离分析和RNA-seq (BSR-seq)分析了紫色芥菜的遗传控制。通过农杆菌介导的转化,对该基因进行了基因精细定位和功能确认。详细分析了突变事件,提出了致病基因的演化规律。本研究有助于进一步了解芥菜紫色叶片调控基因的遗传和进化规律,为进一步开展芥菜育种提供参考。
结果
芥菜品种花青素的特性研究
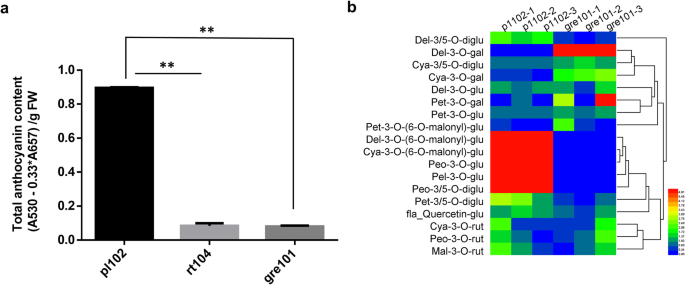
芥末有绿色和紫色品种(无花果。1a、 b、c)。比较了一个紫芥菜品种(pl102)和两个绿芥菜品种(rt104和gre101)的总花青素含量。与预期一样,紫色品种的总花青素含量显著高于两个绿色品种(图。2一种)。紫色品种的叶片组织的释放部分表明,花青素主要在表皮细胞中积累,在表皮附近的叶片细胞的程度上累积。相比之下,在绿色品种中没有发现明显的花青素(图。1d) 是的。
紫色和绿色亲本芥菜品种总花青素含量和花青素化合物分析。一种紫色和绿色品种(叶片)的总花青素含量。B.紫色(pl102)和绿色(gre101)三个生物复制品种的花青素化合物热图。左侧显示了花青素化合物的缩写,表中列出了相应的花青素化合物全名S1.统计分析采用t检验**P. < 0.01
利用液相色谱-电喷雾质谱(LC-ESI-MS)对紫、绿两个品种的花色苷类型及其含量进行了分析。共鉴定出18种花青素(见表1)S1).其中,紫色品种中有6种浓度显著高于绿色品种(P.< 0.05),包括飞燕草苷3,5- o -二葡萄糖苷、飞燕草苷3- o -(6 " - o -丙二烯基)- β -d -葡萄糖苷、花青苷3- o -(6 " - o -丙二烯基)- β -d -葡萄糖苷、天骐草苷3- o -葡萄糖苷、牡丹苷3,5- o -二葡萄糖苷、牡丹苷3- o -葡萄糖苷,均呈深色(图。2b) 是的。我们认为芥菜叶片的紫色是由于这些花青素的大量积累造成的。
芥菜颜色变异控制基因的图位克隆
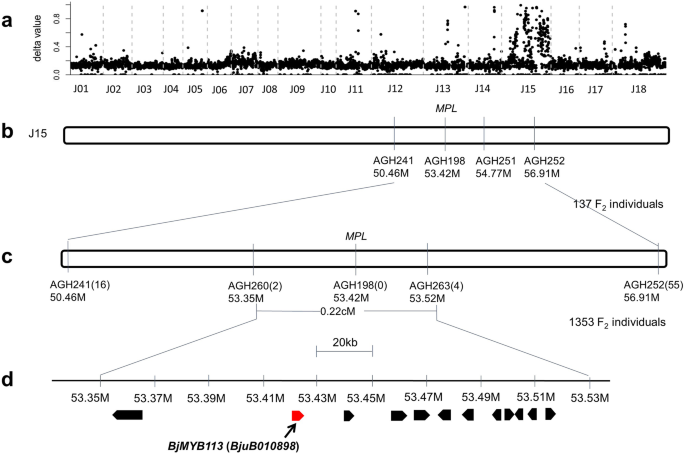
所背景部分,先前的研究表明,在第一个内含子中插入1,268-BP片段my基因对其功能的丧失和绿叶负有责任[3.].此外,一些绿色品种如rt104和gre101没有1268 bp的插入,因此应该有独特的功能丧失机制。为解决上述问题,将紫色品种pl102与绿色品种rt104和gre101分别进行杂交。两个F1杂种是紫色的,它们自交产生两个F2隔离的种群数量。
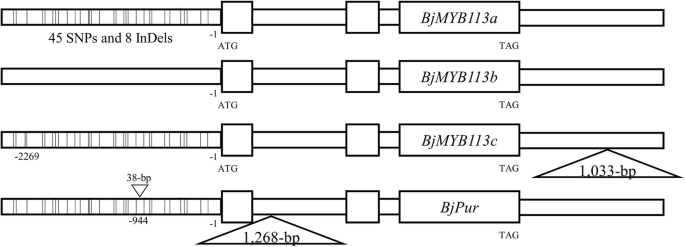
F2由pl102 × rt104组合衍生出的分离群体,紫色叶片102个,绿色叶片35个,期望比为3:1 (χ2= 0.0219 < χ2(0.05,1) = 3.84,P. > 0.05, TableS2),认为是单个基因控制着颜色的变化,这被称为芥末紫色的叶子(MPL)在本研究中。然后,我们使用BSR-seq对颜色变异的基因进行遗传定位。这个MPL基因被映射到染色体J15(B05)(图。3.一种)。从f中筛选总共1,353个个体2人口最终绘制了MPL在J15(B05)上标记AG260和AGH263之间的基因,在约170kb区域的间隔(图。3.b, c).在这段时间内,只预测了12个开放阅读帧(orf)。这my基因,这是一个orthologmyb113在里面拟南芥并且先前被证明可以控制芥菜的颜色变化,也被定位在候选区间,并且仍然是一个可靠的候选基因(BjMYB113) (图。3.d).如上所述,在之前的一项研究中建议灭活候选基因的1268 bp的插入,在绿色亲本中缺失[3.].验证BjMYB113作为候选基因,我们首先调查了该基因在两个亲本之间的序列变异,包括其2842 bp的上游序列。在紫色亲本pl102和绿色亲本rt104的两个等位基因中,共发现45个SNPs和8个indel(图1)。4.).
有趣的是,在紫母PLL02和另一绿色栽培格式GRE101之间未发现这种序列变异。这BjMYB113来自绿色品种Gre101的基因与紫色品种几乎相同,仅在启动子区的-2,269处仅具有一个SNP(图。4.),和BjMYB113两个品种的基因在内含子1中都没有1268bp的插入。对pl102×gre101分离群体的BSR-seq分析也表明,控制叶色的基因位于同一区域BjMYB113在染色体J15(图。S1)(见上图)。然后对其侧翼区域进行测序,发现在其终止密码子下游2873 bp处插入了一个1033 bp的片段。因此,至少有四个等位基因BjMYB113基因,包括bjmyb113a.(紫色等位基因),BJMYB113B.(绿色等位基因)bjmyb113c.(在其3'下游的1,033-bp插入的绿色等位基因,以及先前鉴定的等位基因,在第一内含子中插入1,268-BP片段(图。4.).
Overexpressing的BjMYB113a、BjMYB113b或BjMYB113c等位基因促进了花青素的积累拟南芥
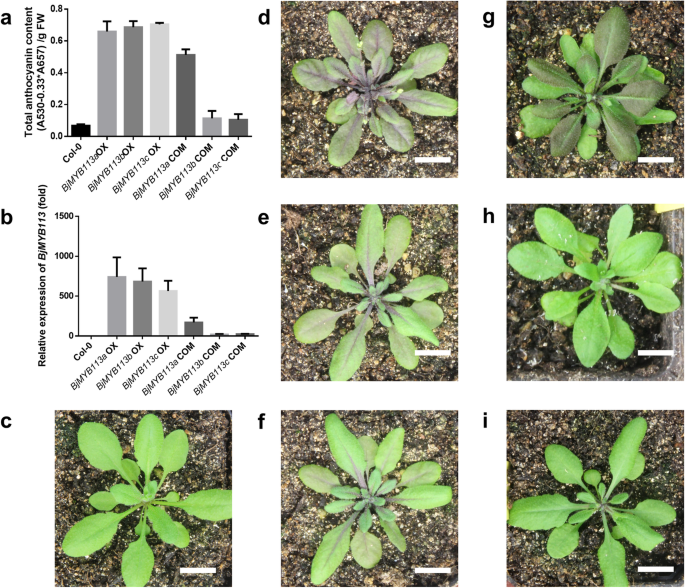
三个等位基因的编码序列bjmyb113a.那BJMYB113B.和bjmyb113c.在不同的芥菜品种中高度保守(Fig。S2). 的编码序列bjmyb113a.和bjmyb113c.是一样的,而bjmyb113a.和BJMYB113B.含有三个SNP,只有其中一个导致氨基酸变化(M120K)(图。S2).验证这三个的功能BjMYB113以花椰菜花叶病毒(CaMV) 35s启动子为驱动基因,将其编码序列转入花椰菜花叶病毒(CaMV) 35s启动子答:芥Col-0。所有拟南芥行overexpressingBjMYB113与野生型的绿叶和茎相比,等位基因有紫色的叶和茎(图。5.C,D,E,F)。正如预期的那样,颜色变化是由于花青素的高积累和高表达BjMYB113(无花果。5.a,b)。上述结果表明,由三个编码的蛋白质BjMYB113等位基因在功能上完全相同。因此,芥菜品种的颜色变异很可能是由基因表达差异引起的BjMYB113等位基因。
启动子区而不是编码区负责基因的激活bjmyb113a.基因
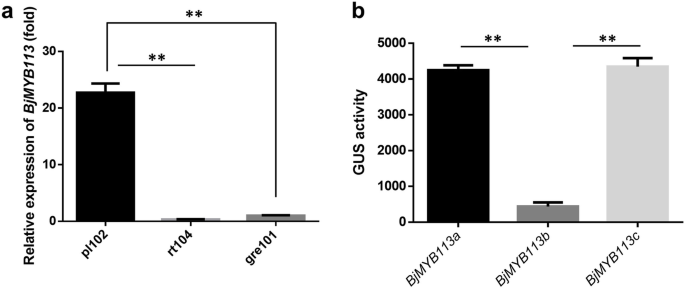
然后,我们研究了表达水平BjMYB113不同芥菜栽培品种的基因。定量实时PCR分析表明表达水平bjmyb113a.(来自紫色品种)明显高于BJMYB113B.和bjmyb113c.(来自绿色品种)(图。6.一种)。我们假设等位基因之间的表达差异bjmyb113a.和BJMYB113B.是由其启动子区域引起的,以及等位基因之间的表达差异bjmyb113a.和BjMYB113C为后者下游1033 bp的插入所致。
测试上述假设,三个启动子活动BjMYB113等位基因进行了分析。格斯启动子驱动的基因bjmyb113a.那BJMYB113B.,bjmyb113c.,分别变成了拟南芥Col-0。获得每种等位基因的六根转基因系,测量这些转基因系的GUS活性。由启动子驱动的GUS活动bjmyb113a.或bjmyb113c.显著高于BJMYB113B.,但在启动子之间没有观察到任何活动差异bjmyb113a.和bjmyb113c.(无花果。6.b)。因此,启动子区域中的多态性占表达差异bjmyb113a.和BJMYB113B.的低表达bjmyb113c.可能是其下游1033 bp的插入而不是启动子区域的点突变引起的。
在基因启动子区之间发现45个SNPs和8个indelbjmyb113a.和BJMYB113B..对于这两个启动子进行基序分析。激活的激活bjmyb113a.在紫色品种pl102中,可能是由于-1317(C到G)、-1576(A到G)、-1588(G到T)、-2593(C到T)的点突变。这四个snp产生了新的转录因子结合位点,包括一个MBSI基序(aaaaaa C(G/C)GTTA)、一个bHLH基序(CANNTG)和两个TATA盒基序(ATTATA)。
1033 -bp的插入抑制了bjmyb113c.
验证1033 -bp插入对表达的影响BjMYB113, 这bjmyb113c.等位基因,包括其本地启动子和3'Region转化为拟南芥Col-0。在阳性转基因中没有观察到颜色变化(图。5.i) 是的。相反,含有bjmyb113a.带有天然启动子和3'下游序列的基因确实将颜色从绿色变为紫色(图。5.G)。注意,上述两个构造之间的主要序列差异是1,033-BP插入。我们得出结论,高表达bjmyb113a.是由于其启动子区域的突变,并且低表达bjmyb113c.是由于插入其下游区域1033 bp片段的抑制作用所致。
高表达bjmyb113a.活化了花青素生物合成基因
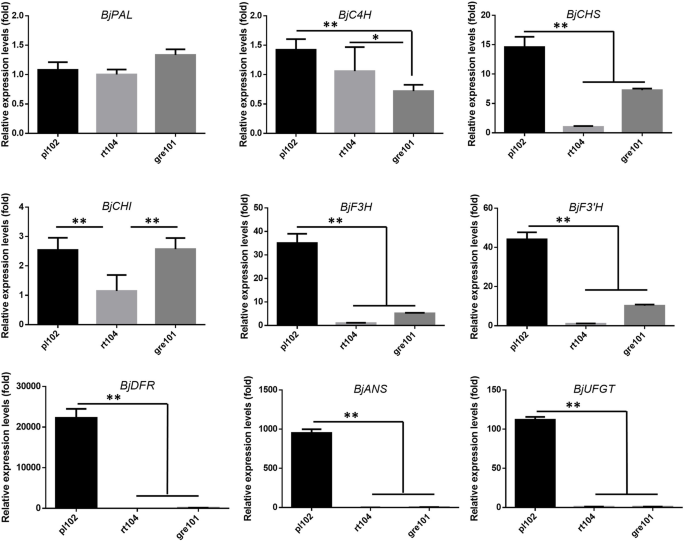
作为MBW转录因子复合物中的一个重要组分,被激活BjMYB113该基因可能上调花青素生物合成途径中的多个基因。采用qRT-PCR方法检测不同基因的表达差异比帕尔(北京036480),BjC4H(BjuB015902),BJCH公司(BjuA041225),比奇(北京004576),bjf3h.(BJUA035478.),bjf3'h.(BjuA047311),BjDFR(BjuA033678),Bjans.(bjub044852),和BjUGFT(BjuA047199).QRT-PCR结果表明表达了BJCH公司那bjf3h.那bjf3'h.那BjDFR那Bjans.,BjUGFT紫色品种pl102显著高于绿色品种rt104和gre101(图1)。7.).
进化的过程BjMYB113基因
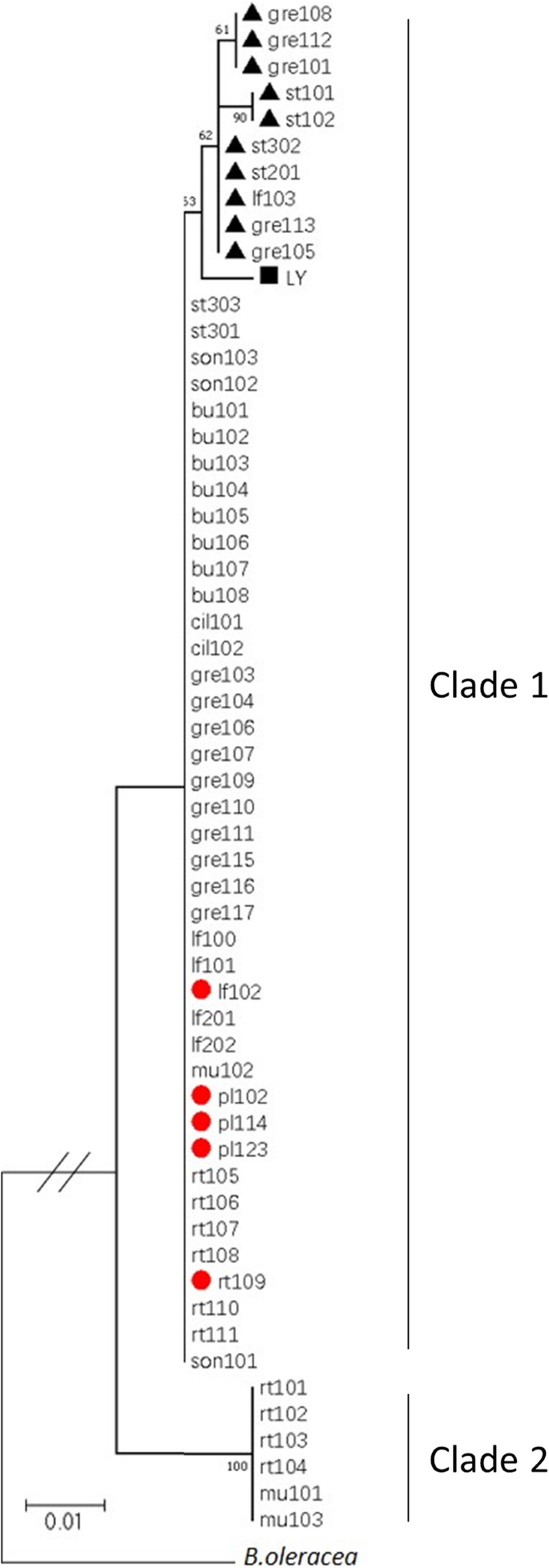
了解地球的演化BjMYB113对58份芥菜材料的启动子序列进行了PCR扩增和测序,其中5份为紫色,53份为绿色。所有材料均对1号内含子中1268 bp的插入及其下游1033 bp的插入进行基因分型。利用基因全长序列构建邻域连接树博米B113从Brassica oleracea.作为一个小组(图。8.).这些基因序列在芥菜中有两个主要的分支,两个分支的启动子序列中至少有50个核苷酸的差异。进化枝2的6个序列是相同的,都带有绿色品种rt101的失活启动子(BJMYB113B.).分支1包含五个不同的序列,包括序列bjmyb113a.,它有激活的启动子,在其下游缺少1033 bp的插入。第二序列(含三个品种)为bjmyb113c.一个核苷酸不同于bjmyb113a.在启动子序列中,在其下游有1033 bp的插入。第三个序列(两个品种)只相差两个核苷酸bjmyb113a.并且还具有1,033bp插入。第四个序列(五种品种)具有与之相同的启动子序列bjmyb113a.并使用1,033-bp插入。第五序列(一种栽培品种)在启动子序列中变化38bp插入,并且在内含子1中具有1,268bp插入。因此,来自疏口液1的所有启动子序列最有可能被活化(见上文)。令人惊讶的是,在疏水板1,36中的52种品种中有绿叶,但它们在内含子1或其3'中没有大的插入。随机选择36种绿色品种的三种基因型作为探测表达水平的代表BjMYB113. 表达水平BjMYB113三个绿色品种的平均产量均显著低于对照bjmyb113a.从紫色品种,表明可能有其他突变事件导致失活BjMYB113花青素生物合成途径的基因或其他基因功能缺失突变(图。S3).
讨论
MYB在植物的颜色变异中起着核心作用
在这项研究中,我们发现BjMYB113基因负责芥末的颜色变化,启动子区域中的点突变和小吲哚占其活化和积累的花青素。颜色多态性可能是由花青素生物合成途径中的任何基因引起的。然而,最常见的天然颜色变化的因果基因是MyB编码基因。例如,RLL2级编码R2R3-MYB转录因子的基因,调节来自花青素生物合成途径的多种基因,促进莴苣叶中花青素的高级别积累[29].在B油菜籽物种,这BoMYB2基因已被独立激活至少三次[31那32]. 血橙是通过在MYB基因上插入Copia样的反转录转座子而产生的红宝石[26].这OsC1编码区域中的突变在水稻中变化的组织着色程度[36].
野生物种在自然种群中有绿色的叶子,而许多园艺品种有红色/紫色的叶子,如红叶李,紫色莴苣和紫色芥菜。根据它们的野生祖先是绿叶的假设,红色或紫色的品种产生于突变和人工选择,并在驯化或育种过程中保持。我们在这项研究中表明BjMYB113由于累积的点突变和/或诱导而被激活基因。有趣的是调查哪个点突变/ indel在其激活中发挥着关键作用。
在这项研究中,我们也发现了一种灭活的突变事件BjMYB113基因,在下游的大插入。Blastn搜索插入的序列显示它在芥末基因组中具有高拷贝数。插入的序列不与已知的转换元件和序列显示相似度本身请勿显示典型的转座子结构,例如目标站点复制(TSD)或终端反转重复(TIR)。
细胞失活的机制BjMYB113插入的基因仍然未知。一种可能是插入可能导致该区域的甲基化,从而下调其表达。我们对这一区域的胞嘧啶甲基化状态进行了研究,但甲基化率在两组间无显著差异bjmyb113a.和bjmyb113c.(无花果。S4).另一种可能性是插入破坏了基因的增强子基序。插入也可能改变染色质结构,从而降低其附近的基因表达。
我们的序列分析表明,至少36个绿色叶片的品种具有激活的启动子bjmyb113a.来自紫色品种的等位基因,但它们在其3'下游或1,268bp插入中没有1,033bp插入,在内含子1中可以沉默基因。我们排序整个BjMYB113来自一些品种的基因,但没有鉴定序列变异。因此,这些绿色表型最可能是由花青素生物合成途径中其他基因的功能丧失引起的,而不是BjMYB113基因。
在最近的一份报告中,第一个内含子中的1,268磅 - BP插入抑制了BjMYB113基因,导致低花青素积累[3.]. 唯一不同的是BjMYB113来自那种品种ly和的基因bjmyb113a.等位基因是一个38-bp插入,并且尚不清楚是低表达BjMYB113该基因在启动子中插入38 bp,或插入内含子1中插入1268 bp(图1)。4.).
不同的突变事件激活与花青素生物合成相关的基因
许多突变事件可能激活与花青素生物合成相关的基因,包括点突变、转座因子插入、基因复制和启动子区的InDels。CACTA样转座子和先兆转座子的插入被激活BoMYB2,分别导致紫甘蓝和紫菜花中花青素的积累[31那32].非ltr逆转录转座子激活CaAn2在紫色Capsicum Annuum.[37].激活了Copia的Retrotransposon红宝石导致血液橙色柑橘类[26].启动子区域的基因复制和突变激活RLL2级基因导致生菜中活化的花青素生物合成[29].启动子变异两个B.等位基因决定了玉米花青素产生的组织特异性[38].
BSA与RNA-SEQ组合是映射和克隆因果基因的有效方法
BSR-seq是一种高效、经济的方法,已被广泛应用于包括小麦在内的多种作物重要性状基因的鉴定[39], 卷心菜 [40,西瓜41], 白饭 [42],菜花[43]和中国羽衣甘蓝[44].在这项研究中MPL通过F的BSR-SEQ分析,基因也被克隆2隔离的种群数量。RNA-seq可能检测不到像DNA-sEq那样多的snp。然而,在大多数情况下,RNA-seq识别的snp数量足以进行遗传分析。两个极端库中一个SNP等位基因频率的巨大差异为SNP与一个致病基因之间的联系提供了直接证据。这两个基因库的rna序列还提供了差异表达基因(DEGs)的信息。这些deg如果位于候选区域,可能有助于候选基因的识别。对两个极端的差异基因池之间的GO分析可能也表明了与兴趣特征相关的途径。在这项研究中,芥菜颜色变异的致病基因,BjMYB113,显示了两个池之间的表达差异。此外,与F的绿色池相比,在紫色池中占据了花青素生物合成途径中的几种基因2隔离人口。所有这些信息极大地帮助我们确定BjMYB113基因作为芥菜颜色变异的致病基因,了解芥菜颜色变异的相关途径。
结论
我们遗传克隆了芥菜中紫叶的R2R3-MYB编码基因。BjMYB113由于启动子的变异而被激活,导致紫色品种花青素生物合成途径中基因的高表达和花青素的高积累。然而,在它的3'区域或第一个内含子中的大量插入破坏了活性等位基因的高表达,导致绿色。这些结果表明,BjMYB113转录因子作为MBW三元复合物的重要成员,在人工选择和驯化过程中经历了功能获得和功能丧失的突变。我们的研究结果有助于更好地理解人类的遗传和进化BjMYB113芥菜紫色叶片的基因调控研究为进一步开展芥菜的育种提供了有用的信息,将引起生物学家的广泛关注。
方法
植物材料和遗传隔离种群
选择紫色芥菜品种PL102和绿色品种RT104和GRE101,以研究紫色叶子的遗传。这三种芥菜植物是棕色芥末(芥菜). 紫色品种pl102分别与绿色品种rt104和gre101杂交,形成两个F2隔离的种群数量。这些F.2在这项研究中,将汉语匡庄教授(华中农业大学园艺和林业科学学院)收购了父母的分离群体。父母种子系最初是在国家蔬菜改善中心(中国中部)。种子在25℃±2℃下在16/8 H光周期下的温室中萌发和播种。所有植物都被种植到中国华中农业大学校园领域,中国武汉。
总花青素含量分析
总花青素含量分析的方法遵循先前描述的指南和方案[45].提取花青素时,每个样品的0.1 g组织用300µL的提取缓冲液(含1% HCl的甲醇)在4℃黑暗中孵育过夜。提取后,每个样品分别加入200µL的水和200µL的氯仿,在530和657 nm处进行吸光度测定。在530 nm (A530) - 0.33A657处计算吸光度测定花青素的含量,每个样品经3次独立实验提取测定。
类黄酮代谢产物分析
黄酮类代谢产物的相对含量芥菜采用MetWare(中国武汉)公司的液相色谱-电喷雾电离-串联质谱(LC-ESI-MS/MS)系统对叶片样品进行分析。采用液相色谱-电喷雾电离-串联质谱(LC-ESI-MS/MS)对中药材中花青素代谢产物进行相对定量芥菜留下样品。在方法中详细描述了方案S1.
膨胀的分离分析和RNA-SEQ(BSR-SEQ)
采用群体分离分析结合RNA-seq(BSR-seq)技术对紫色叶的控制基因进行了定位[46].来自f的共有20个紫色的人2将种群混合为紫色池,将20个绿色个体混合为绿色池。使用Rnaiso Plus(Takara,Japan)从两个池中提取总RNA。RNA-SEQ对Illumina Hiseq2500平台进行(Novogene,China)进行,为每个池获得约5 GB的清洁数据。数据被映射到芥菜参考基因组[47],使用Bowtie软件[48].使用SAMtools执行SNP调用[49].具有地图质量值<30的低质量SNP,读取深度<10×或基本质量<20被排除在外。Δ(SNP-INDEX)的关键参数用于识别紫色/绿色特征的目标区域[50].通过从紫色池的SNP指数值中减去绿色池的SNP指数值来计算Δ(SNP-index)。在候选区域设计切割的扩增多态序列(帽)标记,并用于筛选人群以精细地图休闲基因。表中示出了基于地图的克隆的引物S3.支持本研究结果的RNA-SEQ数据可在NCBI SRA中获得(序列读取存档,http://www.ncbi.nlm.nih.gov/sra/)生物项目PRJNA672814下的储存库。
RNA提取和实时逆转录聚合酶链反应(qRT-PCR)定量分析
使用Rnaiso Plus(Takara,Japan)从叶子中提取了总RNA。使用Orgo-DT18引物使用转肌型单步GDNA去除和cDNA合成超混合物(Transscript)合成cDNA。QRT-PCR分析遵循先前描述的指南和协议[51].使用SYBR预混物(5.0μL2×SYBR预混物GO TAQ II,0.5μL引物,1.0μLcDNA和3.5μlDDH2O)进行所有反应。QRT-PCR样品的熔化曲线分析显示,每个基因引物反应只有一种产品。测序PCR产物以确认特异性扩增。保留的基因BjEF-1-α37用于组织内标。相对表达量按公式2计算-△△CQ.如Bio-rad协议中所述,使用学生的测试计算统计差异。在QRT-PCR中进行了三种生物复制和三种技术复制。QRT-PCR分析中使用的引物显示在表中S3.
质粒构建与植物转化
全长BjMYB113用CAMV 35 S启动子克隆cDNA中的pRI101-GFP载体,以构建过表达载体。全长BjMYB113扩增基因序列(包括天然启动子和3’区序列),克隆到pr101 - gfp中构建互补载体。启动子区约3 kbBjMYB113扩增等位基因并将其重组成PCAMBIA1301-GUS载体,用于检查GUS活动。所有载体都是使用同源重组构建的。通过测序验证阳性质粒,然后转化为农杆菌肿瘤术GV3101采用热刺激法。这些向量被变换成拟南芥采用浸花法[52].所有用于载体构建的引物见表S3.
启动子活动分析
定量GUS活性的测定采用Lu的方法,稍加修改[53]. 1月龄时检测到GUS活性拟南芥叶组织(10mg)从三种独立的转基因系和每条线的六个个体。使用300μLGUS萃取缓冲液(50mM磷酸盐缓冲液,pH7.0; 10mM EDTA,pH 8.0; 0.1%DoCECVL硫酸钠; 10mMβ-巯基乙醇)来提取总蛋白质。使用BCA蛋白质测定(BeyoTime Biotechnology,中国)来测量蛋白质浓度。将萃取(100μl)加入含有1mm 4-甲基纤维素葡萄糖醛(MUG,Sigma)的900μLGUS提取缓冲液中并在37℃温育。900μL静止溶液(1M碳酸钠)分别在100μl上述反应混合物中加入100μl,以后60分钟。使用Tecan Infnite™在455nm发射和365nm激发中使用Tecan Infnite™监测4-甲基纤维酮(mu)的荧光。Gus活性表示为μmoles4-甲基纤维素(mu)min−1毫克−1蛋白质。
序列分析与邻接树
启动子序列BjMYB113采用PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).
使用Muscle程序进行序列比对,并在GeneDoc中手动调整(http://www.nrbsc.org/gfx/genedoc/).使用Mega 7.0构建邻居加入树[54“使用1,000次计算引导值。
基因序列(bjmyb113a., -B.,和-C)支持这项研究的结果可在NCBI基因库(https://www.ncbi.nlm.nih.gov/genbank/)注册号:MW166171-MW166173,银行编号:2394807。用于基因序列分析的引物如表所示S3.
甲基化敏感消化
甲基化敏感消化方法遵循先前描述的指南和方案[55].从紫色芥菜栽培品种PL102和绿色品种GRE101中提取基因组DNA。通过使用NanoDrop(Thermofisher Scientific,U.S.A.)分光光度分析评估提取的基因组DNA的质量和完整性。根据制造商的指示(新英格兰Biolab Inc.,U.S.A.),通过甲基化敏感的肝脏核酸酶MCRBC消化基因组DNA。然后,进行QRT-PCR分析[51].每个样本在三个独立的实验中测量。C均值T.数值用于计算ΔCT.如下:ΔCT.= [CT.(McrBC治疗T.(对照)],甲基化百分比计算为甲基化% = 100 - (100 × 2-ΔcT.).
数据和材料的可用性
支持本研究结果的数据在纸质及其附加文件中。所有测序数据集都在BioProject ID Prjna672814下沉积在国家生物技术信息(NCBI)中,序列读取实现(SRA)加入SRR12919405-SRR12919408。基因序列(bjmyb113a., -B.,和-C)支持这项研究的结果可在NCBI基因库(https://www.ncbi.nlm.nih.gov/genbank/)根据“银行2394807的登录号MW166171 - MW166173”。
缩写
- 答:
-
花青素合成酶
- BSR-seq:
-
膨胀的偏析分析和RNA-SEQ
- CaMV:
-
花椰菜花叶病毒
- 帽子:
-
剪切扩增多态性序列
- Chi:
-
Chalcone异构酶
- CHS:
-
查耳酮合酶
- 可见:
-
差异表达基因
- DFR:
-
二氢烷醇4-还原酶
- F3h:
-
黄烷酮3-hydroxylase
- 去:
-
基因本体论
- indels:
-
插入和删除
- LC-ESI-MS:
-
液相色谱 - 电喷雾电离质谱法
- MPL:
-
芥末紫色的叶子
- μ:
-
4-methylumbelliferone
- 杯:
-
4-methylumbelliferyl葡糖苷酸
- ORFS:
-
开放阅读框架
- 朋友:
-
苯丙氨酸解氨酶
- qRT PCR:
-
定量实时逆转录聚合酶链反应
- ROS:
-
活性氧物种
- SNPS:
-
单核苷酸多态性
- 行动:
-
终端反向重复
- TSD:
-
目标站点重复
参考
- 1.
谢琦、胡志军、张勇、田S、王志军、赵志军、杨勇、陈戈。紫色瘤茎芥菜花色苷的积累及其分子调控(芥菜var。tumida tsen et lee)。JAgric Food Chem。2014; 62(31):7813-21。
- 2.
刘旭,陆勇,袁勇,刘硕,关聪,陈硕,刘振中。德诺维转录组的芥菜种皮及黄酮类化合物生物合成基因的鉴定。《公共科学图书馆•综合》。2013;8 (8):e71110。
- 3.
衡器,程q,张t,刘x,黄鹤,姚p,刘z,van z,富t.细微绘图BJPUR.紫色叶颜色的基因芥菜.Al Appl Genet 2020:https://doi.org/10.1007/s00122-00020-03634-00129.
- 4.
关键词:植物,花青素,生物活性,分析植物化学。2003;64(5):923 - 33所示。
- 5.
斯图尔曼J、霍巴拉M、布罗格L、摩尔J、巴斯滕C、库勒迈耶C。中国花卉授粉综合征的解剖矮牵牛.遗传学。2004;168(3):1585 - 99。
- 6.
SO neil, Gould KS。叶子中的花青素:光衰减剂还是抗氧化剂?植物生物学杂志。2003;30(8):865-73。
- 7。
古尔卡斯。大自然的瑞士军刀:花青素在叶子中的不同保护作用。j生物医学生物技术。2004; 2004(5):314-20。
- 8。
Albert NW,Lewis DH,张H,欧文LJ,Jameson Pe,Davies Km。光诱导营养花青素色素沉着矮牵牛.J Exp Bot。2009; 60(7):2191-202。
- 9。
奥尔森KM、斯利姆斯塔德R、利厄乌斯、布雷德C、洛夫达尔T、鲁奥夫P、维赫尔M、利洛C。温度和氮对类黄酮途径调节因子和产物的影响:实验和动力学模型研究。植物细胞环境。2009;32(3):286–99.
- 10.
Zhang Y, Butelli E, De Stefano R, Schoonbeek HJ, Magusin A, Pagliarani C, Wellner N, Hill L, Orzaez D, Granell A等。花青素通过延缓过度成熟和降低对灰霉病的敏感性,使番茄的保质期延长了一倍。咕咕叫医学杂志。2013;23(12):1094 - 100。
- 11.
曹旭,邱智,王旭,范江涛,刘欣,王杰,王旭,高军,郭勇,杜勇,等。一个假定的r3 myb.阻遏因子是潜在的候选基因atroviolacium,是番茄果实中花青素色素沉着的位点。实验机器人。2017;68(21-22):5745-58。
- 12.
王ls,stoner gd。花青素及其在癌症预防中的作用。癌症吧。2008; 269(2):281-90。
- 13.
关键词:植物,花青素,生物合成,生物工程植物生物学杂志。2014;19:81-90。
- 14.
津田T、荷利欧F、内田K、青木H、大泽T。富含3-O-β-D-葡萄糖苷的紫玉米色素可预防肥胖并改善小鼠的高血糖。营养学杂志。2003;133(7):2125–30.
- 15.
Rasmussen SE,Frederiksen H,Krogholm Ks,Poulsen L.膳食原花青素:发生,膳食摄入,生物利用度和防抗心血管疾病的保护。Mol Nutr Food Res。2005; 49(2):159-74。
- 16.
Butelli E, Titta L, Giorgio M, Mock HP, Matros A, Peterek S, Schijlen EGWM, Hall RD, Bovy AG, Luo J,等。通过选择转录因子的表达富集番茄果实中促进健康的花青素。生物科技Nat》。2008;26(11):1301 - 8。
- 17.
Koes R,Verweij W,Quattrocchio F.FlavOnoids:一种彩色模型,用于生化途径的调节和演变。趋势植物SCI。2005; 10(5):236-42。
- 18。
Ramsay NA, Glover BJ。MYB-bHLH-WD40蛋白复合物与细胞多样性的进化植物学报,2005;10(2):63-70。
- 19。
冈萨雷斯A,赵M,利维特JM,劳埃德AM。TTG1/bHLH/Myb转录复合物对花青素生物合成途径的调控拟南芥幼苗。工厂J. 2008; 53(5):814-27。
- 20.
Holton Ta,康沃欧欧盟。花青素生物合成的遗传学和生物化学。植物细胞。1995; 7(7):1071-83。
- 21.
Springob K、Nakajima J、Yamazaki M、Saito K。花青素生物合成与积累研究进展。《国家生产报告》,2003年;20(3):288–303.
- 22。
关键词:血桃,NAC转录因子,花青素,生物合成,分子遗传学植物j . 2015; 82(1): 105 - 21所示。
- 23。
Espley RV,Hellens RP,Putterill J,Stevenson DE,Kutty Amma S,Allan AC.苹果果实的红色是由于MYB转录因子MdMYB10的活性引起的。植物J。2007;49(3):414–27.
- 24。
Li C,Wu J,Hu KD,Wei SW,Sun Hy,Hu Ly,Han Z,Yao Gf,张H. pywrky26和Pybhlh3 Cotargeted Pybyb114启动子调节红皮梨的花青素生物合成和运输。Hortic Res。2020; 7:37。
- 25。
Walker Ar,Lee E,Bogs J,McDavid Daj,Thomas Mr,Robinson SP。白葡萄通过两个类似和相邻的调控基因的突变产生。工厂J. 2007; 49(5):772-85。
- 26。
Butelli E,Licciardello C,张Y,Liu J,Mackay S,Bailey P,Reforgiato-Recupero G,Martin C. Retrotransposons控制血液橙子中花青素的果实特异性,冷依赖性积累。植物细胞。2012; 24(3):1242-55。
- 27。
关键词:分子动力学,分子结构,分子结构,分子分析花青素2喇叭花基因及其在花色演变中的作用。植物细胞。1999; 11(8):1433-44。
- 28.
Sweeney Mt,Thomson MJ,Pfeil,McCouch S.抓住了红牌:rc.编码水稻中的基本螺旋环螺旋蛋白调节红色果皮。植物细胞。2006; 18(2):283-94。
- 29.
Su W,Tao R,Liu W,Yu C,Yue Z,He S,Laplle D,张W,张L,A G,等。莴苣中红叶颜色的四种多态性基因的特征在驯化后发生破坏性选择。植物Biotechnol J. 2020; 18(2):479-90。
- 30.
张燕,陈刚,董涛,潘燕,赵智,田胜,胡哲(Brassica Rapa.var。中国人).JAgric Food Chem。2014; 62(51):12366-76。
- 31.
燕c,一个g,zhu t,张w,张l,彭l,陈俊,匡h.独立激活的BoMYB2紫色性状基因Brassica oleracea..Al Appl Genet。2019; 132(4):895-906。
- 32.
Chiu LW,周X,Burke S,Wu X,先前RL,Li L.紫色花椰菜由MyB转录因子的激活产生。植物理性。2010; 154(3):1470-80。
- 33.
李鹏,陈湾,张克,陈立,董Q,温九,迈索尔ks,赵j。花青素和原霉素生物合成的调节Medicago Truncatula.bHLH转录因子MtTT8。新植醇。2016;210(3):905 - 21所示。
- 34.
Amato A, Cavallini E, Zenoni S, Finezzo L, Begheldo M, Ruperti B, Tornielli GB。一个类似于ttg2的葡萄WRKY转录因子参与了液泡运输和类黄酮生物合成的调节。植物科学,2017;
- 35.
彭XX,胡yj,唐XK,周庞,邓XB,王鹤,郭ZJ。稻米的组成型表达WRKY30型基因增加内源性茉莉酸积累,PR.基因表达与水稻真菌病原体的抗性。Planta。2012; 236(5):1485-98。
- 36.
Saitoh K,Onishi K,Mikami I,Thidar K,Sano Y.等位基因多样化C(OsC1)野生和栽培水稻的位点:与表型相关的核苷酸变化。遗传学。2004;168(2):997 - 1007。
- 37.
Jung S,Venkatesh J,Kang My,Kwon JK,Kang BC。非LTR回收转移通过调节MYB转录因子来激活花青素生物合成Capsicum Annuum..植物科学。2019;287:110181。
- 38.
Radicella JP, Brown D, Tolar LA, Chandler VL。玉米的等位基因多样性B.调控基因:不同的前导子和启动子序列两种B.等位基因决定了花青素生产的不同组织特异性。基因开发。1992年; 6(11):2152-64。
- 39.
李啊,熊,郭h,周c,谢y,zhao,顾j,zhao,丁y,刘L.鉴定葡萄酒化基因VRN-B1QTL映射负责使用小麦的RIL群体的QTL映射的日期变化。BMC植物BIOL。2020; 20(1):331。
- 40
李R,侯Z,高L,肖D,侯X,张C,严J,宋L。结合BSA-Seq和BSR-Seq分析大白菜叶头形成的分子途径。工厂(巴塞尔)。2019;8(12):603.
- 41
西瓜硬度的连锁定位与转录组比较分析(英文)Citrullus lanatus).植物科学与技术,2000,11:831。
- 42.
高J,Dai G,Zhou W,梁H,Huang J,清D,Chen W,Wu H,Yang X,Li D等。映射和鉴定候选基因Plr4型,通过使用下一代测序使用致稀土的分离和转录组分析,通过使用致碎的分离和转录组分析来调节紫色叶的隐性基因。int j mol sci。2019; 20(18):4335。
- 43.
赵Z,盛X,俞h,王继,沉义,顾人鉴定抑制抑制凝乳水稻在花椰菜中的候选基因。int j mol sci。2020; 21(6):1999。
- 44.
唐qw,tian my,一个gh,张wy,陈俊,燕ch。快速鉴定紫茎(PS.)基因(Brassica oleracea.var。alboglabra)通过膨胀的偏析分析和RNA测序进行分离畸变群。mol品种。2017; 37(12):153。
- 45.
Shin J, Park E, Choi G. PIF3以hy5依赖的方式调控花青素生物合成,这两种因子直接结合花青素生物合成基因启动子拟南芥.工厂J. 2007; 49(6):981-94。
- 46。
Liu S, Yeh CT, Tang HM, Nettleton D . Schnable PS. genetic mapping by block segregant RNA-Seq (BSR-Seq)《公共科学图书馆•综合》。2012;7 (5):e36406。
- 47。
杨杰,刘丹,王旭,纪超,程飞,刘波,胡忠,陈森,Pental D,居勇,等。异源多倍体基因组序列芥菜差异同源基因表达对选择的影响分析。Nat麝猫。2016;48(10):1225 - 32。
- 48。
人类基因组短DNA序列的超快速和高效记忆对齐。基因组医学杂志。2009;10 (3):R25。
- 49。
李H,手机B,Wysoker A,Fennell T,Ruan J,Homer N,Marth G,Abecasis G,Durbin R.基因组项目数据处理S:序列对齐/地图格式和SAMTools。生物信息学。2009年; 25(16):2078-9。
- 50
Takagi H,Abe A,Yoshida K,Kosugi S,Natsume S,Mitsuoka C,Uemura A,Utsushi H,Tamiru M,Takuno S等人。QTL-SEQ:通过两种膨胀种群的DNA全基因组在水稻中的定量特征基因座的快速映射。工厂J. 2013; 74(1):174-83。
- 51
乌德瓦尔迪MK,捷克斯洛伐克T,舍比勒WR。定量RT-PCR的十一条黄金法则。植物细胞。2008;20(7):1736–7.
- 52
弯曲的AF.花浸出_一种简化的方法农杆菌介断的转换拟南芥.植物j . 1998; 16(6): 735 - 43。
- 53.
吕S,张Y,郑X,朱K,许Q,邓X。柑橘番茄红素β环化酶基因启动子的分离及功能鉴定。前植物科学。2016;7:1367.
- 54.
基于更大数据集的分子进化遗传学分析7.0版。中国生物医学工程学报。2016;33(7):1870-4。
- 55.
Sicilia A, Scialo E, Puglisi I, Lo Piero AR.甜橙果实花青素生物合成和DNA甲基化动态[柑橘sinensis.L.(Osbeck)]在冷凝压下。JAgric Food Chem。2020; 68(26):7024-31。
致谢
我们感谢长春余(华中农业大学)为传染媒介PRI101-GFP和PCAMBIA1301-GUS,Weiyi Zhang博士(华中农业大学)为生物信息学的技术支持,汉语匡(华中农业大学)为植物材料支持有助于对这项工作的建议。
资金
本工作得到了中国国家重点研究和发展方案的补助金[2018YFD1000800],以及中央大学的基本研究资金[2662018点]。所有资助者都没有参与研究的设计,数据分析和写作稿件。
作者信息
从属关系
贡献
J.C.设计了该项目。G.A.进行实验。G.A.用J.C的帮助写了稿件。作者读并批准了最终手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
出版许可
不适用。
利益争夺
作者声明没有利益冲突。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充资料
附加文件1:图S1。
基于地图的克隆MPL在F基因2pl102 × gre101种群。
附加文件2:图S2。
蛋白质序列的排列BjMYB113及其最相似的R2R3-MYB转录因子同源基因。
附加文件3:图S3。
相对表达BjMYB113紫色品种pl102和3个绿色品种。
附加文件4:图S4。
3 '区甲基化状态分析bjmyb113a.和bjmyb113c..
附加文件5:表S1。
不同类型的花青素及其在紫色和绿色品种中的浓度,具有三种生物复制。
附加文件6:表S2。
两个紫色/绿色隔离群体的卡方(χ2)。
附加文件7:表S3。
本研究中使用的引物。
附加文件8:方法S1。
花青素代谢产物分析。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
陈建平,陈建平。一种常发生的功能增益和功能损失突变BjMYB113叶片颜色变异的基因芥菜.BMC植物杂志21,301 (2021). https://doi.org/10.1186/s12870-021-03084-5
收到了:
公认:
出版:
关键词
- 叶子的颜色
- MYB转录因子
- BSR-SEQ.
- 图谱克隆
- 芥菜