摘要
背景
MYB转录因子是一种能够与启动子区域特异相互作用的DNA结合蛋白。的成员MYB转录因子广泛参与植物的生长发育、次生代谢、胁迫反应和激素信号转导。然而,目前尚无对MYB家族进行全面生物信息学分析的报道木麻黄.
结果
在这项研究中,生物信息学方法用于筛选182MYB转录因子木麻黄其中,1R-MYB 69个,R2R3-MYB 107个,R1R2R3-MYB 4个,4R-MYB 2个。的C. EquisetifoliaR2R3-MYB基因按系统发育拓扑结构和分类分为29组MYB总科在拟南芥蒂利亚纳,剩下的时间MYB基因(1R-MYB、R1R2R3-MYB、4R-MYB)分为19组。此外,保守基序和基因结构分析表明,该菌的成员CeqMYB实验组被分为基因结构基本相似的亚组。此外,在蛋白质的R2和R3结构域中有许多保守的氨基酸CeqMYB特别是色氨酸残基(W),在R2重复中有3个保守W,在R3重复中有2个保守W。结合启动子和GO注释分析,推测其多种生物学功能CeqMYB年代,因此32MYB选择基因以通过使用QPCR分析技术进一步探索其对盐胁迫的响应。最多CeqMYB不同盐处理对基因的调控存在差异。
结论
七个基因(CeqMYB164,CEQMYB4,CeqMYB53,CeqMYB32,CEQMYB114,CEQMYB71和CeqMYB177通过GO注释分配给“盐压力响应”。其中,CEQMYB4的表达水平在各种盐处理下调节,表明CEQMYB4可能参与了对盐胁迫的反应。我们的研究结果为其生物学功能提供了重要的信息C. Equisetifolia,为盐胁迫机制的进一步研究提供候选基因。
背景
MYB(V-MYB AVIAN脲素母细胞素病毒癌症同源物)转录因子(TF)家族是植物中最大的转录因子之一,并且获得其名称,因为其结构具有保守的DNA结合区域,称为MYB结构域。n末端区域MYB转录因子结构域高度保守,并且域由1-4个序列和非还原缺陷序列重复(R1,R2,R3和R4)组成。每次重复包括约50个氨基酸,含有一系列高度保守的氨基酸残基和间隔序列,其中氨基酸残基以螺旋转动螺旋(Hth)的形式与DNA一起参与结合过程[1,2].MyB蛋白可以根据重复的数量分成不同的类别:1R-MYB(一个重复),R2R3-MYB(两次重复),R1R2R3-MYB(三个重复)和4R-MYB(四个重复)[3.,4].
作为监管蛋白质,MYBTFS在植物生长和发展中发挥着重要作用。1987年,PAZ-ARES等人。确定了第一植物MYB玉米基因,研究表明,它与花青素合成有关,并命名为它ZmMYBC1[5].从那以后,MYB基因已在许多物种中被鉴定和分离。其中,R2R3-MYB转录因子被证实广泛参与植物次生代谢的调控,在植物细胞分化和器官形成的调控中起着关键作用[4,6,7].过度表达MYB6转基因杨树花青素和原花青素的积累显著增加,但抑制了次生细胞壁的发育[8].Mu等人发现R2R3 TFAtMYB59能调节细胞周期和根的生长吗拟南芥蒂利亚纳[9]和JcMYB1 (R2R3-MYB)在非生物胁迫响应中发挥重要作用[10.].此外,MYB30型在防御反应中,对根系生长具有重要的调控作用LcMYB2干旱胁迫下促进种子萌发和根系生长[11.].发现3R型MYBMYBL2不仅抑制了毛状体的发育,而且抑制了类黄酮的生物合成[12.,13.]和3R类型MYBPhMYBx花青素合成下调[14.,15.].之前的研究已经发现,表情AtMYB2型在植物后期发育中上调,并参与整株衰老的调控[16.].
MYB家庭基因也广泛参与植物对激素和环境因素的反应,并在植物对压力的反应中发挥着重要的监管作用。例如,R2R2-MYB TFAtMYB41不仅影响细胞壁发育,而且对ABA、干旱和盐胁迫也有响应[17.].以前的研究表明AtMYB96增强了抵抗力答:芥以低温促表达CBF年代(18.),而AtMYB14公司和AtMYB15公司通过负向调控表达参与低温反应CBF年代(19.,20.].更重要的是,AtMYB60在答:芥已被证明与植物的耐旱胁迫有关[21].最近,ZmMYB3R和GmMYB118发现转基因植物能提高对干旱和盐胁迫的耐受性[22,23].此外,AtMYB2型,AtMYB44和AtMYB74增强了容忍度答:芥盐胁迫[24,25,26),而AtMYB73在植物盐胁迫性抵抗中发挥了负面作用[27]. 此外,TaMYB73,StMYB30和GhMYB73型据报道,在转基因植物中增强盐胁迫耐受性[28,29,30.].在转基因番茄植物中,SLMYB102通过调控Na来提高耐盐性+k+内稳态和活性氧平衡[31].虽然最重要的是MYB盐胁迫应答基因属于R2R3型,少数3R-MYB基因(包括OsMYB3R-2和TaMYB3R1)参与植物盐胁迫的调节[32,33].
木麻黄科是被子植物中较为特殊的一个科,与其他植物的亲缘关系较远[34].C. Equisetifolia广泛栽培在热带和亚热带地区,有许多用途。适用于干旱区沿海防风固沙、改良盐碱地和造林。它还可以固定氮,提供木材和薪材,应用于农用林业[35].此外,木麻黄是少数几种能在海岸海滩上茁壮成长的植物之一,因为它的耐盐性和树枝的灵活性可以抵御台风。木麻黄全序列的可用性[36]和生物信息学方法的结合提供了一个机会,进行全面的,全基因组分析c . equisetifolia MYB基因。
的MYB基因家族在单子叶植物和双子叶植物中已被广泛研究。然而,目前关于MYB蛋白的基础知识C. Equisetifolia仍然有限。在本研究中,共有182人MYB使用已知的鉴定基因MYB基因序列的答:芥基因组。并对其物理位置、系统发育关系、保守基序和外显子-内含子结构进行了分析。进一步分析了这些基因的选择压力、顺式作用元件和基因本体。最后,对表达水平进行选择CeqMYB通过使用RNA-SEQ数据和QRT-PCR研究了不同盐浓度和治疗时间下的根和芽的基因。基于当前数据,这是关于基因组基因家族鉴定的第一个报告C. Equisetifolia.因此,本研究提供了一个探索功能的起点MYB基因在C. Equisetifolia,为基因工程筛选候选基因提供了依据C. Equisetifolia繁殖。
结果
小鼠MYB基因的鉴定C. Equisetifolia
初步筛选出具有典型MYB或MYB样结构域的候选基因木麻黄基因组数据库根据隐马尔可夫模型(HMM)剖面的MYB域。总共182个MYB基因在C. Equisetifolia去除冗余重复序列后。基于基因标识符的顺序,CeqMYB基因被命名CEQMYB1来CeqMYB182.CeqMYB蛋白序列长度范围为104 ~ 1072个氨基酸,分子量为11.08 kDa (CeqMYB153)至117.93 kDa (CeqMYB158).理论等电点(pI)范围为4.06 ~ 10.65。其他一些参数,如支架位置,开放阅读框(ORF)长度和域的数量,在表S中有详细说明1.预测的亚细胞定位数据(表S2)的结果表明,大多数CeqMYB蛋白在细胞核中表达,也有部分在叶绿体(CeqMYB41、CeqMYB114和CeqMYB148)、线粒体(CeqMYB37)和细胞质(CeqMYB5和CeqMYB23)中表达。
系统发育树和类群分类CeqMYB基因
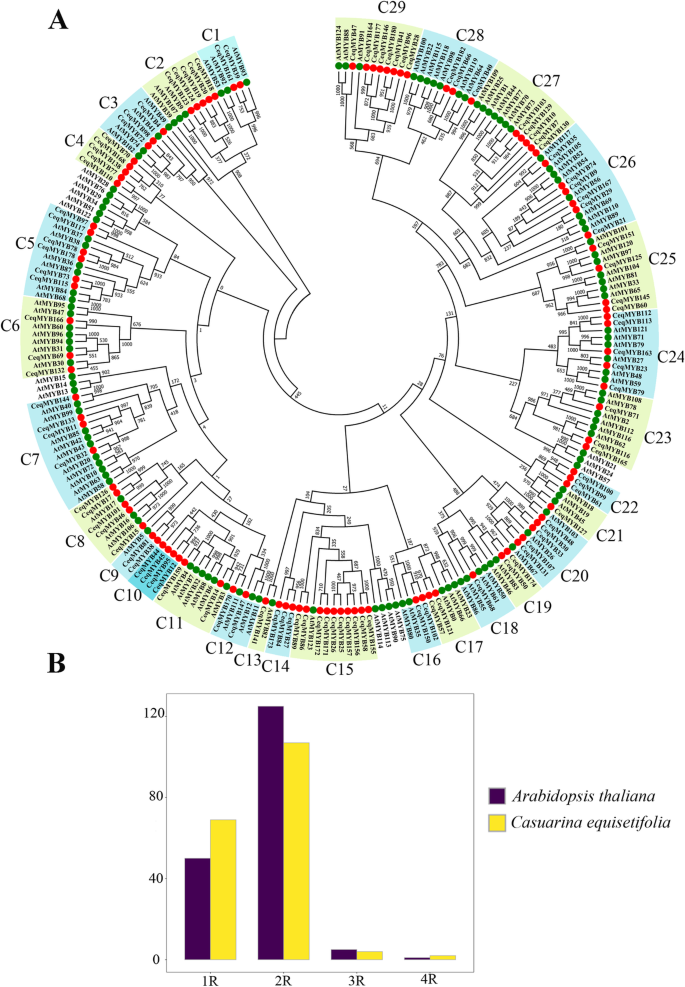
共鉴定出69个1R-MYB蛋白、107个R2R3-MYB蛋白、4个R1R2R3-MYB蛋白和2个4R-MYB蛋白C. Equisetifolia(表1). 在此基础上,利用MYB蛋白构建了两个系统发育树答:芥和C. Equisetifolia(无花果。1A和图。2). 数量分布MYB基因C. Equisetifolia是一致的吗答:芥(无花果。1b)。R2R3-MYB蛋白是最大的亚家族,而4R-MYB亚家族的数量是最小的。
R2R3-MYB基因的系统发育关系木麻黄和拟南芥。一个推测MYB蛋白在C. Equisetifolia基于系统发生树和myb答:芥.具体功能请参见表S3..通过NJ方法生成循环直接的树,具有1000个引导程序复制。BMYB基因的数量分布C. Equisetifolia和答:芥
第一个系统发育树(图。1A)含有125个R2R3-MYB基因答:芥107个R2R3-MYB基因C. Equisetifolia.然后,这107个R2R3-MYB基因C. Equisetifolia根据树的拓扑结构和MYB总科在答:芥(表3.).C13、C18和C21只有1个成员,是最小的群,而C15有10个成员,是最大的群。此外,C4、C10、C14和C22的成员没有聚集到任何组答:芥,表示发生了一些变化MYB不同物种在进化过程中的基因。我们研究中的大多数组(C1、C3、C5、C6等)都得到了前人研究的高bootstrap支持。例如,AtMYB93,AtMYB92, 和AtMYB53C1组调控根发育AtMYB49,AtMYB41,AtMYB74, 和AtMYB102公司C3组对逆境应激有反应。
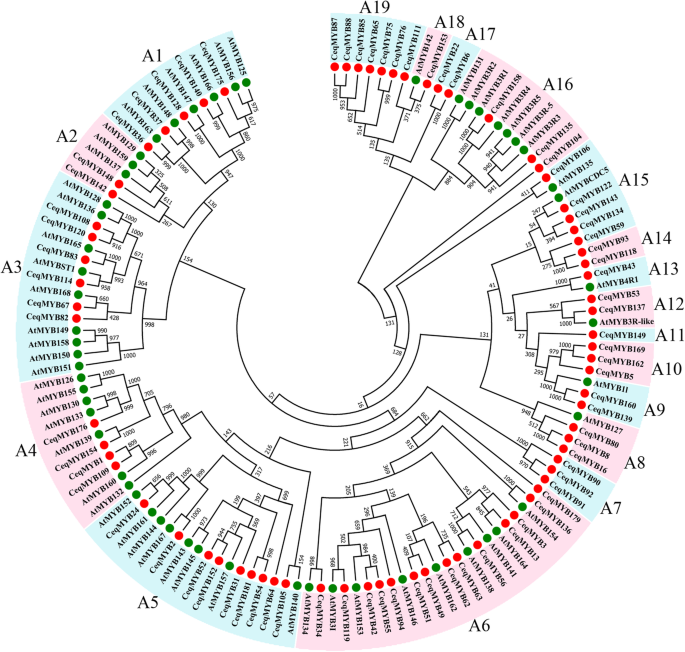
在第二种系统发育树中(图。2)共获得131个MYB蛋白(119个1R-MYB,9个3R-MYB和3个4R-MYB)C. Equisetifolia和答:芥提取,构建系统发育树。并根据树的拓扑结构进行分类答:芥,将131个MYB蛋白分为19组(A1 ~ A19)。如图所示。2,一个4R-MYB蛋白(CeqMYB43)聚集成4R-MYB蛋白答:芥,三个R1R2R3-MYB蛋白(CeqMYB104型,CeqMYB135型和CeqMYB158)被聚集成五个R1R2R3-MYB蛋白答:芥.
CeqMYB基因结构与蛋白质基序分析
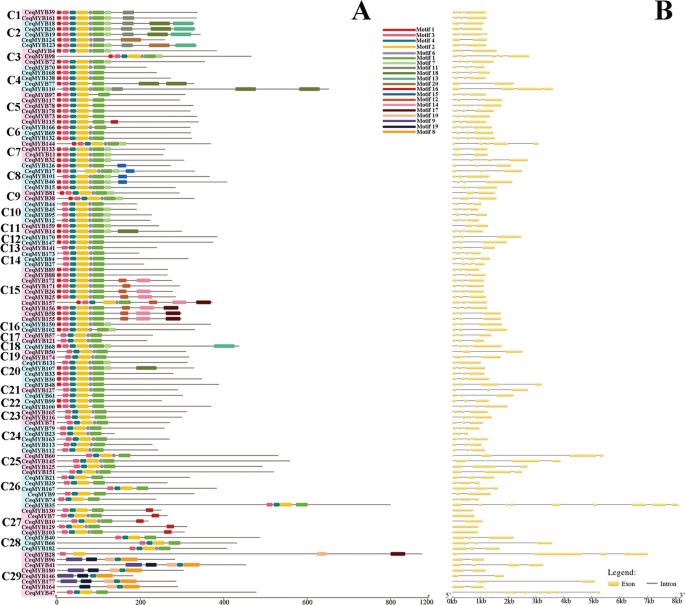
为了更全面地了解守恒域CeqMYB基因,进行基因诱导(MEME)分析。在R2R3-MYB等中发现了20个保守的主题CeqMYBs (1R-MYB, 3R-MYB和4R-MYB)蛋白C. Equisetifolia(无花果。3.一个;无花果。4A).如图所示。3.A和表S4,发现图案1,图案2,图案3,图案4,图案4,图案10,图案10和图案10编码MyB DNA绑定域,而另一个图案在R2R3-MYB的情况下没有函数注释C. Equisetifolia.在107个R2R3-MYB蛋白中,共有100个包含motif 3、motif 4、motif 2、motif 6和motif 1。CeqMYB28由图案3和图案2,图案10和图案17组成。CeqMYB96,CeqMYB41,CeqMYB180,CeqMYB146,CeqMYB177和CeqMYB164C29组中的聚集在R2R3-MYB蛋白中具有9,19,10,4和8的独特图案C. Equisetifolia.这一特征与前人对红枣(Ziziphus jujuba轧机)。R2R3-MYB蛋白(3.]. 另外,其他基因的保守基序CeqMYB预测基因(1R-MYB,3R-MYB和4R-MYB),不同的群体具有不同的主题,而MOTIF 1是常见的MYB基因在无花果。4A.具体地,图案1重复四次CeqMYB137型,但在A16组成员中重复两次。和图案5重复三次CeqMYB43. 第17、1、5和4个基序在实验中各重复两次CeqMYB87.也发现了类似的结果向日葵L[37]. 此外,the result of PFAM and SMART annotation were shown in Table S5其中,Motif 1、Motif 2、Motif 5、Motif 6、Motif 8编码MYB dna结合域,Motif 4编码MYB- cc型域,其他Motif无功能注释。
基因结构分析木麻黄.一个R2R3-MYB基因组用不同颜色的背景突出显示,所有的基序都通过MEME进行识别。不同颜色的盒子代表不同的主题和它们在每个MYB序列中的位置。有关图案的详细信息见表S4.B外显子和内含子分别用黄色矩形和黑色线条表示
保守基序的分布、基因结构及在CeqMYB基因(1R-MYB, 3R-MYB和4R-MYB)。一个数字1-20的图案用不同颜色的盒子表示。表S提供了母元序列信息5.B黄框和黑线分别表示外显子和内含子
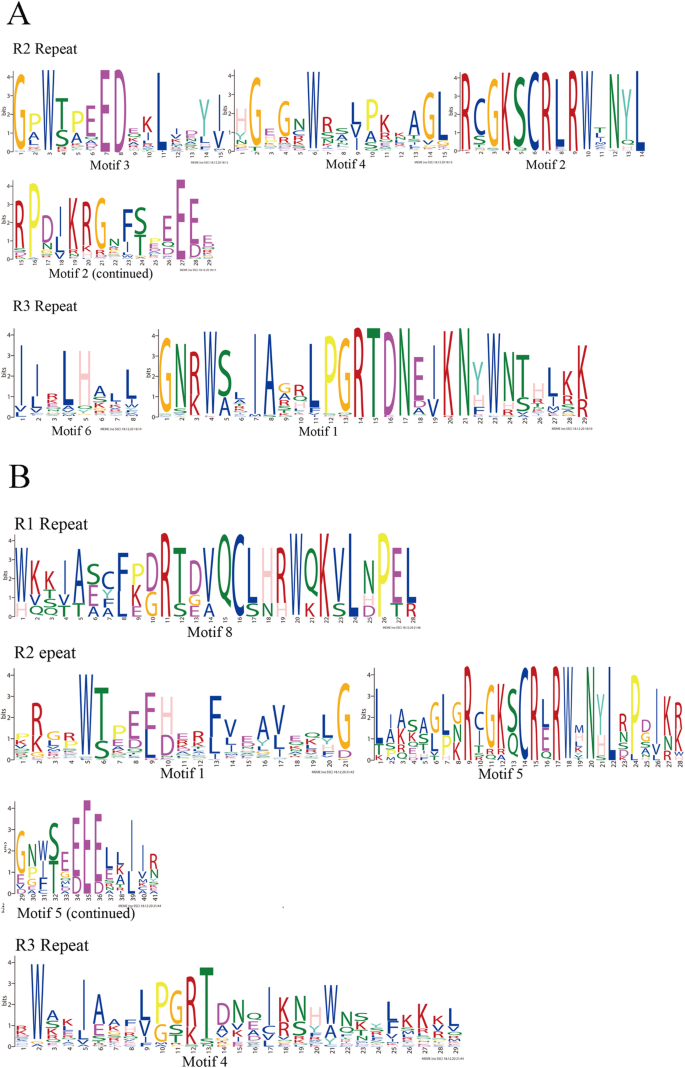
为了证明在特定位置的保护,WebLogo被用来进一步调查。结果(图。5)结果表明,在蛋白质的R2和R3结构域中存在许多保守的氨基酸CeqMYBs,特别是色氨酸残基(W),在R2重复中有3个保守W。在R3重复序列中,只有两个保守的W残基,第一个W通常被亮氨酸(L)或苯丙氨酸(F)所取代[38],在本研究中被L代替。
为了对结构多样性有更多的了解MYBTFs, R2R3-MYB的外显子/内含子组织等MYB(1R-MYB,3R-MYB和4R-MYB)C. Equisetifolia是分开了。如图所示。3.B, 107个R2R3-MYB基因包含不同数量的外显子,从1个到12个不等。我们发现大多数R2R3-MYB基因有2个(20/107)或3个(71/107)外显子,而有9个和12个外显子的R2R3-MYB基因各有一个。此外,结合系统发生树分类,发现有5个基因包含1个外显子,并且这5个基因聚集在同一组C27中。此外,还详细分析了其他的外显子/内含子结构CeqMYB基因(1R-MYB,3R-MYB和4R-MYB)如图2所示。4B. 1r - myb的外显子数范围为1 ~ 11,3r - myb的外显子数范围为8 ~ 11。更重要的是,两个4r - myb有9 (CeqMYB8710(CeqMYB43“外显子”分别。基于上述观察结果,发现了CeqMYB聚集在同一组的基因具有相同或相似数量的外显子。例如,CeqMYB属于C28(3个外显子)和A14(6个外显子)组的基因具有相同数量的外显子,而A7组有4到6个外显子。简言之,基因的外显子数目MYB基因C. Equisetifolia系统发育树越近,基因结构的相似性越大。
MYB假字和直接同源
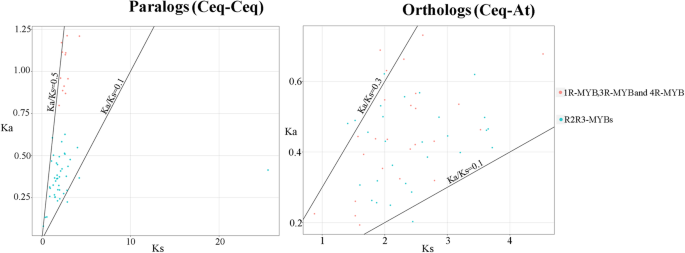
基于系统发育树的拓扑结构和BLASTN方法共鉴定出53个同源词和54个同源词。非同义替代(Ka)与同义替代(Ks)的比值可以反映生物进化过程中的选择压力。因此,探讨选择压力在其中的作用MYB获得基因家族演化,ks值,ka值和Ka / ks比例的谬论和旁级或正轨6和无花果。6).通常,Ka / ks小于1的比率表示纯化选择;Ka / ks的比例大于1平均阳性选择;Ka / ks等于1的比率表示中性选择。所有的KA / KS比例CeqMYB基因对小于1,其中大多数正向素的Ka / ks比为0.1-0.3,寄生杆菌的比例为0.1-0.5(图。6).结果表明,纯化选择可能在植物的进化过程中起了重要作用MYB基因在C. Equisetifolia.
分析的表达CeqMYB基因和GO注释分析
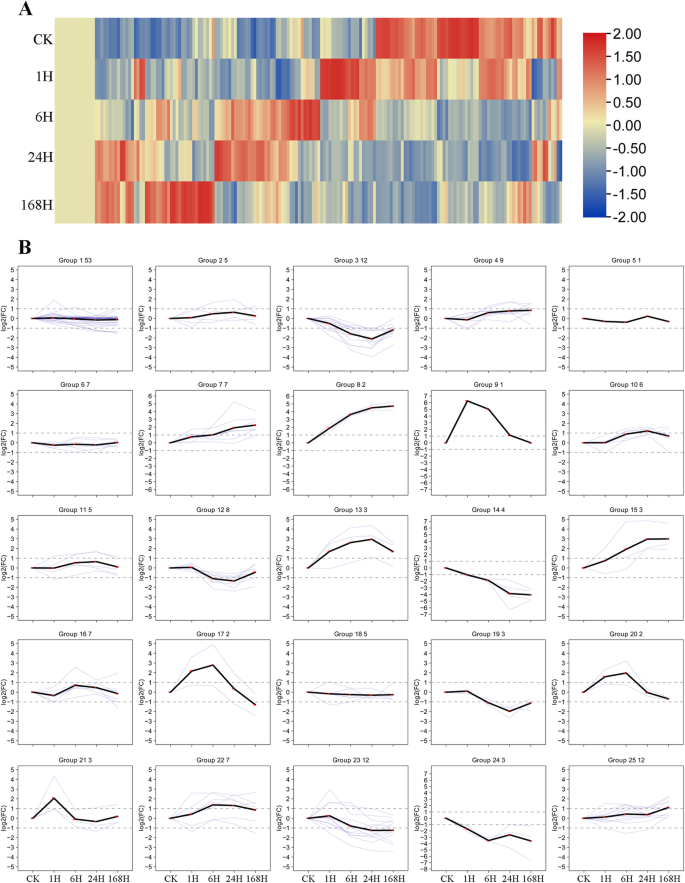
基于转录组数据,热图CeqMYB对200 mM NaCl处理不同时期的基因进行分析。7A) 是的。接下来是182年的热图数据MYB将基因聚类成25个表达模式进行趋势分析(图1)。7B;表的年代7).的CeqMYB200 mM NaCl处理后不同时期的基因响应,如CeqMYB122型和CEQMYB14在盐处理后24和168小时强烈调高,而表达水平CEQMYB10和CeqMYB112型盐处理1 h后表达上调,盐处理后各时间点表达下调。其中一些对白有相似的表达模式;例如,CeqMYB163型/− 113在6h时达到最大值,之后逐渐下降。然而,部分对白表现出不同的表达模式;例如,表达CEQMYB16在盐处理后持续上调,在168h达到最高水平,而其对应物,CeqMYB140,在盐压力期间在1小时内表达了高度表达。
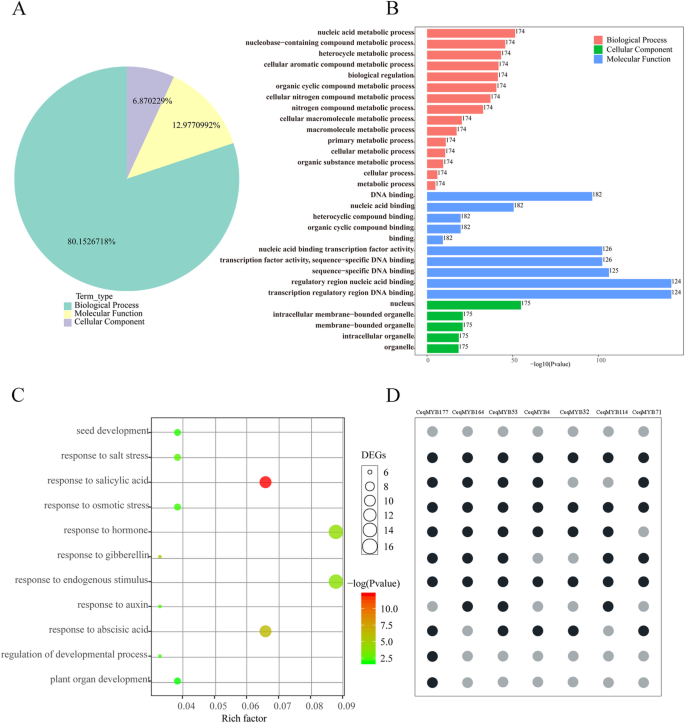
为了预测MYB蛋白的功能C. Equisetifolia,使用截断值的GO注释P≤0.05表示,盐处理共富集131个GO项目(表S8).如图所示。8A, 80%的时间被归为生物过程。其中,细胞核、细胞器、结合、生物调控、细胞过程和代谢过程占主导地位。8b)。细胞组分注释的分析表明,这些蛋白质主要位于核中,结果与亚细胞定位的预测一致。此外,发现一些CeqMYB与发育、激素和应激反应相关的基因。七个基因被分配到“盐胁迫反应”类别,其中CeqMYB164,CEQMYB4,CeqMYB53,CeqMYB32,CeqMYB114型和CeqMYB71也被分配到与激素反应相关的类别。特别是,CeqMYB177属于与发育、激素和应激反应相关的类别(图。8CD) 是的。
总之,结合盐处理后的表达模式,并进行注释分析,32CeqMYB选择基因进行进一步分析。
启动子分析
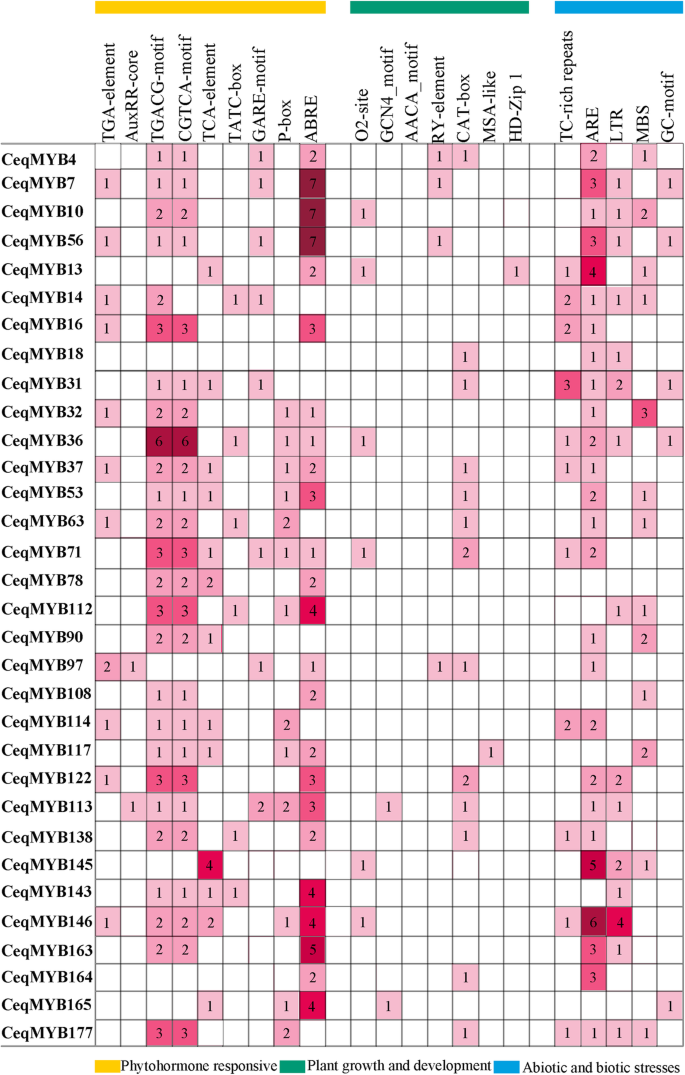
选择32个顺式元素分析CeqMYB基因如图2所示。9,参与Zein代谢调控的O2位点在4个启动子中发现CeqMYB基因。细胞周期调控因子(MSA-like)的表达CEQMYB13和CeqMYB117型促进剂分别。另外,在启动子中还鉴定了分生剂表达(猫盒),种子特异性调节(Ry-元素)和胚乳表达(GCN4_motif)CeqMYB基因。许多hormone-responsive元素被识别,auxin-responsive元素(TGA元素和AuxRR-core), SA-responsive元素(柠檬酸元素),MeJA-responsive元素(CGTCA图案和TGACG图案),gibberellin-responsive元素(TATC-box GARE-motif和P-box)和ABA-responsive元素(ABRE)被发现在12的推动者,14 25 20 23CeqMYB基因,分别。此外,在32个启动子区还发现了与胁迫相关的顺式元件MBS(干旱诱导响应元件)、LTR(低温响应元件)、ARE(厌氧诱导响应元件)、GC-motif(缺氧特异诱导元件)和TC-rich(防御和胁迫响应元件)CeqMYB基因。因此,CeqMYB基因可能在不同的非生物胁迫下受到转录调控。
的验证CeqMYB盐处理后的基因表达
根据盐处理后的表达模式和GO注释分析,筛选出32个表达CeqMYB在使用不同浓度的NaCl处理克隆A8幼苗以进行不同时间点后,通过QRT-PCR检测根和芽中的基因。此外,QRT-PCR的特定引物列于表S中9.
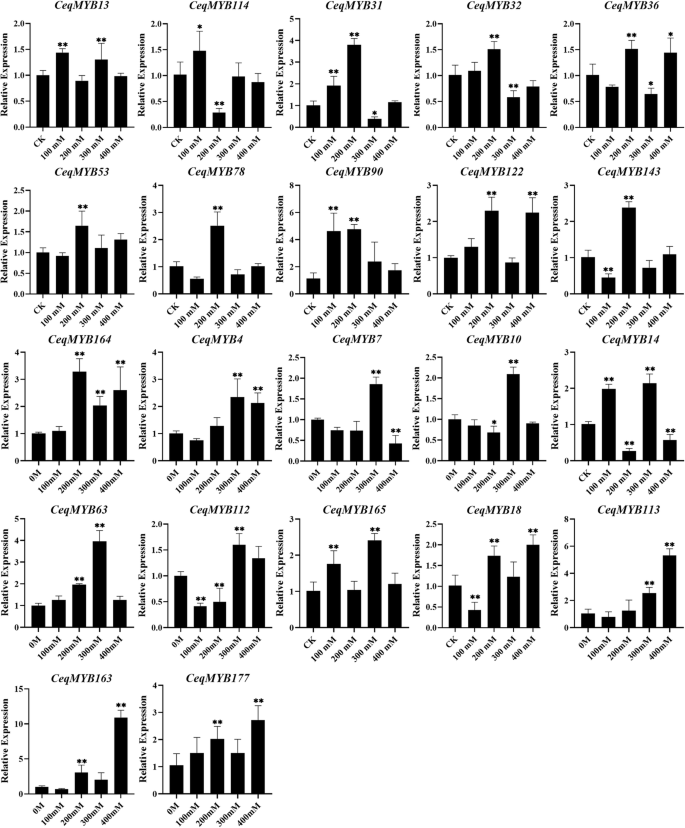
无花果。1显示90.6% (29/32)MYB在不同浓度的NaCl处理下,基因被诱导/抑制C. Equisetifolia的根源。例如,表达CEQMYB18,CeqMYB113型,CeqMYB163,CeqMYB177在400点达到峰值 嗯。此外,16个基因的表达在不同浓度下达到高峰(图。10.). 例如,CeqMYB31和CeqMYB90在低盐处理下,在200 mM处达到最大值,但随后下降。此外,CeqMYB90被显著上调超过4倍。另外,200 mM NaCl胁迫下根系的响应如图S2,选定的所有成员CeqMYBS可以产生相关的压力。九个基因(CEQMYB14,CEQMYB16,CeqMYB31,CeqMYB32,CeqMYB37,CeqMYB71,CeqMYB97,CeqMYB122型和CeqMYB165)在24h和168h时表达上调,而仅在24h和168h时表达上调CeqMYB164随着时间的推移被压抑。在副骨中获得了类似的结果(CEQMYB113 / - 163),高盐处理(400 mM)和根中1 h时表达量显著上调(图。10.和无花果。2).
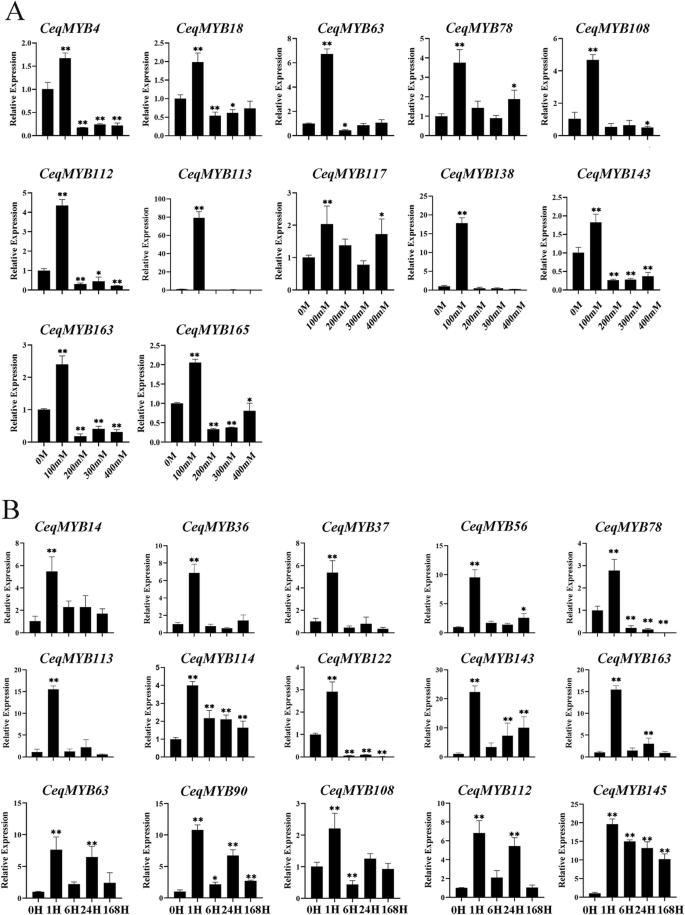
接下来,我们分析了CeqMYB不同浓度NaCl处理后不同时间的基因表达谱。32的CeqMYB基因,15以不同浓度上调,而16个基因被下调,与未处理的幼苗相比(图。3.).16个基因在低盐度(100 mM)时表达强烈上调,然后明显下调(图1)。11.一个)。CeqMYB113型(超过60倍),CeqMYB138型(超过15倍),CeqMYB108型(超过4倍),CeqMYB112型(超过4倍)和CeqMYB63(超过6倍)在100 mM NaCl处理下表达显著上调。进一步调查的反应CeqMYB使用脱盐胁迫的基因,使用不同的盐处理时间段。从这些,表达水平CeqMYB978个基因在24h达到诱导高峰,3个基因在不同时间点受到抑制(图S4).此外,无花果。11.B显示32个中的15个CeqMYB基因表达量在1 h达到峰值,表明这些基因可能参与了幼苗对渗透胁迫的即时/早期响应。CeqMYB113型和CeqMYB163这一趋势是典型的,其表达在以后的时间点保持相对不变,但在1 h强烈上调约15倍。简而言之,最CeqMYB这些基因在不同NaCl处理下的根和地上部均有表达上调,表明这些基因可能在盐胁迫响应中起重要作用。
讨论
MYB基因家族是植物中最大的转录因子之一。和MYB基因在植物的细胞周期、初级代谢、次级代谢、环境反应和胁迫反应等生理过程中发挥着重要作用[4,7,38,39]. 到目前为止,这是人类首次对基因家族进行系统研究C. Equisetifolia利用生物信息学工具和表达谱的基础上测序C. Equisetifolia基因组。
在本研究中,共182人CeqMYB基因被鉴定在C. Equisetifolia基因组,以及分布趋势CeqMYB成员与报告的类似答:芥(无花果。1B).系统发育关系MYB基因家族在C. Equisetifolia和答:芥研究过(图。1和2).系统发育树显示了一些MYB基因在C. Equisetifolia和答:芥形成了各自独立的类群,说明两个物种具有保守的进化过程。此外,并非所有CeqMYB基因控制ATMYB.基因。例如,C4组不包含任何ATMYB.,反映了物种适应特定环境的要求[40). .最密切相关的MYB基因可能有相似的功能。之前的研究已经报道过了AtMYB44通过阳性调节脱离酸(ABA)信号传导诱导气孔闭合来增强转基因大豆对干旱/盐胁迫的耐受性[41],和AtMYB73在植物耐盐性中起负作用[27].AtMYB44和AtMYB73都聚集在同一组,这意味着CeqMYB130/−7/−10/−129/−103C27组对盐胁迫有反应。
此外,保守的基因和基因结构为182CeqMYB基因分析(Figs。3.和4).其中保守基序的数量和分布以及外显子/内含子结构不同CeqMYB基因。其中,4CeqMYB基因只有一个图案,最大值有10个主题元素。同一组的图案分布MYB相对一致,大多数基序元素浓缩并定期分布在N末端,少量(例如基序18和r2R3-MYB中的图案17)在C末端不规则地分布,表明这一点CeqMYB进化关系密切的基因具有相似的功能。一些基序的出现频率较高,如基序4和基序2,反映了它们在细胞功能中的重要性CeqMYB蛋白质。此外,成员CeqMYB基因分为与大多数相似的基因结构相同的基团。结合以前的研究[42,43]同时还发现,大多数基因的外显子数目MYB基因不超过两个内含子。总的来说,序列中保守基序和外显子/内含子结构的数量、类型和分布的差异可能揭示了每个基因的不同功能。Ka/Ks可以反映生物进化过程中的选择压力。对所有已鉴定的同源对进行Ka/Ks分析,结果表明所有Ka/Ks比值均小于1(图。6),表明这一点MYB基因在进化过程中主要受纯化选择的影响(表S6).
许多MYB蛋白参与植物对不良生长环境的响应,其中一些与植物盐胁迫的调控密切相关。最近的研究报告称GhMYB108类基于定量表达分析,将在干旱和盐胁迫响应中发挥重要的调控作用[44和过度表达TaMYB344烟草对干旱、高温、盐胁迫的耐受性增强[45,而过度表达VcMYB4a蓝莓愈伤组织增强了对盐、干旱、寒冷、冰冻和热胁迫的敏感性[46].基于转录组数据,我们分析了182个基因的表达模式CeqMYB在不同时间点对200 mM NaCl处理的响应,并根据不同的表达模式将其分为25组(图。7).此外,分子功能注释分析显示7CeqMYB盐胁迫应答基因(图。8).我们从中挑选了32个MYB基因来进一步探索它们对盐胁迫的反应。启动子分析(图。9)显示,32个样本中有24个被选中CeqMYB基因涉及ABA响应的ABRE CIS-SCONSICATION元素。还在选定的11的启动子中鉴定了植物素响应元件(TGA元素和辅助核心)CeqMYB基因。研究表明,ABA信号通路在介导的耐盐性中发挥了重要作用。过度表达TaMYB33能提高小麦的抗旱性和耐盐性拟南芥蒂利亚纳通过aba介导的应激反应信号调节[47].此外,由多脂肪(OSMPS)编码的R2R3型MYB TF涉及植物激素和细胞壁合成,同时响应高盐度信号[48].这些结果表明MYBTFs通过介导植物激素的信号转导,提高植物的耐盐性。
而基因表达模式的阐明可以为基因功能的研究提供重要线索。表达水平为32MYB对玉米根和地上部的基因进行了检测C. Equisetifolia不同NaCl浓度和不同时间点的盐胁迫。不同浓度的NaCl处理后,根系中22个基因表达上调,地上部中15个基因表达上调(图S1; 图S3.).特别是表达水平CEQMYB16,CeqMYB37和CeqMYB56根的变化不明显,地上部则下调。以及CeqMYB71不同浓度下,根和地上部均有下调。此外,一些人的表达水平CeqMYB基因在盐胁迫下凝固,但在芽中下调。相似的结果是观察到的向日葵[37]表明部分MYB基因在根中特异表达。一些同源对在同一组织中表现出相似的表达模式。例如,CeqMYB7 /−10在300 mM NaCl处理下根系达到峰值,但在地上部不同浓度NaCl处理下下降到CK的一半以下。大多数具有相同数量外显子的基因具有相似的表达模式,如CeqMYB7/−10包含一个外显子,CeqMYB4/−16/−32包含3个外显子(图S3.).此外,qRT-PCR实验和RNA-Seq数据分析显示CeqMYB盐处理后不同时间点根系和地上部基因表达量均有上调(图S2; 图S4),与之前的研究一致,如周等人的报告,他发现MYB300 mM NaCl处理24h或/和48h诱导油棕榈基因[49]. qRT-PCR分析表明,盐胁迫下花生根系至少有8个基因表达[50].此外,诱导速度快AtMYB41对渗透和盐胁迫反应的表达[51],以及转基因植物过表达AtMYB74在种子萌发过程中表现出对NaCl的过敏[26].CEQMYB4,CeqMYB98,CeqMYB72,AtMYB41和AtMYB74在同一组中聚集在一起,这表明这三个CeqMYB基因反应盐胁迫。在这项研究中,CEQMYB4,这是一对同源的AtMYB74,在1和24 h时,表达量强烈上调约10倍。它再次证明了这一点CEQMYB4在盐压力中发挥了重要作用。同样,最重要的是CeqMYBNaCl处理后,基因表达在一定程度上上调,表明在盐胁迫反应中可能起着重要作用。
结论
在这项研究中,182MYB在基因组中鉴定基因C. Equisetifolia.采用全面的生物信息学分析来研究系统发育关系、保守基序、基因结构和启动子分析。GO注释分析CeqMYB基因在C. Equisetifolia显示,7CeqMYB基因被归类为“对盐胁迫的反应”一类。结合RNA-Seq数据的表达谱分析,32MYB选择基因进一步探索其对盐胁迫的响应。采用qRT-PCR方法检测32个基因在不同浓度NaCl处理幼苗不同时间点的根和茎中的表达谱。表达水平选择最多MYB不同处理下,茎和根的基因表达均上调。此外,表达水平CEQMYB4在各种盐处理下上调,表明CeqMYB4可能参与了对盐胁迫的反应。这些结果提供的信息可能有助于进一步的功能分析CeqMYB阐明盐胁迫的作用机制C. Equisetifolia.
材料和方法
序列检索和基因鉴定
木麻黄基因组数据从网上下载(http://forestry.fafu.edu.cn/db/Casuarinaceae/).MYB根据先前的研究方法鉴定基因[3.,52].嗯剖面MYBTFs(PF00249)从Pfam蛋白家族数据库下载(http://pfam.xfam.org/),然后将其用作查询(P< 0.001)用于所有推定的识别CeqMYB基因。最后,所有候选人MYBPFAM数据库手动筛选基因(http://pfam.janelia.org/)、NCBI保守域数据库(http://www.ncbi.nlm.nih.gov/structure/cdd/wpsb.cgi.)以及智能数据库(http://smart.embl-heidelberg.de/).答:芥基因组序列来自植物染色体数据库(http://www.phytozome.net/). 分析各组的氨基酸数目、开放阅读框(ORF)长度、分子量(MW)和等电点(pI)MYB使用ExPASy (http://www.expasy.ch/tools/pi_tool.html).此外,透过网上网站WoLP PSORT (https://wolfpeort.hgc.jp/),预测CeqMYB推断蛋白的亚细胞定位。
多序列比对和系统发育树构建
Myb推断出蛋白质C. Equisetifolia是与ATMYB.s使用ClustalX 2.11 [53,54带有默认参数的软件。基于序列比对,采用MEGA7软件进行邻域连接(neighbor-joining, NJ)系统发育分析。采用1000个重复的Bootstrap分析来计算NJ树的可靠性[55].
外显子-内含子结构和保守基序分析
为了映射MyB基因的外显子内分布的基因结构,在线基因结构显示服务器(http://gsds.cbi.pku.edu.ch用过)。为此目的,需要上传每个MYB基因的CD及其相应的基因组DNA序列。MEME在线计划(http://meme-suite.org/tools/meme)并对其保守基序进行了分析MYB超家族成员C. Equisetifolia.执行此分析的参数为:重复次数= any;最大图案数= 20;最佳基序长度= 6-200残基。对每一个假定的主题都进行了pam和SMART的注释。
同源对的Ka和Ks分析
根据研究方法[56],定义的伞病。该方法是通过工作爆炸进行的[57]对于每个物种的所有核苷酸序列。一对对齐超过300bp的匹配序列,并且身份超过80%被定义为副古曲克C. Equisetifolia.基因对间每个位点的同义(Ks)和非同义(Ka)置换用dnaps v5.0软件计算[58].
基因本体(GO)注释分析
基因本体(GO)分析进行了分析CeqMYBagriGO数据库中的基因(http://systemsbiology.cau.edu.cn/agriGOv2/index.php).所有23,397个基因C. Equisetifolia分别作为参考集和CeqMYB取两个样本的基因作为测试集。研究结果分为分子功能、生物过程和细胞组分三类。
表达剖析CeqMYB基因
表达谱数据从NCBI数据库(项目登录号SRP064226)的Short Read Archive下载,用于表达分析C. Equisetifolia不同盐处理时期的根系。使用Htseq-count计算每个转录本的原始读取计数,然后将其标准化为每百万转录本(TPM)。热图通过TBTOOLS软件生成并可视化[59],显示的颜色刻度表示TPM计数,比率进行log2转换。R软件(https://www.r-project.org)进行聚类分析。
假定启动子顺式作用元件分析
进一步研究药物的调节机制CeqMYB通过PlantCARE项目鉴定了许多与植物生长发育、激素响应以及非生物和生物胁迫响应相关的顺式作用元件。上游1500 bp区域的平移起始点CeqMYB基因是从木麻黄科数据库。PlantCARE程序用于筛选假定的顺式元素。综述了植物生长发育、激素反应、非生物和生物胁迫反应的相关因素。
植物材料和盐处理
的C. EquisetifoliaA8克隆系由中国林业科学研究院热带林业研究所保存栽培,于20世纪80年代由湛江林业科学研究院选育,现已商业化,样品采集和使用无需任何许可。将A8无性系的生根扦插在生长室内培养3个月作为实验材料。在200 mM NaCl处理后0、1、6、24和168 h分别收获根和地上部。将不同浓度(0、100、200、300和400 mM NaCl)溶液分别灌注于蛭石和黑土培养基上。盐处理24 h后收获根和芽,立即在液氮中冷冻,转移至超低温冰箱中,在80℃保存,然后提取RNA。
RNA提取及qRT-PCR分析
使用Aidlab植物RNA试剂盒(Aidlab Biotech,北京,中国)按照规格从根中提取总RNA。RNA的完整性和浓度通过1%琼脂糖凝胶电泳和NanoDrop™One/OneC (ThermoFisher Scientific, USA)验证。第一条cDNA是由PrimerScript RT MasterMix (Takara,东京,日本)根据制造商的说明合成的。采用LightCycler480 II Real-Time PCR系统(瑞士制造),采用TB Green Premix Ex Taq II(中国大连TaKaRa生物技术有限公司),采样量为20 μL。每个反应混合物包含2.0 μl稀释的cDNA, 0.8 μl引物,10.0 μl TB Green Premix Ex Taq II, 6.4 μl RNase-free water。qPCR反应循环条件根据TB Green Premix Ex Taq II制造商说明书设置。每个样本重复进行三次生物实验。计算各基因的相对表达量为2-ΔCT[60]与未处理对照植株(设1)进行比较。特定的引物CeqMYB基因设计采用primerpremier5.0软件和pcr技术EF1α.被用作管家基因[61].GraphPad 8软件统计分析及绘图[62].
统计分析
用jmp8软件进行配对t检验,具有统计学意义。平均值和标准差(SDs)是从三个生物和三个技术重复中计算出来的,与对照组相比有显著差异**P < 0.01 and *P< 0.05。
数据和材料的可用性
Illumina原始序列数据保存在NCBI数据库的Short Read Archive(项目注册号SRP064226)中。支持本文结果的数据集包含在文章和附加文件中。
参考文献
- 1。
Lipsick J. Myb的十亿年前。致癌基因。1996;13(2):223 - 35。
- 2.
拟南芥(Arabidopsis thaliana) R2R3-MYB基因家族。植物生物学杂志。2001;4(5):447-56。https://doi.org/10.1016/s1369-5266(00)00199-0.
- 3.
清J,Dawei W,Jun Z,Yulan X,Bingqi S,风扇Z.MYB超家族基因在中国枣发育阶段的基因组型谱和表达分析。Peer J. 2019; 7:E6353。https://doi.org/10.7717/peerj.6353.
- 4.
Dubos C、Stracke R、Grotewold E、Weisshaar B、Martin C、Lepiniec L。拟南芥中的MYB转录因子。植物科学趋势。2010;15(10):573–81.https://doi.org/10.1016/j.tplants.2010.06.005.
- 5.
Paz-Ares J, Ghosal D, Wienand U, Peterson PA, Saedler H. zea mays调控c1位点编码的蛋白与MYB原癌基因产物具有同源性,与转录激活因子具有结构相似性。EMBO j . 1987; 6(12): 3553 - 8。https://doi.org/10.1002/j.1460-2075.1987.tb02684.x.
- 6.
Legay S,Sivadon P,Blervacq A-S,Pavy N,Baghdady A,Tremblay L等。EGMYB1,来自桉树的R2R3 MYB转录因子负调节拟南芥和杨树中的二次细胞壁形成。新植物。2010; 188(3):774-86。https://doi.org/10.1111/j.1469-8137.2010.03432.x.
- 7.
Kranz H, Scholz K, Weisshaar B. C-MYB癌基因类基因编码三个MYB重复序列出现在所有主要的植物谱系中。植物j . 2000; 21(2): 231 - 5。https://doi.org/10.1046/j.1365-313x.2000.00666.x.
- 8.
王丽、陆薇、冉丽、窦丽、姚S。R2R3-MYB转录因子MYB6促进毛白杨花青素和原花青素的生物合成,但抑制次生细胞壁的形成。植物J细胞分子生物学。2019;99(4):733–51.https://doi.org/10.1111/tpj.14364.
- 9.
牟瑞玲,曹烨,刘云飞,雷刚,邹海峰,廖勇,等。拟南芥中一个r2r3型转录因子基因AtMYB59调控根生长和细胞周期进程。细胞研究》2009;19(11):1291 - 304。https://doi.org/10.1038/cr.2009.83.
- 10。
李H-L,Guo D,Peng S-Q。JCMYB1的分子和功能表征,编码了在麻州CURCAS中的推定的R2R3-MYB转录因子。植物生长调节。2015; 75(1):45-53。https://doi.org/10.1007/s10725-014-9930-z.
- 11.
赵鹏,侯松,郭鑫,贾静,杨伟,刘志,等。来自羊草的myb相关转录因子LcMYB2,在干旱胁迫下促进种子萌发和根系生长。中国生物医学工程学报,2019;https://doi.org/10.1186/s12870-019-2159-2.
- 12.
MYBL2是拟南芥类黄酮生物合成的一个新调节因子。植物J。2008;55(6):940–53.https://doi.org/10.1111/j.1365-313X.2008.03564.x.
- 13.
Kyoko M,Yoshimi U,Masaru OT。AtMYBL2是一种具有单一MYB结构域的蛋白质,是拟南芥花青素生物合成的负调控因子。植物J。2008;55(6):954–67.
- 14.
黄酮类化合物:调节和进化生物化学途径的一个丰富多彩的模型。植物科学学报,2005;https://doi.org/10.1016/j.tplants.2005.03.002.
- 15.
Chezem WR, Clay NK。myb和bHLHs对植物次生代谢和相关的特殊细胞发育的调控。植物化学。2016;131:26-43。https://doi.org/10.1016/j.phytochem.2016.08.006.
- 16.
郭毅,甘S。AtMYB2通过抑制细胞分裂素介导的拟南芥发育后期的分枝来调节整个植物的衰老。植物生理学。2011;156(3):1612–9.https://doi.org/10.1104/pp.111.177022.
- 17.
拟南芥AtMYB41基因的过度表达改变了细胞扩张和叶片表面通透性。植物j . 2008; 53(1): 53 - 64。https://doi.org/10.1111/j.1365-313X.2007.03310.x.
- 18.
MYB96-HHP模块整合冷和脱落酸信号通路激活拟南芥CBF-COR通路。工厂j . 2015, 82(6): 962 - 77。
- 19.
agarwal m,hao y,kapoor a,dong c-h,fujii h,zheng x等。R2R3型MYB转录因子参与CBF基因的冷调节,并获得凝固耐受性。J Biol Chem。2006; 281(49):37636-45。https://doi.org/10.1074/jbc.m605895200.
- 20.
陈Y,陈Z,康J,Kang D,古H,Qin G. AtmyB14调节拟南芥的耐寒性。植物mol biol报告。2013; 31(1):87-97。https://doi.org/10.1007/s11105-012-0481-z.
- 21.
Cominelli E, Galbiati M, vavasur A, Conti L, Sala T, Vuylsteke M,等。一个保卫细胞特异性MYB转录因子调节气孔运动和植物耐旱性。咕咕叫医学杂志2005;15(13):1196 - 200。https://doi.org/10.1016/j.cub.2005.05.048.
- 22.
杜勇,赵敏,王超,高原,王勇,刘勇,等。GmMYB118对干旱和盐胁迫响应的鉴定和表征生物医药中心。2018;18(1):320。
- 23。
关键词:玉米,MYB,转录因子ZmMYB3R,干旱,盐胁迫植物生理学学报,2019;https://doi.org/10.1016/j.plaphy.2019.02.010.
- 24。
Yoo JH,YoungPark C,Kim JC,Heo WD,Cheong MS,Park HC,等。不同CaM亚型与转录因子MYB2的直接相互作用增强拟南芥的耐盐性。生物化学杂志。2005;280(5):3697–706.https://doi.org/10.1074/jbc.m408237200.
- 25。
Jung C,SEO JS,Han SW,Koo YJ,Kim Ch,Song Si等。AtmyB44的过度表达增强了气孔闭合以在转基因拟南芥中赋予非生物应激耐受性。植物理性。2008; 146(2):623-35。https://doi.org/10.1104/pp.107.110981.
- 26。
徐R,王勇,郑H,吕W,吴C,黄J,等。拟南芥盐诱导转录因子MYB74受RNA介导的DNA甲基化途径调控。J实验机器人。2015;66(19):5997–6008.https://doi.org/10.1093/jxb/erv312..
- 27。
在拟南芥中,R2R3基因MYB, AtMyb73的缺失导致SOS1和SOS3基因在高盐胁迫下的高诱导。植物生理学杂志。2013;https://doi.org/10.1016/j.jplph.2013.05.011.
- 28。
小麦MYB转录因子TaMYB73基因的异位表达提高了拟南芥的耐盐性。实验机器人,2012;63(3):1511-22。https://doi.org/10.1093/jxb/err389.
- 29.
杨赵Y, Z,丁Y,刘L,汉族人X,詹J, et al。一个R2R3 MYB基因GhMYB73的过表达增加了转基因拟南芥对盐胁迫的耐受性。植物科学。2019;286:28-36。https://doi.org/10.1016/j.plantsci.2019.05.021.
- 30.
acta photonica sinica, 2011, 41(5): 759 - 768 .李旭,郭超,Ahmad S,王强,于军,刘超,等。马铃薯MYB家族基因及其在发育和胁迫响应中的多重作用的系统分析。生物分子。2019;9(8):317。https://doi.org/10.3390/biom9080317.
- 31。
张X,Chen L,Shi Q,Ren Z.SlmyB102,R2R3型MyB基因,赋予转基因番茄中的耐盐性。植物SCI。2020; 291:110356。https://doi.org/10.1016/j.plantsci.2019.110356.
- 32。
戴X,徐y,ma q,xu w,wang t,xue y等。R1R2R3 MyB基因,OSMYB3R-2的过度表达会增加转基因拟南芥中的冻结,干旱和盐胁迫的耐受性。植物理性。2007; 143(4):1739-51。https://doi.org/10.1104/pp.106.094532.
- 33。
Cai H,Tian S,Liu C,Dong H.鉴定小麦干旱,盐和冷应力的MYB3R基因(Triticum Aestivum L.)。基因。2011; 485(2):146-52。https://doi.org/10.1016/j.gene.2011.06.026.
- 34。
Beadle NCW。澳大利亚的植被。剑桥:剑桥大学出版社;1981年。
- 35。
Lui Y,Zhong C,Bai J,Zhang Y,Chen J.盐致电实验在组织培养中Casuarina秤的四个克隆。广东林业科技。2003; 19(2):47-50。
- 36。
YE G,张H,Chen B,Nie S,Liu H,Gao W等人。De Novo Genome组装的应力耐受性森林物种Casuarina Equisetifolia提供了对二次生长的洞察力。植物J. 2019; 97(4):779-94。https://doi.org/10.1111/tpj.14159.
- 37.
李家,刘H,杨C,王j,yan g,si p等。Helianthus Anuus L. Ind Crop Prod中不同生物和非生物胁迫下的MYB基因和表达分析的基因组鉴定。2020; 143:111924。https://doi.org/10.1016/j.indcrop.2019.111924.
- 38.
关键词:梨,MYB,转录因子,全基因组分类,表达谱植物科学与技术,2016;
- 39.
张建平,张建平,张建平,等。拟南芥R1R2R3-Myb蛋白通过激活KNOLLE转录正向调控胞质分裂。发展。2007;134(6):1101 - 10。https://doi.org/10.1242/dev.02801.
- 40.
Nozawa M、Kawahara Y、Nei M。人类感觉受体基因的基因组漂移和拷贝数变异。美国国家科学院学报。2007;18(51):20421–6.
- 41.
Seo JS, Sohn HB, Noh K, Jung C, An JH, Donovan CM,等。拟南芥AtMYB44基因的表达使转基因大豆具有耐干旱/盐胁迫的能力。摩尔品种。2012;29(3):601 - 8。https://doi.org/10.1007/S11032-011-9576-8.
- 42.
杨克,李伊,王某,徐x,孙h,zhao h等。MOSO竹子(Phyllostachys Edulis)中MYB转录因子的基因组型鉴定及表达分析。Peer J. 2019; 6:E6242。https://doi.org/10.7717/peerj.6242.
- 43.
刘C,Hao J,秋M,Pan J,HE Y.日本李子(Prunus Salicina)中MYB转录因子的基因组型鉴定及表达分析。基因组学。2020; 112(6):4875-86。https://doi.org/10.1016/j.ygeno.2020.08.018.
- 44.
乌拉(Ullah A)、卡马尔MTU、尼萨尔(Nisar M)、哈兹拉特(Hazrat A)、拉希姆(Rahim G)、汗阿(Khan AH)等棉花MYB新基因GhMYB108 - like对非生物胁迫的响应特性研究。Mol Biol Rep. 2020;47(3): 1573-81。https://doi.org/10.1007/s11033-020-05244-6.
- 45.
魏Q,陈岚,魏x,刘y,zhao s,yin x等。基因组鉴定R2R3-MYB系列小麦和非生物应激响应基因Tamyb344的功能特征。BMC基因组学。2020; 21(1):792。https://doi.org/10.1186/s12864-020-07175-9..
- 46.
张长勇,刘洪超,张学森,郭庆新,边善明,王建勇,等。VcMYB4a,来自Vaccinium corymbosum,负调节盐,干旱和温度胁迫。基因。2020; 757:144935。https://doi.org/10.1016/j.gene.2020.144935.
- 47。
关键词:小麦,MYB,转录因子,TaMYB33,拟南芥,耐盐性Mol Biol Rep. 2012;39(6): 7183-92。https://doi.org/10.1007/s11033-012-1550-y.
- 48。
Schmidt R, Schippers JHM, Mieulet D, Obata T, Fernie AR, Guiderdoni E等。MULTIPASS是一种水稻r2r3型MYB转录因子,通过整合多种激素途径调节适应性生长。植物j . 2013; 76(2): 258 - 73。https://doi.org/10.1111/tpj.12286.
- 49。
油棕MYB基因家族的全基因组鉴定与表达分析(英文)Elaeis guineensis在非生物胁迫条件下。环境实验机器人。2020;180:104245。https://doi.org/10.1016/j.envexpbot.2020.104245.
- 50
陈楠,杨Q,潘莉,池×,陈梅,胡德,等。花生(Arachis hypogaea L.)30个MYB转录因子基因的鉴定及其在非生物胁迫下的表达分析。基因。2014;533(1):332–45.https://doi.org/10.1016/j.gene.2013.08.092.
- 51。
Lippold F, Sanchez DH, Musialak M, Schlereth A, Scheible W-R, Hincha DK等。在拟南芥中,AtMyb41调控渗透胁迫的转录和代谢反应。植物杂志。2009;149(4):1761 - 72。https://doi.org/10.1104/pp.108.134874.
- 52。
赵鹏,王丹,王锐,孔宁,张超,杨超,等。马铃薯Hsp20基因家族的全基因组分析:鉴定,基因组组织和表达谱对热应激的响应。BMC基因组学。2018;19(1):61。https://doi.org/10.1186/s12864-018-4443-1.
- 53。
邻居连接法:一种重建系统发育树的新方法。Molbiolevol。1987;4(4):406 - 25所示。
- 54。
Thompson J, Gibson T, Plewniak F, Jeanmougin F, Higgins D. The Clustal_X windows interface: flexible strategies for multiple sequence alignment with quality analysis tool。核酸研究。1997;25(24):4876-82。https://doi.org/10.1093/nar/25.24.4876.
- 55。
Kumar S, Stecher G, Tamura K. MEGA7:针对更大数据集的分子进化遗传学分析7.0版。中国生物医学工程学报。2016;33(7):1870-4。https://doi.org/10.1093/molbev/msw054.
- 56。
布兰克G,沃尔夫KH。从重复基因的年龄分布推断模式植物广泛的古多倍体。植物细胞。2004;16(7):1667–78.https://doi.org/10.1105/tpc.021345.
- 57。
Altschul S,Madden T,Schäffer A,Zhang J,Zhang Z,Miller W,et al.Gapped BLAST(基本局部比对搜索工具)和PSI-BLAST:新一代蛋白质数据库搜索程序。核酸研究,1997年;25(17):3389–402.https://doi.org/10.1093/nar/25.17.3389.
- 58。
Librado P,Rozas J。DnaSP-v5:DNA多态性数据综合分析软件。生物信息学。2009;25(11):1451–2.https://doi.org/10.1093/bioinformatics/btp187.
- 59。
Chen C,陈H,Zhang Y,Thomas HR,夏R.TBTOOLS:为大生物数据的互动分析开发了一种综合工具包。莫尔植物。2020; 13(8):1194-202。https://doi.org/10.1016/j.molp.2020.06.009.
- 60
Schmittgen TD, Livak KJ。采用对比CT法对实时荧光定量PCR数据进行分析。Nat Protoc。2008;3(6):1101 - 8。https://doi.org/10.1038/nprot2008.73.
- 61
关键词:木麻黄,盐胁迫,实时荧光定量PCR,内参基因医学杂志。2017;61(3):463 - 72。https://doi.org/10.1007/s10535-016-0670-y.
- 62
Bryfczynski SP, Pargas RP。GraphPad:一个用于CS2/CS7的图形创建工具;2009.p。389。
致谢
不适用。
资金
国家公益性科研机构专项基金项目(No. CAFYBB2018ZB003);国家自然科学基金项目(No. 31770716)。关键词:岩石力学,数值模拟,数值模拟资助机构没有参与研究的设计、数据的收集、分析和解释,也没有参与手稿的撰写。
作者信息
从属关系
贡献
构思设计实验:YJW, CLZ, YZ。分析数据:YJW、JXM和ZL。写的论文:YJW。参与了本研究的设计和修改稿:YJW, CJF, YZ。作者阅读并批准了最终稿件。
通讯作者
道德声明
伦理批准并同意参与
不适用。
出版许可
不适用。
相互竞争的利益
作者声明没有财务或商业利益冲突。
额外的信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充资料
附加文件1:图S1
.相对表达量32个CeqMYB通过qRT-PCR分析不同浓度NaCl处理对根系的影响。y轴和x轴分别表示胁迫处理的相对表达量和盐浓度。从3个生物重复和3个技术重复中获得平均值和标准偏差(SDs)。误差条表示标准偏差。**P < 0.01 and *P< 0.05。
附加文件2:图S2
.相对表达量32个CeqMYB不同时间NaCl处理后的基因序列。热图显示了32个层次的聚类CeqMYB不同时间点的基因。色标表示Log10表达值,蓝色表示低表达,红色表示高表达水平(转录性丰度)。
附加文件3:图S3
.相对表达量32个CeqMYB通过qRT-PCR分析不同浓度NaCl处理下的不同基因。y轴和x轴分别表示胁迫处理的相对表达量和盐浓度。从3个生物重复和3个技术重复中获得平均值和标准偏差(SDs)。误差条表示标准偏差。**P < 0.01和*P < 0.05。
附加文件4:图S4
.相对表达量32个CeqMYB用qRT-PCR方法研究NaCl处理后不同时期地上部的基因。Y轴和X轴分别表示应激处理的相对表达水平和时间进程。平均值和标准差(SDs)是从三个生物和三个技术复制获得的。误差线表示标准偏差。
附加文件5:表S1
.鉴定的详情CeqMYB基因。表S2亚细胞定位的预测CeqMYB基因。表S3推测MYB蛋白在木麻黄.表S4的R2R3-MYB蛋白20个基序的详细信息木麻黄.表S51R-MYB,3R-MYB和4R-MYB蛋白的20个图案的详细信息木麻黄.表S6基因对的Ka/Ks比值木麻黄.表S7182个MYB基因家族的热图数据木麻黄.表S8我国MYB基因家族的基因本体研究木麻黄.表S9选择32株用于qRT-PCR分析的引物序列列表CeqMYB基因。
权利和权限
开放访问本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
王,y。,张,y。,风扇,c。等。基因组分析MYB转录因子及其对盐压力的反应木麻黄.BMC植物杂志21,328(2021)。https://doi.org/10.1186/s12870-021-03083-6
已收到:
接受:
出版:
关键词
- 木麻黄
- MYB转录因子
- 去注释分析
- 盐胁迫