抽象的
背景
植物激素脱落酸(ABA)参与了各种生物过程的调节。在拟南芥中,众所周知,SNRK2S是控制植物生长和应激反应之间平衡的ABA信号传导途径的中心部件,但ZMSNRK2在玉米中的功能很少。因此,研究ZMSNRK2.了解玉米中的ABA信号通路。
结果
在这项研究中,14ZMSNRK2.基因在最新版本的玉米基因组数据库中被鉴定。系统发育分析表明,ZmSnRK2s根据其C端结构域的多样性可分为三个亚类。外显子-内含子结构、系统发育、同源性和共线性分析表明,SnRK2s,特别是SnRK2的Ⅲ亚类,在玉米、水稻和拟南芥中具有进化上的保守性。亚细胞定位显示ZmSnRK2蛋白定位于细胞核和细胞质。RNA-Seq数据集和qRT-PCR分析表明ZMSNRK2.基因在不同玉米组织的生长和发育过程中表现出空间和时间表达模式,以及一些物质的转录水平ZMSNRK2.ABA和蔗糖处理显著诱导籽粒中的基因。另外,我们发现ZMSNRK2.10属于子类III的,在内核中高度表达并由ABA激活。过度表达ZMSNRK2.10部分解救了ABA不敏感表型SNRK2.2 / 2.3双倍和snrk2.2/2.3/2.6型三倍突变体并导致拟南芥延迟植物开花。
结论
这SNRK2.基因家族展现出高进化的守恒,并在植物中扩展了全基因组重复事件。这ZMSNRK2S.用全基因组和节段性重复扩展玉米,而不是串联复制。表达模式分析ZMSNRK2S.在玉米中提供了研究其功能的重要信息。研究功能ZmSnRK.10号在拟南芥中表明ABA依赖会员SNRK2S.在植物中进化地保守。我们的研究阐明了结构和演变SNRK2.为ZmSnRK2s蛋白在玉米中的功能研究提供了基础。
背景
植物激素脱落酸(ABA)广泛参与植物的生长发育、对生物和非生物胁迫的响应以及作物籽粒灌浆和种子成熟过程[1那2]. 这个core regulatory components of ABA signaling have been identified and studied well in Arabidopsis. ABA binds to the receptors pyrabactin resistance 1 (PYR1) and PYR1-like proteins (PYLs), which interact with and inhibit clade-A protein phosphatase type 2Cs (PP2Cs), leading to the release of SnRK2 (Sucrose non-fermenting protein kinase 2). The activated SnRK2s subsequently phosphorylate downstream target proteins such as ABA-responsive element-binding factors (ABFs) to mediate various ABA responses [3.那4.那5.那6.那7.].SNRK2S对于ABA信号至关重要,因为ABA介导的各种生理过程的调节归因于SNRK2S介导的不同下游靶标的磷酸化。
首先SNRK2.基因,命名PKABA1公司,被克隆和以小麦特征。PKABA1参与下游ABA响应性转录因子TAABF1的磷酸化[8.].到目前为止,已经在许多物种中鉴定并表征了SNRK2蛋白质,其中包括拟南芥(SNRK2.1至-21)中的10种成员[9.]和10(SAPK1至− 10) 米饭[10].SNRK2家族可以基于C末端结构域的氨基酸序列分为三个亚类(亚类I,II和III)[9.].对拟南芥和水稻SnRK2的激酶活性分析表明,SnRK2各亚类在ABA和渗透胁迫下具有不同的激活模式。第I类snrk2被渗透胁迫快速而强烈地激活,而独立于ABA的第II类和第III类snrk2被ABA和渗透胁迫同时激活。具体来说,II类snrk2被ABA弱激活,III类snrk2被ABA快速而强烈激活。因此,III类snrk2被广泛认为是ABA信号通路的关键调控因子[10那11那12那13那14].在拟南芥中,SnRK2s亚类由三个基因编码,SNRK2.2.那SNRK2.3.,SNRK2.6由ABA治疗迅速激活[11那15].snrk2.2/2.3/2.6型三重突变体表现出小的植物大小,并且在种子萌发和种子生长方面对ABA不敏感[16].尽管SNRK2.2.那SNRK2.3.,SNRK2.6在aba介导的植物生长和胁迫反应中起着重要作用,在某些方面也表现出不同的功能。SNRK2.6主要是ABA诱导的气孔闭合所必需的,因此SNRK2.6.单突变体导致拟南芥的严重水分叶[17那18].SNRK2.2.和SNRK2.3.特别参与调节种子萌发和幼苗生长。SNRK2.2 / 2.3双突变体可以在极高的ABA浓度存在下发芽[19].在水稻中,Subcrass III SNRK2S包括三种基因,萨普克8那SAPK9.,SAPK10这与拟南芥同源SNRK2.2.那SNRK2.3.,SNRK2.6分别。这三种SNRK2蛋白也由ABA激活[10那20].与野生型(WT)相比,转基因水稻生产过表达萨普克8那SAPK9.,或SAPK10显示萌发和幼苗生长延迟[21],暗示水稻中的亚类III SNRK2S也参与了种子萌发的调节。
玉米(Zea Mays.L.)不仅作为粮食和饲料作物,而且在食品和生物能源工业等许多领域广泛用作主要原料。在玉米中,ABA与VIVIPAROUS1 (VP1)转录因子在籽粒发育成熟中起着至关重要的作用[22那23]. 此外,ABA也是玉米胚乳发育过程中细胞程序性死亡调控的关键因子[24那25].在这里,我们进行了全基因组识别ZMSNRK2.玉米基因家族,以及基因结构,染色体位置,系统发育关系,同步和表达概况ZMSNRK2S.被调查了。而且,我们发现了ZMSNRK2.10玉米ABA激活了Ⅲ亚类基因。过表达ZMSNRK2.10能部分补充表型吗atsnrk2.2 / 2.3那Atsnrk2.2/2.3/2.6型突变体与拟南芥开花延迟.这项研究将增进我们对SNRK2.基因家族,并提供洞见的功能多样性SNRK2.玉米中的基因。
结果
全基因组鉴定与进化分析SNRK2.基因玉米
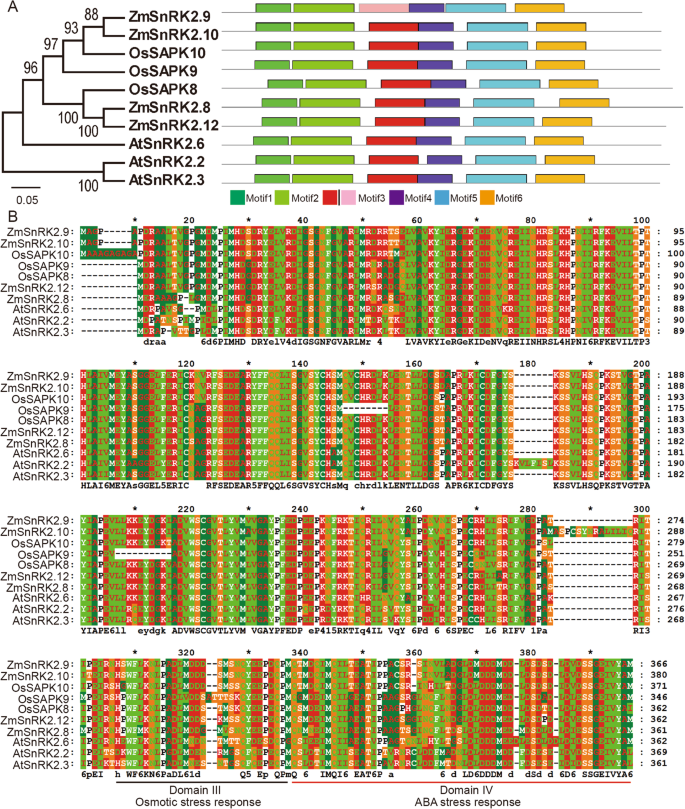
鉴定MaizeGDB数据库中可能的SnRK2同源物(https://maizegdb.org/),我们基于其蛋白质序列构建了SNRK2S的HMM(隐马尔可夫MADE)拟南芥和奥雅萨苜蓿,并使用它进行BLASTP分析。共14名候选人ZMSNRK2.确定基因并表征(附加文件1:表S1),其中10ZMSNRK2.基因已经被克隆和报道过[26,我们克隆了znsnrk2.9基因和剩下的三个新发现ZMSNRK2.基因是指定的ZMSNRK2.12.到ZMSNRK2.14. 为了表征玉米中已鉴定的SnRK2s的特性,利用ExPASy软件对ZmSnRK2s的蛋白质序列进行了分析(https://web.expasy.org/compute_pi/). 如表S1所示,ZmSnRK2s的蛋白质长度范围为333个氨基酸(ZmSnRK2.3)到366个氨基酸(ZmSnRK2.8和ZmSnRK2.12),分子量范围为37.84 kDa(ZmSnRK2.3)至42.84 kDa(ZmSnRK2.5)。ZmSnRK2蛋白呈酸性,预测pI值为4.57~6.73。
14个ZmSnRK2蛋白全长从Gramene (http://ensembl.grammene.org/)通过Clustalw1.83聚集,然后构建邻近(NJ)系统发育树(附加文件1:图。S1A)。比较分析表明ZMSNRK2S.分为三个亚类,其中ZMSNRK2.12.和ZmSnRK2.8那ZmSnRK2.9和ZMSNRK2.10被归类为Subclass III,而zmsnrk2.13和ZMSNRK2.14和ZmSnRK2.4那ZmSnRK2.5那ZmSnRK2.6那ZmSnRK2.7和ZMSNRK2.11.被聚集到子类I.基于之前的报告[26那27],ZmSnRK2.3和ZmSnRK2.1和ZmSnRK2.2被归类为子类II。通过MEME分析ZMSNRK2蛋白质中的保守基序(http://meme-suite.org/),鉴定了所有ZMSNRK2蛋白质含有六个大保守的主题(附加文件1:图。S1A)。在这些蛋白质中,亚类III蛋白中的保守基序的位置显示出高相似性,而其他10 ZMSNRK2S(亚类I和亚类II)表现出类似的基序分布模式。蛋白质序列对准表明ZMSNRK2S进化保存,并且ZMSNRK2蛋白的变化主要在C终端区域鉴定(附加文件1:图印地)。
研究已鉴定物种的进化特征ZMSNRK2.玉米中的基因在其他植物中,基于来自所有SNRK2蛋白的氨基酸序列来进行系统发育和保守的图案分析Zea Mays.那拟南芥和水稻。所有这些SNRK2被分为三个亚类,并包含六个大的保守基序(另一个文件)1:图S2A,图S2B)。值得注意的是ZmSnRK2.8/2.9/2.10/2.12与…同属一个分支SNRK2.2./2.3/2.6在拟南芥和萨普克8/9./10在水稻中表现出相似的保守基序分布模式(图。1一个)。SNRK2.2./2.3/2.6对拟南芥中的ABA信号途径作出至关重要的作用[28],这可能表明,响应于玉米中的ABA信号,这四个子类III的四个成员发挥着重要功能。另外两个新发现ZMSNRK2.基因(zmsnrk2.13和ZMSNRK2.14)聚集着AtSnRK2s在拟南芥中特别参与对渗透胁迫的反应[16,这表明这两种可能的作用ZMSNRK2S.玉米渗透胁迫的调控。亚类III与亚类I和亚类II的区别在于,天冬氨酸(简称D)富集在亚类III蛋白质的C端区域,而谷氨酸(简称E)富集在亚类I和II蛋白质的C端区域(图。1b和附加文件1:图。S2C)。
基因结构,染色体定位和联合症分析ZMSNRK2.基因Zea Mays.
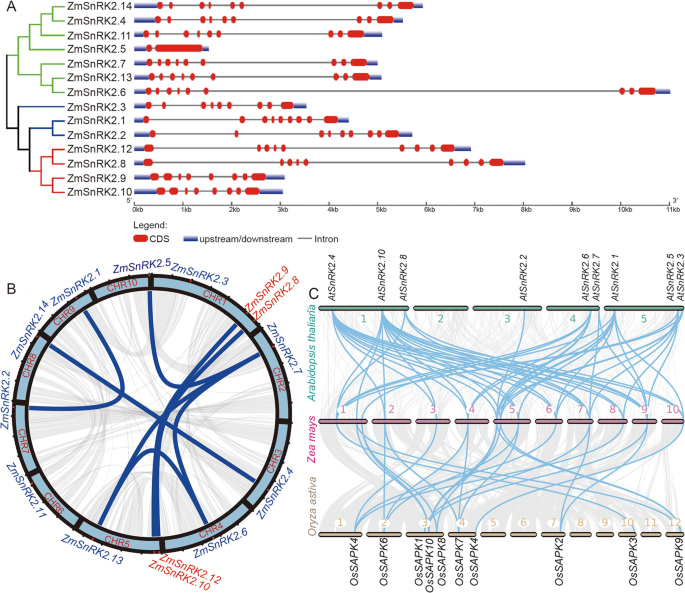
探索结构的多样性ZMSNRK2.成员,内含子-外显子组织各不相同ZMSNRK2.通过将CDNA序列与相应的基因组DNA序列进行比较来分析基因。如图2所示。2一个,大多数ZMSNRK2.基因包含9个外显子和8个内含子,而ZmSnRK2.5只包含一个内含子。与其他相比ZMSNRK2.基因,ZmSnRK2.6在其基因结构中含有一个长内含子。值得注意的是,三名成员(ZmSnRK2.1那ZmSnRK2.2和ZmSnRK2.3)在子类中聚集在基因结构中共享高相似性。四ZMSNRK2.会员(ZmSnRK2.8那ZmSnRK2.9那ZMSNRK2.10,ZMSNRK2.12.)聚集在亚类III中,ZmSnRK2.8和ZMSNRK2.12.在基因结构上有很高的相似性ZmSnRK2.9和ZMSNRK2.10.除此之外,ZMSNRK2.14,ZMSNRK2.11.和ZmSnRK2.4在基因结构上有很高的相似性zmsnrk2.13和zmsnrk2.7。
结合这些高度保守的基序信息,对其进行系统发育和基因结构分析ZMSNRK2S.,我们推测膨胀ZMSNRK2S.在玉米倾向于是串联或分段重复事件。首先,物理位置ZMSNRK2.基于基因组数据库分析染色体的基因。作为图。2B显示所有的标识ZMSNRK2.基因可以映射到1至10的玉米染色体,每3次染色体1和5。有趣的是,四个ZMSNRK2.在子类III中聚集的成员位于染色体1或染色体的远端5.此外,ZmSnRK2.8和ZmSnRK2.9与染色体1密切相关,同时ZMSNRK2.10和ZMSNRK2.12.在5号染色体上密切相关。此外,我们还发现了许多节段性重复事件,但没有发现串联重复事件SNRK2S.利用MCScanX程序对玉米进行了分析。此外,我们还研究了它们之间的共线和共线关系Zea Mays.那拟南芥和奥雅萨苜蓿分析了调查潜在的进化事件SNRK2S.在植物中。每个成员SNRK2.在玉米中有一个或多个拟南芥和水稻的正交基因,并且这种共同关系发生在同一亚类中(图。2c),暗示重复事件SNRK2S.在植物中发生在玉米,水稻和拟南芥的分化之前。这些结果表明,扩展了SNRK2.玉米基因家族主要是因为分段重复。
表达模式分析ZMSNRK2.基因Zea Mays.
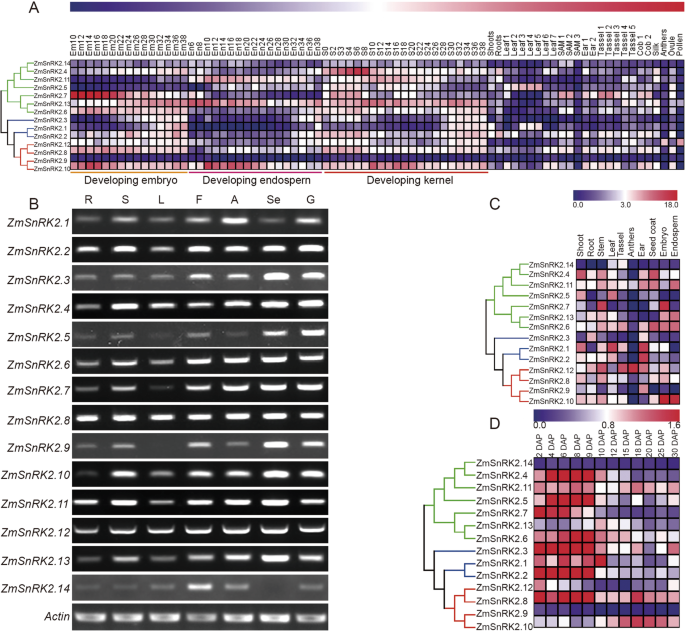
探讨脑组织的生物学功能ZMSNRK2.基因,我们首先分析表达谱ZMSNRK2.78个样本中的基因。这些样本来自玉米不同发育阶段的不同组织,其中的转录组数据从NCBI数据库下载(http://www.ncbi.nlm.nih.gov/sra.) [29]. 这个ZMSNRK2.基因在玉米中表现出不同的时空表达模式(图。3.A) 是的。对于亚类Ⅲ的成员,基因的表达水平ZmSnRK2.8在内核发育的每个阶段相对稳定,但胚胎的胚胎显着高于胚乳。表达水平ZmSnRK2.9在所有样本中都很低。值得注意的是,ZMSNRK2.10在籽粒发育期间高度表达,特别是在10个DAP(授粉后的天数)和24个系列的核发展,这对于谷物填充和种子成熟非常重要。ZMSNRK2.12.是唯一在花粉中表现出高表达水平的基因。另外,表达水平ZMSNRK2.14在几乎所有组织中相对较低,而zmsnrk2.13在种子中高度表达(图。3.a,b)。表达ZMSNRK2.通过半定量RT-PCR(sqRT-PCR)或qRT-PCR分析,对几种玉米组织或籽粒发育过程中的基因进行了检测,qRT-PCR分析的结果与公共数据库的结果基本一致(图。3B级-四维). ABA和蔗糖是调控籽粒灌浆过程中代谢相关基因表达的信号分子[2那30].然后分析了其表达变化ZMSNRK2.ABA和蔗糖处理下玉米籽粒中的基因,结果表明ZMSNRK2.外源ABA或蔗糖处理后,基因表达差异显著(附加文件1:图。S3)。例如,表达水平ZmSnRK2.1/2.3/2.6/2.9/2.10型在ABA处理下表达上调,而ZmSnRK2.8/2.9/2.10/1.12型, III亚类成员,蔗糖处理后增加。的表达水平zmsnrk2.13在ABA和蔗糖处理下均表达下调。
表达分析ZMSNRK2S.在玉米。(一种)热图是根据从公共数据库下载的RNA-seq数据生成的(http://www.ncbi.nlm..nih.gov/sra)在“加入号”下SRP037559。颜色刻度显示在图的上部。更高的表达水平以红色显示,蓝蓝色。地图是由MEV 4.9制作的。(B.)采用半定量RT-PCR分析14ZMSNRK2.根(R)、茎(S)、叶(L)、花(F)、花药(A)、种子(Se)和萌发种子(G)的基因序列。C)Heatmap表示14的相对表达ZMSNRK2.基于qRT-PCR数据的地上部、根、茎、叶、雄穗、花药、种皮(15dap)、胚(15dap)和胚乳(15dap)中的基因(D.)Heatmap表示表达ZMSNRK2.基于QRT-PCR数据的玉米种子中的基因。S2-S30:种子(2个DAP)--Seeds(30 dap),(Dap:授粉后的天)
ZmSnRK2蛋白定位于细胞质和细胞核
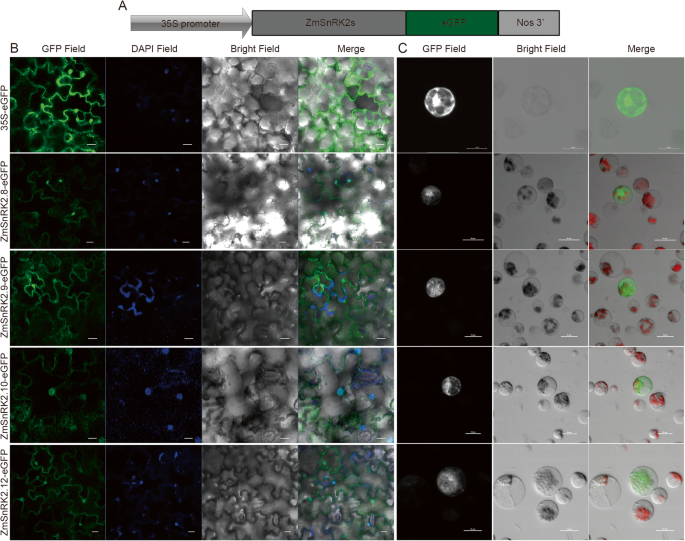
蛋白ZmSnRK2.1与ZmSnRK2.11(除ZmSnRK2.9)的细胞质和核定位烟草benthamiana有报道称[31]. 在这里,为了准确测定所有ZmSnRK2蛋白的亚细胞定位,我们制作了ZmSnRK2s绿色荧光粉利用花椰菜花叶病毒(CaMV)35S启动子构建融合体,并将其瞬时转化为玉米原生质体和玉米原生质体烟草benthamiana树叶。在玉米原生质体的核和细胞质中观察到强大的绿色荧光信号或烟草benthamiana叶细胞转化为ZmSnRK2s绿色荧光粉,而在细胞质,血浆膜和核中检测到游离GFP蛋白(图。4.和附加文件1:图。S4)。
ABA激活ZMSNRK2.10蛋白的激酶活性
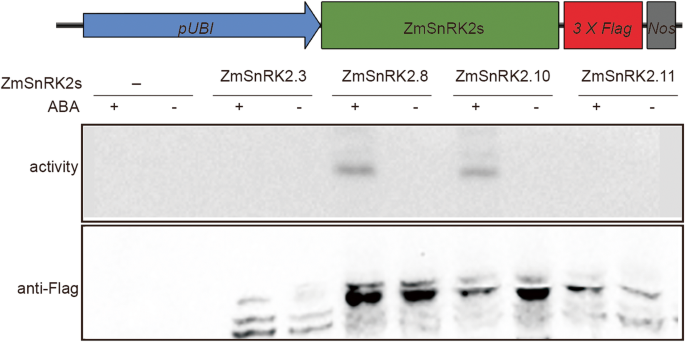
考虑到ZMSNRK2.10我们研究了ZmSnRK2.10蛋白激酶是否被ABA激活以及是否直接参与ABA信号转导途径。ABA反应基因驱动的荧光素酶报告基因RD29B型利用启动子验证了其作用ZMSNRK2.10在ABA信号通路。四选ZMSNRK2S.成员,包括ZmSnRK2.8(zmost1.)由ABA激活,弱介导玉米中的气孔闭合[32],ZMSNRK2.10那ZMSNRK2.11.(子类别的成员)和ZmSnRK2.3(亚类II的成员)进行了测试。这个ZMSNRK2.基因和报告基因将基因共转化到玉米叶片原生质体中。结果表明原生质体表达ZmSnRK2.8或ZMSNRK2.10展出了更高的RD29B型-luc表达比表达的表达ZmSnRK2.3或ZMSNRK2.11..类似于ZmSnRK2.8,上调RD29B-LUC型表达方式ZMSNRK2.10ABA处理显著增强(附加文件1:图。S5)。为了进一步证实,通过ABA直接激活ZMSNRK2.10蛋白激酶,使用MBP作为基质进行免疫沉淀 - 激酶(IP-激酶)测定,以研究有或没有ABA治疗的激酶活性。通过抗标绳抗体免疫沉淀ZMSNRK2蛋白质后,进行体外激酶测定。结果表明,这些ZMSNRK2中的任何一个都没有表现出没有ABA治疗的激酶活性。然而,在ABA处理后诱导ZMSNRK2.8和ZMSNRK2.10,但不是ZMSNRK2.3和ZMSNRK2.11的激酶活性(图。5.)。这些结果表明,ZMSNRK2.8和ZMSNRK2.10均由ABA激活,并参与ABA响应基因表达的调节。
过度表达ZMSNRK2.10部分拯救了ABA不敏感的表型SNRK2.2 / 2.3和snrk2.2/2.3/2.6型突变体
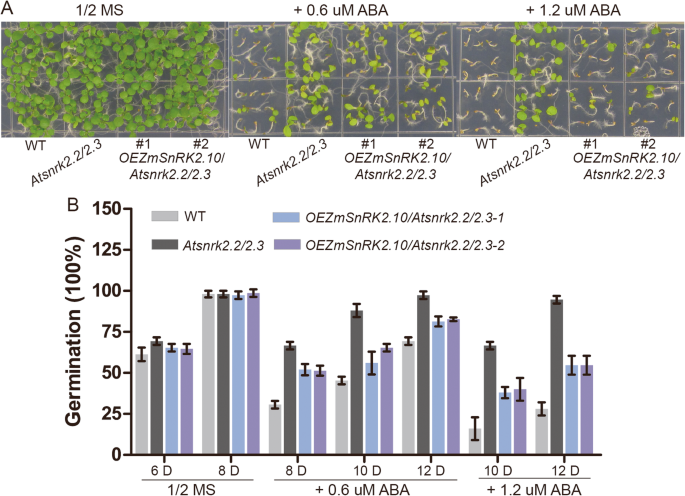
调查生物学功能ZMSNRK2S.,我们获得了表达4个选择的转基因植物的拟南芥ZMSNRK2.基因(ZmSnRK2.3/2.8/2.10/2.11)由Ubi启动子驱动SNRK2.2 / 2.3双突变体背景,每个转基因获得几个纯合的转基因系。这个atsnrk2.2 / 2.3双突变体在种子萌发和播种生长期间表现出ABA不敏感的表型[19].检查是否过表达ZMSNRK2.基因影响了ABA的敏感性atsnrk2.2 / 2.3双突变体,WT的种子,atsnrk2.2 / 2.3突变体和转基因植物在补充有不同浓度的ABA的培养基上发芽。如附加文件所示1:图S6, WT、WT、atsnrk2.2 / 2.3在正常条件下突变体和转基因植物。然而,在外源性ABA存在下,种子萌发和种子生长ZmSnRK2.8和ZMSNRK2.10转基因植物atsnrk2.2 / 2.3与...相比,突变背景明显抑制atsnrk2.2 / 2.3突变体,但不如野生型严重ZmSnRK2.3和ZMSNRK2.11.过度抑制植物atsnrk2.2 / 2.3突变体的背景表现出与之相似的表型atsnrk2.2 / 2.3在ABA治疗下的突变体。这些结果表明ZmSnRK2.8和ZMSNRK2.10拥有类似的功能AtSnRK2.2和AtSnRK2.3在ABA信号传导途径。萌发率ZMSNRK2.10过表达atsnrk2.2 / 2.3对突变体进行进一步统计分析。无花果。6.在播种含有1.2μmaba的1 / 2ms琼脂培养基后的第10天,大约50%的两种种子OEZmSnRK2.10型/Atsnrk2.2型/2.3与WT的26%和100%相比atsnrk2.2 / 2.3突变种子发芽,进一步证实了这一点ZMSNRK2.10可以部分补充ABA不敏感的表型atsnrk2.2 / 2.3.
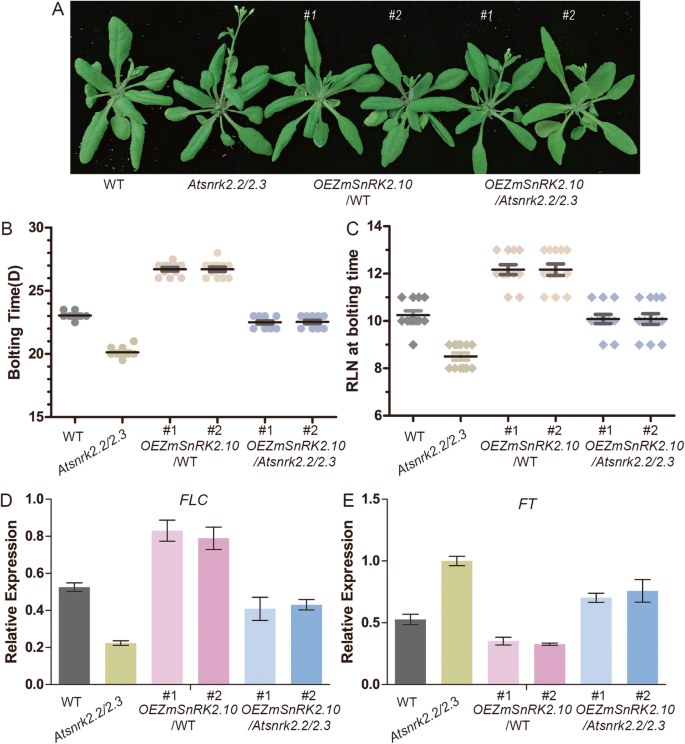
我们还分析了表达的转基因素的开花时间ZMSNRK2.10在WT和Atsnrk2.2型/2.3突变背景(图。7.a - c)。与野生型植物相比Atnrk2.2/2.3双突变体表现出早花表型。过表达ZMSNRK2.10在里面Atsnrk2.2型/2.3而背景可以恢复花期Atsnrk2.2型/2.3双突变体到WT水平。ZMSNRK2.10在WT背景下也导致了开花时间的显著延迟。在转基因植物中过表达ZMSNRK2.11.野生型和野生型的基因Atsnrk2.2型/2.3突变背景,开花时间不受影响。(附加文件1:图。S7),暗示ZMSNRK2.10在控制拟南芥开花时间方面有特殊作用。了解的机制ZMSNRK2.10在花期调控中,两个关键基因的转录水平,开花轨迹T(FT)和开花轨迹C(FLC.),对转基因株系进行qRT-PCR分析。FT.控制拟南芥的开花时间,其突变体植株表现出明显的迟花现象[33].FLC.是一种花卉压缩机和FT.能直接结合到启动子区吗FLC.抑制其表达,从而抑制拟南芥的开花[34]. 这个qRT-PCR analysis indicated that the expression level ofFLC.上调和表达水平FT.转基因植物过表达的转基因植物ZMSNRK2.10(图。7.D-e)。因此,我们怀疑过度表达ZMSNRK2.10延迟开花时间至少部分是通过调控FLC.和FT.基因。
过度表达ZMSNRK2.10导致拟南芥的开花时间延迟.(一种) WT的开花表型,atsnrk2.2 / 2.3那OEZmSnRK2.10型/ wt,和OEZmSnRK2.10型/atsnrk2.2 / 2.3. 这张照片是35岁时拍的 在LD条件下生长的天数(B.)WT的开花时间,atsnrk2.2 / 2.3那OEZmSnRK2.10型/ wt,和OEZmSnRK2.10型/atsnrk2.2 / 2.3在LD条件下得分于从萌芽到螺栓的日期得分。(C)WT的开花时间,atsnrk2.2 / 2.3那OEZmSnRK2.10型/ wt,和OEZmSnRK2.10型/atsnrk2.2 / 2.3基于开花阶段的莲座叶的数量得分于LD条件下。(D.)QRT-PCR分析FLC.基因在WT中,atsnrk2.2 / 2.3那OEZmSnRK2.10型/ wt,和OEZmSnRK2.10型/atsnrk2.2 / 2.3.(E.)QRT-PCR分析FT.基因在WT中,atsnrk2.2 / 2.3那OEZmSnRK2.10型/ wt,和OEZmSnRK2.10型/atsnrk2.2 / 2.3.误差条代表三个生物重复的SE
此外,几乎所有主要的ABA反应在Atsnrk2.2/2.3/2.6型拟南芥中的三重突变体。三重突变体显示早期开花,较小的植物大小,花粉数量较少,施肥表型差Atsnrk2.2型/2.3双突变体(6.那16].我们也转变了ZMSNRK2.10进入之内Atsnrk2.2型/3./6.三重突变体并获得过表达转基因系(附加文件1:图。S8A,B)。过度表达ZMSNRK2.10拯救了矮人的形态Atsnrk2.2/2.3/2.6型突变体显着,但转基因植物的植物尺寸仍然小于wt(图。8.和附加文件1:图。S8C)。结果表明ZMSNRK2.10冗余函数AtSnRK2.2/2.3/2.6。
讨论
保守的演变ZMSNRK2S.
在双子叶模式植物拟南芥中,ABA信号途径的核心成分已得到了很好的表征,但作物ABA调控途径的研究仍需加强。蛋白激酶SnRK2s是ABA信号转导的中心节点[35那36]. 这个SNRK2.基因家族已经在许多植物中被鉴定出来。在玉米、11SNRK2.先前已经报道了基因[26]. 在这项研究中,我们确定了14名SNRK2.使用最新的玉米基因组数据库的基因组水平。与拟南芥和米饭中10名成员的10名成员相比SNRK2.玉米成员扩大到14 [9.那10]. 这个expansion ofSNRK2.玉米基因归因于基因重复事件,这是用于适应周围环境的植物的重要策略之一[37那38].据报道,在植物中发生了三种重复事件,包括全基因组重复、基因组串联重复和片段重复[39]. 与拟南芥和水稻相似的是SNRK2.玉米基因分为三个子类(附加文件1:图。S1和图3. S2)和外显子内组织SNRK2.这三种种类中的基因表现出高相似性(图。2A),这表明基因结构SNRK2S.在高等植物中进化保存。的共线性关系SNRK2S.表示SNRK2.在玉米,水稻和拟南芥的分化之前,基因已经区分了(图。2C)。最古老的陆地植物,如苔藓植物和轮藻纲藻类,只包含SNRK2.在亚类III中聚集的基因,并将亚类I和II分支分支作为新系统,以适应苔藓植物和血管植物的分离后的渗透胁迫条件[38]. 这个neofunctionalization and subfunctionalization of the duplication gene is an important mechanism to maintain its stability. The original duplicated gene has dual functions and repulsion between these two functions, which results in gene loss. When the duplication event occurs, each gene obtains one of the functions and optimizes them respectively, leading to the elimination of functional conflict and the stability of duplicated genes [40].这表明重复事件SNRK2.基因是一种古老的系统,随着植物中全基因组复制事件的发生而扩展。先前的研究推测,玉米经历了至少三个全基因组复制事件:单子叶植物分化,出现禾本科以及玉米和高粱的分化。这些重复事件发生在大约1.1亿年前,5000万年前,1200万年前分别[41那42那43].此外,通过同步和共线性分析SNRK2.玉米基因组中的基因,我们确定了八个节段重复但没有串联复制(图。2B),这支持大多数玉米基因在古代多倍化过程中被复制的观点[44]. 这些结果表明SNRK2.玉米新型基因功能的成员和起源可能是由于分段重复和多倍化。这种解释与自适应辐射模型一致,提出新开发的基因有助于现有的基因应对新的条件,基因组串联复制加速了重复基因的新功能的演变[45那46].
表达模式ZMSNRK2S.在玉米
基因表达模式的分析可以为探索基因功能提供重要线索。在拟南芥中,基因的组织特异性表达SNRK2.6气孔与保卫细胞的功能紧密结合以调节气孔关闭[18]. 这个expression of two other subclass III genes,SNRK2.2.和SNRK2.3.,与的不同SNRK2.6.这两种基因在几乎所有组织中表达,与其在调节各种ABA反应中的作用密切相关,例如种子萌发,休眠和幼苗生长[19那28].以前的研究揭示了表达谱ZMSNRK2.在不同的非生物胁迫下的家庭基因[26那31].调查时空表达模式ZMSNRK2S.,我们首先分析了表达ZMSNRK2S.使用公共RNA-SEQ数据库,发现ZMSNRK2.基因在各种玉米组织的生长和发展期间表现出差异表达模式。即使在同一亚类中,每个基因也表现出明显的表达模式。寄生基因倾向于保持相似的功能,但表明活动和特异性的差异。基因表达的显着差异ZMSNRK2.基因与先前研究中报告的结果一致[47那48]. 这个changes of homologous genes in the promoter region lead to rapid divergence in expression patterns, which further lead to functional differentiation [49]. 染色体定位、基因结构和共线性分析表明这四个基因ZmSnRK2.8那ZmSnRK2.9那ZMSNRK2.10,zmsnrk2.12,属于玉米SnRK2亚类III,来源于基因复制事件。我们重点研究了这四个基因的差异表达模式,发现ZMSNRK2.10在胚乳和胚中均有高表达,特别是在核发育中后期,这两个阶段是贮藏物质积累和种子成熟的重要阶段(图1)。3.d)。此外,还原的成绩单ZMSNRK2.10分别由ABA和蔗糖诱导(附加文件1:图。S3)。在小麦,转录物PKABA1公司和TaSnRK2.3ABA诱导,两种基因对于种子成熟和非生物应激反应很重要[8.那27].虽然在本研究中测试了不同的玉米组织和之前的报告[26那31],一些表达模式的一些ZMSNRK2S.ABA处理下几乎一致,如ZmSnRK2.1和ZmSnRK2.7(附加文件1:图。S3)。此外,最多的表达模式ZMSNRK2S.玉米的不同组织有差异。例如ZMSNRK2.10在ABA治疗后籽粒表达增加,但在幼苗,叶和根部中的表达下降了[26那31].结合结果ZMSNRK2.10在内核中高度表达,由ABA诱导,我们提出了这一点ZMSNRK2.10在籽粒灌浆和成熟过程中起着连接代谢和胁迫信号的重要作用。
功能表征ZMSNRK2.10在拟南芥
SNRK2S.基于ABA激活的拟南芥分为三个子类.第III子类,包括SNRK2.2.那SNRK2.3.和SNRK2.6,由ABA和Subclass II强烈激活,包括SNRK2.7和SNRK2.8.,被ABA轻微激活。亚类ISNRK2S.不能通过ABA激活,但可以通过超细压力强烈激活,除了SNRK2.9.[7.那11].因为子类III SNRK2S是ABA依赖的,所以SNRK2.2.或2.3单突变体表现出弱的ABA不敏感表型和SNRK2.2 / 2.3双突变体在拟南芥种子萌发和幼苗生长过程中表现出强烈的ABA不敏感表型[19].进一步的研究表明snrk2.2/2.3/2.6型三个突变体在种子萌发和幼苗生长过程中对ABA几乎完全不敏感[16那28].萨普克8那SAPK9.,SAPK10,它们是atsnrk2.2,atsnrk2.3,AtSnRK2.6,属于水稻的III亚类,被ABA强烈激活[10]. 过表达萨普克8那SAPK9.,或SAPK10与野生型相比,水稻种子萌发和幼苗生长延迟是由于ABA积累水平较高所致[21].相比之下,萨普克8和SAPK9.那SAPK10显示与的最高同源性AtSnRK2.2和AtSnRK2.3并介导WRKY72的磷酸化,从而释放其对茉莉酸合成和细菌性白叶枯病抗性的抑制[50]. 过表达SAPK10在种子萌发和幼苗生长期间将水稻与ABA进行过敏和米饭[51].在玉米中,我们发现了ZMSNRK2.10是最接近的同源基因SAPK10在米饭和SNRK2.2 / 2.3在拟南芥那和这个基因,以及ZmSnRK2.8(和...一样OST1.在拟南芥中),由ABA激活。另一个子类成员ZmSnRK2.3和ZMSNRK2.11.ABA不能激活(图。5.和附加文件1:图S5)。过表达ZmSnRK2.8拯救干旱超敏表型OST1.突变体和显著提高植物在逆境条件下的生长发育[32那52在我们的研究中,过度表达ZmSnRK2.8和ZMSNRK2.10, 但不是ZmSnRK2.3和ZMSNRK2.11.,在atsnrk2.2 / 2.3背景可部分补充过敏表型atsnrk2.2 / 2.3在种子萌发和早期幼苗发育中的ABA(图。6.和附加文件1:图。S6)。此外,过表达ZMSNRK2.10也可以拯救表型Atsnrk2.2/2.3/2.6型三突变体(图。8.和附加文件1:图。S8)。确定的功能ZmSnRK.10号在拟南芥中表明ABA依赖会员SNRK2.可能在植物中进化保存。
另一方面,ABA能抑制植物的花转化[53]. 外源ABA的施用推迟了植物的开花时间。一系列ABA合成和信号转导突变体,包括ABA2.那abi4型那abi5型,snrk2.2/2.3/2.6型,表现出早花表型[6.那53那54那55].我们发现SNRK2.2 / 2.3双突变体还显示拟南芥和过度表达的早期开花ZMSNRK2.10在里面SNRK2.2 / 2.3双突变体挽救了早花表型。此外,过表达ZMSNRK2.10在WT背景中通过上调延迟开花时间FLC.参与花转变的基因(图。7.). 这一结果与SnRK2介导的ABI5和/或ABF磷酸化促进FLC.基因表达 [53].所有这些结果表明植物中亚类III SNRK2S的分子函数在植物中保守。在将来,过度表达或敲门声ZMSNRK2.10通过CRISPR-CAS9技术需要在玉米中进行,这将推进我们对角色的理解ZMSNRK2.10玉米非生物胁迫耐受性的调控。
结论
尽管ZMSNRK2S.早在2008年之前已经克隆并表征了玉米,没有基因组鉴定和表征ZMSNRK2S.已在玉米进行。在这里,我们提出了一种基因组覆盖的识别ZMSNRK2S.在玉米和发现14岁SNRK2.基于公布的玉米基因组数据的基因。通过染色体定位、基因结构、进化关联、共时性和共线性分析SNRK2.通过与玉米的比较,得出了玉米的基因SNRK2S.在水稻和拟南芥中,我们可以知道SNRK2.家族基因在植物中被进化地保守,特别是ABA依赖性子类III SNRK2S。此外,通过转录和生化分析,我们发现了ZMSNRK2.10在内核中高度表达,由ABA激活。过度表达ZMSNRK2.10在里面SNRK2.2 / 2.3双倍和snrk2.2/2.3/2.6型三重突变体部分地拯救了这些突变体的ABA不敏感表型,并且还导致拟南芥延迟植物。我们的研究提供了关于结构,进化和功能的新见解SNRK2S.在玉米。
方法
植物材料及生长条件
玉米(Zea Mays.L.)自交系B73材料(来自四川农业大学玉米研究所),在四川崇州的四川农业大学试验农场种植。的种子拟南芥加入Col-0(哥伦比亚0)和突变体SNRK2.2 / 2.3那snrk2.2/2.3/2.6型(所有在Col-0背景中,从普渡大学朱实验室获得)[6.那19在本研究中使用。这拟南芥在当天在22℃下在22℃和16℃下在22℃下在16小时光/ 8 H暗状态下生长在内的植物。
SnRK2s全基因组鉴定Zea Mays.
识别SNRK2.基因Zea Mays.的基因组序列和注释数据Zea Mays.来自MaizeGDB(https://www.maizegdb.org/)。通过使用查询序列来爆炸蛋白质数据库和基因组数据库SNRK2.家庭拟南芥(http://www.arabidopsis.org.) 和奥雅萨苜蓿(http://www.ricedate.com.)。E-Value截止设置为1.0E-5,以确保手动删除置信度和冗余序列。
多序列对齐,直晶基因鉴定和系统发育分析
本文对SnRK2家族进行了系统发育分析[56].简而言之,氨基酸序列来自Zea Mays.那拟南芥和奥雅萨苜蓿通过clustalxv1.83与默认参数对齐,然后在MEGA(版本5.10)中使用邻居连接(NJ)方法构建系统发育树[57]. 这个parameters of NJ analysis were as followed: bootstrap with 1000 replicates for statistical testing, pairwise deletion for data processing and poisson correction for modeling. The position in phylogenetic tree (bootstrap value > 50) and identify between orthologous gene pairs (> 90%) would determine the orthologous gene inZea Mays.那拟南芥和奥雅萨苜蓿.
ZMSNRK2S的染色体位置和共线性分析
基因ID信息ZMSNRK2.染色体上的基因座是从基因组注释文件中获得的。分配ZMSNRK2S.在MapChart版本2.32生成染色体上[58]. 这个Gene Structure Display Server (http://gsds.cbi.pku.edu.cn/)进行基因结构分析。保守的蛋白质基序ZMSNRK2S.由MEME Version 5.0.4程序(http://meme-suite.org/)。MEME的默认参数是设置,除外两个:最大数量的图案,25;最佳宽度,6-50 [59). .MCscanX程序被用来识别ZMSNRK2S.上文所述的副本[56那60]. 所有基因被分为不同类型的重复,包括WGD、片段和串联重复。假定的WGD或片段复制的示意图ZMSNRK2S.建造了Circos(http://circos.ca/),和ZMSNRK2S.与WGD或节段重复通过线连接。
的表达模式分析ZMSNRK2.基因
研究表达模式ZMSNRK2.基因,我们获得了每个表达水平ZMSNRK2.通过分析释放的转录数据,不同组织中的基因[29],然后提交给MeV\U 4\U 9\U 0[61]用于分层聚类(Hierarchical clustering, HCL)。采集B73同一时期(抽穗期)的不同组织(根、茎、叶、丝、花药)进行RNA提取和qRT-PCR分析。采集授粉后2 ~ 30 d的籽粒、授粉后15 d的胚乳和胚。对离体核的处理参考文献[30]. 这个RNA extraction of materials was followed the protocol of Trizol (TIANGEN, Beijing, China) reagent. RNA was reverse transcribed using the PrimeScript™ RT Reagent Kit with genomic DNA Eraser (Takara, Dalian, China), and quantitative RT-PCRs were performed using a SYBR premix Ex Taqtm RT-PCR kit (Takara, Dalian, China). All the experiments were performed following the manufacturer’s instructions. The primers used for qRT-PCR were listed in Additional file1:表S2。
ZmSnRK2基因的克隆、载体构建及亚细胞定位
基因的全长cDNA序列ZMSNRK2.用PCR扩增排除终止密码子的基因。PCR产物测序后,亚克隆到pCAMBIA 2300-35S-eGFP载体中[62]. 这个n the pCAMBIA2300-ZmSnRK2-eGFP fusion protein were transformed into农杆菌肿瘤术菌株GV3101。空的PCAMBIA2300-35S-EGFP用作控制。这农杆菌被感染到烟草benthamiana通过共聚焦显微镜(Leica,Wetzlar,Germany)观察到绿色荧光蛋白(GFP)的叶子和荧光信号。这ZMSNRK2.14由于其几乎所有组织中的表达低,因此没有亚克隆。用于矢量承包商的引物列于其他文件中1:表S2。
原生质体的分离与转染
玉米原生质体的分离如前所述,只进行了一些小的修饰[63]. 这个middle parts (7 cm) of the second leaves of B73 were transversally cut into 0.5–0.8 mm long strips and put into a petri dish containing 0.6 M mannitol for 5 min. Then the strips were transferred into another dish containing enzyme solution [0.6 M mannitol, 20 mM MES, pH 5.7, 0.1% cellulase RS, 0.01% macerozyme, 0.1% BSA, 1 mM CaC12和ddH2O] 是的。真空后(15–20 室温下蒸馏20 在28分钟时,培养皿被孵育 °C在黑暗中摇动3分钟 h在40 rpm和10 80分钟 转速。然后,原生质体被释放。含原生质体的酶液经35℃过滤后转入无菌试管 μm尼龙网。原生质体以110×g离心4小时 室温下最小,用0.6洗涤一次 我是甘露醇。最后,原生质体在MMg溶液(0.6)中再悬浮 甘露醇,4 毫米MES,pH 5.7, 15 毫米MgC12)并在光镜下观察其质量和数量。
原生质体转染采用PEG介导的原生质体转化法[63那64]. 20岁 将p2300-ZmSnRK2s的μg质粒DNA与200混合 μL原生质体(浓度为2倍 105.细胞/ ml)。约220μLPEG溶液(0.8M甘露醇,40%PEG 4000和100 mm CaCl2,通过轻轻摇动,立即与原生质体和质粒DNA混合,然后在25℃下温育15分钟。孵育后,通过离心洗涤原生质体的混合物并收集,然后重悬于温育溶液(4mM MES,pH 5.7,0.6M甘露醇,4mM KCl)中,并在25℃下在黑暗中孵育过夜。通过共聚焦显微镜(Leica,Wetzlar,德国)观察荧光信号。
共转染的ZMSNRK2.3,ZMSNRK2.8,ZMSNRK2.10和ZMSNRK2.11与报告基因分别重建B73叶片原生质体中的ABA信号通路。用RD29B-LUC和Zmubi-Gus选择ABA响应的报告和内部对照。在转染后,在光的不存在/存在下,在光的情况下孵育原生质体以进一步分析。
转基因植物的构建
的序列确认的orfZmSnRK2.3那ZmSnRK2.8那ZMSNRK2.10和ZMSNRK2.11.被克隆到PCAMBIA3301 Vector(Cambia,Cambia,Canberra,Australia)中。将构建体转移到农杆菌肿瘤术使用电穿孔法菌株GV3101然后转化为拟南芥使用花尖方法[65]. 这个seeds of the T0.在土壤中收获和播种的一代,转化体1用Basta(草甘膦铵;Solarbio,北京,中国),并通过PCR扩增证实35 s: ZmSnRK2s片段和bar基因。将确认的转基因植株单独收获。T2将种子置于1 / 2MS(Murashige&Skoog)琼脂培养基(1%)上含有5mg / L甘氨酸铵。T.的种子3.从具有3:1(抗性:敏感)隔离比率的转基因系中收集。两个人t3.显示100%Basta抗性的线被认为是纯合的并且用于进一步实验。这拟南芥COL-0用作对照。在同一阶段收集WT,突变体和转基因植物的所有种子。
发芽试验和表型鉴定
种子用75% (v/v)乙醇和0.1% (v/v)吐温80灭菌20 min,乙醇洗涤2次,风干。50每个转基因的种子,突变体和WT被放置或琼脂培养基(1.0%)补充与不同浓度的ABA(0.5, 0.6, 1.0, 1.2或1.5μM),维持在4°C在黑暗2天,然后转移到生长室在65%相对湿度下16小时光在22°C和8-h-dark 18°C。在室温下放置8天后,每天测定两个绿色子叶的出苗率。
通过测量每条线的螺栓连接时间进行比较WT,突变体和转基因系的开花时间表型。记录叶片(RLN)的数量将是衡量开花时间的另一个特征。
GUS染色测定
在GUS实验中,GUS活性参照本文进行[66]几乎没有修改。切叶移入GUS染色液(1 mM X-Gluc,10 mM磷酸盐缓冲液 7.0%,0.5%[v/v]Triton X-100和2 亚铁氰化钾)。在真空渗透和室温下过夜振荡培养后,通过在70%乙醇中反复洗涤去除叶片染色并拍照。
蛋白提取及免疫印迹分析
对于如图所示的实验。5.,附加文件:图S6、S7和S8,蛋白质提取和免疫印迹分析如所述进行[11]稍加修改。蛋白质提取缓冲液(100 嗯,赫普斯,pH 7.5, 5 毫米乙二胺四乙酸,5 毫米EGTA,2 mm正钒酸盐,10 毫米氟化钠,20 β-甘油磷酸,5 mm DTT,蛋白酶抑制剂鸡尾酒[Sigma-Aldrich],用于植物细胞和组织提取物1:100和50 用μM-PMSF提取转基因植株的液氮叶片。样品在4℃下离心 °C高速10分钟 min,收集上清液。蛋白质浓度用Bio-Rad蛋白测定法测定。隔离后,大约15分钟 μg蛋白组分转移到SDS负载缓冲液中,用SDS-PAGE(12.5%丙烯酰胺)进行分离。参照本文进行了蛋白质的westernblotting检测[30].
数据和材料的可用性
支持本研究结论的数据集可通过与相应作者联系(yubihuang@sohu.com.). RNA序列数据可在NCBI中获得(www.ncbi.nlm.nih.gov.),注册号为SRP037559。
缩写
- 阿巴:
-
脱盐酸
- BSA:
-
牛血清白蛋白
- CAMV:
-
花椰菜马赛克病毒
- 光盘:
-
蛋白质中氨基酸的序列编码
- DAPI:
-
4',6-二氨基-2-苯基吲哚
- EDTA:
-
乙二胺四乙酸
- EGTA公司:
-
乙二醇双(2-氨基乙醚)-N,N,N′,N′-四乙酸
- GUS:
-
β-葡萄糖醛酸酶
- HEPES:
-
2-[4-(2-羟乙基)哌嗪-1-基]乙磺酸
- 市场经济地位:
-
吗啉乙酰磺酸
- 小姐:
-
Murashige &斯
- 子:
-
开放阅读框
- PEG:
-
聚乙二醇
- PMSF:
-
Phenylmethanesulfonyl氟化
- SDS-PAGE:
-
十二烷基硫酸钠聚丙烯酰胺凝胶电泳
- UBI:
-
泛素
工具书类
- 1.
Chen K,Li G-J,Bressan Ra,Song CP,Zhu J-K,Zhao Y.植物中的脱落酸动力学,信号和功能。J Intent Plant Biol。2020; 62(1):25-54。https://doi.org/10.1111/jipb.12899.
- 2.
张德普。脱落酸:代谢、转运和信号:Springer;2014
- 3.
Ma Y,Szostkiewicz I,Korte A,Moes D,Yang Y,Christmann A等。PP2C磷酸酶活性的调节剂作为脱落酸传感器。科学。2009; 324(5930):1064-8。https://doi.org/10.1126/science.1172408.
- 4.
裴士毅,冯鹏,Nishimura N, Jensen DR, Fujii H, Zhao Y,等。脱落酸通过START蛋白的PYR/PYL家族抑制2C型蛋白磷酸酶。科学。2009;324(5930):1068 - 71。https://doi.org/10.1126/science.1173041.
- 5.
Fujii H, Chinnusamy V, Rodrigues A, Rubio S, Antoni R, Park S- y等。脱落酸信号通路的体外重建。大自然。2009;462(7273):660 - 4。https://doi.org/10.1038/nature08599.
- 6.
王p,薛升,巴斯特利g,李某,侯y-j,范奥奥斯滕mj等。定量磷蛋白酶鉴定SNRK2蛋白激酶基质并揭示了脱离酸作用的效果。P Natl Acad Sci USA。2013; 110(27):11205-10。https://doi.org/10.1073/pnas.1308974110.
- 7.
Lin Z, Li Y, Zhang Z, Liu X, Hsu C-C, Du Y, Sang T, Zhu C, Wang Y, Satheesh V, et al. .一个RAF-SnRK2激酶级联调控高等植物早期渗透胁迫信号。Nat Commun 2020; 11(1): 1 - 10。
- 8.
Anderberg RJ,Walker-Simmons MK。将小麦cDNA克隆分离用于脱离酸诱导的转录物与蛋白激酶的同源性。P Natl Acad Sci USA。1992年; 89(21):10183-7。https://doi.org/10.1073/pnas.89.21.10183.
- 9。
Hrabak EM,Chan CWM,Gribskov M,Harper JF,Choi JH,Halford N等。拟南芥CDPK-SnRK蛋白激酶超家族。植物生理学。2003;132(2):666–80.https://doi.org/10.1104/pp.102.011999.
- 10.
Kobayashi Y,Yamamoto S,Minami H,Kagaya Y,Hattori T.米蔗糖无效化1相关蛋白激酶的差异激活,通过高骨质胁迫和脱钙酸。植物细胞。2004; 16(5):1163-77。https://doi.org/10.1105/tpc.019943.
- 11.
Boudsocq M、Barbier Brygoo H、Lauriere C。高渗和盐胁迫激活的9种蔗糖非发酵1相关蛋白激酶2的鉴定拟南芥.生物化学学报。2004;279(40):41758-66。
- 12
Mizoguchi M、Umezawa T、Nakashima K、Kidokoro S、Takasaki H、Fujita Y等。两种密切相关的Ⅱ类SnRK2蛋白激酶协同调控干旱诱导基因表达。植物细胞生理学。2010;51(5):842–7.
- 13
梅泽华,中岛,宫川,黑森,田仓,筱崎等。ABA反应核心调控网络的分子基础:感知。植物生理学杂志。2010;51(11):1821 - 1824。https://doi.org/10.1093/pcp/pcq156.
- 14
Yang G,Yu Z,Gao L,Zheng C.SNRK2S在十字路口的生长和压力反应。趋势植物SCI。2019; 24(8):672-6。https://doi.org/10.1016/j.tplants.2019.05.010.
- 15
Boudsocq M、Droillard M-J、Barbier Brygoo H、Lauriere C。渗透胁迫和脱落酸对蔗糖非发酵1相关蛋白激酶2的激活涉及不同的磷酸化机制。植物分子生物学。2007;63(4):491–503.https://doi.org/10.1007/S11103-006-9103-1..
- 16
富士H,Verslues Pe,朱杰克。Arabidopsis Decuple突变体揭示了SNRK2激酶在体内渗透应激反应中的重要性。P Natl Acad Sci USA。2011; 108(4):1717-22。https://doi.org/10.1073/pnas.1018367108.
- 17.
Yoshida R,Hobo T,Ichimura K,Mizoguchi T,Takahashi F,Aronso J等。ABA活化的SNRK2蛋白激酶是拟南芥中脱水应力信号传导所必需的。植物细胞生理。2002; 43(12):1473-83。https://doi.org/10.1093/pcp/pcf188.
- 18.
Mustilli AC、Merlot S、Vavasseur A、Fenzi F、Giraudat J。拟南芥OST1蛋白激酶介导脱落酸对气孔孔径的调节,并在活性氧产生的上游起作用。植物细胞。2002;14(12):3089–99.https://doi.org/10.1105/tpc.007906.
- 19.
富士H,Verslues Pe,朱杰克。鉴定拟南芥中种子萌发,根生长和基因表达的脱落酸调节所需的两种蛋白激酶。植物细胞。2007; 19(2):485-94。https://doi.org/10.1105/tpc.106.048538.
- 20。
萨哈J、查特吉C、森古普塔A、古普塔K、古普塔B。蔗糖非发酵1相关蛋白激酶2的全基因组分析与进化研究(SNRK2.)基因家族成员拟南芥和奥雅萨苜蓿.计算Biol Chem。2014; 49:59-70。https://doi.org/10.1016/j.compbiolchem.2013.09.005.
- 21。
林Q,吴F,盛p,张z,张x,guo x等。SNRK2-APC / C-TE调节模块介导赤霉酸和脱落酸途径的拮抗作用。NAT Communce。2015; 6(1):1-10。
- 22。
McCarty Dr,Hattori T,Carson CB,Vasil V,Lazar M,Vasil Ik。这胎生-1发育玉米基因编码新的转录活化剂。细胞。1991; 66(5):895-905。https://doi.org/10.1016/0092-8674(91)90436-3.
- 23。
种子发育中成熟与萌发途径的遗传控制与整合。植物生物学杂志,1995;46(1):71-93。https://doi.org/10.1146/annurev.pp.46.060195.000443.
- 24。
年轻的te,gallie dr。胚乳开发期间编程的细胞死亡。植物mol biol。2000; 44(3):283-301。https://doi.org/10.1023/A:1026588408152.
- 25。
脱落酸对玉米胚乳程序性细胞死亡的调控。植物生物学杂志,2000;42(2):397-414。https://doi.org/10.1023/a:1006333103342.
- 26。
怀娟,王敏,何娟,郑洁,董卓,吕辉,等。来源SnRK2基因家族的克隆及特性分析Zea Mays.. 植物细胞代表2008;27(12):1861–8.https://doi.org/10.1007/S00299-008-0608-8.
- 27。
田思,毛X,张H,陈某,翟C,杨S等人。普通小麦新型SNRK2基因TasnRK2.3的克隆与表征。J Exp Bot。2013; 64(7):2063-80。https://doi.org/10.1093/jxb/ert072.
- 28。
Nakashima K,Fujita Y,Kanamori N,Katagiri T,Umezawa T,Kidokoro S等人。三种拟南芥SNRK2蛋白激酶,SRK2D / SNRK2.2,SRK2E / SNRK2.6 / OST1和SRK2I / SNRK2.3,ABA信号传导涉及控制种子开发和休眠至关重要。植物细胞生理。2009; 50(7):1345-63。https://doi.org/10.1093/pcp/pcp083.
- 29。
陈继,曾B,张米,谢S,王g,哈克A等。玉米胚胎和胚乳发育的动态转录景观。植物理性。2014; 166(1):252-64。https://doi.org/10.1104/pp.114.240689.
- 30.
李勇,于刚,吕勇,龙涛,李鹏,胡勇,等。两个相邻的组合相互作用CIS.- 活化的推动者区域介导协同诱导Bt2在玉米胚乳中添加蔗糖和ABA。植物科学。2018;274:332-40。https://doi.org/10.1016/j.plantsci.2018.06.003..
- 31.
王yg,fu fl,yu hq,hu t,zhangy,tao y等。玉米核心ABA信令组件的交互网络。植物mol biol。2018; 96(3):245-63。https://doi.org/10.1007/s11103-017-0692-7.
- 32.
Vilela B、Moreno Cortés A、Rabissi A、Leung J、Pagès M、Lumberras V。玉米OST1激酶同源物磷酸化并调节玉米SNAC1型转录因子。公共科学图书馆一号。2013;8(2):e58105。https://doi.org/10.1371/journal.pone.0058105..
- 33.
Koornneef M,Hanhart CJ,Veen JH。晚开花突变体的遗传与生理学分析拟南芥.Mol Gen Genet。1991; 229(1):57-66。https://doi.org/10.1007/BF00264213.
- 34.
Bastow R,Mylne JS,Lister C,Lippman Z,Martienssen Ra,Dean C. vernalization需要通过组蛋白甲基化进行FLC的表观遗传沉默。自然。2004; 427(6970):164-7。https://doi.org/10.1038/nature02269..
- 35.
Cutler SR,Rodriguez PL,Finkelstein RR,Abrams SR.脱落酸:核心信号网络的出现。植物生物学年鉴。2010;61(1):651–79.https://doi.org/10.1146/annurev-arplant-042809-112122.
- 36
Kulik A,Wawer I,Krzywinska E,Bucholc M,Dobrowolska G.SnRK2蛋白激酶 - 植物反应对非生物胁迫的关键调节因子。omics。2011; 15(12):859-72。https://doi.org/10.1089/omi.2011.0091.
- 37
克朗克QCB。后基因组背景下的植物进化与发育。纳特·雷夫·吉内特。2001;2(8):607–19.https://doi.org/10.1038/35084556.
- 38
Shinozawa A,Otake R,Takezawa D,Umezawa T,Komatsu K,Tanaka K,等。SNRK2蛋白激酶代表植物中的古代系统,以适应陆地环境。Communic Biol。2019; 2(1):1-13。
- 39
张吉茨。基因复制的演变:更新。趋势ECOL EVOL。2003; 18(6):292-8。https://doi.org/10.1016/S0169-5347(03)00033-8.
- 40.
基因复制后新功能蛋白质的进化。P Roy Soc B-Biol科学。1994;256(1346):119–24.
- 41.
Lyons E,Freeling M.如何使用与DNA序列相比将同源植物基因和染色体进行比较。工厂J. 2008; 53(4):661-73。https://doi.org/10.1111/j.1365-313X.2007.03326.x.
- 42.
唐清,鲍德·杰,王X,明河,阿拉姆米,帕特森啊。透视 - 植物基因组中的同步和共线性。科学。2008; 320(5875):486-8。https://doi.org/10.1126/science.1153917.
- 43.
Lee T-H、Tang H、Wang X、Paterson A。植物基因和基因组复制数据库。核酸研究,2013年;41(D1):D1152–8。
- 44。
安·S,坦斯利·SD。水稻和玉米基因组的比较连锁图谱。美国国家科学院,1993年;90(17):7980–4.https://doi.org/10.1073/pnas.90.17.7980.
- 45。
赵开,程yh,张c,沉x-j,q-b,guo w等。大豆GMSNRK2家族的基因组鉴定与表征。int j mol sci。2017; 18(9):1834。https://doi.org/10.3390/ijms18091834.
- 46。
弗朗尼诺州。新基因函数源的自适应辐射模型。NAT Genet。2005; 37(6):573-7。https://doi.org/10.1038/ng1579..
- 47。
施纳布尔JC,斯普林格NM,弗里林M。玉米亚基因组的基因组显性分化和古老和持续的基因丢失。美国自然科学院,2011;108(10):4069–74.https://doi.org/10.1073/pnas.1101368108.
- 48。
Garcia N,张W,Wu Y,汇流J.基因扩增后基因表达的演变。基因组Biol Evol。2015; 7(5):1303-12。https://doi.org/10.1093/gbe/evv075..
- 49。
Kaessmann H,Vinckenbosch N,Long M.基于RNA的基因复制:机械和进化见解。NAT Rev Genet。2009; 10(1):19-31。https://doi.org/10.1038/nrg2487.
- 50
侯勇,王勇,唐玲,童欣,王玲,刘玲,等。sapk10介导的WRKY72磷酸化释放其对茉莉酸合成和白叶枯病抗性的抑制。Iscience。2019;16:499 - 510。https://doi.org/10.1016/j.isci.2019.06.009.
- 51
王勇,侯勇,邱杰,王辉,王松,唐磊,等。脱落酸通过'SAPK10-bZIP72-AOC'途径促进茉莉酸生物合成,协同抑制水稻种子萌发(奥雅萨苜蓿). 新植物醇。2020;228(4):1336–53.https://doi.org/10.1111/3/16774.
- 52
盈,张D-F,Li H-Y,Liu Y-H,Shi Y-C,Song Y-C等人。玉米的克隆与表征SNRK2.蛋白激酶基因增强了转基因拟南芥的耐盐性。Plant Cell rep 2011;30(9): 1683-99。https://doi.org/10.1007/s00299-011-1077-z.
- 53
王Y,Li L,YE T,Lu Y,Chen X,Wu Y. ABA对花卉过渡的抑制作用是由Abi5在拟南芥中介导的。J Exp Bot。2013; 64(2):675-84。https://doi.org/10.1093/jxb/sers361.
- 54.
MA Domagalska, Sarnowska E, Nagy F, Davis SJ。赤霉素、脱落酸和油菜素内酯调控花期的相互作用的遗传分析拟南芥.Plos一个。2010; 5(11):E14012。https://doi.org/10.1371/journal.pone.0014012.
- 55.
舒酸,陈Q,吴y,刘r,张h,王S等人。通过直接促进拟南芥开花基因座C转录,脱落酸不敏感4负调节开花。J Exp Bot。2016; 67(1):195-205。https://doi.org/10.1093/jxb/erv459.
- 56.
Zhao L,Youjun吕,陈W,等。棉花(Gossymium)中AHL基因家族的基因组鉴定和分析。BMC基因组学,2020;21(1):69。
- 57.
BG。利用MEGA构建分子系统发育树。中国生物医学工程学报,2013;https://doi.org/10.1093/molbev/mst012.
- 58.
Voorrips RE. MapChart:用于图形表示连锁图谱和qtl的软件。J在这里。2002;93(1):77 - 8。https://doi.org/10.1093/jhered/93.1.77.
- 59.
胡斌,金杰,郭亚英,张赫,罗杰,高庚。gsds2.0:一个升级的基因特征可视化服务器。生物信息学。2015;31(8):1296–7.https://doi.org/10.1093/bioinformatics/btu817.
- 60。
王颖,唐浩,DeBarry JD,谭鑫,李军,王欣,Lee T-h, Jin H, Marler B, Guo H,等。MCScanX:一个用于基因共线性和共线性检测和进化分析的工具包。2012;40(7):e49。https://doi.org/10.1093/nar/gkr1293.
- 61。
Chu VT, Gottardo R, raaftery AE, Bumgarner RE, Yeung KY。MeV+R:在微阵列分析中使用MeV作为生物导体应用的图形用户界面。基因组医学杂志。2008;9 (7):R118。https://doi.org/10.1186/gb-2008-9-7-R118.
- 62。
小Q,王Y,Du J,Li H,Wei B,Wang Y等。ZMMYB14是玉米淀粉生物合成中ZMBT1启动子的活性调节的重要转录因素。FEBS J. 2017; 284(18):3079-99。https://doi.org/10.1111/febs.14179.
- 63。
Cao J,Yao D,Lin F,姜M.PEG介导的肿瘤介质瞬态基因表达和沉默系统在玉米叶片原生质体中:玉米信号转导研究的宝贵工具。acta physiol植物。2014; 36(5):1271-81。https://doi.org/10.1007/s11738-014-1508-x.
- 64.
Yoo S-D,Cho Y-H,Sheen J。拟南芥叶肉原生质体:一个用于瞬时基因表达分析的多功能细胞系统。Nat协议。2007;2(7):1565–72.https://doi.org/10.1038/nprot2007.199.
- 65.
阵伤SJ,弯曲AF。花卉DIP:简化方法农杆菌介断的转换拟南芥.工厂J. 1998; 16(6):735-43。https://doi.org/10.1046/j.1365-313x.1998.00343.x.
- 66.
Stangeland B,Salehian Z。拟南芥胚乳和种子GUS测定方法的改进。《植物分子生物学》2002;20(2):107–14.https://doi.org/10.1007/BF02799426.
致谢
非常感谢Jian-Kang朱博士(上海植物压力生物学中心和CAS卓越中心,中国科学院分子植物科学卓越中心)为提供SNRK2.2 / 2.3和snrk2.2/2.3/2.6型突变体。
资金
国家转基因生物育种重大专项(no . 2016ZX08003-001);四川省科技计划项目(no . 2019YJ0428)。关键词:岩石力学,抗剪强度,抗剪强度资助机构在研究设计、数据收集和分析、数据解释和手稿撰写中没有发挥作用。
作者信息
隶属关系
贡献
Y.B.H和Y.P.L构思并监督了这项研究。Y.P.L和T.D.L设计了实验。T.D.L,B.J.X,Y.Y.W,C.Q.M,Y.B.W进行了实验。T.D.L和B.J.X写了原稿。Y.F.H、J.J.Z、H.M.L和G.W.Y分析了部分数据。Y.H.L,H.H.H,C.Z.Z修改了手稿。所有作者都已阅读并批准了手稿。
相应的作者
道德宣言
道德认可和参与同意
不适用。
出版许可
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
权利和权限
开放存取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
龙涛,徐斌,胡勇。等等。全基因组鉴定ZMSNRK2.玉米ABA信号通路ZMSNRK2.10的基因及功能分析(Zea Mays.l)。BMC植物生物学21,309(2021)。https://doi.org/10.1186/s12870-021-03064-9
收到了:
公认:
出版:
关键词
- 玉米
- 阿坝州
- SnRK2系列
- 进化
- 表达式模式
- ZMSNRK2.10
- 功能分析