- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
在微型玫瑰中的色彩突变中综合代谢组和转录组分析。微型玫瑰中的色彩突变GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba21GydF4y2Ba文章编号:GydF4y2Ba257.GydF4y2Ba(GydF4y2Ba2021GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
玫瑰是全世界着名的装饰植物。花卉着色是玫瑰中最突出的性状之一,主要通过花青素生物合成途径调节。在这项研究中,我们研究了在微型玫瑰中参与颜色突变的花青素生物合成途径的关键基因和代谢物。在海王星王玫瑰及其颜色突变体,女王升起,在盛开的阶段进行比较代谢和转录组分析。海王星王玫瑰有浅粉红色的花瓣,而女王玫瑰有深粉红色的花瓣。GydF4y2Ba
结果GydF4y2Ba
鉴定了总共190种类的类黄酮相关的代谢物和38,551个独特的基因。45种类异质相关代谢物的含量和参与黄酮途径的15个基因的表达,两种品种之间有显着变化。七个花青素(Cyanidin 3-GydF4y2BaO.GydF4y2Ba-glucosyl-malonylglucoside,花青色素GydF4y2BaO.GydF4y2Ba-丁香酸,花青素3-GydF4y2BaO.GydF4y2Ba-rutinoside,Cyanidin 3-GydF4y2BaO.GydF4y2Ba-Galactoside,Cyanidin 3-GydF4y2BaO.GydF4y2Bapeonidin 3 -葡萄糖苷GydF4y2BaO.GydF4y2Ba-glucoside chloride和天竺葵苷3-GydF4y2BaO.GydF4y2Ba-葡萄糖苷(-glucoside))是主要代谢产物,在皇后玫瑰中含量较高。13个花青素合成相关基因在突变体花中表达上调,这可能有利于突变体花中花青素水平的提高。此外,八GydF4y2Ba透明的外种皮12GydF4y2Ba在女王上升发现基因上调,可能有助于花青素的高阳火封存。在两种品种之间差异表达了30个转录因子,包括两种MYB和一个BHLH。GydF4y2Ba
结论GydF4y2Ba
本研究为了解微型玫瑰花色苷生物合成途径的主要基因和代谢产物提供了重要依据。研究结果将有助于调控花青素途径,从而设计出具有特定颜色的微型玫瑰新品种。GydF4y2Ba
背景GydF4y2Ba
纵观人类历史,玫瑰一直具有高度的标志性文化意义。玫瑰被用作园林观赏植物,并被用于食品和化妆品等各个行业。玫瑰品种的花色有很大的差异。在观赏植物中,花的颜色是主要属性,与色素类型的分布密切相关[GydF4y2Ba1GydF4y2Ba].类黄酮、类胡萝卜素、甜菜碱和生物碱等天然色素在形成花朵颜色方面是众所周知的[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba].GydF4y2Ba
特别是黄酮类化合物,作为植物中重要的次生代谢物,越来越受到人们的关注[GydF4y2Ba5.GydF4y2Ba].已知黄酮类化合物在植物生理过程的各个方面发挥重大作用,包括免受紫外线辐射,色素沉着和植物防御的保护[GydF4y2Ba6.GydF4y2Ba].黄酮类化合物是苯丙烷化生物合成途径的产品,其特征在于GydF4y2Ba拟南芥GydF4y2Ba和矮牵牛[GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba].一些基因如苯丙氨酸裂解酶、肉桂酸羟化酶、4-香豆酸-辅酶a连接酶、查尔酮合成酶、查尔酮异构酶、类黄酮3-羟化酶、黄酮醇合成酶、二氢黄酮醇4-还原酶和花青素合成酶参与了不同的途径步骤。花青素是类黄酮途径的最终产物,但它们在细胞质中不稳定,需要进一步糖基化。udp -葡萄糖基转移酶和谷胱甘肽s -转移酶家族基因开始作用[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba].在黄酮类生物合成途径中鉴定了保守的结构基因,但它们的调节机制在植物物种中变化[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba11GydF4y2Ba那GydF4y2Ba12GydF4y2Ba那GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba].GydF4y2Ba
花色作为玫瑰的主要审美特征,育种家们对其研究较早。到目前为止,在玫瑰中发现的黄酮类化合物很少。众所周知,玫瑰花瓣含有花青素,如天竺葵苷、花青素和芍药苷[GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba].与3-糖基化的黄酮醇相关的3,5-二糖基花青素的存在赋予粉红色和红颜色[GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba].三个基因(GydF4y2BaRhGT1GydF4y2Ba那GydF4y2BaRhGT2GydF4y2Ba, 和GydF4y2BaRhGT3GydF4y2Ba发现编码黄酮醇3-糖基转移酶参与形成花青素苷糖苷的形成[GydF4y2Ba20.GydF4y2Ba].由于调控花青素途径的几个结构基因和转录因子(TF)尚未被报道,我们对玫瑰花色机制的了解还很不完整。此外,现代玫瑰中存在的巨大变异可能表明不同玫瑰之间颜色形成的分子机制不同[GydF4y2Ba21GydF4y2Ba那GydF4y2Ba22GydF4y2Ba].各种高质量基因组GydF4y2Ba罗莎GydF4y2Ba现在可以提供物种,并将促进对这些植物的基本研究[GydF4y2Ba23GydF4y2Ba那GydF4y2Ba24GydF4y2Ba那GydF4y2Ba25GydF4y2Ba].虽然已经克隆出了一些与玫瑰花色有关的基因,但由于缺乏可以进行比较研究的突变体,因此无法清楚地了解花青素途径的调控[GydF4y2Ba26GydF4y2Ba那GydF4y2Ba27GydF4y2Ba那GydF4y2Ba28GydF4y2Ba那GydF4y2Ba29GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba31GydF4y2Ba那GydF4y2Ba32GydF4y2Ba那GydF4y2Ba33GydF4y2Ba那GydF4y2Ba34GydF4y2Ba那GydF4y2Ba35GydF4y2Ba那GydF4y2Ba36GydF4y2Ba那GydF4y2Ba37GydF4y2Ba那GydF4y2Ba38GydF4y2Ba].GydF4y2Ba
了解修改着色剂的遗传和分子机制不仅会回答涉及基本玫瑰生物学的迷人查询,而且还允许操纵玫瑰质。通过整合代谢物和转录组分析,研究人员已经确定了植物中的关键代谢物和基因(结构或TF)调节颜色形成。在这项研究中,我们使用了微型玫瑰品种(海王星王)及其天然色彩突变体(女王),并研究了影响其花瓣中的花青素组合物的分子变化。GydF4y2Ba
结果GydF4y2Ba
花瓣样品的代谢组分析GydF4y2Ba
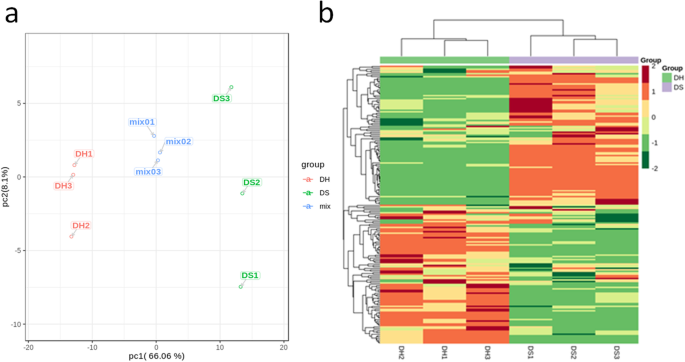
新鲜花瓣从微细的玫瑰品种海王星国王(H)有浅粉色的颜色和它的自然色突变皇后(S)显示深粉色的颜色收集(图。GydF4y2Ba1GydF4y2Baa, b).采用超高效液相色谱-质谱联用(UPLC-MS/MS)对花瓣样品进行黄酮类化合物含量分析。H花和S花的类黄酮谱有显著差异(图)GydF4y2BaS1GydF4y2Ba和GydF4y2BaS2GydF4y2Ba、补充材料)。使用局部代谢物数据库,鉴定了总共190种类化合物相关的代谢物,其中包括18个花青素,61个黄酮醇,8二氢酚,3二氢烷烃,12种黄酮碳糖苷,7例,其他类黄酮,11个原花青素,1个螯合酶和2个单宁(桌子GydF4y2BaS1GydF4y2Ba、补充材料)。我们使用代谢物量化数据构建一个层次聚类热图。结果显示,生物重复之间有密切的关系,这是高质量代谢组量化的标志(图。GydF4y2Ba2GydF4y2Baa,b)。此外,可以观察到H和S花瓣样品的清晰分离,表明H和S样品中的不同的黄酮谱。GydF4y2Ba
H和S花瓣样品之间的差异累积代谢物(dam)是基于预测≥1和fold change≥2或≤0.5的变量重要性来确定的。比较样品中有45种代谢物的积累差异显著,其中差异积累的类黄酮(DAFs)主要是花青素、其他类黄酮、原花青素和黄酮醇(表)GydF4y2Ba1GydF4y2Ba).特别是七种花青素,即花青素3-GydF4y2BaO.GydF4y2Ba-glucosyl-malonylglucoside,花青色素GydF4y2BaO.GydF4y2Ba-丁香酸,花青素3-GydF4y2BaO.GydF4y2Ba-rutinoside,Cyanidin 3-GydF4y2BaO.GydF4y2Ba-Galactoside,Cyanidin 3-GydF4y2BaO.GydF4y2Bapeonidin 3 -葡萄糖苷GydF4y2BaO.GydF4y2Ba-glucoside chloride和天竺葵苷3-GydF4y2BaO.GydF4y2Ba-葡萄糖苷在S品种中含量显著高于H品种。花色素的量GydF4y2BaO.GydF4y2Ba在S栽培品种中溶性酸高,但在H栽培品种中不可检测。另外,Cyanidin 3-的含量GydF4y2BaO.GydF4y2Ba-葡萄糖-丙二酰葡萄糖苷在H品种中的积累量低于S品种。结果表明,这些花青素可能在S花的深粉色形成中起关键作用。因此,S品种中芍药苷、天竺葵苷和花青素衍生物的大量积累可能导致其颜色相关变化。GydF4y2Ba
转录组测序和分析GydF4y2Ba
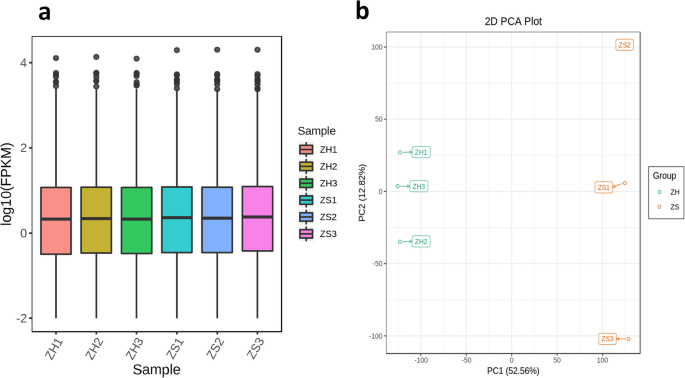
在两个品种的花瓣样品中进一步分析了整体基因表达。从6个cDNA文库(每个样本3个生物重复)中,我们总共获得了47.52 Gb的干净数据,其中超过91%的碱基评分Q30(见表)GydF4y2BaS2GydF4y2Ba、补充材料)。图书馆有46,782,302-55,533,348清洁读数,它成功映射到了GydF4y2Ba罗莎对GydF4y2Ba基因组(GydF4y2Bahttps://lipm-brows -sers.toulouse.inra.fr/pub/rchiobhm-v2/GydF4y2Ba),匹配率在80.49%-82.12%的范围内。因此,鉴定了5,149个新基因,发现1,303个独特的基因在玫瑰花瓣中表达(表GydF4y2BaS3.GydF4y2Ba、补充材料)。在玫瑰样品中共检测到38551个基因,根据外显子模型每千碱基片段每百万reads图谱值法估计其表达水平(图)。GydF4y2Ba3.GydF4y2Ba一张桌子GydF4y2BaS4GydF4y2Ba、补充材料)。基于转录组的主成分分析(PCA)数据显示H和S样本有明显的区别,这与基于代谢组分析的结果相似(图)。GydF4y2Ba3.GydF4y2Bab).这表明两种表型中的dam受差异表达基因(DEGs)的调控。共4298个基因,其中上调基因1851个,下调基因2447个(图)GydF4y2BaS2GydF4y2Ba,在样品之间鉴定补充材料)。GydF4y2Ba
类黄酮生物合成途径相关基因的表达GydF4y2Ba
分析了类黄酮生物合成途径相关基因的表达模式。共有150个基因被分配到该途径(表)GydF4y2BaS5GydF4y2Ba、补充材料)。H和S数据比较,发现有15个类黄酮相关基因差异表达。除ANS外,所有参与花青素生物合成途径的基因在S品种中均上调,这可能是颜色相关变化的决定因素(表)GydF4y2Ba2GydF4y2Ba).GydF4y2Ba
转录因子的表达模式GydF4y2Ba
MYB和bHLH是已知的控制花青素生物合成结构基因表达水平的特殊转录因子(TF) [GydF4y2Ba39GydF4y2Ba].因此,我们搜索或编码两种品种之间的DEG。鉴定了30次编码TFS。在这些TFS中,我们确定了一个bhlh(GydF4y2BaRchiOBHmChr1g0361301GydF4y2Ba)及两份MYB (GydF4y2BaRchiobhmchr1g0373541GydF4y2Ba和GydF4y2BaRchiOBHmChr1g0361191GydF4y2Ba) (桌子GydF4y2Ba3.GydF4y2Ba).GydF4y2BaRchiOBHmChr1g0361301GydF4y2Ba(bHLH)和GydF4y2BaRchiOBHmChr1g0361191GydF4y2Ba(MYB)基因在S品种中表达强烈上调,表明花色苷生物合成结构基因正调控GydF4y2Ba.GydF4y2Ba相比之下,GydF4y2BaRchiobhmchr1g0373541GydF4y2Ba(MYB)根本没有表达S品种的花瓣,但在H栽培品种的花瓣中表达。该转录物的序列的比较在两个品种中没有显示出任何核苷酸变化,因此可能在调节区域发生突变。GydF4y2Ba
MATE和ABCC基因家族成员的表达模式GydF4y2Ba
据报道,多药和有毒复合挤出(配合)和ATP结合盒式传输器子的成员GydF4y2Ba家庭GydF4y2BaC (ABCC)家族在花青素从细胞质到液泡的隔离中发挥着优势作用[GydF4y2Ba40GydF4y2Ba那GydF4y2Ba41GydF4y2Ba].因此,我们扩展了我们对微型玫瑰花瓣中ABCC和MATE基因的表达模式的研究。在H和S样品中发现总共55和64 ABCC和伴侣基因。在两个样品之间差异表达ABCC基因。相比之下,鉴定了10个配偶的次伴侣,其中H样品中的8个下调和2个上调的伴基因(表GydF4y2BaS6GydF4y2Ba、补充材料)。H样品中大量下调的MATE基因表明花色苷在花瓣液泡中被弱隔离。GydF4y2Ba
花青素相关基因表达模式的qRT-PCR验证GydF4y2Ba
为了进一步验证RNA-SEQ结果,选择与花青素生物合成相关的九次,并使用QRT-PCR在坯开花阶段的H和S瓣中分析它们的表达水平。基因的引物序列如表所示GydF4y2BaS7GydF4y2Ba,补充材料。结果证实了花青素的生物合成和调控基因,包括GydF4y2BaDFR.GydF4y2Ba(GydF4y2BaRchiobhmchr5g0037071.GydF4y2Ba那GydF4y2BaRchiobhmchr6g0281711.GydF4y2Ba),GydF4y2BachGydF4y2Ba(GydF4y2BaRchiOBHmChr1g0372181GydF4y2Ba),GydF4y2BaBZ1.GydF4y2Ba(GydF4y2BaRchiOBHmChr4g0393121GydF4y2Ba那GydF4y2BaRchiOBHmChr6g0302721GydF4y2Ba),GydF4y2BaUGT79B1GydF4y2Ba(GydF4y2BaRchiobhmchr5g0009571.GydF4y2Ba),GydF4y2BamyGydF4y2Ba(GydF4y2BaRchiOBHmChr6g0252211GydF4y2Ba那GydF4y2BaRchiOBHmChr7g0241861GydF4y2Ba), 和GydF4y2BabHLHGydF4y2Ba(GydF4y2BaRchiOBHmChr1g0361301GydF4y2Ba)在S品种的花瓣中上调(图GydF4y2BaS3.GydF4y2Ba、补充材料)。我们注意到QRT-PCR和RNA-SEQ结果之间的完全一致性,表明该研究中的RNA-SEQ数据和DEG分析可靠。GydF4y2Ba
代谢物和转录组的关联分析GydF4y2Ba
为了证明坝和灰度的合成和调节特性,构建子网以显示转录物代谢相关性。在分析中考虑仅考虑具有相关系数> 0.8的对。GydF4y2Ba
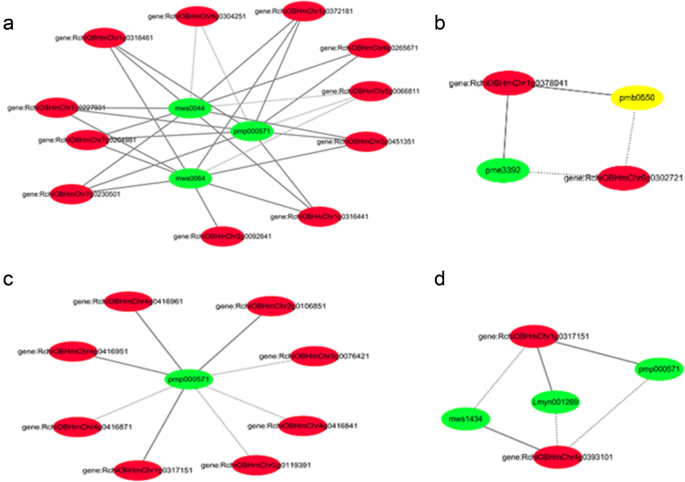
构建了4个转录-代谢物相关网络。其中Ko00941由15个节点和31条边组成,26对正相关,5对负相关(图2)。GydF4y2Ba4.GydF4y2Baa). Ko00942由5个节点和6条边组成,其中4对为正相关,2对为负相关(图2)。GydF4y2Ba4.GydF4y2Bab,补充材料)。Ko00943由9个节点和8条边组成,其中4对为正相关,4对为负相关(图2)。GydF4y2Ba4.GydF4y2Bac). Ko00944由5个节点和6条边组成,其中3对为正相关,3对为负相关(图3)。GydF4y2Ba4.GydF4y2Bad).类黄酮生物合成相关基因-代谢产物对的详细信息列于表中GydF4y2BaS8-1-S8-4GydF4y2Ba,补充材料。GydF4y2Ba
这些结果表明,几个经典的花色素相关基因与其相应的代谢产物高度相关,这些代谢产物参与类黄酮的生物合成,从而再次证实了类黄酮生物合成在花颜色中的重要性。GydF4y2Ba
玫瑰花青素生物合成和积累的调控GydF4y2Ba
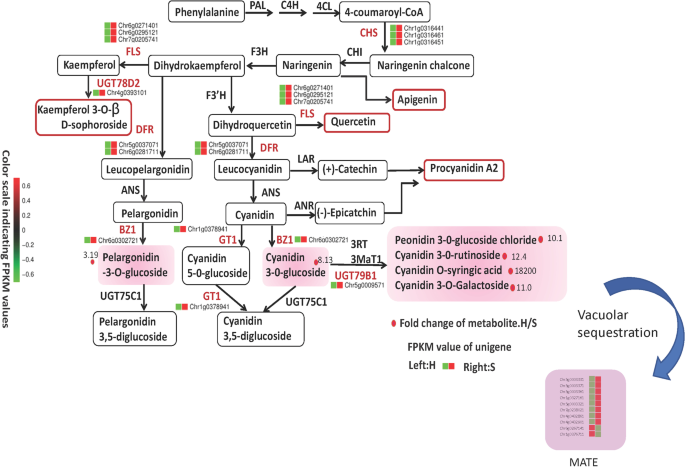
类黄酮途径从查尔酮合成酶(CHS)开始,由4-香豆蔻酰辅酶a和丙二酰辅酶a合成柚皮素查尔酮。然后,通过查尔酮异构酶(CHI)将柚皮素查尔酮异构化为柚皮素。柚皮素通过黄酮3-羟化酶(F3H)转化为二氢山奈酚。再通过类黄酮3 ' -羟化酶(F3 ' h)或类黄酮3 ',5 ' -羟化酶(F3 ' 5 ' h),二氢山酚可进一步羟基化成二氢槲皮素或二氢杨梅素。这些二氢黄酮醇通过二氢黄酮醇4-还原酶(DFR)转化为无色无色花青素,再通过花青素合酶(ANS)转化为有色花青素。最后,花青素被不同的糖基转移酶修饰和糖基化,包括类黄酮3- o -糖基转移酶(UFGT) [GydF4y2Ba19GydF4y2Ba].GydF4y2Ba
在此基础上,我们重建了微型玫瑰花青素的生物合成途径。将鉴定出的花青素及其相关中间体重新排列到相应位置(图)。GydF4y2Ba5.GydF4y2Ba).花青素生物合成的关键基因在S品种的花瓣中显著上调,这与S品种花青素的高积累相一致GydF4y2BaCHS.GydF4y2Ba那GydF4y2BaDFR.GydF4y2Ba那GydF4y2Ba霉GydF4y2Ba那GydF4y2BaBZ1.GydF4y2Ba那GydF4y2BaGT1,UGT78D2,GydF4y2Ba和GydF4y2BaUGT79B1GydF4y2Ba同时,MATE基因的高表达水平在刺激花青素的合成和积累中起着关键作用,包括花青素o -丁香酸、花青素3- o -芦丁苷、花青素3- o -半乳糖苷、花青素3- o -葡萄糖苷、花青素3- o -葡萄糖苷和天竺葵苷3-GydF4y2BaO.GydF4y2Ba-葡萄糖苷,使S品种呈深粉色。GydF4y2Ba
讨论GydF4y2Ba
花的美学特征在兰花的观赏品质和商业价值中具有核心重要性。花色是生物学研究的重点[GydF4y2Ba42GydF4y2Ba那GydF4y2Ba43GydF4y2Ba那GydF4y2Ba44GydF4y2Ba[已经表明,在色素沉着中存在特异性特异性特异性。为有助于现有的知识,需要对花卉颜色形成的特异性研究以及特定调节机制的阐明。在本研究中,我们调查了两种不同的花表型颜色形成的潜在机制,微型玫瑰品种海王星国王及其突变体,女王玫瑰。GydF4y2Ba
花青素分布对两朵玫瑰品种花色的影响GydF4y2Ba
检测到总共190种类的类黄酮相关的代谢物,并分为八个亚组,其中包括18个花青素和11个原霉素。这提供了在微型玫瑰中参与花色中的代谢物的最完整视图。之前的学习 [GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba那GydF4y2Ba45GydF4y2Ba那GydF4y2Ba46GydF4y2Ba]对玫瑰着色过程的影响仅限于几种类黄酮代谢产物。花青素和黄酮醇的组成决定了花的不同表型[GydF4y2Ba47GydF4y2Ba那GydF4y2Ba48GydF4y2Ba].对突变体蚁后的分析表明,该突变体具有多种黄酮类化合物大量积累的特点。在本研究中,我们检测了45种不同的类黄酮相关代谢产物,其中包括7种花青素。结果表明,花青素GydF4y2BaO.GydF4y2Ba-丁香酸,花青素3-GydF4y2BaO.GydF4y2Ba-rutinoside,Cyanidin 3-GydF4y2BaO.GydF4y2Ba-Galactoside,Cyanidin 3-GydF4y2BaO.GydF4y2Bapeonidin 3 -葡萄糖苷GydF4y2BaO.GydF4y2Ba-glucoside chloride和天竺葵苷3-GydF4y2BaO.GydF4y2Ba-葡萄糖苷在突变体花中积累较多。因此,花青素衍生物可以被认为是引起颜色变化的关键花青素。据报道,花青素和牡丹素是橙色到红色的主要成分[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba49GydF4y2Ba那GydF4y2Ba50GydF4y2Ba那GydF4y2Ba51GydF4y2Ba那GydF4y2Ba52GydF4y2Ba那GydF4y2Ba53GydF4y2Ba那GydF4y2Ba54GydF4y2Ba].GydF4y2Ba
花青素的内容被认为是具有粉红色或浅红色花朵的转基因烟草的主要因素[GydF4y2Ba55GydF4y2Ba那GydF4y2Ba56GydF4y2Ba那GydF4y2Ba57GydF4y2Ba那GydF4y2Ba58GydF4y2Ba那GydF4y2Ba59GydF4y2Ba].类似地,Cyanidin和PeoNidin已被证明是对各种植物中的红颜色负责,例如树牡丹,草莓,苹果,GydF4y2Ba菊花GydF4y2Ba那GydF4y2Ba杜鹃花GydF4y2Ba和GydF4y2Ba李属却已GydF4y2Ba[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba60GydF4y2Ba那GydF4y2Ba61GydF4y2Ba那GydF4y2Ba62GydF4y2Ba那GydF4y2Ba63GydF4y2Ba].此外,几种类黄酮代谢物的组合导致共色素沉着效果,这导致更深的颜色[GydF4y2Ba64GydF4y2Ba那GydF4y2Ba65GydF4y2Ba那GydF4y2Ba66GydF4y2Ba].在目前的工作中,一种木犀草素衍生物、三种山酚、三种槲皮素衍生物和一种芹菜素的水平在S样本中同时增加,这表明在突变的皇后玫瑰中观察到的深粉色是一种共色素作用。GydF4y2Ba
影响两个玫瑰品种花色苷的主要相关基因GydF4y2Ba
最近,高通量RNA-SEQ已广泛用于玫瑰的研究[GydF4y2Ba67GydF4y2Ba那GydF4y2Ba68GydF4y2Ba那GydF4y2Ba69GydF4y2Ba那GydF4y2Ba70GydF4y2Ba].控制花朵着色的途径在植物中适当地表征,包括玫瑰[GydF4y2Ba71GydF4y2Ba那GydF4y2Ba72GydF4y2Ba].然而,由于以玫瑰观察到的广泛遗传变化,预期了颜色形成的变化机制。GydF4y2Ba
在该研究中,分析了海王星王的转录组及其颜色突变体,鉴定了影响颜色形成的差异表达的黄酮类生物合成基因。RNA-SEQ的结果表明,在S花黄酮类生物合成途径中表达的基因表达显着增加,这强烈支持我们代谢分析的结果。我们的研究结果表明了基因的上调表达如GydF4y2BaChs, dfr, bz1, ugt79b1, gt1, ugt78d2, fls,GydF4y2Ba和GydF4y2Baif7mat.GydF4y2Ba在与H相比,暗示这些基因的高表达是突变花朵中的花青素累积的直接原因。在先前的报告中,早期或晚期生物合成基因的表达通常与花青素含量正相关[GydF4y2Ba73GydF4y2Ba那GydF4y2Ba74GydF4y2Ba那GydF4y2Ba75GydF4y2Ba那GydF4y2Ba76GydF4y2Ba那GydF4y2Ba77GydF4y2Ba那GydF4y2Ba78GydF4y2Ba那GydF4y2Ba79GydF4y2Ba那GydF4y2Ba80GydF4y2Ba].GydF4y2Ba
CHS是催化转化的主要速率限制酶GydF4y2BaP.GydF4y2Ba-香豆素辅酶a和丙二酰辅酶a在类黄酮生物合成中合成四羟基查尔酮。弱的表达GydF4y2BaCHS.GydF4y2Ba抑制花青素的生物合成,导致植物组织的颜色变化。的变化GydF4y2BaCHS.GydF4y2Ba表达水平赋予海棠花和北极芥菜花颜色多态性[GydF4y2Ba81GydF4y2Ba那GydF4y2Ba82GydF4y2Ba].在目前的工作中,我们推断出高度表达水平GydF4y2BaCHS.GydF4y2Ba在S花中将提供足够的前体化合物,用于更高的花青素含量。GydF4y2Ba
DFR被认为是花青素生物合成中的关键后期酶。DFR催化Dihydroquercetin的转化为Loucohogyanins,其可以为花青素途径供应类黄酮。调制GydF4y2BaDFR.GydF4y2Ba表达水平导致在植物中改变花青素水平和色素沉着GydF4y2BaDianthus Caryophyllus.GydF4y2Ba那GydF4y2Ba拟南芥GydF4y2Ba,crabapples和rubellis [GydF4y2Ba83GydF4y2Ba那GydF4y2Ba84GydF4y2Ba那GydF4y2Ba85GydF4y2Ba那GydF4y2Ba86GydF4y2Ba那GydF4y2Ba87GydF4y2Ba那GydF4y2Ba88GydF4y2Ba那GydF4y2Ba89GydF4y2Ba].GydF4y2Ba
花青素极不稳定,易退化;因此,糖基化对稳定和运输这些化合物到液泡至关重要,在液泡中,它们可以作为色素发挥作用。这种糖基化作用是由GydF4y2BaUFGTGydF4y2Ba基因(GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba90GydF4y2Ba].在本研究中,GydF4y2BaRhGT1GydF4y2Ba表达在S花中上调,这可能会考虑深粉色。根据我们的研究,Griesser等。[GydF4y2Ba91GydF4y2Ba]证明了一个下调GydF4y2BaGT1GydF4y2Ba导致成熟草莓果实中的花青素颜料显着减少。GydF4y2Ba
MYB和bHLH是调控花青素生物合成结构基因表达的主要转录因子[GydF4y2Ba39GydF4y2Ba].在这项研究中,我们确定了三个可以进一步调查的关键基因,以便于在微型玫瑰中调制颜色。GydF4y2Ba
伴侣基因的下调可以降低H花液中的花青素螯合GydF4y2Ba
花青素,特别是疏水苷元形式,由于其高化学反应活性,是细胞机械的有毒分子。因此,合成后,立即触发花青素去除机制,导致中央液泡的隔离。花青素的高液泡积累是植物组织中观察到的颜色表型。MATE和ABCC成员已被报道为参与液泡中花青素隔离的关键基因[GydF4y2Ba40GydF4y2Ba那GydF4y2Ba41GydF4y2Ba].Debeaujon等人。[GydF4y2Ba40GydF4y2Ba]是第一个发现该基因的GydF4y2Ba透明Testa12.GydF4y2Ba(GydF4y2BaTT12GydF4y2Ba),这是拟南芥种皮内皮细胞液泡中类黄酮隔离所必需的。后来,GydF4y2BaTT12GydF4y2Ba已被鉴定,孤立和功能验证,如芸苔,葡萄藤和蓝莓等各种植物种类[GydF4y2Ba92GydF4y2Ba那GydF4y2Ba93GydF4y2Ba那GydF4y2Ba94GydF4y2Ba].在这项研究中,我们确定了八个GydF4y2BaTT12GydF4y2Ba这表明这些基因可能是导致花青素大量积累的重要原因。GydF4y2Ba
结论GydF4y2Ba
在该研究中,与其野生型相比,在玫瑰突变体中观察到更高的不同类黄酮和基因表达模式中的改变。该突变诱导参与花青素合成途径,糖基化和封存的关键基因的显着上调,导致S品种中显着增加的花青素积累和较深的花朵着色。候选结构基因的功能表征以及三个主要的转录因子将继续。GydF4y2Ba
方法GydF4y2Ba
植物材料及取样GydF4y2Ba
在辽宁省农业科学院沈阳(41°48′11.75″N, 123°25′31.18″E)栽培迷你月玫瑰品种海王(H)及其自然突变体皇后(S)。植物材料的正式鉴定由孙红梅教授负责。植物保存于沈阳农业大学园艺学院,教育部和辽宁省设施园艺重点实验室。采集花瓣样品进行代谢组学研究、RNA-Seq和qRT-PCR分析。每个样本采集3个生物重复,随机从同一批次的10株植物中采集10朵花。这些花瓣被冷冻在液氮中,保存在−80°C直到下次使用。用于代谢组分析的H和S样本分别命名为DH和DS,用于RNA-seq分析的H和S样本分别命名为ZH和ZS。GydF4y2Ba
样品制备和提取GydF4y2Ba
类黄酮代谢物按照以前的方案提取[GydF4y2Ba65GydF4y2Ba,只做了一些修改。花瓣样品真空冷冻干燥,并使用研磨机(1.5分钟,30赫兹)研磨成粉末。将粉末(0.1 g)称重并溶解在70%甲醇水溶液中。为了提高提取效率,将溶解的样品旋转3次,然后在4°C下保存过夜。上清液经10000 ×离心后,用孔径为0.22 μm的微孔膜过滤GydF4y2BaGGydF4y2Ba, 10分钟),并保存在进样瓶中,用于超高效液相色谱-质谱/质谱分析。GydF4y2Ba
黄酮类化鉴定,量化和数据分析GydF4y2Ba
通过UPLC-MS / MS系统(Shim-Pack UFLC Shimadzu CBM30A和应用生物系统6500 Qtrap)分析所有样品。预定的多反应监测方法用于代谢地定量。GydF4y2Ba
基于自建MWDB数据库(Metuke Biotechnology Co.,Ltd。,武汉,中国)和代谢物信息的公共数据库,使用分析师1.6.3的基本和次要MS记录进行了定性分析。将鉴定的含量差异差异的代谢物设置为0.5≥折叠变化≥0或折叠变化≥2,GydF4y2BaP.GydF4y2Ba-value < 0.05, VIP≥1为daf。最后,KEGG通路数据库(GydF4y2Bahttp://www.kegg.jp/kegg/pathway.htmlGydF4y2Ba)和MWDB以代谢反应和串联可能的代谢途径为中心。GydF4y2Ba
RNA提取、定量和测序GydF4y2Ba
从花瓣样本中提取RNA,并按照Dossa等详细的程序进行定量和测序[GydF4y2Ba95GydF4y2Ba那GydF4y2Ba96GydF4y2Ba].在Illumina Hiseq 4000平台的标准程序后制备代表收集的H和S花瓣样品的六种文库(分别为三种生物重复)。GydF4y2Ba
转录组数据分析GydF4y2Ba
使用FASTQC具有默认参数,通过删除适配器和低质量读取来清除原始数据。然后,清洁读数被映射到GydF4y2Bar对GydF4y2Ba基因组(GydF4y2Bahttps://lipm-brows -sers.toulouse.inra.fr/pub/rchiobhm-v2/GydF4y2Ba)使用HISAT工具。外显子模型每千碱基每百万reads图谱值的片段用于基因/转录本测量。差异表达基因(DEG)分析采用DESeq2工具。基因与|日志GydF4y2Ba2GydF4y2Ba折叠变化|≥1和aGydF4y2BaP.GydF4y2Ba-value < 0.05,被描述为DEGs [GydF4y2Ba96GydF4y2Ba].在R包' clusterProfiler '中对DEGs进行GO和KEGG富集分析。GydF4y2Ba
存在分析GydF4y2Ba
利用qRT-PCR技术筛选出9个花青素相关基因。qRT-PCR是根据测序所用的相同RNA样本进行的[GydF4y2Ba95GydF4y2Ba].的基因GydF4y2Ba施GydF4y2Ba作为转录本表达正常化的内部对照。引物对使用primer 5工具设计。使用SuperScript™III First-Strand Synthesis SuperMix for qRT-PCR (Invitrogen公司)合成cdna。qRT-PCR在ABI 7500 Fast实时检测系统(Applied Biosystems)上进行。反应混合物包括:5 μl FastStart Universal SYBR Green Master (Roche Life Sciences)、2 μM引物混合物、2 μl稀释后的1:10 cDNA和ddHGydF4y2Ba2GydF4y2Ba将O加入10μl的最终体积。将循环条件设定如下:95℃,10分钟,40℃,15℃,60℃,1分钟。该实验是用三个生物重复和三种技术重复进行的。根据2分析数据GydF4y2Ba−∆∆GydF4y2BaCGydF4y2BaT.GydF4y2Ba方法(GydF4y2Ba97GydF4y2Ba].GydF4y2Ba
可用性数据和材料GydF4y2Ba
RNA-SEQ数据已提交给NCBI SRA:PRJNA684357。GydF4y2Ba
缩写GydF4y2Ba
- 答:GydF4y2Ba
-
花青素合成酶GydF4y2Ba
- Chi:GydF4y2Ba
-
查耳酮异构酶GydF4y2Ba
- CHS:GydF4y2Ba
-
Chalcone合成酶GydF4y2Ba
- DAF:GydF4y2Ba
-
不同的类黄酮积累GydF4y2Ba
- 大坝:GydF4y2Ba
-
不同代谢物积累GydF4y2Ba
- 度:GydF4y2Ba
-
差异表达基因GydF4y2Ba
- DFR:GydF4y2Ba
-
二氢烷醇4-还原酶GydF4y2Ba
- F3h:GydF4y2Ba
-
黄酮类化合物3-羟化酶GydF4y2Ba
- 读者:GydF4y2Ba
-
黄酮醇合成酶GydF4y2Ba
- 去:GydF4y2Ba
-
基因本体论GydF4y2Ba
- GT:GydF4y2Ba
-
花青素5,3 -GydF4y2BaO.GydF4y2Ba葡糖基转移酶GydF4y2Ba
- KEGG:GydF4y2Ba
-
京都基因和基因组百科全书GydF4y2Ba
- Kog:GydF4y2Ba
-
真核外科群体GydF4y2Ba
- OPLS-DA:GydF4y2Ba
-
正交偏最小二乘判别分析GydF4y2Ba
- PC1:GydF4y2Ba
-
第一个主要成分GydF4y2Ba
- 主成分分析:GydF4y2Ba
-
主成分分析GydF4y2Ba
- QRT-PCR:GydF4y2Ba
-
定量实时聚合酶链反应GydF4y2Ba
- RNA-SEQ:GydF4y2Ba
-
RNA序列GydF4y2Ba
- UGT:GydF4y2Ba
-
UDP-葡糖糖基转移酶GydF4y2Ba
- UPLC-MS /女士:GydF4y2Ba
-
超高效液相色谱-串联质谱GydF4y2Ba
- 贵宾:GydF4y2Ba
-
投影中的可变重要性GydF4y2Ba
参考文献GydF4y2Ba
- 1.GydF4y2Ba
赵东,陶杰。观赏植物花色发育与调控的研究进展。植物学报。2015;6:261。GydF4y2Ba
- 2.GydF4y2Ba
王林生,白石一,桥本F,青木N,坂田安。中、日两种牡丹品种花瓣花色苷含量的研究。植物学报2001;114:33-43。GydF4y2Ba
- 3.GydF4y2Ba
马凯飞,张启新,程天良,闫晓莉,潘海涛,王杰。观赏树花色嵌合的表观遗传变异GydF4y2Ba李属却已GydF4y2Ba通过单碱基分辨率甲基组检测和转录组测序揭示。中华医学杂志。2018;19:2315。GydF4y2Ba
- 4.GydF4y2Ba
朱海红,杨建新,肖春华,毛天宇,张军,张海英。黄酮途径代谢产物及其转录本对水生植物黄色花瓣颜色的影响GydF4y2BaNelumbo NuciferaGydF4y2Ba.BMC Plant Biol. 2019;19:277。GydF4y2Ba
- 5.GydF4y2Ba
Ferrer JL,Austin MB,Stewart C,Noel JP。苯丙醇苯甲酸生物合成酶的结构和功能。植物理性生物化学。2008; 46:356-70。GydF4y2Ba
- 6.GydF4y2Ba
黄酮作为花色素:自然光谱的形成及其基因工程的扩展。植物育种。1991;106(1):1-26。GydF4y2Ba
- 7.GydF4y2Ba
Saito K,Yonekura-Sakakibara K,Nakabayashi R,Higashi Y,Yamazaki M,Tohge T,Fernie AR。拟南芥的类黄酮生物合成途径:结构和遗传多样性。植物理性生物化学。2013; 72:21-34。GydF4y2Ba
- 8.GydF4y2Ba
Holton Ta,Brugliera F,Tanaka Y. Flavonol合成酶的克隆和表达GydF4y2Ba佩妮矮牵牛GydF4y2Ba.工厂J.2010; 4:1003-10。GydF4y2Ba
- 9.GydF4y2Ba
黄志强。果实花色苷生物合成调控的新见解。植物生态学报。2013;18:477-83。GydF4y2Ba
- 10。GydF4y2Ba
黄酮类化合物的生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物理疗。2001;126:485 - 93。GydF4y2Ba
- 11.GydF4y2Ba
植物色素的遗传与生物化学。植物学报2006;57:761-80。GydF4y2Ba
- 12.GydF4y2Ba
戴维斯,km,schwinn ke。花卉颜料的分子生物学和生物技术。植物Dev Biol Biotech持续。2010年:161-87。GydF4y2Ba
- 13.GydF4y2Ba
陈梦晨,季涛,张杰,林克婷,张婷婷,李云丛。不同叶色苹果二氢黄酮醇4-还原酶基因启动子的特性。贺南洪杂志2017;4:17070。GydF4y2Ba
- 14.GydF4y2Ba
bHLH和MYB结构域蛋白的分析:种特异性调控差异是由靶花青素基因的不同进化引起的。植物j . 1998; 13:475 - 88。GydF4y2Ba
- 15.GydF4y2Ba
Arisumi K. Rosa的花色研究,特别是生化和遗传分析,以及这些结果在实际育种中的应用I. Gakugei Zasshi Kyushu Daigaku Nogakubu. 1963; 20:131-49。GydF4y2Ba
- 16.GydF4y2Ba
月季花色的研究,特别是生化和遗传分析,以及这些结果在实际育种中的应用。学艺社九州杂志代乐能学部1964;21:169-84。GydF4y2Ba
- 17.GydF4y2Ba
黄志强,王志强。玫瑰色素的化学性质。angreen Chem Int Ed Engl. 1991; 30:654-72。GydF4y2Ba
- 18.GydF4y2Ba
Biolley JP,Jay M.在现代玫瑰的花青素 - 化学和比色特征与颜色范围有关。J Exp B. 1993; 44:1725-34。GydF4y2Ba
- 19.GydF4y2Ba
杨志刚,田志刚,田志刚,等。玫瑰花青素的生物合成。植物化学学报。大自然。2005;435:757-8。GydF4y2Ba
- 20.GydF4y2Ba
Fukuchi-Mizutani M,Akagi M,Ishiguro K,Katsumoto Y,Fukui Y,Togami J,Nakamura N,Tanaka Y.罗斯×杂交菌的花青素/黄酮醇3-葡糖基化途径的生化和分子表征。植物生物技术。2011; 28:239-44。GydF4y2Ba
- 21.GydF4y2Ba
黄酮类化合物在生物化学途径调控和进化中的作用。植物科学进展。2005;10:236-42。GydF4y2Ba
- 22.GydF4y2Ba
Jing M, Fougère-Danezan M, Zhang LB, Li DZ, Yi TS. untangelorigin of Chinese tea roses: a DNA sequence of单拷贝核和叶绿体基因。植物系统。2011;297:157 - 70。GydF4y2Ba
- 23.GydF4y2Ba
Nakamura N, Hirakawa H, Sato S, Otagaki S, Matsumoto S, Tabata S, Tanaka Y.基因组结构GydF4y2Ba罗莎·莫比林GydF4y2Ba它是栽培玫瑰的野生祖先。DNA研究》2017;25:113-21。GydF4y2Ba
- 24.GydF4y2Ba
Raymond O, Gouzy J, Just J, Badouin H, Verdenaud M, Lemainque A, Vergne P, Moja S, Choisne N, Pont C. Rosa基因组为现代玫瑰的驯化提供了新的视角。Nat麝猫。2018;50:772-7。GydF4y2Ba
- 25。GydF4y2Ba
中国蔷薇(Rosa chinensis)的高质量基因组序列。Nat植物。2018;4:473 - 84。GydF4y2Ba
- 26。GydF4y2Ba
娄强,刘艳,齐勇,焦松,田芳,姜玲,王颖。转录组测序和代谢产物分析揭示飞燕素代谢对葡萄风信子花色的影响。J Exp Bot. 2014;65:3157。GydF4y2Ba
- 27。GydF4y2Ba
Matus JT。葡萄果实的转录组和代谢组网络表明,对抗紫外线辐射需要的不仅仅是类黄酮。植物科学学报2016;7:1337。GydF4y2Ba
- 28。GydF4y2Ba
Wang Z, Cui Y, Vainstein A, Chen S, Ma h (GydF4y2Ba无花果GydF4y2BaL.)果子颜色:类黄酮生物合成途径的代谢组和转录组分析。前植物SCI。2017; 8:1990。GydF4y2Ba
- 29。GydF4y2Ba
转录组分析揭示了与“Red Bartlett”(红色巴特利特)褪色相关的候选基因GydF4y2BaPyrus Communis.GydF4y2Bal .)。前植物SCI。2017; 8:455。GydF4y2Ba
- 30.GydF4y2Ba
李y,方j,qi x,林m,zhong y,sun l,崔w。果实代谢物和转录组的综合分析显示了类黄酮生物合成中的候选基因GydF4y2Ba猕猴桃argutaGydF4y2Ba.int j mol sci。2018; 19。GydF4y2Ba
- 31。GydF4y2Ba
小安L,Na L,Ling F,寿州Z.综合代谢物和转录组分析揭示了花青素新陈代谢的作用GydF4y2Ba白兰maudiaeGydF4y2Ba.国际期刊。2019。GydF4y2Ba
- 32。GydF4y2Ba
Zhou C, Mei X, O’’S Rothenberg D, Yang Z, Zhang W, Wan S, Yang H, Zhang L. Metabolome and transcriptome analysis reveals putative genes involved in花青素积累和着色(GydF4y2Ba茶树GydF4y2Ba) 花。分子。2020; 25:190。GydF4y2Ba
- 33。GydF4y2Ba
董T,韩河,俞茹,朱米,张Y,龚y,李苏蛋白在绿色和紫色芦笋中代谢物和转录组的相关基因的积累与分子分析(GydF4y2Ba芦笋officinalisGydF4y2Bal .)。食品化学。2019; 271:18-28。GydF4y2Ba
- 34。GydF4y2Ba
王敏,陈亮,梁振华,何新,刘伟,姜斌,闫军,孙鹏,曹志鹏,彭强,林玉玲。叶绿素和花青素代谢途径与黄瓜果皮颜色的关系。BMC Plant Biol. 2020;20:386。GydF4y2Ba
- 35.GydF4y2Ba
焦飞,赵玲,吴旭,宋志,李永华。烟草花色突变分子机制的代谢组学和转录组分析。BMC染色体组。2020;21:611。GydF4y2Ba
- 36.GydF4y2Ba
刘Y,LV J,Liu Z,Wang J,Yang B,Chen W,Ou L,Dai X,Zhang Z,Zou X.代谢物和转录组的综合分析揭示了胡椒水果中的颜色形成机制(GydF4y2Ba甜椒GydF4y2Bal .)。食品化学。2020; 306:125629。GydF4y2Ba
- 37.GydF4y2Ba
张Q,王L,刘Z,赵Z,赵杰,王Z,周G,Lio P,刘M.转录组和代谢谱揭开Ziziphus Jujuba磨机的机制。剥离着色。食品化学。2020; 312:125903。GydF4y2Ba
- 38.GydF4y2Ba
Cho K,Cho K-S,Sohn H-B,Ha Ij,Hong S-Y,Lee H,Kim Y-M,Nam MH。代谢物和转录组的网络分析揭示了马铃薯色素沉着的新颖调节。J Exp B. 2016; 67:1519-33。GydF4y2Ba
- 39.GydF4y2Ba
类黄酮生物合成的转录控制:一个涉及拟南芥分化的多个方面的保守调控的复杂网络。植物学报。2005;8:272-9。GydF4y2Ba
- 40。GydF4y2Ba
Debeaujon I,Peeters AJM,Léon-kloosterziel km,koornneef m.该GydF4y2Ba透明Testa12.GydF4y2Ba拟南芥的基因编码了一种多药二级转运蛋白,它是类黄酮在种皮内皮液泡中隔离所必需的。植物细胞。2001;13:853 - 71。GydF4y2Ba
- 41。GydF4y2Ba
Francisco RM, Regalado A, Ageorges A, Burla BJ, Bassin B, Eisenach C, Zarrouk O, Vialet S, Marlin T, Chaves MM, Martinoia E, Nagy R. ABCC1,葡萄浆果中的ATP结合盒蛋白,转运花青素3-O-糖苷。植物细胞。2013;25:1840-54。GydF4y2Ba
- 42.GydF4y2Ba
Mol J,Grotewold E,Koes R.基因如何绘制花和种子。趋势植物。1998年; 3:212-7。GydF4y2Ba
- 43.GydF4y2Ba
王志强,王志强,王志强,等。花青素对植物色素沉着的分子调控。《观赏植物的育种:经典与分子方法》,陈志强,陈志强,2002。GydF4y2Ba
- 44.GydF4y2Ba
Sobel JM,Streisfeld MA。花色作为植物Evo-Devo研究的模型系统。前植物SCI。2013; 4:321。GydF4y2Ba
- 45.GydF4y2Ba
李海平,李芙蓉,林斌,张永琪。杂交转录组测序和相关代谢产物分析揭示了与蔷薇突变体花色差异相关的基因。植物。2019;8:267。GydF4y2Ba
- 46.GydF4y2Ba
Suzuki K, Tsuda S, Fukui Y, Fukuchi-Mizutani M, Yonekura-Sakakibara K, Tanaka Y, Kusumi T.玫瑰类黄酮生物合成基因的分子特性及其在矮牵牛花中的应用。生物技术装备。2000;14:56-62。GydF4y2Ba
- 47.GydF4y2Ba
乔德海姆。花青苷。奇切斯特:威利,2010;1 - 12页。GydF4y2Ba
- 48.GydF4y2Ba
黄志强,王志强,王志强。花青素的生物合成、功能和应用。施普林格;2009.GydF4y2Ba
- 49。GydF4y2Ba
何乔,阿志兰,邓街,林思敏。花青素和花青素:色素作为食品、医药成分的潜在健康益处。食物减轻。2017;61:1361779。GydF4y2Ba
- 50.GydF4y2Ba
Tanaka Y,Brugliera F,Chandler S. Biotechnology花卉颜色修改的最近进展。int j mol sci。2009; 10:5350-69。GydF4y2Ba
- 51.GydF4y2Ba
薛莉,王紫,张文,李耀,王j,雷jj。粉红花和白花草莓杂交种的花粉遗传和杂交种特征。SCI Hortic。2016; 200:143-50。GydF4y2Ba
- 52.GydF4y2Ba
Holton Ta,康沃欧欧盟。花青素生物合成的遗传学和生物化学。植物细胞。1995年; 7:1071-83。GydF4y2Ba
- 53.GydF4y2Ba
植物生物化学:玫瑰花青素的合成。大自然。2005;435:757-8。GydF4y2Ba
- 54.GydF4y2Ba
杨X,夏x,张z,nong b,zeng y,吴y,xiong f,张y,梁h,潘y,戴g,邓g,李d。使用pcamp鉴定水稻果皮中的花青素生物合成基因。植物Biotechnol J. 2019; 17:1700-2。GydF4y2Ba
- 55。GydF4y2Ba
过表达CsANR提高了转基因烟草黄烷-3-醇含量,降低了花色苷含量。生物科技摩尔》。2013;54:426-35。GydF4y2Ba
- 56。GydF4y2Ba
黄泽,赵涛,王,郑某。LC差异调节的花青素生物合成在烟草(尼古拉烟草L.)植物中的异位表达。机器人螺柱。2016; 57:24。GydF4y2Ba
- 57。GydF4y2Ba
美国李R2R3-MYB转录因子调控烟草和柑橘花青素积累的差异模式。转基因作物与粮食。2017;8:85-105。GydF4y2Ba
- 58。GydF4y2Ba
Nishihara M,Nakatsuka T,Yamamura S.通过抑制Chalcone异构酶基因转基因烟草植物的黄酮组分和花色。费用。2005; 579:6074。GydF4y2Ba
- 59.GydF4y2Ba
杨沪科,俞吉,赵Q,朱迪,Ao Gm。玉米LC调节基因对转基因烟草和喇叭花花色的影响。JAgric Biotechnol。2007; 15:85-9。GydF4y2Ba
- 60。GydF4y2Ba
刘立,张丽,王股,牛XY。从东南西藏的Sygea山脉10种Rhododendron种花瓣和黄酮酚分析。植物理性生物化学。2016; 104:250-6。GydF4y2Ba
- 61。GydF4y2Ba
Schwinn KE, Markham KR, Giveno NK。花类黄酮及其在商业菊花品种中合成天竺葵苷的潜力。植物化学。1993;35:145-50。GydF4y2Ba
- 62。GydF4y2Ba
本田C,Kotoda N,Wada M.Anthocyanin生物合成基因在苹果皮中的红色期间协调。植物理性生物化学。2002; 40:955-62。GydF4y2Ba
- 63。GydF4y2Ba
杜华,赖丽,王飞,孙伟,张丽,李昕,王磊,姜玲,郑勇。30种杜鹃属植物花色苷和黄酮醇鉴定及数量性状的研究。植物医学杂志。2018;20:121-9。GydF4y2Ba
- 64。GydF4y2Ba
Asen S, Stewart RN, Norris KH。植物组织中花青素的共色素作用及其对颜色的影响。植物化学。1972;11:1139-44。GydF4y2Ba
- 65。GydF4y2Ba
花青素的共色素作用及其在红酒颜色中的作用:一个评论。美国国立卫生研究所,2001;52:67-87。GydF4y2Ba
- 66.GydF4y2Ba
李志强,李志强,李志强,等。荷兰鸢尾属植物新糖基黄酮的鉴定及其对花色的影响。植物生理生化。2013;72:116-24。GydF4y2Ba
- 67.GydF4y2Ba
刘X,Cao X,Shi S,Zhao N,Li D,Fang P,Chen X,Qi W,张Z.对比RNA-SEQ分析揭示了芸薹类葡萄干(Rosa Hybrida)Petal防御对抗Botrytis Cinerea感染的关键作用.BMC Genet。2018; 19:62。GydF4y2Ba
- 68.GydF4y2Ba
齐W,陈X,方P,Shi S,Li J,Liu X,Cao X,Zhao N,Hao H,Li Y.罗莎杂交菌的基因组和转录组测序为繁殖,花特征改善和分类学研究提供微卫星标志。BMC植物BIOL。2018; 18:119。GydF4y2Ba
- 69.GydF4y2Ba
Dubois A, Carrere S, Raymond O, Pouvreau B, Cottret L, Roccia A, Onesto JP, Sakr S, Atanassova R, Baudino S.玫瑰转录组数据库资源和基因表达图谱。BMC染色体组。2012;13:638。GydF4y2Ba
- 70。GydF4y2Ba
郭X,yu c,luo l,wan h,zhen n,xu t,tan j,pan h,张q.罗莎中华民币旧腮红的花卉过渡转录组。'BMC基因组。2017; 18:199。GydF4y2Ba
- 71。GydF4y2Ba
黄酮类化合物在生物化学途径调控和进化中的作用。趋势。2005;10:236-42。GydF4y2Ba
- 72。GydF4y2Ba
Bendahmane M,Dubois A,Raymond O,Le BRIS M.花卉发起和开发的遗传学和基因组学。J Exp Bot。2013; 64:847-57。GydF4y2Ba
- 73.GydF4y2Ba
本田C,Kotoda N,Wada M,Kobays,Kobayashi S,Soejima J,Zhang Z,Tsuda T,Moriguchi T.在苹果皮肤上的红色中有相同的表达。植物理性生物化学。2002; 40:955-62。GydF4y2Ba
- 74.GydF4y2Ba
杨志强,杨志强,杨志强,等。苹果果皮中氨基酸-糖的生物合成途径:对花青素- 3-半乳糖生物合成的贡献。足底。2009;230:871 - 81。GydF4y2Ba
- 75.GydF4y2Ba
AZA-GONZÁLEZC,Herrera-IsidrónL,Núñez-Palenius HG,MartínezdeLavao,Ochoa-Alejo N.辣椒果实发育过程中生物合成相关基因的Anthocyanin积累和表达分析。Biologia plantarum。2013; 57:49-55。GydF4y2Ba
- 76.GydF4y2Ba
王志强,王志强,王志强,等。桃果实花色苷生物合成的调控。足底。2014;240(5):913 - 29。GydF4y2Ba
- 77.GydF4y2Ba
郑T,棕褐色,杨H,张l,李t,刘b,张d,林h.通过MyB75 / Tut1 / TPL介导的转录抑制调节血清粘蛋白积累。Plos Genet。2019; 15。GydF4y2Ba
- 78.GydF4y2Ba
庄华,楼强,刘海,韩华,王强,唐涛,马玉华,王辉。基于转录组和代谢组分析的绿色和紫色萝卜花色苷的差异调控。国际分子生物学杂志。2019;20:4387。GydF4y2Ba
- 79。GydF4y2Ba
赵飞,崔玉英,曾晓霞。转录组学和代谢组学分析对野生桃mira Koehne果实发育和果肉着色的新认识。BMC Plant Biol. 2019;19:463。GydF4y2Ba
- 80。GydF4y2Ba
乔志,刘胜,曾辉,李艳,王旭,陈勇,王旭,蔡宁。紫红叶稳定表型的分子机制研究。国际分子生物学杂志。2019;20:5636。GydF4y2Ba
- 81。GydF4y2Ba
田杰,张杰,宋涛,姚亚。海棠查尔酮合成酶基因Mc CHS调控红花瓣颜色和类黄酮的生物合成。PLoS ONE。2014; 9:110570。GydF4y2Ba
- 82。GydF4y2Ba
迪克加利福尼亚州迪克,布伦斯特罗·j,巴特勒t,卡尔森ml,kliebenstein dj,whittall jb。北极芥末花色多态性受花瓣特异性下调的阈值,在花青素生物合成途径的阈值下。PLoS ONE。2011; 6:18230。GydF4y2Ba
- 83。GydF4y2Ba
Stich K,Eidenberger T,Wurst F,Forkmann G.使用花提取物的二氢酚酰胺酶转化为Flavan-3,4-二醇GydF4y2BaDianthus Caryophyllus.GydF4y2BaL.(康乃馨)。Planta。1992年; 187(1):103-8。GydF4y2Ba
- 84。GydF4y2Ba
Feyissa DN, Løvdal T, Olsen KM, Slimestad R, Lillo c。足底。2009;230(4):747 - 54。GydF4y2Ba
- 85。GydF4y2Ba
田J,汉Z-y,张j,胡yj,歌曲t,姚y。二氢烷醇4-还原酶和黄酮合成酶的表达平衡调节蟹肉中的黄酮类生物合成和红色叶子着色。SCI批准。2015; 5(1):12228。GydF4y2Ba
- 86。GydF4y2Ba
戴维斯km,albert nw,schwinn ke。从降落灯到模仿。花环的分子调节和色素沉着图案化机制。Funct植物Biol。2012; 39:619-38。GydF4y2Ba
- 87。GydF4y2Ba
葡萄风信子的异位表达(GydF4y2BaMuscari armeniacumGydF4y2Ba) R2R3-MYB转录因子基因MaAN2诱导烟草花青素积累。植物学报2017;GydF4y2Ba
- 88。GydF4y2Ba
石原H, Tohge T, Viehöver P, Fernie AR, Weisshaar B, Stracke R.拟南芥中黄酮醇积累的自然变异是由黄酮醇葡萄糖转移酶BGLU6决定的。J Exp Bot. 2016; 67:1505-17。GydF4y2Ba
- 89。GydF4y2Ba
Jie G,Rui R,Yonglu W,Jianpeng J,Jianpeng J,Sagheer A.比较代谢组分揭示了Cymbidium Sinense'Red Sun的叶子颜色发展的不同的类黄酮生物合成调控。1869; 2020:21。GydF4y2Ba
- 90.GydF4y2Ba
Yonekura-Sakakibara K,Tohge T,Matsuda F,Nakabayashi R,Takayama H,Niida R,Watanabe-Takahashi A,Inoue E,Saito K.综合黄酮型分析和转录组CO表达分析,导致拟南芥中的解码基因 - 代谢物相关性。植物细胞。2008; 20:2160-76。GydF4y2Ba
- 91。GydF4y2Ba
Griesser M,Hoffmann T,Bellido ML,Rosati C,Fink B,Kurtzer R,Aharoni A,Muñoz-Blanco J,Schwab W。通过逐渐降压在成熟的草莓果实中的下调进行黄酮类生物合成重定向。植物理性。2008; 146:1528-39。GydF4y2Ba
- 92。GydF4y2Ba
Gomez C, Terrier N, Torregrosa L, Vialet S, fournier level A, Verriès C, Souquet JM, Mazauric JP, Klein M, Cheynier V, Ageorges A.葡萄藤mate型蛋白作为液泡H+依赖的酰基化花青素转运体。植物杂志。2009;150:402-15。GydF4y2Ba
- 93。GydF4y2Ba
陈丽,刘玉英,刘华,康丽,耿杰,凯艳,丁颖,孙辉,李艳。蓝莓类黄酮转运相关基因的鉴定与表达分析。PLoS ONE。2015; 10: e0118578。GydF4y2Ba
- 94。GydF4y2Ba
柴YR,Lei B,Huang Hl,Li Jn,Yin JM,唐ZL,Wang R,陈L.甘蓝型油菜和家长的透明Testa 12基因:克隆,演化和黄色种子特质的差异参与。Mol Genet基因组学。2009; 281:109-23。GydF4y2Ba
- 95。GydF4y2Ba
Dossa K,MMADI MA,周R,周Q,杨M,Cisse N,Diouf D,Wang L,张X.与芝麻的转录物积累相关的发散DNA甲基化计划是基础的。植物SCI。2018; 277:207-17。GydF4y2Ba
- 96。GydF4y2Ba
Dossa K,MMADI MA,周R,张T,SU R,Zhang Y,Wang L,You J,Zhang X.描绘核心转录组调节多个非生物胁迫在芝麻中的反应(GydF4y2Ba胡麻属indicumGydF4y2Bal .)。国际分子生物学杂志。2019;20:3930。GydF4y2Ba
- 97.GydF4y2Ba
Livak KJ, Schmittgen TD。利用实时定量PCR和2(-Delta Delta C (T))方法分析相对基因表达数据。方法。2001;25:402-8。GydF4y2Ba
致谢GydF4y2Ba
我们感谢来自辽宁省农业科学院(沈阳(110161))的蔡忠杰、瞿连伟、刘荣晓和张晓飞在实验中给予的帮助。GydF4y2Ba
资金GydF4y2Ba
辽宁省重点研发计划项目(no . 2020JH2/10200016);国家重点研发计划项目(no . 2019YFD1001001)。资助方不参与研究设计、数据收集和分析、决定发表或手稿的准备。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
概念化,J.L.和H.S.;方法,Q.Z.;软件,C.J.;验证、J.L.和q.z;形式分析,j.l., q.z and L.L.;调查,X.W.;资源,L.L.;写作-初稿准备,J.L.;所有作者都已阅读并同意该手稿的出版版本。GydF4y2Ba
通讯作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
附加信息GydF4y2Ba
出版商的注意事项GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:图S1GydF4y2Ba
.(a)代谢物中的多峰值检测图在多重反应监测模式下;(b)通过质谱检测的质量控制样品的总离子电流重叠;(c)通过质谱法测定一个质量控制样品的总离子电流。GydF4y2Ba
附加文件2:图S2GydF4y2Ba
.差异基因火山图。GydF4y2Ba
附加文件3:图S3GydF4y2Ba
.选择差异表达基因进行qRT-PCR验证。GydF4y2Ba
附加文件4:表S1GydF4y2Ba
.H和S中黄酮类化合物的种类和含量。GydF4y2Ba表S2GydF4y2Ba:测序摘要。GydF4y2Ba表S3GydF4y2Ba:玫瑰花瓣中鉴定的新基因列表。GydF4y2Ba表S4GydF4y2Ba:玫瑰花瓣中独特表达的基因列表。GydF4y2Ba表S5GydF4y2Ba:三种途径的基因总数被分配。GydF4y2Ba表S6GydF4y2Ba:差异表达的伴侣基因列表。GydF4y2Ba表S7GydF4y2Ba:用于qRT-PCR验证的基因引物序列。GydF4y2Ba
附加文件5:表S8-1GydF4y2Ba
.基因 - 代谢物对涉及KO00941。GydF4y2BaS8-2GydF4y2Ba:涉及KO00942的基因 - 代谢物对。GydF4y2BaS8-3GydF4y2Ba:涉及KO00943的基因 - 代谢物对。GydF4y2BaS8-4GydF4y2Ba:涉及KO00944的基因 - 代谢物对。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
吕军,张强,郎L。GydF4y2Ba等等。GydF4y2Ba微型玫瑰花色苷生物合成途径与颜色突变的综合代谢组和转录组分析。GydF4y2BaBMC植物杂志GydF4y2Ba21,GydF4y2Ba257(2021)。https://doi.org/10.1186/s12870-021-03063-0.021-03063-021-03063-0.GydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-021-03063-0.021-03063-021-03063-0.GydF4y2Ba
关键词GydF4y2Ba
- 小玫瑰GydF4y2Ba
- 突变GydF4y2Ba
- 色素沉着GydF4y2Ba
- 转录组GydF4y2Ba
- 花青素生物合成途径GydF4y2Ba