抽象的
背景
迟到的恶意严重威胁着全球马铃薯种植。由真菌病原体引起的严重和广泛的损伤可能导致马铃薯产率下降。虽然嫁接技术已被广泛用于改善作物抵抗力,但嫁接对马铃薯晚枯燥抗性以及相关分子机制的影响仍不清楚。因此,我们进行了RNA转录组测序分析和浅层抗性抗性多样性青山9和易感品种的青睐,分别用作砧木和曲率,反之亦然.本研究旨在探讨砧木对接穗抗病性的影响及其分子机制。
结果
京都基因和基因组百科全书的通路富集分析显示,基因的表达水平与植物相互作用,植物增殖蛋白激酶(MAPK)信号通路,青树9号作为砧木时,接穗中植物激素信号转导通路显著上调。其中部分基因编码钙依赖蛋白激酶(CDPKs)、几丁质诱导子受体激酶(CERKs)、LRR受体丝氨酸/苏氨酸蛋白激酶(LRR- lrks)、水杨酸合成途径中的NPR家族蛋白以及马铃薯晚疫病反应蛋白MAPKs。用Favorita作砧木时,青树9号接穗中只有少数迟疫病反应基因表达上调。用抗性品种作为砧木嫁接植株p . 5当敏感品种作为砧木时,孢子的病变大小显著减小,而病变大小无显著差异。我们还发现,这种对接穗,特别是敏感马铃薯品种的接穗的抗病诱导是由接穗中植物抗病相关基因的表达上调介导的。
结论
我们的研究结果表明,使用晚期抗腐蚀品种的马铃薯接枝可以通过上调疾病抗病基因在阴分中的表达来呈现或增强源于易感品种的阴分抗性。结果为探索砧木对茎秆抗病性抗性的影响的分子机制提供了依据。
背景
马铃薯(Solanum tuberosum L.),原产于南美洲安第斯山脉的一年生茄科草本植物,已成为世界上第四大最重要的粮食作物[1].自17世纪传入中国以来,中国已成为土豆的主要生产国之一。在全球范围内,中国是土豆的主要生产国。马铃薯块茎是一个丰富的营养来源,包括淀粉,蛋白质,矿物质,粗纤维,抗氧化和抗衰老化合物。马铃薯除了作为一种常见的食用蔬菜外,还因其淀粉含量高而广泛应用于纺织、制药、食品、染料、造纸等行业。因此,马铃薯的用途极其多样,其生产可以极大地影响国民经济。然而,马铃薯产量受到虫害和不利环境条件的严重影响。对全球马铃薯可持续生产最有害的威胁是晚疫病Phytophthora Infestans.(Mont。)de bary [2].晚疫病使马铃薯产量急剧下降,在某些情况下损失高达100%。全球每年因晚疫病感染造成的直接经济损失高达67亿美元,相当于马铃薯总产量的15% [3.].因此,开发有效的防治马铃薯晚疫病的方法至关重要。“福沃里塔”是1981年由中央农业部国有资产监督管理局从荷兰引进的高产马铃薯品种,可以生产优质薯块。费乌利塔是一种高产马铃薯品种,可生产优质块茎,由荷兰引进中国。但由于对晚疫病敏感,在栽培过程中需要严格的栽培条件。晚疫病的爆发将严重影响费沃瑞塔马铃薯的产量和品质[4].因此,提高费乌瑞草的抗晚疫病能力是十分必要的。
嫁接是一种古老的农业技术,可以追溯到公元前424年。嫁接是一种营养杂交栽培方法,将两棵切下来的植物连接在一起,让它们愈合后长成新的植物。芽或枝条通常用作接穗,而根茎用作砧木;接穗附着在根茎的切口上,然后融合的植物材料愈合形成嫁接植物[5].在农业中,嫁接技术主要用于增加作物产量,提高分支结构,增强对生物和非生物应激的作物抵抗[6].中国有历史悠久的应用作物嫁接技术。具体而言,它已被广泛用于培育抗胁迫的番茄,茄子,胡椒和甜瓜品种,以及阐明这些作物的应力抗性的机制[7].在以耐旱烟草品种作为砧木的研究中,Huo(2016)等研究人员得出结论,嫁接烟草植株可以通过调节抗氧化酶活性和胁迫应答基因表达来提高其抗旱性[8].Wang et al.(2015)将番茄嫁接到紫薯砧木上,发现嫁接能显著提高番茄产量,降低青枯病发生率,但不影响果实品质[[9].此外,将黄瓜嫁接到云南黑色种子南瓜砧木可以增加黄瓜抗性枯萎[10.].因此,选择合适的砧木可以提高植株的抗逆性和产量。嫁接也与植物长距离信号的研究相关[11.].许多研究证明,RNA,蛋白质,激素和甚至叶绿体和核基因组可以从砧木输送到SCION [12.,13.,14.].植物特征的变化可能与植物和砧木之间的材料交换密切相关。然而,植物特性修饰的分子基础和嫁接后的生理或生物化学变化仍然未知。接枝植物的转录组分析可以揭示参与调节通过嫁接诱导的生理反应的特定基因[15.[在接枝前后,转录网络中转录网络中的差异网络和主要代谢途径的差异表达基因(DEGS)和影响植物生长,发育和对环境压力的反应的反应,以探讨分子移植植物的特质变化的机制和机制等级 [16.].例如,改善了植物激素水杨酸(SA),茉莉酸(JA)和乙烯(ET)是涉及非生物和生物应激反应的重要信号传导分子。与疾病反应和钙依赖信号传导相关的基因也对植物应激反应至关重要[17.].
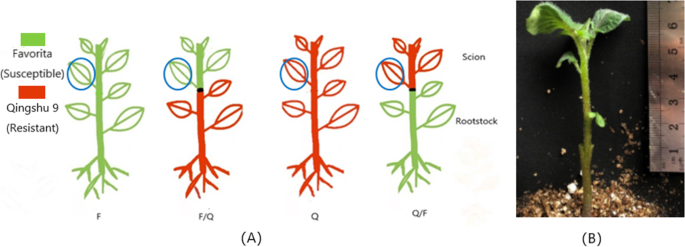
本试验以早熟易感马铃薯品种费乌瑞塔(F)和中晚熟高抗晚疫病马铃薯品种青薯9号(Q)为试验材料。这些品种作为接穗和砧木相互嫁接。嫁接后对接穗进行了抗性试验。此外,在马铃薯基因组序列的基础上,我们分析了接穗的转录组数据,以探讨马铃薯嫁接对接穗基因表达和抗晚疫病的影响。
结果
嫁接后马铃薯的抗性降临枯萎
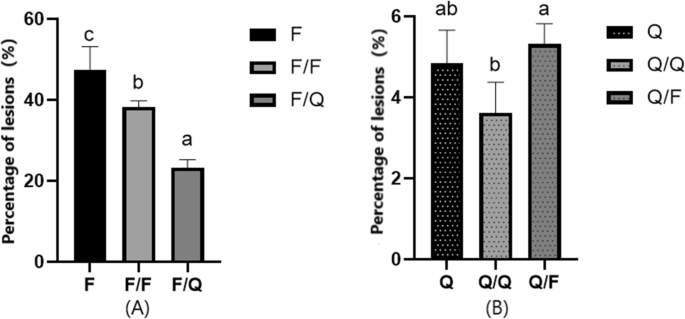
在接枝后35天,收集F / F,F / Q,Q / Q和Q / F叶片,用于体外接种测定,叶片来自未移植的F和Q植物作为对照。嫁接后,易感品种F的晚期抗性显着提高。使用高度抗性品种Q作为砧木时,与未分枝和自接枝相比,易感品种中患者斑点的比例分别降低了51.03%和39.31%,这是显着的(P< 0.05)。同时,自嫁接的感病品种的病斑比例比未嫁接的低19.3%,差异极显著(P< 0.05)。叶面积F、F/F和F/Q病变比例分别为47.46±5.69%、38.29±1.49%、23.24±2.03%,病害等级分别为4级、4级、3级。与Q相比,Q/F接穗上Q病斑比例增加了9.70%,差异不显著。与Q/Q相比,未嫁接的Q病斑比例下降了25.36%,差异不显著。叶面积Q、Q/Q、F/Q病变的百分比分别为4.85±0.81%、3.62±0.75%、5.32±5.08%,病害等级为2级(图2)。1).
转录组测序和组装
用Illumina高通量测序平台测序来自分析的植物的顶部的第三叶的转录om,测序每个样品的3个生物学重复(图。2A),得到6.5 × 107, 5.7 × 107, 6.1 × 107, 5.5 × 107原始读取,经过过滤得到6.3 × 107, 5.6 × 107, 6.1 × 107, 5.4 × 107分别为F/Q, Q/F, F和Q叶子的干净读取。所有叶片的总体数据排序错误率为0.03%。F/Q、Q/F、F和Q叶的Q30(即phred值大于30的总碱基的百分比,其中phred = -10log10 (e))分别为93.66%、93.76%、93.86%和92.82%,GC含量分别为42.38%、42.31%、42.24%和42.18%。使用HISAT程序将clean reads与参考基因组序列进行比对(即转录本拼接比对的分层索引)[18.].F / Q,Q / F,F和Q叶的平均映射率分别为87.61%,86.09%,82.43%和85.78%。样本中的映射率的相似性表明样品之间的清洁读取数据是可比的。因此,转录组测序结果可靠且适用于进一步分析(表1).
筛选度
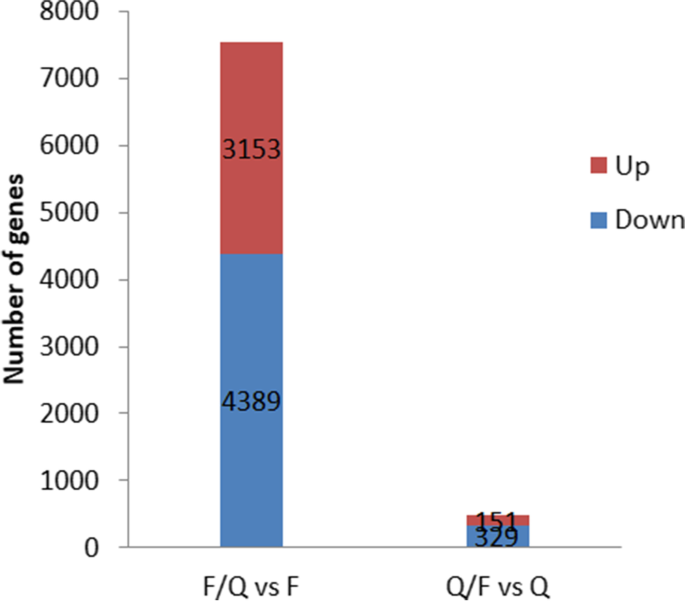
利用基因表达水平的倍数变化> 1和ap-value < 0.05为标准,我们检测到8022 DEGs(图。3.).F / QvsF比较显示上调基因3153个,下调基因4389个。相比之下,Q/FvsQ比较发现上调基因329个,下调基因151个。
基因本体(GO)富集分析
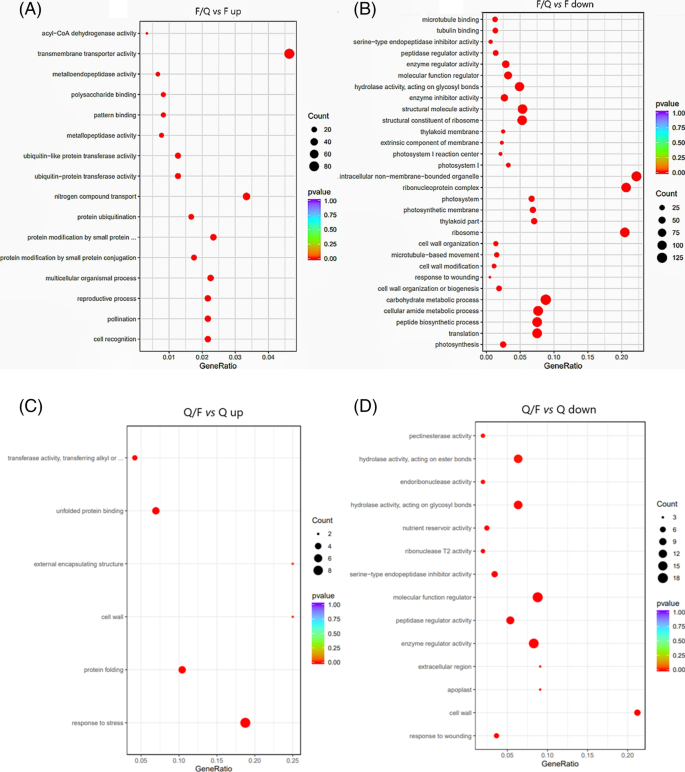
基于GO分类对deg进行功能注释(图。4将基因分为生物过程(BP)、细胞成分(CC)和分子功能(MF)三类。与F相比,F/Q上调基因在BP和MF中明显富集。BP中最富集的是氮化合物转运基因,MF中最富集的是跨膜转运活性基因。BP中碳水化合物代谢过程、肽代谢过程和光合作用中表达下调的基因富集。在CC中,主要富集于胞内非膜细胞器基因。MF中结构分子活性最为丰富,细胞调控、多肽酶催化活性等基因也明显下调。与Q相比,Q/F上调的基因主要富集在BP的应激反应、CC的细胞壁和外部封装结构以及MF的未展开蛋白结合。MF中下调基因多为细胞调控和多肽酶催化活性基因,BP中下调基因和CC中下调基因在创伤反应中富集。
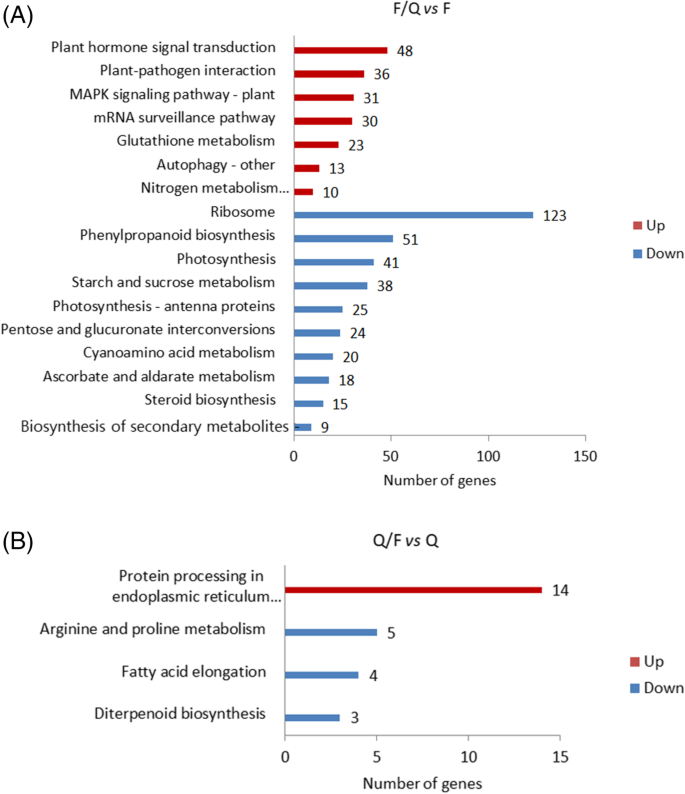
基因和基因组(Kegg)京都植物百科全书(Kegg)富集分析
使用KEGG通路数据库分析两种比较中识别的deg(图)。5).确定了前20条富集KEGG通路。更具体地说,在F/Q中vsF比较,上调的DEGs主要与mRNA监测途径、自噬-其他、谷胱甘肽代谢、植物-病原体相互作用、植物激素信号转导、氮代谢、丝裂原激活蛋白激酶(MAPK)信号通路有关,而下调的DEGs主要与核糖体和光合天线蛋白以及光合作用、苯丙烷生物合成、氰氨基酸代谢、类固醇生物合成、戊糖和葡萄糖醛酸转化有关。关于Q / FvsQ比较,上调的DEGs主要与内质网蛋白加工途径相关,下调的DEGs主要参与脂肪酸伸长、精氨酸和脯氨酸代谢、二萜生物合成途径。
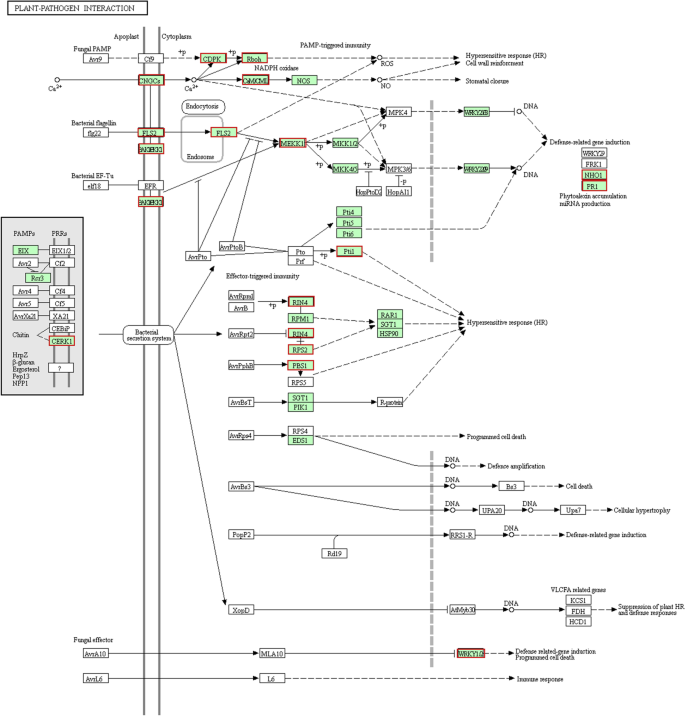
嫁接对植物-病原互作相关基因表达的影响
Kegg途径分析显示,36种植物病原体相互作用相关基因在F / Q叶中比在F叶中更高度表达(图。6).这些基因编码10个钙依赖蛋白激酶(CDPKs)、5个环核苷酸门控离子通道(CNGC)蛋白、3个几丁质激发子受体激酶(CERKs)、2个LRR受体丝氨酸/苏氨酸蛋白激酶(LRR- lrks)和2个WRKY转录因子。基于对Q/F中DEGs的KEGG通路分析结果vsQ比较,只有三个热休克蛋白(HtpG)基因和一个谷胱甘肽过氧化物酶(GSH-Px)基因的表达水平上调。
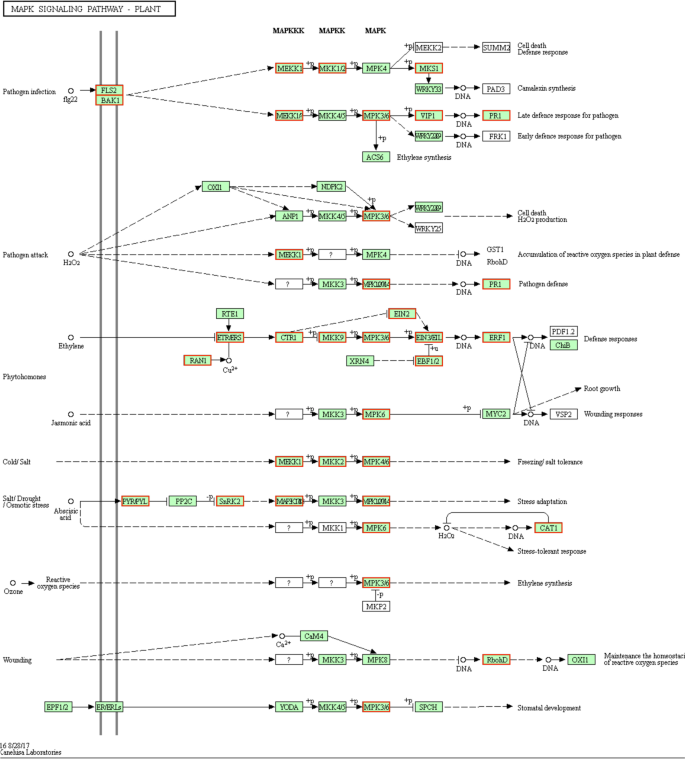
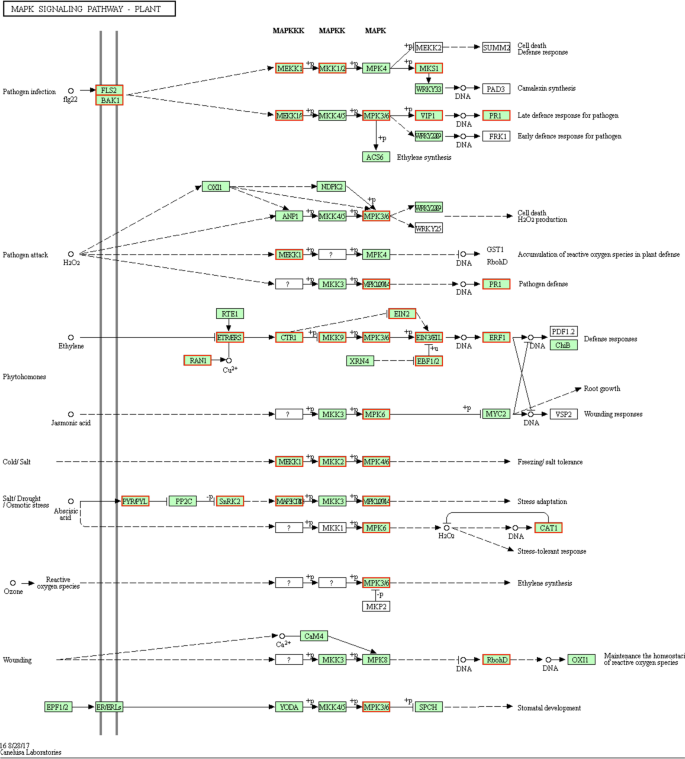
接枝对MAPK信号通路中涉及基因表达的影响
Kegg途径分析表明,31Mapk信号通路相关基因在F / Q叶中具有比F叶中的更高表达水平(图。7).这些基因包括6个编码MAPKs的基因,5个编码乙烯不敏感蛋白的基因,3个编码ABA受体PYL的基因。此外,与Q叶相比,Q叶中高表达的DEGs包括一个丝氨酸/苏氨酸蛋白激酶(serine/苏氨酸蛋白激酶(SRK2)基因和一个蛋白磷酸酶(PP2C)基因。
嫁接对植物激素信号相关基因表达的影响
植物激素信号转导受嫁接的影响。在F / QvsF比较,上调基因主要与ET,SA和JA途径有关。在ET信号转导途径中的基因中,一个ETR基因,一个EIN2基因,四种EIN3基因和一个ERF1 / 2基因的表达水平被上调。六次DEG与JA信号转导途径有关,其中四个是上调基因,两种是下调基因。上调基因编码了Ja合成酶,而下调基因是依赖家族基因。在SA途径中有11个上调基因和一个下调基因,包括三个NPR家族基因,五个TGA家族基因和两种编码疾病相关蛋白的基因(图。8).Q/F中上调的DEGsvsQ比较编码一个SRK2基因和一个PP2C基因。
讨论
嫁接对马铃薯抗晚疫病能力的影响
为探讨嫁接2个马铃薯品种后砧木对接穗抗晚疫病能力的影响,以马铃薯抗晚疫病品种青薯9号和感病品种费乌利塔为嫁接材料。然后测定了接穗分离叶片的抗晚疫病能力。我们的分析表明,无论是晚疫病敏感品种F的自嫁接还是高抗品种Q嫁接,都能提高接穗F的抗晚疫病能力。这说明嫁接本身就能诱导提高植株的抗病性。这可能与嫁接后应激反应增强、抗氧化酶活性及相关基因表达有关。与抗病砧木嫁接后,砧木与接穗之间存在交互作用。根茎中的抗病物质或基因可能向上传递到接穗,从而使接穗对疾病更具抵抗力。这与前人的研究结论是一致的,即嫁接植株的抗性一方面可能来自于砧木中抗病物质向上传导,另一方面是由嫁接自身诱导和刺激的[19.,20.].此外,C的晚期枯萎病用F的抗抗抗性低于Q的自覆自接枝。因此,我们推测了植物和砧木之间有一些材料交换,这对苍白的抗病症具有重要影响。
基于转录体测序数据分析嫁接对马铃薯晚疫阻力的影响
为进一步探索嫁接植株抗接穗晚疫病的分子机制,利用Illumina HiSeq 4000测序平台对稳定的F/Q和Q/F接穗的转录组进行测序,以未嫁接的F和Q作为对照。F/Q共鉴定出7542个DEGsvsF比较,包括3,152个上调基因和4,389个下调基因。Q / F透露的480次vsQ比较由329个上调基因和151个下调基因组成。根据丰富的GO条款,在功能性表征中的情况。大多数DEG与伤口反应,细胞部件,对刺激,生物调节和催化活性的反应有关。与细胞重排,细胞分裂,代谢模式相关的许多基因的转录在接枝后的枝条中改变了。F / Q中的上调基因富含跨膜转运蛋白活性,氮化合物转运和泛素 - 蛋白转移酶活性基因,并且Q / F中的上调基因响应应力和转移酶活性,转移烷基或转移酶活性而富集芳基(甲基)基团基因。它表明,细胞重组或者也许有一些从砧木转移到中断的物质,导致相关基因的表达增加。另外,在接枝后,重建细胞壁,因此显着上调多糖结合,细胞壁,蛋白质折叠和细胞皮质部分基因的表达。
富集的Kegg途径表明,与未移植的F中的相应表达相比,在F间隙中,一些应激相关基因的表达水平显着上调。这些基因主要与植物 - 病原体相互作用,植物MAPK信号传导和植物激素信号传导有关。这与早期的Kegg途径浓缩分析王Hui等人在接枝番茄区段的转录组序列中鉴定的egs的浓缩分析结果一致。陈振等人的接枝荔枝段的转录组测序揭示了。[21.,22.].他们认为嫁接诱导植物的氧化应激,导致抗氧化防御系统在C区的刺激以及相关基因的上调表达。除了与生长素,胃肠杆菌素,ABA,ET,SA和JA有关的基因的表达水平,也改变了。例如,上调植物生长和发育中涉及植物生长和发育调节的(Auxin Inlux载体)Aux1系列(小型氧化载体RNA)Saur家族和转录因子家族基因的表达。我们推测它是由嫁接后通过细胞重建引起的。与此同时,在目前的研究中,我们发现一些上调基因编码了CDPK,CERK,LRR-LRK,NPR蛋白,涉及SA合成途径的NPR蛋白,以及MAPK,它们是所有土豆晚疫反应蛋白[23.].植物与病原菌互作的基因、MAPK信号通路和植物激素信号转导也影响着许多作物的抗性反应[24.,25.,26.].因此,我们推测,这些基因的上调表达可能会越来越大的F裂纹抗性。q / fvsQ比较显示相对较少的deg。所鉴定的上调基因主要参与内质网的合成、内吞作用和细胞间运动。只有6个基因表达上调与马铃薯对晚疫病的反应有关(3HSP90.,一个氧化酶和2L-抗坏血酸过氧化物酶(APX)).这可能是因为Q是抗病的多样性,其中这些基因已经高度表达。这些基因的表达可能与Q下隙的抗性有关。因此,我们推测rootstock f对Scion Q的晚疫性抗性几乎没有影响。
结论
以上结果表明,感病马铃薯品种自嫁接和抗病品种嫁接作砧木均可提高感病马铃薯品种对晚疫病的抗性,但抗病品种作砧木的抗性更强。用感病品种作砧木对抗病接穗的抗病性无显著影响。晚枯病抗性与接穗中抗性相关基因表达的变化有关。抗性基因表达上调可提高敏感接穗的抗晚疫病能力。本研究中发现的deg是未来功能分析的潜在候选基因。该研究结果为进一步研究马铃薯异种嫁接提高接穗抗病性的分子机制奠定了基础。
方法
材料
贵州农业科学院,贵州省贵州省贵州省贵州市贵州市生物技术研究所提供土豆后期抗抗性品种青山9和敏感的多样性青睐。Phytophthora Infestans.W1由贵州大学/贵州省生化工程中心,贵州市贵州市贵州市提供。
方法
嫁接
2019年6月26日,在贵州大学农业生物工程研究所的玻璃温室中,两个品种的脱毒马铃薯块被播种在一个直径11厘米的装满无菌养分土壤的盆栽中,只有一个芽眼。2019年7月26日,采用“剪接法”嫁接植物。具体来说,将脱毒马铃薯段置于无菌的营养土壤中。选择生长均匀的4周龄非空心枝条的植株进行嫁接。接穗采用4 ~ 5 cm、4 ~ 5叶的健康幼嫩枝,离地2 ~ 3cm的健康幼嫩枝作为砧木。嫁接时,在砧木中间垂直切开0.7 cm深的切口。接穗被切成楔形,插入切口,立即用塑料包裹起来。最后,用嫁接夹固定接枝,然后用塑料杯覆盖幼苗(图。2b).嫁接过程在玻璃温室中完成。
嫁接后抗晚疫病的评价
检查了稳定的嫁接植物,以评估它们对晚期枯萎的抗性,并在2019年6月26日播种的未移植的F和Q植物用作对照。使用体外叶片含量评估晚期枯燥的抗性。在接种叶子之前,p . 5培养15 d后加入无菌水试管中。然后将溶液通过1-2层滤纸,用显微镜检查滤液,确认孢子囊的产生。将孢子囊置于4℃冰箱冷藏1 h,促进游动孢子释放至浓度为2 × 104孢子/μL。健康的第三片叶子(从植株顶部)被收集来接种。F和Q未嫁接对照和F/F、Q/Q、Q/F和F/Q嫁接样品的叶片样品采集。每个嫁接组合设置3个生物重复,每个重复2片叶片。将叶片置于塑料培养皿中,叶片背面朝上,然后用湿滤纸覆盖并喷洒2ml蒸馏水。用移液管接种叶片,接种量为20 μ lp . 5悬架。接种部位位于主静脉旁。用parfilm密封培养皿,在22℃下孵育,光照16小时/黑暗8小时循环。每天检查叶子的疾病症状,特别关注水分保留。在接种后第5天检测到症状,第7天测量患病区域的大小。记录病变部位最长、最宽[长(L)、宽(W)垂直],计算病变面积:A = 1/4 × π × L × W。根据Yao et al.(2001)提出的分类指标,晚疫病严重程度的评价采用以下等级[27.]:1级:没有症状或病变面积小于3%;2级:病变面积在3到10%之间,没有萎缩和水浸在死组织周围;3级:病变面积在10%至30%之间,周围区域浸泡并含有白色菌丝体;4级:病变区在30%至60%之间,具有明显的白色菌丝体;和5级:病变区大于60%,具有明显的腐烂组织。
嫁接后的转录组测序
2019年8月26日,Illumina HiSeq 4000高通量平台采集了生长均匀且健康植株(F/Q, Q/F,以及未嫁接的F和Q)顶部的第三片叶子,用于后续转录组测序分析(图2)。2a).测序通过3个生物重复完成。RNA提取和转录组测序由北京诺和之源科技有限公司完成。
- (1)
的识别度
为了比较嫁接前后马铃薯RNA文库的基因表达水平,采用feature recots计算每个基因的阅读量,并对基因表达水平进行定量分析。定量分析后,对表达数据进行统计分析,筛选出不同条件下样本中表达水平存在显著差异的基因。首先对原始readcount进行归一化,即对测序深度进行校正,然后计算假设检验概率(p值)的统计模型,最后对多重假设检验进行校正,得到FDR值,即错误发现率,主要为padj。DEGs的选择标准为|log2(FoldChange)|> 1和padj < 0.05。对DEGS进行GO功能富集和KEGG通路富集,以满足P值0.05标准的GO功能和KEGG通路为显著富集的DEGS。
- (2)
GO和KEGG分析
使用Clusterprofiler软件进行GO功能富集分析和KEGG通路富集分析。以马铃薯基因组数据库为基础,利用聚类转录组序列和公共数据库进行基因功能注释,将差异基因注释到GO或KEGG数据库的基因集中。
数据和材料的可用性
在当前研究期间使用和/或分析的数据集可以从作者获得合理的要求。
缩写
- Kegg:
-
Kyoto基因和基因组的百科全书
- 地图:
-
植物丝裂原活化蛋白激酶
- CDPKS:
-
Calcium-dependent蛋白激酶
- 塞克斯:
-
几丁质Elicitor受体激酶
- LRR-LRK:
-
LRR受体丝氨酸/苏氨酸蛋白激酶
- 中国:
-
核苷酸门控离子通道
- SA:
-
水杨酸
- 是:
-
茉莉酸
- 等:
-
乙烯
- Aux1:
-
生长素inlux载体
- 阿富汗二月:
-
小auxin-up RNA
- HtpG:
-
热休克蛋白
- SRK2:
-
丝氨酸/苏氨酸蛋白激酶
- PP2C:
-
蛋白磷酸酶
- 阿巴:
-
脱盐酸
- 走:
-
基因本体论
- 英国石油公司:
-
生物过程
- CC:
-
细胞成分
- MF:
-
分子功能
- 可见:
-
差异表达基因
参考
- 1。
程毅,张立,歌曲yx。建立马铃薯高效遗传转化受体系统。西北农业J. 2016; 25(9):1350-7。
- 2。
谢ch。马铃薯产业的现状与发展。J华中农业大学:社会科学版。2012; 97:1-4。
- 3.
吴启元,黄凯,刘明明,周琦,熊小云。马铃薯抗晚疫病基因研究进展。中国马铃薯。2014;3:175-9。
- 4.
刘应祥,王兴华。“Favorita”马铃薯品种特点及优质高产栽培技术。中国马铃薯。2014;28(3):152 - 3。
- 5.
质谱分析在植物系统生物学中的作用。质谱修订版2006;25:173-214。
- 6.
Thomas HR, Frank MH.《连接碎片:揭示植物嫁接远距离通讯的分子基础》。新植醇。2019;223(2):582 - 9。
- 7.
马志强,王志强,王志强,等。嫁接:一种修饰园艺作物中离子积累的技术。植物学报。2016;7:1457-72。
- 8。
霍勇军,徐志伟,王锐,王海英,刘建军,苏晓华,等。干旱胁迫下嫁接对烟草抗氧化酶活性、膜脂过氧化及胁迫反应基因表达的影响地球科学进展。2016;49(8):14-20。
- 9。
王xl,王h,黄t,挂,沉xs。番茄嫁接紫春季马铃薯的共生培养方法。四川省农业科技。2015; 4:15-6。
- 10.
彭克,廖杰杰。嫁接黄瓜栽培和嫁接技术的抗病性和产量增加效应。新疆农业科学。1988; 01:19-21。
- 11.
盖昂洛杉矶,卡瓦略RF。长途信号:嫁接揭示了什么?植物营养学报。2018;37:694-704。
- 12.
夏超,郑勇,黄杰,周晓军,李锐,查MR,等。本烟/番茄异种嫁接系统中长距离mRNA运动机制的研究。植物杂志。2018;177:746-58。
- 13。
STEGEMANN S,BOOK R.植物组织移植物中细胞之间的遗传物质交换。科学。2009; 324(5927):649-51。
- 14。
刘宁,杨建华,傅XX,张磊,唐凯,Guy KM,等。西瓜和南瓜砧木嫁接反应mRNA的高通量测序全基因组鉴定和比较分析中国生物医学工程学报。2016;29(2):621-33。
- 15.
王浩,周鹏,朱文英,王峰。番茄同质和异质嫁接接穗差异表达基因的转录组比较分析。自然杂志2019;六枝。
- 16.
陈志强,陈志强,陈志强。拟南芥亲和植物-蚜虫互作中的基因表达谱分析。昆虫学报。2002;51(4):182-203。
- 17.
Lazebnik J,Frago E,Dicke M,Van Loon JJA。食草动物与植物病原体之间相互作用的植物激素调解。J Chem Ecol。2014; 40(7):730-41。
- 18。
HISAT:低内存要求的快速拼接对准器。Nat方法。2015;12(4):357 - 60。
- 19。
日本茄科果蔬生产中砧木的应用。日本农业Res. 1982; 15:175-9。
- 20.
植物寄生性线虫的研究进展[j]。Biores抛光工艺。1999;69:167 - 79。
- 21.
王浩,周鹏,朱文英,王峰。番茄同质和异质嫁接接穗差异表达基因的转录组比较分析。Sci众议员2019;9(1):20240 - 52。
- 22.
陈智,赵金涛,胡富春,秦永华,王小华,胡桂平。荔枝亲和和不亲和嫁接组合的数字基因表达谱的转录组变化Sci众议员2017;7(1):3954 - 66。
- 23.
肖发,高建华,张应祥,王铮,张东辉,陈清林,叶兴志,易旭,杨翠萍,闫丽,程强,陈建军,沈玉峰。马铃薯疫病菌侵染叶片的定量蛋白质组学研究为了解病害早期和晚期蛋白质表达的协调和改变提供了依据。中华医学杂志。2019;20(1):136-61。
- 24。
Raja V,Majed U,Kang Hs,Andrabi Ki,John R.非生物压力:在ROS,荷尔蒙和迈克克之间的相互作用。Environ Exp Bot。2017; 137:142-57。
- 25。
Agrawal GK, Tamogami SK, Iwahashi HS, Agrawal VP, Rakwal RP。不同生物和非生物胁迫对茉莉酸诱导的水稻MAP激酶基因(OsBWMK1)的瞬时调控植物生理生化。2003;41(4):355-61。
- 26。
陈志强,陈志强,陈志强,等。氧化应激激活的丝裂原活化蛋白激酶级联反应的功能分析。中国科学院院刊2000;97(6):2940-5。
- 27.
姚玉青,龚芳,高庆华,曹永林,赵建明。马铃薯晚疫病抗性鉴定与评价。北方农业,2001;2:8-9。
确认
我想表达的是实验室里其他老师,他们在我的学习过程中给予了我很多的指导和帮助。我也要感谢我的朋友和同学,他们给了我他们的帮助和时间倾听我,帮助我解决我的问题在困难的学习过程中。
感谢国家转基因生物新品种培育重大项目(NO.2016ZX08010003-009)和贵州省高水平创新人才培养计划项目([2016]4003)给予的资助。感谢贵州省农业科学院生物技术研究所、贵州大学/贵州省生物化学工程中心提供的实验材料。
资金
本研究由国家重大项目提供资金,培养新品种的转基因生物(2016年ZX08010003-009)和贵州省高级创新人才培训计划项目([2016] 4003)。在我的研究期间,这两个资助机构为我的试剂提供了财务保障。
作者信息
从属关系
贡献
通讯作者DGZ为论文的设计提供思路,指导实验过程,并对文章进行修改。本文作者YXL根据通讯作者的思路设计实验,进行实验操作并撰写论文。所有作者均已阅读并批准本稿件。
作者的信息
李悦欣(音译)是中国贵州大学的博士生。主要研究方向为植物基因工程,主修生物化学和分子生物学。2016年获得贵州大学理学学士学位,同年在贵州大学攻读理学硕士学位。2018年获得贵州大学博士学位,开始攻读博士学位。在此期间,她一直致力于分子研究,主要是植物基因功能验证。2019年开始研究植物嫁接,探索嫁接后的基因转移模式。
相应的作者
伦理宣言
伦理批准和同意参与
我们不包含人类或动物科目的任何研究。
同意出版
我的稿件不包含任何形式的任何个人数据(包括任何个人细节,图像或视频)。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
李,Y.,Zhao,D.转录到嫁接到马铃薯砧木中的阴分细胞分析,以改善晚期抗性。BMC植物杂志21,272(2021)。https://doi.org/10.1186/s12870-021-03039-w
收到了:
接受:
发表:
关键词
- 土豆
- 贪污
- 晚疫病
- 转录组测序