抽象的
花朵受精产生的果实和种子,代表了被子植物不可思议的进化优势,并已成为我们食物供应的关键元素。
已经进行了许多研究来揭示水果是如何在保护生长的种子和确保它们传播的同时成熟的。结果表明,在模式植物和农作物中均分离到多种参与果实成熟和衰老的转录因子。这些调节因子调节果实成熟过程中的几个细胞过程,如叶绿素分解、组织软化、碳水化合物和色素积累。
已知转录因子的NAC超家族涉及果实发育和成熟的几乎所有这些方面。在这篇综述中,我们总结了关于调节模型物种果实成熟的NAC的目前的知识(拟南芥和茄属植物lycopersicum)及具有商业利益的作物(奥雅萨苜蓿,马吕斯有明显,Fragaria.属,素类和穆萨acuminata).
背景
众所周知,水果在Anviosperms的进化史上发挥着关键作用[1,2].果实在种子生长和发育过程中保护种子,并有利于种子的分散,提供了显著的进化优势[3.].与此同时,它们是我们饮食中必不可少的营养成分,也是世界经济最重要的支柱之一[4,5].因此,关于水果的形成和成熟的研究至关重要,以在果实开发过程中发挥作用的影响至关重要,因为这可能导致在优化产量,质量和收获后储存中可能的应用。
转录因子调节不同组织中许多基因的表达,并根据其功能域和结合特异性进行分类[6].在它们的许多目标中,它们调节与环境应激反应有关的基因的转录[7,8]、对病原体的反应[9和果实成熟[10.,11所有这些都影响着果实的正常发育和成熟。众所周知,许多转录因子参与了这一过程,例如MADS-box (MCM1/AGAMOUS/DEFICIENS/SRF)转录因子家族统计了果实发育和成熟的众多关键角色[12],与myb(骨髓丝溶膜)一起[13,14]和AP2/ERF (APETALA 2/乙烯反应因子)DNA结合蛋白[15,16].除了这些广泛的转录因子组,更小的家族也参与了水果发育和成熟的调控,如SPL (Squamosa.启动子结合蛋白样),TCP (TEOSINTE BRANCHED 1/CYCLOIDEA/ prolifering4 CELL FACTORS)和Dof (DNA结合单指)蛋白[17.,18.,19.].然而,已知已涉及此类过程的最大和最着名的植物特异性转录因子之一是NAC(NAM / ATAF1 / CUC2)超家族[20.,21.,22.,23.].在接下来的段落中,我们将讨论NAC转录因子在果实发育和成熟中的关键作用,不仅关注于果实模式物种(拟南芥和茄属植物lycopersicum),以及其他相关物种。
NAC转录因子的概要
一个植物的家庭
NAC Superfamily是一大群植物特异性转录因子,名称是NAM,ATAF1,2和CUC2的首字母缩略词,其特征是。nam(没有顶端商品)的特征在于佩妮x矮牵牛;在不结盟运动突变体,胚未发育SAM(茎尖分生组织),子叶融合,有时花中器官原基数量和分布异常[24.].在拟南芥,CUC2(杯状子叶)表现出高度的同源性纳姆序列。CUC2与CUC1具有冗余作用,且为双突变体cuc1 cuc2未能开发SAM,其子叶在双方融合[25.].拟南芥转录激活因子(ATAF)是NAC家族的一个亚组,其中包括两个NAC家族的首批蛋白ATAF1和2,参与应激反应和衰老[26.,27.].对于这些转录因子及其保守结构的更深入的表征,见下文(2.2“NAC转录因子的结构”和3.1“拟南芥果实和NAC转录因子”)。
NAC超科的成员可以在许多不同的植物物种中找到(见表)S1).然而,随着基因组注释的完善,物种数量和物种数量也在不断增加(见第3.3段“物种数量的不断增加依赖于NAC转录因子”)。在表1,我们列出了下一段中提出和讨论的NAC转录因子。
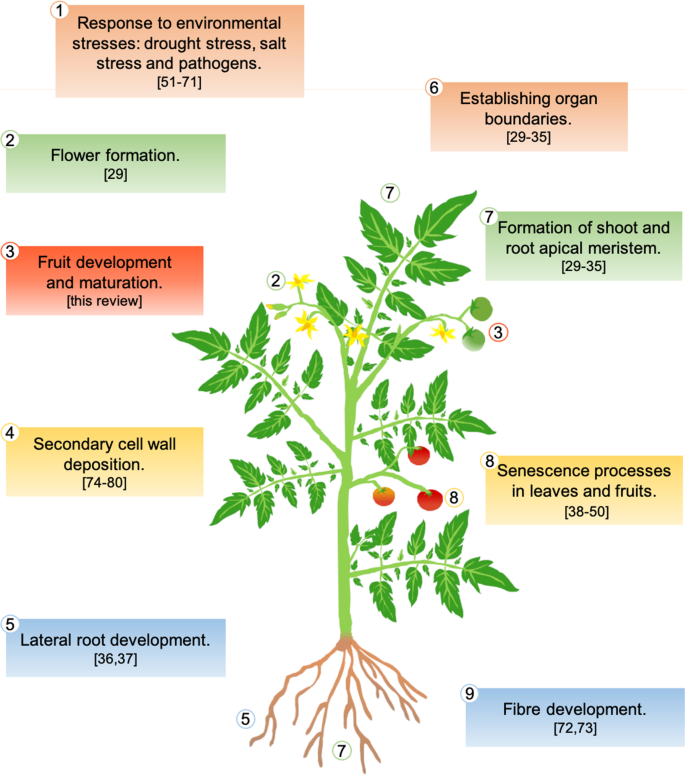
NAC家族是最大的转录因子组之一,它们在植物寿命期间调节几个过程(图。1).他们参与各种发育计划,例如在胚胎发生期间形成芽和根顶部分泌,与归属蛋白相互作用并建立器官界限[29.,30.,31.,32.,33.,34.,35.].一些NAC转录因子也被证明在侧根发育中发挥作用[36.,37.]和在成花过程中[29.].它们还调节树叶和水果的衰老过程[38.,39.,40,41.,42.,43.,44.,45.,46.,47.,48.,49.,50].
NAC转录因子主要调节对环境压力的反应[51,52,53,54,55,56,57,58],例如干旱胁迫[59,60,61,62,63,64,65]和盐压力[66,67].同时,NAC转录因子也调节病原菌引发的应激反应[52,55,68,69,70,71].此外,它们还参与纤维的开发[72,73]、次生细胞壁沉积[74,75,76,77,78,79]通过在目标基因的启动子中结合nac特异性序列[80].其中,NACs调控MYB转录因子参与次生细胞壁和木质素生物合成。此外,它们的目标是参与细胞壁修饰和程序性细胞死亡的其他NACs或酶[80,81].作为植物过程的重要调控因子,NAC转录因子响应植物激素[82例如脱落酸(ABA)[83], 乙烯 [84] Cytokinins [85],茉莉酸[86],赤霉素[87,88和生长素[36.,89].
在它们调控的所有调控过程中,NAC转录因子也调控果实的发育和成熟。在此,将对目前已鉴定和表征的与水果相关的NACs进行全面综述。
NAC转录因子的结构
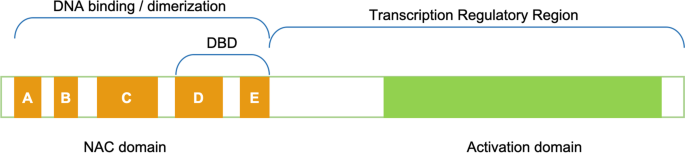
NAC TFS的模块化结构的特征在于高度保守的N-末端NAC结构域(约150个氨基酸)和更加发散的C末端转录调节区(TRR)(图。2) [90,91].NAC结构域负责DNA结合活性,它被分为5个子结构域A-E [92,93.].子域A涉及功能二聚体的形成,而高度保守的C和D亚域含有几种正极的氨基酸,其与DNA相互作用。B和E子域具有分歧,它们可能对NAC基因的功能多样性负责[90,94.].已经在C和D子域中检测到推定的核定位信号(NLS),而DNA结合结构域(DBD)是位于亚域D和E亚域内的60个氨基酸区[92,93.].在许多NAC蛋白中,NLS存在于N-末端,然而,Mohanta和合作者还描述了放置在C末端区域中的一些NLS [23.].他们还描述了含有不止一个NLS的NAC TFs,在一个NAC蛋白中多达四个NLS。NLS的特征是存在一簇带正电荷的氨基酸,而NAC蛋白可以包含单个或多个定义单、双或多部基序的簇[23.].
n端DBD也参与了homo-和/或hetero-二聚体的形成:NAC TFs可以以homo-或hetero-二聚体的形式结合DNA,二聚体是DNA稳定结合所必需的[20.,95.].在大豆中,已经证明D子域含有疏水性阴性调节结构域(NRD)以抑制转录活动[96.].最近在几种植物中发现了这种转录阻遏因子[23.].
在c端,TRR中存在几个组特异性基序,允许转录的激活或抑制[23.].它的差异决定了每个NAC蛋白的功能,并调节NAC转录因子与其靶蛋白之间的相互作用。韦纳及其合作者[95.提示NAC基因在特定的DNA识别中具有保守的一致序列,增加了DNA结合亲和力。最近,这一共识序列在160种植物中被检测到[23.].
几种NAC具有跨膜结构域;它可以位于蛋白质的末端,但突出发现在C末端末端[23.].
2004年,Ernst和合作者通过x射线晶体学解决了ANAC019的NAC结构域[90].几年后,Chen和合作者确定了水稻逆境反应蛋白NAC1 (SNAC1)的NAC结构域的晶体结构[94.].NAC结构域由扭曲的反平行β-片组成,用于DNA结合,在一侧的N末端α-螺旋之间包装,另一个[90].位于C、D和E亚域的几个氨基酸被鉴定为具有对DNA结合至关重要的生化功能[90,91,94.].
NAC结合位点的序列已被几种技术(x射线、SELEX、EMSA、足迹、PBM、ChIP)确定。结合位点包含CGT[AG]核心基序,侧翼序列参与目标启动子结合亲和力和特异性的确定(综述见[97.])。
同一科,不同种
NAC超家族仅包括植物特异性转录因子,越来越多的物种。首先,我们将专注于模型物种,如拟南芥和茄属植物lycopersicum,因为它们在果实发育、成熟和衰老的研究中作为参考植物的作用[98.].
拟南芥siilique和NAC转录因子
被描述为果实衰老调节剂的第一个NAC是NARS1和NARS2(NAC-REGULATED种子MORPHOLOGY1和-2,也被称为ANAC056./NAC2和ANAC018/纳姆分别)。NARS1和NARS2通过控制胚珠被皮发育和退化、种子形态发生和角果衰老来调控胚胎发生[99.].虽然单个突变体不显示任何表型,双突变体nars1 nars2有延缓角质层衰老。目前,尚无关于NARS1和/或NARS2参与激素信号通路的分子数据。研究表明,NARS1和/或NARS2的作用是缓解由被毛细胞程序性死亡引发的细胞内环境,同样也可能发生在角质层。最近,马和同事[50)提出NARS1和NARS2作为也不(非洲化)同源物。NAC转录因子也没有参与番茄果实成熟(见下文,[One hundred.])。然而,基于它们的表达模式和表型,Ma和合作者[50结论,NARS1和NARS2的行为不同于也不不同。的确,而且NARS1和NARS2在衰老的叶子和成熟的果实中都有表达nars1 nars2突变体的衰老仅在角果中延迟,而对叶片没有影响。这表明了与NOR相比的一种不同的行动模式。
atnap.(钠样,被ap3 / pi激活,ANAC029.)最初被描述为叶片衰老的启动子[38.],但后来显示促进硅质成熟[43.].的确,atnap.信使随着果实的成熟进程而积累atnap果荚延缓衰老4-5天。此外,乙烯和呼吸激增是脱钩的,外源乙烯处理不能预测呼吸激增[43.].少量基因,其产品参与乙烯生物合成,感知和信号转导途径,在下调atnap突变体。然而,目前尚不清楚这些基因表达的变化如何影响突变植物的衰老。AtNAP可能与NOR同源,但这样的结论没有得到充分支持[43.].
其他拟南芥NAC蛋白在角果中的作用已被描述,其中NAC058抑制角果衰老。在nac058敲击突变体果实的成熟是早熟的,如过早的泛黄,降低的叶绿素含量和降低的光合性能[101].
JUNGBRUNNEN1(JUB1 / ANAC042)不参与成熟过程,而不是在Silique的生长中。过度表达的植物的Siliquejub1.比正常的短,但有趣的是,在番茄中Atjub1.将果实成熟推迟6天[87,88].过度的Atjub1.在番茄中抑制几个乙烯相关的成熟基因,如ACS(ACC合酶)和华(Acc氧化酶,[88])。在拟南芥和番茄中,AtJUB1抑制基因的转录GA3ox1(GA 3-氧化酶1) 和DWF4(矮人4.),赤霉素(gibberellin, GA)和油菜素内酯(brassinosteroids, BR)生物合成的重要基因,因此表型拷贝GA和BR缺乏。AtJUB1也直接抑制PIF4(Phytochrome相互作用因子4.),一种细胞伸长的正调节剂,并激活德拉基因,细胞增殖和扩张的抑制因子[87,88].
番茄果实及其NAC转录因子
番茄基因组的完整排序[102提供了预测和鉴定大量基因的基本工具。104SlNAC基因已经被确定[103,绘制出所有12条染色体。
的也不突变体未能产生乙烯的更年期高峰,因而导致成熟受阻[One hundred.,104]不能通过外源施用乙烯来挽救[105,106].位置克隆证明了这一点也不编码NAC转录因子[105,106].另一个自发的等位基因也不是alcobaca.(酒精度),这种西红柿保质期很长。107,108].的酒精度等位基因较弱也不,但它的成熟延迟与较新的品种相当也不最近使用CRISPR-Cas9方法获得的等位基因[108,109,110,111].所有这些等位基因都是由无形态突变引起的,与古典相比,突变植物显示较高的表型也不突变,这实际上是一种功能增益[111,112,113].也有类似的结果用Crispr零参与果实成熟的其他番茄转录因子的等位基因,如凛和CNR.[111].凛编码MADS-box转录因子[114,115]直接绑定也不启动子(116,117,118].但是,王和合作者[111]最近建议这种转录因子可能在集成多个信号的复杂网络中冗余,而不是单独成为主监管机构。实际上,它们对乙烯生产的影响,番茄红素积聚和其他成熟性状已被证明是定量和添加剂的[119].而且,虽然都是也不和凛只在果实衰老中起作用也不已被发现参与了成熟果实中病原菌易感性的调节[120.].
一些能够影响果实发育和成熟的NAC转录因子最初被归类为胁迫响应基因n基因通常使用不同的名称,使文献数据筛选复杂化[121.].NOR-like1最初被认为是SlNAC3, ABA调控下干旱胁迫的负调控因子[122.].之后,分析RNA干扰线,SlNAC3被揭示对种子的适当胚胎和胚乳发育至关重要[123.].polygalacturonase-2(pg-2)最终通过共免疫沉淀测定分离为SLNAC3的直接靶标的[124.].同时,朱与合作者也提到NOR-like1作为SNAC4(SLNAC48),确定它是盐胁迫和耐旱性的调节因子[125.].它有49.2%的核苷酸序列与也不其破坏导致类胡萝卜素积累,叶绿素分解和乙烯生物合成的减少[126.].而且,NOR-like1可以直接绑定两者凛和也不,提示它可能作用于这些成熟调控因子的上游,其预测的三级结构与ANAC072高度相似,参与叶片衰老过程中的叶绿素降解[126.,127.,128.].最近,NOR-like1已经被证明可以直接结合乙烯产生、果实硬度和颜色变化相关基因的启动子[129.].
Tweneboah and Oh [55[以前所指出的,总结了不同茄科的应力相关的NAC转录因子,其中一些人参与了水果发育和成熟。作为示例,SLNAC1(也称为SLNAC033)参与热量和冷却耐受性[130.,131.]和防御假单胞菌含油[132.,从而调节生物和非生物的应激反应。SlNAC1结合乙烯或番茄红素生物合成相关基因的调控区域[133.],其抑制或过度表达可改变果实软化和色素沉着[133.,134.].
SlORE1S02,SlORE1S03,SlORE1S06是拟南芥的同源物吗ORESARA1(ORE1/NAC092) [135.].ORESARA在韩语中是“长寿”的意思;事实上,ore1突变体延缓拟南芥叶片衰老[136.].SlORE1S02,SlORE1S03,SlORE1S06和ORE1都是由microRNA调控的MIR164..在番茄中,它们在其过表达加速衰老的叶子中表达。减少SlORE1S02通过RNAi干扰导致碳同化增加,因此转基因植株表现出更高的收获指数,而对果实大小没有影响。转基因水果延缓衰老,并在成熟果实中积累更多可溶性固形物[135.].
SLNAP2.影响果实产量和代谢,因为抑制使果实保留更多的糖[83].这种转录因子在结构上类似于atnap.(上一段所述[43.])。寇及同事[127.] 描述SLNAP2.给它命名SNAC9(SLNAC19.).水果的slnac19类胡萝卜素含量和乙烯产量降低[137.].已经观察到相同的表型nor-like1果实,但它们积累的ABA比SLNAC19.的(137.].SLNAP2.调制也不表达式[50和…一起也不和NOR-like1,它被认为是关键的番茄成熟调节因素[138.].
不断越来越多的物种依赖于NAC转录因子
除了用于干燥和肉质水果的模型物种旁边,还在许多其他商业利益中鉴定并分析了NAC转录因子。这里列出了几种选择中最新的发现。我们将审查他们的角色奥雅萨苜蓿,马吕斯有明显,Fragaria.属,素类和穆萨acuminata.
米 (奥雅萨苜蓿)
虽然谷物不像果实的经典理念,但它们实际上由强烈绑定到种子涂层的水果涂层组成,它们包围胚芽和胚乳。这种非规范式单梯果是通过谷物生产的,例如米饭,大麦和小麦,并且被称为Caryopsis。
水稻是种植最广泛的谷物之一,因此它代表了许多研究的主题。在水稻中,NAC转录因子参与生物和非生物胁迫[52,139.].osnac020,osnac023.和osnac026.已被鉴定为水稻中的粒特异保守NAC基因[140.].事实上,之前的研究osnac020,osnac023.和osnac026.在Caryopsis中检测到更高的表达[141.].此外,OsNAC020和OsNAC023可以与OsNAC026二聚并在细胞核中定位,从而调节涉及种子大小和重量的基因[142.].
由于水稻种子主要供人类食用,其成分是需要考虑的主要特征之一。Onac127和Onac129在Caryopsis中表达,相应的基因产物调节与籽粒填充期间与碳水化合物运输有关的淀粉积累和基因[143.].
另一个重要的商业特征是粮食产量,由众多因素决定,例如,抗旱胁迫和射击分支。过度表达奥纳克5.,osnac9.和奥纳克10.导致根直径和架构的变化导致促进耐受性和谷物产量增加[144.,145.,146.].同样的,OsNAP和SNAC1在有限的水分条件下,过度表达导致更高的种子产量[147.,148.].然而,有趣的是,并非所有参与干旱胁迫缓解的NAC转录因子都能提高籽粒产量Onac022[149.].分枝最终会影响籽粒产量。例如,osnac2.调节枝分枝[150]植物身高[151].osnac2.是由miR164b;如果序列被突变为抵抗力miR164b,则最终粒数增加[152].
苹果 (马吕斯有明显)
在苹果品种“金鲜”中,王和徐[153]发现MdNAC1和MdNAC2分别与乙烯受体相互作用并共同表达MdRTE1a(Malus domestica逆转 - 乙烯Sensitivity1a) 和MdRTE1b.这表明可能与梨果的生长和成熟有关。之后,mdnac1.也被发现与植株高度和耐旱性有关,因为它的过度表达导致矮化表型[154]降低水分损失和稳定的光合速率[155].此外,贾和同事们还提出了这样的假设mdnac1.控制ABA的生物合成[154].
NAC转录因子介导苹果中乙烯和生长素的串扰,特别是当乙烯的产生受到损害时[156],正如拟南芥中所提出的[91].
张和合作者[157发现,在果实生长和成熟过程中,13个NAC基因在许多组织中差异表达。对其对1-MCP处理和乙烯暴露的反应的评价表明NACS可以以乙烯依赖性和独立的方式调节沼泽地开发。通过MDNAC47进一步证实了乙烯信号传导的调解,其直接结合乙烯生物合成的阳性调节剂MdERF3(Malus Domestica乙烯反应因素),调节盐胁迫耐受性[158].之所以叫MdNAC47,是因为它被认为是拟南芥的同源物anac047,但其基因组位点最近被注释为MdNAC63[159].
果实硬度是果实采后保存的一个重要性状,也受NAC转录因子的控制。其中,NAC18.1蛋白与番茄NOR具有高度的相似性,可能是果实软化和收获日期的主要决定因素[160,161].肉质水果成熟的另一个典型过程是花青素等类黄酮的积累,花青素使水果呈现出颜色,从而吸引食果动物。162].MdNAC52过表达导致苹果愈伤组织中花青素的积累,并诱导其表达mdmyb9.和mdmyb11.,调节原花青素生物合成[163].最近,MDNAC042还发现与红苹果中的花青素含量正相关,通过用MDMYB10的二聚化调节色素沉着[164].
草莓(草莓属属)
在商品草莓(草莓属x ananassa),这要归功于与林地草莓(Fragaria Vesca.)基因组165].其中六种与水果成熟和衰老有关:FaNAC006,FANAC021.,FANAC022.,FANAC035.,FANAC042,FANAC092..它们的表达模式与花青素生物合成相关[166],它们的产品在组织软化中发挥作用[167].最近,研究证实FaNAC035通过控制果实软化和色素和糖的积累来调控果实的成熟。此外,它还调节ABA的生物合成和信号传递以及细胞壁的降解和修饰[168].
FANAC087.和FANAC038是由miRNA164[169,就像发生在拟南芥与ORE1[170].自FANAC087.和FANAC038在成熟的最后阶段增加它们的表达[169],李和同事[171]分析了它们在采后贮藏条件下的调控,证实了二者之间的负相关关系miRNA164和它的NAC信使目标。srna作为收获后货架期的调节者的作用最近得到了证实,强调NAC和其他转录因子家族代表了重要的靶标[172].
商业草莓(草莓属x ananassa)是通过亲本杂交获得的草莓属chiloensis和草莓属virginiana.由于其有限的收获后期兴趣,涉及果实成熟调节和细胞壁重塑的转录因子草莓属chiloensis,包括NAC助教。其中FcNAC1与FcPL (草莓属chiloensis果胶酶),有助于细胞壁重塑[173].
橙色的 (素类)
鉴于甜橙的经济和营养重要性,果实质量和持续时间监管机构的发现一直是达到的重要目标。在橙色,属于NAC超家族的转录因子代表这些过程的关键要素之一。鉴定了在晚熟突变体和野生型甜橙之间差异表达的NAC基因[174),其中NAC61.,NAC74,NAC84.和RD26.(对干燥敏感的).特别是,RD26.与果糖、葡萄糖积累呈高度相关;的拟南芥orthologueRD26./anac072.是ABA信号的转导器[175],并激活参与叶片衰老过程中叶绿体蛋白降解的基因表达[176].
CitNAC在橙色果实成熟期间在果皮和纸浆中表达,并且在系统发育地类似atnap.[177].这表明可能涉及CitNAC在甜橙果实开发和衰老。
为了降低成熟果实中柠檬酸含量,CitNAC62与CitWRKY1协同调控CitAco3,涉及柠檬酸分解代谢的穴位水合物[178].
与番茄一样,胁迫相关的NAC转录因子在确定水果质量方面发挥着积极作用,从而影响了采后保护。粉丝和同事[179指出,CSNAC,Arabidopsis Ataf1的正交,参与柑橘剥点,这是一种影响柑橘类水果的质量和经济价值的疾病。NAC转录因子也参与了对冷储存的反应,可能增加了花青素含量[180].Mitalo和合作者[181发现NAC超家族参与了转录级联反应,其产物有助于对抗柑橘类水果的一种破坏性疾病——柑橘黄龙病(Bove, 2006)。它们也可能参与了柠檬果实中类似的抵抗过程[181].特别是,NAC-1和RD26.在柑橘绿化的症状和无症状阶段期间检测转录物[182].此外,已经发现了许多参与响应多重应力的许多其他柑橘NAC转录因子[183].然而,还需要进一步的研究来揭示它们在确定果实品质和正常发育中的作用。
香蕉(穆萨acuminata)
香蕉NAC超家族的研究始于预测可能编码这类转录因子的基因座,以及定义比较单子叶和双子叶序列的同源组[28.].最近的工作实现了之前的发现,鉴定了所有12条染色体上的181个NACs [184].10.MaNACs与乙烯处理过的香蕉果实的成熟有关,其中一些启动子携带乙烯响应元件。其中六人(MaNAC1到MaNAC6)已经以前已经表征为乙烯介导的果实成熟的一部分[185].MaNAC1(MaNAC087)以其在胁迫耐受性和果实成熟中的作用而闻名,在冷应激之后诱导,并与冷信号通路元件物理相互作用[185].而且,Manac1与Maeil5互动(穆萨acuminata乙烯不敏感3样5),乙烯信号通路的下游组分[186].与Manac1一样,Manac2(Manac092)与Maeil5直接相互作用,其表达在香蕉果皮的果皮和纸浆中均以乙烯上调[186].另外,表示MaNAC1和MaNAC2,加上MaNAC5(MANAC140),在感染后的果实中上调Collettrichum Musae.[187].此外,MANAC5可以与WRKY转录因子相互作用,并激活与病因相关基因进行抵消疾病[187].到目前为止,在香蕉中发现的其他NAC转录因子在叶片衰老中发挥作用[188或干旱胁迫[189,190].进一步的研究是深化NAC超家族在香蕉果实成熟中的作用。
结论
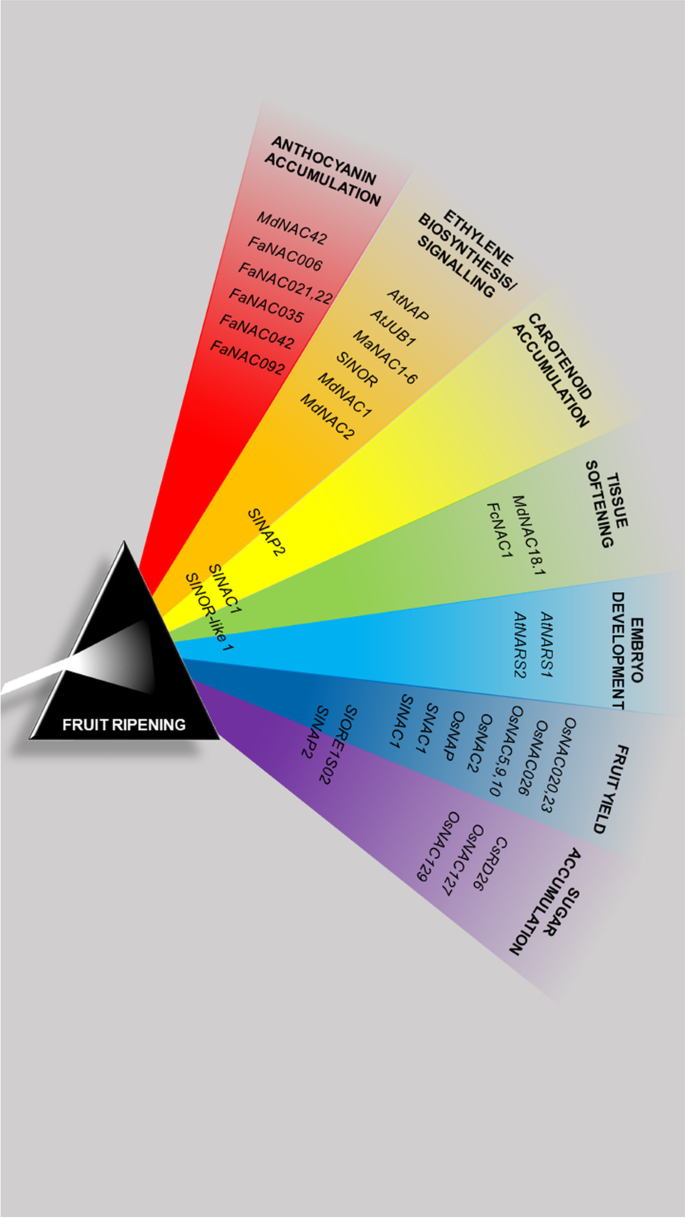
水果的经济和饮食相关性是探索非模型物种中果成熟和衰老的重要刺激。关于果实成熟,NAC转录因子发挥枢轴作用,因此提出了它们作为调节开发和成熟的有趣目标,并延长果实保质期。在这项工作中,我们提供了在模型物种和主要作物物种中鉴定的水果相关NAC转录因子的概要(图。3.).必须微调成熟和成熟的过程,以确保保护种子生长和后代的正确释放。因此,它们由属于不同家庭的互连转录因子网络来调节。
不幸的是,非模型物种尚未深入调查,但从可用数据中,很明显NAC转录因素代表水果发育,成熟和收获后生命的规定所需的保守家庭。由于它们在许多物种中存在普遍存在,揭幕NAC TF调节网络可以代表在经济相关物种中调节收获后果养护和病原体抵抗的潜在工具。在这个观点中,如辛格和合作者的建议[191],未来的研究可以集中在分析这些转录因子之间的冗余度,以确定调控果实成熟的关键角色。
与此同时,NAC互作体的鉴定可以揭示其活性的潜在抑制因子或增强因子,有助于商业水果对病原菌的保护和响应。
数据和材料的可用性
不适用。
缩写
- 阿巴:
-
脱盐酸
- DBD:
-
DNA结合域
- 南京:
-
NAM / ATAF / CUC
- NLS:
-
核定位信号
- ”:
-
负监管领域
- 山姆:
-
技条顶端分生组织
- TF:
-
转录因子
- TRR:
-
转录调控区
参考文献
- 1.
陈志强,陈志强,陈志强,等。种子扩散与果实类型的演化:系统发育和生态系统的初步研究。中国科学(d辑:地球科学)2008;
- 2。
水果——被子植物的创新。在:果实成熟的分子生物学和生物化学。牛津:布莱克威尔出版有限公司;2013.21-42页。https://doi.org/10.1002/9781118593714.ch2..
- 3.
烟草到番茄:茄科植物果实多样性的系统发育研究。中国农业科学。2002;53:2001-22。https://doi.org/10.1093/jxb/erf068.
- 4.
陈志强,陈志强,陈志强,等。水果,蔬菜,与健康:一个全面的叙述,伞式回顾的科学和建议加强公共政策,以提高摄入量。食品科学。2019;60:2174-211。https://doi.org/10.1080/10408398.2019.1632258.
- 5.
Mason-d'crozd,博加德Jr,呜咽Tb,cenacchi n,dunston s,herrero m等。水果和蔬菜生产,需求和全球和国家层面的推荐消费之间的差距:综合建模研究。柳叶刀行星健康。2019; 3:E318-29。https://doi.org/10.1016/s2542-5196(19)30095-6.
- 6.
植物特异性转录因子的dna结合结构域:结构、功能和进化。植物生态学报。2013;18:267-76。https://doi.org/10.1016/j.tplants.2012.09.001.
- 7.
Joshi R, Wani SH, Singh B, Bohra A, Dar ZA, Lone AA,等。转录因子与植物对干旱胁迫的响应:目前的认识和未来的方向。植物科学学报2016;7(7):1-15。
- 8.
李敏,王胜,尹洪涛。植物转录因子在抗非生物胁迫中的作用。中华医学杂志。2018;19:1-29。
- 9.
acta botanica sinica(云南植物研究);acta botanica sinica(云南植物研究);生物谷biosciences . 2017; 18:335-51。
- 10.
Chen G,亚历山大L,格尔特森D. EIL样转录因子的组成型表达部分恢复乙烯不敏感NR番茄突变体中的成熟。J Exp Bot。2004; 55:1491-7。
- 11.
MADS-box转录因子对番茄果实成熟的调控。日本农业Res Q. 2016; 50:33-8。
- 12.
陈志强,陈志强,陈志强,等。番茄组织特异性转录调控和代谢产物积累的研究进展。原生质。2020;257:1093 - 108。https://doi.org/10.1007/s00709-020-01492-2.
- 13。
曹华,陈建军,岳敏,徐超,简伟,刘勇,等。番茄转录抑制因子MYB70直接调控乙烯依赖型果实成熟。植物j . 2020; 104:1568 - 81。https://doi.org/10.1111/tpj.15021.
- 14。
傅C,Chen H,Gao H,Lu Y,Han C,Han Y.两只番木瓜MyB蛋白质通过调节细胞壁降解和类胡萝卜素生物合成的一些基因进行果实成熟。J SCI食物农业。2020; 100:4442-8。https://doi.org/10.1002/jsfa.10484.
- 15.
关键词:柑桔,晚熟突变体,转录组,基因组,转录因子2016.https://doi.org/10.1371/journal.pone.0154330.
- 16.
高军,张勇,李智,刘明。乙烯响应因子在果实成熟中的作用。食品质量标准2020;4:15-20。https://doi.org/10.1093/fqsafe/fyz042.
- 17.
kksar G, Sangchay W, Pinsorn P, Sangpong L, Sirikantaramas S.榴莲Dof基因家族全基因组分析揭示了果实成熟相关和品种依赖的Dof转录因子。Sci众议员2019;9:12109。https://doi.org/10.1038/s41598-019-48601-7.
- 18.
谢玉刚,马云云,毕鹏,魏伟,刘杰,胡勇,等。转录因子FvTCP9通过调节脱落酸和花青素的生物合成来促进草莓果实成熟。植物生理生化。2020;46:374 - 83。https://doi.org/10.1016/j.plaphy.2019.11.004.
- 19.
徐Y,徐H,墙壁mm,阳j.转录因子Squamosa启动子结合蛋白质样基因家族在番木瓜(Carica番木瓜)的发育和成熟。基因组学。2020; 112:2734-47。
- 20.
NAC转录因子的dna结合特异性和分子功能。植物科学。2005;169:785 - 97。
- 21.
NAC转录因子在植物非生物胁迫反应中的作用。生物物理学报。2012;19:97 - 103。https://doi.org/10.1016/j.bbagrm.2011.10.005.
- 22.
Puranik S,Sahu PP,Srivastava PS,Prasad M.NAC蛋白:调节和在应力耐受的作用。趋势植物SCI。2012; 17:369-81。https://doi.org/10.1016/j.tplants.2012.02.004.
- 23。
Mohanta TK, Yadav D, Khan A, Hashem A, Tabassum B, Khan AL,等。NAC转录因子的基因组学、分子和进化视角。2020.https://doi.org/10.1371/journal.pone.0231425.
- 24。
Souer E,Van Houwelingen A,Kloos D,Mol J,Koes R.在胚胎和花中的图案形成需要喇叭花的无顶部分泌基因,并在分生和原始界限中表达。细胞。1996年; 85:159-70。
- 25。
Aida M, Ishida T, Fujisawa H, Tasaka M.拟南芥器官分离相关基因:杯状子叶突变体的分析。植物细胞。1997;9:841-57。
- 26。
Christianson JA, Dennis ES, Llewellyn DJ, Wilson IW。ATAF NAC转录因子:植物逆境信号的调控因子。植物信号行为。2010;5:428-32。
- 27。
拟南芥ATAF1转录因子通过直接调控叶绿体维持和衰老的转录级联而促进衰老。植物杂志。2015;168:1122-39。https://doi.org/10.1104/pp.15.00567.
- 28.
香蕉(Musa acuminata) NAC转录因子的基因组分析及单子叶和双子叶NAC同源群的定义。植物学报。2014;65:63 - 80。
- 29.
aptala3 /PISTILLATA花同源性基因的直接靶点是NO顶端分生组织同源物。细胞。1998;92:93 - 103。
- 30.
王志强,王志强,王志强,等。拟南芥茎尖分生组织和子叶的形成:杯状子叶和无分生组织基因的相互作用。发展。1999;126:1563 - 70。
- 31.
关键词:拟南芥,杯状子叶组织,分生组织,|发展。2001;128:1127-35。https://dev.biologists.org/content/128/7/1127.2020年9月26日。
- 32.
Hibara KI, Takada S, Tasaka M. CUC1基因激活sam相关基因的表达诱导不定芽形成。植物j . 2003; 36:687 - 96。
- 33.
vroemen cw,mordhorst ap,albrecht c,kwaaitaal macj,de vries sc。拟南芥中的边界和芽分泌形成需要杯形子叶3基因。植物细胞。2003; 15:1563-77。
- 34.
Weir I,Lu J,Cook H,Cansier B,Schwarz-Sommer Z,Davies B. Cupuliformis在Antirrhinum中建立了侧向器官界限。发展。2003; 131:915-22。https://doi.org/10.1242/dev.00993..
- 35.
陈志强,陈志强,陈志强,等。MIR164A和CUC2基因之间的平衡控制着拟南芥的叶缘锯齿。植物细胞。2006;18:2929-45。
- 36。
拟南芥NAC1通过向TIR1下游转导生长素信号促进侧根发育。基因Dev。2000;14:3024-36。
- 37。
他xj,mu rl,cao wh,张紫杉,张js,陈声。AtNAC2,乙烯和养猪信号传导途径下游的转录因子,涉及盐应激响应和侧根发育。工厂J. 2005; 44:903-16。
- 38。
NAC家族转录因子AtNAP在叶片衰老过程中起重要作用。植物j . 2006; 46:601-12。
- 39.
Uauy C,Distelfeld A,Fahima T,Blechl A,Dubcovsky J.调节衰老的NAC基因改善了小麦中的粒子蛋白,Zn和Fe含量。科学(80 -)。2006; 314:1298-301。
- 40.
kaersgaard T, Jensen MK, Christiansen MW, Gregersen P, Kragelund BB, Skriver K.衰老相关大麦NAC (NAM, ATAF1,2, CUC)转录因子通过一个无序的调控域与自由基诱导的细胞死亡1相互作用。J Biol Chem. 2011; 286:35418-29。
- 41.
杨sd,徐pj, Yoon HK, Park CM。拟南芥NAC转录因子VNI2通过COR/RD基因将脱落酸信号整合到叶片衰老过程中。植物细胞。2011;23:2155 - 68。
- 42.
Lee S,SEO PJ,Lee Hj,Park Cm。NAC转录因子NTL4在拟南芥中促进干旱诱导的叶片衰老期间的活性氧物种产生。工厂J. 2012; 70:831-44。
- 43.
kou x,watkins cb,gan ss。Arabidopsis Atnap调节水果衰老。J Exp Bot。2012; 63:6139-47。https://doi.org/10.1093/jxb/sers266.
- 44.
范凯,毕碧N,甘胜,李飞,袁胜,倪敏,等。一个新的NAP成员GhNAP参与陆地棉叶片衰老。J Exp Bot. 2015; 66:4669-82。
- 45.
陈志强,陈志强,陈志强,等。NAC转录因子在植物衰老过程中的作用。植物。2015;4:412-48。
- 46.
高崎,Maruyama K, Takahashi F, Fujita M, Yoshida T, Nakashima K,等。胁迫响应NAC转录因子SNAC-As介导aba诱导的叶片衰老。植物j . 2015; 84:1114-23。
- 47。
Pimenta MR, Silva PA, Mendes GC, Alves JR, Caetano HDN, Machado JPB等。胁迫诱导的大豆NAC转录因子GmNAC81在发育程序性叶片衰老中发挥积极作用。植物生理学杂志。2016;57:1098-114。
- 48。
毛超,吕波,张波,沈军,何军,等。水稻nac转录因子通过ABA生物合成促进叶片衰老。植物杂志。2017;174:1747 - 63。
- 49。
李胜,徐华,鞠震,曹东,朱辉,付东,等。MADS-box转录因子RIN-MC融合具有转录活性,调控多种成熟基因的表达1。植物杂志。2018;176(1):891 - 909。
- 50。
陈志强,王志强,王志强,等。番茄果实成熟因子对番茄叶片衰老的影响。J Exp Bot. 2019; 70:2727-40。
- 51。
TRAN LSP,Nishiyama R,Yamaguchi-Shinozaki K,Shinozaki K.通过生物技术方法提高植物中非生物胁迫耐受性的潜在利用。GM庄稼。2010; 1:32-9。
- 52。
Nuruzzaman M,Sharoni Am,Kikuchi S. NAC转录因子的角色在植物中生物和非生物应激反应的调控中的作用。前微生物。2013; 4:1-16。
- 53.
少世,王H,唐X.NAC转录因子在植物多生物应激反应中的进展与前景。前植物SCI。2015; 6:902。https://doi.org/10.3389/fpls.2015.00902.
- 54.
王G,张某,马X,王Y,孔F,萌Q.来自番茄的应激相关的NAC转录因子(SLNAC35)在生物和非生物胁迫中起着积极作用。physiol植物。2016; 158:45-64。https://doi.org/10.1111/ppl.12444.
- 55.
Tweneboah s,oh sk。NAC转录因子在溶于作物中生物与非生物应激应激调控中的生物学作用。J植物生物科技。2017; 44:1-11。
- 56.
张志强,徐鹏。植物抗逆相关转录因子的研究进展。基因(巴塞尔)。2019; 10:1-23。
- 57.
关键词:转基因拟南芥,NAC基因GmNAC109,侧根形成,非生物胁迫植物学报。2019;10(8):1-12。
- 58.
关键词:拟南芥,胁迫响应,NAC转录因子,lldreb1, LLZHFD4国际分子生物学杂志。2019;20:1-20。
- 59.
陈丽萍,中岛康,佐久间,辛普森,Fujita Y, Maruyama K,等。拟南芥干旱胁迫诱导NAC转录因子的分离和功能分析。植物细胞。2004;16:2481 - 98。https://doi.org/10.1105/tpc.104.022699.
- 60.
Bhatnagar-Mathur P, Devi MJ, Reddy DS, Lavanya M, Vadez V, Serraj R, et al.;转基因花生(Arachis hypogaea L.)在胁迫诱导下表达DREB1A可提高水分限制条件下的蒸腾效率。Plant Cell rep 2007; 26:2071-82。
- 61.
高飞,熊安,彭锐,金旭,徐军,朱斌,等。OsNAC52是一种水稻NAC转录因子,可能对ABA有响应,并在转基因植株中具有抗旱性。植物细胞组织器官邪教。2010;100:255-62。https://doi.org/10.1007/s11240-009-9640-9.
- 62.
Nakashima K,Yamaguchi-Shinozaki K,Shinozaki K.在干旱反应中的转录监管网络及其在非生物应激反应中的串扰,包括干旱,冷和热量。前植物SCI。2014; 5(5月):1-7。
- 63.
王j,连w,cao,王x,王g,qi c等。来自Bonac019的过表达,来自Brassica Oleracea的NAC转录因子,负调节拟南芥中的脱水反应和花青素生物合成。SCI批准。2018; 8:1-15。https://doi.org/10.1038/s41598-018-31690.1..
- 64.
Guérinc,roche j,allard v,ravel c,mouzeyar s,bouzidi mf。在面包小麦(T. aestivum L.)下干旱和热应力下Nac系列的基因组分析,扩张和表达。Plos一个。2019; 14:1-26。https://doi.org/10.1371/journal.pone.0213390.
- 65.
袁晓霞,王华,蔡军,毕颖,李冬,宋飞。水稻NAC转录因子ONAC066对干旱和氧化胁迫响应的正向调节作用。BMC Plant Biol. 2019; 19:1-19。
- 66.
黄强,王勇,李斌,常杰,陈明,李凯,等。来自小麦的NAC转录因子TaNAC29可增强转基因拟南芥的耐盐和耐旱能力。BMC Plant Biol. 2015; 15:1-15。https://doi.org/10.1186/s12870-015-0644-9..
- 67.
他z,li z,lu h,huo l,wang z,王y等。来自Tamarix Hispida,ThnAc7,通过增加反应性氧物种清除能力来赋予盐和渗透胁迫耐受性的NAC蛋白。植物。2019; 8:1-19。
- 68.
Nuruzzaman M,Sharoni Am,Satoh K,Karim Mr,Harikrishna Ja,Shimizu T,等。NAC转录因子家族基因在稻幼龙病毒的感染期间在水稻中差异表达,米黑色斑点矮化病毒,稻草特技病毒,稻褴褛的特技病毒和水稻暂时性泛黄病毒。前植物SCI。2015; 6(9月):1-15。
- 69.
张华,吕胜,王成,季伟。转录因子在小麦抗病中的作用及其在育种中的应用前景。植物生物多样性(英文版);https://www.meddocsonline.org/journal-of-plant-biology-and-crop-research/The-role-of-transcription-factor-in-wheat-defense-against-pathogen-and-its-prospect-in-breeding.html.9月29日2020年。
- 70.
Meisrimler CN,Pelgrom AJE,Oud B,Out S,Van Den Ackerveken G.多个柔软的霉菌效应源靶向生菜中的应力相关NAC转录因子LSNAC069。植物J. 2019; 99:1098-115。
- 71.
元X,王H,Cai J,Li D,宋F. NAC转录因子植物免疫。植物疗法res。2019; 1:1-13。
- 72.
高志华,杨树华,朴雅,勒鲁塞尔·欧,韩国汉。ANAC012是植物特异性NAC转录因子家族的成员,负调控拟南芥木质素纤维的发育。植物j . 2007; 50:1035-48。
- 73.
孙浩,胡敏,李军,陈丽,李敏,张胜,等。通过对NAC转录因子的综合分析,揭示了它们在棉花纤维发育和胁迫反应中的作用。BMC Plant Biol. 2018; 18:1-15。
- 74。
王国良。水稻细胞壁发育与NAC转录因子OsSWN1的关系。植物学报。2015;58:44-51。https://doi.org/10.1007/s12374-014-0400-y.
- 75。
Nakano Y,Yamaguchi M,Endo H,Rejab Na,Ohtani M. NAC-MyB的基于NAC-MYB的陆地植物中次级细胞壁生物合成的转录调控。前植物SCI。2015; 6:288。https://doi.org/10.3389/fpls.2015.00288.
- 76。
MITSUDA N,OHME-TAKAGI M.NAC转录因子NST1和NST3通过在建立组织标识后通过促进二次壁形成来调节部分冗余的方式调节POD。工厂J. 2008; 56:768-78。https://doi.org/10.1111/j.1365-313X.2008.03633.x.
- 77。
张辉,应勇强,王健,赵晓辉,曾伟,Beahan C,等。转录组分析为毛竹(Phyllostachys edulis)茎部木质化的形成提供了深刻的见解。Sci众议员2018;8:1-16。https://doi.org/10.1038/s41598-018-21766-3.
- 78.
杨勇,刘志刚,罗德曼,温凯乐,杨志刚,等。PdWND3A是一种含NAC结构域的木材相关蛋白,影响杨树木质素的生物合成和组成。BMC Plant Biol. 2019; 19:1-12。
- 79.
yu Y. osknat7桥梁二次细胞壁形成和细胞生长调节。植物理性。2019; 181:385-6。
- 80.
麦卡锡,钟河,叶zh。二级壁NAC结合元素(SNBE),由次级壁NAC主开关进行靶基因激活所需的关键顺式作用元件。植物信号表现。2011; 6:1282-5。
- 81.
钟锐,李晨,叶振华。拟南芥次生壁NAC主开关直接靶标的全局分析。摩尔。2010;3:1087 - 103。
- 82.
Jensen Mk,Kjaersgaard T,Petersen K,Skriver K. NAC基因:拟南芥中荷尔蒙信号传导的时间特异性调节因子。植物信号表现。2010; 5:907-10。
- 83.
Ma X,Zhang Y,Turečkováv,xue gp,fernie ar,Mueller-roeber b等人。NAC转录因子SLNAP2调节番茄中的叶片衰老和果实产量。植物理性。2018; 177:1286-302。
- 84.
寇旭,周军,吴策策,杨松,刘勇,柴磊,等。ABA/乙烯与NAC转录因子在番茄果实成熟过程中的相互作用植物生物学杂志。2021;1:3。https://doi.org/10.1007/s11103-021-01128-w.
- 85.
Kim YS, Kim SG, Park JE, Park HY, Lim MH, Chua NH,等。一种膜结合的NAC转录因子调节拟南芥的细胞分裂。植物细胞。2006;18:3132-44。
- 86.
卜强,姜浩,李长博,翟强,张军,吴旭,等。拟南芥NAC转录因子ANAC019和ANAC055在调控茉莉酸信号防御反应中的作用。细胞研究》2008;18:756 - 67。https://doi.org/10.1038/cr.2008.53.
- 87.
Shahnejat-Bushehri S, Tarkowska D, Sakuraba Y, Balazadeh S. Arabidopsis NAC转录因子JUB1调控GA/BR代谢和信号通路。Nat植物。2016;2:1-9。https://doi.org/10.1038/NPLANTS.2016.13.
- 88.
Shahnejat-Bushehri S, Allu AD, Mehterov N, Thirumalaikumar VP, Alseekh S, Fernie AR, et al。拟南芥NAC转录因子JUNGBRUNNEN1对番茄赤霉素和油菜素内酯代谢及信号基因具有保守调控作用。植物学报2017;8 - 13。
- 89.
植物生长素通过抑制次生细胞壁NAC-domain转录因子的表达来调控木质部发育的时间。杂志。2019;165:673 - 89。https://doi.org/10.1111/ppl.12766.
- 90。
安志强,李志强,李志强。ANAC保守结构域的结构,是NAC家族转录因子的一员。EMBO众议员5:297 2004;303年。
- 91。
NAC转录因子:结构不同,功能不同。植物科学进展。2005;10:79-87。
- 92。
Kikuchi K,Ueguchi-Tanaka M,Yoshida Kt,Nagato Y,Matsusoka M,Hirano Hy。水稻NAC基因家族的分子分析。Mol Gen Genet。2000; 262:1047-51。https://doi.org/10.1007/PL00008647..
- 93.
拟南芥NAC结构域超家族的一个成员AtNAM的分子特征。acta botanica sinica(云南植物学报)2002;50:237-48。https://doi.org/10.1023/A:1016028530943.
- 94.
陈强,王强,熊磊,楼志刚。水稻胁迫响应NAC1保守结构域的结构分析。蛋白质细胞。2011,盘中一度- 63。https://doi.org/10.1007/s13238-011-1010-9.
- 95.
Welner DH, Lindemose S, Grossmann JG, m ø lleggaard NE, Olsen AN, Helgstrand C,等。植物特异性NAC转录因子在晶体和溶液中的DNA结合:与WRKY和GCM转录因子的牢固连接。j . 2012; 444:395 - 404。https://doi.org/10.1042/BJ20111742.
- 96.
郝yj,song qx,陈hw,zou hf,wei w,kang xs等。植物NAC型转录因子蛋白质含有用于抑制转录激活的名称结构域。Planta。2010; 232:1033-43。
- 97.
植物胁迫和衰老过程中NAC转录因子的基因调控和蛋白质相互作用网络。IUBMB生活。2014;66:156 - 66。https://doi.org/10.1002/iub.1256..
- 98。
GómezMD,Vera-Sirera F,Pérez-Amador MA。干燥和肉质水果中衰老的分子计划。J Exp Bot。2014; 65:4515-26。
- 99。
田立田,田志强,田志强,等。NAC家族蛋白NARS1/NAC2和NARS2/NAM在拟南芥中调控胚胎发生。植物细胞。2008;20:2631-42。https://doi.org/10.1105/tpc.108.060160.
- One hundred.
Tigchelaar E,Tomes M,Kerr E,Barman R.一种新的果实成熟突变体,非果实(也不)。Rep Tomato Genet Coop。1973; 23:33-4。
- 101.
Mizzotti C,Rotasperti L,Moretto M,Tadini L,Resentiinf,Galliani Bm,等。Arabidopsis Siliques的时间过程转录组分析公开了果实发育和成熟必需的基因。植物理性。2018; 178:1249-68。https://doi.org/10.1104/pp.18.00727.
- 102.
Sato S, Tabata S, Hirakawa H, Asamizu E, Shirasawa K, Isobe S, et al.;番茄基因组序列提供了深入了解肉质水果的进化。大自然。2012;485:635-41。
- 103.
Sakuraba Y, Kim Y- s, Han S-H, Lee B-D, pan - c。拟南芥转录因子NAC016通过一个涉及NAP的三叉前导调控环路抑制AREB1的转录,从而促进干旱胁迫响应。植物细胞。2015;27:1771 - 87。https://doi.org/10.1105/TPC.15.00222.
- 104.
Tigchelaar EC, McGlasson WB, Franklin MJ。番茄(Lycopersicon esculentum Mill.)的成熟抑制剂(rin)和非成熟(nor)突变体的F1杂种的自然和乙烯利刺激成熟。植物生理学报,1978;5:449-56。https://agris.fao.org/agris-search/search.do?recordID=AU7901714.Accessed 15 Oct 2020。
- 105.
Klee HJ, Giovannoni JJ。番茄果实成熟和品质性状的遗传与控制。Annu Rev Genet, 2011; 45:41-59。https://doi.org/10.1146/annurev-genet-110410-132507.
- 106.
Karlova R, Chapman N, David K, Angenent GC, Seymour GB, De Maagd RA。肉质果实发育和成熟的转录控制。J Exp Bot. 2014; 65:4527-41。
- 107.
关键词:Penjar番茄,贮藏期,遗传多样性,遗传多样性植物遗传资源学报。2012;59:219-29。
- 108.
番茄Penjar种质的NAC-NOR突变可以减弱多种代谢过程,延长果实的货架期。食品化学。2018;259:234-44。https://doi.org/10.1016/j.foodchem.2018.03.135.
- 109.
高毅,朱宁,朱旭,吴敏,蔡忠,等。由fruitENCODE和新的CRISPR/Cas9 CNR和NOR突变体揭示的成熟调控网络的多样性和冗余性。Hortic杂志2019;6:39。
- 110。
王R,Da Rocha Tavano EC,Lammers M,Martinelli AP,Angenent GC,De Maagd Ra。番茄果实开发中转录因子功能的再评估,用CRISPR / CAS9诱变成熟。SCI批准。2019; 9:1-10。
- 111。
Wang R, Angenent GC, Seymour G, de Maagd RA。重温主调控因子在番茄成熟中的作用。植物生态学报。2020;25:291-301。https://doi.org/10.1016/j.tplants.2019.11.005.
- 112。
高艳,魏伟,范志,赵旭,张颖,景勇,等。nor突变和na - nor转录因子在番茄果实成熟中的作用的重新评价。J Exp Bot. 2020; 71:3560-74。
- 113.
等。成熟抑制基因位点的等位基因突变在番茄成熟过程中产生广泛的变异。植物杂志。2020;183:80 - 95。
- 114.
Giovannoni JJ。果实发育和成熟的遗传调控。植物细胞。2004;16 (5):s170 - 80。https://doi.org/10.1105/tpc.019158.
- 115.
Barry CS, Giovannoni JJ。乙烯和果实成熟。植物生长调节剂。2007;26:143-59。
- 116.
Martel C, Vrebalov J, Tafelmeyer P, Giovannoni JJ。番茄MADS-box转录因子成熟抑制因子以无色非成熟依赖的方式与参与众多成熟过程的启动子相互作用。植物杂志。2011;157:1568 - 79。
- 117。
富士川M,Nakano T,Shima Y,ITO Y.番茄豆箱转录因子成熟抑制剂的直接靶向大规模鉴定揭示了果实成熟的调节。植物细胞。2013; 25:371-86。
- 118。
引用本文:Fujisawa M, Shima Y, Higuchi N, Nakano T, Koyama Y, Kasumi T, et al.通过转录组和染色质免疫沉淀分析鉴定番茄成熟调节剂RIN的直接靶点。足底。2012;235:1107-22。https://doi.org/10.1007/s00425-011-1561-2.
- 119。
王R,Lammers M,Tikunov Y,Bovy Ag,Angenent GC,De Maagd Ra。rin,nor和cnr自发性突变抑制了添加剂和背景上的番茄果实成熟。植物SCI。2020; 294:1-12。https://doi.org/10.1016/j.plantsci.2020.110436.
- 120.
c . Cantu D . Blanco-Ulate B . Yang L ., Labavitch JM ., Bennett AB ., Powell ALT.番茄果实对番茄灰霉病的成熟调控敏感性不需要RIN或乙烯,而需要NOR。植物杂志。2009;150:1434-49。
- 121.
金建峰,王志强,何清云,王景云,李鹏飞,徐建明,等。番茄(Solanum lycopersicum)铝胁迫下NAC转录因子家族的全基因组鉴定与表达分析BMC基因组学。2020;21:1-14。
- 122.
韩强,张建军,李华,罗志,欧阳斌,等。番茄胁迫应答NAC基因的鉴定及表达模式。Mol Biol rep 2012; 39:1713-20。
- 123.
韩QQ,宋永忠,张建宇,刘丽芳。番茄(Solanum lycopersicum)中SlNAC3基因调控种子发育作用的研究中国生物技术杂志。2014;89:423-9。
- 124.
李军,宋勇,张军,陈强,韩强。番茄成熟调节剂SlNAC3的研究进展。开放生命科学2018;13:518-26。
- 125.
朱敏,陈刚,张建军,张勇,谢强,赵志,等。非生物胁迫响应的na型转录因子SlNAC4调控番茄(Solanum lycopersicum)的耐盐、耐旱及胁迫相关基因。植物细胞代表2014;33:1851-63。
- 126.
朱米,陈克,周某,涂,王y,dong t等。一种新的番茄NAC(NAM ATAF1 / 2 / CUC2)转录因子,SLNAC4,用作果实成熟和类胡萝卜素积累的正调节因子。植物细胞生理。2014; 55:119-35。
- 127.
Kou X,Liu C,Han L,Wang S,Xue Z.NAC转录因子在乙烯生物合成,接收和番茄果实发信号中发挥着重要作用。Mol Genet基因组学。2016; 291:1205-17。
- 128.
李胜,高军,姚林,任刚,朱旭,高胜,等。ANAC072在年龄和黑暗诱导的叶片衰老过程中调控叶绿素降解的作用。植物细胞代表2016;35:1729-41。https://doi.org/10.1007/S00299-016-1991-1..
- 129.
Gao Y,Wei W,Zhao X,Tan X,Fan Z,Zhang Y等。NAC转录因子,NOR-LIDE1是番茄果实成熟的新阳性调节因子。Hortic Res。2018; 5:75。
- 130。
马宁宁,左玉青,梁晓青,尹波,王光,孟QW。多重逆境响应转录因子SlNAC1提高了番茄的耐冷性。杂志。2013;149:474 - 86。
- 131。
梁晓青,马宁宁,王国栋,孟X,艾西泽,孟QW。抑制SlNAC1会降低番茄植株的耐热性。医学杂志。2014;59:92-8。
- 132。
黄伟,苗敏,库德建,牛旭,欧阳波,张建军,等。SlNAC1是一种与应激相关的转录因子,在转录和翻译后水平上都有微调。新植醇。2013;197:1214-24。
- 133。
马宁,冯海峰,李东,杨东,吴超,等。番茄SlNAC1转录因子的过表达改变了果实的色素沉着和软化。BMC Plant Biol. 2014; 14:1-14。
- 134。
赵伟,梁晓东,马宁,等。抑制番茄SlNAC1转录因子延缓果实成熟。acta botanica yunnanica(云南植物研究). 2016;https://doi.org/10.1016/j.jplph.2016.01.014.
- 135。
Lira BS, Gramegna G, Trench BA, Alves FRR, Silva EM, Silva GFF,等。操纵衰老相关基因提高肉质果实产量。植物杂志。2017;175:77 - 91。https://doi.org/10.1104/pp.17.00452.
- 136。
俄亥俄州,公园,在李克,熙·帕特,吉尔·帕拟南芥鉴定鉴定三种遗传基因座控制叶片衰老。工厂J. 1997; 12:527-35。
- 137.
江赵口X, Y,吴C, B,张Z, Rathbun JR, et al。SNAC4和SNAC9转录因子对番茄类胡萝卜素生物合成和软化的影响差异显著。采后生物技术。2018;144:9-19。
- 138.
等。国家自然科学基金青年基金项目。番茄果实发育和代谢。植物学报。2019;10:1-23。
- 139.
张志强,张志强,张志强,等。水稻NAC转录因子家族全基因组分析。基因。2010;465:30-44。https://doi.org/10.1016/j.gene.2010.06.008.
- 140。
Murozuka e,Massange-sánchezJA,Nielsen K,Graumann Pl,Braumann I.基因组大麦NAC转录因子的广泛表征使得能够鉴定为单子叶植物的Poaceae家族独家的谷物特异性转录因子。Plos一个。2018; 13:1-28。
- 141。
Sharma R,Agarwal P,Ray S,Deveshwar P,Sharma P,Sharma N等。籼稻穗和种子发育阶段代谢和监管组分的表达动态。Funct综合基因组学。2012; 12:229-48。https://doi.org/10.1007/S10142-012-0274-3.
- 142。
三种水稻NAC转录因子杂种化并与种子大小相关。植物学报。2016;2016(7):1-16。
- 143。
任勇,黄志强,姜浩,王志,吴芳,熊勇,等。热胁迫响应型NAC转录因子异源二聚体在水稻颖果灌浆过程中起关键作用。bioRxiv。2020.https://doi.org/10.1101/2020.02.08.939728.
- 144.
郑志士,金泳三,白赫,郑赫,河实,道崔,等。在田间干旱条件下,OsNAC10的根特异性表达提高了水稻的抗旱性和产量。植物杂志。2010;153:185 - 97。
- 145.
雷泽拉斯MCFR,山东,金YS,Jung H,Bang SW,Choi Yd等。OSNAC9的过度表达改变了水稻植物的根系结构,提高了现场条件下的抗旱性和籽粒产量。植物Biotechnol J. 2012; 10:792-805。https://doi.org/10.1111/j.1467-7652.2012.00697.x.
- 146.
郑俊生,金永年,Redillas MCFR,张刚,郑赫,方西南,等。OsNAC5过表达增大了水稻植株的根直径,从而增强了抗旱性,提高了田间产量。植物生态学报2013;11:101-14。
- 147.
胡浩,戴敏,姚建军,肖波,李旭,张强,等。过表达NAM、ATAF和CUC (NAC)转录因子可以增强水稻的抗旱性和耐盐性。美国国家科学研究院2006;103:12987-92。https://doi.org/10.1073/pnas.0604882103.
- 148.
Chen M, MacGregor DR, Dave A, Florance H, Moore K, Paszkiewicz K, et al.;母体温度历史激活果实的开花位点T,根据一年的时间控制后代的休眠。中国科学技术大学学报(自然科学版)2014;111:18787-92。https://doi.org/10.1073/pnas.1412274111.
- 149.
洪Y,张H,黄L,Li D,Song F.过表达应激响应NAC转录因子基因Onac022的过度表达改善了水稻中的干旱和耐盐性。前植物SCI。2016; 7:1-19。
- 150。
毛超,丁伟,吴玉杰,何旭,寿华,等。在水稻中,nac结构域蛋白的过度表达促进了枝条的分枝。新植醇。2007;176:288 - 98。
- 151。
陈X,Lu S,Wang Y,Zhang X,LV B,Luo L等。编码影响植物高度的NAC转录因子的欧妥·奥纳克2通过在水稻中介导凝胶酸途径来影响植物高度。工厂J. 2015; 82:302-14。
- 152。
姜东,陈伟,董军,李军,杨峰,吴志伟,等。过表达抗mir164b的OsNAC2可改善水稻植株结构和产量。J Exp Bot. 2018; 69:1533-43。
- 153。
王安,徐坤。苹果乙烯还原敏感性的两种直方图。中国生物医学杂志2012;
- 154。
贾D,龚X,李米,李C,Sun T,MA F.一种新型苹果NAC转录因子基因的过表达,MDNAC1,赋予转基因苹果(Malus Domestica)中的矮化表型。基因(巴塞尔)。2018; 9:229。https://doi.org/10.3390/genes9050229.
- 155。
贾冬梅,姜强,龚晓峰,马峰。NAC转录因子对转基因苹果抗旱性的影响。植物生理生化。2019;139(3月):504-12。https://doi.org/10.1016/j.plaphy.2019.04.011.
- 156。
Busatto N,Tadiello A,Tareotti L,Costa F.苹果果实的变化成熟是由乙烯和生长素之间的交叉谈话刺激的转录电路调节。植物信号表现。2017; 12:1-4。https://doi.org/10.1080/15592324.2016.1268312.
- 157。
张强,李涛,张玲,董伟,王安。NAC基因在苹果生长和成熟过程中的表达分析。Hortic Sci。2018;45:1-10。
- 158。
安太平,姚建峰,徐瑞荣,尤春霞,王雪峰,郝玉娟。苹果NAC转录因子通过调节乙烯反应增强耐盐性。杂志。2018;164:279 - 89。
- 159。
李H,Ran K,Dong Q,Zhao Q,Shi S. 32 NAC转录因子(MDNAC)的克隆,测序和表达分析。peerj。2020; 8:E8249。https://doi.org/10.7717/peerj.8249.
- 160.
Larsen B,Migicovsky Z,Jeppesen AA,Gardner Km,Tellam-Andersen TB,Myles S等人。苹果基因组关联研究显示香气挥发物,糖组成和收获日期的基因座。植物基因组。2019; 12:180104。
- 161.
Yeats T,Migicovsky Z,Watts S,Song J,Forney C,Burgher-Maclellan K,等。NAC18.1的等位基因多样性是Apple(Malus Domestica)的果实强度和收获日期的主要决定因素。bioRxiv。2019年。https://doi.org/10.1101/708040.
- 162。
Schaefer HM, Schaefer V, levy DJ。动植物之间的相互作用是如何在交流方面产生新的见解的。趋势生态演变2004;19:577-84。
- 163。
孙强,姜胜,张涛,徐华,方辉,张军,等。苹果NAC转录因子MdNAC52通过MdMYB9和MdMYB11调控花青素和原花青素的生物合成。植物科学。2019;289(6):110286。https://doi.org/10.1016/j.plantsci.2019.110286.
- 164。
张胜,陈勇,赵林,李超,于军,李涛,等。一种新的NAC转录因子MdNAC42通过与MdMYB10互作调控红肉苹果花青素的积累。树杂志。2020;40:413-23。
- 165。
Moyano E, Martínez-Rivas FJ, Blanco-Portales R, Molina-Hidalgo FJ, Ric-Varas P, Matas-Arroyo AJ,等。Fragaria × ananassa果实发育和成熟过程中NAC转录因子家族的全基因组分析及表达《公共科学图书馆•综合》。2018;13:1-23。
- 166。
林艳,姜玲,陈强,李艳,张颖,罗艳,等。对红草莓和白草莓(Fragaria × ananassa)的转录组比较分析为花青素途径的调控提供了新的思路。植物生理学杂志。2018;59:1844-59。
- 167。
Moya-León MA, mat图- araya E, Herrera R.草莓果实软化过程中的分子事件。植物学报。2019;10(5):1-11。
- 168.
Martín-Pizarro C,Vallarino JG,Osorio S,Meco V,Urrutia M,Pillet J等。NAC转录因子Farif控制草莓成熟的果实。植物细胞。2021。https://doi.org/10.1093/plcell/koab070.
- 169.
徐旭,尹玲,应强,宋华,薛东,赖涛,等。高通量测序和降解组分析鉴定了草莓果实衰老相关的mirna及其靶标。《公共科学图书馆•综合》。2013;8:e70959。https://doi.org/10.1371/journal.pone.0070959..
- 170.
金俊华,吴瑞华,金俊,林波,李志华,崔胜,等。拟南芥中涉及miR164的年龄依赖性细胞死亡的三叉前馈调控。科学(80 -)。2009; 323:1053-7。https://doi.org/10.1126/science.1166386.
- 171.
李军,赖涛,宋华,徐昕。MiR164在低温下负调控NAC转录因子基因延缓草莓果实衰老的作用。acta botanica yunnanica(云南植物研究). 2017;64:251-9。
- 172.
王y,李文,张h,周j,罗y,张k等。SRNAMEOM和转录组分析提供了对草莓果实成熟的洞察力。基因组学。2020; 112:2369-78。https://doi.org/10.1016/j.ygeno.2020.01.008.
- 173.
Carrasco-Orellana C, Stappung Y, Mendez-Yañez A, Allan AC, Espley RV, Plunkett BJ, et al.;赤豆果实成熟相关转录因子FcNAC1的特性研究。Sci众议员2018;8:1-12。
- 174。
关键词:柑桔,晚熟突变体,转录组,基因组,转录因子《公共科学图书馆•综合》。2016;11:1-22。
- 175.
Fujita M,Fujita Y,Maruyama K,Seki M,Hiratsu K,Ohme-Takagi M,等。脱水诱导的NAC蛋白RD26参与新的ABA依赖性应力信号通路。工厂J. 2004; 39:863-76。https://doi.org/10.1111/j.1365-313X.2004.02171.x.
- 176。
Kamranfar I,Xue GP,Tohge T,Sedaghatmehr M,Fernie Ar,Balazadeh S等人。转录因子RD26是黑暗衰老期间代谢重编程的关键调节因子。新植物。2018; 218:1543-57。
- 177。
刘永忠,白明仁,范锐,叶金龙,曹永春,邓XX。中国柑桔(citrus sinensis osbeck)一个新的NAM、ATAF和cuclike基因的鉴定和表达模式。Plant Mol Biol rep 2009; 27:292-7。
- 178。
李SJ,尹XR,王WL,刘XF,张b,陈ks。Citrus Citnac62与CitWrky1合作,通过Citaco3的上调参与柠檬酸降解。J Exp Bot。2017; 68:3419-26。
- 179。
风扇j,gao x,杨yw,邓小,李紫术。产橙水果响应中NAC样基因的分子克隆与表征去除血压胁迫。植物mol biol rep。2007; 25:145-53。https://doi.org/10.1007/s11105-007-0016-1.
- 180。
Crifò T, Petrone G, Lo Cicero L, Lo Piero AR.短时间冷藏提高血橙花色苷含量及其生物合成相关转录本水平。中国农业科学。2012;60:476-81。
- 181.
等。低温对柠檬果皮的自然脱脂作用与内源性乙烯无关。J Exp Bot. 2020; 71:4778-96。https://doi.org/10.1093/jxb/eraa206.
- 182.
Martinelli F, Uratsu SL, Albrecht U, Reagan RL, Phu ML, Britton M,等。柑橘果实对黄龙病反应的转录组分析。《公共科学图书馆•综合》。2012;7:1-16。
- 183.
de Oliveira Tm,Cidade Lc,Gesteira As,Filho Mac,Filho Wss,Costa MGC。柑橘中NAC转录因子基因家族的分析揭示了涉及多种非生物应激反应的新型成员。树遗传学基因组织。2011; 7:1123-34。
- 184.
李b,范r,杨q,胡c,sheng o,deng g等。NAC转录因子家族在果实成熟过程中NAC转录因子家庭的基因组鉴定与表征。int j mol sci。2020; 21:1-19。
- 185.
山W,Kuang JF,Lu WJ,Chen Jy。香蕉果NAC转录因子Manac1是Maice1的直接目标,并通过与MacBF1相互作用而参与冷应力。植物细胞环境。2014; 37:2116-27。
- 186.
山W,kuang j,chen l,谢h,peng h,xiao y等。香蕉NAC转录甲基化和染色质图案化因子的分子表征及其与果实成熟过程中乙烯信号组分EIL的相互作用。J Exp Bot。2012; 63:5175-8。
- 187。
山W,陈杰,匡吉夫,路WJ。香蕉果NAC转录因子MAAC5与MAWRKYS合作,增强病因相关基因对Collettrichum Musae的表达。莫尔植物途径。2016; 17:330-8。
- 188。
来自香蕉(Musa x paradisiaca)的胁迫相关NAC转录因子MpSNAC67参与了叶绿素分解代谢途径的调控。植物生理生化。2018;132(8月):61-71。https://doi.org/10.1016/j.plaphy.2018.08.020.
- 189。
香蕉NAC转录因子MusaNAC042与耐干旱、耐盐性呈正相关。原生质。2017;254:803-16。
- 190。
negi s,tak h,ganapathi tr。Banana NAC转录因子(Musasnac1)通过调节气孔闭合和H 2 O 2含量来赋予抗旱耐受性。植物mol biol。2018; 96:457-71。https://doi.org/10.1007/s11103-018-0710-4.
- 191。
植物特异性NAC转录因子家族在作物改良中的重要意义。J Plant Res. 123AD;https://doi.org/10.1007/s10265-021-01270-y.
致谢
我们感谢James Friel对手稿的批判性阅读。作者通过APC倡议来承认米兰大学的支持。对于由于空间限制而无法引用的所有研究人员,我们深表歉意。
资金
这项工作得到了Ministero dell 'Istruzione, dell 'Università e della Ricerca (PRIN ISIDE, no。2015BPM9H3_005和PRIN微分子,批准号:2015BPM9H3_00520173LBZM2),并获得Università degli Studi di Milano到旧金山的奖学金。资助方没有参与实验设计、数据收集和分析或手稿的撰写。
作者信息
从属关系
贡献
SF, CM和SM写了这篇评论。所有作者都已阅读并批准了最终稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:表S1。
几种植物物种中鉴定的NAC转录因子数量。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Forlani,S.,Mizzotti,C.&Masiero,S。水果的NAC一侧:调整水果开发和成熟。BMC植物杂志21,238(2021)。https://doi.org/10.1186/s12870-021-03029-0.
收到了:
接受:
发表:
关键字
- 水果
- n
- 成熟
- 衰老
- 转录因子