- 研究文章
- 开放存取
- 发布:
候选效应探索感染和生存策略的比较转录组分析Bursaphelenchus Xylophilus.在不同的互动阶段,杉树
BMC植物生物学体积21文章编号:224(2021.)
抽象的
背景
松材线虫,Bursaphelenchus Xylophilus.是许多人的致命病原体松树中国种。本研究的目的是通过比较PWN三个转录组的差异表达基因和候选效应子,了解PWN与其宿主相互作用的分子机制B嗜木菌在不同的感染阶段。
结果
总共,在三个转录组(2.5%)中鉴定出62、69和46个候选效应子 h感染后6、12和24 感染后6天和15天)。除了未被鉴定的先驱外,其他候选效应物还参与宿主组织的降解、抑制宿主防御、靶向植物信号通路、摄食和解毒,这有助于B嗜木菌在宿主中成功存活。在我们的研究和实验中发现了7个候选效应子B嗜木菌转录组2.5 在所有三个转录组中鉴定出一个候选效应子。这些常见的候选效应子在感染阶段被上调,其中一个抑制病原体相关分子模式(PAMP)PsXEG1触发的细胞死亡尼古利亚娜·宾夕法尼亚州。
结论
结果表明:B嗜木菌分泌各种候选效果,其中一些在所有感染阶段继续运作。这些各种候选效果很重要B嗜木菌感染和存活,它们以不同的方式运作(例如分解宿主壁,抑制宿主防御,促进饲养效率,促进排毒和毒力函数)。目前的结果为有价值的资源提供了有价值的资源,对发病机制进行了深入的研究B嗜木菌从效应器的角度来看。
背景
松材线虫是针叶林最严重的病原之一,Bursaphelenchus Xylophilus.是全球森林生态系统的重要威胁,而松材线虫病(PWD)是由B嗜木菌导致亚洲和欧洲国家的经济损失大规模,特别是中国和日本[1.,2.].在中国,PWD的发生已经在18个省份分发(2020年第4号公报,中国国家林业和草地行政当局)。
B嗜木菌是一种具有独特喂养策略的迁徙植物植物线虫,其包括植物和噬菌体阶段,使其能够在宿主松树中繁殖和存活。由于之间的相互作用的复杂性B嗜木菌其宿主、发病机制尚不清楚。
效果是各种病原体和寄生虫的毒力的关键要素(包括针对植物的寄生虫(包括真菌,oomycetes,细菌和植物 - 寄生线虫[ppns])[3.,4.,5.,6.]. PPNs的效应因子分泌到寄主植物组织中,促进入侵和迁移,调节寄主免疫系统[7.]. 为了确定PPNs效应子在PPNs与宿主相互作用过程中的作用,筛选和鉴定效应子是非常必要的。
与微阵列和表达的序列标签(EST)相比,RNA-SEQ允许同时表现出发现和丰度估计以及在感染过程中分泌的病原体的相关分子细胞途径和病原体的效果[8.].通过这种可靠方法鉴定了许多病原体效应器。例如,推定的效应蛋白山科裸子孢菌和G. Asiaticumrice.生锈物种,燕麦异口线虫谷物囊肿线虫Hirschmanniella oryzae.根线虫和穿心莲利用RNA-seq技术筛选了可能改变寄主防御机制的根腐线虫[9,10,11,12].目前,转录组测序也已用于鉴定差异表达的基因(DEGS)时B嗜木菌进入最初的植食性阶段(接种后2.5 h) [13].Espada等。预测候选人B嗜木菌通过比较菌丝体和中后期植食性寄生阶段(伤害后6天和15天)之间的转录组的效应物[14].此外,在我们最近的研究中,我们成功地识别并表征了三种效应器(BXSAPB1,BXSAPB3和BX-FAR-1)以及来自转录组的新型分子模式BXCDP1B嗜木菌在噬菌和早期感染阶段(6,12和24 (伤害后)[15,16,17,18]. 然而,我们的转录组数据仅用于筛选候选效应子列表,大量数据还没有被彻底分析,包括上调基因的类型、功能注释、相关候选效应子的分子细胞途径以及候选效应子之间的内部关系。此外,以往的研究表明,在不同的感染阶段,其分泌的效应病原体也不同[10,19].
在这项研究中,我们的目标是确定候选效果的角色B嗜木菌感染和生存的比较研究B嗜木菌在不同侵染阶段与寄主树的相互作用中。为此,我们进行了相对比较转录组学分析B嗜木菌在我们的数据和之前报道的两个数据之间接种到松树上B嗜木菌不同感染阶段(2.5 h、6和15 d)的转录组数据集。重点介绍了基因差异表达载体的鉴定、差异表达载体的比较、基因本体论(GO)富集分析和京都基因基因组百科全书(KEGG)通路分析B嗜木菌来自三个转录组。三种常见的候选效应因子的相对表达B嗜木菌通过定量实时聚合酶链反应(QRT-PCR)在感染阶段检测到S转录om。此外,通过马铃薯病毒X(PVX)表达载体表征了五种常见候选效应的瞬时表达尼古利亚娜·宾夕法尼亚州.
结果
转录组的De Novo组装和来自三种转录om的摘要数据的比较Bursaphelenchus Xylophilus.
总共生成592,991,982个原始读数,570,138,674次通过Illumina测序从12个样品中清洁读数,这已在我们之前的研究中显示[15].计算这些样品之间的Pearson相关性(图。S1级).在这项研究中,我们表示我们的转录组测序数据和前面的两个先前报告B嗜木菌从2.5 h,6和15 d的不同感染阶段的转录组数据集分别作为B组,组和c组。来自三个转录om(A,B和C组)的汇总数据的比较B嗜木菌见表S1级.对比结果表明,来自A组和C组的原始读取和清洁读数的数量远低于我们实验数据(B组)的读数。
大肠杆菌感染期上调基因的筛选B嗜木菌
在我们的研究中P-价值< 0.05和对数2.(折叠变化)> 1分配为感染早期阶段(6,12和24小时的活动)和肉豆蔻阶段(0h)之间的次数。最后,总共获得了867次。与噬菌体阶段相比,在至少一种植物的时间点期间,在至少一种植物的时间点期间上调247。在噬菌体阶段和三种早期植物寄生阶段的DEGS的VENN图和热图示于图1和2中。S2级-S3级.在一个组中的2272℃中,在至少一个职前样品中上调1143个基因。与对照相比,在突发样本中,将60个基因上调[13].在以前的文献中,C组中没有特异性指示不同基因的数量,但鉴定了在线虫寄生寿命阶段上调的前200个序列[14].
中上调基因的功能注释B嗜木菌转录组
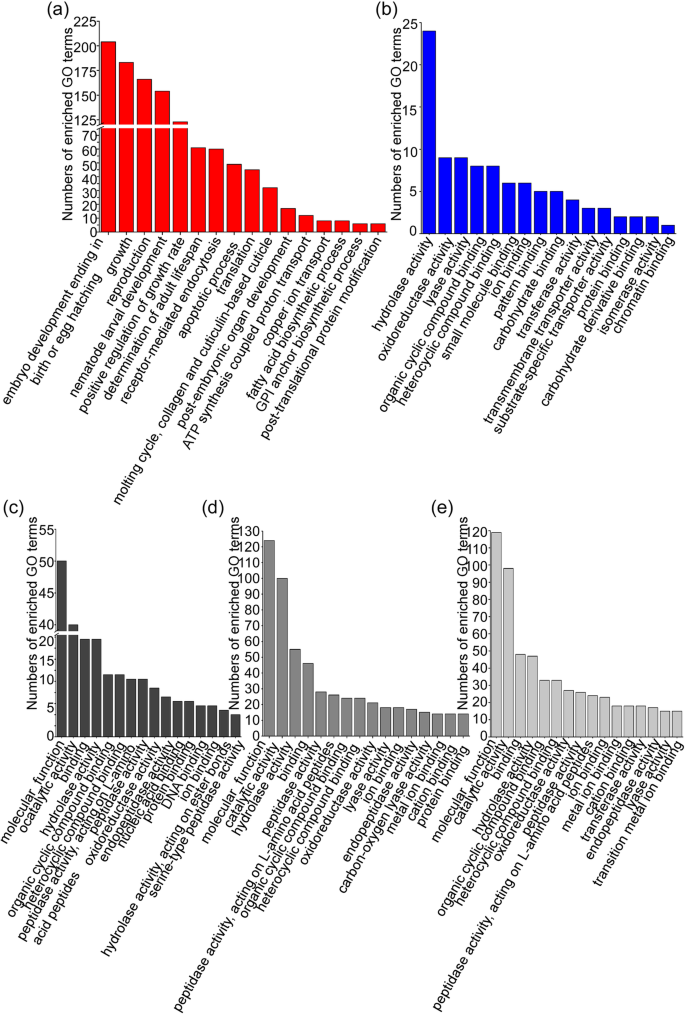
转录体注释提供了进入基因所涉及的结构,功能和生物过程的洞察力[20]. 确定上调基因的功能注释B嗜木菌基因,我们用了GO数据库。三种基因表达上调的GO项B嗜木菌对转录组进行比较,排序在分子功能类别前16位的转录组如图所示。1..结果表明,所涉及的上调基因的主要功能是生物过程B嗜木菌,如胚胎发育,积极的增长率和繁殖。这结果表明,与生长和发展有关的基因B嗜木菌在植物 - 宿主相互作用的初始阶段发挥作用(2.5小时,Postinfection)(图。1.a) 是的。在这组200个基因的表达上调中,最具代表性的是GO术语B嗜木菌在分子功能分类中,感染的中晚期是水解酶、氧化还原酶和裂解酶活性(感染后6和15天)(图)。1.b).在我们的实验数据中,247个分子功能类上调基因中最具代表意义的GO项是感染早期的分子功能、催化活性、水解酶活性和结合,而不论感染后的时间点(6、12和24 h)(图)。1.一部)。同时,在后两个转录组的分子功能类别中,如水解酶、氧化还原酶活性、裂解酶活性和离子结合等相同的GO术语高度代表。这些发现表明B嗜木菌使用一些类似的反应在松树中存活。
识别三个候选效果B嗜木菌转录组
在我们之前的实验数据中,247个基因中的69个被表示为候选效果[15]. 根据公认的候选效应子筛选标准,本研究共筛选出62个候选效应子B嗜木菌转录组2.5 h感染后。此外,Espada等人还鉴定了46个候选效应子[14].来自三个转录om的候选效果列表如表所示S3级. 比较不同来源的候选效应器B嗜木菌S转录om,这些候选效果通过本地爆炸搜索彼此匹配。结果表明,在我们的研究中发现了七个候选效果B嗜木菌转录组2.5 在所有三个细胞中都发现了一个候选效应子B嗜木菌成绩单(表1.).这些结果表明一些效果B嗜木菌在早期感染阶段发挥作用,一些效果在中间和后期感染阶段发挥作用。也就是说,类似于其他病原体,B嗜木菌s在不同感染阶段分泌不同的效应因子。然而,在整个感染过程中也有一些效应因子发挥作用。
先前的研究表征了一个B嗜木菌分泌体P浙贝感染[21]. 为了确定我们预测的候选效应子(在本研究中也被鉴定为分泌蛋白)的数量,通过局部BLAST搜索将来自三个转录组的所有候选效应子与分泌组匹配。结果显示,59、29和24个候选效应子来自B嗜木菌转录组2.5 h感染后6、12和24 感染后h、感染后6d和15d在小鼠分泌组织中均有表达B嗜木菌分别为(表S4级).结果表明了这些研究之间的一些交叉验证。
候选效果的功能诠释
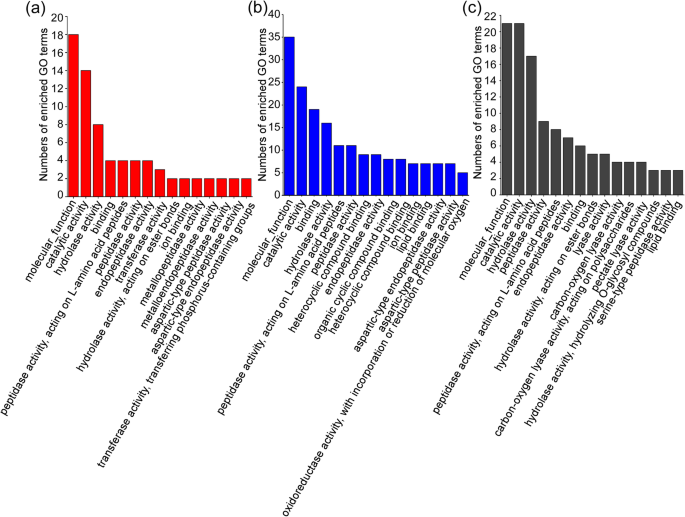
确定B嗜木菌候选效果来自不同的感染阶段,我们也使用了Go数据库。因为候选效应器的转向为6和15 dB嗜木菌松树中的感染尚未发布,我们通过当地爆炸搜查匹配46个候选效果,并发现了我们的转录组数据,并发现了相应的基因ID号。然后,在我们的转录组GO注释信息中搜索了这些基因的GO注释。在分子函数中排名第一的GO术语在图2中示出。2..结果表明,来自分子函数类别中的三种转录om的最高代表性否则的候选效应术是所有分子函数,催化活性和水解酶活性,并且15种GO术语中的8个术语与PWN感染的松树的转录组之间相同2.5小时和6,12和24小时(图。2.a、c)。感染PWN 2.5 h、6 d和15 d的松树的转录组在15个GO项中有10个是相同的(图1)。2.a-b),15个GO术语中有7个在感染PWN的松树的转录组中是相同的 h和6以及15 d(图。2.b-c)。这一结果表明,三个转录组的候选效应子在侵染过程中起着相似的作用,它们的水解酶活性和催化活性在催化降解植物细胞壁和去除ROS中起着重要作用B嗜木菌成功地感染松树。
来自三个候选效果的类别B嗜木菌转录组
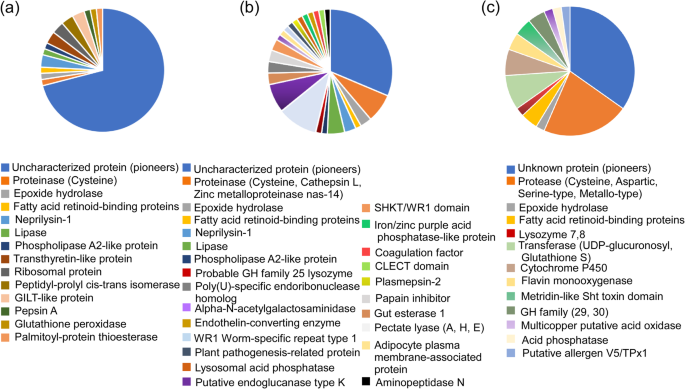
使用BLASTP在SWISS-Prot数据库中搜索候选效应器。来自三个转录组的候选效应子的类别如图所示。3.. 62个候选效应器中的44个来自B嗜木菌在2.5小时后的转录组在4.5小时的染色中是无表征蛋白质的;因此,它们表示为先驱。另外,其他候选效应包括几类蛋白酶(百事糖素A和半胱氨酸蛋白酶),核苷酸样蛋白样蛋白质,核糖体蛋白质和脂肪酶,以及参与异丙酚化合物的解毒的几种酶,例如环氧化物水解酶和谷胱甘肽过氧化物酶(图.3.一种)。来自69个候选效果中的二十一岁B嗜木菌感染后6、12和24 h的转录组是先驱。其他候选效应因子包括蛋白酶(如半胱氨酸蛋白酶B、组织蛋白酶L和锌金属蛋白酶nas-14)、碳水化合物活性酶(CAZymes;如果胶酸裂解酶A、果胶酸裂解酶H、果胶酸裂解酶E和假定的内切葡聚糖酶K)、脂肪酶、可能的GH家族25溶菌酶和解毒相关蛋白,包括溶酶体酸性磷酸酶、铁/锌紫酸类磷酸酶蛋白和环氧化物水解酶(图)。3.b) 是的。46个候选效应器中的16个来自B嗜木菌转录组在6和15 d后染液是先驱。另一个候选效果还包括几种蛋白酶(天冬氨酸蛋白酶A1,半胱氨酸蛋白酶C1A和丝氨酸型蛋白酶),脂肪酸输送蛋白,推定的V5 / TPX1过敏原,溶菌酶和几种相关蛋白质,例如UDP-葡糖醛糖基转移酶,多电囊推定酸氧化酶,谷胱甘肽S-转移酶,细胞色素P450,酸性磷酸酶和环氧化物水解酶(图。3.c) 是的。
三曲候选效果的KEGG路径分布比较B嗜木菌转录组
来自三个的候选效果B嗜木菌利用KEGG通路数据库,利用KOBAS软件进行BLAST分析。结果显示,大多数候选效应子没有被分配到已知的KEGG通路(表2.). 只有一个候选效应器(BXY1074200)来自B嗜木菌通过细胞色素P450途径分配了2.5小时后的转录蛋白,其分配给异种症的代谢。同时,只有一个候选效应器(BXY_0298700)来自B嗜木菌S转录om在6和15 d发射染色中分配给药物代谢 - 细胞色素p450途径。来自七个候选效果B嗜木菌第6、12和24页的成绩单 h感染后被分为四条途径:药物代谢-其他酶、代谢途径、溶酶体和细胞色素P450代谢途径。这一结果表明,细胞色素P450通路在细胞凋亡中起重要作用B嗜木菌在整个感染阶段。
在早期感染阶段高度上调八个常见候选效应
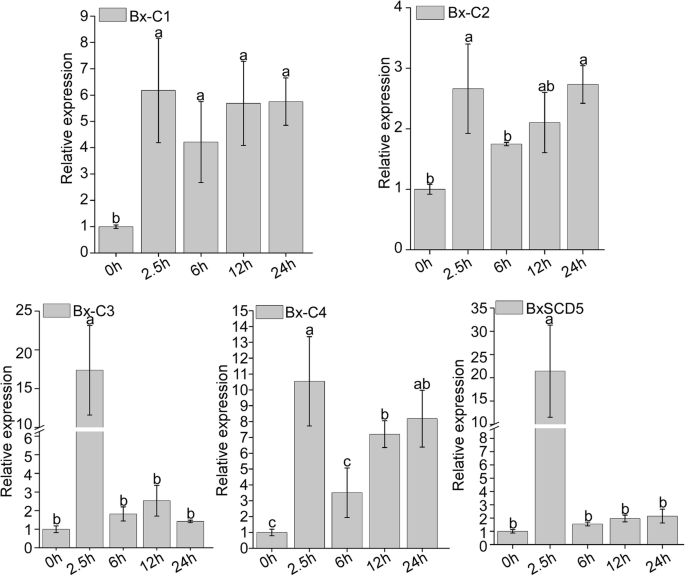
根据上述转录组数据B嗜木菌8种常见的候选效应子(包括BxSapB1、BxSapB3和Bx-FAR-1)在感染期表达上调。除了BxSapB1、BxSapB3和Bx-FAR-1之外,还命名了其他五种常见的候选效应器BX-C1,BX-C2.,BX-C3.,BX-C4和BxSCD5.为了进一步证实这一发现,我们采用qRT-PCR方法获得了它们在感染早期的表达谱。结果表明,与真菌侵染期相比,5种常见的候选效应因子在侵染早期均呈上调趋势。的相对表达水平BX-C1,BX-C3.,BX-C4和BxSCD5最高为2.5 h与其他感染次数比较,其相对表达量为BX-C2.最高的是24岁 h(图。4.).这些结果表明,这些共同的候选效应在阶段中起着重要的作用B嗜木菌感染。
BXSCD5有效地抑制PAMP PSXEG1触发的细胞死亡
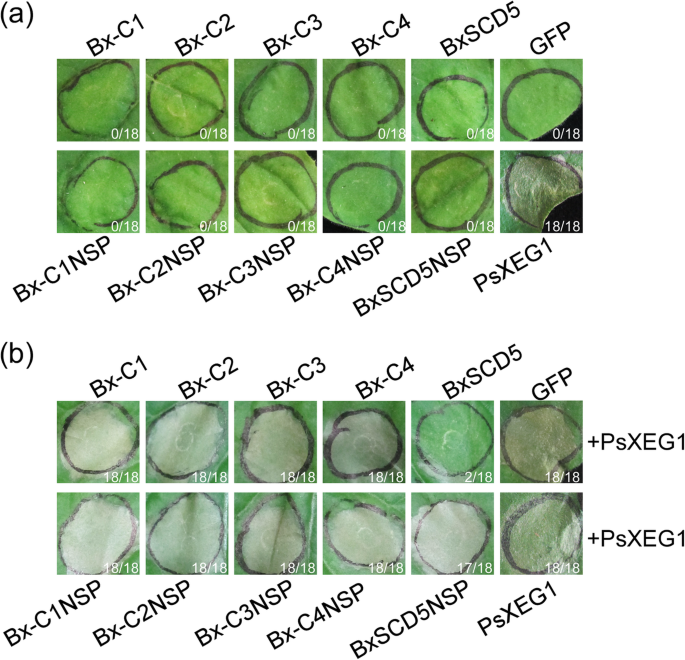
之前的一项研究表明Phytophthora.效应因子导致宿主和/或非宿主植物的细胞死亡,例如P. sojae.RXLR效应器,Avh241 [22].测试5个常见候选效果吗?B嗜木菌诱发细胞死亡,他们被表达N底栖动物使用农毒素污染。结果表明,在注射5候选效果后开发细胞死亡表型的渗透部位的比例几乎为零,表明它们不会引发细胞死亡N底栖动物(图。5.一种)。
BXSCD5候选效应器Bursaphelenchus Xylophilus.抑制PAMP PSXEG1触发的细胞死亡尼古利亚娜·宾夕法尼亚州.A.代表N底栖动物七点离开 接种后天数农杆菌sp。菌株GV3101携带五个常见候选效果[有天然信号肽(SP)]B嗜木菌在pGR107向量中。图中的比率表示形成细胞死亡表型的浸润部位的比例。试验至少重复三次。在每个实验中,使用三种不同的植物和三片接种的叶子,得到相似的结果。B五个常见候选效果的功能检测(有和没有天然的SP)B嗜木菌抑制PAMP PSXEG1触发的细胞死亡。图片中的比率表明渗透地点的比例,所述渗透位点开发了细胞死亡表型。渗透测定进行三次,并且在每个测定中,使用三种不同的植物,其中具有三种接种叶片,得到类似的结果
Pamps引发了各种植物中强大的防御反应,许多人P. sojae.效应物抑制免疫反应,包括PAMP触发的细胞死亡[19].确定5个常见候选效果吗(BXSAPB1,BXSAPB3和BX-FAR-1除外)B嗜木菌抑制P. sojae.Pamp psxeg1触发的细胞死亡,我们表示psxeg1N底栖动物在表达5常见的候选效应或GFP(阴性对照)使用农毒滤液后留下16小时。除了注射BXSCD5NSP(没有SP)后,在注射BXSCD5NSP(没有SP)后,渗透位点的比例几乎为BXSCD5(具有SP)除了注射PSXEG1的其他4个候选效应器。这些结果表明,只有BXSCD5抑制PSXEG1触发的细胞死亡(图。5.b) 表明BxSCD5抑制PsXEG1诱导的细胞死亡N底栖动物当分泌到质外体时。
讨论
一般认为,在感染阶段,病原体的DEGs,特别是上调的基因,参与了病原体与宿主之间的相互作用。在本研究中,三个转录组获得的raw reads、clean reads和上调基因不同,上调基因的注释信息显示基因在B嗜木菌不同时期感染情况不同。在A组(感染后2.5 h)中,上调的基因主要参与菌体的生长发育B嗜木菌,这可能是由于调整B嗜木菌在突然改变植物阶段的植物阶段突然变化期间生存和更好地适应新环境。在B族(6,12和24小时的发芽)中,主要上调基因参与分子功能,催化活性,水解酶活性和结合,以及这些GO术语中涉及的上调基因的数量是巨大的。在C组(6和15d PostInfection)中,上调基因主要参与水解酶,氧化还原酶和裂解酶活性。有趣的是,B组水解酶,氧化还原酶和裂解酶活性的上调基因的数量大于C组中的含量。这结果表明它更为重要B嗜木菌通过分泌水解酶和裂解酶来降解宿主的细胞壁,以促进早期感染阶段的寄生术。以前的研究表明,一些植物细胞壁降解酶(CWDES)B嗜木菌具有致病性决定因素的作用,如糖苷水解酶家族45纤维素酶、果胶裂解酶和b-1,3-内切葡聚糖酶[23,24,25].在该研究中,将几种旁碱酶和内切葡聚糖酶鉴定为B组中的候选效应,支持这些CWDE通常被认为是“效果”的观点。此外,氧化突发是对植物病原体攻击的最早的防御反应之一。ROS的瞬态积累有助于从入侵病原体抵御宿主,并充当信号分子,以触发各种其他植物防御响应[26]. 已有研究表明,宿主清除ROS的能力是PWN高抗性的关键,而氧化应激的增强有助于PWN致病性的增强B嗜木菌[27,28].树中ROS的数量对生存至关重要B嗜木菌. 此外,过氧化氢酶(BXY-CTL-1和BXY-CTL-2)高毒力B嗜木菌对长期暴露于体外氧化应激下的线虫生存至关重要[29].令人惊讶的是,BXY-CTL-1(BUX.s00579.159)在B组(即bxy1386500)中被鉴定具有氧化还原酶活性,参与氧化还原过程。此外,对强毒株的氧化还原酶活性和氧化还原过程也有显著的GO项B嗜木菌与无毒菌株相比,菌株在统计学上富集[30].在我们的研究中,在B和C组中发现显着的GO期,氧化还原酶活性(GO:0016491),并且富集的统计学术语的DEG列表主要是B组。因此,我们推测,在B和C组中催化和氧化还原酶活性的上调基因可能在通过催化和氧化控制来消除ROS来帮助B嗜木菌在主人身上生存。
基因组数据B嗜木菌表明该线虫具有许多特定基因[31].先前的研究表明,久入PPNS(例如囊肿和根结线虫)的效应曲目含有数百种蛋白质,在建立成功的植物病原体相互作用[7.].在这项研究中,尽管三个转录om中的上调基因的数量不同,但候选效应器的数量相似(62,69和46),表明效果的数量相似B嗜木菌可能小于久坐不动的PPN。虽然生命周期B嗜木菌与其他PPN的不同,不同PPN中的同源基因通常发挥类似的功能。还在其他PPN中研究了本研究中筛选的几种候选反应器。例如,已经证明了谷胱甘肽的转移酶(GST)在根结线虫中发挥重要作用[32[本研究中的C组中,GST在C组中发现。还在几个PPN中研究了脂肪酸类含有retinoid结合(远)蛋白(例如radopholus similis.,苍白球绦虫和P. Penetran.),表明整个线虫生命周期是必要的蛋白质[33,34,35].在目前的研究中,B嗜木菌FAR蛋白在三组中均得到鉴定。此外,Bx-FAR-1已被Li鉴定为关键效应子[18]. 吸血鬼的吸血鬼G喙突马铃薯孢囊线虫是抑制寄主免疫所必需的[36]. 在本研究中,在C组发现了一个类似VAPs的候选效应器。
雄虫(如纤维素酶,果酸盐酶,Caltreticulin和扩展素)对于分解植物细胞壁的多糖来建立感染是重要的[8.].在本研究中,一些辛烯(推定旁碱酶A,H和E以及内切葡聚糖酶A型)包括在B组中列出的候选效果中,其可能在宿主组织的侵袭,延伸和降解中发挥作用。据报道,脂肪酸结合蛋白,视黄醇结合蛋白和过洛昔洛蛋白,以保护宿主防御中的抗抗原化合物的线虫[37].在本研究中,在所有基团中鉴定脂肪酸和视黄醇结合蛋白。一些效果,如膜蛋白,毒液过敏原蛋白,ransthyretin样蛋白和泛素延伸蛋白,靶植物信号传导途径和抑制宿主防御[37].在这里,假定的过敏原V5/TPx1和transthyretinlike蛋白分别在C和A组中被鉴定。先前的一项研究表明,一些效应物是喂养效率所必需的,比如组织蛋白酶。蛋白质水解酶可分为以下四大类:半胱氨酸、丝氨酸、天冬氨酸和金属蛋白酶。其中,半胱氨酸蛋白酶的研究最为广泛[38].在我们的研究中,在所有三种转录组基团中发现了包括组织蛋白酶L的半胱氨酸蛋白酶。这些结果表明,蛋白水解酶,尤其是半胱氨酸蛋白酶B嗜木菌在营养摄入中起关键作用,促进寄生。一些研究还表明,半胱氨酸蛋白酶在线虫和许多其他动物寄生虫的胚胎发生、发育、感染、寄生、致病和免疫逃避等方面发挥着重要作用[39,40,41].此外,一种组织蛋白酶L样半胱氨酸蛋白酶B嗜木菌已被证明会影响其发育和致病性[42].致病细菌和真菌的几种脂肪酶被鉴定为毒力因子[43].这里,在三组中还鉴定了几种其他消化酶,例如丝氨酸型蛋白酶,百香A和天冬氨酸蛋白酶A1,并且在A和B组中存在脂肪酶。许多推定效果具有未知的功能,称为先驱。在本研究中,许多先驱者在三个转录组基团中鉴定,其中大多数成功地匹配了秘密B嗜木菌[21].这些先驱的功能研究将是调查致病机制的重要步骤B嗜木菌.
除上述功能外,我们还发现一些效应因子与外源化合物的解毒作用有关。例如,在A组中发现了环氧化物水解酶和谷胱甘肽过氧化物酶。环氧化物水解酶在以往的研究中被认为是毒力因子[44,45].与环氧化物水解酶不同,B组中包含溶酶体酸性磷酸酶和铁/锌紫酸磷酸酶样蛋白。在C组中,将UDP-葡糖醛糖基转移酶,多电囊推定酸氧化酶,GST,细胞色素P450和酸性磷酸酶分类。这结果表明早期和晚期感染阶段B嗜木菌需要排毒来克服寄主的抵抗力,但有些排毒物质是由寄主分泌的B嗜木菌是不同的。此外,A组中的一些候选效应子,如核糖体蛋白,被认为参与了RNA的转录和翻译。此外,17个编码核糖体蛋白的基因被发现发生了显著的变化Meloidogyne incognita.感染Solanum lycopersicum.根[46].这些结果表明,核糖体蛋白在植物酸碱线虫和宿主的相互作用中起重要作用。
在病原与宿主相互作用过程中,病原分泌pamp和效应物可触发植物的防御反应,包括pamp触发免疫(PTI)和效应触发免疫(ETI)。然而,在强大的自然选择压力下,病原体会不断产生新的效应物来抑制宿主的PTI和ETI,帮助病原体逃避宿主识别[47].同时,效应体之间的协同合作可以促进病原体的成功感染[3.].先前的研究表明,毒性分离株感染诱导了一些PINE的PINE的表达B嗜木菌[48],表明这一点B嗜木菌可能会分泌一些纸浆或分子模式,例如BXCDP1 [17]诱导松树的防御反应。在我们的研究中,我们瞬时表达了五种常见的候选效应子(除了三种已知的效应子BxSapB1、BxSapB3和Bx-FAR-1)N底栖动物功能分析模型植物。在五种候选效应中,BXSCD5候选效应器有效地抑制了PAMP PSXEG1触发的细胞死亡N底栖动物.因此,我们推测虽然宿主的防御反应是感染后诱导的B嗜木菌此外,也有一些效应物在一定程度上抑制了宿主的防御,帮助线虫成功感染,如BxSCD5。许多病原体的效应因子已被确定使用这种策略[49,50.,51.,52.].因此,识别效果也是可行的B嗜木菌在里面N底栖动物非植物。当然,需要在自己的主机中研究病理到主机交互过程中的角色效应。因此,将来将在未来研究BXSCD5在宿主松树中的功能。
在本研究中,共同的效果(7个候选效应器,在A和B组中,在三组中都有1个候选效应物)被鉴定在三组中B嗜木菌转录om。有几种可能性为什么只确定了几个因素。首先,类似于其他病原体,B嗜木菌在不同的感染阶段分泌不同的效应器以应对不同的生存威胁,在三个不同的感染阶段产生少数常见的效应器。第二,仅选择线虫寄生生命阶段上调前200个基因预测C组(感染后6天和15 d)的候选效应子[14];因此,从前200个上调基因筛选候选效应,而不是来自所有上调的基因,这可能导致一些效果损失。第三,不同B嗜木菌所使用的三个转录域的菌株,松树物种,树龄,接种环境和测序深度可能导致不同的DEG和候选效果。尽管如此,BXSAPB1,BXSAPB3,BX-FAR-1和BXSCD5主要效果仍然从三个不同的筛选B嗜木菌转录组在促进线虫感染方面发挥了重要作用。因此,本研究中使用的相对比较转录组分析虽然存在不足,但在一定程度上是可行的。要充分理解B嗜木菌感染,我们还将研究未来三个转录om的非常见候选效应源的功能。
结论
本研究的目的是通过比较转录组学分析上调基因和候选效应基因的感染和生存策略B嗜木菌在不同的感染阶段。B嗜木菌在不同的感染阶段分泌不同的候选效应物,其中一些继续在所有感染阶段起作用。候选人效应器帮助B嗜木菌以不同的方式(例如分解宿主墙壁,抑制宿主防御,促进喂养效率,解毒和毒动力函数),在主机中成功感染和生存。我们提供了继续存在“常见”PPN效应器的证据,并确定了一些参与感染过程的新效果B嗜木菌.这些结果为研究发病机制提供了许多资源B嗜木菌从效应器的角度来看。此外,这些效应子的植物靶标的鉴定和特征也应该进行,以了解这些效应子如何劫持植物细胞的形态和生理的许多方面,包括免疫系统。
方法
生物材料
在这项研究中,高毒性B嗜木菌使用菌株AMA3,来自中国安徽省[53.].培养方法B嗜木菌与此前报道的那些相似[54.].根据我们以前的研究进行了线虫的培养和分离[15].
PWN接种试验
黑松从南京林业大学(裕廊Yaolingkou Forest Farm,江苏,中国)获得的幼苗(3岁)用于接种PWN菌株AMA3。我们以前的研究中描述了线虫的数量和接种时间[15].简而言之,从PDA收集大约10,000个混合寿命线虫的悬浮液作为噬菌体对照(B-0 H)。将相同数量的线虫(AMA3)接种到杉木茎中6小时(B-6 H),12小时(B-12H)和24小时(B-24小时)。收集线虫,然后根据我们之前的方法进行再冷冻以进一步的RNA分离[15].每个处理设3个生物重复。
样品制备和Illumina测序
从B-0 H,B-6 H,B-12 H和B-24 H样品中提取Nematode(AMA3)RNA。然后,在1%琼脂糖凝胶上监测mRNA降解和污染。然后,根据我们之前的研究单独确定RNA纯度,RNA浓度,RNA完整性,cDNA文库制剂和测序[15]. 本研究的RNA序列数据在NCBI上提交,注册号为PRJNA39701。
差异基因表达分析
HTSEQ V0.6.1和DESEQ用于将映射到每个基因的读数分别标准化每个基因的读数。使用DESEQ R包(1.18.0)进行四种处理的差异表达分析,该方法已经证明优于FPKM或RPKM [55.].最后,基因(有一个P-价值< 0.05和对数2.(折叠变化)> 1)被分配为四种治疗之间的差异表达。我们之前的研究中描述了DEG的定义[15].
松材线虫转录组数据集
两人此前曾报道B嗜木菌来自不同感染阶段的转录组数据集(2.5小时,6D和6 D和15 D Postfection)[13,14]我们收集了相关的转录组学分析和我们的转录组学实验数据。其中,一个实验设计使用了两个伤害后事件(2.5) 在8月和9月感染h)和一个对照(菌丝体阶段),每个条件有两个生物复制,表示为A-2.5 h-8,A-2.5 h-9和A-0 H另一个数据集还使用了两个感染后事件(感染后6天和15天)和一个对照组(噬菌期),分别表示为C-6 d、C-15 d和C-0 d。C组的两个伤害后事件有三个生物重复,对照组有两个生物重复。
差异表达基因的富集分析
天然气的GO富集分析B嗜木菌来自上述三种转录组数据集的次数由Goseq R包来实现,其中基因长度偏置已纠正[56.].氧化石墨烯的功能分类分为生物过程、细胞组分和分子功能。修正后的GO条款P值得大于0.05的值(即假发现率,FDR)显着富集。
候选人效应器分析
我们根据我们先前的研究筛选了潜在的效应蛋白(N-末端信号肽的存在和跨膜结构域的缺失)[15].信号肽和跨膜结构域通过SignalP 4.1预测(http://www.cbs.dtu.dk/services/SignalP/) [57.]和tmhmm 2.0(http://www.cbs.dtu.dk/services/tmmm/) [58.),分别。所有候选效应器都是根据我们之前的方法预测的函数[15].
Kegg浓缩分析候选效果B嗜木菌
kegg是一种了解生物系统的高级功能和实用程序的数据库资源(http://www.genome.jp/kegg/) [59.].Kobas软件用于确定统计富集B嗜木菌KEGG通路中上述三个转录组数据集的候选效应子。此外,为了改进注释,对SWISS Prot数据库执行了BLAST搜索。
本地爆炸分析
来自上述三种转录组数据集的候选效应器的氨基酸序列与秘密相匹配B嗜木菌通过本地爆炸搜索[21].用E值= 1E-10进行BLAST搜索,选择具有百分比相似性> 80%的蛋白质。
qRT-PCR分析
参考先前使用的方法[17],将大约10000只AMA3线虫接种到3岁的幼体中P浙贝然后在接种后在2.5,6,12和24小时下收集线圈,然后在接种后收集。提取AMA3线虫的RNA并逆转录成cDNA。根据我们之前的方法进行QRT-PCR测定[15]. 上述三种基因中五种常见候选效应子(已知的三种效应子BxSapB1、BxSapB3和Bx-FAR-1除外)的表达水平B嗜木菌宿主感染早期的转录组(2.5,6,12和24 h) 进行了测量。肌动蛋白B嗜木菌(GenBank EU100952)作为组成性表达的内源性调控基因[48]. 所有分析均进行三次。表中提供了引物序列S2级.
质粒构建
参考先前使用的方法[17],来自上述三个常见候选效果B嗜木菌转录组克隆与否,其天然信号肽(SP)从B嗜木菌使用表中所列的特异性引物S2级. 随后,经测序确认后,使用CloneExpress II一步克隆试剂盒(Vazyme,中国南京)将纯化的PCR产物连接到pGR107载体(pGR107–3*HA)中。
瞬时表达分析N底栖动物
构建质粒的转化方法、培养条件根癌农杆菌GV3101菌株和农药污染测定与先前研究中的菌株相同[17].一种直接渗透的实验设计A. Tumefaciens.悬浮液中含有5个候选效应物(有或没有它的原生SP)进入叶片N底栖动物使用无缝注射器。另一个实验设计渗透A. Tumefaciens.含有5个候选效应子的悬浮液(有或没有其天然SP)16 在被渗透之前Phytophthora sojae.病原相关分子模式(PAMP)PsXEG1。以绿色荧光蛋白(GFP)作为阴性对照。基因的表型N底栖动物入渗后5 ~ 7天记录叶片。每个实验重复3次,每个实验由3株接种了3个叶片的植株组成。最后,我们计算浸润位点发生细胞死亡表型的比例,以筛选触发细胞死亡或抑制psxeg1触发细胞死亡的效应子。
可用性数据和材料
本研究中的RNA-SEQ数据可通过登录号PRJNA397001获得NCBI。我们有允许收集我们在本研究中使用的植物样本。复制这些发现所需的所有数据和材料都可以通过联系相应的作者,小琴吴教授共享(xqwu@njfu.edu.cn.).
缩写
- PWN:
-
松木线虫
- PWD:
-
松材线虫是松树萎蔫病
- B嗜木菌:
-
Bursaphelenchus Xylophilus.
- PPN:
-
植物寄生线虫
- 测试:
-
表达序列标签
- RNA-SEQ:
-
RNA测序
- G. Asiaticumrice.:
-
亚洲裸子孢
- P. Penetran.:
-
穿心莲
- G喙突:
-
globodera rostochiensis.
- 可见:
-
差异表达基因
- 去:
-
基因本体论
- Kegg:
-
京都基因和基因组百科全书
- 罗斯福:
-
错误发现率
- PVX:
-
马铃薯X病毒
- QRT-PCR:
-
定量实时聚合酶链反应
- N底栖动物:
-
尼古利亚娜·宾夕法尼亚州
- 巨大的:
-
碳水化合物活性的酶
- CWDE:
-
细胞壁降解酶
- P. sojae.:
-
Phytophthora sojae.
- 零售价:
-
核糖体蛋白质
- PDA:
-
土豆葡萄糖琼脂
- A. Tumefaciens.:
-
根癌农杆菌
- ROS:
-
反应性氧气
参考
- 1.
Vicente C,Espada M,Vieira P,Mota M. Pine Wilt病:对欧洲林业的威胁。EUR J植物途径。2011; 133(1):89-99。
- 2.
Jones JT、Haegeman A、Danchin EG、Gaur HS、Helder J、Jones MG等。分子植物病理学中的十大植物寄生线虫。植物病理学。2013;14(9):946–61.https://doi.org/10.1111/mpp.12057.
- 3.
Ma Z,Song T,Zhu L,YE W,Wang Y,Shao Y等。一种Phytophthora sojae.糖苷水解酶12蛋白是大豆感染期间的主要毒力因子,并且被认为是粘合剂。植物细胞。2015; 27(7):2057-72。https://doi.org/10.1105/tpc.15.00390.
- 4.
Abramovitch RB,Janjusevic R,Stebbins Ce。III型效应器AVRPTOB需要内在的E3泛素连接酶活性以抑制植物细胞死亡和免疫力。Proc Natl Acad Sci U S A. 2006; 103(8):2851-6。
- 5。
亚麻锈病致病基因与抗病基因之间的直接蛋白质相互作用是基因对基因的特异性和协同进化的基础。国家自然科学基金资助项目:国家自然科学基金资助项目。https://doi.org/10.1073/pnas.0602577103.
- 6。
陈继,林B,黄Q,胡L,Zhu k,廖J。一本小说有graminicola效应器MGCPP分泌到宿主细胞中,并与蛋白水解进行音乐会进行糖基化以抑制植物防御和促进寄生疫苗。PLOS POAROG。2017; 13(4):E1006301。https://doi.org/10.1371/journal.ppat.1006301.
- 7。
Mitchum MG,Hussey RS,Baum TJ,Wang X,Elling AA,Wubben M,等。线虫效应蛋白:寄生的新兴范例。新植物醇。2013;199(4):879–94.https://doi.org/10.1111/nph.12323.
- 8。
Sonah H、Zhang X、Deshmukh RK、Borhan MH、Fernando WG、Belanger RR。大肠杆菌毒力因子的比较转录组学分析斑点钩端螺旋体在与油菜亲和和不亲和的互作过程中。植物科学与技术,2016;
- 9。
Bauters L、Haegeman A、Kynt T、Gheysen G。基因转录组分析Hirschmanniella oryzae.探讨潜在的生存策略和寄主线虫相互作用。植物病理学。2014;15(4):352–63.https://doi.org/10.1111/mpp.12098.
- 10
Vieira P,Maier Tr,伊斯舍·帕特·泰克斯,Howe Dk,Zasada I,Baum TJ,等。Pratylenchus Penetrans候选效应基因的鉴定。莫尔植物途径。2018; 19(8):1887-907。https://doi.org/10.1111/mpp.12666.
- 11
陶平方,曹湾,天厘米,梁烨。两种相关锈病中候选效应的比较转录组分析与鉴定(山科裸子孢菌和亚洲裸子孢).BMC基因组学。2017; 18(1):651。https://doi.org/10.1186/s12864-017-4059-x..
- 12
杨德,陈C,刘Q,累编寄生术转录瘤和矿业先锋效应的比较分析燕麦异口线虫.细胞Biosci。2017; 7(1):11。https://doi.org/10.1186/s13578-017-0138-6.
- 13
蔡建平,田中平,韩志明,等。植物寄生线虫由食菌向食植物过渡阶段的转录和形态变化Bursaphelenchus Xylophilus..莫尔植物途径。2016; 17(1):77-83。https://doi.org/10.1111/mpp.12261.
- 14
Espada M,Silva AC.Eves van den Akker S,Cock PJ,Mota M,Jones JT:松材线虫寄生基因的鉴定和鉴定Bursaphelenchus Xylophilus.揭示了多层排毒策略。Mol Plant Pathol. 2016;17(2): 286-95。https://doi.org/10.1111/mpp.12280.
- 15
胡lj,吴昕,李海,赵q,王yc,ye jr。效应,BXSAPB1,诱导细胞死亡并有助于松木线虫的毒力Bursaphelenchus Xylophilus.. 植物与微生物相互作用。2019;32(4):452–63.https://doi.org/10.1094/mpmi-10-18-0275-r..
- 16。
黄X,胡lj,吴昕。鉴定一种新的效应BXSAPB3,其增强松木线虫的毒力Bursaphelenchus Xylophilus..Acta Biochim Biophys Sin。2019; 51(10):1071-8。https://doi.org/10.1093/abbs/gmz100.
- 17。
胡LJ,吴昕,李海,王YC,黄X,王Y等。来自松木线虫的BXCDP1Bursaphelenchus Xylophilus.被认为是一种新的分子模式。Mol Plant Pathol. 2020;21(7): 923-35。https://doi.org/10.1111/mpp.12939..
- 18。
李毅、胡立杰、吴旭、小叶ABursaphelenchus Xylophilus.效应子Bx-FAR-1抑制植物防御,影响松树线虫感染。植物病理学杂志。2020;153(3):637–50.
- 19。
王QQ,韩慈,费雷拉AO,于XL,叶WW,Tripathy S,等。基因转录编程与功能相互作用Phytophthora sojae.rxlr effector reptoire。植物细胞。2011; 23(6):2064-86。https://doi.org/10.1105/tpc.111.086082.
- 20。
Mutz KO, Heilkenbrinker A, Lönne M, Walter JG, Stahl F.使用下一代测序的转录组分析。2013;24(1): 22-30。https://doi.org/10.1016/j.copbio.2012.09.004.
- 21。
Shinya R,Morisaka H,Kikuchi T,Takeuchi Y,Ueda M,Futai K.松木线虫的秘密分析Bursaphelenchus Xylophilus.揭示了寄生的纠结根及其分子模拟的可能性。公共科学图书馆一号。2013;8:e67377。
- 22
yu x,唐家议,王q,ye w,tao k,duan s等人。RXLR效应器AVH241来自Phytophthora sojae.需要质膜定位来诱导植物细胞死亡。新植醇。2012;196(1):247 - 60。https://doi.org/10.1111/j.1469-8137.2012.04241.x.
- 23
菊池T、琼斯JT、爱川T、小坂H、大仓N。松材线虫糖基水解酶家族45纤维素酶Bursaphelenchus Xylophilus..2月。2004;572(1 - 3):201 - 5。https://doi.org/10.1016/j.febslet.2004.07.039.
- 24
菊池T,涩谷H,琼斯JT。松材线虫内β-1,3-葡聚糖酶的分子生物学特性研究Bursaphelenchus Xylophilus.通过从细菌的水平基因转移获得。Biochem J. 2005; 389(1):117-25。https://doi.org/10.1042/BJ20042042.
- 25
Kikuchi T,Shibuya H,Aikawa T,Jones Jt。松树线虫食管腺体表达的植物裂化酶的克隆与表征Bursaphelenchus Xylophilus..Mol植物微生物相互作用。2006; 19(3):280-7。https://doi.org/10.1094/mpmi-19-0280.
- 26
透过,Smant G.寄生线虫的植物先天免疫激活和抑制。Annu Rev phytopathol。2014; 52(1):243-65。https://doi.org/10.1146/annurev-phyto-102313-050118.
- 27
马尾松线虫抗性基因的转录组分析马尾松羔羊)。Sci代表2017;7(1):4693–707.https://doi.org/10.1038/s41598-017-04944-7..
- 28.
张W,赵立,周J,Yu H,张C,LV Y等。增强氧化应激有助于侵袭性松木线虫的致病性增加。Philos Trans R SoC Lond Ser B Biol Sci。2019; 374(1767):1-10。
- 29.
陈建平,陈建平,陈建平,等。松材线虫高毒力诱导过氧化氢酶的研究进展Bursaphelenchus Xylophilus.在过氧化氢诱导的应力下。Plos一个。2015; 10(4):E0123839。https://doi.org/10.1371/journal.pone.0123839.
- 30.
Filipiak A,Malewski T,Matczynska E,Tomalak M.隔离毒性线虫Bursaphelenchus Xylophilus的毒性和无毒菌株中的分子变异。Mol Genet基因组学。2021; 296(2):259-69。
- 31。
Kikuchi T,Cotton Ja,Dalzell Jj,Haegawa K,Kanzaki N,McVeigh P等人。基因组洞察新兴植物病原体中寄生派的起源Bursaphelenchus Xylophilus..PLOS POAROG。2011; 7(9):E1002219。https://doi.org/10.1371/journal.ppat.1002219.
- 32。
DubReuil M,Magliano E,Deleury P,Abad P,Rosso Mn。寄生寄生早期阶段诱导的根结线虫功能的转录组分析。新植物。2007; 176(2):426-36。https://doi.org/10.1111/j.1469-8137.2007.02181.x.
- 33。
之前的A,Jones JT,Blok VC,Beauchamp J,McDermott L,Cooper A等。来自马铃薯囊肿线虫的表面相关的视黄醇和脂肪酸结合蛋白(GP-FAR-1)苍白球绦虫:脂质结合活动,结构分析和表达模式。Biochem J. 2001; 356(2):387-94。https://doi.org/10.1042/bj3560387.
- 34
张聪,谢华,程×,王维德,李毅,徐CL,等。洞穴线虫脂肪酸和维甲酸结合蛋白基因Rs-far-1的分子鉴定及功能鉴定radopholus similis.(Tylenchida:pratylenchidae)。Plos一个。2015; 10(3):E0118414。https://doi.org/10.1371/journal.pone.0118414.
- 35
维埃拉P、卡莫K、艾森巴克JD。脂肪酸和视黄醇结合的Pp-far-1基因在小鼠体内的表达及沉默穿心莲.植物病理学研究。2017;66(7):1214 - 24。https://doi.org/10.1111/ppa.12664.
- 36
Lozano-Torres JL,Wilbers RHP,暖和德姆S,Finkers-Tomczak A,Diaz-Granados A,Van Schaik Cc等。囊肿线虫的妊娠毒液过敏原蛋白样蛋白质通过细胞表面受体调节基础植物先天免疫的活化。PLOS POAROG。2014; 10(12):E1004569。https://doi.org/10.1371/journal.ppat.1004569..
- 37
Haegeman A,Mantelin S,Jones JT,Gheysen G.植物寄生线虫的效果效果的功能作用。基因。2012; 492(1):19-31。https://doi.org/10.1016/j.gene.2011.10.040.
- 38
关键词:穴居线虫,组织蛋白酶S,半胱氨酸蛋白酶,半胱氨酸蛋白酶radopholus similis.对繁殖和入侵至关重要。细胞生物学。2016;6(1):39.https://doi.org/10.1186/s13578-016-0107-5.
- 39
Carmona C,Dowd Aj,Smith Am,Dalton JP。组织蛋白酶l蛋白酶分泌Fasciola hepatica.体外防止抗体介导的嗜酸性粒细胞附着到新脱囊的青少年。分子生物化学寄生虫。1993;62(1):9–17.https://doi.org/10.1016/0166-6851电话:(93)90172-T.
- 40。
Hashmi S、Britton C、Liu J、Guiliano DB、Oksov Y、Lustigman S。组织蛋白酶L是胚胎发生和发育的关键秀丽隐杆线虫.J Biol Chem。2002; 277(5):3477-86。https://doi.org/10.1074/jbc.m106117200.
- 41。
Malagónd,díaz-lópezm,Benítezr,adroher fj。在体外发育过程中,组织蛋白酶B-和L样半胱氨酸蛋白酶活动Hysterothylacium aduncum(奈塔罗迪达:Anisakidae),全球鱼寄生虫。寄生醇int。2010; 59(1):89-92。https://doi.org/10.1016/j.parint.2009.11.001.
- 42。
关键词:组织蛋白酶l -样半胱氨酸蛋白酶,松材线虫,致病性Bursaphelenchus Xylophilus..int j mol sci。2019; 20(1):215。https://doi.org/10.3390/ijms20010215.
- 43。
Stehr F、Kretschmar M、Kröger C、Hube B、Schäfer W。微生物脂肪酶作为毒力因子。过氧化氢酶。2003;22(5–6):347–55.https://doi.org/10.1016/s1381-1177(03)00049-3.
- 44。
哺乳动物环氧化物水合酶:诱导酶催化从芳香和烯烃化合物衍生的致癌和细胞毒性代谢物失活。Xenobiotica。1973;3(5):305 - 40。https://doi.org/10.3109/00498257309151525..
- 45。
Hvorecny KL,Bahl CD,Kitamura S,Lee KSS,Hammock BD,Morisseau C,et al.《细菌毒力因子的活性位点柔性和底物特异性:环氧化物水解酶的晶体快照》。结构。2017;25(5):697–707 e694。https://doi.org/10.1016/j.stra.2017.03.002.
- 46
Shukla N,Yadav R,Kaur P,Rasmussen S,Goel S,Agarwal M等。根结线虫的转录组分析(Meloidogyne incognita.)-感染番茄(Solanum lycopersicum.)根部在敏感和阻力响应期间揭示了宿主和线虫的复杂基因表达谱和代谢网络。莫尔植物途径。2018; 19(3):615-33。https://doi.org/10.1111/mpp.12547.
- 47
Jones JD,Dangl JL。植物免疫系统。自然。2006;444(7117):323–9.https://doi.org/10.1038/nature05286.
- 48
Hirao T,Fukatsu E,Watanabe A.使用抑制减去杂交的Pinus Thunbergii对松木线虫感染的抗性的表征。BMC植物生物学。2012; 12(13):207-12。https://doi.org/10.1186/1471-2229-12-13.
- 49
陈聪,刘S,刘Q,牛J,刘P,赵J,等。谷类孢囊线虫膜联蛋白燕麦异口线虫抑制植物防御。Plos一个。2015; 10(4):E0122256。https://doi.org/10.1371/journal.pone.0122256.
- 50。
张L,Ni H,Du X,Wang S,MA XW,Nurnberger T,等。特异性特异性蛋白质VDSCP7定位于植物核,并调节对真菌感染的免疫力。新植物。2017; 215(1):368-81。https://doi.org/10.1111/3/14537.
- 51。
陈聪,陈奕,詹宏,杨丁,戴奕,潘璐,等。大尺度土壤微生物鉴定与鉴定燕麦异口线虫推测的抑制或诱导细胞死亡的效应因子尼古利亚娜·宾夕法尼亚州.植物科学与技术,2017;
- 52。
李Z,尹Z,范Y,许M,康Z,黄L。坏死营养型苹果溃疡病菌的候选效应蛋白苹果腐烂病菌能抑制BAX诱导的PCD。前植物科学。2015;6:579.
- 53。
丁X,叶J,林S,吴X,李D,年B。不同毒力松材线虫的分子变异研究。公共科学图书馆一号。2016;11(5):e0156040。https://doi.org/10.1371/journal.pone.0156040.
- 54。
邱X,吴X,黄L,田M,叶J。线虫特异表达的基因Bursaphelenchus Xylophilus.参与与松树的早期互动。《公共科学图书馆•综合》。2013;8 (10):e78063。https://doi.org/10.1371/journal.pone.0078063.
- 55。
狄米尔MA,RAU A,Aubert J,Hennequet-Antier C,Jeanmougin M,Servant N等人。Illumina高通量RNA测序数据分析综合评价。简短生物形式。2013; 14(6):671-83。https://doi.org/10.1093/bib/bbs046.
- 56。
Young医学博士、Wakefield MJ、Smyth GK、Oshlack A。RNA-seq的基因本体分析:选择偏差的解释。基因组生物学。2010;11(2):R14。https://doi.org/10.1186/gb-2010-11-2-R14.
- 57。
Thomas NP、Soren B、Gunnar von H、Henrik N。信号肽4.0:区分信号肽和跨膜区。Nat方法。2011;8:785–6.
- 58
Sonnhammer el,von heijne g,krogh A.一种隐藏的马尔可夫模型,用于预测蛋白质序列中的跨膜螺旋。Proc Int Conv Intel Syst Mol Biol。1998年; 6:175-82。
- 59
Kanehisa M,Sato Y,Kawashima M,Furumichi M,Tanabe M.Kegg作为基因和蛋白质注释的参考资源。核酸RES。2016; 44(D1):D457-62。https://doi.org/10.1093/nar/gkv1070.
致谢
我们感谢Yuanchao Wang教授(植物病理学,南京农业大学,中国)提供载体PGR107,种子尼古利亚娜·宾夕法尼亚州技术助理。我们也感谢闫望博士(中国南京农业大学植物病理学系)提供有用的建议。
作者,贡献
XQW和LJH是本研究计划的领先调查员。LJH和XQW计划和设计了研究;LJH在XLD的帮助下表演了大多数实验;XQW和Jry贡献了试剂,材料和分析工具;LJH分析了数据;LJH用来自XQW,XLD和Jry的建议写了论文。所有作者都在提交之前对文章评论。作者读并批准了最终的稿件。
基金
本工作得到了中国国家重点研发计划(2018YFD0600203),江苏省自然科学基金(SBK2020044533),江苏高等教育机构的优先学术计划发展(PAPD),江苏博士后研究资金计划(2020Z366)。资金组织在设计,数据收集,分析和解释方面没有作用以及写作稿件。
作者信息
隶属关系
通讯作者
道德宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充资料
附加文件1:表S1。
三个转录om的摘要数据比较Bursaphelenchus Xylophilus.在植物和噬菌体阶段。答:转录组B嗜木菌在2.5小时后。B:转录组B嗜木菌在6,12和24 h感染后。C:转录组B嗜木菌感染后第6和15天。
附加文件2:表S2。
本研究中使用的引物列表。
附加文件3:表S3。
松材线虫三个转录组的候选效应因子列表Bursaphelenchus Xylophilus..
附加文件4:表S4。
候选效果名单Bursaphelenchus Xylophilus.分泌体黑松感染。
附加文件5:图S1。
Pearson在样品之间的相关性。BX-A:霉菌阶段(0小时)。BX-B:Bursaphelenchus Xylophilus.接种到每个杉木茎6小时。BX-C:B嗜木菌接种到每一个杉木茎12小时。BX-D:B嗜木菌接种于每根松树茎24小时。每个处理设3个生物重复。
附加文件6:图。S2。
在噬菌体阶段和三种早期植物寄生阶段的差异表达基因(DEGS)的VENN图。总共获得了867次。
附加文件7:图S3。
菌丝体阶段和三个早期植食性寄生阶段差异表达基因(DEGs)的热图。
权利和权限
开放存取本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
胡,LJ,吴,XQ。,丁,XL。等。候选效应探索感染和生存策略的比较转录组分析Bursaphelenchus Xylophilus.在与松树相互作用的不同阶段。BMC植物生物学21,224(2021)。https://doi.org/10.1186/s12870-021-02993-9.
已收到:
认可的:
发表:
关键词
- Bursaphelenchus Xylophilus.
- RNA-SEQ.
- 比较转录组
- 候选效果
- 细胞死亡抑制