- 研究文章
- 开放访问
- 发布:
细胞壁相关激酶的识别作为重要的调节参与gossypium hirsutum抵抗verticillium dahliae.
BMC植物生物学体积21., 文章编号:220(2021.)
抽象的
背景
黄萎病,由土壤传播真菌引起verticillium dahliae.,是全球棉花生产的主要威胁。越来越多的调查结果表明了瓦克基因参与植物病原体相互作用,但它们在棉花抵抗力方面的作用v大丽花仍然很大程度上不清楚。
结果
在这里,我们对Wak基因家族进行了基因组分析gossypium hirsutum这导致识别81个推定Ghwaks.,这普遍认为是在质膜上定位的。其中,使用荧光融合蛋白的瞬时表达进一步位于烟草表皮细胞中的GHWAK77。所有GHWAK都可以根据其不同的蛋白质结构域分为七组,表明它们可能有意义不同的外部信号以触发对各种环境应力的核心信号传导途径。许多CIS.-预测了调控因子在植物生长的上游区域Ghwaks.并分为激素类、生物类、非生物类和光类四大类。多达28个Ghwaks.,在棉花与土壤的相互作用中发挥潜在作用v大丽花,通过RNA-seq和qRT-PCR筛选。进一步研究Ghwaks.在棉花抵抗力v大丽花,VIGS技术被用来沉默Ghwaks..在20 dpi,剧烈的植物比对照植物显示出更多的萎黄和枯萎病。剧痛植物的疾病指数也明显高于对照的疾病。此外,沉默Ghwaks.显著影响JA-和sa相关标记基因的表达,增加了传播v大丽花在棉茎中,显着妥协v大丽花- 诱导木质素的积累2O.2没有,但增强的豆荚活动。
结论
本研究首次对棉花WAK基因家族进行了综合分析。表达分析和VIGS分析为该病的发生提供了直接证据Ghwaks.参与棉花抵抗力v大丽花.
背景
tetraploid.gossypium hirsutum是世界上栽培最广泛的棉花品种,是天然纤维和油籽的重要来源。黄萎病,由土壤传播真菌引起verticillium dahliae.,是棉花生产的重大威胁[1].抗病性相关基因的鉴定和鉴定是了解棉花与水稻互作的重要基础v大丽花,这对于开发新型疾病管理方法和耐霉菌枯萎的新品种是必要的。
植物生活在一个复杂的环境中,挤满了生物胁迫,主要由各种植物病变和害虫引起,并暴露于非生物胁迫,包括冷,热,干旱和盐度。为了克服这些压力挑战,植物已经发展了一种复杂和高效的防御信令网络,其包括监测系统,以感知触发特定防御响应的不同应力导出的信号[2].细胞壁是一种围绕植物细胞的动态结构,已成为必不可少的监测系统[3.那4.]. 一些受体样激酶(receptor like kinases,RLKs)被认为是细胞壁完整性的传感器,负责细胞壁和细胞质之间的通讯。通常,RLKs包含一个信号肽(SP)、跨膜(TM)结构域和细胞质激酶结构域。根据其不同的胞外结构域可分为21个亚家族[5.].其中,壁相关激酶(WAKs)与其他RLKs的区别在于其独特的细胞外表皮生长因子(EGF)样结构域[5.那6.].
在拟南芥蒂利亚纳, WAKs由5编码wak和22Wakls.(类似的基因)[7.].迄今为止,瓦克基因家族也被识别在其他植物中,包括奥雅萨苜蓿[8.],Brassica Rapa.[9.),毛果杨[10.].已经证明一些WAK参与植物发育,非生物和生物应激反应性。值得注意的是,大多数wak以拟南芥和米饭为特征。拟南芥ATWAK1.,植物中的第一个鉴定的WAK基因显示有助于免疫反应[11.那12.].米饭瓦克的基因,OsDEES1(早期胚胎SAC1的缺陷),在早期胚胎囊发育的调节中发挥了作用[13.].osiwak1.(O. Sativa indica.WAK-1)和HvWAK1(Hordeum Vulgare.WAK-1)参与植物根部发展[14.那15.].XA4编码米饭中的WAK,赋予了比赛特异性耐用性黄oryzaepv。oryzae.通过加强细胞壁并增加茉莉酸酯 - 异亮氨酸和Phytoalexins的产生[16.].奥卡克1(o.苜蓿WAK)和奥斯卡克25.通过伤口和水杨酸(SA)上调,它们的过表达导致转基因稻米的耐受性更高magnaporthe oryzae.[17.那18.].其他四种大米瓦克基因,包括奥斯卡克14.那奥卡克91.那奥斯卡赫92.和奥斯旺112d.,也建议需要抵抗M. Oryzae.通过功能缺失突变[19.].超越米饭和拟南芥,wak在其他植物,比如番茄中也有对病原体的反应吗SlWAK1型(使人抗拒)假单胞菌含油)[20.)、玉米Zmwak.(使人抗拒)Sporisorium Reilianum.)[21.),zmwak-rlk1(使人抗拒)Setosphaeria turcica)[22.].
越来越多的调查结果表明了瓦克基因参与植物病原体相互作用。因此,在我们的研究中,我们使用最新G. Hirsutum基因组序列数据(HAU版本1.1 [23.去探索瓦克基因家族,代表了第一个基因组的识别Ghwaks..而且,二Ghwaks.在功能性地表征以响应v大丽花利用病毒诱导基因沉默(VIGS)进行感染。
结果
Ghwaks.识别和本地化
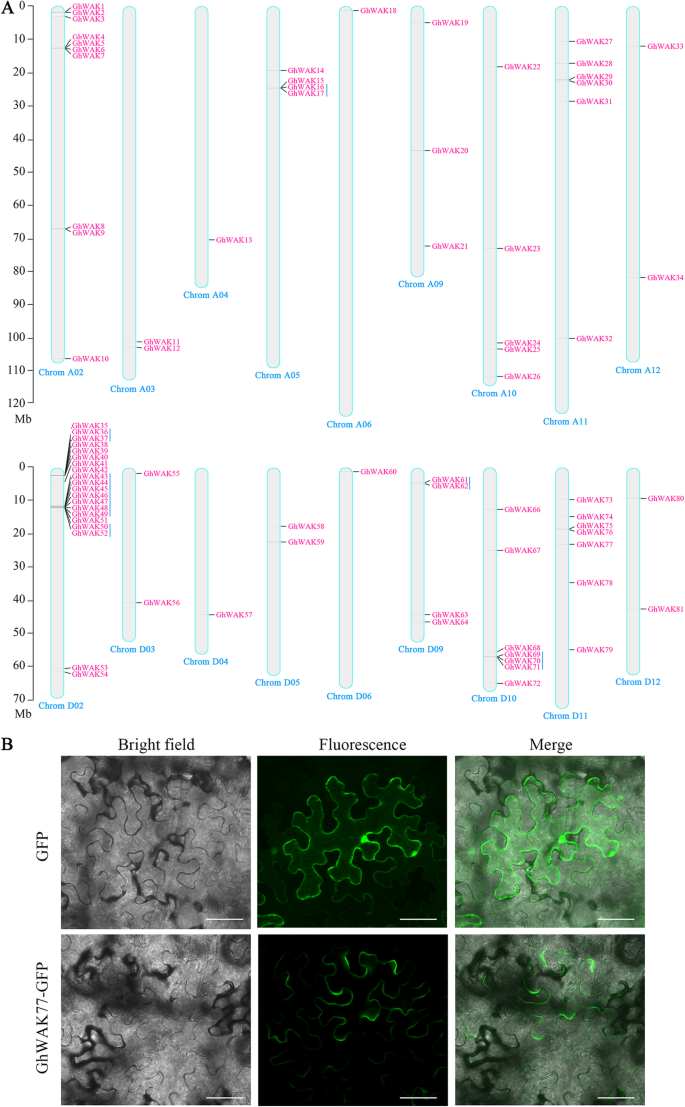
总共,81Ghwaks.作为候选人被鉴定并根据染色体位置命名。这些Ghwaks.标记在18染色体的物理图上(图。1a)和一个脚手架664(GhWAK65).共计34和46Ghwaks.分别分布在A和D子基因组中。染色体D02覆盖了最多的数量Ghwaks.有20个基因。发现了六对串联复制事件,包括GHWAK16 / 17.那GHWAK36 / 37.那GHWAK43 / 44-49那GhWAK50/52那GHWAK61 / 62.和GHWAK69 / 70/71.这些结果表明,进化和扩展Ghwaks.发生在G. Hirsutum,特别是在D02染色体上。有关的详细信息Ghwaks.,包括基因ID,开放阅读框(ORF)长度,氨基酸长度,蛋白质分子量,不稳定指数和亚细胞定位,列于表中1.
所有ghwak均定位于质膜(PM)(见下表)1). 其中,以GhWAK77为代表,利用瞬时表达的荧光融合蛋白进一步定位于烟草表皮细胞。图像清楚地显示,荧光信号对应的唯一GFP.绿色荧光蛋白(green fluorescent protein,绿色荧光蛋白)基因在PM、细胞质和细胞核中均有表达。然而,荧光信号对应于GhWAK77-GFP.单独在PM中示出(图。1b)。这些建议,GHWAK可能是负责电池内外通信的潜在连接器。
Ghwaks具有保守的激酶结构域和不同的细胞外域
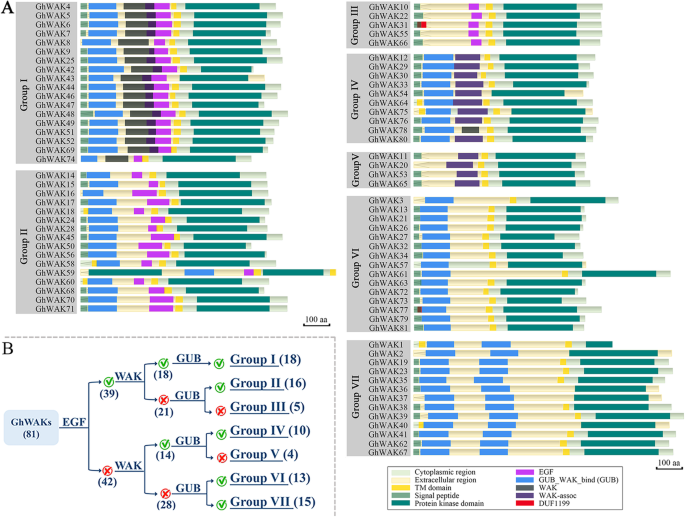
大多数的Ghwaks.有3-4个内含子,并显示相似的外显子-内含子结构(图S1).在GHWAK中鉴定了总共六个保守的蛋白质结构域,包括GUB_WAK_BIND(壁相关受体激酶半月醛酸盐,PF13947),WAK(壁相关激酶,PF08488),WAK Ascap。(壁相关受体激酶C末端,PF14380),EGF(EGF,PF00008; CEGF,PF12662; HEGF,PF12661; EGF_CA,PF07645; EGF_3,PF12947),DUF1199(未知功能的域,PF06712)和蛋白激酶结构域(Pkinase,PF00069; p kkinase_tyr,pf07714;激酶样,pf14531; fam69,pf12260的蛋白质 - 激酶结构域(图。2一种)。在大多数Ghwaks中,细胞质,细胞外和TM区域都是预测的,进一步表明它们是PM蛋白质。典型的瓦克用细胞质激酶结构域和细胞外区域编码跨膜蛋白。然而,几种蛋白质显示出罕见的结构特征,例如细胞外区域中的激酶结构域,双TMS和激酶结构域。根据其蛋白质结构域分析,将所有GHWAK分为七组(图。2b)。I族,II组和第III族的成员是含有细胞外区域中EGF结构域的典型WAK。另外四组,包括IV,V,VI和VII,不含EGF。I和IV组的GHWAKS包含WAK和GUB域。反转,III组的GHWAKS既不包含WAK也不包含GUB域。第II组,VI和VII的GHWAK仅包含GUB域。然而,II和VI是一种GUB结构域组,VII是双GUB域组。G组中的GHWAKS仅包含WAK域。此外,DUF1199域在GHWAK31和GHWAK77中找到。在GHWAK中存在不同类型和数量的细胞外域,表明它们可能会感知或结合不同的外部信号,以触发控制植物开发和对各种环境应力的反应的细胞内信号传导途径。
预测推定CIS.监管元素Ghwak.启动子
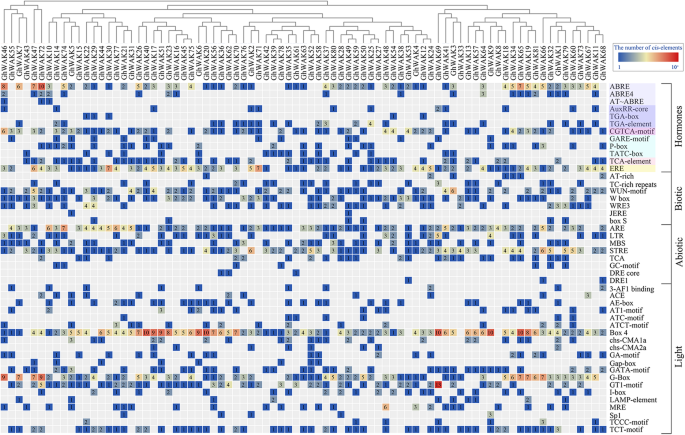
翻译的2-kB地区的翻译开始网站Ghwaks.被认为是促进者,并分析潜在的作用CIS.-调节元件(图。3.).这些CIS.- 分为四个主要组,包括激素,生物,非生物和光。与脱钙酸(ABA)(ABRE,ABRE4和AT-ABRE),生长素(IAA)(AUXRRR-CORE,TGA-BOX和TGA元素),茉莉酮(MEJA)(CGTCA-MOTIF)相关联),鉴定了嗜酸甘油蛋白(Ga)(Ga)(Gar-motif,p盒和TATC盒),SA(TCA元素)和乙烯(ERE)(ERE)。其中,ABRE-MOTIF,CGTCA-MOTIF和ERE在大多数情况下富集Ghwak.推动者,表明它们可能被ABA,JA和ET广泛诱导。生物应激相关的调节元件,如富含富含TC的重复,W-Box,Wun-Motif,WRE3,Jere和Box S,参与Elicitor介导的激活,伤害和病原体反应性。此外,八种非生物响应性调节元件,与厌氧诱导(和GC-矩阵)相关,低温响应性(LTR),干旱诱导性(MBS,DRE核心和DRE1),热休克,渗透胁迫,低pH值,营养饥饿(strE)和相关(TCA),在其中鉴定Ghwak.推动者区域。此外,在启动子中存在各种光响应元件Ghwaks..特别是,盒子4和G箱被广泛肆无忌惮。这些结果表明Ghwaks.可能在对各种压力,激素和光线的反应中发挥重要作用。
Ghwaks.被显着诱导v大丽花感染
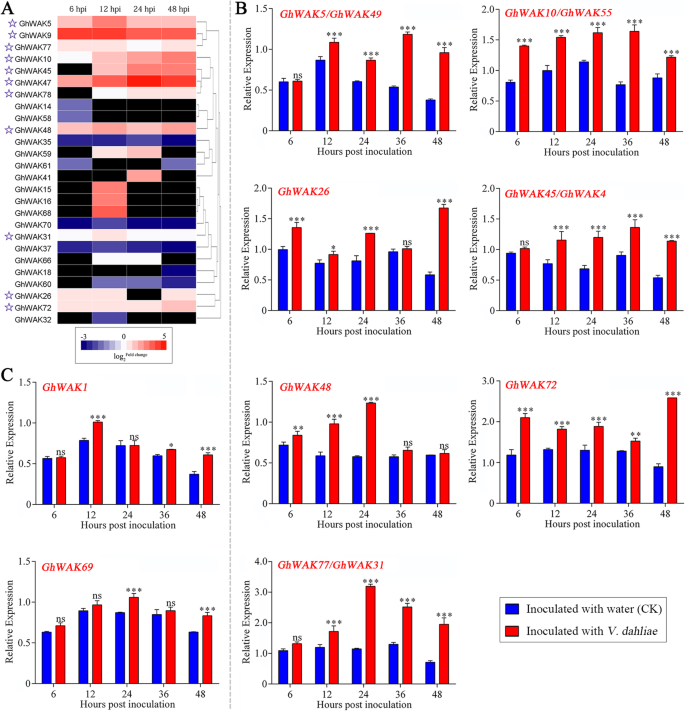
识别Ghwaks.这与v大丽花感染,从RNA-SEQ作为最小截止的转录物表达谱中施加两倍变化。结果,26Ghwaks.筛选出来,包括17个上调和9个下调基因(图。4.一种)。其中,11Ghwaks.,包括GHWAK5那ghwak9.那GhWAK77那GhWAK10那GhWAK45那GhWAK47那GhWAK78那GhWAK48那GhWAK31那GhWAK26和GhWAK72,在至少三个时间点中显着上调,表明他们不断回应v大丽花感染。通过实时定量逆转录PCR(QRT-PCR)进一步验证它们的表达谱。他们的表达结果是响应的v大丽花QRT-PCR感染与RNA-SEQ数据中的那些一致(图。4.b).由于序列相似度高Ghwaks.家庭,难以设计四个基因对的特异性引物,包括ghwak4./GhWAK45那GHWAK5/Ghwak.49岁,GHWAK10 / GHWAK55, 和GhWAK31/GhWAK77。qRT-PCR结果表明,这4对dna序列均为阳性Ghwaks.显着上调。根据RNA-SEQ数据,ghwak4.那GhWAK49和GhWAK55没有表现出上调。因此,使用QRT-PCR找到的表达变化可能更多代表GhWAK45那GHWAK5和GhWAK10至v大丽花感染。另外,其他45Ghwaks.通过QRT-PCR进一步检测到未显示RNA-SEQ数据中的差异表达。因此,ghwak1.和GhWAK69显示接种棉花幼苗的转录水平v大丽花比对照互补地筛选(图。4.C)。最后,共28岁Ghwaks.发现在棉花和v大丽花.
表达式Ghwaks.回应v大丽花感染。一种,Heatmap表示表达模式为26Ghwaks.由于棉花接种而差异化表达v大丽花,与相应的控制相比。基因的表达水平显示为日志2折叠变化(FC)。Fc是治疗FPKM与从RNA-SEQ数据获得的FPKM的比率。通过粉红色和蓝色表示较高和更低的转录水平,并且没有通过深色表示检测到的表达。B.和C,表达分析Ghwaks.从G. HirsutumND601诱导与v大丽花通过QRT-PCR。使用比较2计算相对基因表达水平-ΔΔCt方法GhHis3公司内部控制。条形图表示三个独立实验计算出的标准误差(SE)。星号表示根据Sidak多重比较检验,差异有统计学意义(**P.< 0.001, * * *P. < 0.01; ns, no significant)
沉默Ghwaks.棉花对黄萎病的抗性减退
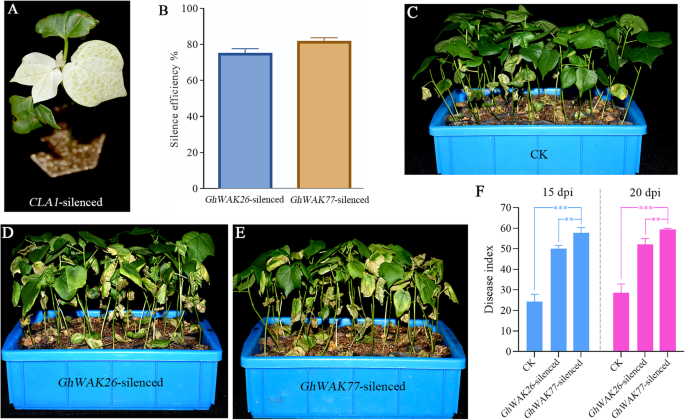
GhWAK26和GhWAK77对病毒感染有明显且持续的上调表达v大丽花(图。4.).此外,它们还包含CIS.- 与Meja和Sa相关的启动子中,这在棉花抵抗力中起着关键作用v大丽花. 从而进一步揭示Ghwaks.在棉花抵抗力v大丽花那GhWAK26和GhWAK77作为在这里的代表优先考虑使用基于烟草的Vigs系统。在渗透后大约两周,用含有PTRV1和PTRV2的土壤杆菌培养物的混合物CLA1,在新出现的真实叶子上显示了强烈的光漂白表型(图。5.a),说明VIGS系统工作良好。然后,表达式GhWAK26和GhWAK77在用ptrv2渗透的叶子中检测到GhWAK26和ptrv2-GhWAK77分别是。如图1所示。5.b,表达GhWAK26和GhWAK77大约减少了80%,表明VIGS引发了棉花植株的沉默。20岁 接种后天数(dpi),活力植物(图。5.d和e)表现出比含有空载体ptrv1和ptrv2的土壤杆菌培养物渗透的对照植物更多的萎黄和枯萎物(图。5.c)在15 dpi和20 dpi时,VIGSed植株的病害指数也显著高于对照(图1)。5.f).因此,VIGS检测结果表明GhWAK26和GhWAK77是棉花抵抗力的重要参与者v大丽花感染。
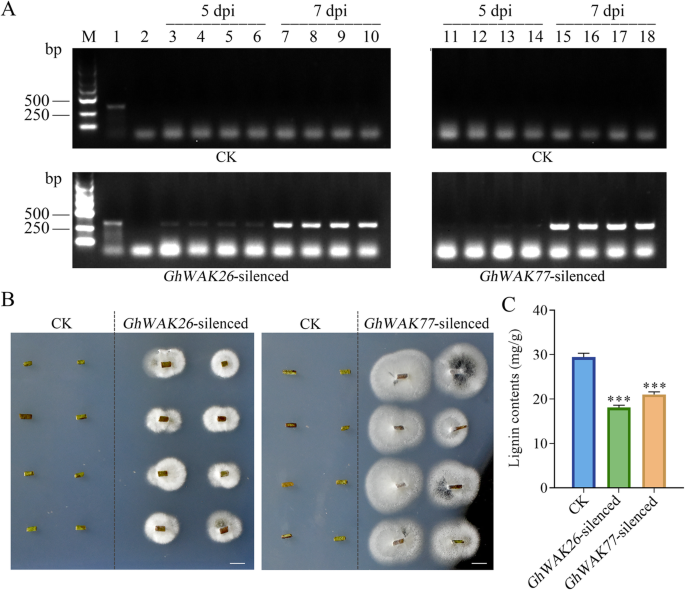
沉默Ghwaks.增加了蔓延v大丽花在棉茎上
接种后,v大丽花采用PCR方法检测棉花茎中蛋白质的含量。无特异性扩增产物v大丽花在5 dpi和7 dpi的ck中显示,表明这一点v大丽花尚未侵入茎或大量乘以(图。6.A和图2).然而,在5 dpi,很少具体产品从v大丽花被扩大了GhWAK26- 义和GhWAK77-沉默的植物,代表少量的病原体入侵。此外,在7dpi时,亮带从GhWAK26- 义和GhWAK77- 琼脂糖凝胶上出现了植物茎,表明这一点v大丽花曾在很大程度上被侵入。此外,马铃薯葡萄糖琼脂(PDA)的病原体分离显示大量v大丽花是从树的茎上长出来的GhWAK26- 义和GhWAK77-沉默的棉花植株,而对照没有菌丝体(图。6.b)。PCR检测和PDA培养结果都表明沉默Ghwaks.显着增加了蔓延v大丽花在棉茎中。
木质素被认为在预防棉花中发挥重要作用v大丽花.因此,我们进一步比较了木质素含量的变化Ghwak.- 用CK的棉茎。结果表明木质素含量Ghwak.- 植物显着低于CK中的植物(图。6.c),这可能影响阀杆结构,然后减少预防棉花v大丽花感染。
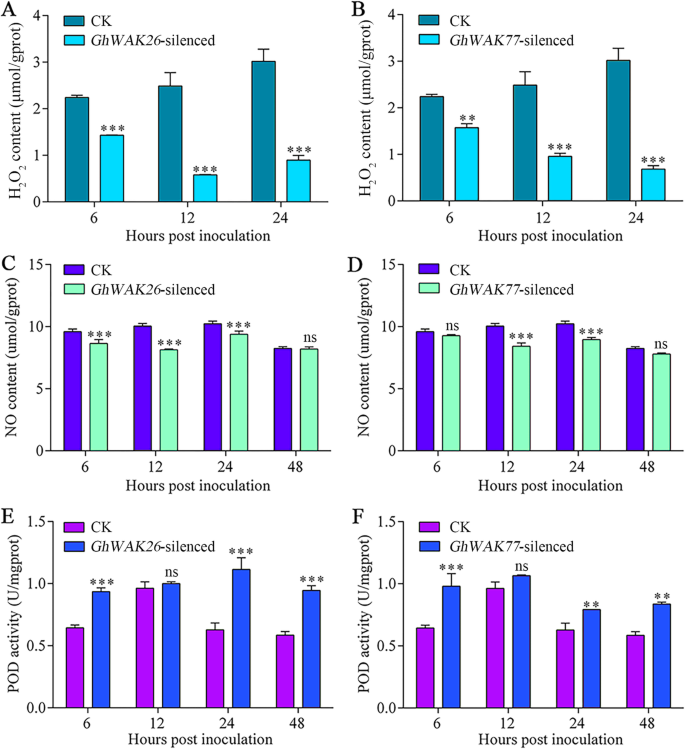
沉默Ghwaks.大幅受到影响v大丽花- 诱导H.2O.2,一氧化氮(NO)和过氧化物酶(POD)
h的内容2O.2和否,和豆荚活动Ghwak.-沉默植物接种v大丽花进一步测量。Ghwaks.沉默引起较低的H水平2O.2在接种后6小时(HPI),12 HPI和24 HPI(图。7.A和B)。两个都GhWAK26- 和GhWAK77- 与CK相比,累积的植物累积大大压下水平(图。7.C和D)。然而,POD的活动显着提升GhWAK26- 和GhWAK77- 除了12 HPI外,6 HPI,24 HPI和48 HPI的植物(图。7.e和f)。
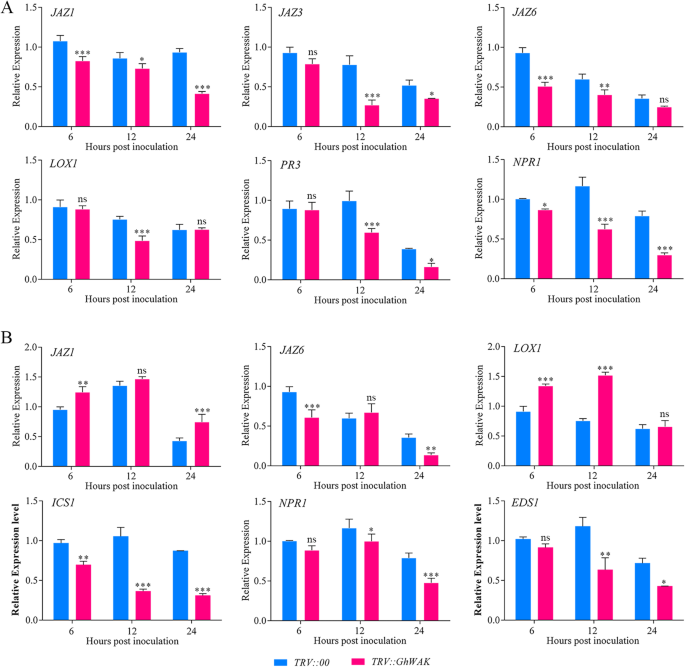
沉默Ghwaks.显着影响JA和SA相关标记基因的表达
此外,检测了涉及植物防御信号传导途径的几种JA和SA相关标记基因的表达。表达JAZ1(jasmonate-zim-domain蛋白质),JAZ3那JAZ6那LOX1.(脂氧合酶)(JA相关标记基因),PR3(发病机制相关蛋白)和NPR1(PR蛋白非表达者)(sa相关标记基因)沉默后显著下调GhWAK26在棉花(图。8.一种)。在GhWAK77- 植物,JAZ6和涉及SA信号通道的三个重要基因,包括IC1.(Isochorismate Synthase),NPR1和EDS1(疾病易感性增强),与对照组相比下调。相反,表达JAZ1和LOX1.由于沉默而显着上调GhWAK77(图。8.b)。这些结果表明GhWAK26和GhWAK77可能涉及棉花抵抗力v大丽花通过SA和JA信号通路。
讨论
Wak基因家族已经在几种植物种类中进行了分析,例如A. Thaliana.[7.],o.苜蓿[8.],P. Trichocarpa.[10.),B. Rapa.[9.]. 一些wak与对病原体感染的反应有关。例子是拟南芥Wak1.[12.)、玉米zmwak-rlk1(HTN1.),Zmwak.(qHSR1)[21.那22.)、小麦Stb6和TaWAK624.那25.], 白饭XA4那奥卡克1和奥卡克91.[16.那17.那26.]和橙色cswakl08.[27.]赋予宿主植物疾病抗性。在目前的工作中,共81岁Ghwaks.首次从高质量的角度对其进行了系统的鉴定和分析G. Hirsutum基因组(表1)[23.]. 其中,28Ghwaks.可能涉及棉花之间的相互作用v大丽花(图。4.).特别是,沉默GhWAK26或者GhWAK77显着降低了棉花植物的抵抗力v大丽花感染(图。5.),建议wak在棉花 - 病原体相互作用期间是重要的抗性基因。
在PM,作为细胞表面受体的RLK可以感知和处理细胞外危险信号以触发植物防御响应[28.].Wak属于RLK亚家族。所有GHWAKS含有典型的真核激酶结构域,主要存在于细胞内区域和相对良好的保守中(图。2一种)。此外,Ghwaks在所有概率中找到PMS(表1, 图。1),暗示Ghwaks在细胞内外沟通时具有潜在的作用。为了穿透植物根部以获得对木质的进入并在血管系统中传播,v大丽花通常分泌各种毒素和碳水化合物活性酶,包括糖蛋白和细胞壁降解酶[29.那30.].因此,可以想到这一点v大丽花感染影响植物细胞壁完整性(CWI)并产生一些降解产物,这些降解产物是重要的防御信号[31.]. 在细胞外区域,GhWAKs包含五个不同的结构域(图。2a),其可以感测CWI或与这些细胞外基质的不同组分相互作用,例如富含甘氨酸的蛋白质,果胶和寡糖醛酸酯(OGS)[32.那33.那34.].
目前,分子机制的瓦克-介导的耐药性在很大程度上仍然是未知的。然而,一些与WAKs相关的防御反应已经被报道,包括细胞壁强化[16.],发病相关的基因激活[18.SA或JA积累[27.豆荚和超氧化物歧化酶活动[27.],反应性氧气(ROS)稳态[27.].在这里,沉默Ghwaks.导致几种基因的上调或下调(图。8.)和抑郁的棉花抵抗力v大丽花.其中,jaz.和熏鲑鱼与ja介导的防御反应有关[35.].NPR1,ICS1和EDS1与SA介导的国防响应有关[36.].已知两种植物激素,JA和SA参与了植物抗性的调节v大丽花[37.那38.].此外,一些激素响应性和生物应激相关的调节元素富集在启动子中Ghwaks.(图。3.).因此,这些发现表明Ghwak.用作介质以激活细胞内SA和JA信号传导途径来调节棉抗性。
v大丽花是一种脉管病原体,穿透寄主的根,然后通过蒸腾作用延伸到植物的其他地上部分[29.那37.]. ROS、NO、细胞壁、木质素、胼胝质和POD等物理、化学和结构障碍的改善,有助于阻止植物的扩张和减少定殖v大丽花在棉花组织中[37.那39.那40那41.].在这项研究中,更多v大丽花中检测出GhWAK26沉默或GhWAK77- 具有较低木质素含量的植物而不是CK中的植物(图。6.).而且,沉默Ghwaks.在棉花植物中显着妥协v大丽花-诱导H积累2O.2与NO相比,POD活性增强(图1)。7.).这些发现表明Ghwaks.通过调节木质素,H的积累,在防止病原体中蔓延的作用2O.2NO和POD活性。总的来说,这些结果增加了我们对棉花WAK基因家族的认识,特别是促进了对其抗病功能的认识。
结论
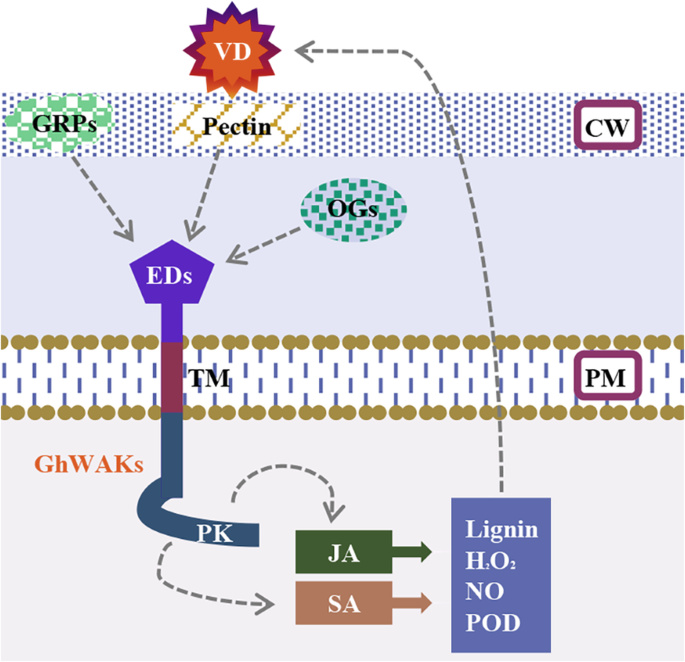
在这项研究中,我们对WAK基因家族进行了基因组分析G. Hirsutum识别81个推定Ghwaks.,这可能有意义不同的外部信号以触发对各种环境 - 应力的核心信令途径。其中,28Ghwaks.棉花和棉花之间相互作用的潜在作用v大丽花被筛选出来了。沉默Ghwaks.可显著影响JA-和SA相关标记基因的表达,增加病毒的传播v大丽花在棉茎中,显着妥协v大丽花- 诱导木质素的积累2O.2没有,但增强的豆荚活动。这些结果提供了直接证据Ghwaks.参与棉花抵抗力v大丽花.最后,旨在为Ghwak涉及棉花抗性的模型v大丽花提出了(图9.).
方法
鉴定和生物信息学分析Ghwaks.
拟南芥WAKs的氨基酸和核苷酸序列https://www.arabidopsis.org/)被询问G. Hirsutum棉花fgd基因组数据库(HAU) (https://cottonfgd.org/)使用BLAST程序(E-value <0.01)[7.那23.]. 通过HMMER软件(HMM数据库)对获得的假定GhWAKs进行进一步鉴定 = Pfam;重要性E值< 0.01) (https://www.ebi.ac.uk/Tools/hmmer/search/hmmscan)确认存在保守的蛋白质结构域。
通过PROSITE数据库分析所有假定GhWAKs的功能位点和跨膜拓扑结构(https://prosite.expasy.org/)和phobius数据库(http://phobius.sbc.su.se/), 分别。使用扩展程序分析蛋白质的氨基酸,分子量,理论等电点和不稳定性指数(http://www.expasy.org/).使用Cello V2.5进行蛋白质亚细胞定位的预测(http://cello.life.nctu.edu.tw/)和protcomp 9.0(http://www.softberry.com/berry.phtml?topic=protcomppl&group=programs&subgroup=proloc).信号肽使用SignalP 5.0 (http://www.cbs.dtu.dk/services/signalp//).
染色体位置分析,基因结构和CIS.-Elements.
有关物理染色体位置和基因结构的信息Ghwaks.从基因特征格式(GFF)文件中的基因注释中提取,从CottonFGD网站下载并由TBTools软件分析[42.].潜在的启动子序列,上游2 kBGhwaks.,也从中提取了G. Hirsutum基因组数据库。的CIS.使用PlantCare数据库预测潜在启动子中的-Elements(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).
植物材料和v大丽花接种
的种子尼古利亚娜·宾夕法尼亚州和G. Hirsutum简历。Nongda 601(ND601)保存在中国河北农业大学中国华北作物改善和监管国家重点实验室。N. Benthamiana.在21°C下在温室中长大为5周,含有14/10小时(光/暗)光周期。ND601在25°C下在温室中在14-H光/ 10-H暗循环下生长,具有约70%的相对湿度。棉花幼苗接种v大丽花菌株林溪2-1 (107.孢子ml- 1)如前所述进行[39.].
蛋白质亚细胞本地化
orf的GhWAK77(没有停止密码子)通过PCR与引物Gwak77-F和Gwak77-R扩增(表S.1),然后通过attb / attp重组反应引入进入载体pdonr™207,如制造商(Invitrogen)所述。的GhWAK77片段从入口克隆转移到表达载体pEarlyGate103 [43.[attl / attr Recombinant反应,如制造商(Invitrogen)所述。将重组表达载体引入根癌土壤杆菌GV3101,通过[中描述的方法,培养并渗透到四周历史的烟草叶中。44.].2天后,使用激光扫描显微镜检查烟草叶片表皮细胞中的GFP信号(Fluoview Fv1000; Olympus)。
RNA序列数据与qRT-PCR分析
转录模式Ghwaks.接种后的棉状根v大丽花使用先前发布的高分程RNA-SEQ数据进行分析[37.].日志2褶皱变化由FPKM计算(每百万映射的外显子模型的碎片),并用于与TBTOOLS V0.67软件的分层聚类的热图[42.].根据制造商的说明,使用EasySpin植物RNA试剂盒(AIDLAB,北京)提取总RNA。通过1.5%琼脂糖凝胶电泳检测RNA的质量和浓度分别检测到1.5%琼脂糖凝胶电泳和Nanodrop TM 1000分光光度计(Thermo Fisher Scientific)。用逆转录试剂盒合成cDNA(REVERTRAACE®QPCRRT MARIC MIX与GDNA去除剂,TAKARA,CHINA)。使用7500个实时PCR系统(Applied Biosystems,USA)进行QRT-PCR与Thunderbird®Sybr®QPCR混合(Takara,大连,中国)进行。2-ΔΔCt方法用于计算基因的相对表达。盖希斯3.用作内部参考。每次治疗服用三种生物重复。
棉花的伟大测定
Wigs,Ptrv1和Ptrv2的载体被清华大学刘雅教授提供了[45.].碎片Ghwaks.通过PCR级别并插入到PTRV2载体中埃森我和kpn.一、将构建的载体分别转入A. Tumefaciens.冻融法菌株GV3101 [46.].如前所述进行棉花的VIGS [47.].每次处理使用至少30种植物,每次治疗重复三次。植物抵抗力v大丽花通过分析疾病指数进行测定[48.].
检测和隔离v大丽花在棉茎上
在5 dpi和7 dpi,1cm和0.5cm的样品在接地上方的0.5cm茎的高度下切除,用于检测和分离v大丽花分别是。v大丽花用引物P1和P2进行PCR检测[49.].v大丽花棉花茎的分离按照之前的方法进行[50.].每个处理取24株单株,重复3次。
NO、H的测量2O.2和豆荚活动
将棉花幼苗的第一片真叶用液氮在砂浆中粉状,用50mm磷酸钠缓冲液(pH 7.0)均质。离心14000 g, 20 min后,上清测定NO、H2O.2与商业化的测定套件(南京江城生物工程研究所)遵循手册,介绍了豆荚活动。使用Pierce TM BCA蛋白质测定试剂盒(Thermo Scientific)测量上清液的总蛋白质浓度。
引物与统计分析
本研究中使用的所有引物列于表S中1.使用Software GraphPadPrism®8(GraphPad,San Diego,CA,USA)分析了测量值之间的差异。具有多种比较的双向ANOVA(SIDAK的测试)用于比较接种之间的棉根中的基因表达v大丽花并在同一HPI,疾病指数,H接种水(CK)2O.2没有内容,与豆荚活动之间Ghwak.-沉默植株和CK。使用Dennett的多重比较测试的单向ANOVA用于比较木质素含量Ghwak.-沉默植株和CK。的P.- 假设尺寸小于0.05尺寸统计学意义。
数据和材料的可用性
所有GhWAKs序列信息可在棉花功能基因组数据库(CottonFGD) (https://cottonfgd.org/about/download.html.).在当前研究期间生成或分析的数据包含在本发布的文章中及其补充数据文件中,并从相应的作者获得合理的请求。
缩写
- 阿巴:
-
脱盐酸
- CWI公司:
-
细胞壁完整性
- eds.:
-
增强疾病易感性
- egf:
-
表皮生长因子
- 等:
-
乙烯
- FPKM:
-
每千碱基每百万外显子模型的碎片被绘制出来
- 遗传算法:
-
吉布林素
- HPI:
-
接种后的小时
- ICS:
-
等抚养态合成酶
- jaz.:
-
Jasmonate-zim-domain蛋白质
- 熏鲑鱼:
-
脂氧合酶
- Meja:
-
茉莉酸甲酯
- 不:
-
一氧化氮
- 美国国家公共电台:
-
pr蛋白的非表达剂
- 下午:
-
血浆膜
- 荚:
-
过氧化物酶
- PR:
-
发病机制相关蛋白
- rlks:
-
受体样激酶
- ROS:
-
反应性氧气
- SA:
-
水杨酸
- SP:
-
信号肽
- TM值:
-
跨膜
- 伟大的人:
-
病毒诱导的基因沉默
- 怪人:
-
墙壁相关的激酶
参考
- 1。
蔡云飞,何兴华,莫继军,孙强,杨建平,刘建国。棉花抗黄萎病的分子研究与基因工程研究进展。生物技术学报。2009;8(25):7363-72。
- 2。
verhage a,van wees sc,pieters cm。植物免疫:这是荷尔蒙说话,但他们说什么?植物理性。2010; 154(2):536-40。https://doi.org/10.1104/pp.110.161570.
- 3.
Bacete L、Mélida H、Miedes E、Molina A。植物细胞壁介导的免疫:细胞壁变化引发抗病反应。植物J。2018;93(4):614–36.https://doi.org/10.1111/tpj.13807.
- 4.
NovakovićL,Guo Tt,Bacic A,Sampathkumar A,Johnson K.击中植物细胞壁响应非生物应激的植物细胞壁重塑中涉及的墙壁感应和信号通路。植物。2018; 7(4):89。https://doi.org/10.3390/plants7040089..
- 5。
受体样激酶来自拟南芥形成一个与动物受体激酶相关的单系基因家族。国家自然科学基金资助项目:国家自然科学基金资助项目。https://doi.org/10.1073/pnas.181141598.
- 6。
陈建平,陈建平。表皮生长因子样结构域与蛋白激酶相互作用的研究进展[j] .中国生物医学工程学报,1999;
- 7。
Verica JA, He ZH。细胞壁相关激酶(瓦克),瓦克- 麦基酶基因家族。植物理性。2002; 129(2):455-9。https://doi.org/10.1104/pp.011028.
- 8。
de Oliveira LFV, Christoff AP, de Lima JC, de Ross BCF, Sachetto-Martins G, Margis-Pinheiro M等。水稻基因组中壁相关激酶基因家族。植物科学。2014;229:181 - 92。https://doi.org/10.1016/j.plantsci.2014.09.007.
- 9。
张B,李P,Su Tb,Li Pr,Xin Xy,Wang Wh等。骨盆相关激酶基因的综合分析及大白菜中非生物和生物应激的表达(芸苔属植物拉伯ssp。学报).植物生长杂志。2020;39:72-86。https://doi.org/10.1007/S00344-019-09964-3.
- 10。
托夸尔(Tocquard)等。在硅壁相关激酶家族的研究显示,大规模的基因组扩展可能与功能多样化有关杨树.树遗传学基因组。2014; 10(5):1135-47。https://doi.org/10.1007/s11295-014-0748-7.
- 11.
他Zh,Fujiki M,Kohorn Bd。细胞壁相关的受体样蛋白激酶。J Biol Chem。1996年; 271(33):19789-93。https://doi.org/10.1074/jbc.271.33.19789.
- 12.
何志红,何丹,何德平。一种细胞壁相关受体激酶的诱导表达。植物j . 1998; 14(1): 55 - 63。https://doi.org/10.1046/j.1365-313X.1998.00092.x.
- 13。
王,黄蜂,任圣,李杰,孙y,太阳dy等。稻壁相关的受体样激酶基因OsDEES1在女性配子上发挥作用。植物理性。2012; 160(2):696-707。https://doi.org/10.1104/pp.112.203943.
- 14。
kanneganti v,gupta ak。Rnai介导的壁悬挂壁相关激酶,osiwak1.在奥雅萨苜蓿导致由于花药盲目而受损的根系发育和无菌。physiolmol biol植物。2011; 17(1):65-77。https://doi.org/10.1007/S12298-011-0050-1..
- 15.
Kaur R,Singh K,Singh J.一种特异性壁相关激酶基因,HvWAK1,调节根生长,在大麦和其他谷物中具有高度分歧。Funct综合基因组。2013; 13(2):167-77。https://doi.org/10.1007/S10142-013-0310-Y..
- 16。
胡k,cao jb,张俊,夏f,ke yg,张ht等。通过细胞壁增强改善抗病性基因多种农艺性状。Nat植物。2017; 3:17009。https://doi.org/10.1038/nplants.2017.9.
- 17。
李鹤,周鸣,赵某,苏sc,彭yl。一种新型壁相关的受体样蛋白激酶基因,奥卡克1在水稻稻瘟病抗性中起着重要作用。植物学报。2009;69(3):337-46。https://doi.org/10.1007/S11103-008-9430-5.
- 18。
张学堂,陈明,等。水稻壁相关激酶25的过表达(奥斯卡克25.)改变对细菌和真菌病原体的抵抗力。Plos一个。2016; 11(1):E0147310。https://doi.org/10.1371/journal.pone.0147310.
- 19。
Delteil A,Gobbato E,Cayrol B,Estevan J,Michel-Romiti C,Dievart A等人。几个壁相关的激酶对稻瘟病真菌的基础防御积极和负面地参与。BMC植物BIOL。2016; 16(1):17。https://doi.org/10.1186/s12870-016-0711-x..
- 20.
Rosli Hg,郑y,帕摩马,钟股,致以象限的,Fei ZJ等。由鞭毛蛋白诱导和通过病原体效应抑制的基于转录组织基因筛选鉴定了植物免疫的细胞壁相关激酶。基因组Biol。2013; 14(12):R139。https://doi.org/10.1186/gb-2013-14-12-r139.
- 21.
Zuo Wl,Chao Q,张n,ye Jr,Tan GQ,Li Bl,等。玉米壁相关激酶赋予头部黑穗料的定量抗性。NAT Genet。2015; 47(2):151-7。https://doi.org/10.1038/ng.3170.
- 22.
Hurni S,Scheuermann D,Krattinger SG,Kessel B,柳条T,Herren G等。玉米抗病基因HTN1.针对北方玉米叶枯病,编码了一个与壁相关的受体样激酶。美国国家科学院学报2015;112(28):8780-5。https://doi.org/10.1073/pnas.1502522112.
- 23.
王M,Tu L,Yuan D,Zhu D,Shen C,Li Jy等。两倍培养的同种异体四倍体棉花的参考基因组序列,gossypium hirsutum和Gossypium Barbadense..NAT Genet。2019; 51(2):224-9。https://doi.org/10.1038/s41588-018-0282-x..
- 24.
Saintenac C,Lee Ws,Cambon F,Rudd JJ,RC,Marande W等人。小麦受体 - 激酶样蛋白STB6控制对真菌病原体的基因抗性抗性Zymoseptoria tritici.NAT Genet。2018; 50(3):368-74。https://doi.org/10.1038/s41588-018-0051-X..
- 25.
Marta DB,Yuliya K,Andrzej Z,PrzemysławW,Anna No,Wojciech MK等。Tawak6.编码壁相关激酶参与小麦抗性与成年植物抗性相似的叶片生锈。Plos一个。2020; 15(1):E0227713。https://doi.org/10.1371/journal.pone.0227713.
- 26.
Al-Bader N,Meier A,Geniza M,Gongora Ys,Oard J,Jaiswal P.损失过早阻止密码子壁相关激酶91(奥卡克91.)水稻纹枯病抗性基因的研究。生物十四。2019;625509https://doi.org/10.1101/625509.
- 27.
李Q,胡啊,qi jj,豆腐,qin xj,zou xp等。Cswakl08,一种病原体诱导的壁相关的受体样激酶在甜橙,通过ROS控制和JA信号传导赋予柑橘细菌溃疡的抗性。Hortic Res。2020; 7(1):42。https://doi.org/10.1038/s41438-020-02638-020-0263-Y..
- 28.
van der Burgh Am,Jooosten Mhaj。植物免疫:思考在外面和盒子里面。趋势植物SCI。2019; 24(7):587-601。https://doi.org/10.1016/j.tplants.2019.04.009.
- 29.
FRADIN EF,THOMMA BP。紫癜枯萎病的生理学和分子方面v大丽花和V. albo-acrum.Mol Plant Pathol. 2006;7(2): 71-86。https://doi.org/10.1111/j.1364-3703.2006.00323.x.
- 30.
Klosterman Sj,Subbarao Kv,Kang S,Veronese P,Gold Se,Thomma BP等。对比基因组学探讨了植物血管枯萎病原体的利基适应。PLOS POAROG。2011; 7(7):E1002137。https://doi.org/10.1371/journal.ppat.1002137.
- 31。
一堵完整的墙:压力下植物细胞壁的监视和维护。新植醇。2020;225(4):1428 - 39。https://doi.org/10.1111/nph.16166.
- 32。
吉亚罗拉五世,克雷S,冯登德里施B,巴特尔D。这个佛罗啶料理植物植物富含甘氨酸的蛋白CpGRP1与细胞壁相关蛋白激酶1 (CpWAK1)相互作用,并在脱水过程中积累在叶片细胞壁中。新植醇。2016;210(2):535 - 50。https://doi.org/10.1111/3/13766.
- 33。
Kohorn Bd,Kohorn SL。细胞壁相关的激酶,WAKS作为果胶受体。前植物SCI。2012; 3:88。https://doi.org/10.3389/fpls.2012.00088.
- 34。
Brutus A,Sicilia F,Macone A,Cervone F,De Lorenzo G.域交换方法揭示了植物壁相关激酶1(Wak1)作为寡聚菌尿酸酯的受体的作用。Proc Natl Acad SCI U S A. 2010; 107(20):9452-7。https://doi.org/10.1073/pnas.1000675107.
- 35。
植物胁迫应答与生长发育中的生物合成、信号转导与作用。2007年检讨的更新植物学.安机器人。2013;111(6):1021 - 58。https://doi.org/10.1093/aob/mct067..
- 36。
郑XY,周M,Yoo H,Prunedapaz JL,Spivey NW,Kay Sa,等。植物免疫信号水杨酸生物合成的空间和时间调节。Proc Natl Acad Sci U S A. 2015; 112(30):9166-73。https://doi.org/10.1073/pnas.1511182112.
- 37。
张Y,王X,荣W,杨杰,李泽,吴Lq等。组织化学分析揭示了强大的内在防御Gossypium Barbadense.而不是G. Hirsutum与抵抗力相关verticillium dahliae..Mol植物微生物相互作用。2017; 30(12):984-96。https://doi.org/10.1094/mpmi-03-17-0067-r..
- 38。
高W,Long L,Zhu L,Xu L,Gao Wh,Sun LQ等。蛋白质组学和病毒诱导的基因沉默(Vigs)分析揭示了棉酚,芸苔类化合物和茉莉酸导致棉花的抵抗力verticillium dahliae..蛋白质组学。2013;12(12):3690-703。https://doi.org/10.1074/mcp.M113.031013.
- 39。
杨杰,张义,王XF,王维克,李泽,吴杰等。hyprp1.在负面调节棉花抵抗力方面进行角色v大丽花通过细胞壁增厚和ROS积累。植物生物学学报。2018;18(1):339。https://doi.org/10.1186/s12870-018-1565.1..
- 40。
徐L,朱禄,涂,刘LL,元DJ,Jin L等。木质素代谢在棉花对枯萎的真菌的抵抗力方面具有核心作用verticillium dahliae.如RNA-SEQ依赖性转录分析和组织化学透露。J Exp Bot。2011; 62(15):5607-21。https://doi.org/10.1093/jxb/Err245.
- 41。
张继,胡hl,王xn,杨烨,张cj,zhu hq,等。动态感染verticillium dahliae.陆地棉。植物生物学。2020;22(1):90–105.https://doi.org/10.1111/plb.13037..
- 42。
陈cj,陈h,张y,thomas hr,frank mh,他,呃等。TBTOOLS:为大生物数据的交互式分析开发了一个综合的工具包。莫尔植物。2020; 13(8):1194-202。https://doi.org/10.1016/j.molp.2020.06.009.
- 43.
Earley KW, Haag JR, Pontes O, Opper K, Juehne T, Song K,等。植物功能基因组学和蛋白质组学的通道兼容载体。植物j . 2006; 45(4): 616 - 29。https://doi.org/10.1111/j.1365-313x.2005.02617.x.
- 44.
火花IA,散迹J,Kearns A,Hawes C.烟草植物中的荧光融合蛋白的快速,瞬态表达以及稳定转化的植物的产生。NAT PROTOC。2006; 1(4):2019-25。https://doi.org/10.1038/nprot2006.286.
- 45.
刘Y,Schiff M,Marathe R,Dinesh-Kumar Sp。烟草RAR1.那EDS1和npr1 / nim1就像基因是N.-介导的对烟草花叶病毒的抗性。植物j . 2002; 30(4): 415 - 29。https://doi.org/10.1046/j.1365-313x.2002.01297.x.
- 46.
陈H,尼尔森卢比,谢尔伍德JL。增强了转化体的恢复根癌土壤杆菌冻融转换后和药物选择。生物技术。1994年; 16(4):664-8 670。
- 47.
高XQ,Britt Rc Jr,Shan LB,他P.农杆菌介质的病毒诱导的棉花诱导基因沉默测定法。j Vis exp。2011; 54:E2938。https://doi.org/10.3791/2938.
- 48.
张宝林,杨元文,陈志忠,于国威,刘德良,李洪军,等。海岛棉Gbve1号编码受体样蛋白的基因赋予抗脱落和非落叶分离株的抗性verticillium dahliae..Plos一个。2012; 7(12):E51091。https://doi.org/10.1371/journal.pone.0051091.
- 49.
朱益,王子,里昂街。PCR检测verticillium dahliae.来自患病植物。Acta phytopathol sinica。1999年; 29(3):250-5。
- 50。
张志军,张志军,张志军等。番茄对黄萎病抗性的遗传分析VE1..植物理性。2009; 150(1):320-32。https://doi.org/10.1104/pp.109.136762.
确认
所有作者都感谢实验室成员寻求帮助,建议和讨论。
资金
这项工作得到了中国农业研究系统(CARS-15-03)、河北省科技支撑计划(16226307D)和河北省优秀青年基金(C2019204365)的资助。资助机构为这项研究提供了资金支持,包括实验设计和实施、抽样和数据分析。没有资助者在数据收集、分析和撰写手稿方面发挥作用。
作者信息
从属关系
贡献
JY,XW和ZM设计了实验并写了稿件。JY,MX和GW大部分实验。YZ和ZL辅助实验,分析了数据并讨论了结果。所有作者均阅读并批准了手稿。
通讯作者
伦理宣言
道德认可和参与同意
不适用。
出版许可
不适用。
相互竞争的利益
作者声明他们没有利益冲突。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
杨,J.,谢,M.,王,X.等等。细胞壁相关激酶的识别作为重要的调节参与gossypium hirsutum抵抗verticillium dahliae..BMC植物BIOL.21,220(2021)。https://doi.org/10.1186/s12870-021-02992-021-02992
已收到:
公认:
出版:
关键词
- gossypium hirsutum
- 瓦克
- verticillium dahliae.
- 电阻
- 中收取