摘要
种子萌发是静态器官通过该过程重新激活其最终与恢复细胞分裂的新陈代谢。通常是种子内含有的植物的生长,并导致形成幼苗。转录后调节在基因表达中起着重要作用。在细胞中,转录后调节由许多因素介导,例如RNA结合蛋白,MicroRNA和抗乳膏。本综述概述了种子萌发与转录后调节之间的关系。它解决了种子萌发和RNA结合蛋白,微瘤和替代剪接之间的关系。本介绍当前知识的陈述将促进新的调查纳入种子萌发与植物后转录后调节的相互作用的相关性。
背景
种子是用于播种的植物的籽粒或成熟的胚珠,并且被认为是植物的浓缩形式。在合适的环境条件下,它可以从生理静态状态发芽,动员其储备,生物合成新蛋白质,再生细胞器,并产生细胞膜,最终突出胚胎并进入幼苗建立。种子萌发是指一系列生理和形态发生过程,其激活许多新的生物学过程,包括DNA复制,酶活化,细胞分裂,膜和线粒体修复,蛋白质合成,产生足够的能量供应,幼苗生长[1那2].在双子叶植物中,胚根首先从种子中出现。它能使幼苗固定在地上。在吸收水分后,胚芽从种子中冒出来[3.那4.].在单子叶植物种子中,胚胎的子叶和胚根分别被植物精神和殖民粒瘤覆盖。罗伊希萨首先生长出种子,然后是胚根。然后将植物精光推才向上推,直至其到达表面[3.那4.].种子萌发的调控网络是由许多因素介导的,如温度、水、氧、光、营养、植物激素和mRNA氧化[5.那6.那7.那8.].
转录后调控是指在转录后水平上对基因表达的调控。它在调节基因表达中起着重要的作用[9.那10那11].不同基因的表达受多种因素的转录后调控,如rna结合蛋白(RBPs)、microrna (mirna)、剪接体[12那13那14那15].RNA结合蛋白是蛋白质,其作为许多方法的重要调节因子,例如替代剪接,mRNA核导出,mRNA稳定和翻译。RNA结合蛋白可以通过RNA识别基序(RRM)来实现这些事件,其允许将RNA结合蛋白与其靶转录物中的二级结构或特定序列结合。RNA结合蛋白在不同RNA的转录后调节中发挥枢轴作用,例如剪接,mRNA稳定性,多腺苷酸,mRNA定位[11那16那17].MicroRNA(miRNA)还参与基因表达的转录后调节。miRNA是一种内源性小非编码RNA分子,长度为约20-24个核苷酸,其在细胞中具有许多重要的调节功能。每个miRNA可以具有多种靶基因,甚至几种miRNA也可以与相同的靶基因配对[14那18].miRNA可以影响mRNA的翻译,驱动mRNA裂解或缩短聚(a)尾部[19那20.].替代剪接由缩写物介导。缩写剂是细胞核内的一种大型和复杂的分子机[21].它主要通过从转录的前mRNA中移除内含子来参与mRNA的加工[22].剪接还可以产生过早终止密码子,这些终止密码子吸收了NMD(无义介导衰变)机制[21那23].由交替剪接的mrna翻译的蛋白质会有不同的氨基酸序列。因此,蛋白质的结构和生物学功能将发生变化。转录后调控还体现在mRNA前体hnRNA的剪接和加工、mRNA的加工和定位、mRNA的稳定性及其降解、RNA的编辑等方面。
了解种子萌发调控网络可以帮助我们更好地了解种子本身的情况,提高种子的发芽率和幼苗的发育状况。本文综述了植物种子萌发与转录后基因调控的关系。它提供了一些重要的转录后调控机制的作用:rna结合蛋白,miRNA和选择性剪接。在讨论部分,我们也提出了一些关于未来研究的问题。
种子萌发和rna结合蛋白
RNA结合蛋白可以在真核细胞中与单链RNA或双链RNA结合,并在转录后调节的几乎所有方面都发挥关键作用[17那24].RNA结合蛋白的特点是存在不同的RNA结合结构域,如RNA识别基序(RRM)、k -同源结构域(KH)、锌指结构域、五萜肽重复结构域(PPR) [25那26那27].在拟南芥中,在基因组中鉴定了超过200种不同的RNA结合蛋白,其中大部分是植物特异性,表明植物生理学中的特定功能[24].rna结合蛋白与种子萌发之间的关系已经被大量的研究证实。Narsai等人(2011)对拟南芥进行了深入的转录组分析,以研究种子萌发的调控机制。超过10000个基因在冷分层过程中差异表达,揭示了种子准备发芽的活跃时期[28].其中,在转录组分析中鉴定了在转录组分析中鉴定了编码参与RNA结合函数的蛋白质,包括RNA螺旋酶,RNA结合蛋白和核糖核酸酶。进一步的分析表明,已经显示的137个含PPR结构域的基因在RNA剪接,切割,编辑,稳定性和翻译中具有在发芽期间显示瞬时表达的作用,其中75个基因显示出萌发特异性表达[28那29].此外,线粒体DNA复制因子和rna处理功能的存在,这一特定的萌发子集代表了细胞器生物发生的最早事件,在任何与能量代谢相关的变化之前。这一结果也表明,rna结合蛋白、线粒体起源和逆行信号之间的合作可能是种子成功发芽的关键[28].
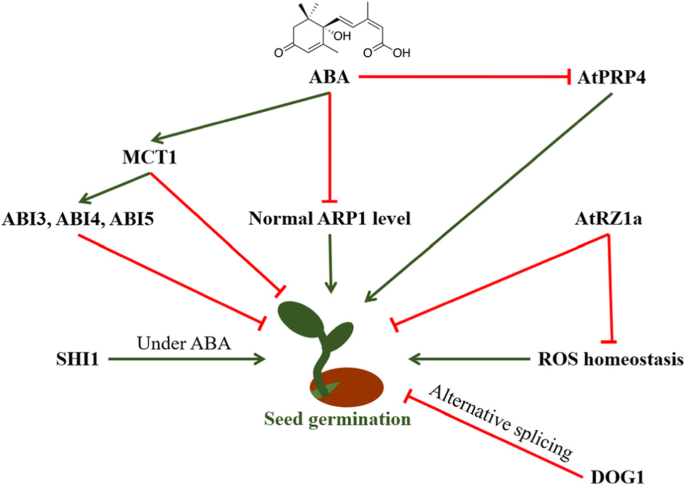
在植物中,脱落酸(ABA)是种子萌发的重要负调节剂[30.].在拟南芥中,Jung等人(2013)鉴定了一个aba调控的RRM-containing rna binding protein ARP1 (ABA-regulated RNA-binding protein 1) [31].实验表明ARP1转录由ABA抑制。有趣的是,过度表达和敲低ARP1.突变体在ABA、高盐和脱水胁迫条件下导致种子萌发延迟。相同的表型ARP1.-过表达突变体和ARP1.基因敲除突变体表明ARP1转录本是正常萌发所必需的。这一结果表明ARP1通过转录后调控aba调控的拟南芥种子萌发[31].此外,MCT1 (me2 C-TERMINAL RRM ONLY LIKE 1)是拟南芥中另一个含有ABA相关RRM的蛋白。Gu et al.(2016)的研究表明,ABA处理后MCT1的转录水平显著升高[32].进一步分析mct1过表达突变体和mct1敲低突变体表明MCT1在ABA治疗下抑制了种子萌发。而且,转录水平Abi3.那Abi4.,Abi5.,通过MCT1增加了三种与信号相关的基因增加[32].以前的研究表明Abi3.那Abi4.,Abi5.在拟南芥种子萌发中起负作用[33那34那35那36那37].这些研究表明,通过调节ABA信号传导相关基因的表达,ABA上调的MCT1在ABA下的种子萌发中发挥了负面作用。此外,非生物胁迫作为种子萌发的重要作用,它们通过ABA调节种子萌发[38那39].各种非生物胁迫相关的RNA结合蛋白在种子响应非生物胁迫过程中RNA代谢的转录后调控中发挥着重要作用。对富含甘氨酸的rna结合蛋白的研究表明,这些蛋白在非生物胁迫下的拟南芥萌发过程中发挥着重要作用[40].
甘氨酸富含蛋白2(GRP2)是富含甘氨酸的RNA结合蛋白。Fusaro等人。(2007)证明AtGRP2表达受拟南芥的寒冷调节[41].表达分析表明AtGRP2基因在分生组织中活跃。Downregulation的AtGRP2基因使用基因沉默技术导致早期开花和改变的雄蕊数,它受到种子发展[41].进一步研究表明,AtGRP2是一种核质蛋白,具有一个核酸结合的CSD结构域、两个富含甘氨酸的结构域和两个CCHC锌指结构域[42].ATRZ-1A编码含锌的富含甘氨酸的甘氨酸RNA结合蛋白,并且在盐或干旱胁迫条件下对拟南芥种子萌发产生负面影响[40].研究人员表明过度表达了atRZ-1a突变体的H2O.2水平和延迟发芽与盐或脱水条件下的野生型相比。相比之下,敲低突变体atRZ-1a在相同的压力条件下早点发芽。此外,转基因植物和突变线的发芽受到ABA的添加影响。此外,研究还表明,几种基因的转录水平,例如ISO(异柠檬酸盐酶),CRU(十字花素),SSP(12S种子贮藏蛋白),飞跃(第5组为LEA蛋白),被诱发了atRZ-1a-overexpressing突变。此外,进一步的蛋白质组分析确定了atRZ-1a的可能靶基因,包括铁氧还原酶、aconitate水合酶、甘油醛3-磷酸脱氢酶、乙醇脱氢酶、磷酸甘油酸突变酶、类囊体管腔蛋白、谷胱甘肽还原酶、谷胱甘肽s -转移酶、谷氨酸1-半醛氨基变性酶、碳酸酐酶和丝氨酸羟甲基转移酶[40].这一分析揭示了参与活性氧物种稳态(对种子萌发很重要,[43那44])在种子萌发期间受ATRZ-1A的影响(图。1)。
此外,Park等人。(2017)研究了三种锌指RNA结合蛋白(RZS)的功能作用Brassica Rapa.[45].实验表明,ABA可以刺激所有三种BRRZ蛋白的表达水平。在种子萌发期间,BrRZ3-过表达突变体在正常生长条件下表现为种子萌发和茎生长迟缓,而转录水平下降β葡糖苷酶(BGU.),GA4同源性(Ga4h.)和增加的水平飞跃和SSPABA的作用。发芽的BrRZ2 -或BrRZ3- 与脱水,盐胁迫和冷应激条件下的野生型种子相比,拟计拟计拟南芥种子延迟。重要的是,所有BRRZ都具有RNA伴侣活动[45].先前的报告还表明RNA结合蛋白与拟南芥中ABA无关的种子萌发。Shiny1(SHI1)是一种含K-同源域的RNA结合蛋白,它与CPL1相互作用以调节基因表达[46].Jiang et al.(2013)报道shi1突变体在拟南芥营养生长过程中对寒冷条件更加敏感,在种子萌发过程中对ABA不敏感[46].SHI1可以与SHI4 / CPL1互动。功能损失突变shi1和适导致了一些应激相关基因表达模式的类似变化。此外,这两个shi1和适突变体表现出更高的mRNA capping效率,并改变了一些与压力相关基因的聚腺苷酸化位点选择[46].除双子叶植物外,近年来人们对单子叶植物进行了大量的蛋白质组学研究,探讨了单子叶植物的基因表达调控、储备动员和代谢激活等方面的研究,为我们了解单子叶植物在单子叶植物中代谢调控的机制提供了新的思路。在奥雅萨苜蓿,蛋白质组学分析显示含KH结构域的蛋白质和富含甘氨酸的RNA结合蛋白对种子萌发是重要的。在种子中吸收水后,降低富含甘氨酸的RNA结合蛋白质水平似乎与种子萌发相关[47].此外,种子吸胀后,富含甘氨酸的rna结合蛋白表达下调,可能对种子萌发有促进作用。他们推测,RNA结合蛋白可能通过在种子萌发过程中形成RNA伴侣而参与RNA稳定性。此外,rna结合蛋白在保持长寿命mrna的稳定性和调节功能方面发挥着重要作用,此前的研究表明,在干水稻种子中存在17000多个存储的mrna [48].
总的来说,这些研究结果表明RNA结合蛋白在萌发过程中的细微控制但重要的作用。到目前为止,这些活动如何以协调和顺序方式调节,主要是未知数。此外,需要在将来发现和研究其他萌发相关的RNA结合蛋白。
种子萌发与miRNA
miRNA是一种小的非编码RNA分子,其参与通过mRNA切割或抑制翻译基因表达的RNA沉默和转录后调节[49那50.那51.那52.].在植物中,MiRNA参与广泛的重要种子相关过程,包括种子发育,种子休眠,种子萌发[53.].通过探索种子萌发机制,已经鉴定了各种参与植物激素信号响应,应激反应,抗氧化效应和关键转录因子调节的各种MIRNA,并且被认为在种子萌发中发挥重要作用[54.那55.].拟南芥的发芽种子中存在许多miRNA,其中一些涉及通过植物激素的萌发调节,例如脱落酸(ABA)和养肝剂。在植物中,miRNA可以与ABA,一个重要的发芽调节剂相互作用,以调节种子萌发。Reyes和Chua(2007)表明,在发芽拟南芥种子中,ABA诱导成熟miRNA159的积累Abi3.- 依赖的方式,和miRNA159介导的乳沟MYB101和myb33转录物(表1)[56.].这两种MYB转录因子均为ABA反应的正调控因子,是ABA反应的敲减突变体myb33和myb101表现出对ABA的低敏感性。此外,miRNA159过表达突变体减少myb33和MYB101使植物对ABA不敏感的转录水平。此外,miRNA159在Abi3.突变体相对于野生类型的突变体减少了2-至3倍,表明这一点Abi3.管理miRNA159表达 [56.].此外,在ABA浓度较高,萌发效率miRNA159-过表达突变体种子在相同条件下的表达量高于野生型种子。这一结果表明aba诱导的miRNA159的积累是一种稳态诱导机制myb33和MYB101转录物降解,其在种子萌发期间将种子脱敏于ABA信号传导[56.].此外,我们还研究了逆境条件下miRNA402在拟南芥中的功能作用[57.].在拟南芥中,ABA被证明通过DNA糖基糖酶调节DNA去甲基化[60.那61.].Kim等人(2010a)指出,miRNA402的靶标是一种可能参与DNA去甲基化的DNA糖基化酶demetre - like protein3 (DML3)1)[57.].的表达DEMETER-LIKE protein3mRNA表达下调miRNA402-OVEREXPRESSING转基因植物。转录水平miRNA402在萌发的种子中,脱水、冷、盐和胁迫反应标记的表达均显著增加RD29A或RD29B在这些压力下显著增加。35S::miRNA402种子DML3.在盐胁迫条件下,突变体种子比野生型种子萌发早。这一发现表明,成熟的miRNA402在胁迫条件下对拟南芥种子萌发具有正调节作用,miRNA402引导的DNA去甲基化调控是植物对胁迫条件的适应过程[57.].
除了ABA,植物蛋白还是参与种子萌发的重要激素。生长素响应因子(ARFS)是涉及疾病信号转导的转录因子[62.].通过使用DERELAGESS实验,其中将静音突变引入与miRNA160互补的ARF10序列中,Liu等人。(2007)表明,MiRNA160 ARF10的负调节在种子萌发中起重要作用[58.].转基因植株表达mirna160抗性形式的ARF10表现出发育缺陷,如卷曲的茎、锯齿状的叶子和扭曲的花。在萌发过程中,转基因突变体种子对ABA呈剂量依赖性。相反,过度表达miRNA160导致发芽期间对ABA的敏感性降低。符合这一点,Nonogaki(2008)还表明miRNA160可以通过拟南芥中的ARF16和ARF17来影响种子萌发[63.].此外,在种子萌发过程中,硫酸盐代谢相关酶的表达也受到mirna的调控。Kim等(2010b)表明转基因拟南芥miRNA395C.-过表达突变体和miRNA395e.- 抑制突变体分别对亚硝酸盐或脱水应力条件下的拟南芥的种子萌发具有阴性和正影响[64.].结果表明发芽miRNA395C.-过表达突变体与野生型相比明显发育迟缓。相比之下,种子萌发的速度就快多了miRNA395e.-过表达突变体在盐或脱水胁迫下明显加速。在种子萌发过程中进一步分析发现,ATP硫酰化酶(APS)和硫酸盐转运体SULTR2;1的mRNA裂解是由成熟miRNA395e介导的[64.].
最近,Chung等人。(2016)表明,光可以通过影响表达来调节种子萌发miRNA163[59.].在拟南芥中,miRNA163长度为24个核苷酸,它靶向s -腺苷- met依赖的羧基甲基转移酶(SAMT)样蛋白的转录本[59.].Chung等人。(2016)还表明,在光线下,原发性miRNA163水平显着增加。相反,PXMT1的转录物水平,编码甲基转移酶的miRNA163的靶标在相同的光条件下降低。此外,在种子萌发期间,MiRNA163及其靶PXMT1主要在胚根中表达,并且mirna163敲除突变体或PXMT1-过度抑制突变体显示出延迟的种子萌发与连续光下的野生型相比[59.].
各种报告还表明,MiRNA和种子萌发在其他植物中具有复杂的监管网络。黄等人。(2013)在种子成熟期间对miRNA进行了综合分析芸苔属植物显著通过使用整个种子和单独的分析[65.].他们的研究发现了500多个保守的miRNA或变异的独特序列。miRNA156家族在种子中最丰富,其次是miRNA159、miRNA172、miRNA167和miRNA158家族。功能分类显示其靶基因在RNA、DNA、蛋白质、s同化、发育、信号转导和氧化还原等通路上高度富集。详细的检测结果显示,一些mirna通过靶向同一家族中的不同基因,在同一途径中发挥作用。此外,他们还预测miRNA173、miRNA400和miRNA396“共靶”五磷酸肽(PPR)重复含蛋白,表明在种子萌发过程中rna结合蛋白和miRNA之间存在相互作用。此外,F-box家族蛋白是miRNA156、miRNA394和miRNA319的共靶蛋白。
助长响应因子(ARFS)可以由miRNA160,miRNA167,miRNA390和miRNA156协调[65.].Jian等(2016)也提出了miRNA156在种子萌发过程中的重要作用芸苔属植物显著[66.].他们构建了三个小rna库芸苔属植物显著在吸收种子期间暴露于蒸馏水,干旱和盐。结果表明,在蒸馏水下,分别发现干旱和盐条件,85,81和81名已知的miRNA。miRNA156在盐和干旱胁迫下的种子萌发的早期阶段,MiRNA156显示出最高丰度,其次是miRNA167,miRNA166和miRNA390 [66.].在干旱条件下,MiRNA156,miRNA169,miRNA860,miRNA399,miRNA171和MiRNA395显着下调,而仅仅显着上调miRNA172。相反,在盐胁迫下只有两个miRNA系列,miRNA393和miRNA399显着下调。此外,对脱水应激蛋白(ERD),应激响应性α-β筒域蛋白(SRAP)和耐盐性同源2(STH2)的早期响应响应性的家庭蛋白(DRRP)被证实为鉴定的miRNA的靶标.此外,所识别的miRNA的预测表明,各种转录因子(包括SBP,MYB,ARF,NAC,TCP,NF-YA,GRF)和代谢过程相关蛋白质(例如F箱蛋白,ATP硫核苷酸酶,CCHC型Zinc手指蛋白,NAD(P) - 桥接蛋白,ADP-核糖聚合酶)被鉴定为保守的miRNA靶标[66.].在Nelumbo Nucifera,通过使用高通量小RNA测序,Hu等。(2016)在种子萌发期间鉴定了145名已知的miRNA和78个新的miRNA。鉴定的最大miRNA系列大小是miRNA396,分别具有12和8个成员的miRNA169和miRNA393 [67.].通过使用降低测量测序,它们还检测到所有miRNA检测到2580个靶标。此外,编码MYB转录因子的miRNA159b和miRNA319c靶向mRNA。miRNA156a,miRNA160a,miRNA160a-5p和miRNA169a靶向mRNA编码许多转录因子,包括SPL17,ARF18,NAc,NF-YA10。Go(基因本体论)和拟给靶基因的Kegg途径分析表明,许多富含“转录调节”并参与“碳水化合物代谢”,“氨基酸和能量代谢”中富集的靶基因[67.].
在单子叶植物中,也有研究探讨了mirna与种子萌发的调控机制。Kang et al.(2012)通过miRNA芯片分析研究玉米种子中保守miRNA的表达,鉴定出125个已知miRNA [68.].进一步的研究表明,miRNA319对种子萌发产生了重大影响。此外,miRNA171和miRNA166还在种子萌发中发挥了重要作用。预计miRNA166预计玉米中的Bzip基因[69.],这可以调节许多过程,例如种子成熟和应力信号传递[70].预计miRNA171靶向控制甘油酸(Ga)信号传导和植物转导的GRAS转录因子在种子中的信号转导[71.].He et al.(2015)通过实验探索miRNA在吸胀后的前24小时的调控机制,这对水稻种子萌发非常重要[72.].分析鉴定了289个miRNA位点,包括59个已知miRNA和230个新miRNA。此外,在被灌吸的水稻种子中检测到17个保守家族,miRNA319、miRNA168、miRNA156、miRNA166和miRNA159在灌吸后具有较高的丰度。而miRNA164、miRNA395和miRNA393等保守mirna在水稻种子中表达较低。miRNA160、miRNA156/miRNA529、miRNA319和miRNA159分别靶向编码ARFs、SPL、TCP、MYB转录因子的mrna调控种子萌发[72.].
替代拼接
可变剪接是基因表达过程中一个精细调控的过程,它导致一个基因编码多个蛋白质。在拟南芥中研究了种子萌发与剪接的相互作用。通过对ABA调控基因表达的基因组研究,鉴定了1354个ABA响应基因和新的ABA信号成分[73.那74.].为了进一步确定编码小核核糖核蛋白颗粒(snRNP)蛋白的剪接相关基因是否受ABA的调控,Raab和Hoth(2007)利用ASRG数据库分析了编码snRNP基因的转录本丰度[75.].他们的结果表明,发现ABA依赖性抑制为25%的91个SNRNP基因,表明在ABA存在下改变剪接活性。此外,U4 / U6特异性SNRNP基因AtPRP4被ABA抑制。的淘汰赛AtPRP4显示延迟的种子萌发,表明替代剪接对于拟南芥种子萌发至关重要[75.].近年来,越来越多的研究在种子萌发期间研究了替代基因剪接。拟南芥蛋白狗(延迟发芽1)是种子休眠的重要效应。它最初通过QTL识别,Dog1基因座在其附加过程中显示出启动子和编码区域的序列变化[76.].而且,变化DOG1表达有助于种子休眠水平的变化[76.].Nakabayashi等人(2015)研究表明DOG1基因在种子休眠期间也是拼接[77.].在他们的研究中,他们指出DOG1基因产生五种转录变体编码三种蛋白质异构体。的种子dog1单基因突变DOG1变异,不积累DOG1蛋白。进一步分析表明,表达两种或两种以上的DOG1转录本变异可导致萌发延迟和DOG1蛋白积累水平高[77.].此外,DOG1蛋白可以与自身结合,不同的DOG1变体所包含的拟南芥种子表现出不同的种子休眠水平。这一发现表明,DOG1蛋白的积累需要多种亚型的存在。有趣的是,他们的研究还表明,单一异构体是功能性的,但需要额外的异构体的存在,以防止蛋白质降解[77.].
此外,张等人。(2016)进行RNA测序实验,在大麦种子萌发中对替代剪接事件进行解剖,并再次强调替代剪接种子萌发中的重要作用[78.].它们的结果鉴定在来自四个大麦品种的发芽大麦胚胎中的552和669次常见的替代剪接转录物。替代3'拼接(34-45%),内含子保留(32-34%)和替代5'剪接(16-21%)在种子萌发过程中是三个主要的替代剪接事件[78.].KEGG通路分析显示,可变剪接转录本主要定位于核糖体、RNA转运、剪接体、氧化磷酸化、mRNA监测、蛋白质合成、糖酵解、碳代谢、剪接体。他们还表明,生长素外排载体和SnRK2在萌发过程中交替剪接[78.].此外,基因表达的相关性分析表明,激素应答转录本的选择性剪接可以与蛋白质生物合成和糖代谢的基因转录本共存,揭示了选择性剪接在大麦种子萌发中的重要作用[78.].最近,Tognacca等人。(2019)进行实验,以研究替代剪接对拟南芥种子萌发期间光相关基因表达的影响。它们评估了用红光或远红光脉冲照射的分层种子的转录组变化。他们表明红光改变了20%的转录组的表达,并改变了与mRNA处理,RNA剪接和mRNA代谢过程的GO类别的强烈富集相关的226个基因的替代拼接模式[79.].此外,实验还证实了红光调控可变剪接相关因子(At-SR30、At-RS31a、At-RS31、At-U2AF65A)、光信号元件(At-PIF6)和休眠相关基因(At-DRM1)的表达。因此,基于这些结果,他们得出结论,红光触发某些剪接因子、光敏色素B、光信号成分和休眠/萌发调节因子的可变剪接变化[79.].
结论
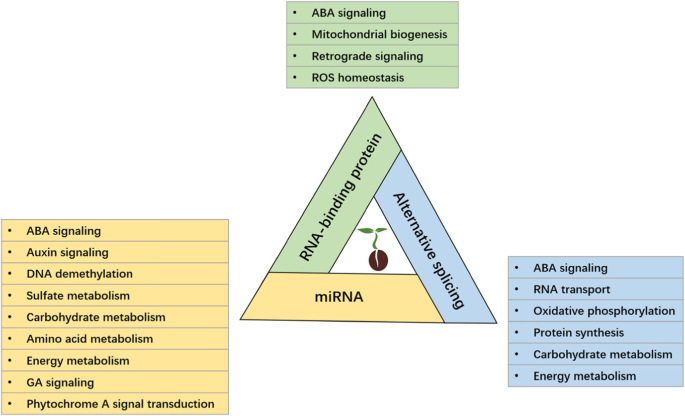
种子萌发是从种子膨胀开始的一系列有序的生理过程和形态发生过程。这也是一个涉及多级监管的复杂过程[1那4.].在植物中,转录后调节是基因表达调控的必要和重要组成部分。许多发现已经推出并表征了转录后调节的各种因素,例如RNA结合蛋白,聚(A) - 粘连蛋白(PABPS),MIRNA,LNCRNA和SNRNA [9.那80那81.那82.].考虑转录后调节和种子萌发之间的紧张和复杂的连接(图。2),发现种子萌发中转录后调控的新机制将是一项有趣的研究。一些最近开发的技术将有助于未来的研究。此外,RNA衰变还有许多方面需要深入研究,如剪接体和编辑体(一种催化RNA编辑的大型多蛋白复合物)在转录后调控中起着至关重要的作用。考虑到rna结合蛋白和mirna在植物中的大量存在,对它们在种子萌发过程中的调控机制知之甚少。最近的研究发现,信使rna稳定性和氧化参与种子萌发的规定,完成萌发和休眠的调控也取决于特定子集的信使rna的降解,表明种子萌发和转录后调控之间的紧密关系在工作(88.那89.那90.那91.].此外,翻译后调节和蛋白质改性还参与了种子萌发的调节,例如mRNA拆下,蛋白质磷酸化,蛋白质氧化[92.那93.那94.那95.].
在这里,我们讨论了植物中种子萌发和转录后调控因子之间的许多重要联系,包括rna结合蛋白、mirna和选择性剪接。这些发现将有助于我们研究新的调控机制,并填补植物种子萌发与转录后调控之间相互作用的知识空白。
综上所述,在种子萌发的相关过程中,转录后调控已经引起了人们的重视。转录后调控在萌发相关过程中的作用和机制尚需进一步研究。这些新发现也为发现植物中新的复杂的调控种子萌发网络铺平了道路,为种子生物学提供了新的研究方向,丰富了种子萌发领域。
可用性数据和材料
数据共享不适用于本文,因为在当前的研究中没有生成或分析数据集。
缩写
- rbps:
-
rna结合蛋白
- RRM:
-
RNA识别主题
- NMD:
-
胡说八道介导腐烂
- KH:
-
k-同源性
- PPR:
-
pentatricopeptide-repeat
- ARP1:
-
ABA调节的RNA结合蛋白1
- MCT1:
-
Mei2 c端RRM只像1
- GRP2:
-
甘氨酸丰富蛋白2
- ISO:
-
异柠檬酸盐酶
- CRU:
-
十字花素
- SSP:
-
12S种子贮藏蛋白
- 飞跃:
-
第5组为LEA蛋白
- 学者:
-
β葡糖苷酶
- Ga4h:
-
GA4同源性
- SHI1:
-
Shiny1.
- DML3:
-
DEMETER-LIKE protein3
- ARFS:
-
生长素反应因素
- APS:
-
ATP硫酸化酶
- DRRP:
-
干旱响应家庭蛋白质
- ERD:
-
脱水应激蛋白
- SRAP:
-
应激反应的α - β桶结构域蛋白
- STH2:
-
盐耐受homolog2
- DOG1:
-
发芽延迟1
参考文献
- 1.
韩琛,杨平。种子萌发的分子机制研究。蛋白质组学,2015;15(10):1671 - 9。https://doi.org/10.1002/PMIC.201400375.
- 2.
Steinbrecher T,Leubner-Metzger G.种子萌发的生物力学。J Exp Bot。2017; 68(4):765-83。https://doi.org/10.1093/jxb/erw428.
- 3.
nonogaki h,bassel gw,bewley jd。发芽 - 仍然是一个谜。植物SCI。2010; 179(6):574-81。https://doi.org/10.1016/j.plantsci.2010.02.010.
- 4.
王志强,王志强,王志强,等。种子萌发与活力的关系。植物学报。2012;63(1):507-33。
- 5。
种子萌发策略:一种独立于营养功能性状的进化轨迹。植物科学学报2015;6:731。
- 6。
舒科,刘旭东,谢强,何振华。一粒种子的两面:休眠和萌发的激素调节。摩尔。2016;9(1):34-45。https://doi.org/10.1016/j.molp.2015.08.010.
- 7。
Penfield S.种子休眠和发芽。Curr Biol。2017; 27(17):R874-8。https://doi.org/10.1016/j.cub.2017.05.050.
- 8。
ChmielowskabąkkJ,Arasimowiczjelonek M,Deckert J.寻找植物中的mRNA改装景观。BMC植物BIOL。2019; 19(1)。
- 9。
Romanowski A, Yanovsky MJ。高等植物的昼夜节律和转录后调控。植物科学学报2015;6:437。
- 10.
Szweykowska-Kulinska Z,Jarmolowski A. MicroRNA积累和功能的后转录调节:植物的新见解。莫尔植物。2018; 11(8):1006-7。https://doi.org/10.1016/j.molp.2018.06.010.
- 11.
Joshna Cr,Saha P,Atugala D,Chua G,Muench DG,Plan Puf。RNA结合蛋白:转录后基因调控的丰富多样性。植物SCI。2020:110505。
- 12.
Guerra D,Crosatti C,Khoshro Hh,Mastrangelo Am,Mica E,Mazzucotelli E.在植物中的干旱和热响应的后转录和翻译后法规:蜘蛛的机制网。前植物SCI。2015; 6:57。
- 13.
Budak H,Akpinar Ba。植物mirnas:生物生成,组织和起源。Funct综合基因组。2015; 15(5):523-31。
- 14.
Samad Af,Sajad M,Nazaruddin N,Fauzi Ia,Murad A,Zainal Z等人。MicroRNA和转录因子:植物监管网络中的关键参与者。前植物SCI。2017; 8:565。
- 15.
Budak H.Budak H.植物小非编码RNA及其在生物应激中的作用。前植物SCI。2018; 9:1038。https://doi.org/10.3389/fpls.2018.01038.
- 16。
Marondedze C,Thomas L,Serrano NL,Lilley Ks,Gehring C.拟南芥的RNA结合蛋白曲目。SCI Rep-UK。2016; 6(1):29766。https://doi.org/10.1038/srep29766.
- 17。
Hentze MW,Castello A,Schwarzl T,Preiss T.勇敢的RNA结合蛋白质。NAT Rev Mol Cell Bio。2018; 19(5):327。
- 18。
acta optica sinica, 2010, 31 (4): 561 - 566 . acta optica sinica, 2010, 31 (4): 561 - 566 . acta optica sinica, 2010, 31 (4): 561 - 566 . acta optica sinica, 2010, 31(4): 561 - 566。EMBOJ。2019; 38(13)。
- 19。
张B. microRNA:一种改善对非生物胁迫的植物耐受性的新目标。J Exp Bot。2015; 66(7):1749-61。https://doi.org/10.1093/jxb/erv013.
- 20.
刘伟伟,孟J,崔娟,栾永生。microRNA的特性和功能∗s在植物中。前植物SCI。2017; 8:2200。https://doi.org/10.3389/fpls.2017.02200.
- 21.
Wilkinson Me,Charenton C,Nagai K. RNA拼接由脾脏剪接。annu rev biochem。2020; 89(1):359-88。https://doi.org/10.1146/annurev-biochem-091719-064225..
- 22.
李勇,夏超,冯军,杨东,吴飞,曹勇,等。在拟南芥中,SKIP的SNW结构域是其整合到剪接体以及与Paf1复合物相互作用所必需的。摩尔。2016;9(7):1040 - 50。https://doi.org/10.1016/j.molp.2016.04.011.
- 23.
作者简介:kearwani AK, Lee HC, Ricca PG, Sullivan G, Faiss N, Wagner G, et al.;植物中RNA监控通路的多因素和物种特异性反馈调节的无意义介导的衰退。植物生理学杂志。2019;60(9):1986-99。https://doi.org/10.1093/pcp/pcz141.
- 24.
LorkovićZJ。植物RNA结合蛋白在发育,应激反应和基因组组织中的作用。趋势植物SCI。2009; 14(4):229-36。https://doi.org/10.1016/j.tplants.2009.01.007.
- 25.
Ambrosone A,Costa A,Leone A,Grillo S.超越转录:RNA结合蛋白作为植物应对环境限制的新兴调节因素。植物SCI。2012年; 182:12-8。https://doi.org/10.1016/j.plantsci.2011.02.004.
- 26.
李志强,李志强,李志强,等。rna结合蛋白在植物生长发育和胁迫反应中的作用。摩尔细胞。2016;(3):179 - 85。https://doi.org/10.14348/molcells.2016.2359.
- 27.
王敏,Ogé L, perezgarcia MD, Hamama L, Sakr S. PUF蛋白家族:PUF RNA靶标、生物学功能和转录后调控概述。中华医学杂志。2018;19(2):410。https://doi.org/10.3390/ijms19020410.
- 28.
acta botanica sinica(云南植物研究中心),2012,29(4):558 - 558。植物杂志。2011;157(3):1342 - 62。https://doi.org/10.1104/pp.111.183129.
- 29.
Schmitz-Linnewebeber C,小I.五戊肽重复蛋白质:用于细胞器基因表达的插座。趋势植物SCI。2008; 13(12):663-70。https://doi.org/10.1016/j.tplants.2008.10.001.
- 30.
Arc E,Sechet J,Corbineau F,Rajjou L,Marion-pol A. Aba串扰,种子休眠和发芽中的乙烯和一氧化氮。前植物SCI。2013; 4:63。
- 31.
关键词:拟南芥,ABA, rna结合蛋白,种子萌发,非生物胁迫植物生理学报。2013;170(2):179-84。https://doi.org/10.1016/j.jplph.2012.09.002.
- 32.
jia L, Jung HJ, Kwak KJ, Dinh SN, Kim YO, Kang H. a RRM-containing mei2-like MCT1在ABA存在下对拟南芥种子萌发和幼苗生长起负作用。植物生理学报。2016;109:273-9。https://doi.org/10.1016/j.plaphy.2016.10.009.
- 33.
王勇,李磊,叶涛,赵松,刘智,冯玉强,等。细胞分裂素通过下调ABI5的表达来拮抗ABA对拟南芥种子萌发的抑制。植物j . 2011; 68(2): 249 - 61。https://doi.org/10.1111/j.1365-313X.2011.04683.x.
- 34.
冯公司,陈烨,王C,孔耶,吴夫,陈毅。Arabidopsis RAV1转录因子,通过SNRK2激酶磷酸化,调节表达Abi3.那Abi4.,Abi5.在种子萌发和幼苗发育初期。植物j . 2014; 80(4): 654 - 68。https://doi.org/10.1111/tpj.12670.
- 35.
Albertos P, Romero-Puertas MC, Tatematsu K, Mateos I, Sánchez-Vicente I, Nambara E, et al.;s -亚硝基化诱导ABI5降解,促进种子萌发和幼苗生长。Nat Commun。2015;6(1):1 - 10。
- 36.
黄X,张X,龚Z,杨某,施华4抑制了Artrs Type-A Arr的表达,以抑制拟南芥种子萌发。工厂J. 2017; 89(2):354-65。https://doi.org/10.1111/tpj.13389..
- 37.
黄Y,Sun M,Ye Q,Wu X,Wu W,Chen Y.脱落酸通过ABA Imsissive5介导的磷酸盐调节种子萌发。植物理性。2017; 175(4):1661-8。https://doi.org/10.1104/pp.17.00164.
- 38.
Nin S,Petrucci Wa,Del Bubba M,Ancillotti C,Giordani E.环境因素对越桔种子萌发和幼苗建立的影响(varcinium myrtillus.l .)。Sci Hortic-Amsterdam。2017; 226:241-9。
- 39.
ABA和GA水平对拟南芥种子发育和萌发的调控。植物学报2018:224-47。https://doi.org/10.1002/9781119312994.apr0283.
- 40。
在盐胁迫和干旱胁迫下,拟南芥种子萌发和幼苗生长受到一种含锌指的富含甘氨酸的rna结合蛋白atRZ-1a的影响。植物生理学报。2007;48(8):1170-81。https://doi.org/10.1093/pcp/pcm087.
- 41。
Fusaro AF, Bocca SN, Ramos RLB, Barrôco RM, Magioli C, Jorge VC,等。AtGRP2是一种冷诱导的核质rna结合蛋白,在花和种子发育中起着重要作用。足底。2007;225(6):1339 - 51。https://doi.org/10.1007/s00425-006-0444-4.
- 42。
拟南芥富含甘氨酸的rna结合蛋白AtGRP2或AtGRP7的表达提高水稻产量(奥雅萨苜蓿)在干旱胁迫条件下。植物SCI。2014; 214:106-12。https://doi.org/10.1016/j.plantsci.2013.10.006.
- 43。
白D,车治勇,姜森,朴b,李慧杰,洪H,等。拟南芥锌指结构域蛋白ARS1在ABA和氧化应激反应中对种子萌发和ROS稳态至关重要。植物科学学报2015;6:963。
- 44.
毕超,马勇,吴震,于永涛,梁松,卢凯,等。拟南芥ABI5通过激活种子萌发过程中过氧化氢酶1的转录来调控ROS稳态。acta botanica sinica(云南植物学报),2017;47(1):1 - 4。https://doi.org/10.1007/s11103-017-0603-y.
- 45.
Park Yr,Choi Mj,Park SJ,康H.三锌 - 手指RNA结合蛋白在白菜中(Brassica Rapa.)在正常和非生物胁迫条件下发挥种子萌发和植物生长的不同作用。physiol platararum。2017; 159(1):93-106。
- 46.
拟南芥RNA结合蛋白SHINY1与拟南芥c端结构域类磷酸酶1 (CPL1)相互作用抑制胁迫诱导基因表达。公共科学图书馆麝猫。2013;9(7)。
- 47.
Masaki S,Yamada T,Hirasawa T,Todaka D,Kanekatsu M. SSDNA亲和柱色谱分离后水稻干燥种子中RNA结合蛋白的蛋白质组学分析。Biotechnol Lett。2008; 30(5):955-60。https://doi.org/10.1007/S10529-007-9619-8.
- 48.
Howell KA, Narsai R, Carroll A, Ivanova A, Lohse M, Usadel B,等。水稻萌发过程中代谢和转录时间开关的定位突出了特定转录因子和RNA不稳定性在萌发过程中的作用。植物杂志。2009;149(2):961 - 80。https://doi.org/10.1104/pp.108.129874.
- 49.
李C,张B.微大研制控制植物开发。J Cell Physiol。2016; 231(2):303-13。https://doi.org/10.1002/jcp.25125.
- 50。
Bartel DP。后生动物的小分子核糖核酸。细胞。2018;173(1):20-51。https://doi.org/10.1016/j.cell.2018.03.006.
- 51。
宋X,李义,Cao X,齐Y. Micrornas及其在植物环境互动中的监管作用。Annu Rev植物Biol。2019; 70(1):489-525。https://doi.org/10.1146/annurev-arplant-050718-100334..
- 52。
Meyers BC, Axtell MJ。植物中的microrna:早期的关键发现。植物细胞。2019;31(6):1206 - 7。https://doi.org/10.1105/tpc.19.00310.
- 53.
Liu H, Yu H, Tang G, Huang T. Small but powerful: microrna在植物发育中的作用。植物学报2018;37(3):515-28。https://doi.org/10.1007/S00299-017-2246-5..
- 54.
拟南芥(Arabidopsis thaliana)和番茄(Lycopersicon esculentum)种子小rna的简单纯化和表达的高效检测。种子科学与资源学报2005;15(4):319-28。https://doi.org/10.1079/ssr2005220.
- 55.
陈志强,刘鹏飞,刘志强,等。种子微rna检测技术的研究进展。植物学。2006;84(2):189 - 98。
- 56.
Reyes JL,Chua NH。ABA诱导MIR159控制拟南芥种子萌发期间两种MYB因子的转录水平。工厂J. 2007; 49(4):592-606。https://doi.org/10.1111/j.1365-313X.2006.02980.x.
- 57.
关键词:拟南芥(Arabidopsis thaliana),胁迫条件下,MicroRNA402, de米特- like Protein3 mRNA,种子萌发植物生理学报。2010a;51(6): 1079-83。https://doi.org/10.1093/pcp/pcq072.
- 58.
刘PP,蒙哥马利TA,Fahlgren N,Kasschau Kd,Nonogaki H,Carrington JC。MicroRNA160的抑制植金响应因子10对种子萌发和发芽后阶段至关重要。工厂J. 2007; 52(1):133-46。https://doi.org/10.1111/j.1365-313x.2007.03218.x.
- 59.
郑PJ, Park BS, Wang H, Liu J, Jang IC, Chua NH。光诱导miR163靶向PXMT1转录本促进拟南芥种子萌发和主根伸长。植物杂志。2016;170(3):1772 - 82。https://doi.org/10.1104/pp.15.01188.
- 60。
朱杰克。由DNA糖基酶介导的活性DNA去甲基化。Annu Rev Genet。2009; 43(1):143-66。https://doi.org/10.1146/annurev-genet-102108-134205.
- 61。
Kim Js,Lim Jy,Shin H,Kim BG,Yoo SD,Kim Wt等。ABA诱导的NIC 3表达需要ROS1依赖性DNA去甲基化。植物理性。2019; 179(4):1810-21。https://doi.org/10.1104/pp.18.01471.
- 62。
钱德勒JW。一种悬垂响应因子。植物细胞环境。2016; 39(5):1014-28。https://doi.org/10.1111/pce.12662.
- 63。
microRNA在种子萌发和萌发后对转录因子的抑制:种子中的另一个分子抑制水平?植物学报。2008;3(1):65-7。https://doi.org/10.4161/psb.3.1.4918.
- 64。
在胁迫条件下,mirna 395c和395e的过表达对拟南芥种子萌发的影响不同。足底,2010 b, 232(6): 1447 - 54。https://doi.org/10.1007/S00425-010-1267-X..
- 65。
黄D,Koh C,Feurtado Ja,Tsang EW,Cutler AJ。MicroRNA和它们在Brassica Napus Seed成熟的推定靶标。BMC基因组学。2013; 14(1):140。https://doi.org/10.1186/1471-2164-14-140.
- 66。
建H,Wang J,Wang T,Wei L,Li J,Liu L.盐水和干旱胁迫下患者早期种子萌发中涉及油菜细胞瘤的鉴定。前植物SCI。2016; 7:658。
- 67。
胡锦涛,金俊,钱Q,黄酸,丁Y.小RNA和降解概况揭示了古代奥鲁姆Nelumifera的种子萌发中的miRNA调节。BMC基因组学。2016; 17(1):684。https://doi.org/10.1186/s12864-016-3032-4.
- 68.
康明,赵强,朱东,于军。玉米种子发育过程中microRNAs的表达特征。BMC基因组学。2012;13(1):360。https://doi.org/10.1186/1471-2164-13-360.
- 69.
张L,Chia J,Kumari S,Stein J,Liu Z,Narcean A等。玉米微小稻草基因的全基因组特征。Plos Genet。2009; 5(11):E1000716。https://doi.org/10.1371/journal.pgen.1000716.
- 70。
杨志强,王志强,王志强,等。拟南芥bZIP转录因子的克隆及表达分析[J]。植物科学进展,2002;7(3):106-11。https://doi.org/10.1016/s1360-1385(01)02223-3.
- 71。
Hirsch S,Oldroyd G. Gras-Domain转录因子调节植物开发。植物信号表现。2019; 4(8):698。https://doi.org/10.4161/psb.4.8.9176.
- 72。
何东,王强,王凯,杨平。水稻种子萌发早期胚胎microRNA表达谱的全基因组分析。《公共科学图书馆•综合》。2015;10(12)。
- 73。
Hoth S,Morgante M,Sanchez J,Hanafey Mk,Tingey SV,Chua N.在Arabidopsis拟南芥中的基因组基因表达分析揭示了ABI1-1突变体在ABI1-1突变体中的脱落酸和基因调节的新靶标。J Cell SCI。2002; 115(24):4891-900。https://doi.org/10.1242/jcs.00175..
- 74。
aba响应rna结合蛋白参与拟南芥幼苗叶绿体和stromule功能。足底。2006;224(4):900 - 14所示。https://doi.org/10.1007/S00425-006-0282-4.
- 75。
Raab S,Hoth S. ATPRP4剪接因子基因的突变抑制了拟南芥中的种子发育。植物BIOL。2007; 9(03):447-52。https://doi.org/10.1055/s-2006-924726.
- 76。
Bentsink L,Jowett J,Hanhart CJ,Koornneef M.狗克隆,一种控制拟南芥种子休眠的定量特质基因座。P Natl Acad SCI。2006; 103(45):17042-7。https://doi.org/10.1073/pnas.0607877103.
- 77.
丁俊杰,王志强,王志强。拟南芥种子休眠需要DOG1蛋白的自结合能力和可变剪接产生的多种亚型的存在。公共科学图书馆麝猫。2015;11(12)。
- 78.
张强,张旭,王胜,谭超,周刚,李超。大麦种子萌发过程中选择性剪接的参与。PloS one。2016; 11(3)。
- 79.
Tognacca Rs,Servi L,Hernando Ce,Saura-Sanchez M,Yanovsky MJ,Petrillo E等人。拟南芥籽粒萌发萌发过程中的替代剪接调节。前植物SCI。2019; 10:1076。https://doi.org/10.3389/fpls.2019.01076.
- 80。
Cuperus JT, Fahlgren N, Carrington JC。MIRNA基因的进化和功能多样化。植物细胞。2011;23(2):431 - 42。https://doi.org/10.1105/tpc.110.082784.
- 81。
Gómez G, Pallás V.类病毒:植物中lncrna调控网络的黑暗中的一束光。新植醇。2013;198(1):这个赛季。https://doi.org/10.1111/nph.12196.
- 82。
OHTANI M.SNRNA的转录调节及其对植物发育的重要性。j植物res。2017; 130(1):57-66。https://doi.org/10.1007/s10265-016-0883-3.
- 83。
人g,谢米,窦y,张某,张c,yu b.拟南芥RNA结合蛋白的miRNA丰富调节。P Natl Acad SCI。2012; 109(31):12817-21。https://doi.org/10.1073/pnas.1204915109.
- 84。
吴旭,石勇,李军,徐磊,方勇,李旭,等。rna结合蛋白MOS2在拟南芥microRNA成熟中的作用。细胞研究》2013;23(5):645 - 57。https://doi.org/10.1038/cr.2013.23.
- 85。
干旱胁迫下mirna介导的基因调控:选择性剪接影响CSD1基因表达。acta botanica sinica(云南植物学报). 2017;45(3):457 - 461。https://doi.org/10.1007/S11103-017-0642-4.
- 86。
Schöning JC, Streitner C, Meyer IM, Gao Y Y, Staiger D.通过连锁反馈环耦合选择性剪接来调节拟南芥中富含甘氨酸的rna结合蛋白。核酸学报2008;36(22):6977-87。https://doi.org/10.1093/nar/gkn847.
- 87。
Bazin J, Romero N, Rigo R, Charon C, Blein T, Ariel F,等。核斑点RNA结合蛋白重塑可变剪接和非编码拟南芥转录组调控生长素和免疫反应之间的交叉对话。植物学报。2018;9:1209。https://doi.org/10.3389/fpls.2018.01209.
- 88。
Basbouss-Serhal I,Pateyron S,Cochet F,Leymarie J,Bailly C. 5'至3'mRNA衰减有助于通过休眠调节拟南芥种子萌发。植物理性。2017; 173(3):1709-23。https://doi.org/10.1104/pp.16.01933.
- 89。
黄志强,王志强,王志强,等。蛋白质和mRNA氧化在种子休眠和萌发中的作用。植物学报2013;4:77。
- 90。
Gao F, Rampitsch C, Chitnis VR, Humphreys GD, Jordan MC, Ayele BT. Integrated analysis of seed protein ome and mRNA oxidation reveals distinct转录后特征调节小麦休眠(Triticum Aestivum.l .)。植物Biotechnol J. 2013; 11(8):921-32。https://doi.org/10.1111/pbi.12083.
- 91。
Bazin J,Langlade N,Vincourt P,Arribat S,Balzergue S,El-Maarouf-Bouteau H,等。靶向mRNA氧化在干燥后熟发期间调节向日葵种子休眠缓解。植物细胞。2011; 23(6):2196-208。https://doi.org/10.1105/TPC.111.086694.
- 92。
王志强,王志强,王志强,等。拟南芥种子和种子萌发过程中蛋白质氧化的研究进展。植物杂志。2005;138(2):790 - 802。https://doi.org/10.1104/pp.105.062778.
- 93。
王志强,王志强,王志强,等。植物种子转录调控的研究进展。植物学报,2019;24(6):487-95。https://doi.org/10.1016/j.tplants.2019.03.011.
- 94。
等。通过蛋白质翻译后修饰和蛋白质组多样性重新启动系统:休眠种子如何重新启动其代谢以准备幼苗建立。蛋白质组学。2011;11(9):1606 - 18。https://doi.org/10.1002/PMIC.201000641.
- 95。
尹晓霞,王旭东,小松。磷蛋白质组学:蛋白质磷酸化对种子萌发和植物生长的调控。Curr Protein Pept Sc. 2018;19(4): 401-12。
确认
不适用。
资金
青岛农业大学人才引进专项基金资助项目(no . 663/1120070);泰山学者资助项目(no . tsqn201909134)。资助方没有参与实验设计、数据收集和分析或手稿的撰写。
作者信息
从属关系
贡献
所有作者都明显促成了这份研究论文。M.W.监督这项工作。M.W,F.J.和X.X.写了手稿。S.D.,M.X.,A.W.,J.C.为稿件和miRNA部分的组织做出了贡献。M.W.,H.X.,X.Z.,Q.J.,Y.Z.促成了背景部分,结论部分并有助于修改稿件。所有作者都读过并批准了稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
薛,X.,焦,F.,徐,H.等等。rna结合蛋白、microRNA和选择性剪接在种子萌发中的作用:有待发现的领域。BMC植物杂志21,194(2021)。https://doi.org/10.1186/s12870-021-02966-y.
收到了:
公认:
发表:
关键词
- 种子发芽
- rna结合蛋白
- microRNA.
- 替代拼接