摘要
背景
脂质代谢涉及的分子机制的调查对红花的基因工程发挥着关键作用(Carthamus Tinctorius.L.),以增加油累加级或改变油组合物。虽然转录序列是目前可用于叶子和红花的花,在种子发育的不同阶段的时间成绩单广泛的扫描尚未对红花进行。
结果
在本研究中,我们分别在开花后10、14、18和22天进行了转录组测序,以揭示不饱和脂肪酸(USFAs)生物合成的相关分子网络。结果表明,脂肪酸的生物合成是10 ~ 14 DAF的主要细胞过程,降解主要发生在18 DAF之后。硬脂酰-[酰基载体蛋白]9-去饱和酶基因(悲伤的)和油酸去饱和酶(FAD2-1),在转录组水平上检测,并通过实时荧光定量PCR实验验证转录组分析所揭示的时间表达模式。此外,13个候选转录因子(TFs)参与调控该基因的表达水平FAD2-1基因被确定。
结论
这些结果在种子的不同发育阶段的脂肪酸生物合成和基因表达之间产生了联系,提供了对潜在的脂质代谢的洞察力,同时为红花品种的基因工程奠定了重要基础。我们已经确定了新的候选基因,包括TFS,值得进一步的探索。
背景
红花(Carthamus Tinctorius.L.)是一种多用途植物具有优异的药用和油值。众所周知的是红花,是中国传统医药(TCM)[使用1].此外,红花也是多个国家种植的重要油类作物[2那3.那4.那5.].红花种子具有高含量的亚油酸(La)的多不饱和脂肪酸(PUFA)。亚油酸对各种病症进行保护,例如心血管和自身免疫疾病。它也被用作生物合成的植物合成,前列腺酸,前列腺素,白葫芦血栓素,具有广泛的药用和营养价值[6.那7.].
多不饱和脂肪酸是重要的营养物质,人体不能合成[8.].目前,提高红花种子的营养质量是油利用红花育种的重要目标。提高效率和RNA测序成本(RNA-SEQ)的成本彻底调查了代谢物机制可能。在亚麻籽[9.)、花生(10),橄榄11], 油棕 [12]和大豆[13[差异表达基因的分析和参与一些代谢物变异的关键基因已经使用De Novo转录组测序鉴定。对于红花,迄今为止,完整的基因组信息不可用,大多数红花研究人员都集中了对花的分子机制的研究[14和不同的组织[15,包括花、叶和根参与黄酮类化合物的生物合成。虽然上述数据集中存在大量可以利用的目标基因信息,但仍缺乏对红花种子动态发育进程的系统转录组分析。因此,为了进一步研究多不饱和脂肪酸生物合成的分子机制,有必要探索红花种子全基因表达水平的RNA转录本的表达。
本研究通过Illumina测序技术对红花种子发育过程中的脂肪酸组成和脂肪酸积累的几个关键阶段进行了筛选,并将其用于转录组分析。从红花种子4个发育阶段的12个转录组中共获得29699个(长度> 500 bp)和15817个(长度> 1000 bp) ungenes。转录组数据和基因表达谱的组装和注释将为研究PUFA和TAG的生物合成途径奠定重要的基础。这也为利用基因工程技术提高作物中LA含量提供了新的认识。
结果
种子发展不同阶段的脂质积累
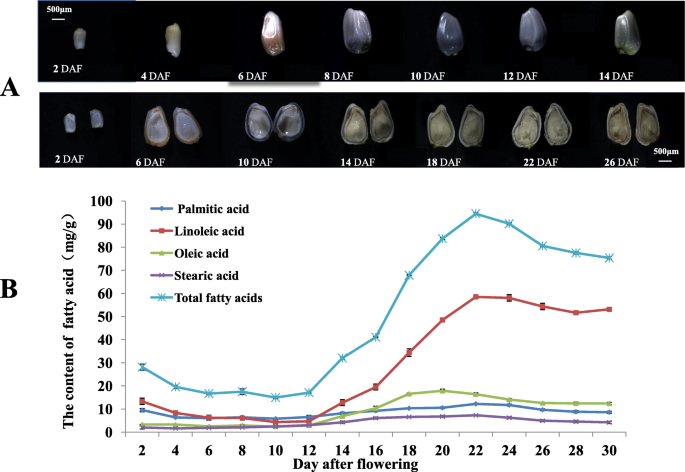
来自不同发育阶段的红花种子在-80℃下迅速冷冻。通过气相色谱 - 质谱(GC-MS)在十五种不同的发育阶段分析脂肪酸组成和含量,参见Li等人的方法。和guan等[16那17[图1中所示。1,有四个主要部件,特别是,亚油酸(LA:C18:2Δ9c,12C)油酸(OA:C18:1Δ9c),棕榈酸(PA:C16:0)和硬脂酸(SA:C18:0)。的亚麻酸(ALA:C18:3Δ9 c, 12 c, 15 c)仅在种子发育过程中检测到2 ~ 10个DAF,其含量极低,因此被忽略。主要脂肪酸在种子发育过程中不断积累,直至种子成熟,脂肪酸含量不断变化。
种子发育过程可划分为三个阶段。在初始阶段(2 ~ 10 DAF),种子逐渐膨大,脂肪酸含量较低;10 DAF后出现了脂肪酸快速积累期(10 ~ 22 DAF),并伴有脱水现象。随着种子的成熟,脂肪酸含量逐渐下降(22 ~ 30 DAF)。红花种子总脂肪酸在10 DAF后逐渐增加,在22 DAF时达到最大值94.474 mg/g。然后在22 DAF后至成熟时略有下降。不饱和脂肪酸(LA和OA)主要在10-22 DAF时增加。1b).此外,在种子成熟时观察到LA水平非常高,如图所示。1湾这LA content increased from 4.68 to 58.52 mg/g. However, the other major fatty acids were maintained at relatively low levels.
Illumina测序和从头组装
To investigate the molecular mechanism of the seeds development and lipids accumulation in safflower, twelve cDNA libraries including three biological repeats were constructed from four time points during the seed development depending on the fatty acid content (i.e., the initial point 10 DAF, two total fatty acid accumulation points 14 and 18 DAF, and the highest content point 22 DAF). The cDNA libraries were processed using the high-throughput sequencing platform. The data were analysed at the four time points and the correlation analysis was detected with the Pearson correlation coefficient. The correlation coefficient, ranging from 0.928 to 0.997, indicated high reproducibility between duplicate samples. As Table1显示,获得每个样品的原始和清洁读数,并选择清洁读数并提交给国家生物技术信息中心(NCBI)短读档案(登录号:SRP186527)。文库的百分比含量为47.27,47.31,47.23%(10 DAF),47.26,48.81,48.12%(14个DAF),50.44,49.90,50.76%(18个DAF),50.50,49.60和50.67%(22 DAF)分别(表1).
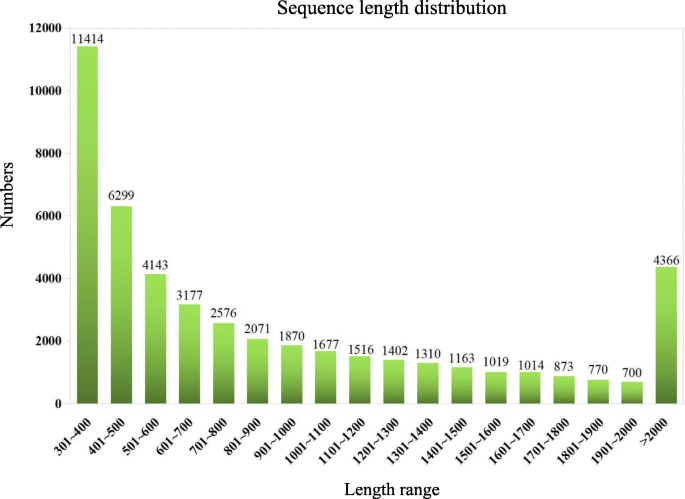
三位一体用于组装这些转录组数据而不参考基因组序列[18那19].只的E值与覆盖读取小于1e-10下高于80%被选择并用于随后的分析。In total, 47,360 non-redundant unigenes with a mean length of 948 bp ranging from 301 to 11,431 bp were obtained, and the size distribution of the unigenes revealed that 15,817 unigenes (33.40%) were longer than 1000 bp (Fig.2).
基因功能注释
对于47360非冗余个Unigenes,可能的编码序列(CDS)和它们的衍生的氨基酸序列进行了注释。进行BLAST搜索(E-值≤10−5)比对NCBI非冗余蛋白序列(NR)、京都基因与基因组百科全书(KEGG)和基因本体(GO)等公共数据库[20.].结果表明,红花unigenes在NR数据库、Swiss-Prot数据库、KOG数据库、KEGG数据库、GO数据库和Pfam数据库中与序列一致的分别为33,751(70.00%)、25,464(53.77%)、12,735(26.89%)、19,246(40.64%)、30,634(64.68%)、22,689(47.91%)和99(0.21%)。与各基因匹配最优的物种为68.55%Cynara cardunculusvar。scolymuS,3.37%与智人,2.1%与Daucus Carota subsp。缎点, 2.08%葡萄L.(附加文件1:图S1),这些结果与近期红花花转录组分析的报道一致[14那15那21].
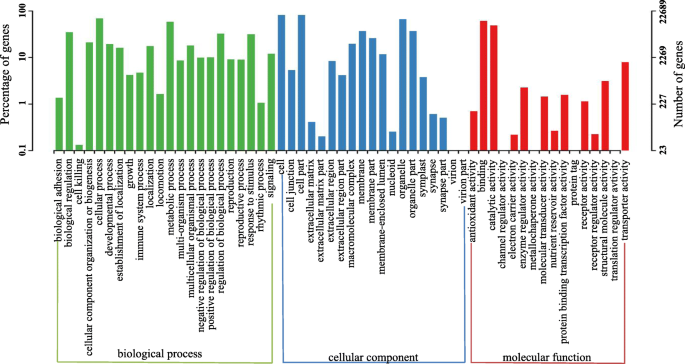
基因本体(GO)的任务中使用到的功能个Unigenes排序。细胞组分包括类的个Unigenes最大数量(20038),其次是分子功能(19321),然后生物过程(19081)。内细胞成分类别,“细胞”,“细胞部分”和“细胞器”是最丰富,并参与蛋白质的“细胞过程,代谢过程”和“生物调控”的生物过程类别富集。对于分子功能,“结合”和“催化活性”占据了大部分的个Unigenes(图3.).
为了进一步评价功能注释的有效性,我们使用KOG分类来选择之前注释过的unigenes。在47360个序列中,总共有19246个序列有KOG分类(附加文件1:图S2),共分为25个KOG类。聚类“仅一般功能预测”显示最大组(4218;21.92%),其次是“信号转导机制”(2149;11.17%)和“翻译后修饰、蛋白质转换和伴侣”(2093;10.87%),而“细胞运动性”类别(17;0.08%)为最小组,证实红花种子发育与复杂的分子调控过程有关。
《京都基因和基因组百科全书》被认为提供了一个全面分析基因表达产物网络的基因功能的平台[22].其中47360注解个Unigenes,11,632被分配到24种KEGG途径识别发挥作用的生物学途径。五大类中的24个通道启动,这三个典型的途径是“信号转导”有1524个会员,“翻译”与1093组的成员,而“糖代谢” 979名成员。此外,15929个Unigenes与注释可分为215种KEGG途径。关于“核糖体”基因是最丰富的(403),其次是“碳代谢”(367)和“蛋白加工的内质网”(356)(附加文件1:表S1)。
特别值得一提的是,563个unigenes属于脂类代谢范畴,可能在脂肪酸的生物合成和代谢中发挥重要作用。在563个ungene中,有51个和55个ungene分别属于“FAs生物合成”和“USFAs生物合成”子途径,这些子途径更有可能参与红花种子的脂类生物合成。此外,还发现LA代谢(29个unigenes)、甘油脂代谢(92个unigenes)、脂肪酸延伸(52个unigenes)和甘油磷脂(145个unigenes)1:表S1)。上述脂质代谢相关基因对红花种子中USFA和TAG生物合成相关关键酶基因的鉴定具有重要意义。
研究人员发现,通过控制转基因中涉及油和淀粉生物合成的基因,切换参与淀粉和油生物合成的碳拟南芥蒂利亚纳可以提高营养组织的能量密度[23].同样,1500多个参与脂质代谢的unigenes被定位到FAs的合成和TAG的组装落花生hypogaea种子发展[1那10].对于两个食用油作物,差异显然红花之间存在落花生hypogaea它们的含油量(30%比50%,大约是干种子)和参与脂质生物合成的预测基因数量(分别为563比1500)。这一差异揭示了两种油料作物存在不同的油脂生物合成机制。在979个碳水化合物代谢unigenes中,293个和205个分别被划分为“淀粉和蔗糖代谢”和“糖酵解/糖异生”子通路。
红花种子发育过程中差异表达基因分析
差异表达的基因(DEGS)提供与种子发育过程的分子事件相关的痕迹。在不同时间点收集数据,并进行时间序列差异表达分析以探讨转录组变化的全局时间模式,注意FA生物合成和降解的动态变化。时间序列中的DEGS被定义为在任何两个时间点之间差异表达的基因。10 DAF的种子被设定为对照,9780,16,731和18,165°(P.-value< 0.05, fold change > 2)分别在14、18和22 DAF处被鉴定。以14 DAF的种子为对照;在18和22 DAF位点分别鉴定出10,894和13,629 DEG。以18 DAF的种子为对照;22 DAF共鉴定出4227个deg(附加文件)1:表S2)。在红花种子的发展过程中,分别在10 DAF和14个DAF,14个DAF和18个DAF和18个DAF中的上调unigenes,分别为503,587和1685个上调的未造林,分别为604,574和634个unigenes受到了监管的(P.值< 0.01)。
进一步分析可识别在红花种子发育过程中与生物合成和积累脂质的脂质相关的分析。具有GO注释的DEGS进一步分为几个子集,以分析基因的潜在功能,其三个对比组的转录水平具有显着表达水平的变化。根据类别,三个比较组显示了类似的模式(附加文件1:图S3)。
然后进行KEGG功能性富集分析以揭示其生物学功能。在对比度组中,10 DAF与14 DAF,不同的unigenes主要富含核糖体(137 unigenes),植物激素信号转导(106),淀粉和蔗糖代谢(95),碳代谢(79)和氨基酸的生物合成(74)。在对比度组14DAF与18dAF中,最代表性的KEGG途径是核糖体(202),碳代谢(105),氨基酸的生物合成,植物激素信号转导(94)和淀粉和蔗糖代谢(85)。在对比度组中,18 DAF与22 DAF,最代表的KEGG途径是PI3K-AKT信号通路(39),吞噬蛋白酶(38),氨基酸的生物合成,局部粘附(31)和淀粉和蔗糖代谢(30)(附加文件1:表S3)。以上分析显示,核糖体,氨基酸的生物合成,淀粉和蔗糖代谢和碳代谢活性从10个DAF到18个DAF的红花种子发育的增强。在对比度组18中,DAF与22 DAF,富含核糖体的不同unigenes的数量,氨基酸生物合成和碳代谢途径显着低于其他对比度。
结果表明,在10 ~ 18 DAF范围内,红花种子的生命活动旺盛,18 DAF后逐渐进入休眠期。此外,有必要提及在种子油生物合成途径中的unigenes。脂肪酸代谢活性主要在10 DAF至18 DAF时增强,不同基因的数量在18 DAF组比22 DAF组减少。在LA代谢中,对比组中出现的不同ungenes数量最多,为14 DAF vs. 18 DAF(附加文件)1:表S4)。这些结果与红花种子总脂肪酸和LA含量从14 DAF急剧增加到18 DAF的结果一致。这些分析为LA生物合成相关候选基因的鉴定奠定了重要的基础。
脂质代谢涉及的DEGS分析
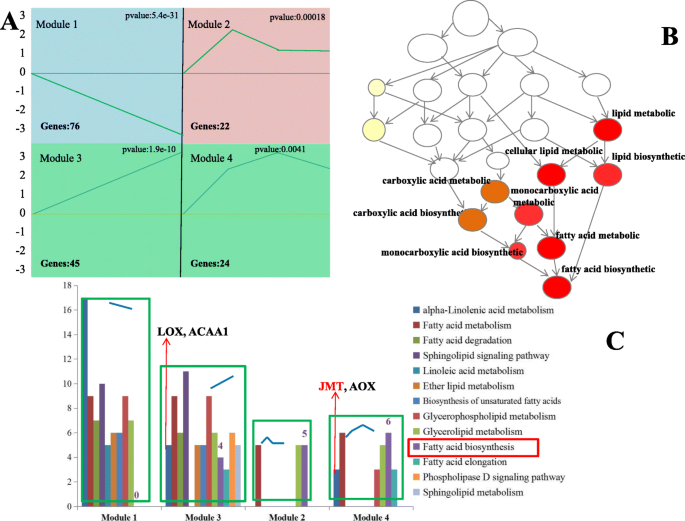
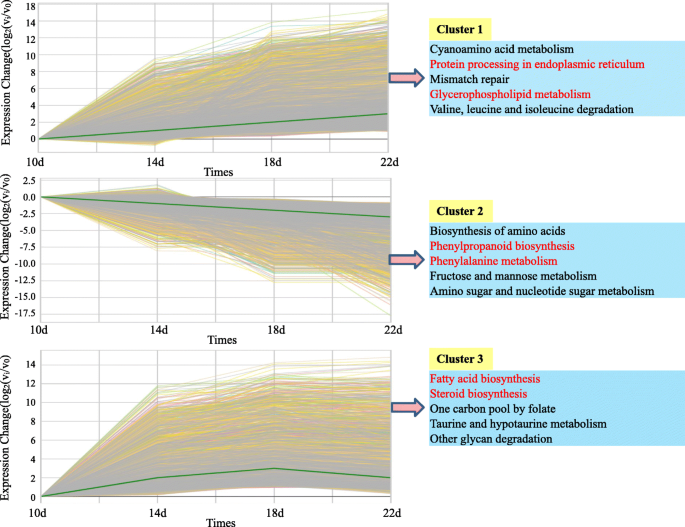
使用GCBI选择并分析与脂质代谢相关的所有曲面(https://www.gcbi.com.cn)在线软件。找到4个有意义的模块,命名为模块1 (down-down-down)、模块2 (up-up-up)、模块3 (up-down-no change)和模块4 (up-up-down)。4.),分别。基因本体富集分析显示,模块4中与脂肪酸/脂质代谢相关的显著富集量最大(图4)。4.b)。数字4.C显示了Kegg途径分析的结果;模块3包含最多的途径浓缩数量(12/13),而模块2中存在最少数量的途径浓缩(3/13)。除模块1外,脂肪酸生物合成途径是否存在于所有模块中,表明大多数基因与Fas生物合成过程有关,从10个DAF上调节到14个DAF。
在整个红花种子发育进展过程中,ALA含量极低,并在10个DAF后消失。我们观察到与α-亚麻酸代谢相关的17个基因存在于模块1中,而在模块3和4中仅存在5和4个基因。模块3和模块4中的表达模式,脂氧合酶(LOX),乙酰-COA酰基转移酶1(ACAA1),茉莉醇酸O-甲基转移酶(JMT)和对称氧合合酶(AX)从10个DAF上调至18个DAF。这些结果表明在10个DAF之前合成的α-亚麻酸的少量α-亚麻酸可能主要用作茉莉酸甲酯(MEJA)生物合成的前体物质,而不是用于其他代谢过程,并且α-亚麻酸含量可能具有在胚胎开始在10个DAF之前,母体组织提供。总之,我们的详细结果为鉴定脂质代谢相关的关键基因提供了有用的见解。
红豆种子中与Fas相关的基因鉴定和标记生物合成
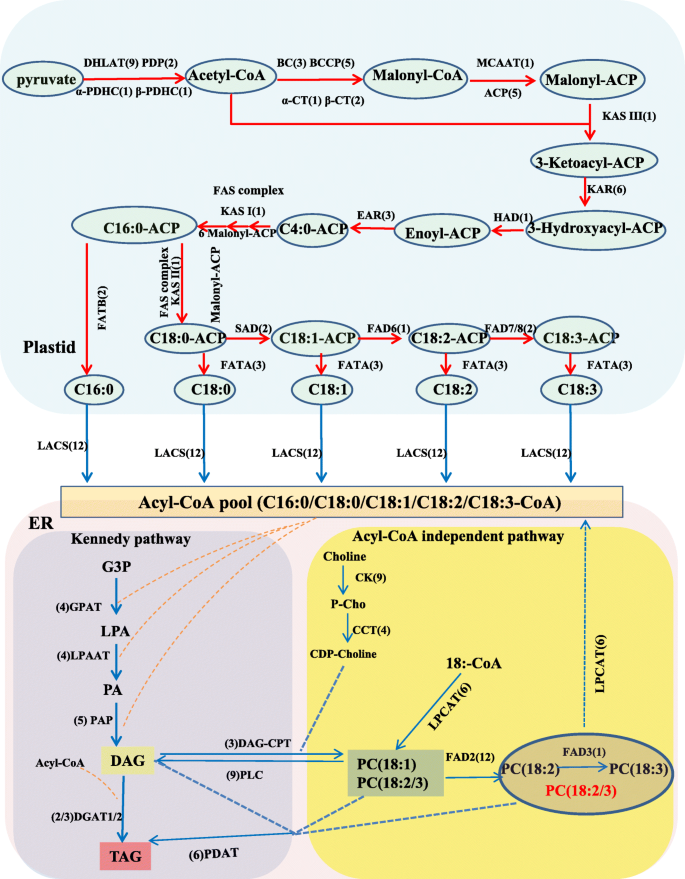
基于之前涉及FAs和TAGs生物合成途径的研究,大多数参与脂类生物合成的酶已经被鉴定[8.那10].发现与FAS和标签生物合成相关的二百五十五五个未成熟(附加文件2:表S5)。通过基于途径的分析阐明了基因的生物学功能。我们发现80个基因参与De Novo FA生物合成的启动和酰基链伸长步骤(附加文件2:表S5)。这些基因具有一种或多种同种型,它们的表达水平在10个DAF或14个DAF中较高,并且在18个DAF或22个DAF下较低,表明它们主要负责在早期红花种子发育阶段的FA生物合成的开始(附加文件1:图。S4)。第一反应由乙酰-CoA羧化酶(Accase)催化,产生丙二酰基。Accase是一种控制脂肪酸合成速率的速率限制酶;随后,通过Fas合成酶衍生出具有生长酰基-ACP链的丙二酰基-ACP的反复缩合,连续加入两种碳单元,直至形成16:0-ACP。新合成的FAS主要出口到ER作为酰基 - COA,并加入油籽中的甘油脂合成途径[24(图。5.).
红花种子中脂肪酸和甘油三酯的新生生物合成途径。注:红色和蓝色箭头分别代表质体和内质网中的生物合成途径。脂质底物简称:C16:0,软脂酸;C18:0,硬脂酸;C18:1油酸;C18:2,亚油酸;C18:3,亚麻酸。酶/蛋白缩写为:DHLAT、二氢脂酰胺乙酰转移酶;丙酮酸脱氢酶亚基α-PDHC;丙酮酸脱氢酶β亚基; PDP, pyruvate dehydrogenase phosphatase; α-CT, carboxyl transferase alpha subunit; β-CT, carboxyl transferase beta subunit; BC, biotin carboxylase; BCCP, biotin carboxyl carrier protein; MCAAT, malonyl-CoA ACP transacylase; ACP, acyl carrier protein; KAS I, II, III, ketoacyl-ACP synthase I, II, III; KAR, ketoacyl-ACP reductase; HAD, hydroxyacyl-ACP dehydrase; EAR, enoyl-ACP reductase; SAD, stearoyl-ACP desaturase; FAD6, oleate desaturase (chloroplast); FAD7/8, linoleate desaturase (chloroplast); FAD2, oleate desaturase; FAD3, linoleate desaturase; FATA/B, acyl-ACP thioesterase A/B; LACS, Long-Chain Acyl-CoA Synthetase; GPAT, glycerol-3-phosphate acyltransferase; LPAAT, 1-acylglycerol-3-phosphate acyltransferase; PAP, phosphatidic acid phosphatase; DGAT1/2, acyl-CoA: diacylglycerolacyltransferase 1/2; PLC, phospholipase C; CK, choline kinase; CCT, choline-phosphate cytidylyltransferase; LPCAT, lysophosphatidylcholine acyltransferase/lyso-PAF acetyltransferase; PDAT, phospholipid:diacylglycerolacyltransferase; DAG-CPT, diacylglycerol cholinephosphotransferase
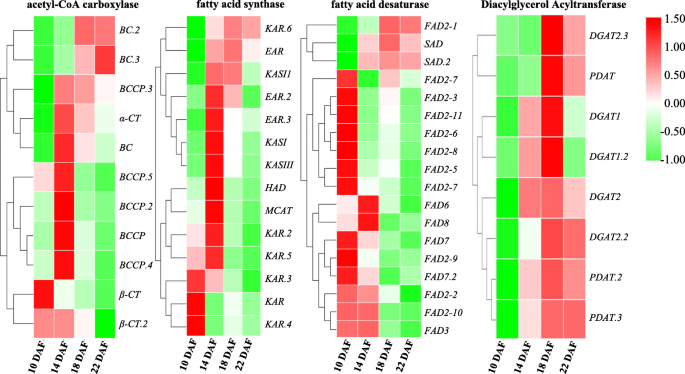
编码Accase和Fas的基因在14个DAF时具有最高的表达水平(图。6.),提示10 ~ 14 DAF期间质体中FAs的从头合成活跃,许多乙酰coa产物(16-C或18-C)被出口到内质网(ER)进行TAG组装。此外,鉴定出12个编码长链酰基辅酶a合成酶(LACS)的ungene,其中7个在10 DAF时表达量高后下降,5个在14 DAF时表达量最大。不同的表达方式lacs.unigenes可能表明不同的基材被催化lacs.基因家族,并确定ER酰基-CoA池的组合物(附加文件2:表S5)。
红花种子不同发育阶段FAs生物合成相关关键酶基因的热图分析注:简略的脂质底物与图中相同。5..不同的颜色代表不同的标准化FPKM值
三酰甘油是植物贮藏脂质的主要成分,可通过肯尼迪途径合成[25].我们鉴定了红花种子中涉及Kennedy途径和酰基编辑/替代标签合成过程的57个unigenes(附加文件)2:表S5)。三酰基甘油也可以主要通过两种不同的酰基-CoA独立途径在植物中合成,两者都存在于红甘油种子中,由二酰甘油转甲酶(DGAT)和磷脂催化:在酰基-CoA独立途径的最后步骤期间二酰甘油酰基转移酶(PDAT)。几种DGAT和PDAT同种型在18个DAF中表达高度表达,揭示了在此期间有效合成标签,并且部分PDAT基因具有更高的表达水平,表明该途径在红花种子发育进展中也可能是重要的(图。5.和6.).此外,还鉴定了42个编码磷脂酶的ungenes(附加文件)2:表S5)。一些报告表明,脂肪酶可能在蓖麻子合成后参加标签的重塑[26那27].共有4种编码三酰基甘油脂肪酶的4个unigenes,并进一步研究这些基因在红花种子发育中的功能。这些鉴定的基因将提供重要的线索,以澄清红花种子油积聚的分子机制。
研究人员此前发现,质体中形成的大多数FAs在去饱和后可用于TAGs生物合成[8.].脂肪的过程中酸去饱和,18个Unigenes为脂肪酸去饱和酶(FAD)在红花籽进行鉴定。在这些个Unigenes,2-硬脂酰-ACP去饱和酶(SAD)和13个油酸去饱和酶基因(11FAD2和一个FAD6)被发现。不同于其他油籽中ALA含量高的植物,只有4个编码omega-3脂肪酸去饱和酶的ungenes(1个为FAD3,两个for.FAD7一个for.FAD8)被识别(附加文件2:表S5)。值得一提的是ω-6 (FAD6)和ω-3 (FAD7)在塑体中局部化的脂肪酸脱氢酶基因在整个红花种子发育进展过程中具有极低的表达水平。这些低水平的原因可能是18:2-CoA和18:3-CoA的较低含量在10 DAF中出口到乙酰辅酶池中。
这FAD2基因(位于急诊室,除了FAD2-1)主要以10dAF表示,并在10个DAF后急剧下降(图。6.).虽然FAD2基因家族在红花中是巨大的,鉴定一些副本没有任何功能或降低油酸去饱和酶的活性[28].只有一个FAD3基因(位于ER)被鉴定为LA去饱和酶,在整个种子发育过程中其表达量极低,这可能导致在10 ~ 12 DAF检测到的LA含量低,ALA含量极低。
然而,FAD2-1基因和悲伤基因在18间DAF的表达水平最高,特别是为FAD2-1基因(附加文件2:表S5和图。6.),建议在14〜18个DAF期间,大多数18:0-ACP转化为18:1-ACP悲伤的基因在质体中,然后18:由2 - 辅酶A:1 - 辅酶A转化至18FAD2-1基因,由于转录水平极低FAD3, 18:2-CoA不能进一步转化为18:3-CoA,这可能导致LA在tag中大量积累。在我们小组之前的研究中FAD2-1被认为是控制成熟红花种子中La含量的关键基因[29那30.]和红花发育的种子的转录组库是与我们先前的研究相一致。虽然该功能FAD2-1基因已被研究,调控机制如何FAD2-1在18个DAF中尚未探讨高度表达。对LA丰富积累的分子调节机制的研究对于使用基因编辑技术有目的地改变红花油中OA和La的比例。
鉴定调节Fas和标签生物合成和胚胎形态发生的可能转录因子
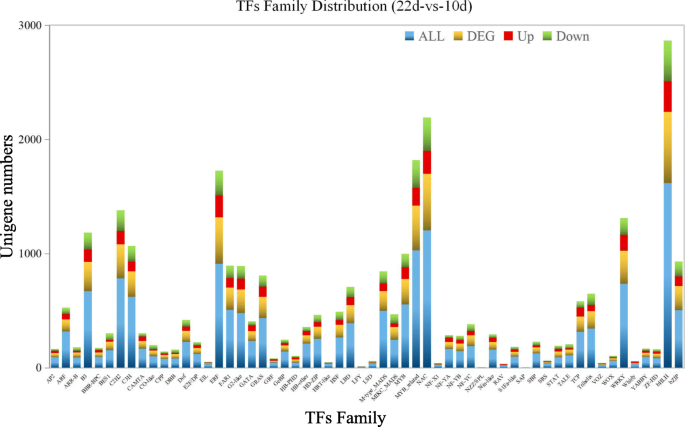
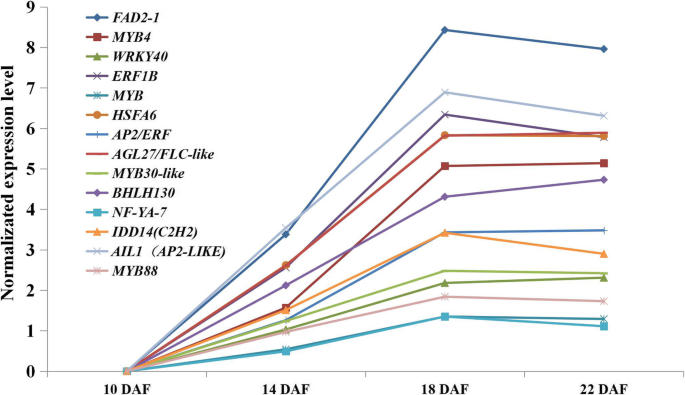
在种子发育过程中,共发现58个转录因子家族,排列前5位的转录因子家族均为转录因子家族Bhlh.那南汽那my-有关的,ERF.和C2H2.域包含家庭。上述结果可能对种子发育具有重要意义。此外,在10 ~ 22个DAF种子中鉴定出了主要的上调差异表达转录因子(log2 Fold Change> 3)。7.).通过对DEGs的KEGG富集分析,结合红花种子发育过程中从头脂肪酸和tag的生物合成途径,以及红花种子发育过程中FAs生物合成相关关键酶的表达模式分析(Figs。5.和6.)表明,脂肪酸的生物合成和糖酵解主要发生在10-14 DAF,不饱和脂肪酸的生物合成发生在14-18 DAF, 18-22 DAF期间,种子休眠是主要的细胞过程。
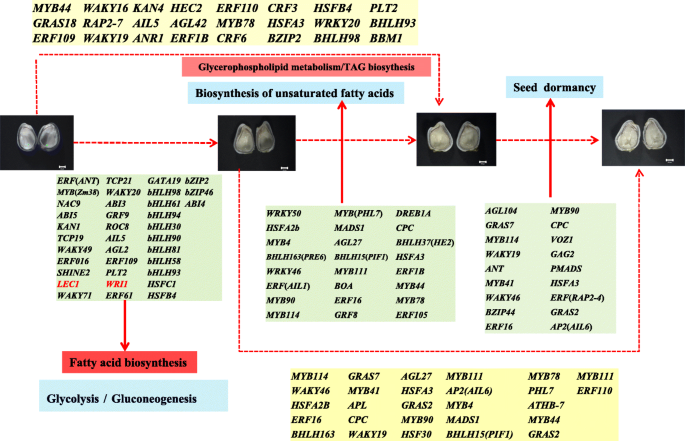
如图所示。8.,选择可能与脂肪酸生物合成和糖酵解相关的36种TFS,包括8个基本螺旋环 - 螺旋(Bhlh.)包含结构域的蛋白质AP2 /小块土地含域的蛋白质,2 HSF型蛋白,3WRKY3个ABA反应基因(ABI3那ABI4和ABI5), 和别的。这些揭示了这一点Bhlh.和AP2 /小块土地含域蛋白在种子发育中起着重要作用。我们鉴定了24个可能参与USFAs和TAGs生物合成的转录因子,包括6个my,2Bhlh.,2疯了,2HSF型转录因子和3乙烯响应转录因子,等等。my转录因子和乙烯响应转录因子可能采取的应对干旱和脱水部分,可以观察到此参与当红花的种子在10-18 DAF经历了严重脱水。此外,可能参与种子休眠18个转录因子进行鉴定。TFS中(LEC1和WRI1.),图中红色标记。8.在以前的研究报告能调节脂肪酸的合成[31那32那33].除此之外bZIP转录因子(Gmbzip123)可以通过结合到它们的启动子和增强脂质含量[促进参与蔗糖转运和细胞壁转化酶的基因的表达34].Atbzip67可以通过结合启动子来调节基因表达水平FAD3增加omega-3脂肪酸含量[35].的转录因子AGL1.(MADS-box family)能促进体细胞胚发育,改变油脂含量[36].FAs和USFAs生物合成中涉及的转录因子的鉴定为脂肪酸生物合成提供了额外的重要线索。
相关的调节转录因子的识别FAD2-1基因表达
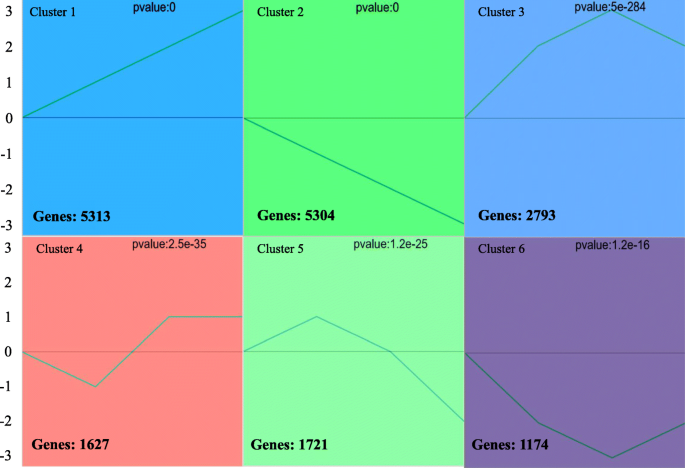
识别参与调控表达的转录因子FAD2-1基因,在从转录组数据中获得的所有unigenes中执行簇(STC)分析的串联试验。STC分析由GCBI执行(https://www.gcbi.com.cn),发现27个集群,包括6个显著集群(P.< 0.05)(图9.).发现六个集群更好地反映了DEG的表达模式。所有这些簇和相应的基因构件都在图2中示出。9..这些基因在每个簇中有相似的时间表达模式,可能参与相同的生物学过程。时间间隔分为3个阶段:10 - 14,14 - 18和18-22 DAF。在这些阶段中,有六个大类变得很明显:“向上-向上-向上”(集群1)、“向下-向下-向下”(集群2)、“向上-向下-向下”(集群3)、“向下-向上-没有变化”(集群4)、“向上-向下-向下”(集群5)和“向下-向下-向上”(集群6)(图6)。9.).GO富集分析显示,在“种子发育(27个)”和“种子油体生物发生(4个)”中,只有聚类1显著富集。进一步的KEGG富集分析表明,聚类1在“甘油磷脂代谢(18个unigenes)”中显著富集(图1)。10).
在6个显著聚类中,共识别出3个具有代表性的关键聚类。聚类1 (up-up-up)包含5313个ungenes,富集因子最高的5个聚类较小P.鉴定了Kegg浓缩分析的价值,包括“蛋白质过程”,“甘油磷脂代谢”等。相反,在簇2(下降下)(下降)中含有5304个unigenes,并且鉴定了通过Kegg浓缩分析的富集因子和较小的p值的前5个簇,包括“苯丙醇生物合成”中的蛋白质方法,“果糖和甘露糖代谢“和其他,揭示在种子发育进展过程中从糖代谢转化对脂质代谢的转化。由于簇1的类似模式,还选择了群集3(上下)以进一步分析,并且含有2793个unigenes。“脂肪酸生物合成(8 unigenes)”,“脂肪酸代谢(9 unigenes)”和“类固醇生物合成(6 unigenes)途径在该簇中显着富集(图。10).
关键酶基因FAD2-1(Trinity_DN2303030_C1_G7_I2_3)通过Blast分析鉴定了La合成,并且在簇1中发现了基因。由于簇1和簇3之间的类似表达模式,鉴定了簇1和簇3中的8106基因,并确定了201TS用于后续分析。使用SPSS统计分析软件进行Pearson相关性分析,鉴定了13个TFS,具有显着相关性(P值<0.01)FAD2-1基因(图。11),这些转录因子可能参与了表达水平的调控FAD2-1基因。在我们之前的研究中(数据未发表),1500 bp序列FAD2-1克隆基因启动子,利用PlantCARE在线软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).结果揭示了热应力响应(HSE),GCC盒,低温响应(LTR)和电子盒元件FAD2-1基因启动子(附加文件1:图S5、图S6)。另外,利用JASPER在线软件(http://jaspar.binf.ku.dk/结果表明,C2H2锌指因子(Dof-type family)、MADS-box family和ABF2 (bzip family)蛋白可能与该蛋白结合FAD2-1基因启动子和调节FAD2-1基因表达水平。
实时聚合酶链反应分析
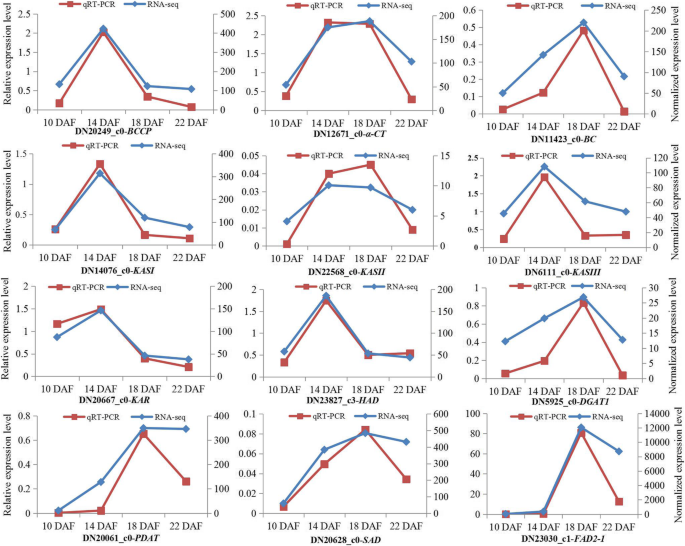
为了验证从转录数据获得的DEGS的时间表达模式,被选择用于定量RT-PCR(QRT-PCR)分析,编码3个ACCases,3-酮脂酰-ACP合酶I(KASI 12脂质代谢相关的个Unigenes),3-酮脂酰-ACP合成酶II(KASII),3-酮脂酰-ACP合酶III(KASIII),3-酮脂酰-ACP还原酶(KAR),3- hydroxyacyl- [酰基 - 载体 - 蛋白]脱水酶(HAD),二酰基甘油酰基转移酶(DGAT1),磷脂:二酰基甘油酰基转移酶(PDAT),硬脂酰 - [酰基 - 载体 - 蛋白] 9去饱和酶(SAD),和微粒体ω-6去饱和酶的FA(FAD2-1)。从在四个发育阶段的种子相同的提取的RNA样品用作对RNA测序和qRT-PCR的模板。对这些12个基因的qRT-PCR和RNA测序的结果基本类似(图12).五个ungenesBCCP.(20249),KASI(14076),KASIII(6111),冰斗(20667)和有(23827)呈上下向下的表达模式。这四个unigenesDGAT.(5925),PDAT(20061),悲伤的(20628)和FAD2-1(23030)显示了上下表达式模式。观察到所有这些12基因在22个DAF的种子中具有较低的表达水平。通常,上述结果表明,在红麻种子发育过程中,我们的转录组数据对于基因的时间表达分析是可靠的。
讨论
与其他PUFAs一起,LA在预防作用和生物活性方面发挥着广泛的作用,同时LA作为植物的储存脂和膜脂也具有重要的作用[37那38].由于LA的高价值和重要性,其利用和利用以及对油和PUFA生物合成机制的研究已被广泛报告[10那11那39那40那41那42].近年来,红花因其高品质的食油而作为一种中药和一种古老的油料作物在我国得到广泛种植。红花油是一种重要的营养补充剂,为特定人群,如断奶婴儿和孕妇。
研究脂质代谢的分子机制对红花基因工程提高其油脂积累水平或改变其油脂组成至关重要。本研究通过转录组分析揭示种子发育过程中FA生物合成的时间变化。检测了10-14、14-18和18-22三个种子发育阶段的瞬时基因表达谱。我们的结果表明,FA生物合成是一个占主导地位的细胞过程第一阶段和脂肪酸去饱和作用主要发生在第一和第二阶段(油酸减饱和主要是在第二阶段),和这些结果是按照在红花种子脂肪酸含量的变化发展。
在10-14 DAF检测到高水平的ACCase基因和脂肪酸合酶基因(FAS)转录本。ACCase能催化乙酰辅酶a转化为丙二酰辅酶a,这是引发FA生物合成的一个不可逆但重要的反应;ACCase也被认为是控制FA生物合成速率的关键酶[43].
对于脂肪酸去饱和,有两个基因表达变化显著,硬脂酰-[酰基载体蛋白]9-去饱和酶基因(悲伤的)和油酸去饱和酶基因(FAD2-1),通过转录组分析发现悲伤的和FAD2-1可能对美国脂肪酸的合成很重要。硬脂酰-[酰基载体蛋白]9-去饱和酶是将甾体- acp转化为油酸- acp的关键酶,油酸去饱和酶(FAD2-1)也是催化单不饱和脂肪酸转化为二不饱和脂肪酸的关键酶[28那44].此外,发现了ER定位的FAD3酶的一种同种型,其表达水平在10-22 DAF中极低,这是未检测到的成熟红花种子中的ALA的主要原因。对于标签组装,DGAT.基因主要在18个DAF中表达,表明标签组件的进展主要在第三阶段(18-22个DAF)。该结果进一步揭示了在红花中,在去饱和之前(第二阶段)之前,产生(第一阶段)的Fas不能立即用于标签生物合成(第三阶段)。
许多与脂质代谢有关的已知基因被鉴定为ACCase那FAS那DGAT.那lacs.和其他人。具有相似时间表达模式的基因可能在相同的细胞过程中具有相似的功能,因此,除已知基因外,1和3聚类中剩余的一些未知基因可能也参与了脂类的生物合成或调节了生物合成途径。我们的研究为进一步探索这些基因在脂肪酸生物合成过程中的潜在作用提供了重要线索。此外,还发现了许多潜在的新的候选调控因子,包括一些已知的转录因子(WRI1.那LEC1, 和ABI3)在第一阶段(10-14个DAF)中全调节(10-14 DAF)[31那32那33].在未来的研究中,除了已知的红花荧光因子外,还需要做更多的工作来扩大红花荧光因子库。上述候选TFs可能在脂质代谢(FAs生物合成、FAs代谢、FAs伸长等)中发挥重要作用。
结论
在这项研究中,为了提供对油积累的分子基础的全面见解,形态特征和FA组合物和含量,我们在发育红花种子中进行了全基因表达扫描。大多数Fas生物合成中所涉及的基因的表达水平增加显示胚性发生阶段的种子油含量早期呈正相关性。在早期种子发育过程中,细胞迅速分化和膨胀,大量合成丰富的膜脂质。涉及在早期种子发育过程中高度表达的大多数Fas生物合成的基因主要负责红花种子中膜脂质的生物合成。随后,对于参与Fas生物合成的基因,在干燥阶段出现了协调的下调,而在种子填充阶段期间激活标签生物合成的基因直至它们在种子中获得最大脂质储存。我们的研究将提供一些脂质代谢相关基因的转录型材与红花种子油的动态累积模式之间的可能相关性。同时,本研究还为进一步照明了石油积累的调控机制的关键线索。
方法
植物材料
2017年在四川农业大学农学院温江试验田(黑色壤土,9月播种,5月收获,已获得采集植株样品许可)采集红花品种川红1号种子,它已经在相同的生长条件下连续生长了五年。观察种子从开花到成熟的发育过程,每隔2 d采集种子,采集范围为28 d,检测种子含油量。收集4个发育阶段(10、14、18和22 DAF)的种子进行转录组分析,每个发育阶段进行3次生物重复。采集的种子保存在−80℃。
脂肪酸检测
对14个发育阶段(2、4、6、8、10、12、14、16、18、20、22、24、26和28个DAF)的种子进行转甲基化、提取和GC-MS检测分析。[17]
高通量测序
分别从10、14、18和22 DAF采集的红花种子中提取和纯化总RNA,并采用Huang等的方法检测RNA完整性、浓度和质量[42].使用Liu等人构建并测序cDNA文库。的方法[45].
De Novo Unigene装配和注释
Clean reads是在Linux下使用Trinity软件组装的[46].使用BLASTX比对Unigenes (E-value<1e-5)。使用ESTScan预测部分CDS序列[47].根据Li等人进行功能注释。的方法[11].
差异表达分析
在Shamir和Huang等人的情况下执行四个发育阶段的未成年人的表达分析。的方法[42那48].
基因本体和Kegg矫正富集分析
在DEGS的GO和KEGG富集分析是指执行Li等人的方法[8.].用超几何检验方法计算富集量P.-值,使用Bonferroni校正法调整p值[49].
实时荧光定量PCR分析
RNA-SEQ实验中使用的剩余的RNA样品用于根据Li等人的方法合成第一链cDNA。的方法[8.].如前所述,采用real-time PCR进行基因表达分析[50].管家基因EF1.和UBCE2被用作归一化的内源参考[51].引物3.0设计特异性引物(添加文件10)。通过观察每对引物的单解离曲线,证实了所有靶基因和内参基因的扩增特异性。目的基因与内参基因扩增效率相似的数据用于后续分析。采用ΔCt方法计算靶基因相对于内参基因的值[52].数据计算为96孔板三次重复的平均值±标准差(SD)。使用CFX Manager™v3.0对数据进行分析。
缩写
- DAF):
-
开花后几天
- 悲伤:
-
硬脂酰-酰基载体蛋白质9-desaturase
- 中医:
-
中国传统医学
- 欧米:
-
多不饱和脂肪酸
- 气相:
-
气相色谱分析-质谱法
- NCBI:
-
国家生物技术信息中心
- ORFS:
-
开放阅读框
- NR:
-
非冗余蛋白质序列
- Kog:
-
真核正式群体
- KEGG:
-
京都基因和基因组百科全书
- 去:
-
基因本体论
- 度:
-
差异表达基因
- 液态氧:
-
脂氧合酶
- ACAA1:
-
乙酰-CoA酰基转移酶
- JMT:
-
jasmonate O-methyl-transferase
- AOX:
-
氧化丙二烯合酶
- Meja:
-
甲基jasmonate
- ACCase:
-
乙酰辅酶a羧化酶
- FAS:
-
脂肪酸合酶
- ER:
-
内质网
- lacs:
-
长链酰coa合成酶
- 标签:
-
三酰基甘油
- DGAT:
-
diacylglyceroltransacylase
- PDAT:
-
磷脂:diacylgly cerolacyltransferase
- 时尚:
-
脂肪酸去饱和酶
- C16:0:
-
棕榈酸
- C18:0:
-
硬脂酸
- C18:1:
-
油酸
- C18:2:
-
亚油酸
- C18:3:
-
亚麻酸
- DHLAT:
-
二氢丙基酰胺乙酰转移酶
- α-PDHC:
-
丙酮酸脱氢酶α亚基
- β-PDHC:
-
丙酮酸脱氢酶亚基
- PDP:
-
丙酮酸脱氢酶磷酸酶
- α- ct:
-
羧基转移酶Alpha亚基
- β-CT:
-
羧基转移酶亚基
- 公元前:
-
生物素羧化酶
- BCCP:
-
生物素羧基载体蛋白
- MCAAT:
-
malonyl-CoA ACP transacylase
- 机场核心计划:
-
酰基载体蛋白
- KAS I,II,III:
-
脂酰-ACP合成I,II,III
- 冰斗:
-
Ketoacyl-ACP还原酶
- 有:
-
羟基乙酰-ACP脱水酶
- 耳朵:
-
enoyl-ACP还原酶
- 悲伤:
-
stearoyl-ACP desaturase
- FAD6:
-
油酸desaturase(叶绿体)
- FAD7 / 8:
-
LiNoLeate去饱和酶(叶绿体)
- FAD2:
-
油酸desaturase
- FAD3:
-
亚油酸酯desaturase
- FATA / B:
-
Acyl-ACP硫酸酶A / B.
- GPAT:
-
甘油-3-磷酸酰基转移酶
- LPAAT:
-
1-酰基甘油-3-磷酸酰基转移酶
- PAP:
-
磷脂酸磷酸酯酶
- DGAT1 / 2 acyl-CoA:
-
二酰甘油乙基转移酶1/2
- PLC:
-
磷脂酶C
- CK:
-
Choline激酶
- 有条件现金转移支付:
-
choline-phosphate cytidylyltransferase
- LPCAT:
-
溶血磷脂酰胆碱酰基转移酶/ LySO-PAF乙酰转移酶
- PDAT:
-
磷脂:diacylglycerolacyltransferase
- DAG-CPT:
-
二酰基甘油cholinephosphotransferase
- STC):
-
簇串试验
- HSE:
-
热应力响应
- LTR:
-
低温响应
- TFS:
-
转录因子
- QRT-PCR:
-
定量RT-PCR
参考文献
- 1.
李DJ,周md, Ramanatha RV。红花种质资源鉴定与评价。北京:地质出版社;1993.260便士。
- 2.
李DJ。红花的研究进展(Carthamus Tinctorius.L.)中国研究与生产。在第三届国际红花会议上,北京,中国。1993.第35-46页。
- 3.
张志强,王志强,王志强,等。不同施肥条件下红花菜产量、叶绿素含量、光合速率和水分利用效率的变化[J]。工业作物产品。2008;27(1):75-85。https://doi.org/10.1016/j.indcrop.2007.07.020.
- 4.
Corleto A. Safflower:适合地中海环境的冬季油素作物[J]。Acta Hortic。2009; 806:285-92。
- 5.
Corleto A,FernándezmartínezJ,Velasco L等人。红麻农场种子产量潜力作为意大利南部替代石油作物的替代油作物[J]。芝麻红麻通讯。2005; 29(1):57-70。
- 6.
-6/ -3必需脂肪酸比例的重要性。生物医学Pharmacother。2002;56(8):365 - 79。https://doi.org/10.1016/s0753 - 3322 (02) 00253 - 6.
- 7.
饮食的进化方面,-6/ -3比例和遗传变异:慢性疾病的营养影响。生物医学Pharmacother。2006;60(9):502 - 7。https://doi.org/10.1016/j.biopha.2006.07.080.
- 8.
李少森,王林林,舒秋宇,等。正在生长的牡丹(芍药属部分牡丹DC。)种子和种子发育过程中转录组分析。BMC基因组学。2015; 16(1):208。
- 9.
Venglat P,项d,邱S,石SL,Tibiche C,克拉姆d,等。亚麻籽发展的基因表达分析。BMC植物BIOL。2011; 11(1):74。https://doi.org/10.1186/1471-2229-11-74.
- 10.
尹东,王颖,张旭,李华,陆旭,张军,等。花生从头组装(落花生hypogaeaL.)种子转录组显示出用于油累积途径的候选人未来。Plos一个。2013; 8(9):E73767。
- 11.
Munoz-Merida A, Gonzalez-Plaza JJ, Canada A, Blanco AM, Garcia-Lopez model C, Rodriguez JM, et al。橄榄的从头组装和功能注释(油橄榄)转录组。DNA Res。2013; 20(1):93-108。https://doi.org/10.1093/dnares/dss036.
- 12.
杜塞尔,Guerin C,Andersson M,Joet T,Tranbarger TJ,Pizot M等。三种油棕榈果和种子组织的比较转录体分析,油含量和脂肪酸组成不同。植物理性。2013; 162(3):1337-58。https://doi.org/10.1104/pp.113.220525.
- 13.
陈辉,王富武,董媛媛,王宁,孙艳萍,李晓燕,等。序列挖掘和转录谱研究大豆种子发育过程中与脂类生物合成相关的差异表达基因。植物学报。2012;12(1):122。https://doi.org/10.1186/1471-2229-12-122.
- 14.
黄LL,杨X,Sun P,Tong W等人。基于illumina的De novo转录组测序和红花花的分析。Plos一个。2012; 7(6):E38653。
- 15.
李H,董y,杨j,刘x,王y,姚n等。德诺人的红花转录组和对油蛋白的识别基因和黄酮类化合物的生物合成。Plos一个。2012; 7(2):E30987。https://doi.org/10.1371/journal.pone.0030987..
- 16.
李斯,元ry,陈lg,王ls,hao xh,wang lj等。60棵树牡丹种子中脂肪酸的系统定性和定量评估(芍药属部分牡丹DC。)栽培种通过GC-MS。食品化学。2015; 173:133-40。https://doi.org/10.1016/j.foodchem.2014.10.017.
- 17.
关丽丽,吴伟,郑亚玲.雅安不同红花种质种子油含量和脂肪酸组成及其与农艺性状和光合参数的相关性分析。中国农业科学。2008;91(4):383-8。
- 18.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I,等。没有参考基因组的RNA-Seq数据的全长度转录组组装。生物科技Nat》。2011;29(7):644 - 52。https://doi.org/10.1038/nbt.1883.
- 19.
Haas BJ, Papanicolaou A, Yassour M, Grabherr M, Blood PD, Bowden J,等。利用trinity平台从RNA-seq中重建从头转录本序列,进行参考文献的生成和分析。Nat Protoc。2013;8(8):1494 - 512。https://doi.org/10.1038/nprot.2013.084.
- 20.
张建军,张志强,张志强,等。gap BLAST和PSI-BLAST:新一代蛋白质数据库搜索程序。核酸学报1997;25(17):3389-402。https://doi.org/10.1093/nar/25.17.3389.
- 21.
刘晓东,姚宁,张颖,王宁,崔旭,等。对红花转录组进行从头测序和分析,以发现与红花黄色相关的推定基因Carthamus Tinctorius.L.诠释J分子科学。2015; 16(10):25657-77。https://doi.org/10.3390/ijms161025657..
- 22.
稔K,后藤S,等人。KEGG的大型分子数据集的整合与诠释。核酸RES。2012; 40(D1):109-14。
- 23.
达雷特TP,魏泽SE等。通过在转基因拟南芥中由淀粉转向碳油的生物合成增加的营养组织中的能量密度。植物生物技术J. 2011; 9(8):874-83。
- 24.
脂质生物合成。植物细胞。1995;7(7):957 - 70。https://doi.org/10.1105/tpc.7.7.957.
- 25。
肯尼迪EP。复合磷脂的生物合成。美联储PROC。1961; 20:934。
- 26。
Brown AP, Kroon JT, Swarbreck D, Febrer M, Larson TR, Graham IA,等。蓖麻组织特异性全转录组测序,旨在了解三酰基甘油脂生物合成途径。《公共科学图书馆•综合》。2012;7 (2):e30100。https://doi.org/10.1371/journal.pone.0030100.
- 27。
胡y,wu g,cay,wu y,xiao l,li x等。种子种子中转录物分析的育种反应芸苔栗鸟.中国生物医学工程学报。2009;10(1):49。https://doi.org/10.1186/1471-2199-10-49.
- 28。
Cao S,Zhou XR,Wood CC等。一个庞大而功能多样的家庭FAD2红花的基因(Carthamus Tinctorius.l .)。植物学报。2013;13(1):5。
- 29.
关LL,徐YW,王镱,陈蕾,邵JF,温度可调节的微粒油酸去饱和酶基因吴W.分离和鉴定(CtFAD2-1)从红花(Carthamus Tinctorius.l .)。植物学报2012;30(2):391-402。https://doi.org/10.1007/S11105-011-0349-7..
- 30.
李东,于俊生,王强,胡斌,陈超,侯凯,等。序列变异及表达分析FAD2不同la型红花材料之间的关系。植物学报,2019;41(8):135。https://doi.org/10.1007/s11738-019-2928-4.
- 31。
谭华,杨X,张楼,郑X,曲C,穆J,等。增强的种子油产量低芥酸菜子通过的条件表达式芸苔栗鸟在显影种子中的叶状子叶1和LEC1样。植物理性。2011; 156(3):1577-88。https://doi.org/10.1104/pp.111.175000.
- 32。
D, Mi CS。拟南芥的过度表达,WRI1.,提高种子质量和贮藏含油量亚麻荠漂白亚麻纤维卷.植物生物技术代表2015; 9(3):137-48。https://doi.org/10.1007/s11816-015-0351-x.
- 33。
刘家,华河,Zhan Gm,等。通过过表达增加转基因拟南芥中的种子质量和油含量wri1-like基因芸苔栗鸟.植物生理生化学报。2010;48(1):9-15。https://doi.org/10.1016/j.plaphy.2009.09.007.
- 34.
宋庆霞,李婷婷,刘艳芳,张凤凤,马波,张文坤,等。大豆GmbZIP123基因增强了转基因拟南芥植物的种子中的脂质含量。J Exp Bot。2013; 64(14):4329-41。https://doi.org/10.1093/jxb/ert238.
- 35.
Mendes A,Kelly Aa,Van Eh等。BZIP67通过激活脂肪酸去饱和酶调节拟南芥籽油中的-3脂肪酸含量。植物细胞。2013;25(8):3104 - 16。https://doi.org/10.1105/tpc.113.116343.
- 36.
王旭,牛庆伟,滕超,李超,穆杰,蔡宁华,等。过度的PGA37 / MYB118和MYB115促进拟南芥的营养到胚胎的转变。细胞研究》2009;19(2):224 - 35。https://doi.org/10.1038/cr.2008.276.
- 37.
植物中脂肪酸衍生的信号。植物科学进展。2012;7:217-24。
- 38.
甘油脂合成:生物化学和调节。植物生理学杂志。2012;42:456-506。
- 39.
格罗弗A,Kumari M,Singh S,Rathode SS,Gupta Sm,Pandey P等人。分析麻风树用于油增强和基因标志物的转录组。physiol mol biol植物。2014; 20(1):139-42。https://doi.org/10.1007/s12298-013-0204-4.
- 40。
Mudalkar S, Golla R, Ghatty S, Reddy AR。亚麻荠漂白亚麻纤维卷利用Illumina GAIIX测序平台进行SSR标记的鉴定。acta botanica yuni sinica(云南植物学报),2014;https://doi.org/10.1007/S11103-013-0125-1..
- 41。
万H,崔Y,丁Y,等人。转录的时间序列分析和蛋白质组学揭示分子网络在菜子油标的积累。前植物SCI。2016; 7(R106)。
- 42。
黄Ĵ,郝X,金Y,郭X,邵Q,库马尔KS等。时空的转录谱发育的种子的揭示了水黄皮相一致的基因调控积油(Millettia pinnata).BMC植物BIOL。2018; 18(1):140。https://doi.org/10.1186/s12870-018-1356-8.
- 43.
Ohlrogge JB,JG贾沃斯基。的脂肪酸合成的调节。Annu Rev植物植物植物Mol Biol。1997; 22(2):109-36。
- 44.
张颖,马克西莫娃SN,吉蒂南MJ。巧克力树硬脂酰酰基载体蛋白去饱和酶基因家族的特性Cacao L..植物学报。2015;6:239。
- 45.
刘T,张X.转录组和代谢组学分析表明监管网络和关键基因在响应蓝光控制玉米气孔发展。预印在https://doi.org/https://doi.org/10.21203/rs.3.rs-152688/v1(2021).
- 46.
郭波,陈志勇,李东东,史淑丽。干旱胁迫与农产品收获前黄曲霉毒素污染的遗传、基因组学和蛋白质组学研究。植物生态学报。2008;50(10):1281-91。https://doi.org/10.1111/j.1744-7909.2008.00739.x.
- 47.
Iseli C,Jongeneel CV,Bucher P. Esscan:用于检测,评估和重建EST序列中的潜在编码区的程序。Proc Int Conv Intel Syst Mol Biol。1999:138-48。
- 48.
Shamir R,Maron-Katz A,Tanay A,Linhart C,Steinfeld I,Sharan R等人。扩展器 - 用于微阵列数据分析的一体化计划套件。BMC生物信息学。2005; 6(1):232-44。https://doi.org/10.1186/1471-2105-6-232.
- 49。
基于KEGG Orthology (KO)的自动化基因组注释和路径识别。生物信息学。2005;21(19):3787 - 93。https://doi.org/10.1093/bioinformatics/bti430.
- 50.
埃尔南德斯ML,帕迪拉MN,拉曼恰男,马丁内斯 - 里瓦斯JM。表达分析识别FAD2-2作为橄榄油酸酯的去饱和酶基因主要负责初榨橄榄油中的亚油酸含量。JAgric Food Chem。2009; 57(14):6199-206。https://doi.org/10.1021/jf900678z.
- 51。
李丹,胡斌,王强,刘辉,潘峰,吴伟。不同实验条件下红花准确转录归一化内参基因的鉴定与评价。《公共科学图书馆•综合》。2015;10 (10):e0140218。https://doi.org/10.1371/journal.pone.0140218.
- 52。
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据-ΔΔct方法。方法。2001; 25(4):402-8。https://doi.org/10.1006/meth.2001.1262.
致谢
不适用。
资金
在这项工作中,来自中国国家自然科学基金的赠款支持研究,收集和分析(#81274020)。贵州大学人才介绍项目(2019#17)撰写了稿件。
作者信息
从属关系
贡献
DL和WW构思了这项研究。QW、XX、DL分别在不同时间点采集红花种子,测定种子形态变化,定量测定正在发育的种子中FA含量。BW准备了用于Illumina测序的rna。JSY和ZYC进行qRT-PCR实验。DL和WW分析了所有表型和分子数据。WW, DL, QW, XX起草并修改了原稿。所有作者都已阅读并批准了最终稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
没有竞争的利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1
与其他植物物种红花序列的顶部BLAST命中的物种分布。图。S2。彻底单位数群体的真核(Kog)组装的unigenes分类。图S3在种子发育的不同阶段具有显著转录变化的单基因的基因本体论分类。图S4。红花种子不同发育阶段脂肪酸合成相关基因的热图分析。图S5。上游调控序列分析CtFAD2-1。图S6。核苷酸序列和顺式作用元件ctfad2-1红花基因启动子。表S1。红花(DOCX 57 KB)中的NORDUMENS unigenes的KEGG类别。表S2。差异表达基因统计表(docx24kb)。表S3。KEGG orthology enrichment analysis of ungenes with significant transcriptional changes in different stages of seed development (docx29 kb)表S4。种子发育不同阶段在种子发育中种子油生物合成中的转录变化的甲基果实富集分析。
附加文件2
红花种子中与脂质积累相关的酶/蛋白质
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
李,D.,王,Q.,Xu,X.等等。发展种子的时间转录组谱分析显示了患有红花中的油积累的候选基因(Carthamus Tinctorius.l .)。BMC植物杂志21,181(2021)。https://doi.org/10.1186/s12870-021-02964-0
已收到:
公认:
发表:
关键词
- 转录组
- 开发红花种子
- 分子机制
- 红花