摘要
背景
MicroRNAs通过整合多种开花途径,在植物营养体相变和开花诱导中发挥着重要作用。百合×formolongi是一种重要的观赏百合品种,可以在播种后一年内花。但是,它仍然尚未解决,MiRNA介导的监管网络如何为其贡献l×formolongi营养生长期短,开花速度快。
结果
本研究构建了小RNA文库和一个degradome文库l×formolongi在营养生长和开花起始阶段,鉴定出366个保守miRNAs和32个新miRNAs。此外,84个mirna在发育过程中显著差异表达。通过降解测序,共鉴定并验证了185个miRNAs中的396个靶点。基因本体论(GO)和《京都基因和基因组百科全书》(KEGG)途径分析表明,该靶点的功能在光合生物的低温和镉离子响应、磷酸戊糖途径和碳固定方面最为丰富。此外,在23对差异表达的mirna靶对中,miR156s-LfSPL2miR172a -LfAP2和miR164a -LfNAC对以及mir159a-LfSPL2基于MiRNA文库中表达谱的相关分析,被发现与开花相关,降低组和转录组。CoExpression调节网络聚焦在差异表达对上也由WGCNA构建,并且在营养开发和开花诱导期间考虑了14名MiRNA。MiR156A / D / E与共表达网络中的其他MIRNA表示特别强烈的关系。
结论
本研究提供了进一步探索短暂营养发展和开花的监管机制的提示l×formolongi.
背景
百合(Liliaceae家族)是一个重要的属,包括作物,这些属性被赋予他们的观赏特征,食用灯泡和医疗用途。它们可以通过性或无性传播传播。通过种子繁殖性繁殖使育种者能够获得无病毒幼苗并保持丰富的遗传多样性[1].大多数百合品种和野生品种在播种后至少需要一年的营养生长才能开花[2]. 然而,l×formolongi,是一种流行的切花品种,具有营养期缩短的特点,可以在萌发后的一年内发生花的转变[3.]. 因此,分子途径的研究涉及到l×formolongi缩短营养生长期,提前花期是百合营养发育和开花开始的必要条件。
萌发后的植物生长是植物植物的植物,以实现花卉的能力,并在少年成人阶段过渡后对外部刺激作出反应,然后过渡到生殖增长[4.].这样,从营养型到生殖相和开花的过渡的最佳定时由由多种途径组成的复杂的遗传网络精确控制。在年度植物中拟南芥,昼长和温度等外部因素影响光周期和春化途径[5.]. 它们与衰老、赤霉素(GA)、海藻糖6-磷酸(T6P)以及由内源因素(包括年龄、激素和碳水化合物状态)控制的自主途径协调控制着相变和开花时间[5.那6.].目前,大量研究表明MIRNA也集成到开花途径中,其中它们执行了策划函数[7.].
成熟植物miRNAs主要通过直接切割mRNAs或抑制特定mRNAs的翻译发挥调控作用[8.那9.].在拟南芥,一些内源性保守mirna及其目标被整合到衰老途径中,影响发育阶段的变化和开花时间[10那11].miR156是该通路的协调器,通过转录分裂或靶基因的翻译抑制,在营养发育中起主要调控作用鳞状藻启动子结合蛋白样(SPL/SBP公司)基因,导致向成年阶段的过渡[12那13].相反,miR172的目标是6个APETALA 2(AP2)-喜欢在开花抑制中起作用的基因,大量的miR172随着年龄的增长而增加[14那15].在顶端,miR172作用于miR156/的下游SPL模块,SPL9和SPL15可以通过直接结合miR172前体来改变miR172的表达吗mir172b.[16]. 除了衰老途径的两个组成部分外,对突变体和转基因植物表型的研究表明,被GA途径中的DELLA蛋白抑制的miR159参与营养体相变,独立于GA,并抑制miR156的表达[17那18].茄,miR156 -SlSBPs与GA和MIR319互动披针形(拉)影响开花诱导和花转变的模块[19].此外,过表达的miR171可以激活miR156来影响大麦的营养-生殖阶段的变化[20.].
许多种特异性或不太保守的miRNAs也被鉴定并进一步证实参与植物的开花诱导。单子叶植物特异性miRNA miR528在长日照条件下促进水稻开花诱导[21].芸苔科特异miRNA miR824及其靶点AGAMOUS-LIKE16 (AGL16)通过抑制表达来调节开花时间英国《金融时报》在长日照条件下拟南芥[22].Pooideae-特异性miR5200已经被证明通过指导序列特异性的卵裂来调节光周期介导的开花过渡英国《金融时报》orthologues在Pooideae植物(23].
作为一种具有地下贮藏器官的地生植物,前人研究证实百合的花期受春化、光周期和鳞茎大小等多种因素的影响[24那25]. 然而,the molecular regulatory factors underlying the vegetative phase transition and responses to various floral induction signals in lily are still unknown. On the other hand, the lily genome is large, complex and lacks a reference genome sequence [26].尽管如此,测序技术使得产生足够的数据来识别与重要农艺性状相关的基因相对容易,并且该研究可以从计算和降低的分析中受益于迅速,准确地检测miRNA的目标[27那28].
为此,构建了15个miRNA文库和一个降解文库l×formolongi在五个关键的发展阶段。数据库结合转录组数据,进一步用于系统地鉴定和分析营养发育和开花起始过程中的mirna及其靶标。潜在的关键开花mirna -靶点对也被鉴定出来。这些结果可能有助于阐明mirna介导的短营养发育的调控机制l×formolongi加速百合花。
结果
高通量测序l×formolongi
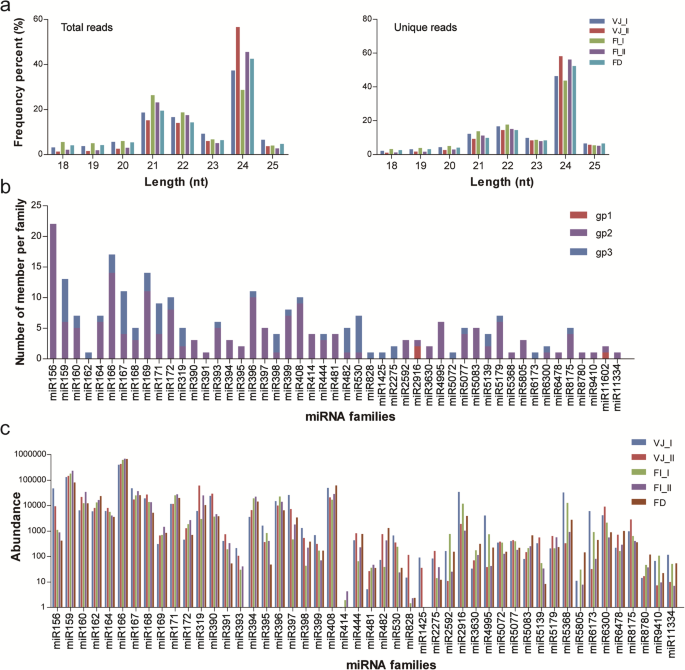
目的探讨miRNA在肿瘤治疗中的应用l×formolongi开发,15个小RNA文库被构建和测序,在五个发育阶段收集的叶子和茎分销组织(VJ_I,VJ_II,FI_I,FI_II和FD)(附加文件)1,图。S1,S2)。总共有87,720,826个原始读取来自这些sRNA文库(表1).在去除垃圾序列、低质量reads和非编码rna后,分别从VJ_I、VJ_II、FI_I、FI_II和FD库中获得了约990万条、1080万条、1470万条、1990万条和560万条与miRBase 22.0中存储的前体完全匹配的有效reads。这些mirna显示出独特的大小分布。长度分布为60,351,351个原始reads和14,126,406个唯一reads集中在21-24 nt范围。这些库中最频繁的有效读取长度为24 nt,其次是总读取的21 nt和唯一读取的22 nt。1一个)。
鉴定保守的miRNAl×formolongi
所有文库的有效读写都与miRBase 22.1中的前体和miRBase的转录组进行了对应l×formolongi鉴定保守的miRNAs。共发现了345个保守的miRNA前体和366个独特的miRNA,它们属于116个miRNA家族,并且这些miRNA中的大多数都获得了转录组定位(图。1b,额外的文件2:表S1)。此外,我们还统计了不同miRNA家族间同源基因的数量。miR156家族是最大的家族,有22名成员,其次是miR166和miR169家族,分别有17名和14名成员。然而,miR162、miR391、miR828和miR5072各只由一个成员代表。此外,两个miR2916成员,一个miR5523成员和一个miR11602成员被确定为已知的miRNAs(组1),其读体和前体可以完全映射到报告的百合miRNAS / miRNAS在miRBase和转录组中的序列。
对百合发育过程中这些保守mirna的相对丰度进行了表征。如图所示。1c,这些mirna表现出显著不同的丰度水平。miR166家族的mirna读数最高,其次是miR159和miR408家族。
中新型miRNAs的鉴定L..×formolongi
被映射到转录组的未经发布的读取L..×formolongi根据前驱体发夹结构的标准筛选新的miRNA预测。总的来说,在所有的miRNA库中发现了32个新的miRNA(附加文件2:表S2)。这些成熟的新miRNAs和新pre-miRNAs的发夹长度分别在19 ~ 25 nt和55 ~ 191 nt之间。在这些时间间隔中,大部分mirna的长度分别为21 nt和164 nt。维持稳定的发夹结构所需的这些二级结构的自由能范围为−125.5 ~−20.9 kCal/ mol3.:图S3。
发育过程中差异表达的mirna
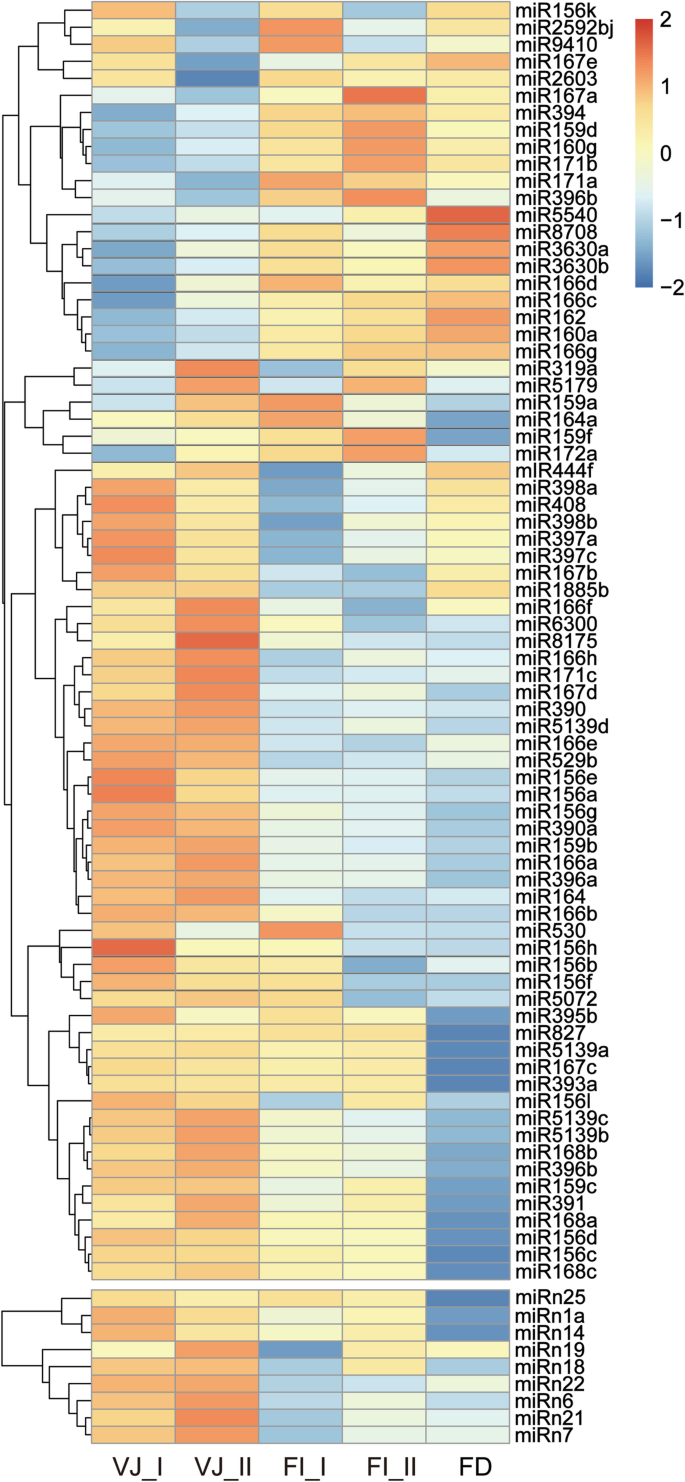
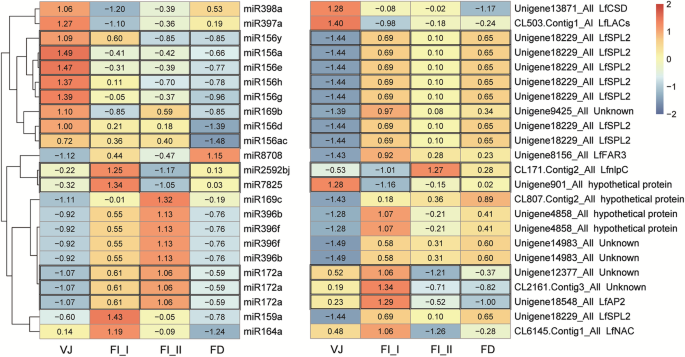
为了鉴定植物生长和百合花的开花起始期间发挥调控作用的关键miRNA,确定了75个保守的miRNA和9个新的miRNA被确定为显着差异(附加档案2:表S3)。对它们的表达模式进行聚类分析,生成不同表达谱的热图(图1)。2).从FD前的VJ_ I期到FI_II期,这些mirna有三种不同的表达谱。
大多数miRNA,包括50个保守的miRNA和9个新的miRNA,在VJ(VJ_I和VJ_II)阶段提出了高表达水平,并且在稍后的发展阶段进行了下调。在MIR156系列中,大多数MIR156S显示始终如一地减少表达式,VJ_I或VJ_II阶段的表达水平最高。类似于MIR156S,大多数MIR166系列在VJ_II阶段表现出表达峰。相比之下,20个保守的miRNA从VJ到FI_II阶段或FD阶段表现出升高的表达。MiR159D,MIR159F,MIR172A和MIR171同源物从VJ_I表现出来自VJ_I至FI_II的上调表达水平,并且几个较少的保守的miRNA,例如MIR5540,MIR8708和MIR3630A / B,从VJ保持增加的表达到FD阶段。此外,在文库中发现许多具有波动水平波动水平的差异表达的miRNA。MiR156K,MIR2592BJ和MIR167E / A的表达在VJ_II和FI_II阶段下调。
降级测序
结合降解体的结果和相应注释mRNA的计算靶标预测,235个mirna的396个靶标转录本在降解体中被全局识别,并通过检测诊断mirna定向切割的mRNA片段进行分析,其中包括157个保守的mirna(图。3.额外的文件2:表S4)和28个新的miRNAs(附加文件2:表S5)。根据每个占用的转录立场的切割签名丰度,根据先前研究中所示的标准将鉴定的降低序列分为5类[29)(附加文件2:表S4)。其中,0、1、2、3、4类指标分别为24、7、179、25、184个。
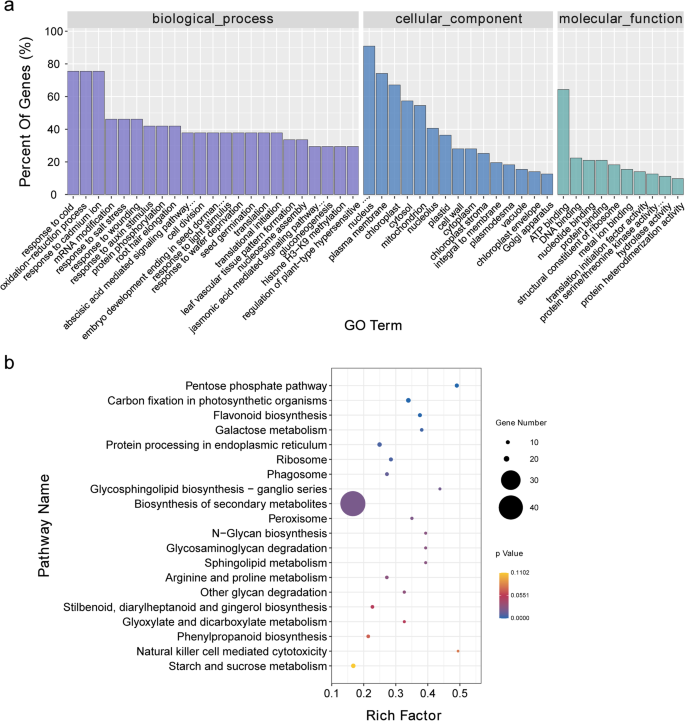
对富集的GO项目进行分析,以阐明所鉴定的靶基因的功能。在生物过程中,“氧化-还原过程”(GO: 0055114)、“对低温的响应”(GO: 0009409)和“对镉离子的响应”(GO: 0046686)是最丰富的类别。‘Nucleus’(GO: 0005634)和‘ATP binding’(GO: 0005524)分别是最具代表性的细胞成分和分子功能类别(图5)。4.a).富集KEGG途径分析显示磷酸戊糖途径(ko00030)、光合生物固碳途径(ko00710)和类黄酮合成途径(ko00941)是最富集的途径(图)。4.b) 是的。
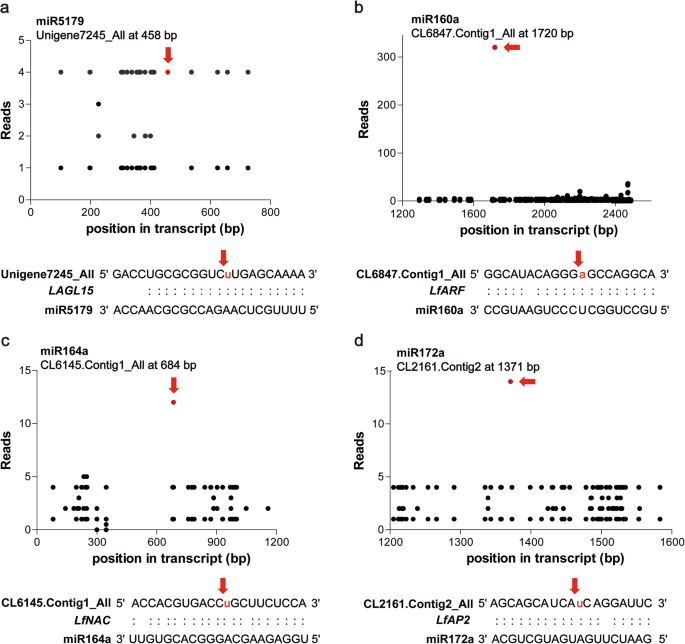
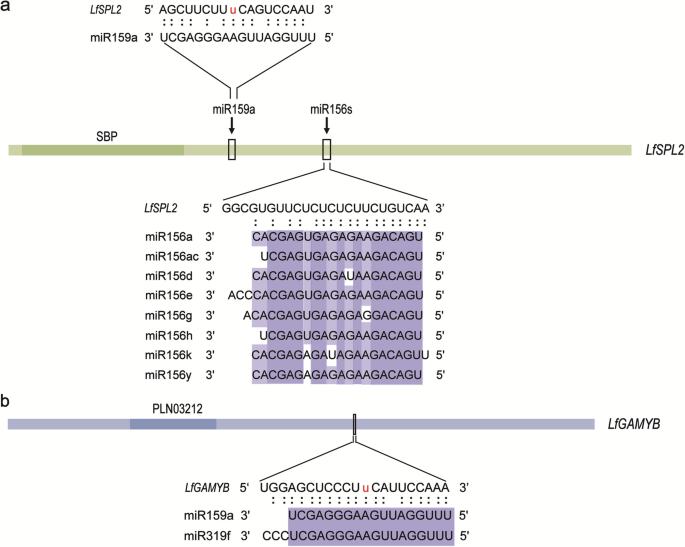
根据功能注释,确定了可能的开花相关靶点。它们由鳞片启动子结合、花同源异型蛋白APETELA2样、MADS-box、含NAC结构域、R2R3-MYB、GAMYB和激素信号生长素反应因子18样蛋白组成(表1)2).我们还发现LfSPL2和LfNAM,以miR156s和miR164a为靶点,在淀粉和蔗糖代谢、戊糖和葡萄糖醛酸互转化途径中富集。此外,miR156s和miR159a均被提示调控共同靶标LfSPL2根据不同靶位点的鉴定(图。5.a). miR159a和miR319f靶向LfGAMYB共享一个共同的目标站点(图。5.b).这些miRNAs靶向的转录本被认为是百合营养发育和开花诱导过程中的候选关键调控因子。
miRNA表达谱与miRNA靶基因的相关性分析
为了研究百合营养发育和开花启动过程中的关键参与者及其变化趋势,将28个从降解组中获得的显著差异表达mirna的靶基因用于差异表达基因(DEGs)分析。从VJ(营养生长)到FD阶段,转录组中有15个deg对应23个差异表达的mirna(图1)。6.).其中,有13对miRNA-mRNA对在表达水平上呈负相关。miR156家族成员表达量最高,表达水平显著下调,而其靶蛋白表达量显著降低LfSPL2在开发过程中增加。
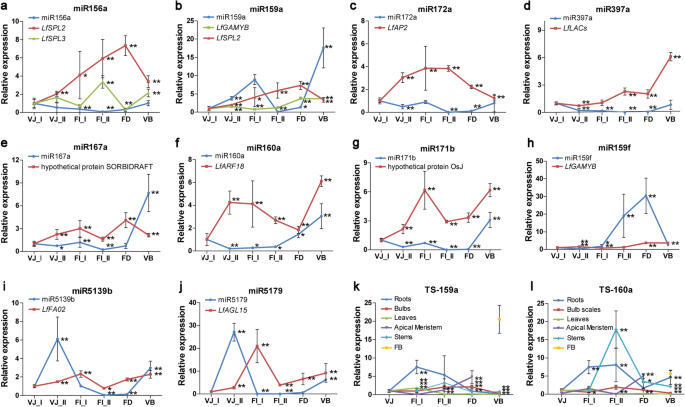
基于靶基因的相关性和功能分析结果,选取12对表达模式不同且可能参与开花诱导的mirna -靶基因对,通过RT-qPCR分析验证测序结果的准确性。如图所示。7.a-j,这10个候选miRNA表现出与miRNA文库数据显示的表达变化基本相似。这些mirna中有一部分与其对应的靶点呈负相关,如miR156a-LfSPL2/LfSPL3miR159a -LfGAMYBmiR397a -LfLACsmiR160a -LfARF18型,miR5139b号-LfFAO2和mir5179-LfAGL15,这证实了MiRNA-mRNA模块的表达谱中的负关系。此外,MIRNA从VJ_I到FD阶段的表达谱不同。在VJ_I阶段之后逐渐上调miR160A,而四个miRNA,包括miR159a,miR172a,miR167a和miR171b,在FI_I阶段表现出上调的表达。MIR5139B和MIR5179都在VJ_II阶段呈现表达峰。除MiR159F外,所有这些miRNA都表现出从FD到VB级的转录物丰度的显着上调,其在FD阶段表现出降低的表达。
我们还检测了两种显著差异表达的mirna, miR159a和miR160a的组织特异性表达谱(图。7.从VJ期到VB期,它们在不同器官和组织中表现出相似的表达模式。在花期诱导阶段(FI_I, FI_II)根和茎中均有高表达。miR159a和miR160a在叶片FI_I期有表达高峰。而在根尖分生组织和鳞片中,miR159a水平从VJ期到FD期呈上升趋势。在可见的花蕾中,mR159a的表达显著最高。同样,miR160a在FD期顶端分生组织中表达量最高。
基因共表达网络分析
为了挖掘与开花诱导相关的miRNA簇,我们利用高通量测序获得的miRNA数据,通过WGCNA进行相关网络分析。在检测异常样本或基因后,通过将软阈值设置为12(附加文件)来构建相关网络4.:图。S4-7)。结果,找到了包含70(蓝色模块),40(棕色模块),53(绿色模块),82(绿松石模块)和33(绿色模块)和33(黄色模块)互连的miRNA的5个miRNA共抑制模块,如附加文件所示2: S7表。我们还在蓝色模块(miR169b, miR156a/ h/ e/ y),棕色模块(miR164a, miR172a, miR2592bj),绿色模块(miR160a),绿宝石模块(miR156d/ g/ ac)和黄色模块(miR398a, miR397a)中识别出属于差异表达mirna靶标对的14个mirna。这些属于差异表达对的mirna在蓝色模块中最多;因此,蓝色模块可认为是百合营养发育和开花开始关键阶段的关键模块。
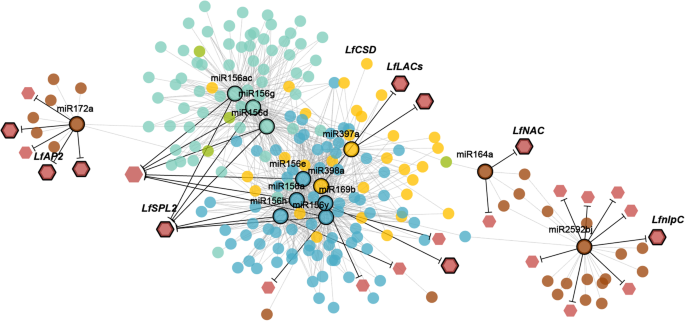
我们还提取了一个包含795条边的子网络,这些边与差异表达的mirna相连,其中也包含了它们的目标(附加文件2:表S8)。在调控网络中,miR156a/d/e与其他序列的相互作用最多,表明它们在共表达基因中的核心作用(图。8.).系统发育分析表明,miR156s与该基因的亲缘关系最为密切拟南芥. 它们很可能是百合开花诱导中的候选mirna,这个家族成员的具体作用需要进一步的验证和研究(附加文件)5.:图S8)。
讨论
在营养发育和开花诱导中潜在的关键mirna
mirna在诱导开花中的作用已经在不同的植物中得到证实,例如拟南芥,大米,玉米,苹果和番茄[19那30.那31].百合营养开发和开花开始遗传网络中的miRNA功能的机制很差。
本研究共鉴定出84个差异表达的mirna,并对其在百合发育过程中的表达动态进行了分析。在小RNA文库中,差异表达的miRNAs在VJïuⅠ期和VJïuⅡ期表达最多。这些结果与我们的假设是一致的,我们认为miRNA介导的调控是通过整合环境和内源因素为诱导开花做准备的营养体发育的关键。
在l×formolongi在差异表达的mirna中,属于miR156家族的mirna最为常见。在拟南芥,MiR156是控制营养态转移的衰老途径的重要协调官,并在营养阶段显示出非常高的表达[32]. miR156成员的保守表达谱已在许多植物中得到证实,如水稻[33],玉米[34),烟草(35和多年生木本植物金合欢混淆那蓝桉,Quercus Acurissima.[36].在l×formolongimiR156家族在植物发育过程中与其他植物的表达谱相似,显示了它们在植物营养发育过程中的进化和功能保护作用。然而,miR156k的表达水平波动,并在FI_I期上调。在拟南芥和米饭,ATH-MIR156A./C和OsmiR156b/H在miR156前体中扮演主要角色[37那38那39].我们观察到mir156的前体(MIR156k)的亲缘关系较近拟南芥序列和那个MIR156k展示了最接近的关系ATH-MIR156A./C,它聚集在同一个分支中(附加文件5.:图S8),表明miR156k前体对百合开花诱导过程中miR156的丰度的影响可能大于在花期-成期过渡期间。
之前的一项研究拟南芥证实了另一个重要的调控因子miR172与miR156表现出反表达模式,并在发育过程中表现出持续上调的表达,以调节相变和花器官特征[40那41.].miR172家族有5个成员,miR172b可以通过miR156e负调控来影响青少年-成人阶段的变化[32].在多年生植物中麻风树,只有两个miR172被确认[42.]. 然而,ten miR172s and only one miR172 (miR172a) were identified among the differentially expressed miRNAs in our libraries. The expression of miR172a was elevated from the VJ to FI_II stages, followed by a decline at the FD stage. Hence, we consider miR172a to exhibit relatively complex or species-specific functions in lily flowering induction or other aspects of development.
在拟南芥和米,mir159a,mir167a和mir160a影响花药和萼片的发展[43.那44.那45.].在百合中,这些高度保守的mirna在VB期也显著上调表达,表明它们在花发育早期的花器官形成中起着重要作用。此外,miR5179通过切割兰花的MADS-box基因来影响花被器官的多样化[46.].相比之下,miR5179在VB期表达上调,而在VJ期表达显著上调,这表明这个在其他植物中很少观察到的保守性较低的miRNA,可能在百合营养发育过程中比在花发育过程中发挥更重要的作用。
花相关miRNA-mRNA模块l×formolongi
MiRNA通过调节特定MRNA的表达来进行其生物学功能。我们确定了编码与开花相关的转录因子或蛋白质的目标。SPL基因由miR156靶向,并调节植物营养发展的许多方面,作为多种途径的重要组成部分[47.].在拟南芥10.SPL基因受miR156调控,并且AtSPL3/14/15/9.能促进开花[4.那48.].SPL7和SPL8参与开花调制,并由草地上的miR156定位[49.].在11LfSPL成员,两个同源染色体,LfSPL2和LfSPL3,由mir156s瞄准L..×formolongi,只有miR156s-LfSPL2成对的细胞差异表达。此外,miR156a/d/e位于共表达网络的核心。因此,miR156a/d/e-LfSPL2模块可能是营养发育和开花诱导过程中衰老途径中最关键的调节因子。miR156-LfSPL模块涉及基础开花的基因网络需要进一步的密集调查和验证。
过去的研究拟南芥已证实MIR159通过规范MIR159调节幼年到成人相转换GAMYB/MYB33相互作用 [50.], 和MYB33也能像靶标一样激活miR156SPL9[17].有趣的是,我们发现miR159a可以调控LfSPL2同时与miR156s,除了LfGAMYB在这个研究中。MiR159A在FI_I阶段表现出高表达水平,以及miR159a的表达水平和LfSPL2从FI_I到VB阶段呈近似负相关。由此可见,miR159可能主要通过miR159-促进幼到成虫的发育阶段变化和诱导开花LfGAMYB模块。同时,miR159a可能参与了一条新的开花途径,通过调控细胞的功能影响开花起始SPL这一调控模块是值得在未来验证的。
影响百合营养发育的关键因素
在我们的实验室中进行的最近进行的研究表明,当幼苗的时候l×formolongi经过螺栓,幼苗过渡到生殖阶段,完成了少年 - 成人转变[3.].因此,我们重点研究了mirna在花期诱导,特别是莲座期营养发育过程中的调控机制L..×formolongi,以及影响这一过程的因素。
在分子调控网络中,糖作用于miR156上游,改变miR156的表达[37]. T6P通过调控叶片和顶端分生组织的开花英国《金融时报》作为碳水化合物条件的代表[6.].以前的研究表明,Daylength强烈影响螺栓连接时间和质量l×formolongi[25].温度在营养发育中也起着重要作用。低温暴露通过打破球茎休眠诱导开花,并影响球茎植物的生长[51.].我们的研究表明,鉴定目标的功能富集于镉离子、低温反应和糖代谢途径,包括磷酸戊糖途径和光合生物的碳固定。因此,营养发育可能与体内碳水化合物、寒冷或光周期密切相关l×formolongi通过microrna。LfSPL2和LfNAM,分别被miR156s和miR164a靶向,在糖代谢途径中被鉴定。因此,这些因素对植物营养发育的影响l×formolongi通过潜在的miRNA-mRNA模块也是等待未来勘探的重要主题。
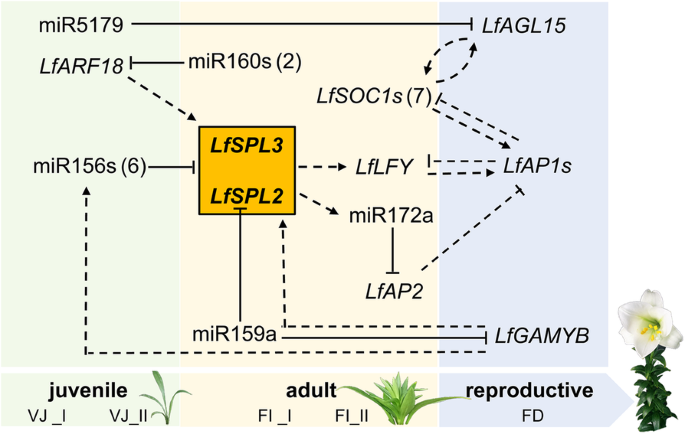
以拟南芥的开花调控网络为参考,通过对小RNA库、降解组和转录组数据的分析,得出了拟南芥开花调控网络的假想示意图。9.).在拟南芥中,miR156和:是营养发育阶段过渡的主要调节因子。SPL蛋白可以诱导花整合子,铜的过度表达抑制剂1(SOC1),AGL42在叶片和顶端分生组织中[13].在顶端分生组织,:也可以调控花分生组织的同一性基因多叶的(LFY),APETALA 1(AP1),它们被AP2转录因子基因,miR172的靶标[13那15].与此同时,SPL9直接促进miR172的转录,从而影响营养-生殖阶段的转变[13].此外,ARF 3/4.可能调节SPL3通过调节幼年-成年的相变[52.].
类似于拟南芥,miRNA-target对mir156-SPL在mirna介导的开花调控网络中占据中心位置L..×formolongi.miR156表达降低诱导LfSPL2和LfSPL3这可能促进了MAD-box基因的表达LfLFY在顶端分生组织中诱导开花。同时,mir160可以靶向LfARF18型,上调LfARF18型VJïuⅡ期可能促进VJïuⅡ的表达LfSPL2和LfSPL3.miR159a可能通过抑制miR159a的表达参与开花诱导和花分生组织的形成LfGAMYB和LfSPL2, 分别。此外,LfGAMYB也可能诱导调节因子miR156s和LfSPLs在衰老过程中。LfSPL2和LfSPL3也可以激活mir172a转录。mir172a目标LfAP2,表达下调LfAP2前VB阶段可抑制LfAP1和LfSOC1.此外,miR5179特异性靶向MADS-box基因LfAGL15,可能在花期诱导阶段起关键作用。
结论
据我们所知,本研究首次整合了百合开花过程中的转录组学、miRNA文库和降解分析,从而全面了解百合开花过程中的miRNA及其靶点。关键的mirna和mirna -靶点对参与营养发育和花诱导L.. × formolongi通过测序数据集的相关性分析进行识别。包括碳水化合物、寒冷和光周期以及相关的富集靶功能等因素可能影响营养发育和开花诱导。这些结果将有助于我们对mirna介导的调节机制有更广泛的了解L.. × formolongi百合的营养发育和开花过程,对调节百合的生长发育过程具有重要意义。
方法
植物材料和样品采集
的种子l×formolongi(“Razan No. 2”)(购自日本茨城县村上种子公司)在4°C分层后播种一个月。将莲座叶2 ~ 3片的幼苗移栽到单个盆中,在320 μmol·m白光照射下,在16 h光照(25°C)/ 8 h暗循环(16°C)、70%湿度条件下生长−2·S.−1光合光子通量密度。
我们实验室的先前研究证实了营养开发和开花起始的关键特征l×formolongi通过形态和基因表达模式调查在漫长的环境下进行[3.].因此,在不同的发育阶段,包括2-3莲座叶期(营养幼年期,VJ_I)、5-6莲座叶期(营养幼年期,VJ_II)、1-2节间期(花期诱导期,FI_I)、5-6节间期(花期诱导期,FI_I)、1 - 6莲座叶期(花期诱导期,VJ_II)和1 - 6莲座叶期(花期诱导期,VJ_II),采集莲座叶的新鲜叶片和茎尖进行小RNA文库构建。FI_II)和9-10节间期(花分化期,FD)。从70 ~ 71节间(可见花芽期,VB)收集的叶片和芽,制备类似的样品用于RT-qPCR分析。检查组织表达模式的差异表达microrna miR159a miR160a,新鲜的叶子,顶端分生组织,中间茎,灯泡尺度(中间的灯泡),根和小花卉小兄弟(约2厘米)也从VJ_I收集从一个工厂到VB阶段。每个发育采收点收集3个生物学重复。所有样品立即在液氮中冷冻,然后在−80℃下保存,以便进一步研究。
小RNA文库构建与测序
总RNA的提取使用EASY spin Plus Plant RNA试剂盒(Aidlab Bio,北京,中国),根据制造商的说明。根据TruSeq small RNA Sample Prep Kits (Illumina, San Diego, USA)协议,将高质量的总RNA用于小RNA文库的生成。简单地说,将RNA用3’和5’适配器连接后,用RNA进行逆转录和PCR扩增。然后进行凝胶电泳和凝胶纯化小RNA文库l×formolongi对不同发育阶段和开花起始阶段进行构建,并进行质量控制分析。测序采用Illumina HiSeq 2500平台(LC Bio,中国杭州)。每个反应重复三次。
sRNA数据的生物信息学分析
测序分析通过一个内部项目ACGT101-miR (LC Bio,杭州,中国)进行。简单地说,获得有效的读取而不参考l×formolongi、序列适配器、低质量reads和含有poly-N的垃圾reads被过滤掉。随后,过滤非编码rna (RNAs、tRNAs、snrna和snoRNA)与RFam中重复序列(http://rfam.xfam.org)及Repbase (http://www.girinst.org/education/index.html)数据库被丢弃。对剩下的18-25个有效reads进行进一步处理,总结长度分布,并通过BLAST搜索和转录组分析(数据未发表)定位到miRBase 22.0中的特定物种前体l×formolongi用于识别已知的miRNAs。根据reads和前体是否与miRBase和转录组中的序列匹配,将miRNAs分为3组,分别是已知的miRNAs(完全匹配的序列,第1组)和保守的miRNAs(第2组和第3组)。在保守的miRNAs中,这些reads可能与miRbase中的前体对齐,而被映射的前体未能被映射到转录组。当这些reads也可以被映射到转录组时,这些reads被归类到第2组,如果没有,则被归类到第3组。
提取已知的miRNAs后,对miRBase中未定位但对转录组进行BLAST搜索l×formolongi选择了新的miRNA鉴定。rnafold软件(http://rna.tbi.univie.ac.at/cgibin/rnawebsuite/rnafold.cgi.)来预测潜在miRNA序列的二级结构。其具体标准为:(1)茎和成熟区单个突起的核苷酸数量≤12个和4个;(2)在预测的发夹中,茎部区域的碱基对数≥16;(3)在成熟区域,一个凸起的偏误差和凸起的数量和误差的数量均≤2 [53.].
差异表达mirna的分析
鉴定差异表达的mirnal×formolongi在开花过渡阶段和发育阶段,深度测序计数按之前报告的描述进行了标准化[54.].简而言之,首先构造一个由所有样本所选公共序列的拷贝数中位数构成的参考数据集。其次,将所有库中样本的总拷贝数转换为Log2(拷贝#),然后计算个体与参考数据集之间的差异。第三,样本与参考集在子集序列(|)上的线性回归△log2(复制#)| < 2), and the arithmetic correction factor were generated to calculate the expected Log2 (copy#). Thus, we calculated the expected Log2 (copy#) values to indicate the original copy numbers of the samples. The differentially expressed miRNAs were identified by one-way ANOVA andP.- 通过图书馆之间的多重比较获得了值。每次试验中具有p值≤0.05的miRNA被定义为百合发育期间显着表达miRNA。
降解库构建与目标识别
来自新鲜叶子的总RNA和顶端公司l×formolongi根据已发表的协议,在5个发育阶段作为一个单一样本均匀混合构建降解文库[55.].利用Illumina Hiseq 2500 (LC Bio,杭州,中国)对降解体cDNA文库进行测序。对原始reads进行处理,去除适配器序列和低质量序列,生成干净reads,并根据之前的研究描述与转录组序列进行潜在的剪切目标识别[56.]. 因此,可以鉴定由miRNAs引导的内切核裂解产生的截断转录物[57.].此外,利用TargetFinder中的计算目标预测算法(https://github.com/carringtonlab/TargetFinder)识别miRNA绑定站点的软件。在基因本体(GO)和基因组(KEGG)途径数据库中进行进一步注释靶标在所有靶植物进行BLAST2GO(左右)后进一步的miRNA-基因调节网络分析(https://www.blast2go.com/)按照先前报道的方法分析并与富集的KEGG途径进行比对[58.].
实时荧光定量PCR分析
利用RNA提取试剂盒,在长时间条件下从幼苗到可见花芽期的6个发育阶段的叶片和顶端分生组织中提取总RNA和miRNA (Aidlab Biotechnology Co., LTD, China;天根生物,北京,中国)和miRcute miRNA分离试剂盒(天根生物,北京,中国)根据制造商的说明。对成熟的miRNA进行聚腺苷化大肠杆菌Poly (A) Poly Polymerase Kit (Invitrogen, Carlsbad, CA, USA) [59.].然后,对获得的rna和miRNAs进行质量鉴定、poly (A)富集和反转录,使用Quant Script RT Kit(天根生物,北京)和ReverTra Ace qPCR RT Master Mix with gDNA Remover(东京,上海,中国)获得cDNA。此外,为了评估组织特异性miRNA的表达,我们分别从同一发育阶段的幼苗不同组织中提取总miRNA。RT-qPCR在Bio-Rad CFX96系统(CFX96 Touch, Bio-Rad,美国)上使用THUNDERBRIRD SYBR qPCR Mix Without Rox (Toyobo,中国上海)进行。每个反应重复三次。5S RNA和英孚基因被用作内部参考基因,用于归一化结果[60.那61.].MiRNA和靶标的引物是使用信标设计器7软件设计的,如补充表6所示。 - 2−∆∆Ct方法对这些数据进行统计分析[62.].
Coexpression网络建设
为了构建百合发育过程中miRNAs的相关网络,采用加权基因共表达网络分析(WGCNA)算法构建了一个无向加权基因网络。有关R中WGCNA包的教程,请参见https://horvath.genetics.ucla.edu/html/CoexpressionNetwork/Rpackages/WGCNA.来自文库的标准化miRNA表达数据用于基因筛选后的相关网络施工,其功率为12.我们将分析分析在百合花期间靶向靶向差异表达的模块eIgengenes。选择了感兴趣的相关网络,用于Cytoscape(版本3.6.1)中的可视化。此外,MiRNA前体序列和MIR156系列的系统发育分析的对准通过默认参数Mega 6.06软件中的Clustalw和NJ方法进行MiR156系列。从miRBase获得的其他物种的前体序列,第21份(http://www.mirbase.org/index.shtml).
数据和材料的可用性
序列数据已提交给NCBI SRA(序列读取存档,http://www.ncbi.nlm.nih.gov/sra/),在加入号码Prjna712953下。
缩写
- microrna:
-
小分子核糖核酸
- 英国《金融时报》:
-
开花轨迹T
- T6P:
-
Trehalose-6-phosphate
- nt:
-
核苷酸
- SPL:
-
鳞状藻启动子结合蛋白样
- AP2:
-
APETALA 2
- 遗传算法:
-
赤霉素
- 东盟地区论坛:
-
生长素反应因素
- 开始:
-
基因本体论
- KEGG:
-
京都基因和基因组百科全书
- NJ:
-
Neighbor-Joining
- RT质量控制报告:
-
定量实时聚合酶链反应
- WGCNA公司:
-
加权基因共表达网络分析
- 注册核糖核酸:
-
核糖体RNA
- tRNA:
-
转移核糖核酸
- Snorna:
-
小核仁RNA
- 核内小rna:
-
小核RNA
- SRNA:
-
小RNA
- mRNA:
-
信使核糖核酸
- NAC公司(不结盟运动):
-
没有顶端分生组织
- 度:
-
差异表达基因
- 虫胶:
-
漆粉
- 粮农组织:
-
脂肪醇氧化酶
- 航空地面照明:
-
AGAMOUS-LIKE
- SOC1:
-
铜的过度表达抑制剂1
工具书类
- 1.
Bakhshaie M,Khosravi S,Azadi P,Bagheri H,Tuyl JMV。生物技术进步百合.植物细胞代表2016;35(9):1799-826。https://doi.org/10.1007/s00299-016-2017-8.
- 2.
Fortanier EJ。回顾了世代周期的长度和缩短,特别是郁金香。Sci长的矮。1973;1(1):107 - 16。https://doi.org/10.1016/0304 - 4238 (73) 90010 - 1.
- 3.
李云飞,张曼曼,张敏,贾光新。花期起始过程中基因表达谱分析百合×formolongi.植物mol biol。2017; 94(4-5):361-79。https://doi.org/10.1007/s11103-017-0612-x.
- 4。
黄建平,李建平。植物生长发育阶段的调控。发展。2011;138(19):4117 - 29。https://doi.org/10.1242/dev.063511.
- 5。
调节花期:条条大路通罗马。中国生物医学工程学报(英文版);2011;https://doi.org/10.1007/s00018-011-0673-y.
- 6。
等。中国科学院研究生院学报(自然科学版);海藻糖-6-磷酸信号转导对开花的调控拟南芥.科学。2013; 339(6120):704-7。https://doi.org/10.1126/science.1230406.
- 7。
Hong Y,Jackson S。花诱导和花形成-miRNAs的作用和潜在应用。植物生物技术J。2015;13(3):282–92.https://doi.org/10.1111/pbi.12340.
- 8.
Wilczynska A,Bushell M。miRNA介导的抑制的复杂性。细胞死亡不同。2015;229(1):22–33.
- 9.
罗杰斯K,陈X.生物发生,翻身,植物microRNA的作用方式。植物细胞。2013; 25(7):2383-99。https://doi.org/10.1105/tpc.113.113159.
- 10.
Dario M, griffithjones S, Kim M. Small rna:对植物发展的重大影响。植物科学进展。2017;22(12):1056 - 1068。https://doi.org/10.1016/j.tplants.2017.09.009.
- 11.
植物花发育过程中microRNA调控程序的进化保护。Dev杂志。2013;380(2):133 - 44。https://doi.org/10.1016/j.ydbio.2013.05.009.
- 12.
何静,徐敏,Willmann MR, McCormick K,胡涛,杨磊,等。miR156/miR157对SPL基因表达的阈值依赖性抑制控制了细胞内营养相的变化拟南芥.Plos Genet。2018; 14(4):E1007337。https://doi.org/10.1371/journal.pgen.1007337.
- 13.
关键词:MiR156, SPL,转录因子,花期调控拟南芥.细胞。2009; 138(4):738-49。https://doi.org/10.1016/j.cell.2009.06.014.
- 14.
miR172靶基因SMZ对开花的抑制作用。公共科学图书馆杂志。2009;7 (7):e1000148。https://doi.org/10.1371/journal.pbio.1000148.
- 15.
Aukerman MJ,Sakai H. MicroRNA的开花时间和花器官身份的调节APETALA2——目标基因。植物细胞。2003;15(11):2730 - 41。https://doi.org/10.1105/tpc.016238.
- 16。
Wu G,Park MY,Conway SR,Wang JW,Weigel D,Poethig RS.miR156和miR172的序贯作用调节胚胎发育时间拟南芥. 牢房。2009;138(4):750–9.https://doi.org/10.1016/j.cell.2009.06.031.
- 17。
郭超,徐勇,石敏,赖勇,吴鑫,王浩,等。miR159对miR156的抑制调控了拟南芥从幼体到成体过渡的时间。植物细胞。2017;29(6):1293 - 304。https://doi.org/10.1105/tpc.16.00975.
- 18。
Moon J,Suh Ss,Lee H,Choi Kr,Hong CB,Paek NC等。这SOC1MADS-box基因整合了春化和赤霉素信号拟南芥. 植物J。2003;35(5):613–23.https://doi.org/10.1046/j.1365-313x.2003.01833.x..
- 19.
Silva-GF,Silva-EM,Correa-JP,Vicente-MH,Jiang-N,Notini-MM等。番茄花的诱导和花的发育是由赤霉素和两个不相关的microRNA控制模块相互作用协调的。新植物醇。2019;221(3):1328–44.https://doi.org/10.1111/nph.15492.
- 20.
关键词:大麦,microRNA171,分生组织,相变植物生物学学报。2013;13(1):6。https://doi.org/10.1186/1471-2229-13-6.
- 21.
杨R,李鹏,梅H,王D,Sun J,Yang C等人。MiR528积累的微调调节水稻中的开花时间。莫尔植物。2019; 12(8):1103-13。https://doi.org/10.1016/j.molp.2019.04.009.
- 22.
胡静,周勇,何飞,董鑫,刘磊,Coupland G,等。mir824调控的研究进展钦am-LIKE16有助于开花时间镇压拟南芥.植物细胞。2014;26:2024-37。
- 23.
吴玲,刘丹,吴杰,张锐,秦卓,刘丹,等。的监管开花轨迹T通过一个microRNA短足.植物细胞。2013;25(11):4363 - 77。https://doi.org/10.1105/TPC.113.118620.
- 24.
Lazare S,Zaccai M.开花途径由灯泡尺寸调节百合longiflorum(复活节百合)。植物医学杂志。2016;18(4):577 - 84。https://doi.org/10.1111/plb.12440.
- 25.
李艳,赵艳,张敏,贾刚君士坦斯例如家庭百合×formolongi.植物细胞生理。2018; 59(9):1874-88。https://doi.org/10.1093/pcp/pcy105.
- 26.
Peruzzi L, Leitch IJ, Caparelli KF。染色体的多样性和进化百合科.Ann Bot。2009; 103(3):459-75。https://doi.org/10.1093/aob/mcn230.
- 27.
林宝平,陆春华,沈宝彬,李国珍,鲍曼JL,马文杰,等。苔类植物中mirna及其靶点的鉴定Marchantia polymorpha通过整合rna测序和降解体分析。植物生理学杂志。2016;57(2):339-58。https://doi.org/10.1093/pcp/pcw020.
- 28.
植物基因组测序技术在作物改良中的应用。植物保护学报(英文版);2010;https://doi.org/10.1111/j.1467-7652.2009.00459.x.
- 29.
韩X,尹H,宋X,张Y,刘M,桑J,等。超积累细胞中小rna、降解体和转录组序列的整合景天属植物alfredii揭示了一个复杂的调控网络,并为镉的植物修复提供了见解。植物保护学报(英文版);2016;https://doi.org/10.1111/pbi.12512.
- 30.
Axtell MJ,Bartel DP。MicroRNA和陆地植物中的古代。植物细胞。2005; 17(6):1658-73。https://doi.org/10.1105/tpc.105.032185.
- 31.
邢玲,张丹,赵超,李勇,马军,安宁,等。苹果枝条弯曲通过mirna介导的调控促进花芽形成(Malus Domestica.Borkh)。植物生物技术2016;14:49 - 70。
- 32.
yant l,mathieu j,Dinh Tt,Ott F,Lanz C,Wollmann H,等。花卉过渡和花卉发展的策划拟南芥通过双功能转录因子APETALA2。植物细胞。2010;22(7):2156 - 70。https://doi.org/10.1105/tpc.110.075606.
- 33.
谢克,沉姬,侯x,姚杰,李x,xiao j等。MiR156逐渐增加调节稻米叶片发育过程中众多基因的时间表达变化。植物理性。2012; 158(3):1382-94。https://doi.org/10.1104/pp.111.190488.
- 34.
关键词:植物生长,miR156,信号转导,营养相变化发展。2011;138(2):245 - 9。https://doi.org/10.1242/dev.058578.
- 35.
冯胜,徐勇,郭超,郑洁,周斌,张勇,等。miR156调控烟草营养相变化相关性状的研究(烟草).实验机器人。2016;67(5):1493-504。https://doi.org/10.1093/jxb/erv551.
- 36.
王j,公园我,王l,koo y,chen x,weigel d,等。树木植物相变的miRNA控制。Plos Genet。2011; 7(2):E1002012。https://doi.org/10.1371/journal.pgen.1002012.
- 37.
yu s,cao,周c,张t,连h,sun y等。糖是植物中的幼年到成人相转变的内源性提示。Elife。2013; 2:E00269。https://doi.org/10.7554/eLife.00269.
- 38.
Francozorrilla JM,Valli A,Todesco M,Mateos I,Puga Mi,Rubiosomoza I等。目标模仿提供了一种用于调节MicroRNA活性的新机制。NAT Genet。2007; 39(8):1033-7。https://doi.org/10.1038/ng2079.
- 39。
关键词:水稻,基因组组织,差异表达,相互作用Squamosa启动子-绑定-喜欢转录因子和microRNA156在水稻中的表达植物理疗。2006;142(1):280 - 93。https://doi.org/10.1104/pp.106.084475.
- 40.
朱Q,Helliwell Ca.MiR172的开花时间和花卉图案的调节。J Exp Bot。2011; 62(2):487-95。https://doi.org/10.1093/jxb/erq295.
- 41.
Jung J, Seo Y, Seo PJ, Reyes JL, Yun J, Chua N, et al. .gigantea调控的microRNA172介导的光周期开花独立于君士坦斯在拟南芥.植物细胞。2007;19(9):2736 - 48。https://doi.org/10.1105/tpc.107.054528.
- 42.
Tang M,Bai X,Niu L,Chai X,Chen M,Xu Z.Miro172在多年生木本植物中调节植物和生殖发育麻风树.植物生理学杂志。2018;59(12):2549-63。https://doi.org/10.1093/pcp/pcy175.
- 43.
研究结果表明,花的成熟与三种microrna的调控有关。公共科学图书馆麝猫。2013;9 (3):e1003374。https://doi.org/10.1371/journal.pgen.1003374.
- 44.
Tsuji H,Aya K,Ueguchitanaka M,Shimada Y,Nakazono M,Watanabe R等。GAMYB控制着不同的基因集,并受糊粉细胞和花药中的microRNA的差异调节。植物J。2006;47(3):427–44.https://doi.org/10.1111/j.1365-313X.2006.02795.x.
- 45.
Achard P, Herr AJ, Baulcombe DC, Harberd NP。赤霉素调控的microRNA调控花的发育。发展。2004;131(14):3357 - 65。https://doi.org/10.1242/dev.01206.
- 46.
Aceto S,Sica M,De Paolo S,D'Argenio V,Cantiello P,Salvatore F等。兰花花序显微结构的分析兰花italica揭示了一个定义-如MADS-box基因作为新的miRNA靶点。公共科学图书馆一号。2014;9(5):e97839。https://doi.org/10.1371/journal.pone.0097839.
- 47.
Preston JC, Hileman LC。植物的功能进化Squamosa-pligher结合蛋白质(SPL)基因家族。前植物SCI。2013; 5(4):80。
- 48.
瓦格纳·D.在合适的时间造花。Dev细胞。2016;37(3):208 - 10。https://doi.org/10.1016/j.devcel.2016.04.021.
- 49.
苟杰,唐超,陈宁,王浩,孙磊,等。SPL7和SPL8代表了柳枝稷开花的一种新的调控机制。新植醇。2019;222(3):1610 - 23所示。https://doi.org/10.1111/nph.15712.
- 50
李建平,李建平,李永平,等。的microRNA159-regulatedGAMYB-like在拟南芥中,基因抑制生长并促进程序性细胞死亡。植物杂志。2010;154(2):757 - 71。https://doi.org/10.1104/pp.110.160630.
- 51.
Lucidos JG,Ryu KB,Younis A,Kim C,Hwang Y,Son B等人。不同的一天和夜间温度响应汉桑百合与生长和花的发育有关。海洋环境生物学报。2013;54(5):405-11。https://doi.org/10.1007/S13580-013-1241-1..
- 52.
关键词:MicroRNA,植物,发育可塑性,分子生物学植物生态学报,2011;https://doi.org/10.1016/j.tplants.2011.03.001.
- 53.
jeyaraj a,张x,hou y,shangguan m,gajjeraman p,li y等。茶厂芽和两嫩叶中保守和新微大RNA的基因组鉴定(茶树),通过小RNA测序、微阵列杂交和基因组调查支架序列。中国生物医学工程学报,2017;https://doi.org/10.1186/s12870-017-1169-1.
- 54.
李X,Shahid MQ,吴俊,王L,刘X,Lu Y.对类动物脂肪和二倍体水稻花粉发育的比较小RNA分析。int j mol sc。2016; 17(4):499。https://doi.org/10.3390/ijms17040499.
- 55.
Addo Quaye C、Eshoo TW、Bartel DP、Axtell MJ。通过基因测序鉴定内源性siRNA和miRNA靶点拟南芥degradome。咕咕叫医学杂志。2008;18(10):758 - 62。https://doi.org/10.1016/j.cub.2008.04.042.
- 56.
琼斯罗迪斯大师,巴特尔DP。植物microrna及其靶标的计算鉴定,包括胁迫诱导的miRNA。摩尔细胞。2004;14(6):787 - 99。https://doi.org/10.1016/j.molcel.2004.05.027.
- 57.
关键词:生物化学,生物化学,生物化学,生物化学PAREsnip:一种通过降解测序快速发现全基因组小RNA/靶标相互作用的工具。2012;40(13):e103。https://doi.org/10.1093/nar/gks277.
- 58.
生物能源植物柳枝稷中microrna及其靶标的鉴定与鉴定(黍virgatum).Planta。2010; 232(2):417-34。https://doi.org/10.1007/s00425-010-1182-1.
- 59.
施克,蒋师傅。用于通过实时PCR定量MicroRNA表达的容易意味着。生物技巧。2018; 39:519-25。
- 60.
关键词:苹果,miR156,氧化还原信号,营养相变化Sci众议员2017;7(1):14223。
- 61.
刘Q,魏C,张MF,贾GX。百合发育期和胁迫期荧光定量PCR标准化的参考基因评价。同行J。2016;图4:e1837。https://doi.org/10.7717/peerj.1837.
- 62.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C (T))方法分析相关基因表达数据。方法.2001; 25(4): 402 - 8。https://doi.org/10.1006/meth.2001.1262.
确认
不适用。
资金
基金资助:国家重点研发计划(No. 2019YFD1000400);国家自然科学基金(No. 31772348)。资助者在研究的设计、收集、分析或数据的解释或手稿的撰写中没有任何作用。
作者信息
从属关系
贡献
GXJ设计了实验。QZ和YQZ进行了实验。QZ在XG的帮助下进行了生物信息学分析,并起草了稿件。GXJ指导并修改了稿件。所有作者阅读并批准最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
出版许可
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1
.样本间的皮尔逊相关性。无花果S2。.基于库表达级别的主成分分析。
附加文件2:表S1
. 百合中保守的miRNA家族。表S2.百合的小说Mirna家庭。表S3.百合中mirna的显著差异表达。表S4.鉴定并注释百合保守miRNAs的靶标转录本。表S5. 对百合中新的miRNAs的靶转录本进行了鉴定和注释。表S6.百合特异性RT-qPCR引物。表S7.WGCNA产生的基因网络重量分析结果的节点。表S8.WGCNA产生的基因网络重量分析结果的边缘。
附加文件3:图S3
. 预测新miRNAs前体的发夹结构。红色序列代表成熟的miRNAs,黄色序列代表miRNAs
附加文件4:图S4
. WGCNA构建共表达网络软阈值功率的选择。选择12作为软阈值功率参数。无花果S5。.分层群集树。分层集群树显示由WGCNA检测到的子表达模块。主要树枝构成5个由不同颜色标记的模块,包括蓝色,绿松石,黄色,绿色和棕色模块。无花果S6。. 基于模块特征基因的聚类树。图S7. 共表达模块基因的相关系数热图。每个亮点对应于每个miRNA和其他miRNA之间的相关性。颜色越深,相应行和列中两个mirna之间的连接就越强。
附加文件5:图S8
.miR156家族同源基因的系统发育关系。利用前体miRNA家族序列构建邻域连接(NJ)树拟南芥(ATH),奥雅萨苜蓿(OSA)和l×formolongi(lfo)。红点代表百合的前体序列,绿点和蓝点代表被证实在调控花期中起重要作用的成员的前体序列拟南芥和奥雅萨苜蓿, 分别。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
张倩,赵永强。高,X。et al。mirna介导的花期诱导调控分析百合×formolongi.BMC植物BIOL.21,190(2021)。https://doi.org/10.1186/s12870-021-02961-3
收到了:
公认:
出版:
关键字
- 百合×formolongi
- 发展
- 开花
- 小RNA