摘要
背景
更大的山药(薯蓣属alata是一种主要的热带和亚热带主食作物,因其富含淀粉的块茎而种植。这种雌雄异株物种的繁殖受到其不稳定开花的阻碍,然而目前对其有性生殖的遗传决定论知之甚少。
结果
在此,我们使用全基因组关联方法,确定了山药1号染色体上的一个主要遗传障碍,代表两个候选基因。考虑到这两个基因参与雄性生殖,以及该非开花显性等位基因在雄性基因库中的频率较低,可以假设这是对雄性适合度的有害影响。我们还扩展了位于染色体6上的XX/XY性别决定系统的假设D阿拉塔包括大部分物种多样性。此外,设计并验证了一个等位基因特异性PCR(KASPar)标记,该标记能够准确估计品种性别。与高度推测的结构变异检测相关的6号染色体的重建证实了染色体的主要部分可能参与。
结论
本研究的调查结果,结合正确估计加入倍性水平,以避免肠果不相容的问题,可以促进未来有前途的父母组合的设计D阿拉塔育种计划。此外,发现这种遗传障碍的繁殖障碍将开启新的途径,以获得对山药生殖生物学和多样化的洞察力。
背景
常规植物育种计划必须产生大量的后代,以增加选择新品种的机会,以所需的表型。高通量表型和基因分型方法的开发显着增强了更好的父母组合的预测。有效的策略可以专注于少数选定的父母组合并产生大人物[1]. 然而,亲本杂交能力(如生育能力、同步性、亲和性)仍然是一个主要问题。事实上,自交不亲和性是被子植物之间的一个共同障碍[2].此外,多种相互作用的外源和内源信号参与开花[3.]. 因此,植物生殖生物学的知识和控制对于有效的植物育种是必不可少的,大量的科学研究一直致力于此。
在块根和块茎作物中,有性繁殖能力的下降是由驯化和多样化过程直接遗传的[4.].由于相关成本,与性繁殖相关的特性不再高度维护或直接抵消。例如,在马铃薯(茄属植物tuberosumL.)的比较基因组研究揭示了参与花粉发育和配子体发生的基因的选择特征[5.].此外,一些品种的广泛克隆繁殖也可能破坏性系统的运作[6.].更一般地说,倍性水平和雌雄异株也是有性生殖的直接障碍,但在这个意义上,可食用山药的淀粉块茎和其雌雄异株是一个关键特征[7.]不是例外。尤其是大山药的情况(D阿拉塔),这是一种多倍体物种[8.]它的野生近亲没有已知的基因流动[9.].
大山药是分布最广的山药品种[10].尽管其文化,经济和营养成分,但耕种品种主要是地体制性的(例如,在科特迪瓦[11),因为育种计划正在努力克服相对较低的杂交成功率。由于倍性水平引起的不亲和性/不育性问题[10]一旦基本染色体数目(2n)被克服 = 40)已确认[8.那12[杂交的失败,由于使用三倍体父母(2N = 60)或胚乳不相容,[13].已经成功使用和/或创建了多倍体索取[12那13那14,但是十字架的成功仍然没有得到解释。此外,亲本组合之间获得的种子集以及倍性问题也存在显著差异[14那15].逐步群体的分离畸变还表明,可以发生配子体和/或Zygotic选择[16].
育种计划主要受到不稳定和异步的开花的阻碍D阿拉塔[17],从而限制了亲本的可育性,从而限制了成功杂交的数量。到目前为止,大多数关于山药生殖生物学的研究都集中在狭窄的物种内多样性环境下的性别决定上。事实上,ZW / ZZ (d . rotundata[18)及XX/XY (D. Floribunda.,[19];D. Tokoro.,[20];;D阿拉塔,[16性别决定系统仅在双亲代群体中被描述过。此外,如前所述,尽管不育性与多倍体相关的假设已被推翻[14],雌性不育的可能性是一个相关的推测,因为大多数开花材料是雄性的(D阿拉塔:[14];d . rotundata:[21])。需要对山药品种的多样性进行进一步的研究,才能对这些发现得出结论。
本研究旨在进一步了解山药生殖生物学,加强山药育种工作。因此我们专注于D阿拉塔,到:(i)识别出开花的任何遗传障碍的存在D阿拉塔,以及(ii)将目前有关性别决定的知识扩展到更广泛和更多样化的山药品种。
结果
面板描述和表型分布
两个面板被用来进行全基因组关联研究。用于研究开花能力的小组由122份材料组成:88份评估为开花形式(40份雌花和48份雄花),34份评估为非开花形式。用于鉴定性别决定论的鉴定小组包括前一已知性别鉴定小组的88份鉴定报告和另外两份鉴定报告(41份女性鉴定报告和49份男性鉴定报告)。结构在两个面板中都是显著的,第一个PCA轴解释了超过40%的方差(附加文件1:图S1;额外的文件2:图。S2)。这主要是由于存在分开的一组三倍体女性敷料。
我们还注意到两个男性基因库的存在。一种是将来自瓜德罗普INRAe育种计划的CRB-PT收集的选种与它们的一个祖“金字塔”一起纳入。另一组由属于卡布萨地方种无性系的材料组成。雄性和雌性供试材料在其他基因库中均均匀分布。在开花能力方面,表型在多样性范围内分布更为均匀。
对于数量性状核苷酸(QTN)检测,观察到p-值与预期的P值进行比较,通过Q-Q图分析,证实使用(P + K) GWAS(全基因组关联研究)模型对面板结构和亲缘关系进行了很好的控制(附加文件1:图S1;额外的文件2:图。S2)。
开花能力的遗传控制
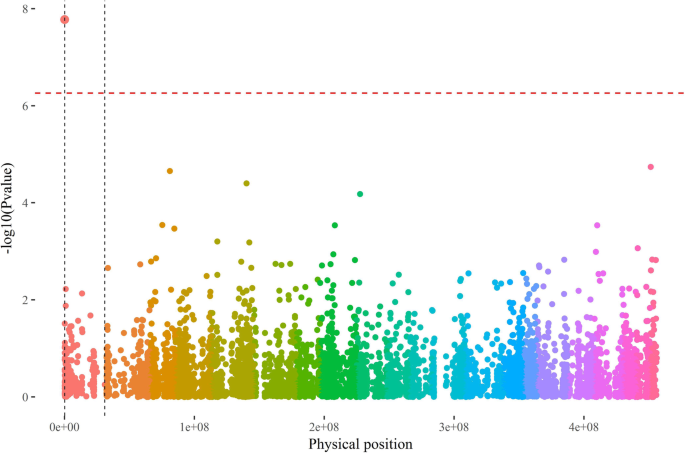
首次采用GWAS方法鉴定与开花表型相关的QTN。仅检测到1个QTN (01.1_172298);当错误发现率(FDR)风险为1%时,使用(P + K)模型(图1)。1).该位点位于1号假染色体172,798 bp位置d . rotundata基因组V1 [18],对应于脚手架112D阿拉塔基因组v1 17773 bp位置(Water Yam genome Project -ftp://yambase.org.).
在开花上进行的gwas(p + k模型)的曼哈顿图.D. rotundata伪染色体v1[18];红色虚线表示FDR阈值为1%;虚线黑色垂直线=染色体1的边界
在该位点,GBS只观察到纯合子CC和杂合子CT两种基因型,与非开花表型相关的T等位基因。实际上,89.7%(26/29)被评估为不开花的基因型材料是杂合子CT, 93.7%(45/48)的男性材料是纯合子CC1).
只是脚手架的开始112D阿拉塔基因组v1实际上被绘制在草图上D阿拉塔染色体1(见[16])和序列同源之间D阿拉塔和d . rotundata是好的(附加文件3.:图S3A)。d . rotundata因此用作该参考D阿拉塔转录组对齐是为了避免相关的问题D阿拉塔脚手架和扩展我们在脚手架开始之前的候选基因的研究112。
基因本体论分析表明,与开花能力相关的QTN的基因组区域显著富集了参与生殖过程和配子生成的基因(附加文件3.:图。S3B)。这是由于存在两种基因的存在D阿拉塔:第一个约125kb (D阿拉塔转录组Contig7439)作为细胞周期蛋白依赖性激酶F-4 CDKF4和第二左右167 kB(D阿拉塔转录组contig699),注释为E3泛素蛋白连接酶SINAT2。
检测性别判定基因座
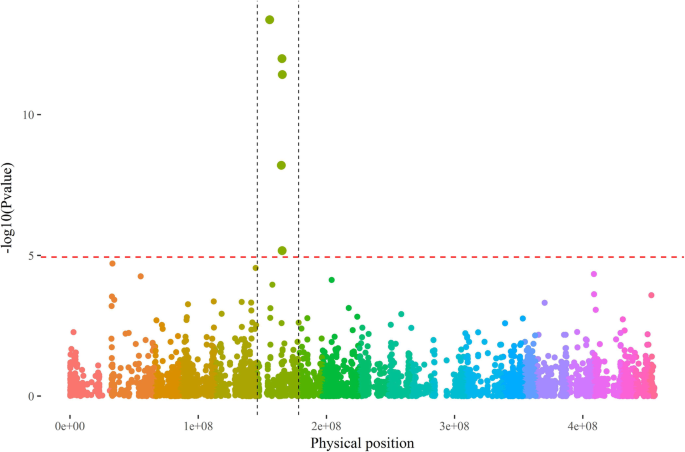
利用开花材料进行GWAS鉴定性别相关基因座。使用1%的FDR阈值和a(P + K) 模型中,显著的性连锁qtn仅位于6号染色体上(图1)。2).这5个qtn的位置在9886,520 bp到19660,282 bp之间d . rotundata伪染色体6v1及其-log10(p-Value)从5.7到13.37。
在最预测的QTN,GBS评估的等位基因组成与观察性的性别一致,持续89%的加入(76/85;表1).该位点位于19,660,282 bp,雌性多为纯合(A/A),雄性多为杂合(A/G)或纯合(G/G)。
提取相应单核苷酸多态性SNP(06.1 1_19660282)的侧翼序列,设计等位基因特异性的KASPar引物(X = A;Y = G)。然后在42份不同的材料上验证了该方法(表2;额外的文件4.:图。S4)。所有四倍体男性都是基因分型作为Xxxy,表明它们的等位基因组合物是AAAG。二倍体雄性被赋予XY(AG)和二倍体女性作为XX(AA)。唯一的两个例外是:xxxy(aaag)四倍体女性('noulelecae')和xx(aa)二倍体男性('彼得')。
总之,KASPar检测作为性别鉴定的诊断工具的效率估计为95%(40/42)。此外,存在一个显性Y等位基因和一个隐性X等位基因的假设,与XX/XY性别决定系统一致,似乎得到了验证。
染色体重建
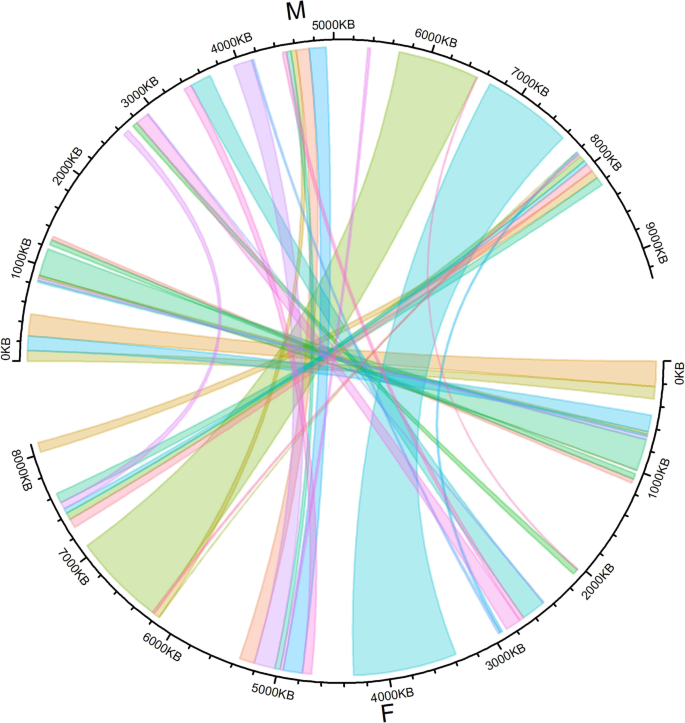
采用双亲隔离种群重建D阿拉塔男性和女性染色体6从可用的无序支架。在雄性侧,有240个高质量的分离SNPs属于连锁群6,其中223个自信定位在76个连锁群上D阿拉塔脚手架v1。在女性侧,164个高质量的分离SNP被鉴定为属于连锁组6,其中包括154,总共有61人定位D阿拉塔脚手架v1。二十个定位的SNP和35个父母在两位父母之间共同。然后使用定位的SNP之间的成对重组频率为每个父母排序并定向支架。然后使用每支支架(平均2.9)的一至36个SNPs用于雄性,而每支架(平均2.5)每支一个至11个SNPS用于女性。最后,对应于染色体6的重建的雄性和雌性基因组序列分别具有9,306,440bp和8,100,612bp的总长度,其累积长度为4,392,624bp(图。3.).
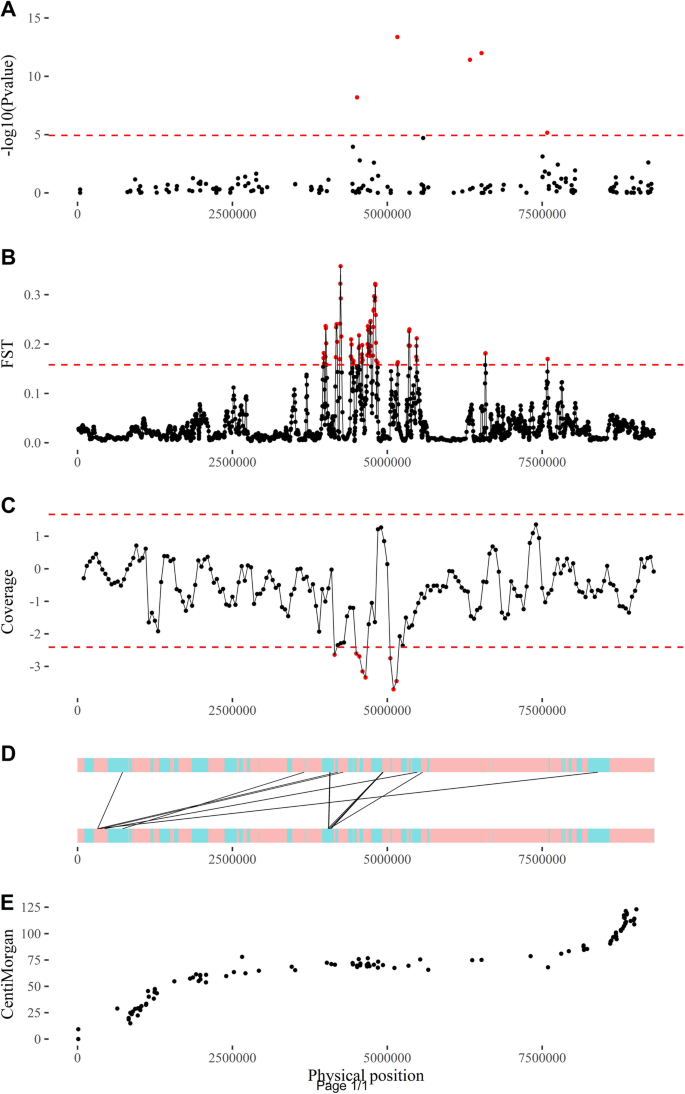
根据成对重组频率,两条染色体都进行了信心重建(附加文件5.:图S5)和物理距离和遗传距离之间的精确对应关系(附加文件6.:图S6)。根据重组雄性6号染色体上的SNP位点,绘制GWAS性别鉴定结果。这表明,如果以显著的SNPs为边界,与性别相关的基因组区域跨度超过3 Mb,从4.51 Mb到7.58 Mb(图1)。4.一个)。
选择签名和结构性变化
采用了几种方法来细化性别相关区域的位置和染色体结构。首次对双亲本群体中的两个雄性和两个雌性DNA库进行了重测序。这总共产生了7.1亿条对端reads,其中6.09%被定位在重构的雄性6号染色体上并在以后使用。
从这些阅读,单核苷酸多态性检测和过滤程序确定188947个高品质的多态性位点在四个DNA池。高度显著分化(置)在雄性和雌性之间被检测到并位于雄性染色体6的着丝粒区域内(图。4.b;额外的文件7.:图。S7)。此外,该结果与在多样性面板上获得的先前结果紧密(图。4.一个)。
然后将映射的读数据按性别合并,以研究读数据的覆盖范围并进行结构变异检测。在男性和女性群体中,沿着这条染色体的中位阅读覆盖率分别为19和20。关于用于评估阅读覆盖率差异的窗口大小,第一个结果显示,男性阅读覆盖率显著低于女性阅读覆盖率(图5)。4.C附加文件6.:图S6)大约5 Mb。
在更精细的尺度上,共检测到59个女性和66个男性的不一致阅读群(可能与结构变异有关),其中9个是女性特异性的,16个是男性特异性的。雄性特异的不一致读丛大多聚集在已经突出的着丝粒区域内(图。4.d;额外的文件8.:图S8)。
讨论
开花的能力
如引言中所述,D阿拉塔繁殖计划被这种物种的不稳定的开花模式阻碍了,从而降低了其交叉潜力。这意味着大多数acade每年都不花花,一旦他们做的花,花就很稀疏[22].因此,应在几个条件下监测表型,以便将“真实”从环保开花的梳理区分中的“真实”的非开花载体,因此促进了遗传值和GWA的准确估计。我们假设通过CRB-PT收集的复发性农业形态表征可能已正确评估非开花表型。在这里,我们通过突出与非开花表型相关的显性等位基因,在山药中繁殖在山药中繁殖遗传障碍。D阿拉塔.
基因组区域参与生殖过程(即雄性配子的产生)的证据通过两个候选基因的存在得到加强:一个同源CDKF4的栽培稻L.和另一个到Sinat2拟南芥蒂利亚纳.CDKF4属于真核生物中保守的丝氨酸/苏氨酸蛋白激酶家族,参与细胞周期调控[23].在O。莎蒂瓦L花芽(NCBI生物项目:PRJNA243371),尤其是成熟花粉中的花芽([24]以及棉花花瓣和雄蕊[25].此外,SinaT2属于E3泛素 - 连接酶,已知是关键的植物激素信号调节器[26].在答:芥(The Arabidopsis Information Resource[拟南芥信息资源]27];). 其活性受CDKG1调控[28,它参与了热敏性雄性减数分裂[29].
更不明确的是,这两个基因也被发现与非生物胁迫反应有关(例如[25那30])。此外,雄性配子的产生和/或对雄性减数分裂的影响似乎与植物开花能力没有直接关系,这可能与花器官发生等机制有关。然而,由于泛素介导的调控和丝氨酸/苏氨酸激酶在植物中是复杂的中枢网络,因此对山药的进一步研究将有助于了解它们可能参与山药开花过程。
非开花的优势等位基因也存在于一半的雌性牧草中,并且在雄性牧场中几乎缺席,因此它与性与性源位的轨迹高,但不在同一染色体上。通过选择可以促进远程LD维护的事实[31表明这种等位基因对雄性健康有有害影响。的确,如果它确实降低/消灭了雄性的适合度,那么选择很可能就发生了,并且在雄性基因库中减少了它的频率。
性别测定和性染色体
染色体6上存在一个XX/XY性别决定系统D阿拉塔首先使用两次婴儿群体中的定量特质基因座QTL方法来确定[16].然而,这一发现可能与亲代特异性有关,特别是对用于产生这两个种群的单个雌性。在这项研究中,我们确认了XX/XY性别决定系统的存在和相关的基因组区域的位置。此外,我们将这些发现扩展到更广泛的范围D阿拉塔使用GWAS登记入册。
两种假说可以解释在[16],即小种群大小和/或存在与异型性染色体相关的低重组区域[32].在这里,我们的结果证实了一个大的着丝粒区域参与性别决定D阿拉塔.男性和女性染色体6之间的显著差异也被强调。此外,在已测序的雄性库与重建的雄性6号染色体之间检测到高度假定的雄性特异性结构变异,从而支持了异型染色体假说。
重建的雄性染色体6实际偏置。遗传和物理距离之间指出的经典形状表明SNP和因此支架被充满置信。然而,检测到SNP,因此它们相应的基因组区域对男性和女性父母很常见。使用的支架也来自女性加入TDA9500038(D alatav1;水芋基因组计划-ftp://yambase.org.).如果Y特定序列确实存在,它们并不存在于我们设计的装配中,所以产生的男性染色体更有可能是假定的Y和X染色体之间的共识,因为X和Y染色体通过减数分裂配对和交换保存同源序列[33].此外,可以假设性关系区域内的男性和女性读取的显着覆盖差异是由于男性(XY)中的单个X拷贝的存在,并且女性(XX)中的两个x复印件。
对山药育种的启示
糖蜜突变体的选择产生了电流D阿拉塔培养多样性([9.那34]. 雄性和雌性表型,以及开花能力,分布在整个研究的多样性小组(附加文件)1:图S1;额外的文件2:图。S2)。因此,两种表型可以通过特定基因库中的突变进行。然而,它们可能在物种多样化过程中出现,这表明所有基因库都可以理论上可以用于传统的育种计划。
本研究中使用的高质量表型,即性别和开花能力,可以通过对CRB-PT收集物中数年的形态特征的单一观察(即如果积累物只开过一次花)来评估。事实上,山药的开花丰度/频率和花粉活力在不同品种间存在很大差异。14])。其他可能解释开花能力变异显著比例的小位点效应现在也应该进行研究。例如,已知“Peter”雄性变异基因型为雌性(XX)会产生少量花粉活力低的小花(E. Maledon, pers。通讯)。
倍增性的加入水平也可能解释本研究和表型突出的遗传因素之间的不匹配。实际上,多倍体导致基因调控和表达的重大变化[35].例如,唯一具有Y等位基因的女性入侵基因型是新氏体,即四倍体。有趣的是,在19份具有非开花等位基因的母本中,有13份为多倍体(4份为四倍体,9份为三倍体)。
然而,性别和非开花表型似乎主要是由基因决定的,因此我们的识别标记可以有效地用于性别和非开花预测。在设计杂交组合之前,可以在育种计划中对可能的亲本组合进行早期准确的估计。这些举措可以与性别/开花遗传决定和倍性水平评估相结合,以避免胚乳不亲和性。此外,明确控制开花能力的遗传因素可以帮助确定有利于开花的环境条件(例如,基因型依赖的温度或日照长度的响应),同时有助于制定促进开花诱导的协议,就像目前木薯开花的情况一样[36]和山药块茎休眠[37].
结论
进行了全基因组关联研究以研究大山药(D阿拉塔)开花能力和性别决定。研究结果强调了1号染色体上的基因对开花能力的贡献和两个基因的表达,其中一个与CDKF4同源栽培稻L.和对Sinat2的另一个同源A. Thaliana。此外,我们证实了在6号染色体上存在一个显性的男性相关等位基因,并且涉及到染色体的很大一部分,从而支持了XX/XY性别决定系统的假设。因此,我们设计了一个KASPar检测作为性别确定的诊断工具。这些有趣的发现可以为确定未来的亲本组合铺平道路,同时促进育种的兴趣性状,如块茎质量和抗病。它们还应该有助于进一步了解作物多样化的过程。
方法
植物材料
共有124只山药(D阿拉塔)利用热带植物生物资源中心(CRB-PT)和CIRAD在西法属印度群岛(瓜德罗普岛)保存的材料进行GWAs分析,以确定与性别决定和开花能力相关的区域9.:表S1)。通过挖掘CRB-PT农业形态描述数据(可在http://intertrop.antilles.inra.fr.),并在花期(12月至1月)对CIRAD材料进行评估。共90份材料,雌性和雄性表型分别编码为0和1。在非开花表型方面,如果采用CRB-PT进行形态学特征分析,则评定为非开花表型,但尚未记录有关其性别的信息。122份材料的开花表型(男性或女性)和非开花表型分别编码为0和1,90份材料中有88份材料的性别决定。
两个F1异交群体的后代,包括一个雌性(74F)和两个雄性(Kabusa和14m),见[16),分别为A (74F × Kabusa)和B (74F × 14m)。这两个群体都用于检测雄性染色体的选择特征和结构变异。群体A也被用来创建性染色体参照序列。
通过测序和SNP筛选进行基因分型
恰好与[中描述的DNA提取,基因分型逐序(GBS)和SNP呼叫和预过滤剂协议完全正常。16)应用。它们是基于[38], [39]和SNP调用和预处理使用过程研究1.0.py软件和vcfprefilter.1.0.py.在VcfHunter包中实现[40].原始测序reads来自[9.]和对齐d . rotundata参考基因组v1(伪染色体BDMI0100001-21 [18];检测单核苷酸多态性。将该方法应用于GWAS和双亲本群体(A, 74F × Kabusa)的性染色体重建。
对于GWAS中使用的预过滤vcf文件的数据集,使用以下过滤器过滤SNPs和加入:最小深度8,每个位点的次要等位基因频率> 5%,每个位点的最大缺失数据< 10%,每次添加的最大缺失数据< 20%。为得到基因分型发病率矩阵,将参考等位基因的纯合型、备用等位基因的杂合型和纯合型分别转换为0、1和2,而不考虑遗传倍性水平。最后,利用90份材料× 4973个SNPs和122份材料× 6033个SNPs分别对性和开花能力进行GWAS分析。
为了重建性染色体(群体A),从预先过滤过的vcf文件中按照以下标准筛选snp和子代:最小深度8,SNP的最大缺失数据< 20%,每个子代的最大缺失数据< 50%,连续SNP之间至少有100 bp,亲本之间有足够的分离(一个亲本纯合子或两个亲本都是杂合子),分离失真χ2测试p值< 1的军医。然后将单核苷酸多态性划分到父系和母系数据集,以确定其在亲本中的分离模式。结果得到110个子代× 5473个单核苷酸多态性,其中单核苷酸多态性在父本中为杂合,在母本中为纯合,或双亲均为杂合;由110个子代× 5866个snp组成的母本杂合snp和父本纯合snp或双亲杂合snp组成的母本基质。SNP和加入过滤采用R scripts (R 3.4.4, R Core Team, 2017),使用vcfR 1.5.0包[41].
基因组协会研究
首先用广义线性模型(用glm函数在R中编码)检验SNP性状关联。根据[40]方法,基于改进的基因分型关联矩阵的主成分分析(PCA),对面板结构进行调查,并采用Tracy-Widow检验。因为只有最大的特征值被评估为显著(p < 0.001), the panel structure was estimated using accession coordinates on the first PCA axis. Then the mixed model procedures Q (i), K (ii), and Q + K (iii) developed by [42使用ASReml-R包[43],表示为:
式中,y是编码为0或1的表型向量;向量1;μ拦截;Q是面板结构分析得到的显著PCA轴上的加入坐标向量;α为被测SNP的加性效应;u是随机多基因效应的向量,假定为正态分布N(0,σ)2yK);其中K是一个相对亲缘关系矩阵,计算为共享等位基因的百分比,S和Z是关联矩阵,ε是残差效应向量。
验证
关于结果,进行了两种类型的验证:使用KASPAR技术或基因本体研究进行基因分型。
KASPar检测的SNP转换如[44[除了湿化学在Cirad Roujol研究站(法国瓜德罗普岛)进行。使用Sniplay3选择多态SNP侧序序列(60bp上游和围绕变体位置下游的60bp)[45].一旦用DNeasy从叶片组织中提取DNA,就使用LGC KASP主混合(31个PCR周期的标准方案)®植物迷你试剂盒(标准提取协议,Qiagen)。总的来说,42份已知倍性水平的材料[9.]进行基因分型,试验纳入8个阴性对照(水或水和混合物)。
基因本体(GO)富集测试使用TopGO R cran软件包(“经典”Fisher测试选项)。GO术语是从注释中提取的D阿拉塔转录组(46]映射到d . rotundata基因组v1可于http://yam-genome-hub.cirad.fr/jbrowse.
染色体重建
对A (74F x Kabusa)双亲代群体110个子代进行了染色体标记分离重建。在每个亲本的基础上进行连锁分析,导致一个女性染色体和一个男性染色体的分离重建。
首先,如前所述,从GBS和vcf筛选得到的基因分型矩阵中,使用JoinMap 4.1软件定义了20个连锁群[47],同时为父母提供7/8的分组LOD阈值。鉴定了属于联动组6的SNP(对应于染色体6的LG6),并对它们的立场上的位置D阿拉塔基因组V1(水纱基因组项目 -ftp://yambase.org.)使用基本的局部对准搜索工具(BLAST)根据[44].
那么D阿拉塔基于它们所含的SNP之间的成对重组频率,对支架进行排序和定向(尽可能)。这是使用南格兰银河系“染色体重建”管道的基于脚手架包来完成[48];可用AT.http://galaxy.southgreen.fr/galaxy/u/droc/p/scaffhunter%2D%2Dchromosome-reconstruction).
重建了雄性和雌性之间的同源性D阿拉塔然后使用Circlize R包使用电路方法来可视化染色体6 [49].
DNA提取和测序
本研究对4个DNA库进行了重测序,分别为74F × Kabusa(雌性36例,雄性38例)和74F × 14m(雌性32例,雄性46例)。每个花期子代由8个叶片组成,以平衡DNA数量,并选择离花较近的叶片以避免藤蔓混合。DNA提取和质量检测如前所述在GenoAgap平台(CIRAD,蒙彼利埃,法国)进行。使用Illumina TruSeq PCR-Free试剂盒进行文库制备和测序。利用Illumina HiSeq3000系统进行2 × 150 bp配对测序。文库制备和测序均在GeT-PlaGe平台(INRAe, Castanet-Tolosan, France)进行。
分异和结构变异的检测
使用F研究雄性和女性差异化圣该方法采用GBS方法,在4个DNA库中检测到单核苷酸多态性,最小深度为20,每个位点的小等位基因频率> 15%,没有缺失数据。F圣利用500个SNPs的滑动窗口(步长= 100个SNPs)评估染色体上的变异。显著性阈值的计算概率为0.01的伽马定律拟合的结果F圣分配。
使用SCAffremodler包检测结构变异[48)可以在https://github.com/SouthGreenPlatform/scaffremodler.首先,通过将原始读数组合通过性别来生成雄性和女性重新排列数据集。这些雄性和雌性数据集在重建的雄性染色体6上单独使用,具有以下参数:最小读取插入尺寸= 150,最大读取插入尺寸= 450和Bowtie2的非常敏感的端到端映射过程[50].然后通过比较两个结果文件,手动识别特定于男性的不和谐读取(可能与结构变体相关)。
从检测不一致reads聚类时进行的对端读图中,男性和女性库的覆盖率差异计算为男性和女性测序深度在200,000 bp (step = 50,000 bp)滑动窗口内的平均差值。显著性阈值的计算概率为0.01的正态律拟合在分布覆盖的结果差异。
数据和材料的可用性
Illumina Hiseq 3000测序原始数据可在NCBI SRA (Sequence Read Archive)中获得,生物项目编号为:PRJNA592336和PRJNA515897。KeyGene N.V.拥有保护其基于序列基因分型技术的专利和专利申请。
缩写
- CDKF4:
-
细胞周期蛋白依赖性激酶f - 4
- CRB-PT:
-
热带植物生物研究中心
- 脱氧核糖核酸:
-
脱氧核糖核酸
- 罗斯福:
-
错误发现率
- GBS:
-
基因分型结果进行排序
- GWAS:
-
全基因组关联研究
- INRAe:
-
Institut National de La Recherche Agroronice
- 卡斯帕尔:
-
竞争性等位基因特异性PCR标记
- LD:
-
连锁不平衡
- PCA:
-
主要成分分析
- 本考察团:
-
定量特征核苷酸
- QTL:
-
数量性状位点
- SINAT2:
-
E3泛素 - 蛋白质连接酶
- SNP:
-
单核苷酸多态性
参考
- 1.
Witcombe JR, Virk DS。参与式和经典植物育种的杂交数和群体大小。Euphytica。2001;122(3):451 - 62。https://doi.org/10.1023/a:1017524122821.
- 2.
Allen Am,Hiscock SJ在Agenperms中自我不相容系统的演变和系统发育。在:开花植物中的自我兼容。柏林,海德堡:斯普林克;2008年。https://doi.org/10.1007/978-3-540-68486-2_4.
- 3.
Levy YY,迪恩C。向开花的过渡。植物细胞。1998;10(12):1973–89.https://doi.org/10.1105/tpc.10.12.1973.
- 4.
作物物种进化:驯化和多样化的遗传。Nat Rev Genet. 2013;14(12): 840-52。https://doi.org/10.1038/nrg3605.
- 5.
Hardigan Ma,Laimbeer FPE,Newton L,Crisovan E,Hamilton JP,Vaillancourt B等人。结核病菌根的基因组多样性揭示了栽培马铃薯的复杂进化历史和驯化目标。PROC NATL ACAD SCI。2017; 114(46):E9999-10008。https://doi.org/10.1073/pnas.1714380114.
- 6.
克隆性对植物有性生殖的影响。自然科学学报,2015;112(29):8859-66。https://doi.org/10.1073/pnas.1501712112.
- 7.
Viruel J,Segarra-Moragues JG,Raz L,Forest F,Wilkin P,Sanmartin I等。晚期白垩纪早期何时山药薯蓣属,Dioscoreaceae)在桂香Palaearctic及其随后的低聚烯 - 中烯多样化。j生物纪元。2016; 43(4):750-62。https://doi.org/10.1111/jbi.12678.
- 8.
关键词:薯蓣(Dioscorea alata L.),细胞遗传学,微卫星分离,倍性中国生物医学工程学报,2009;https://doi.org/10.1007/s00122-009-0977-6.
- 9.
Sharif BM, Burgarella C, Cormier F, Mournet P, Causse S, Van KN,等。全基因组基因分型分析揭示了山药多倍体和无性系繁殖的地理多样性和散布性。安机器人。2020;126(6):1029 - 38。https://doi.org/10.1093/aob/mcaa122.
- 10。
亚伯拉罕K,Nair PG。与Dioscoreaalata L.(Dioscoreaceae)相关的多倍体和无菌。genetica。1991; 83(2):93-7。https://doi.org/10.1007/BF00058525.
- 11.
Kouakou Am,Yao GF,Brice Dibi Ke,Mahyao A,Lopez-Montes A,Essis BS等。COTE D'IVOIRE中的山药种植系统:现行实践和约束。EUR SCI J ESJ。2019; 15。https://doi.org/10.19044/esj.2019.v15n30p278.
- 12
大山药同源四倍体无性系减数分裂与有性育性薯蓣属alata中国科学院植物研究所,2013;https://doi.org/10.1007/S10722-013-9973-4.
- 13
尼莫林A、大卫J、马莱登E、努多尔E、达隆J、阿诺G。微卫星和流式细胞仪分析有助于了解薯蓣多倍体的起源。安·博特。2013;112(5):811–9.https://doi.org/10.1093/aob/mct145.
- 14
Lebot V,亚伯拉罕K,Kaoh J,Rogers C,MolisaléT。较大山药(Dioscorea Alata L.)的抗碱抗性杂种的开发与D. nummularia lam的特异性杂交。遗传资源作物evol。2019; 66(4):871-83。https://doi.org/10.1007/s10722-019-00756-y.
- 15
eounou AE, Kouakou AM, N 'zi JC, Dibi KEB, Bakayoko Y, Essis BS等。山药种内杂交制取杂交种子薯蓣属alatal,vol。8;2018. p。11.
- 16.
Cormier F, Lawac F, Maledon E, Gravillon M-C, Nudol E, Mournet P,等。大山药高密度遗传参考图谱。中国生物医学工程学报,2019;https://doi.org/10.1007/s00122-019-03311-6.
- 17.
大山药的遗传多样性(薯蓣属alata答案:D。nummularia林。和d . transversa布尔。正如AFLP标记所透露的那样。遗传资源作物evol。2005; 52:919-29。https://doi.org/10.1007/s10722-003-6122-5.
- 18.
田江,夏目漱石,高木,白木等。对主要粮食作物白几内亚山药的基因组测序使性别确定的分子标记的开发成为可能。BMC医学杂志2017;15(1):86。https://doi.org/10.1186/s12915-017-0419-x.
- 19.
马丁·弗兰克-威廉姆斯。薯蓣属植物的性别比与性别决定。J在这里。1966;57(3):95 - 9。https://doi.org/10.1093/oxfordjournals.jhered.a107485..
- 20。
Terauchi R, Kahl G. Mapping of Dioscorea tokoro genome: AFLP markers linked to sex, vol. 42;1999.11页。
- 21。
Girma G,Natsume S,Carluccio AV,Takagi H,Matsumura H,Uemura A等。白色亚马山药鉴定候选开花和性别基因(d . rotundata Poir。)通过超越转录组分析。预印刷品。植物BIOL。2019年。https://doi.org/10.1101/626200.
- 22。
黄建平,李建平。人工传粉与花生物学。北京:科学出版社薯蓣属alataL. Euphytica1990; 48:45-51。
- 23
Malumbres M.周期蛋白依赖激酶。基因组医学杂志。2014;15(6):122。https://doi.org/10.1186/gb4184.
- 24
Fujita M,Horiuchi Y,Ueda Y,Mizuta Y,Kubo T,Yano K,等。稻米表达阿特拉斯在生殖发展中。植物细胞生理。2010; 51(12):2060-81。https://doi.org/10.1093/pcp/pcq165.
- 25
马旺加,陆平,基伦古,蔡欣,周忠,王旭,等。棉花细胞周期蛋白依赖激酶(Cyclin dependent kinase, CDK)基因家族全基因组分析及CDKF4基因在植物耐干旱、耐盐中的功能评价国际分子科学杂志。2018;19(9):2625。https://doi.org/10.3390/ijms19092625.
- 26
泛素连接酶:植物激素信号转导的关键调控因子。Mol细胞蛋白质组学。2018; 17(6): 1047 - 54。https://doi.org/10.1074/mcp.mr117.000476.
- 27
Schmid M,Davison Ts,Henz Sr,Pape Uj,Demar M,Vingron M等。拟南芥发展的基因表达图。NAT Genet。2005; 37(5):501-6。https://doi.org/10.1038/ng1543.
- 28.
Chen Y,Fokar M,Kang M,Chen N,Allen Rd,Chen Y. Cdkg1的拟南芥SINA2的磷酸化影响其泛素连接酶活性。BMC植物BIOL。2018; 18(1):147。https://doi.org/10.1186/s12870-018-1364-8.
- 29.
郑T、尼保C、菲利普斯DW、詹金斯G、阿姆斯特朗SJ、杜南JH。CDKG1蛋白激酶在拟南芥突触和雄性减数分裂中起重要作用。美国国家科学院学报。2014;111(6):2182–7.https://doi.org/10.1073/pnas.1318460111.
- 30.
宝益,王C,江C,潘j,张g,刘开。肿瘤坏死因子受体相关因子(TRAF)在缺失2(SINA2)中占缺陷2(SINA2)以ABA依赖性方式促进拟南芥的耐旱性。新植物。2014; 202(1):174-87。https://doi.org/10.1111/nph.12644.
- 31。
联系不平衡-理解进化的过去和绘制医学的未来。李建平。2008;9(6):477-85。https://doi.org/10.1038/nrg2361.
- 32。
Kumar S,Kumari R,Sharma V. Diocy的遗传学和植物中因果性染色体。J Genet。2014; 93(1):241-77。https://doi.org/10.1007/s12041-014-0326-7.
- 33。
Otto SP,Pannell Jr,Peichel Cl,Ashman T-L,Charlesworth D,Chippindale Ak等。关于PAR:伪变截道区域的独特进化动态。趋势类型。2011; 27(9):358-67。https://doi.org/10.1016/j.tig.2011.05.001.
- 34。
van enbroucke H, Mournet P, Vignes H, Chaïr H, Malapa R, Duval MF等。芋头体细胞无性系变异(Colocasia esculenta肖特)和山药(薯蓣属alataL.)被纳入瓦努阿图农民的品种组合。基因资源作物进化。2016;63:495–511.
- 35
陈ZJ。植物多倍体基因表达和表型变异的遗传和表观遗传机制。植物生物学杂志。2007;58(1):377-406https://doi.org/10.1146/annurev.arplant.58.032806.103835.
- 36
海德Pt,guan x,abreu v,setter tl。抗乙烯生长调节剂银硫代硫酸盐(STS)增加了木薯(Manihot Esculenta Crantz)的花卉生产和寿命。植物生长调节。2020; 90(3):441-53。https://doi.org/10.1007/s10725-019-00542-x.
- 37
哈马迪纳E.玉米斯科西亚罗德纳塔肿块休眠期的持续时间:植物生长调节剂的影响及其与块茎年龄的关系。J Adv Biol。2015; 7:1230-7。
- 38
Risterucci A-M, hipolyte I, Perrier X, Xia L, Caig V, Evers M,等。Musa植物高通量DNA分析多样性阵列技术的发展与评价。中国生物医学工程学报,2009;https://doi.org/10.1007/S00122-009-1111-5.
- 39
Elshire RJ、Glaubitz JC、Sun Q、Poland JA、Kawamoto K、Buckler ES等。一种用于高多样性物种的稳健、简单的测序基因分型(GBS)方法。公共科学图书馆一号。2011;6(5).https://doi.org/10.1371/journal.pone.0019379..
- 40.
Garsmeur O, Droc G, Antonise R, Grimwood J, Potier B, Aitken K等。甘蔗高度复杂基因组的镶嵌单倍体参考序列。Nat Commun。2018;9(1):2638。https://doi.org/10.1038/s41467-018-05051-5.
- 41。
knaus bj,grünwaldnj。VCFR:用于操纵和可视化R. Mol ECOL Resour中的变体呼叫格式数据的包。2017; 17(1):44-53。https://doi.org/10.1111/1755-0998.12549.
- 42。
余江明,Pressoir G,Briggs WH,Bi IV,Yamasaki M,Doebley JF,等。一种考虑多层次关联性的关联映射统一混合模型方法。纳特·吉内特。2006;38(2):203–8.https://doi.org/10.1038/ng1702.
- 43。
Butler DG, Cullis BR, Gilmour AR, Gogel BJ, Thompson R. ASReml估计一般线性下的方差分量。VSN International Ltd, Hemel Hempstead, HP1 1ES, UK;2018.
- 44。
Cormier F,Mournet P,Cause S,Arnau G,Maledon E,Gomez R-M等人。用于管理更高亚马种质收集的成本效益单核苷酸多态性基因分型阵列的开发。ECOL EVOL。2019; 9:5617-36。https://doi.org/10.1002/ece3.5141.
- 45。
等。关键词:聚类;聚类;SNiPlay3:一个基于网络的应用程序,用于探索和大规模分析基因组变异。核酸研究2015;43(Web服务器版):W295-300。
- 46。
关键词:神经网络,神经网络,神经网络,神经网络26个新的参考转录组致力于作物和野生近缘植物的比较群体基因组学。分子生态资源。2017;17(3):565-80。https://doi.org/10.1111/1755-0998.12587.
- 47
范ooijen JW。JoinMap 4.1,用于计算二倍体物种实验群体遗传联系地图的软件。Kyazma Bv,Wageningen,荷兰;2012年。
- 48
作者简介:Martin G, Carreel F, Coriton O, Hervouet C, Cardi C, Derouault P, et al。香蕉基因组(Musa acuminata)的进化受到染色体易位的影响。2017;34(9): 2140-52。https://doi.org/10.1093/molbev/msx164.
- 49
acta physica sinica, 2014, 40(6): 1191 - 1196 .顾振华,顾l, Eils R, Schlesner M, Brors B. Circlize implementation and improved circular visualization in R. Bioinformatics. 2014, 40(6): 1191 - 1196。https://doi.org/10.1093/bioinformatics/btu393.
- 50.
Langmead B,Salzberg SL。与Bowtie 2. NAT方法的快速喷射读取对齐。2012; 9(4):357-9。https://doi.org/10.1038/nmeth.1923.
确认
作者要感谢Elie Nudol、Minfort Louis、Marie-Claire Gravillon、Suzia Gelabale、Rose-Marie Gomez和Claudie Pavis参与CRB-PT和CIRAD的体外和野外保护行动。
资金
这项工作得到了欧盟和瓜德罗普地区的财政支持(项目Opérationnel FEDER -瓜德罗普-康塞尔Régional 2017-2020)。这些资金被用于研究领域和基因分型实验以及LL的奖学金。
作者信息
隶属关系
贡献
DC,YF提供了CRB-PT收集的表型数据和叶样品。Ga和Em提供了致循环集合的表型数据和叶样本。SC和HV提取DNA并制备GBS文库。HC,PM和FC进行了SNP检测和过滤。FC和GM执行了分析。LL和FC执行了Kaspar验证。FC,HC和GM设计了实验并写了稿件。所有作者都参与了解释,审查并批准了最终手稿。
通讯作者
道德宣言
伦理批准和同意参与
作者声明,这些实验符合他们所进行的国家的现行法律。
同意出版
作者声明他们都同意出版。
利益争夺
作者声明他们没有利益冲突。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
附加文件1:图S1。
关于GWAS关于性别决定的细节(女性或男性的开花加入)。A)计算出面板结构前10个PCA特征值的Barplot。B)基于前5个主成分分析轴坐标的聚类。r cran,hclust函数,“ward.d2”方法。红色,女性access;蓝色,男性牧师。C) GWAS结果的QQplot。上/左,广义线性模型;/右,P模型;下/左K模型,下/右PK模型。
附加文件2:图S2。
关于非开花表型的GWAS细节。A)计算出面板结构前10个PCA特征值的Barplot。B)基于前5个主成分分析轴坐标的聚类。r cran,hclust函数,“ward.d2”方法。紫色,无花到达;黑色,花期登记入册。C) GWAS结果的QQplot。上/左,广义线性模型;/右,P模型;下/左K模型,下/右PK模型。
附加文件3:图S3。
与非开花/开花表型相关的基因组区域的细节。A)序列同源点图d . rotundata和D阿拉塔.dotplot是使用NCBI blastn web服务器(不连续的megablast,默认参数)计算的d . rotundata染色体BDMI01000001.1序列(d . rotundata基因组V1 [18];)在y轴和D阿拉塔脚手架112(D阿拉塔基因组v1)在x轴上。B)基因组区域内显著富集的G.O.术语的摘要。G.O.术语是从注释中提取的D阿拉塔转录组(46]映射到d . rotundata基因组v1,可在http://yam-genome-hub.cirad.fr/jbrowse.采用TopGO R cran软件包(“经典”Fisher测试选项)进行G.O term富集分析d . rotundata从50 kb到250 kb的基因组区域d . rotundata染色体BDMI01000001.1。
附加文件4:图S4。
性相关SNP的KASPar验证详情(06.119660282)。A) SNP侧翼序列和B)KASPar荧光结果。荧光信号按加入、倍性和观察到的性别绘制。在x中,是“A”荧光等位基因,在y中是“G”荧光等位基因。
附加文件5:图。S5。
:重建雄性和雌性染色体6的重组频率的圆形夹板D阿拉塔.A)男性6号染色体和B)女性6号染色体。重组频率计算来自双亲本群体(74F x Kabusa)的110个子代。支架的D阿拉塔使用基因组V1。染色体重建管道可在:http://galaxy.southgreen.fr/galaxy/u/droc/p/scaffhunter%2D%2Dchromosome-reconstruction.
附加文件6:图。S6。
沿着两个重建的性染色体6的物理和遗传距离。,男性染色体;下来,女性染色体。利用JoinMap 4.1软件计算遗传距离(Van Ooijen, 2012;选项:重组频率低于0.45,LODs超过1.0,ripple值1,回归映射和Kosambi映射函数)。
附加文件7:图S7。
关于男性和女性重型比较研究的意义阈值的详细信息。a)男性和女性与雌性和意义阈值的定义的分布。使用500个SNP的滑动窗口(步骤= 100个SNP)来计算FST。然后评估显着性阈值0.158。b)男性和女性阅读覆盖的差异。使用了200,000bp的滑动窗口(步骤= 50,000bp)。在6.67和2.59中评估阈值分别在6.67和2.59中分别对男性和女性的过度覆盖和覆盖范围的意义。对于两种分析,使用Fitdistrplus R Cran库(红色曲线)的FITDIST功能拟合伽马分布。然后使用0.01的风险评估显着性阈值(垂直红线)。
附加文件8:图S8。
CIRCOS可视化男性特定的不间断的读取簇。使用Scaffremodler包(Martin等,2017)检测到不和谐的读取簇(推定的结构变体)https://github.com/SouthGreenPlatform/scaffremodler.雄性和雌性重测序数据分别用于重建的雄性6号染色体。默认选项与预期的正反向读取方向以及最小和最大插入大小分别设置为150和450 bp一起使用。然后通过比较两个结果文件,对男性特定的不一致读集群进行裁剪。链接颜色:红色,删除;蓝色,reverse-forward;脚手架,黑色或黄色;由黑色到蓝色的Barplot取决于男性阅读深度和男性和女性池之间的覆盖率差异图(步长:500 bp;窗口:1000个基点)。
附加文件9:表S1。
本研究中使用的附加属性:开花和性。
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
科米尔,F,马丁,G,维涅斯,H。et al。山药开花的遗传控制(薯蓣属alataL.)。BMC植物杂志21,163(2021)。https://doi.org/10.1186/s12870-021-02941-7
已收到:
公认:
发表:
关键字
- 雌雄异株
- 薯蓣属alata
- 性别
- 开花
- 繁殖
- GWAS
- 繁殖
- 山药