摘要
背景
尽管百慕大草具有良好的耐盐性,但与时间盐反应有关的关键基因和途径(香附子(l)Pers.)尚未被探索。因此,在本研究中,为了了解不同盐暴露时间下的潜在调控机制,我们对百慕大草根系进行了全面的转录组分析。
结果
研究了百慕大草根系在200 mM NaCl水培1 h、6 h、24 h后转录本的调控情况。数据集系列分析揭示了16种不同的盐反应表达谱。富集分析发现可能重要的盐反应基因属于特定的类别,如激素代谢,次生代谢,杂化。、细胞壁、转录因子和基因编码一系列转运体。加权基因共表达网络分析(WGCNA)结果表明,lavenderbruth2和brown4模块与脯氨酸含量和过氧化物酶活性呈显著正相关,并进一步确定了这两个模块内的轮毂基因。此外,盐处理1 h后,信号受体激酶、转录因子、四吡啉合成、脂质代谢等类基因与后续时间点相比,立即、专一地上调,表明生理反应迅速、立时。单纯酚类、硫代葡萄糖苷类、异黄酮类、生育酚类次生代谢物合成相关基因在盐处理24 h后全部上调,表明代谢调节反应稍慢。
结论
在本研究中,我们发现了在短期盐胁迫中盐响应基因的共同或差异表达,提示了根系可能的适应性盐响应机制。此外,所研究的独特的盐反应途径和潜在的耐盐中心基因可为探索百慕大草的分子机制提供有用的参考。
背景
土壤盐分是限制植物生长发育的重要非生物因子。为了减轻盐诱导的渗透胁迫、离子毒性和氧化损伤,植物进化出了一系列生理和分子响应机制[1,2,3.].普通的百慕大草(香附子(l)Pers.)是一种广泛使用的草皮种,可通过匍匐茎、根茎和种子传播[4,5].尽管具有较好的耐盐性,但种内变异较大。因此,盐度胁迫会严重抑制相对敏感品种的生长发育,大大限制了百慕大草在盐渍土壤中的推广应用[6,7].因此,深入分析耐盐机理,挖掘关键响应基因和途径,将有助于其在盐碱化环境中的应用。
在植物中,盐胁迫引发全基因组转录组重编程,以响应这种环境刺激。因此,与许多生理性状和盐反应通路相关的基因组被调节以减轻不良影响,使盐反应成为一个复杂的数量性状[1,8].当植物感知到来自环境的盐胁迫信号后,多种信号转导通路立即被迅速激活[9,10和钙离子(钙离子)的升高2+)专注是对外界刺激的第一反应之一。11].为了应对压力,刺激的作用可能会减弱2+传感器(如CBLs:钙调神经磷酸酶b样蛋白;CIPKs: Ca2+-独立蛋白激酶;CDPKs: Ca2+-依赖蛋白激酶;cml:类钙调蛋白)[11]先于一系列反应,如SOS(盐过度敏感)和MAPK(丝裂原激活蛋白激酶)通路[12,13,14].在Ca2+信号,其他第二信使,如活性氧(活性氧)也参与[3.].尽管ROS可以作为信号分子响应环境线索[2,15],过量积累可导致细胞氧化损伤[16].为了抑制ros诱导的氧化损伤,植物进化出了一个复杂的清除系统,包括抗氧化剂酶(如超氧化物歧化酶,SOD;过氧化物酶,豆荚;过氧化氢酶(CAT)和非酶清除物(如生育酚;类胡萝卜素;酚)已经被开发用来清除过度产生的ROS,保护自己免受盐诱导的氧化应激[17,18].此外,植物激素介导的信号通路(如生长素;脱落酸,ABA;茉莉酸,JA;细胞分裂素与原;赤霉素GA;乙烯,ETH)也在植物在环境刺激后的适应性生长中发挥关键作用[19].
为了进一步保护植物免受损害,激活的级联如Ca2+、ROS和激素信号级联可进一步激活其他调控因子,如转录因子(如aba响应元件结合蛋白/ aba结合因子,ABRE/ABF) [20.来调节其他下游的盐反应基因。例如,据报道,在对初始渗透胁迫的初始反应中,调节渗透保护剂水平的基因是第一个胁迫诱导转录本。提高细胞内的渗透液浓度,如脯氨酸、可溶性糖和脱氢酶,以提高细胞渗透压[2,21].在长时间暴露于盐胁迫后,采用其他策略来缓解钠+毒性(24小时或更长时间),例如,离子转运体HKT(高亲和力K+NHX (Na+/小时+反转运蛋白)基因家族可能被调控以进一步隔离或分隔多余的钠+在细胞质K含量较高的液泡中+/ Na+和抗盐胁迫的糖类植物[22,23].在大豆中,处理24 h及以上后,幼苗进入光合速率和气孔导度降低的新生理状态,随之而来的是Na的积累+在叶子中可能对植物有害。因此,24 h可能是许多植物盐反应策略开始改变的转折点[24].
在过度的盐暴露下,根系是最先检测到胁迫的器官,由于根部与嫩枝的距离更近,根系可能遭受更多的伤害[25,26].因此,根系感知到早发的渗透胁迫并作出反应。随后,这些最初的反应可以传递到整个植物[2].这使得根系成为研究植物耐盐和适应的分子机制的理想敏感靶点[27].在其他物种中,迄今为止已经完成了一些根系中盐响应的转录组学研究[24,28,29].在百慕大根中,使用两个耐盐水平不同的品种,在盐胁迫7天后进行转录组分析[30.].然而,涉及多时间点间早期盐反应的百慕大草根系转录组学研究还未见报道。在评估植物对胁迫因子的响应时,考虑这些时间动态变化可以为表达谱提供更系统的分析[25,28,29].本研究通过对短时间盐胁迫下基因表达重编程的研究和比较,探讨了百慕大草根系盐响应基因的共享和排他响应模式及表达连接。发现了盐胁迫早期诱导的一些关键调控途径、基因家族和枢纽基因。这些结果可以对百慕大草的盐盐早期响应转录图谱进行一个概述,为进一步研究百慕大草的盐盐响应提供更多有用的信息。
结果
盐胁迫对百慕大草根系生理参数的影响
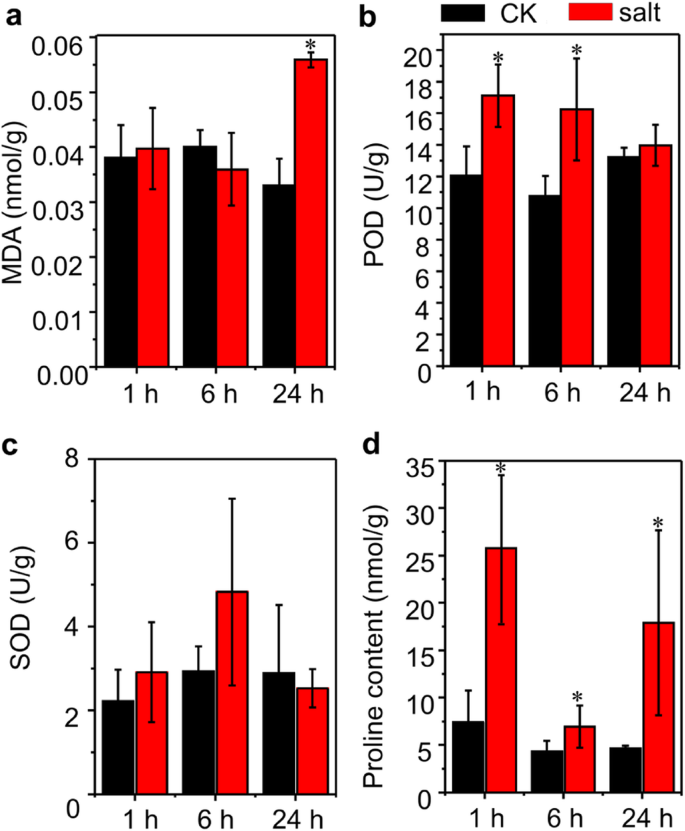
为研究百慕大草根系对盐胁迫的早期响应,分别用200 mM NaCl处理1 h、6 h和24 h。采集根系样品进行生理参数测定和转录组分析。由于暴露在盐胁迫下的时间相对较短,生长参数如株高、芽生物量和根长没有受到显著影响(数据未显示)。然而,生理上,盐处理24小时的植株根系显示出高于对照植株的丙二醛(MDA)含量(图1)。1a).与对照相比,盐处理1 h和6 h的植株根系中POD活性显著升高(图1)。1b).盐处理1 h和6 h的根系SOD活性有上升趋势,但与各自对照植株相比上升不显著(图2)。1c).此外,与非盐胁迫条件相比,盐胁迫诱导根系积累了更多的脯氨酸(图5)。1d).这些代谢物的积累表明,在用于转录组分析时,植物根系正在经历盐胁迫并产生胁迫反应。
百慕大草根系差异表达基因的一般转录组反应和表达谱
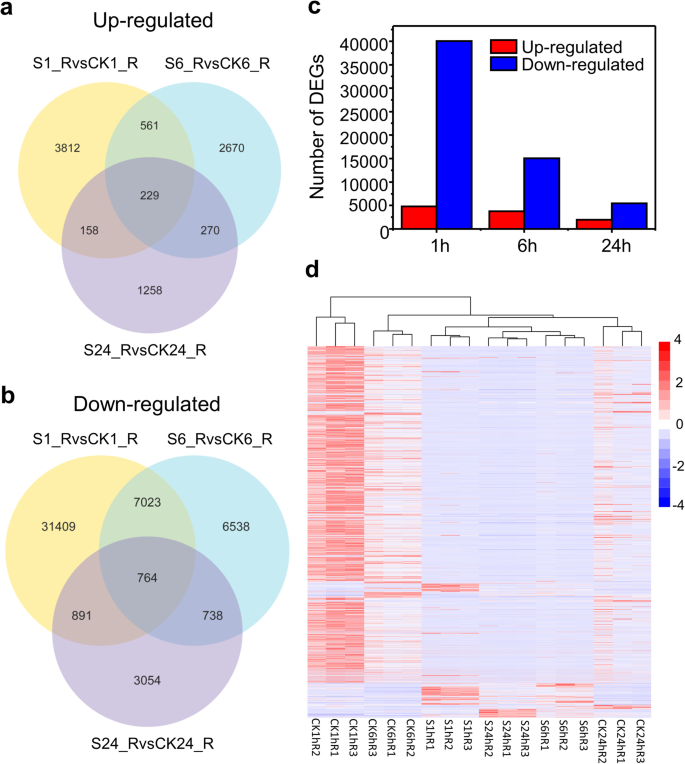
共获得695,542个转录本和694,799个unigenes, N50为1391 bp。基因表达分析表明,58,979个基因的表达在一个或多个时间点对盐胁迫的响应发生了显著变化。Venn图显示,在三个时间点,上调基因229个,下调基因764个(图4)。2a, b)。盐胁迫上调基因中,3812、2670和1258个基因分别在1 h、6 h和24 h内表达。2a).在下调基因中,有31409个基因的表达在1 h时被特异性调控;6538个基因的表达仅在6 h时被调节,而3054个基因的表达在24 h时完全被调节(图。2b;表格S1).总的来说,大部分响应基因在NaCl处理的三个时间点都表达下调(图1)。2c).此外,盐处理1 h后差异表达基因(DEGs)的数量相对于盐处理6 h和24 h后差异表达基因(DEGs)的数量较多(图1)。2c, d)。
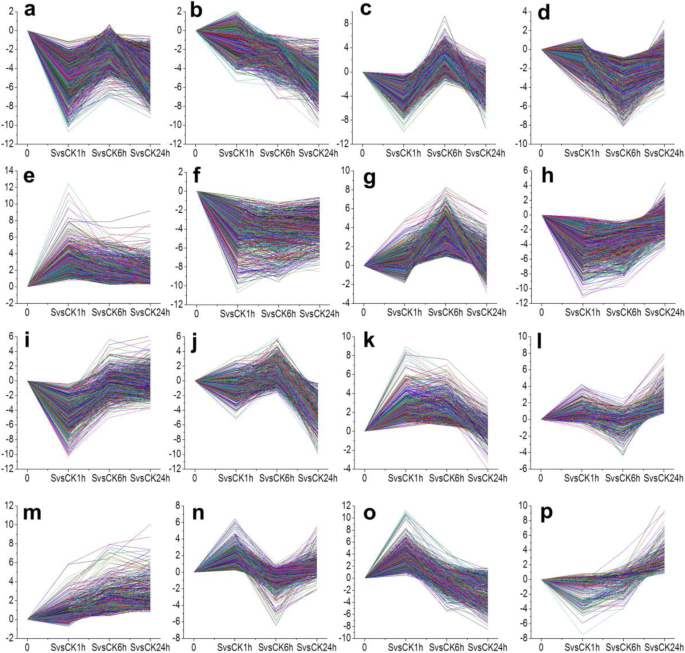
为了检测DEGs的表达模式,STEM (Short Time-series expression Miner,短时间序列表达矿工)软件包(表S1),识别出16种不同的时间表达模式(图。3.).主要图谱显示,在盐处理后,大多数DEGs的表达模式在盐处理后的前1小时内发生了快速变化(图1)。3.).一些基因表达在1小时达到峰值(抑制或诱导)(图。3.e, i, o),而其他组基因在6 h时达到峰值(图。3.d, g)或24 h。3.b, j, l, m, p)。一些在1 h有反应的基因在随后的时间点继续沿着相同的轨迹(图1)。3.b, m)或恢复到未处理的状态水平(图。3.i, o)。部分基因在1 h时被诱导并持续存在(图。3.e, f)。其他基因在24小时前出现轻微变化(图。3.l, p)。此外,与1 h或24 h相比,一些基因在6 h时表现出相反的诱导和抑制模式(图1)。3.c, n)。部分基因在1 h和6 h时出现中度反应,在24 h时出现轻微反应(图2)。3.h, k)。还有一些在1 h时被抑制的基因在6 h时轻度抑制,在24 h时达到高度抑制表达(图。3.a).这些基因表达谱表明百慕大根可能存在时间特异性的响应模式。
顺表达基因的功能分类
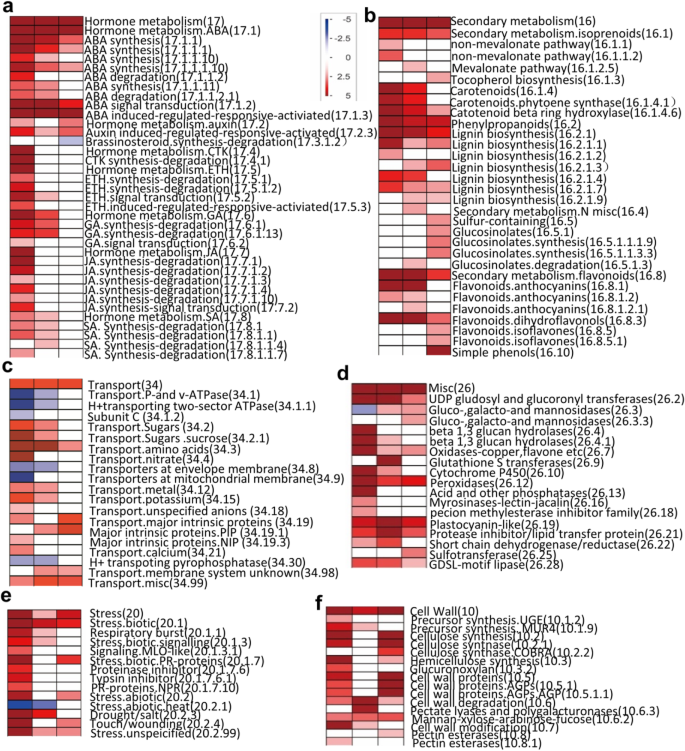
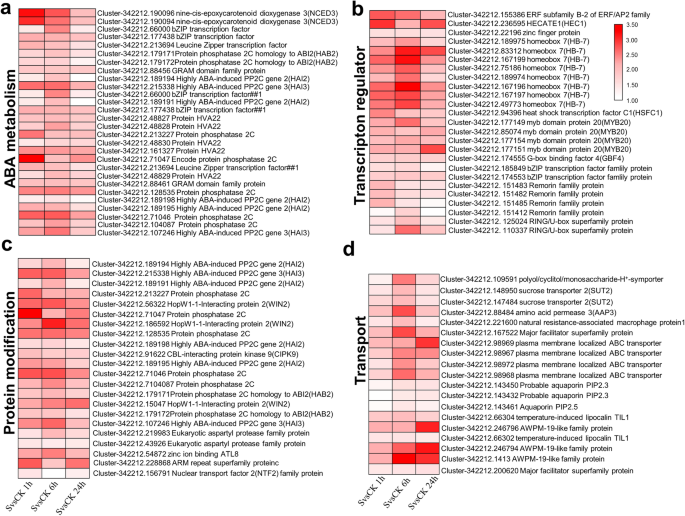
为了了解不同类别基因的转录本模式变化,检测不同表达基因的存在,我们利用PageMan分析分析不同响应时间点的富集转录本与其生物学意义之间的关系。结果表明,箱参与主代谢(2)、细胞壁(10)、次生代谢(16)、激素代谢(17)、应激(20)、杂化。(26)、发育(bin 33)和运输(34)都是富集的(图。4f;表格S2),而DNA(28)、蛋白质(29)、能量相关(8:TCA/org转化;9:线粒体电子转运/ATP合成)和细胞相关的仓(31)在所有三个时间点都显示盐胁迫下上调基因的显著消耗(图3)。S1;表格S2).这些持续上调的基因主要包括参与ABA合成和信号转导的基因(如9-顺式-环氧类胡萝卜素双加氧酶,NCED;蛋白磷酸酶2C, PP2C;ABRE结合因子(ABFs)5a),转录因子(如HB, MYB和bZip的成员)(图。5b),几组转运蛋白(图。5D)(例如糖、氨基酸、多肽和寡肽的转运体;ABC转运蛋白;多药耐药系统;主要内在蛋白。pip),调节渗透保护剂水平的基因(如s -腺苷甲硫氨酸脱羧酶;galactinol合成酶;棉子糖sythases;海藻糖;胼胝质;半乳糖)、编码抗氧化酶(如过氧化物酶)、参与氧化酶应激的基因(如氧化酶-铜、谷胱甘肽S转移酶、β 1,3葡聚糖水解酶、质体青素样蛋白)和其他蛋白质(如参与渗透应激反应的胚胎晚期丰富蛋白和awpm -19样膜家族蛋白)的转录本;参与苯丙类、类胡萝卜素、类黄酮和多胺代谢的基因,如4-香豆酸辅酶a连接酶1 (4CL-like)、过氧化物酶1、植物烯合酶基因(PSY3)和2-氧戊二酸(2OG)和Fe(II)依赖的加氧酶超家族蛋白)(图。S2一个;表格S1).尽管蛋白质合成和氨基酸激活子仓在所有三个时间点都显示出上调基因的显著缺失,但蛋白质修饰子仓显著富集了上调基因(如PP2C、HAB、HAI、WIN、CIPK家族成员)(图1)。5c).然而,参与蛋白翻译修饰的基因,如激酶和泛素化通路相关基因上调(图5)。S3).
盐反应基因在不同时间点的分类
盐处理在不同时间点触发排他反应(表S2).例如,在盐暴露1小时后,参与信号转导酶(30)的受体样激酶子bin(30.2)明显过度表达(表S2;无花果。S4a),包括富含亮氨酸重复序列(LRR V、VIII和XII)、桃红素样受体、Catharanthus roseus-like RLK1、未知功能域(DUF) 26、豆类凝集素域(LLD)、LRK10样受体;赖氨酸基序、脯氨酸延伸样蛋白(PERK)、s位点糖蛋白样蛋白和壁相关受体激酶(WAK)。一些钙信号相关基因(如钙依赖性蛋白激酶CDPK11;钙调蛋白,CAM3;钙调蛋白结构域蛋白激酶(CPK5);calmodulin-like CML43)。与At2g43790同源的丝裂原激活蛋白激酶MAPK2 (cluster-342,212.26954)也在1 h时上调(图。S2b).参与激素代谢(17)的子仓,如JA合成-降解(17.7.1)和信号转导(17.7.2)、CTK代谢(17.4)和ETH代谢(17.5)在1 h被特异性诱导(表S2;无花果。4a).参与ETH生物合成(1个ACC合成酶和4个ACC氧化酶)、乙烯信号转导(3个ERF和1个DREB)、JA生物合成(1个烯氧化物合成酶,AOS1;1个烯氧化物环化酶(AOC4)、JA信号转导(JAZ1)和CTK代谢降解(5个udp -糖基转移酶和9个细胞分裂素氧化酶)在1 h盐处理下显著上调,表明这些激素可能参与了根对盐胁迫的早期反应(表4)S2,无花果。4a).此外,一系列tf子箱(例如ARF: 27.3.4;加勒比海盗:27.3.12;摘要:27.3.5;南京:27.3.27;Trihelix: 27.3.30;AS2: 27.3.37;JUMONJI: 27.3.57;PHOR1: 27.3.64;pdo ARR: 27.3.68)在盐处理1 h后与之后的时间点相比出现了过多的表达,这意味着这些转录因子可能只参与了百慕大草根系的早期盐反应(表2)S2;无花果。S5).其他基因也在1小时内单独表达,包括几组转运蛋白(如。主要内含蛋白NIP, PIP);应激反应分子(如类型蛋白酶抑制剂、PR蛋白、mlo样受体)、脂质代谢(如胆碱激酶)(见表S2).
与后两个时间点(分别为1小时16个,6小时10个和24小时11个)相比,PageMan富集的图谱箱在植物暴露于盐下1小时后出现了过多的表现(图2)。S6).其中包括四吡咯合成仓(19)(图19)。S4c),异种生物的生物降解(24)。S4e),脂质代谢(11)。S4b),表明对盐的反应相对较早(图。S4).然而,只有在盐处理6小时和24小时后,多胺合成亚仓才出现过代表(图。S6).在次生代谢仓中,与类异戊二烯、苯丙和类黄酮代谢相关的亚仓在盐暴露的三个时间点均出现上调。然而,次级代谢(16)中包括一些子库,如单酚(16.10),硫代葡萄糖苷(16.5.1),异黄酮(16.8.5)和生育酚生物合成(16.1.3)(表S2)在24 h时过度表达(图。4B),表明对盐的反应稍有延迟。这些结果表明,在感知盐胁迫后,不同盐反应类型的调控因子或效应因子可能在不同时间点激活。
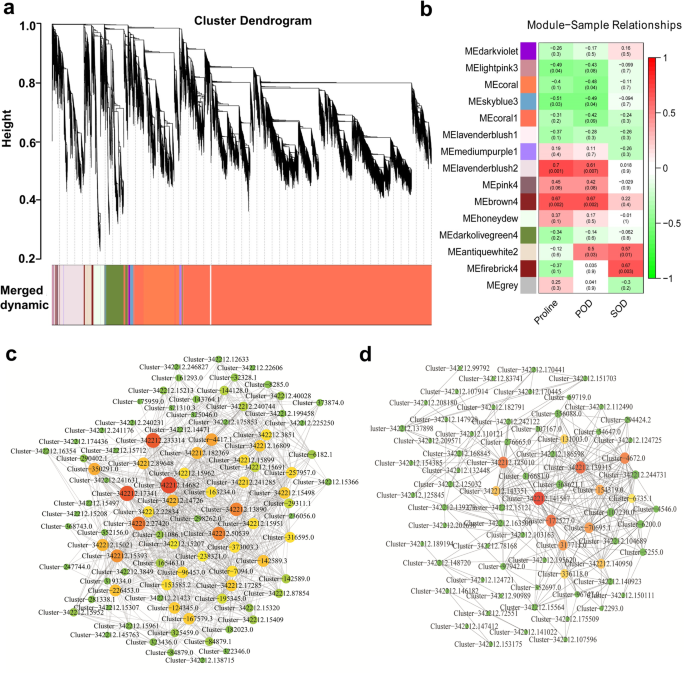
WGCNA共表达网络分析及枢纽基因研究
进一步进行WGCNA,以确定百慕大草根中与盐反应高度相关的特定基因(表。S4).基于基因表达的两两相关性分析,共表达网络中共鉴定出15个网络模块,分别为:darkviolet、lightpink3、coral、skyblue3、coral1、lavenderbluest1、mediumpurple1、lavenderbluest2、pink4、brown4、honeydew、dark橄榄绿、antiquewhite2、firebrick4和grey(图1)。6a, b).研究盐反应生理指标(脯氨酸\POD\SOD)与模块特征基因之间的关系发现,脯氨酸、POD和SOD的相关系数值分别为- 0.67 ~ 0.70、- 0.55 ~ 0.70和- 0.55 ~ 0.70(图1)。6b).在p值< 0.05水平,4个模块与脯氨酸含量相关,5个模块与POD含量相关,2个模块与SOD含量相关。lavenderblush2和brown4模块的特征基因呈显著正相关(p< 0.01),表明这两个模块在盐反应中可能有更大的相关性(图1)。6b).使用Cytoscape软件对分别代表882个和438个基因的lavenderflush2和brown4模块进行可视化。brown4共表达网络的前三个枢纽基因包含一个假设蛋白MTR_3g035650的同源物Medicago truncatula(Cluster-342,212.125010),一个与AGC78945.1同源的假设线粒体蛋白蚕豆根尖(Cluster-342,212.139315)和一个经典转录因子HSF (cluster-342,212.125010)。6c;表格S4).Cytoscape显示的lavender腮红2共表达网络的前三个枢纽基因包含一个编码β-淀粉酶(Cluster-342,212.182369)的基因,该基因属于糖基水解酶14家族(图14)。6d;表格S4).然而,这两个模块的其他枢纽基因没有被注释。
RT-qPCR验证所选顺表达的轮毂基因
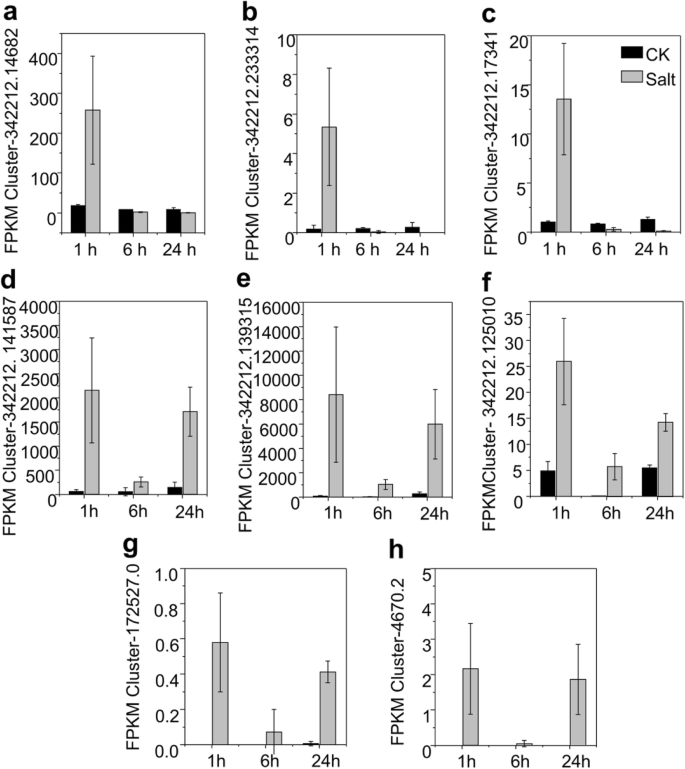
由于对枢纽基因的研究是基于基因的FPKM与生理参数的关系,因此需要确认这些枢纽基因在转录组数据中的FPKM值的准确性。8个不同表达模式的轮毂基因表达量(图。7通过RT-qPCR分析进一步确定了两个WGCNA模块中的lavderbruth2和brown4(图4)。S7;表格S5).在盐胁迫1 h后,模块lavenderbluech2的前三个轮毂基因的表达谱表现为诱导表达,但在之后的时间点表达量下降或无明显变化(图4)。7得了;无花果。S7a - c)。brow4模块中前5个轮毂基因的表达在盐暴露的3个时间点都有显著的诱导(图4)。7d - h;S7d - h)。经RT-qPCR验证的这些hub基因的表达模式及其转录组的FPKM值在相应处理下表现出一致的趋势。这些结果不仅证实了这些枢纽基因在不同模块的响应模式的差异,也证实了转录组数据的可靠性。
讨论
百慕大草根系中具有时间特异性的快速盐反应模块
以往的转录组分析揭示了植物在盐胁迫不同阶段的不同响应策略[31,32].例如,植物对初始渗透胁迫的反应是通过增加细胞内渗透物的浓度[2].NaCl暴露24 ~ 72 h后,钠含量明显降低+毒性成为更紧迫的任务[23,24].为了研究百慕大草根系对盐胁迫早期的转录组调整,首先选取1 h进行盐胁迫的直接响应。接下来,我们选择6 h作为处理时间点,研究大豆在盐处理后1 h至4 h面临初始渗透胁迫阶段后的第一时间反应(1 h) [2].此外,选择24 h来研究百慕大草的盐反应策略是否开始改变,因为24 h可能是一些植物盐反应策略开始改变的转折点[23,24].
在bermuda草中,与暴露于盐下6小时或24小时的根相比,暴露于盐下1小时的根中来自不同基因类别的特异盐反应基因的调控差异约为2.4倍和6倍,表明暴露于盐后反应迅速(图1)。3.).例如,几个信号受体,如激酶(如LRR, thaumatin-like, RLK1, DUF26, LLD, LRK10 like, PERK,和WAK)立即被检测到,并在1小时内全部上调(图)。S4a).这些信号受体激酶总是在较早的时间点响应,在蛋白质磷酸化和修饰中发挥作用,这是启动盐反应信号通路并最终导致转录调控的重要步骤[33,34,35,36,37].此外,盐信号还可以立即触发下游的激素通路,已知这些激素通路在很大范围内参与了应激反应[19,38].在本研究中,ABA生物合成和信号转导子仓(17.1.1,17.1.2,17.1.3)相关基因在所有三个时间点(如NCED;PP2C和ABFs)(图。5A),暗示对盐反应的既定作用[9].然而,我们也注意到,转录本参与ETH的生物合成代谢和信号转导(如ACC合成酶;ACC氧化酶和ERF)和JA(例如AOS1和AOC4)在盐暴露1小时时过度表达(图。4一个;表格S2),表明这些盐反应激素代谢途径可能参与了百慕大草根内盐反应的快速进展[32,39,40].此外,还注意到CTK和GA降解相关转录物的诱导(图。4一个;表格S2).编码赤霉素降解酶- 2氧化酶(At4g21200和At1g75450同源基因)的转录本表明,在环境盐胁迫下,赤霉素降解酶- 2氧化酶在一定程度上抑制了细胞生长。至少有9个AtCKX6 (At1g75450)同源物的转录本的表达受到了调控S2),编码细胞分裂素氧化酶/脱氢酶,参与催化细胞因子的降解[41,42].这些结果表明,激素信号在介导盐反应时并非单独起作用,而可能与其他激素在多种串扰网络中发挥作用。
细胞内磷酸化事件是二级信使的下游,如CDPKs [9,10,11,12,13,14和MAPK级联[43,44,45,据报道,它们是植物中必不可少的传感器-换能器。在本研究中,一些钙信号通路参与的基因成员在盐暴露1小时后立即发生反应(如CDPK11、CAM3、CPK5和CML43)(图1)。S4一个;表格S2).部分钙转运atp酶编码基因在1 h时出现特异性过表达,这可能进一步促进钙的跨膜转运2+(表S2).一个MAPK2与At2g43790同源的基因(cluster-342,212.26954)也仅在1 h上调(图1)。S2b)在盐反应中可能与ROS和激素相互作用[46,47].这些编码基因的蛋白激酶的立即上调可能进一步触发下游转录组重组,以应对应激盐环境[48].
在百慕大草的根中,我们还发现了超过10个转录因子家族,这些转录因子家族在盐暴露后的一个或多个时间点被显著诱导(图1)。S5).1 h诱导的tf数明显多于后一个时间点。在这些转录因子中,AP2、WRKY、bHLH和HB家族在被鉴定的盐诱导转录因子总数中占很大比例,并且这三个家族(MYB、HB、bZip)在三个时间点都有显著的诱导(图1)。5b;表格S2).本研究研究了一个HSF转录因子作为brown4共表达网络的枢纽基因(图4)。6d).这一HSF转录因子在三个时间点均被盐上调表达,可作为未来研究的良好靶点(图1)。7f;S7).与之前的研究一致,WRKY转录因子可积极或消极参与耐盐[49],我们还观察到,在根中检测到的23个WRKY转录因子中,有20个在1小时盐处理后显著诱导(图。S5;表格S2).据报道,AP2/EREBP家族也包括一些应激响应型tf [50].我们还观察到17个AP2转录本中的16个在盐处理1小时后上调(表S2).盐胁迫下,根中另一个受影响最大的TF家族是bHLH,在盐胁迫下,28个转录本中有24个在1 h时被诱导,19个转录本中有10个在6 h时被诱导S2).在这些诱导的bHLH tf中,一些重要的成员,如bHLH92,已被报道积极参与盐胁迫反应[51].Aux/IAA家族的盐反应转录本显著增加,特别是在1小时内,所有12个转录本均受盐胁迫上调(例如IAA5、12、20、24、18、23)(表2)S2).这些盐反应Aux/IAA基因在生长素反应中起着中心作用,可能将来自环境刺激的信号整合到生长素相关基因调控网络中[52].因此,在这里,我们注意到在盐胁迫早期有一些生物学过程的响应,主要包括信号转导、激素代谢和TFs的调节。这些快速反应可能会形成一个级联,激活一系列下游反应因子。
百慕大草根系中常见和独特的盐正响应机制
植物已经进化出不同的基因家族来解毒由恶劣环境(如盐)引起的ROS [19,20.].在我们的研究中,盐处理1 h和6 h的植株根系中POD活性明显高于各自对照的根系(图2)。1b).但是,盐处理1 h和6 h的根系SOD活性有升高的趋势,但与各自对照植株相比升高不显著(图2)。1c).因此,在我们的转录组数据中,POD编码基因的少数成员上调,而SOD编码基因没有上调(图5)。4d;表格S2).由于氧化应激是ROS引起的脂质过氧化(以MDA表示)恶化的结果,因此我们也测量了根中MDA的含量。然而,直到暴露于盐中24 h,根系MDA含量才显示出高于对照的值(图2)。1A),说明随着处理时间的增加,其累积量逐渐增加。编码氧化酶的基因家族的其他成员-铜、谷胱甘肽S转移酶、β 1,3葡聚糖水解酶、UDP葡萄糖和葡醛酰基转移酶、质体青素样蛋白(图。4d;表格S2)也会在一个或多个时间点上调,以应对盐胁迫。例如,UDP葡萄糖转移酶UGT79B2/B3在拟南芥据报道,通过影响花青素积累和增强ROS清除,促进非生物胁迫的耐受性,如盐和干旱[53].与之前对植物的研究一致,百慕大草根中的一些生物活性次生代谢产物(如类胡萝卜素、生育酚和类黄酮)[54,55,56]在盐下也有过多的表现,也可能作为ROS清除物(图。4b;表格S2).正如预期的那样,在本研究中,调节渗透保护剂水平的基因也被高度上调。它们包括编码半乳糖醇合成酶、棉子糖合成酶、海藻糖、胼胝质糖和半乳糖的基因。S4D),它们被报道为盐胁迫下第一批胁迫诱导基因[23,24,25,26].
植物细胞壁由纤维素、半纤维素、木质素、果胶和许多糖蛋白组成[57,58]被认为是感知和响应盐胁迫的重要因素。我们还注意到,在经盐处理的百慕大草根系中,参与纤维素合成酶(10.2)、半纤维素合成(10.3)和木质素合成(16.2.1)的基因被过度表达(图1)。4f).盐胁迫1 h显著诱导糖苷水解酶(GH17)家族基因表达(图)。4d;表格S2),提示其可能参与细胞壁相关蛋白的翻译后修饰,导致细胞壁灵活性的改变[59,60].此外,其他与细胞壁延伸性有关的细胞壁相关基因家族在盐反应转录本中也表现出差异调控。例如,的表达式MUR4在百慕大草的根中被发现表达上调(图1)。4f),并被报道在udp -阿拉伯糖的生物合成中发挥作用。突变MUR4影响细胞壁的完整性,导致细胞与细胞之间的粘附有缺陷,在高盐度下根系伸长减少[61].此外,在我们的研究中,发现了几个编码基因AGPs(阿拉伯半乳蛋白)在转录水平上被盐上调(图。4f).细胞壁或质膜上的agp也被报道与细胞生长有关[62,63]和一种AGP (SOS5)是已知的有助于盐耐受性Arabdiopsis[64].我们进一步注意到百慕大根的脂质代谢有较早的反应。特别是,当暴露于盐中1 h时,FA合成和延伸相关基因的表达下调,而FA去饱和和脂质降解相关基因的表达立即显著上调(图1)。S4b).研究表明,在包括盐胁迫在内的不同条件下,FA去饱和酶对植物细胞细胞膜生物功能的维持起着重要作用[65,66].在这里,盐胁迫显著改变了编码ω-3 FA去饱和酶的基因表达,这可能导致FA组成的改变(图。S4b,表S2).直接调控脂质组成重组基因可以为提高百慕大草的耐盐性提供新的见解。
除了次级代谢相关基因显著参与细胞壁修饰外(图。4F),一些重要的次生代谢途径在较长时间点被显著诱导,表明可能涉及代谢调节的反应略慢[67,68].例如,只有在盐处理6 h和24 h后,多胺合成亚仓才出现过代表。一些次级代谢中的亚仓,如单酚、硫代葡萄糖苷、异黄酮和生育酚生物合成,在24小时内出现了特别多的表现(图。4b;表格S2).这些次生代谢以前曾报道过与某些物种的植物氧化反应有关[67,68].例如,漆酶编码基因的表达在暴露于盐24 h后上调,这可能参与了百慕大草根系中简单酚的氧化还原,缓解盐胁迫引起的氧化应激[69,70].
百慕大草根系受盐胁迫下调基因的分类
在本研究中,下调的基因在三个时间点都更丰富(图5)。2C),表明转录的巨大负调控对植物代谢和功能的影响。实际上,重要富集的基因类别如激素代谢、转录因子、杂化等。次生代谢也含有大量的下调基因(表S2).例如,参与油菜素内酯合成或降解的基因(如CYP450家族成员)和信号转导的基因(如BRI)在盐胁迫下显著下调S2),表明百慕大草中参与盐反应的激素相互作用[71].虽然一系列TF家族表现出上调,但其他TF家族如C2H2和HAP在一个或多个时间点出现大量下调基因(表S2).HAP转录因子AtHAP3b和C2H2Zat7蛋白在促进根伸长以提高抗旱性和抗盐性方面起着关键作用拟南芥,分别为(72,73].
在之前的蛋白质组学研究中,NaCl处理降低了蛋白质的翻译,这与本研究中大多数核糖体蛋白相关转录本的下调是一致的(图1)。S3;表格S2) [27,74].我们还注意到,盐处理1 h后的deg数量相对于盐处理6 h和24 h后的deg数量要高(图1)。2c, d)。更多编码基因和蛋白质代谢相关基因的核糖体蛋白在暴露于盐中1 h后立即显著过表达,表明更多参与蛋白质或氨基酸代谢的基因被快速负调控。参与蛋白翻译修饰的基因,如激酶和泛素化途径上调(图。S3).值得注意的是,大部分E3 RING和E3 SCF蛋白相关基因都被盐胁迫显著诱导(图1)。S3;表格S2),表明在盐反应过程中,这些酶可能以独立于26S蛋白酶体的方式发挥作用[75].蛋白质合成受到抑制,蛋白质降解增强,可能导致游离氨基酸浓度升高,特别是具有渗透保护作用的脯氨酸浓度升高。本研究中,在NaCl胁迫下,百慕大草根系脯氨酸含量显著升高(图1)。1d).这些游离氨基酸可以进一步引发脱氢蛋白或多胺的合成,它们可能在盐下维持蛋白质和细胞膜的结构中起作用[2].然而,与脯氨酸合成相关的基因类别没有显著的过代表,这表明在本研究的所有治疗时间点,参与脯氨酸代谢的基因可能没有受到显著的转录调控。
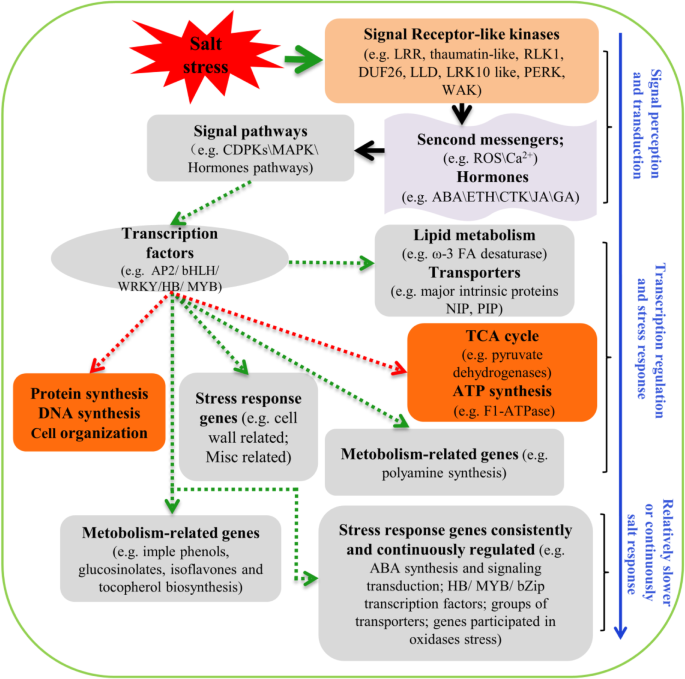
此外,盐胁迫下调了需氧生物主要呼吸途径三羧酸循环(TCA)相关基因的表达(图1)。S1一个;表格S2).例如,编码丙酮酸脱氢酶的基因在丙酮酸转化为乙酰辅酶a的过程中起作用,从而将糖酵解途径连接到TCA循环,在下调的基因类别中富集(图。S1一个;表格S2).此外,编码线粒体电子传递链成分的基因,如NAD(P)H脱氢酶和f1 - atp酶,也在下调的基因类别中独家富集(图。S1b;表格S2).这表明线粒体可能受到氧化应激的破坏。此外,我们注意到参与DNA合成和细胞组织的基因在1和6小时被下调(图2)。S11 c, d)。这些基因可能共同发挥作用,节省能量和物质,以维持植物在盐胁迫下的生长发育。研究人员提出了百慕大草根系中受盐胁迫积极和消极影响的关键基因类别的模型。8).一般情况下,信号受体激酶、激素和信号通路等信号通路基因在NaCl暴露后立即反应,这些信号通路参与信号的感知和转导。在较早时间点响应的转录因子进一步正向或负向调控下游响应基因。在这些盐反应基因类别中,脂质代谢和蛋白质合成等一些类别的反应要早得多,而参与次生代谢物生物合成的其他类别的反应则要晚一些[26,76].
结论
为了了解百慕大草根系在盐暴露后的潜在调控机制,我们进行了一项全面的转录组分析。确定了重要的盐反应基因类群。此外,本研究研究的独特盐响应途径、时间特异性响应和潜在的枢纽基因可为进一步深入研究百慕大草的盐响应机制提供有益的参考。
方法
植物材料和生长条件
在本研究中使用了Bermudagrass的登录号“A12359”(由俄克拉荷马州立大学的Yanqi Wu博士提供)。均匀的匍匐茎(每盆10枝匍匐茎)在装满沙子的花盆中种植约1个月。每2天用霍格兰溶液灌溉植株。将植株的根系洗净,转入用Hoagland的溶液水培培养约1周,使植株适应。处理前,将植株割至均匀高度,转入CK (0 mM NaCl霍格兰溶液)和盐胁迫(200 mM NaCl霍格兰溶液)条件下的水培培养。分别处理1 h、6 h和24 h。每个处理包括3个重复,收集18个根样本进行RNA提取和生理参数测定。水培培养条件为:22/18℃(昼夜),相对湿度65%,光周期16 h,光子通量密度300 μmol m−2年代−1.
转录组分析
NaCl处理1 h、6 h和24 h的植株根系样品(Salt 1 h_R;盐6h_r;盐24h_r)及其各自的对照制度(CK 1 h_R;CK 6h_r;CK 24 h_ R)用于转录组分析。每个处理包括3个复制,18个测序文库用于RNA测序。总RNA提取采用植物RNA提取试剂盒(Sigma-Aldrich, USA)进行。用NanoDrop ND-1000紫外可见分光光度计测定dna酶I消化后的RNA浓度。RNA完整性测定采用生物分析仪2100系统(安捷伦技术公司)。按上文所述进行以下步骤[31].一般情况下,RNA文库根据NEBNext®Ultra™RNA文库准备试剂盒(NEB, USA)为Illumina®生成。将RNA片段连接到测序适配器上,并在Illumina HiSeq 2000平台(Illumina, USA)上进行测序,以生成对端reads。去除所有样本的原始reads和适配器后生成Clean reads,然后由Trinity程序重新组装得到assembly转录组[77].使用cufflinks程序(2.0.2版本)分析转录本的表达,使用FPKM值估计其表达分布[31].通过比较对照和nacl处理样品的表达变化,我们确定了DEGs(定义为基因在一个或多个时间点受到盐的上调或下调)。根据盐处理后的阈值评估差异基因表达的显著性:log2fold change值≥1或≤- 1,FDR(错误发现率)≤0.05,FPKM值≥1 [31].
PageMan分析
日志2将SvsCK1h(左列)、SvsCK6h(中列)和SvsCK24h(右列)的折叠变化导入PageMan (MapMan中包含的用于通路分析的新版本),并对所有处理的过表达进行比较概述[78,79].为了预测BINs受到显著影响,我们应用了PageMan中提供的统计分析。数据采用Wilcoxon检验进行分析。基于a定义了BINs的显著差异p-value < 0.05。红色表示上调基因的显著富集,蓝色表示上调基因的显著缺失。
基因表达模式的STEM分析
时间表达谱分析使用STEM软件[80].盐处理(S)的deg:未处理对照(CK)日志2在一个或多个时间点上,表达率显著不同于0进行分析。日志2基因表达率见表S1.根据前面描述的方法,配置文件的最大数量设置为16,最大单位变化设置为3 [27].
WGCNA
通过超几何测试,利用来自相同样本的针对生理参数的基因表达进行WGCNA分析[81].RPKM值一般先用平方根变换归一化,显著富集的截止值为FDR < 0.05 [82].网络构建和模块检测采用自动一步法,默认设置。然后,利用计算得到的模块特征基因值确定18个样品的模块与各盐响应相关生理参数的相关性。利用Cytoscape,与生理参数显示出较大相关性的模块被可视化。连接更多基因的基因用更大的尺寸和暗红色表示,据推测,这些基因在与其他基因的相互作用中更重要。
RT-qPCR基因表达分析
根据制造商的说明,使用RNeasy试剂盒(Qiagen)在所有三个时间点从三个生物重复的根中提取总RNA。使用TaqMan逆转录试剂盒(Applied Biosystems)从DNase - i处理的总RNA (1-5 μg)合成每个样品的第一链cDNA。每个总体积为20 μl的RT-qPCR反应包含2 μl cDNA模板、0.2 μl引物和10 μl SYBR Green qPCR mix (Toyobo, Japan),使用ABI实时PCR系统(Applied Biosystems, FosterCity, CA)进行,如前文所述[30.].每个反应都有三个技术重复。各基因的转录模式按2——ΔCt方法(83].的CdActin2作为基因表达规范化的参考基因。RT-qPCR实验的所有技术层面均符合MIQE指南的要求[84].在基因表达分析之前,所有样品的RNA完整性通过琼脂糖凝胶电泳进行评估,并检测RNA吸光度OD260/280比。每个样本的原始cDNA用无菌ddH连续稀释10倍(10、100、1000倍)2O.以原始cDNA和稀释后的cDNA为模板,制作标准曲线(log基因拷贝数与Ct值的曲线),进一步计算基因特异性引物效率和R2(回归系数)[85].所有引物的引物效率均在90%以上。各引物的特异性由所有样品的熔解曲线的单峰来确定。所用引物列于表中S5.
统计分析
采用SPSS17.0 for Windows (SPSS)进行单因素方差分析。以上所有试验至少有3个独立重复。结果以均数±表示SD,和*显示显著差异(P< 0.05)t以及。
数据和材料的可用性
在本研究过程中产生或分析的所有数据都包含在文章及其补充材料中。我们已将转录组数据存入序列读取档案(SRA) (http://www.ncbi.nlm.nih.gov/sra/),我们提交的登记编号为:PRJNA645038。
缩写
- 美国广播公司(ABC):
-
磷酸腺苷磁带
- ABI:
-
阿坝不敏感
- AOC:
-
烯氧化物环化酶
- 代谢:
-
烯氧化物合酶
- AP2:
-
Apetala-2
- 东盟地区论坛:
-
生长素反应因子
- bHLH:
-
基本helix-loop-helix
- bZIP:
-
基本亮氨酸拉链
- 凸轮:
-
钙调蛋白
- CDPK:
-
钙依赖性蛋白激酶
- 猫:
-
过氧化氢酶
- CML:
-
钙调蛋白等
- 肌酸磷酸激酶:
-
钙调蛋白结构域蛋白激酶
- COMT的:
-
咖啡酸o -甲基转移酶样
- 度:
-
差异表达基因
- EREBP:
-
乙烯响应元件结合蛋白
- 小块土地:
-
乙烯响应系数
- 罗斯福:
-
错误发现率
- “大酒店”:
-
糖苷水解酶
- 销售税:
-
谷胱甘肽S-transferase
- GT:
-
糖基转移酶
- HB:
-
同源框
- HKT:
-
高亲和性K+转运体
- HSF:
-
热冲击系数
- 博士研究生:
-
Legume-lectin域
- MAPK:
-
丝裂原激活蛋白激酶
- MDA:
-
丙二醛
- MYB:
-
成髓细胞瘤
- nc:
-
9-cis-epoxycarotenoid加双氧酶
- NHX:
-
Na+/ K+换热器
- 朋友:
-
Phenylalanine-ammonia裂合酶
- 好处:
-
脯氨酸样扩展蛋白
- PP2C:
-
蛋白磷酸酶2C
- 圆荚体:
-
过氧化物酶
- ROS:
-
活性氧种类
- SKP:
-
相关联的激酶蛋白激酶
- SOD:
-
超氧化物歧化酶
- 柠檬酸:
-
三羧基的
- 虽然算法:
-
UDP-glucose 4-epimerase
- WAK:
-
s位点糖蛋白样和壁相关受体激酶
- XTH:
-
木葡聚糖內源转糖基酶
参考文献
- 1.
植物耐盐机制:生理、生化和分子特征。国际基因组学杂志2014;2014(1):701596。
- 2.
杨志强,杨文华,杨文华,等。植物耐盐机理。植物学报2008;59(1):651-81。https://doi.org/10.1146/annurev.arplant.59.032607.092911.
- 3.
朱镕基JK。植物盐和干旱胁迫信号转导。植物学报2002;53(1):247-73。https://doi.org/10.1146/annurev.arplant.53.091401.143329.
- 4.
Giolo M, Macolino S, Barolo E, Rimi F. Stolons在过渡带环境下的储备和春季绿化。HortScience。2013年,48(6):1 - 5。
- 5.
马海文迪,Butler JD,吴林。盐度与草坪草培养。:草坪草。Waddington DV, Carrow RN, Shearman RC,编辑。阿米尔。Soc。阿格龙。专著;1992.p . 207 - 229。
- 6.
百慕大草草坪品种的耐盐性和盐腺排泄效率。作物科学,2006;46(6):2571-4。https://doi.org/10.2135/cropsci2006.01.0027.
- 7.
Peacock CH, Lee DJ, Reynolds WC, Gregg JP, Cooper RJ, Bruneau AH。盐度对6种百慕大草草坪品种的影响。植物学报2004;661:193-7。
- 8.
基因与耐盐性:将它们结合在一起。新植物学报,2005;167(3):645-63。https://doi.org/10.1111/j.1469-8137.2005.01487.x.
- 9.
费尔南多VCD,施罗德DF。ABA在拟南芥耐盐、耐干旱和耐脱水中的作用。在:Shanker AK, Shanker C,编辑。植物中的非生物和生物胁迫——最新进展和未来展望。InTech;2016.22页。
- 10.
Ji H, Pardo JM, Batelli G, Van Oosten MJ, Bressan RA, Li x。盐过度敏感(SOS)通路:已建立和正在形成的作用。植物学报,2013;6(2):275-86。https://doi.org/10.1093/mp/sst017.
- 11.
骑士H,崔瓦瓦斯AJ,骑士先生钙信号拟南芥对干旱和盐碱的反应。植物学报,1997;12(5):1067-78。https://doi.org/10.1046/j.1365-313X.1997.12051067.x.
- 12.
郭艳。植物耐盐所需蛋白激酶SOS2功能域的分子特征。植物学报,2001;13(6):1383-400。https://doi.org/10.1105/TPC.010021.
- 13.
植物钙盐胁迫信号:SOS通路的研究进展。生物化学学报。2008;471(2):146-58。https://doi.org/10.1016/j.abb.2008.01.010.
- 14.
Mehlmer N, Wurzinger B, Stael S, Hofmann-Rodrigues D, Csaszar E, Pfister B,等。Ca2+-依赖蛋白激酶CPK3是mapk依赖的盐胁迫适应所必需的拟南芥.植物学报。2010;32(3):394 - 394。https://doi.org/10.1111/j.1365-313X.2010.04257.x.
- 15.
王晓燕,王晓燕,王晓燕,等。活性氧在植物细胞信号转导中的作用研究进展。植物生理学报,2016;https://doi.org/10.1104/pp.16.00938.
- 16.
杨晓燕,张晓燕,张晓燕,等。干旱和盐胁迫下活性氧的内稳态和信号转导。植物细胞环境学报,2010;33(4):453-67。https://doi.org/10.1111/j.1365-3040.2009.02041.x.
- 17.
notor G, Reichheld JP, Foyer CH.植物ros相关的氧化还原调控和信号传导。中国生物医学工程学报2017;80:3-12。
- 18.
庞昌,王斌。植物的氧化应激与耐盐性。在:Lüttge U, Beyschlag W, Berlin MJ,编辑。植物学进展。柏林,海德堡:施普林格柏林海德堡;2008.p . p231-45。
- 19.
赵春,张宏,宋春,朱建军,沙巴拉申。植物对土壤盐分的响应及其适应机制。创新。2020;1(1):100017。https://doi.org/10.1016/j.xinn.2020.100017.
- 20.
王晓燕,王晓燕,王晓燕。转录因子在植物抗非生物胁迫中的作用。正确的做法:Shanker A,编辑。植物生理、生化和遗传方面的非生物胁迫反应。InTech;2011.p。10。
- 21.
王晓燕,王晓燕,王晓燕。植物脱氢酶及其耐胁迫性能研究。植物信号行为学报,2011;6(10):1503-9。https://doi.org/10.4161/psb.6.10.17088.
- 22.
Assaha DVM, Akihiro U, Hirofumi S, Rashid AY, Yaish MW。Na的作用+和K+糖类植物盐胁迫适应中的转运蛋白。前沿物理。2017;8:509。https://doi.org/10.3389/fphys.2017.00509.
- 23.
王晓燕,王晓燕。植物离子转运蛋白与非生物胁迫耐受性。ISRN Mol Biol 2012;927436。
- 24.
刘安,肖铮,李文明,王福林,容文伟,顾玉生,等。盐胁迫下大豆幼苗的转录组重编程。植物细胞环境学报2019;42(1):98-114。https://doi.org/10.1111/pce.13186.
- 25.
李志强,李志强,李志强,等。模式水稻根系发育的遗传控制。植物学报,2010;15(4):219-26。https://doi.org/10.1016/j.tplants.2010.01.008.
- 26.
王晓燕,王晓燕,王晓燕,等。玉米根系发育与结构的遗传与基因组分析。植物生物学杂志,2009;12(2):172-7。https://doi.org/10.1016/j.pbi.2008.12.002.
- 27.
蒋勇,戴宏明。nacl胁迫的转录谱分析拟南芥根揭示了反应基因的新类别。植物生物学,2006;6(1):25。https://doi.org/10.1186/1471-2229-6-25.
- 28.
波斯特尼科娃OA,邵杰,涅姆奇诺夫LG。苜蓿根系对盐胁迫响应的转录组分析。植物细胞物理学报,2013;54(7):1041-55。https://doi.org/10.1093/pcp/pct056.
- 29.
Song L, Prince S, Valliyodan B, Joshi T, Maldonado dos Santos JV, Wang J,等。不同水分亏缺条件下大豆主根全基因组转录组分析。BMC Genom. 2016;17(1):57。
- 30.
胡丽,李宏,陈玲,娄勇,Amombo E,付杰。与根生长相关的基因鉴定和转录本谱分析(香附子)在盐度胁迫下。BMC基因组学,2015;16(1):575。https://doi.org/10.1186/s12864-015-1799-3.
- 31.
Anuradha U, Tulsi G, Kumar UA, Satisha J, Shinde MP, Kadoo NY,等。葡萄的全球转录组分析(葡萄盐胁迫下鲜食葡萄叶片在胁迫前期和后期表现出不同的响应。汤普森无核。植物生理与生物学报2018;129:168-79。
- 32.
耿勇,吴锐,魏文武,谢峰,魏旭,陈敏,等。盐胁迫对植物生长调控的时空意义拟南芥.植物细胞学报,2013;25(6):2132-54。https://doi.org/10.1105/tpc.113.112896.
- 33.
de Lorenzo L, merchant F, Laporte P, Thompson R, Clarke J, Sousa C,等。一种新的植物富含亮氨酸重复序列受体激酶调节植物的反应Medicago truncatula根系受盐胁迫的影响。植物学报,2009;21(2):668-80。https://doi.org/10.1105/tpc.108.059576.
- 34.
Marshall A, Aalen RB, Audenaert D, Beeckman T, Broadley MR, Butenko MA,等。应对干旱胁迫:受体样激酶提出了新的方法。植物学报,2012;24(6):2262-78。https://doi.org/10.1105/tpc.112.096677.
- 35.
欧阳淑琴,刘艳芳,刘鹏,雷刚,陈思思。受体样激酶OsSIK1提高水稻耐干旱和耐盐能力(栽培稻)植物。植物学报。2010;32(2):369 - 369。https://doi.org/10.1111/j.1365-313X.2010.04146.x.
- 36.
植物发育和胁迫反应中的凝集素受体样激酶。植物学报,2013;6(5):1405-18。https://doi.org/10.1093/mp/sst033.
- 37.
大坂Y,山口信崎K,信崎K,陈少林。感知环境:膜定位激酶在植物感知和响应非生物胁迫中的关键作用。中国生物医学工程学报,2013;32(2):445-58。https://doi.org/10.1093/jxb/ers354.
- 38.
ab4通过减少植物生长素极性运输,介导脱落酸和细胞分裂素对侧根形成的抑制拟南芥.植物细胞学报,2010;22(11):3560-73。https://doi.org/10.1105/tpc.110.074641.
- 39.
曹烨,陈思思,张建军。乙烯信号通路调节盐胁迫反应。植物信号行为学报2008;3(10):763 - 3。https://doi.org/10.4161/psb.3.10.5934.
- 40.
茉莉酸酯和乙烯在抗非生物胁迫中的不同作用。植物科学进展,2015;20(4):219-29。https://doi.org/10.1016/j.tplants.2015.02.001.
- 41.
冯军,史勇,杨松,左军。3-细胞分裂素。李:李J, C,史密斯SM,编辑。植物激素代谢与信号转导:文献出版社;2017.p . 77 - 106。
- 42.
柳洪,赵一贵。植物抗盐胁迫激素。植物生物学杂志,2015;58(3):147-55。https://doi.org/10.1007/s12374-015-0103-z.
- 43.
张志强,张志强,张志强,等。MKK2通路介导冷和盐胁迫信号拟南芥.《分子细胞》2004;15(1):141-52。https://doi.org/10.1016/j.molcel.2004.06.023.
- 44.
王峰,景伟,张伟。丝裂原激活蛋白激酶级联MKK1-MPK4介导水稻盐信号通路。植物科学2014;227:181-9。https://doi.org/10.1016/j.plantsci.2014.08.007.
- 45.
于玲,聂杰,曹超,金燕,闫梅,王芳,等。磷脂酸通过调控体内MPK6介导盐胁迫反应拟南芥.植物生态学报,2010;38(3):366 - 366。https://doi.org/10.1111/j.1469-8137.2010.03422.x.
- 46.
王晓燕,王晓燕,王晓燕。活性氧、激素和MAPKs在非生物应激中的作用。environment Exp Bot. 2017; 137:142-57。https://doi.org/10.1016/j.envexpbot.2017.02.010.
- 47.
Smékalová V, Doskočilová A, Komis G, Šamaj J.植物非生物胁迫信号中次生信使、激素和MAPK模块之间的串扰。生物技术进展2014;32(1):2-11。https://doi.org/10.1016/j.biotechadv.2013.07.009.
- 48.
Kumar J, Singh S, Singh M, Srivastava PK, Mishra RK, Singh VP,等。植物盐胁迫的转录调控:综述。植物基因,2017;11:160-9。https://doi.org/10.1016/j.plgene.2017.04.001.
- 49.
蒋建军,马硕,叶乃华,蒋敏,曹建军,张建华。WRKY转录因子在植物胁迫响应中的作用。植物生物学杂志,2017;59(2):86-101。https://doi.org/10.1111/jipb.12513.
- 50.
Gilmour SJ, Zarka DG, Stockinger EJ, Salazar MP, Houghton JM, Thomashow MF。低温调节的拟南芥CBF家族的AP2转录激活因子是寒冷诱导的早期步骤天哪基因的表达。植物学报。2001;16(4):433 - 433。
- 51.
蒋勇,杨波,杨波,杨晓燕拟南芥bHLH92转录因子在非生物胁迫中的作用。分子基因组学,2009;282(5):503-16。https://doi.org/10.1007/s00438-009-0481-3.
- 52.
Shani E, Salehin M, Zhang Y, Sanchez SE, Doherty C, Wang R,等。植物的抗逆性需要生长素敏感的Aux/IAA转录阻遏子。中国畜牧杂志2017;27(3):437-44。https://doi.org/10.1016/j.cub.2016.12.016.
- 53.
李鹏,李玉军,张芳军,张广泽,蒋晓霞,余慧敏,等。的拟南芥udp -糖基转移酶UGT79B2和79B3通过调节花青素积累,有助于抗寒、耐盐和耐干旱胁迫。植物学报(英文版);2017;https://doi.org/10.1111/tpj.13324.
- 54.
作物植物抗非生物胁迫中的活性氧种类和抗氧化机制。植物生理与生物化学。2010;48(12):909-30。https://doi.org/10.1016/j.plaphy.2010.08.016.
- 55.
Mittler R, Vanderauwera S, Gollery M, Van Breusegem F.植物活性氧基因网络。植物科学进展2004;9(10):490-8。https://doi.org/10.1016/j.tplants.2004.08.009.
- 56.
黄酮类化合物的生物合成和应激的影响。植物学报,2002;5(3):218-23。https://doi.org/10.1016/s1369 - 5266 (02) 00256 - x.
- 57.
冯伟,Kita D, Peaucelle A, Cartwright HN, Doan V,段琪,等。在盐胁迫下,FERONIA受体激酶通过钙维持细胞壁的完整性2+信号。植物生物学杂志2018;28(5):666-75。https://doi.org/10.1016/j.cub.2018.01.023.
- 58.
赵超,扎耶德奥,于志,蒋伟,朱建军。富含亮氨酸的重复延伸蛋白调节植物的耐盐性拟南芥.美国国家科学院。2018; 115(51): 201816991。
- 59.
李阳,崔D,肯德H. Expansins:不断扩展的数和函数。植物学报,2001;4(6):527-32。https://doi.org/10.1016/s1369 - 5266 (00) 00211 - 9.
- 60.
Vissenberg K, Oyama M, Osato Y,横山R, Verbelen JP, Nishitani KAtXTH17,AtXTH18,AtXTH19而且AtXTH20基因在拟南芥的根源。细胞壁构造规范中的生理作用。植物细胞学报2005;46(1):192-200。https://doi.org/10.1093/pcp/pci013.
- 61.
赵超,扎耶德阿,曾峰,刘超,张磊,朱鹏,等。阿拉伯糖的生物合成是植物耐盐性的关键拟南芥.新植物学报2019;224(1):274-90。https://doi.org/10.1111/nph.15867.
- 62.
Ellis M, Egelund J, Schultz CJ, Bacic A.阿拉伯半乳糖蛋白:细胞表面的关键调节因子?植物生理学报,2010;32(2):447 - 447。https://doi.org/10.1104/pp.110.156000.
- 63.
阿拉伯半乳蛋白在植物发育中的多重作用。植物物理学报,2000;22(1):3-10。https://doi.org/10.1104/pp.122.1.3.
- 64.
史宏,金勇,郭勇,史蒂文森,朱建军。的拟南芥SOS5位点编码一种细胞表面粘附蛋白,是正常细胞扩张所必需的。植物细胞,2003;15(1):19-32。https://doi.org/10.1105/tpc.007872.
- 65.
隋宁,王勇,刘松,杨铮,王峰,万松。花生不饱和脂肪酸与盐胁迫关系的转录组学和生理学证据。植物科学,2018;9:7。
- 66.
张建堂,朱建强,朱强,刘辉,高晓霞,张海霞。脂肪酸去饱和酶-6 (Fad6)是植物耐盐性所必需的拟南芥.生物化学与生物物理学报2009;39(3):469-74。https://doi.org/10.1016/j.bbrc.2009.09.095.
- 67.
Akula R, Ravishankar GA。非生物胁迫信号对植物次生代谢产物的影响。植物信号行为学报,2011;6(11):1720-31。https://doi.org/10.4161/psb.6.11.17613.
- 68.
塔库尔M,巴塔查里亚S,科斯拉PK,普里S.通过生物和非生物诱导提高植物次生代谢产物的生产。应用医学芳香杂志2019;12:1-12。
- 69.
梁明,Haroldsen V,蔡雪,吴勇。漆酶基因的表达,ZmLAC1在胁迫下的玉米主根中。植物细胞环境学报,2006;29(5):746-53。https://doi.org/10.1111/j.1365-3040.2005.01435.x.
- 70.
漆酶下调引起杨树酚代谢和细胞壁结构的改变。植物物理学报,2002;29(1):145-55。https://doi.org/10.1104/pp.010988.
- 71.
油菜素内酯介导的抗应激能力拟南芥显示与脱落酸,乙烯和水杨酸途径的相互作用。植物生物学杂志,2010;10(1):151。https://doi.org/10.1186/1471-2229-10-151.
- 72.
Ballif J, Endo S, Kotani M, MacAdam J,吴勇HAP3b增强根的伸长拟南芥.植物生理学报,2011;49(6):579-83。https://doi.org/10.1016/j.plaphy.2011.01.013.
- 73.
Ciftci-Yilmaz S, Morsy MR, Song L, Coutu A, Krizek BA, Lewis MW,等。Cys2/ his2型锌指蛋白Zat7的ear基序在蛋白的防御反应中起关键作用拟南芥盐度胁迫。中国生物化学杂志2007;282(12):9260-8。https://doi.org/10.1074/jbc.M611093200.
- 74.
Ndimba BK, Chivasa S, Simon WJ, Slabas AR拟南芥用二维差分凝胶电泳和质谱分析盐和渗透胁迫响应蛋白。蛋白质组学。2005;5(16):4185 - 96。https://doi.org/10.1002/pmic.200401282.
- 75.
小J, Vierstra RD.泛素26S蛋白酶体蛋白水解途径。植物学报2004;55(1):555-90。https://doi.org/10.1146/annurev.arplant.55.031903.141801.
- 76.
莫勒我。植物线粒体与氧化应激:电子转运,NADPH周转,活性氧代谢。植物物理学报2001;52(1):561-91。https://doi.org/10.1146/annurev.arplant.52.1.561.
- 77.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I,等。没有参考基因组的RNA-Seq数据的全长转录组组装。中国生物工程学报,2011;29(7):644-52。https://doi.org/10.1038/nbt.1883.
- 78.
Usadel B, Nagel A, Steinhauser D, Gibon Y, Bläsing OE, Redestig H,等。PageMan:用于生成、显示和注释概要图的交互式本体工具,用于概要分析实验。生物学报。2006;7(1):535。https://doi.org/10.1186/1471-2105-7-535.
- 79.
丁姆·欧,Bläsing O,吉本·伊,奈格尔·A,梅耶斯,Krüger P,等。MAPMAN:一个用户驱动的工具,用于在代谢途径和其他生物过程的图表上显示基因组数据集。植物学报。2004;37(6):914 - 919。https://doi.org/10.1111/j.1365-313X.2004.02016.x.
- 80.
恩斯特J, Bar-Joseph Z. STEM:用于分析短时间序列基因表达数据的工具。生物学报。2006;7(1):1 - 11。
- 81.
Langfelder P, Horvath S. WGCNA:加权相关网络分析的R包。生物学报。2008;9(1):559。https://doi.org/10.1186/1471-2105-9-559.
- 82.
白燕,Dougherty L,程磊,钟光光,徐坤。揭示了调节不同苹果果实酸度的共表达基因网络模块。BMC基因组学,2015;16(1):612。https://doi.org/10.1186/s12864-015-1816-6.
- 83.
Vandesompele J, Preter KD, Pattyn F, Poppe B, Roy NV, Paepe AD,等。通过多个内控基因的几何平均,实时定量RT-PCR数据的精确归一化。基因组生物学,2002;3研究0034.1(2002)。
- 84.
Bustin SA, Benes V, Garson JA, Hellemans J, Huggett J, Kubista M,等。MIQE指南:发表实时定量PCR实验的最低信息。临床化学2009;55(4):611-22。https://doi.org/10.1373/clinchem.2008.112797.
- 85.
Schmittgen T, Livak K, Schmittgen TD, Livak KJ。用比较C(T)法分析实时PCR数据。通信学报。2008;3(6):1101-8。https://doi.org/10.1038/nprot.2008.73.
确认
我们感谢位于中国武汉的诺健公司对计算工作的支持。感谢国家自然科学基金和山东省自然科学基金的资助。
资金
本研究得到国家自然科学基金(批准号:)资助。山东省自然科学基金资助项目(批准号:31801892);ZR2019PC012)。资助机构没有参与研究的设计、数据的收集、数据的分析和解释,也没有参与撰写手稿。
作者信息
从属关系
贡献
A.S.和W.W.完成了大部分的实验,分析了大部分的数据,并撰写了所有作者贡献的文章;顺丰提供了技术援助;X.X、Y.Y、X.L、G.W.、H.W.协助实验;J.F.监督了这些实验。e。a。编辑了手稿。所有的作者都审阅了草稿。作者(们)阅读并批准了最终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明他们没有竞争利益
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:图S1
.使用PageMan在不同时间点进行盐处理后下调的基因类别示例。无花果S2。.基因通常在三个时间点上调或在1小时特异性上调的例子。基因id和标记在每个热图的右侧。S3无花果。.不同时间点盐处理对蛋白质代谢的调节。SvsCK1h(左列)、SvsCK6h(中列)和SvsCK24h(右列)。无花果。S4.使用PageMan进行1小时盐处理后基因类别特异上调的例子。SvsCK1h(左列)、SvsCK6h(中列)和SvsCK24h(右列)。无花果S5。.利用PageMan分析,不同时间点盐处理后转录因子上调。无花果S6。.使用pageman分析的丰富基因类别的完整视图。SvsCK1h(左列)、SvsCK6h(中列)和SvsCK24h(右列)。图S7.lavenderbruth2和brown4模块中轮毂基因的相对表达量。a-c,来自lavenderblush2模块的Hub基因。d-h,来自brown4模块的Hub基因。相对表达水平用平均值±表示SD每个时间点重复三次。轮毂基因的表达量用2−△CT方法使用Actin2作为参考基因。表S1.不同时间点的DEGs基因表及STEM包装DEGs的折叠变化。表S2.使用MapMan系统的特定时间的DEGs富集子仓列表。每个时间点不同富集类别的基因以log表示2,并可通过列标头进行区分。表S3.在所有三个时间点通常被监管的deg列表。每个时间点不同富集类别的基因以log表示2规模。表S4.用于WGCNA分析的生理指标和涉及薰衣草红2和棕色4模块的轮毂基因。表S5.用于RT-qPCR的枢纽基因的引物。
权利与权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
邵爱玲,王伟,范淑贞,王文华,王文华。et al。综合转录分析揭示了百慕大草中盐胁迫调控的关键途径、枢纽基因和时间特异性响应基因类别(香附子(l)珀耳斯)的根源。植物生物学21日,175(2021)。https://doi.org/10.1186/s12870-021-02939-1
收到了:
接受:
发表:
关键字
- 常见bermudagrass
- 根
- 转录组分析
- WGCNA
- 中心的基因
- 有时限的响应