- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
揭示辣椒植物的耐盐机制:一种生理和转录组学方法gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21gydF4y2Ba文章编号:gydF4y2Ba169gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
辣椒是世界上种植最多的作物之一,但对盐度很敏感。这种敏感性取决于品种,而我们关于它们如何面对这种压力的知识是有限的,主要是根据分子的观点。这就是我们决定进行转录组学分析的主要原因。耐受性和敏感性分别为A25和A6,在对照条件和70 mM NaCl灌溉下生长14 d。通过对生物量、不同生理参数和差异表达基因的分析,得出两种材料对不同盐度机制的响应。gydF4y2Ba
结果gydF4y2Ba
在对照和胁迫条件下发现的遗传变化可以通过渗透电位的降低来解释A25的生理行为,这可能主要是由于钾和脯氨酸积累的增加,生长的改善(如膨胀素),更有效的淀粉积累(如BAM1),离子稳态(如CBL9, HAI3, BASS1),光合保护(如FIB1A, TIL, JAR1)和抗氧化活性(如psd3, SnRK2.10)。此外,ABA信号(如HAB1, ERD4, HAI3)和其他胁迫信号基因(如JAR1)的调控失调可能是解释两种材料对NaCl敏感性不同的关键。gydF4y2Ba
结论gydF4y2Ba
在分析了生理行为和转录组结果后,我们得出结论,A25的加入利用不同的策略来更好地应对盐胁迫,aba信号是调控的关键点。然而,其他策略,如降低渗透势以保持叶片中的水分状态,似乎是解释辣椒A25植物对盐的防御反应的重要原因。gydF4y2Ba
背景gydF4y2Ba
胡椒(gydF4y2Ba甜椒gydF4y2BaL.)是世界上最重要的栽培园艺物种之一。在过去20年里,产量从1700万吨增加到3600万吨,耕地面积扩大了约35% [gydF4y2Ba1gydF4y2Ba].然而,几种胁迫仍然显著影响辣椒,降低产量和果实质量。最重要的胁迫是生物胁迫,但辣椒也会受到一些非生物胁迫的影响[gydF4y2Ba2gydF4y2Ba].其中最相关的是盐胁迫,因为辣椒被认为是中等敏感、敏感或高度敏感的植物[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].影响植物的高盐浓度的来源可能是土壤或灌溉水[gydF4y2Ba5gydF4y2Ba].在4.4 dS m灌溉条件下,辣椒植株的干重和市场产量分别减少了46%和25%gydF4y2Ba−1gydF4y2Ba[gydF4y2Ba6gydF4y2Ba].gydF4y2Ba
根是高钠暴露后最先受到影响的器官gydF4y2Ba+gydF4y2Ba和ClgydF4y2Ba−gydF4y2Ba浓度,因为过量的这些离子会产生渗透和离子应力[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].这些离子也会迅速移动到光合器官,并造成一些负面影响。事实上,植物组织中的盐积累会引起生理代谢的变化,如营养失衡,并产生活性氧(ROS),以及其他导致生物量和作物产量减少的生理紊乱[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].然而,一些物种能够处理这些负面影响,并能忍受盐胁迫。为了达到这一条件,一个与耐盐相关的复杂基因网络是必要的[gydF4y2Ba10gydF4y2Ba,可以改变植物的生理和生化反应。gydF4y2Ba
在农业物种中,种植者总是倾向于选择商业产量增加的基因型,通常与对特定胁迫的耐受性提高有关。因此,现在有可能找到各种各样的材料,它们的耐受力等级各不相同。以辣椒为例,几位作者已经证明,负面影响的严重程度取决于辣椒的品种[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
这种种内变异可能是寻找与耐受性相关的基因、蛋白质或代谢物等因素的信息源,可用于例如传统育种计划或基因工程技术[gydF4y2Ba10gydF4y2Ba],或在嫁接植株中用作耐受性砧木[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].gydF4y2Ba
几项转录组学研究揭示了辣椒植物对各种胁迫(如热胁迫、低温或卷叶病毒)的耐受性的遗传机制[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].在盐胁迫的情况下,耐受性的特定遗传途径已被研究出来[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba但有关胡椒植物的信息却很少。gydF4y2Ba
因此,在分析了一系列生理和农学参数后,本研究比较了两种之前被我们分类为耐盐(A25)和敏感(A6)的辣椒品种[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].这项研究包括一系列的测量,以评估不同的生理特征,以及转录组分析,通过微阵列,以阐明表达的遗传程序,负责耐盐胁迫。这一分析可以揭示辣椒应对盐胁迫的潜在机制,并开辟在盐胁迫条件下提高作物性能的新策略。gydF4y2Ba
结果gydF4y2Ba
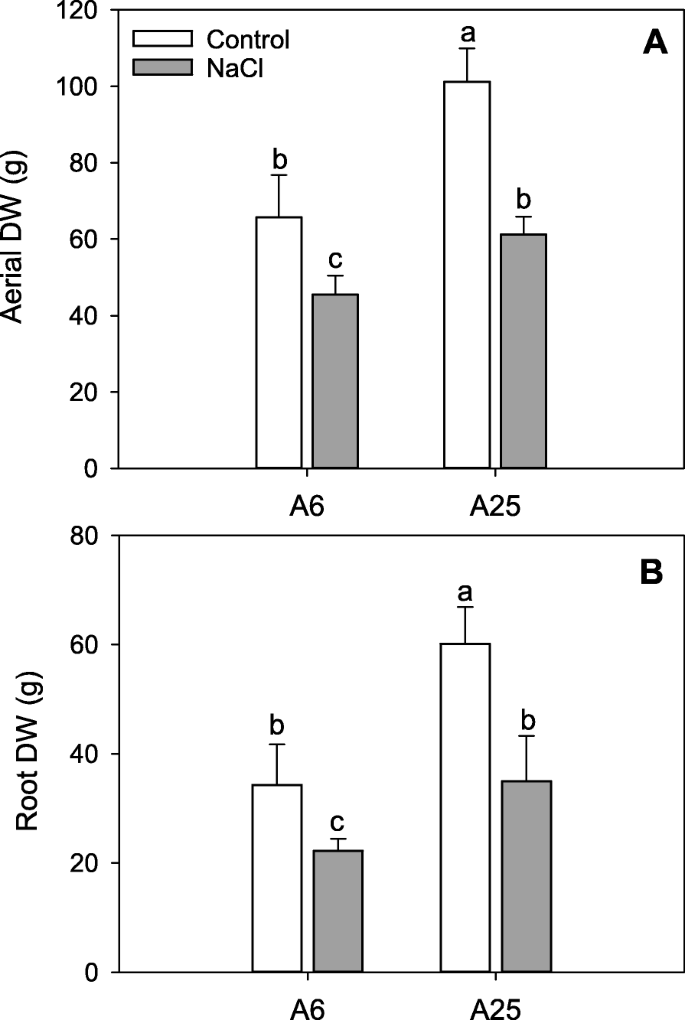
生物质gydF4y2Ba
为了评价NaCl处理后植物是否保持相同的生长速率,在处理后14天(14DAT)测定了根系和地上器官的干生物量。在对照条件下,与盐胁迫条件相比,两种材料获得了更高的值(图1)。gydF4y2Ba1gydF4y2Baa, b)。然而,在对照条件下,A25在空气和根系生物量上都获得了更高的值(图5)。gydF4y2Ba1gydF4y2Baa, b).与试验结束时(14DAT)的A6相比,耐受性A25在盐胁迫条件下更好地保持了气重和根干重。gydF4y2Ba
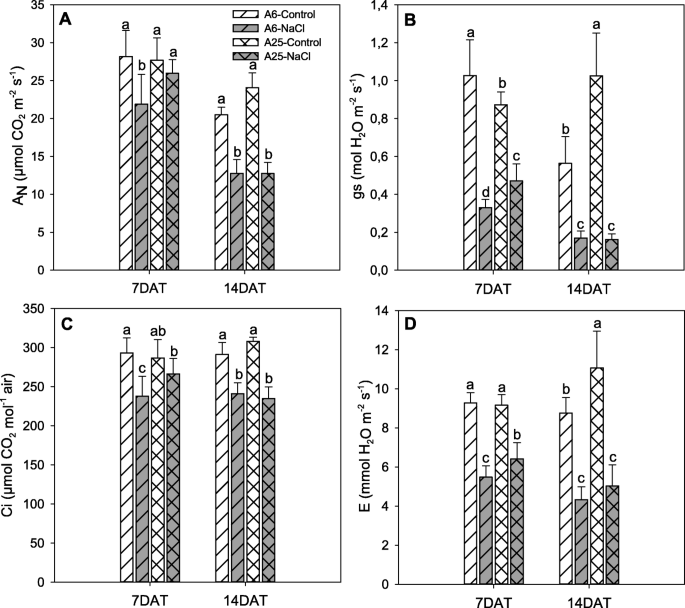
气体交换的测量gydF4y2Ba
由于光合作用是盐胁迫暴露后最先受到影响的过程之一,因此评估其参数及其随时间暴露的进展是至关重要的。在这个实验中,COgydF4y2Ba2gydF4y2Ba同化速率(gydF4y2BaNgydF4y2Ba)、气孔对水蒸气的导度(gs)、气孔下COgydF4y2Ba2gydF4y2Ba对7DAT和14DAT的浓度(Ci)和蒸腾速率(E)进行分析(图。gydF4y2Ba2gydF4y2Ba).7DAT时,A25与A无显著差异gydF4y2BaNgydF4y2Ba和Ci(无花果。gydF4y2Ba2gydF4y2BaA, c)对照与盐胁迫条件之间。相反,gs和E在胁迫植株中下降(图5)。gydF4y2Ba2gydF4y2Bab, d),但与A6相比,A25的这些参数保持得更好,因为A6的值最低。gydF4y2Ba
有限公司gydF4y2Ba2gydF4y2Ba固定利率(gydF4y2BaNgydF4y2Baμ摩尔公司gydF4y2Ba2gydF4y2Ba米gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba) (gydF4y2Ba一个gydF4y2Ba)、气孔对水汽的导度(gs, mol HgydF4y2Ba2gydF4y2BaO mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba) (gydF4y2BabgydF4y2Ba), substomatal有限公司gydF4y2Ba2gydF4y2Ba浓度(Ci, μmol COgydF4y2Ba2gydF4y2Ba摩尔gydF4y2Ba−1gydF4y2Ba空气)(gydF4y2BacgydF4y2Ba)和蒸腾速率(E, mmol HgydF4y2Ba2gydF4y2BaO mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba) (gydF4y2BadgydF4y2Ba)在对照和盐胁迫(70 mM NaCl)条件下。分别在试验第7天(7DAT)和第14天(14DAT)进行测量。数据为5次重复的平均值,误差条属于标准差。对于每个研究时间,不同的字母表示显著的差异gydF4y2BaPgydF4y2Ba< 0.05 (LSD检验)gydF4y2Ba
在对照条件下14DAT时,气孔导度和蒸腾作用对A25的耐受性响应较好。gydF4y2Ba2gydF4y2Bab, d),不像AgydF4y2BaNgydF4y2Ba和Ci,保持不变(图5)。gydF4y2Ba2gydF4y2Baa, c).在盐胁迫条件下发现了不同的结果,在所有研究的气体交换参数中,两种被研究的资源之间没有显著差异,得分相似。gydF4y2Ba
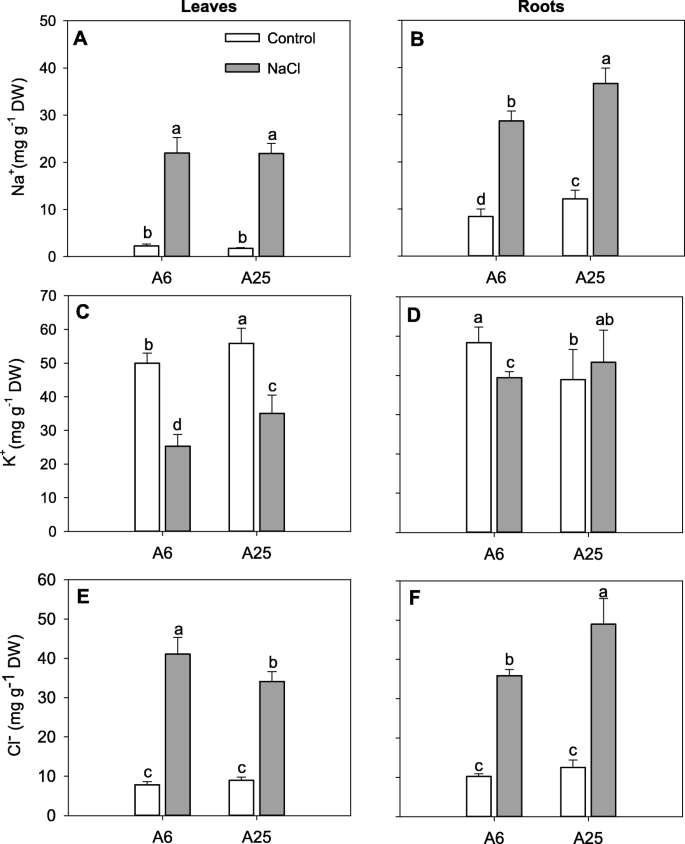
离子测定gydF4y2Ba
暴露于高NaCl浓度下破坏植物细胞中的离子稳态[gydF4y2Ba8gydF4y2Ba].因此,评估应激后不同组织中的离子浓度对本实验至关重要。为了这个目的,娜gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba和ClgydF4y2Ba−gydF4y2Ba在实验结束时(14DAT)测定了叶片中的浓度(图。gydF4y2Ba3.gydF4y2Baa, c, e)和根(图。gydF4y2Ba3.gydF4y2Bab, d, f)gydF4y2Ba+gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2BaA, b)在盐胁迫下,两种材料的叶和根的浓度都有所增加。值得注意的是,无论是添加还是处理,根中钠含量均高于叶片,尤其是A25中钠含量较高gydF4y2Ba+gydF4y2Ba与A6相比。gydF4y2Ba
NagydF4y2Ba+gydF4y2Ba(gydF4y2Baa、bgydF4y2Ba), KgydF4y2Ba+gydF4y2Ba(gydF4y2Bac, dgydF4y2Ba)和氯gydF4y2Ba−gydF4y2Ba浓度(gydF4y2Bae, fgydF4y2Ba)在叶子里(gydF4y2BaA, c, egydF4y2Ba)和根(gydF4y2Bab, d, fgydF4y2Ba)在对照和盐胁迫(70 mM)条件下,A6和A25均有显著差异。在实验结束时(14DAT)进行测量。数据为6次重复的平均值,误差条属于标准差。不同的字母表示显著的差异gydF4y2BaPgydF4y2Ba< 0.05 (LSD检验)gydF4y2Ba
对于KgydF4y2Ba+gydF4y2Ba浓度(图。gydF4y2Ba3.gydF4y2BaC, d),在高盐度处理下,叶片的渗漏量高于根系。尽管如此,在两种条件下,A25根中的钾含量保持不变。此外,KgydF4y2Ba+gydF4y2Ba盐胁迫下A25在叶和根中的含量均高于A6。gydF4y2Ba
另外,一个更高的ClgydF4y2Ba−gydF4y2Ba与对照相比,在盐条件下检测了所有被研究器官和材料的浓度(图1)。gydF4y2Ba3.gydF4y2Bae, f)。与A6相比,盐胁迫下A25根中盐浓度升高,叶片中盐浓度降低。在对照条件下,研究的任何器官都没有发现显著差异。gydF4y2Ba
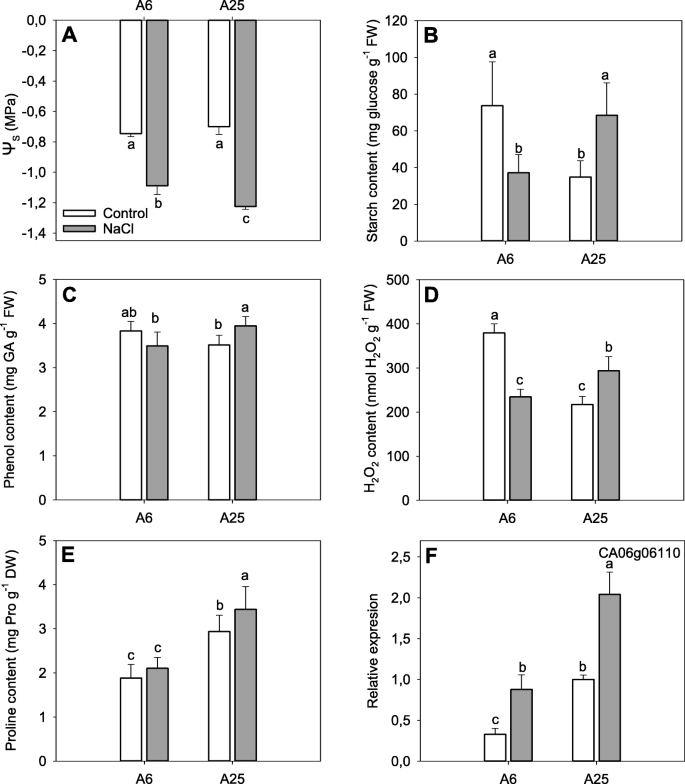
生理决定gydF4y2Ba
渗透势(ψ)的计算gydF4y2Ba年代gydF4y2Ba)、淀粉含量、酚类、脯氨酸和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba浓度还可以反映植物耐受或不耐受盐胁迫条件的能力。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
渗透势(gydF4y2Ba一个gydF4y2Ba)、淀粉含量(gydF4y2BabgydF4y2Ba)、总酚含量(gydF4y2BacgydF4y2Ba), HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba内容(gydF4y2BadgydF4y2Ba)、脯氨酸浓度(gydF4y2BaegydF4y2Ba),gydF4y2BaCaP5CSgydF4y2Ba(CA06g06110)基因相对表达(gydF4y2BafgydF4y2Ba)在对照和盐胁迫(70 mM)条件下,A6和A25的叶片中均有显著增加。在实验结束时(14DAT)进行测量。除脯氨酸含量为6次重复的平均值外,其余数据为4次重复的平均值。误差条属于标准差。不同的字母表示显著的差异gydF4y2BaPgydF4y2Ba< 0.05 (LSD检验)gydF4y2Ba
的ψgydF4y2Ba年代gydF4y2Ba在14DAT的叶片中评估(图。gydF4y2Ba4gydF4y2Baa)表明,与对照条件不同,盐胁迫条件下耐受性和敏感性表现出显著差异,其中A25值最低。gydF4y2Ba
通过淀粉含量分析,我们可以发现,在对照和胁迫条件下,供试材料表现出非常不同的行为(图1)。gydF4y2Ba4gydF4y2Bab).具体而言,在盐胁迫条件下,A6在14DAT时淀粉含量下降,降低到A25对照条件的值。相反,在盐胁迫条件下,A25显著高于对照和A6。gydF4y2Ba
在叶片中总酚浓度的情况下(图。gydF4y2Ba4gydF4y2BaC),在实验结束时,我们没有发现两组对照条件的显著差异。然而,在盐胁迫后,观察到显著的差异,在A25的情况下达到最大值。gydF4y2Ba
关于HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba决心(图。gydF4y2Ba4gydF4y2Bad) 14DAT时,耐受性和敏感品系叶片积累差异明显。在对照条件下,A6积累量最高,盐胁迫时A6积累量降低。相反,A25显著增加HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba与对照条件或盐胁迫下A6添加量比较。gydF4y2Ba
最后,在实验结束时,测定了叶片中脯氨酸含量及其推测基因CaP5CS (CA06g06110)的相对表达量(图6)。gydF4y2Ba4gydF4y2Bae-f)。在脯氨酸含量的情况下(图。gydF4y2Ba4gydF4y2Bae), A6最低,盐胁迫条件与对照无显著差异;相反,A25在盐胁迫下的积累量高于对照或A6。在CaP5CS基因的相对表达情况下也发现了类似的结果(图5)。gydF4y2Ba4gydF4y2Baf),盐胁迫条件下A25表达量较对照或盐胁迫下A6表达量显著增加2倍;然而,我们也检测到,在盐胁迫条件下,与对照相比,A6的CaP5CS表达增加。gydF4y2Ba
转录组表达结果gydF4y2Ba
通过微阵列实验分析,了解A25的转录组学变化,以解释其对氯化钠的耐受性。gydF4y2Ba
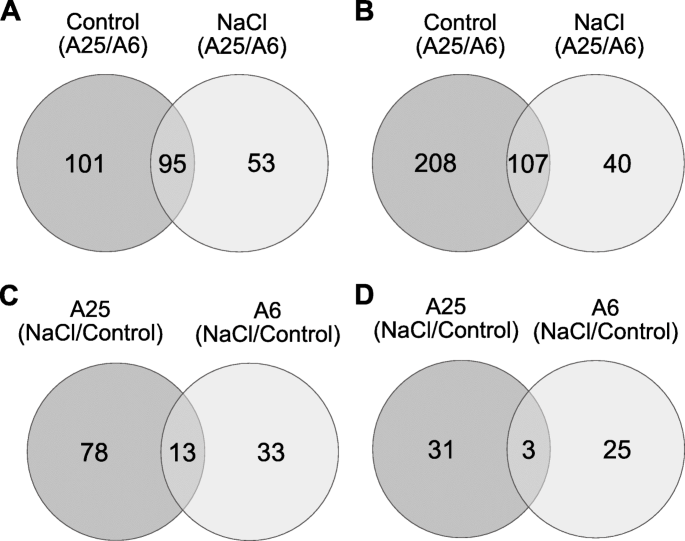
在A25与A6对照条件下,分别有196个和315个基因上调和下调(图5)。gydF4y2Ba5gydF4y2BaA, b),其中95个上调基因和107个下调基因在对照和盐胁迫条件下共同表达。在所有这些基因中,强调A25和A6中与细胞壁生物合成和扩张(PMEI13, TUB8, EXPA13, XK-1, PME1, CEL5, CSLE1),蜡和脂肪酸生物合成(KASI, LACS2),细胞分裂(CDC2),维生素运输(BASS1), aba信号(SnRK2.10, TINY2和ERD4)和光合作用(PSBP-1)相关的上调基因是很重要的。与A6相比,与细胞屏障形成相关的基因如木质素(PRX71, PRX66)和蜡质(WS6D, CER1)在A25中表达下调。胁迫保护基因(CAMTA5, JAR1, CBL9)和光合作用基因(NDHG, CCB3)的下调(表4)gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba)是值得注意的。根据这些发现,功能性GO分析显示了相关的结果(附加文件gydF4y2Ba2gydF4y2Ba,图S1)。gydF4y2Ba
我们可以检查与“对压力的反应”、“对非生物或生物刺激的反应”、“转运”和“信号转导”相关的基因的丰度。关于细胞成分,我们强调与“叶绿体”、“细胞壁”或“质体”相关的显著数量的基因。KEGG路径(附加文件gydF4y2Ba1gydF4y2Ba表S1-2)显示了这组基因的显著结果。“次生代谢物的生物合成”、“角质、亚嘌呤和蜡的生物合成”、“果糖和甘露糖的代谢”和“光合生物的碳固定”是下调基因的富集途径。gydF4y2Ba
每个加入的基因对盐胁迫(NaCl/对照)的反应非常不同,只有13个上调基因和3个下调基因共同表达(如CSD1, MIOX1)(图1)。gydF4y2Ba5gydF4y2Bac, d)。关于A25的加入,特异性表达了78和31个基因(图。gydF4y2Ba5gydF4y2Bac, d).抗应激(JAR1, CAMTA5, CBL9, HAB1),细胞壁(MIOX5, EXLB1),多胺生物合成(SPDS3),光保护(FIB1A)和淀粉降解(BAM1)相关基因上调(表gydF4y2Ba3.gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba).相反,光合作用相关基因(PSAG, PSAO, PORA, CYP38)和与ABA信号相关的磷酸酶PP2C (HAI3)被显著抑制。这些deg的GO分析在A25(附加文件gydF4y2Ba2gydF4y2Ba(图S3)显示了与对照条件相似的显著类别,揭示了31个与“应激反应”类别相关的差异表达基因。关于KEGG路径(附加文件gydF4y2Ba1gydF4y2Ba(表S7-S8),“精氨酸和脯氨酸代谢”、“内质网蛋白加工”等范畴在盐胁迫后A25特异上调基因中富集。gydF4y2Ba
对于A6的加入,盐胁迫后分别发现了33个和25个特异性上调和下调基因(图。gydF4y2Ba5gydF4y2Bac, d),其中与细胞膨胀(EXPA4)、光合作用(PSBP-1、TROL、psai -2)和淀粉降解(BAM5)相关的基因下调(表5)gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba).盐胁迫后,氧化石墨烯富集了A6细胞中不同种类的DEGsgydF4y2Ba2gydF4y2Ba图S4)与A25在相同条件下相似,但基因数量显著降低。另一方面,我们强调了“光合作用”作为KEGG富集途径在对照条件下A6和盐胁迫后A6中特定下调的DEGs中。gydF4y2Ba
最后,我们还分析了盐胁迫条件下A25和A6的转录组差异。比较发现,在盐胁迫条件下特异性表达的上调基因有53个,下调基因有40个。gydF4y2Ba5gydF4y2Baa, b).伴侣蛋白(J8, TTA1)、光合作用(CcdA)、离子稳态(OCT4, PHT1;4;TIL)、细胞膨胀(EXPA4)、类黄酮生物合成(TT4)和ABA信号传导(SnrK2.5)上调,而参与光合作用(PPD1、PORA)和蜡生物合成(CER1)的基因下调(见表gydF4y2Ba5gydF4y2Ba;额外的文件gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
在这项工作中,我们分析了对照和盐胁迫条件下的两个辣椒品种A25和A6的基因表达,这两个品种以前从农学和生理学角度被分类为对盐胁迫条件的耐受和敏感[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].在本研究中,A25的加入在对照条件下表现出与细胞生长、分裂和细胞壁扩张相关基因的激活。这一证据,以及淀粉降解和防御途径的失活,为A25提供了相对于A6的优势,因为我们观察到生物量的增强。事实上,有几位作者已经可视化地看到了在种类或种类上的差异gydF4y2Ba拟南芥gydF4y2Ba,胡椒或番茄[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba]在可能影响盐胁迫耐受性等级的控制条件下。gydF4y2Ba
另一方面,我们在两个研究材料中发现了面对盐胁迫的不同策略,在14DAT时赋予了不同的耐受性等级。在下面的几个部分中,我们解释了这个复杂的基因调节网络在响应盐度胁迫时所影响的主要过程。gydF4y2Ba
激素信号gydF4y2Ba
激素信号和生物合成一直被认为是调节植物对胁迫的耐受性或敏感性的一个基本要点[gydF4y2Ba25gydF4y2Ba].因此,我们的研究结果发现了几个与茉莉酸(JAs)和脱落酸(ABA)合成、降解或信号传导有关的基因,这些基因可以解释所分析材料的行为。gydF4y2Ba
茉莉酸盐是在不同非生物胁迫下调控一系列过程的关键元素[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].然而,它们需要与一系列化合物结合才具有活性[gydF4y2Ba29gydF4y2Ba].我们发现,在盐胁迫和对照比较时,A25加入的茉莉酸盐抗性基因1 (JAR1)调控上调,而A6没有。JAR1基因负责产生活性茉莉基异亮氨酸(JA-Ile)共轭物。有几位作者通过外用证明JAs可以提高不同抗氧化酶的活性、生长发育、光合活性和NagydF4y2Ba+gydF4y2Ba体内平衡(gydF4y2Ba26gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].gydF4y2Ba
ABA是一种众所周知的激素,在植物对不同非生物胁迫的耐受中起着重要作用,它在植物生长发育中发挥着广泛的功能,通过气孔的打开调节植物的水分平衡,在渗透胁迫的耐受中起着至关重要的作用[gydF4y2Ba32gydF4y2Ba].增加ABA浓度和信号传递是几位作者描述的耐受的广泛响应,这有利于气孔关闭,从而避免过度蒸腾。然而,这一事实也损害了植物的生长,因为它降低了光合作用的活性[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].在我们的实验中,我们发现A25中的几个DEGs被描述为ABA的调节因子,或被ABA信号调节(HAB1, ERD4, CAMTA5, Tiny2, CBL9, Snrk2.5, Snrk2.10, HAI3),因此,它们在控制耐受度中起着核心作用。gydF4y2Ba
在所有在A25中发现的与aba相关的DEGs中,最相关的是对ABA1 (HAB1)高度敏感的上调基因。HAB1编码一种功能型2C蛋白磷酸酶(PP2C),据报道,HAB1是ABA信号传导的正向或负向调控因子,这取决于剪接变体[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].事实上,该基因的过表达会导致轻微或主要的ABA敏感性,改变气孔打开和基因表达[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].gydF4y2Ba
钙调素结合转录激活因子家族(CAMTA)是一种转录因子家族,据报道,该家族受ABA调控,并在抗应激能力中发挥重要作用[gydF4y2Ba37gydF4y2Ba].已有研究表明,CAMTA家族可以与脱水反应元件结合(DREB)转录因子家族不同成员的启动子结合,并调节应激反应[gydF4y2Ba38gydF4y2Ba].在我们的研究中,我们发现在A25的加入中CAMTA5基因和DREB成员TINY2上调,这可能表明这两个基因通过改善生长、发育、胁迫响应基因的表达或aba介导的气孔关闭来增强对盐胁迫的响应[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].gydF4y2Ba
生物量和细胞生长gydF4y2Ba
盐胁迫对细胞生长和植物生物量有负面影响。然而,更大的生物量保存被认为是宽容的标志[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].在本研究中,与在盐胁迫条件下加入的A6相比,在14DAT时A25的根系和空气生物量保持得更好。生物量保存通常与与细胞生长和分裂相关的各种基因的差异表达有关,其中一些在本实验中被识别出来。其中一个基因是aba相关基因ERD4(对脱水早反应4),在对照和盐胁迫条件下,该基因在A25/A6比较中上调。该基因在耐受转基因中被描述为过表达gydF4y2Ba答:芥gydF4y2Ba添加盐时的植物[gydF4y2Ba47gydF4y2Ba].gydF4y2Ba
改善植物生长的关键之一是植物保持水分状态的能力。加盐后,植物细胞中水分含量减少;为了避免它,植物设置了不同的机制。其中,广泛兼容渗透物的积累,如脯氨酸,是帮助降低Ψ的关键gydF4y2Ba年代gydF4y2Ba[gydF4y2Ba48gydF4y2Ba].在此,我们证明了在盐胁迫下,耐受性增加维持在较低的渗透势水平,并在叶片中积累更多的脯氨酸含量,这可能与植物水分状态的保存有关,如前所述[gydF4y2Ba49gydF4y2Ba].事实上,我们还发现CaP5CS基因的上调与脯氨酸含量(RgydF4y2Ba2gydF4y2Ba= 0.85),这被描述为容忍的信号[gydF4y2Ba4gydF4y2Ba].尽管有这些结果,我们不排除参考文献中描述的其他化合物的可能性,如糖、甜菜碱或离子等不相容的渗透剂都参与了降低渗透电位[gydF4y2Ba48gydF4y2Ba].gydF4y2Ba
我们还检测到一系列与细胞分裂和扩张相关的A25基因的上调。其中一个基因是细胞分裂控制2 (CDC2),它调节有丝分裂中G1/S和G2/M的过渡[gydF4y2Ba50gydF4y2Ba].已有研究表明,干旱等非生物胁迫会对CDC2活性产生负面影响[gydF4y2Ba51gydF4y2Ba].在盐胁迫下,A25的表达提高了6.91倍,细胞分裂节律得到改善。此外,我们发现在盐胁迫下,与对照或A6连接相比,A25连接的扩展蛋白基因表达量增加,负责植物细胞壁的非酶性松动和延伸[gydF4y2Ba52gydF4y2Ba].这一发现表明,A25改善了细胞壁的扩张和膨胀,这可能会导致更好的生长和发育,正如其他作者已经证明的那样[gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].gydF4y2Ba
淀粉降解gydF4y2Ba
非生物胁迫也可能影响淀粉的积累和降解,因为当光合作用受到限制时,淀粉可能被重新动员,释放能量、糖、碳和衍生代谢物[gydF4y2Ba55gydF4y2Ba].一般来说,在盐胁迫条件下淀粉含量下降,尽管在耐盐植物中观察到淀粉积累增加[gydF4y2Ba56gydF4y2Ba,正如我们在A25的实验中注意到的那样。然而,淀粉更好地降解为可溶性糖也与抗应激能力有关,因为它们可能与激素、基因和蛋白质相互作用,调节不同的生长和发育途径[gydF4y2Ba57gydF4y2Ba].与此相一致的是,β-淀粉酶1 (BAM1)在A25的加入中只在盐胁迫条件下上调,这将响应成熟叶片的保护细胞和叶肉细胞的短暂淀粉降解,正如其他作者在渗透和盐胁迫条件下已经观察到的[gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba].gydF4y2Ba
离子体内平衡gydF4y2Ba
当植物接触到盐时,保持离子稳态以避免毒素积累是至关重要的。植物通过不同的机制来应对这种情况,这些机制有助于耐盐性,其中一些在参考书目中有很好的记录[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba60gydF4y2Ba].gydF4y2Ba
钾是植物细胞中最重要和最丰富的阳离子之一gydF4y2Ba+gydF4y2Ba,在盐胁迫条件下,由于钠的替换,钠含量降低gydF4y2Ba+gydF4y2Ba.增强的KgydF4y2Ba+gydF4y2Ba两个器官中A25的内稳态表明KgydF4y2Ba+gydF4y2Ba正如其他作者已经证明的那样,对盐的耐受力起了关键作用[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].在这一行中,之前已经描述过,这种阳离子与其他兼容的渗透剂一起,可以有助于降低植物的渗透势[gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba],由于在A25加入时积累更为明显,在这里什么可以表明类似的功能。在本实验中,我们还发现A25可能具有某种保持K的机制gydF4y2Ba+gydF4y2Ba细胞内的差异分析;一个可能的候选者是AKT1,一种专门引入K的被动转运蛋白gydF4y2Ba+gydF4y2Ba变成根和叶肉细胞[gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].因此,我们检测到在盐胁迫条件下,A25加入时ABA信号CBL9(钙调磷酸酶b样蛋白9)的负调控因子上调,而阳性调控因子HAI3(高ABA诱导的3)下调[gydF4y2Ba65gydF4y2Ba].这些基因在AKT1的调控中起相反的作用,因为CBL9是阳性调控因子[gydF4y2Ba66gydF4y2Ba],而HAI3可能是一种抑制因子,因为该基因与HAI2具有高度同源性[gydF4y2Ba67gydF4y2Ba,gydF4y2Ba68gydF4y2Ba].gydF4y2Ba
Cl的积累gydF4y2Ba−gydF4y2Ba离子,尤其是NagydF4y2Ba+gydF4y2Ba在辣椒植物组织中发挥多种生理功能[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].当钠gydF4y2Ba+gydF4y2Ba当离子达到毒性水平时,植物可减少离子流入细胞,并改善离子在其他无毒细胞器中的外排和区隔化[gydF4y2Ba7gydF4y2Ba].在我们的实验中,我们发现NagydF4y2Ba+gydF4y2Ba在14DAT后,在两个材料的根中积累。由于这种积累在A25幼苗中尤为明显,而且与A6幼苗相比,根系生物量有所提高,这种影响可能与液泡或其他细胞器中的分隔化有关,正如其他作者已经证明的那样[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba69gydF4y2Ba].尽管其毒性作用对植物生长结果有负面影响,但在盐度下离子的积累有助于维持植物的膨压[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba70gydF4y2Ba].通过吸收无机离子来调节渗透势意味着比细胞内合成的有机分子所消耗的能量要低得多[gydF4y2Ba71gydF4y2Ba].gydF4y2Ba
在树叶,NagydF4y2Ba+gydF4y2Ba但只有A25的生物量提高了,这表明NagydF4y2Ba+gydF4y2Ba这两种辣椒的管理方式都是不同的。与此同时,我们注意到叶片中的离子运输与A25叶绿体的保护密切相关,我们发现了一些相关基因。其中一个基因是BASS1(胆汁酸/钠转运体1),该基因在A25/A6对照和盐胁迫处理中上调。这个基因,编码Na的转运体gydF4y2Ba+gydF4y2Ba而pantoate,维生素B5的前体,在A25中可以发挥双重作用:一方面,它可以保护人体免受钠的侵袭gydF4y2Ba+gydF4y2Ba叶绿体的毒性以保存光合作用响应另一方面,促进泛酸循环[gydF4y2Ba72gydF4y2Ba,gydF4y2Ba73gydF4y2Ba].我们还发现,在盐度胁迫下,A25基因TIL(温度诱导lipocalin)较A6基因上调,可以避免Na过量gydF4y2Ba+gydF4y2Ba和ClgydF4y2Ba−gydF4y2Ba通过这种方式保护叶绿素b的降解而在叶绿体中积累[gydF4y2Ba74gydF4y2Ba].gydF4y2Ba
盐胁迫条件下A25/A6比较中上调的基因为OCT4(有机阳离子/肉碱转运体4),降低了有毒Na的浓度gydF4y2Ba+gydF4y2Ba在细胞质中通过液泡积累。这个基因家族负责Na的共带gydF4y2Ba+gydF4y2Ba有机分子,如肉碱[gydF4y2Ba75gydF4y2Ba,gydF4y2Ba76gydF4y2Ba].因此,它将在我们耐受的加入中通过离子稳态在渗透平衡中发挥重要作用。gydF4y2Ba
包括光gydF4y2Ba
当植物接触到盐胁迫时,主要的影响过程之一是光合作用。本文分析的光合参数表明,与对照条件相比,只有A25在7DAT时保持了这些参数,但在试验结束时,两种品种受到的影响相同。这些原因表明,A25使植物的光合能力在较长时间内保持在较高水平[gydF4y2Ba77gydF4y2Ba].另外,部分参与光合作用保护的基因在两份材料中表达存在差异。与此同时,我们发现aba相关基因纤原蛋白1A (FIB1A)在A25 NaCl/对照中上调,这表明纤原蛋白在叶绿体中积累,从而提高PSII的保护和效率[gydF4y2Ba78gydF4y2Ba].与FIB1A一起,其他先前解释过的基因也参与了光保护,如TIL、BASS1或JAR1。gydF4y2Ba
ROS清除gydF4y2Ba
当光合作用被盐胁迫干扰时,会检测到一系列的次生效应,如氧化应激,这可能导致活性氧(ROS)达到有毒水平[gydF4y2Ba79gydF4y2Ba].通过有效的ros清除机制减少所有这些分子数量的能力对于获得耐受性至关重要。在我们的具体案例中,我们发现改善酚类化合物的积累在盐胁迫下A25的加入中得到了加强,这已被广泛描述为提高植物的抗氧化能力[gydF4y2Ba80gydF4y2Ba].此外,HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在植物中,如A25,已经被几位作者确定为ROS损伤的信号。尽管如此,在过去的几十年里,它也被认为是激活与非生物胁迫适应相关的植物抗氧化过程的次要信使,从而介导对非生物胁迫的适应性反应[gydF4y2Ba16gydF4y2Ba,因此提出了类似的函数。如其他作者已经描述过的,在A25耐受位点中其他分子的积累,如脯氨酸,也可能与ROS解毒和盐保护有关[gydF4y2Ba81gydF4y2Ba].在基因表达方面,我们发现在盐胁迫条件下A25基因SPDS3(亚精胺合成酶3)上调,该基因催化亚精胺的形成,亚精胺是一种多胺,可以改善植物的多个过程,如ROS清除,KgydF4y2Ba+gydF4y2Ba/ NagydF4y2Ba+gydF4y2Ba保护类囊体膜的比例和PSII效率及叶绿素含量[gydF4y2Ba82gydF4y2Ba,gydF4y2Ba83gydF4y2Ba,gydF4y2Ba84gydF4y2Ba].我们还发现了盐胁迫条件下A25中另一个上调的基因,叫做蔗糖非发酵1相关蛋白激酶2-10 (SnRK2.10),它调节几种ros相关酶的基因表达、蛋白水平和/或酶活性,也参与HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba体内积累和抗坏血酸循环调节gydF4y2Ba答:芥gydF4y2Ba[gydF4y2Ba85gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
通过对两种材料生理参数和DEGs的分析,我们得出结论:在盐胁迫下A25耐系同时发生了不同的耐受策略,aba信号是调控的关键点,不同基因与生理性状之间建立了一个重要的网络,揭示了盐胁迫诱导的复杂反应。这些结果为研究辣椒等重要作物的盐胁迫机制提供了有价值的结果。值得注意的是,我们还发现了几个可能与耐受性有关的基因,但它们的功能尚未被发现。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
基于以往的研究[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba24gydF4y2Ba的两个后缀gydF4y2Bac .建立gydF4y2Ba根据它们对盐胁迫的耐受性选择:代码A6 (Pasilla bajio, Mexico)是敏感的,代码A25 (Numex big Jim, Nuevo Mexico)是耐受的。本研究所用的所有材料都属于瓦伦西亚农业多样性保护与改良研究所(西班牙瓦伦西亚大学Politècnica de València)的种质库。Maria José Diez, COMAV主任,分别用沉积号BGV013994和BGV014452验证A6和A25。gydF4y2Ba
种子被播种在104孔的种子托盘中,填充有丰富的基质以便发芽。当植物长有6-8片真叶时,它们被放置在5升的聚乙烯罐中,罐内覆盖铝板(根部之前被清除基质)。罐子里装满营养液(以mmol L为单位)gydF4y2Ba−1gydF4y2Ba) 12.3没有gydF4y2Ba3.gydF4y2Ba−gydF4y2Ba, 1.02小时gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 2.45gydF4y2Ba4gydF4y2Ba2−gydF4y2Ba3, 24 ClgydF4y2Ba−gydF4y2Ba5.05 KgydF4y2Ba+gydF4y2Ba, 4.23gydF4y2Ba2 +gydF4y2Ba, 2.55毫克gydF4y2Ba2 +gydF4y2Ba微量元素(15.8 μM FegydF4y2Ba2 +gydF4y2Ba, 10.3 μM MngydF4y2Ba2 +gydF4y2Ba, 4.2 μM ZngydF4y2Ba2 +gydF4y2Ba, 43.5 μmgydF4y2Ba+gydF4y2Ba1.4 μM CugydF4y2Ba2 +gydF4y2Ba),以人工充气。该营养液的电导率(EC)和pH值为1.7 dS mgydF4y2Ba−1gydF4y2Ba和6.5,分别。每天添加营养液以补偿吸收。经过14 d的植物驯化,通过更换盆栽溶液添加NaCl 70 mM诱导盐胁迫,得到的EC为8.5 dS mgydF4y2Ba−1gydF4y2BapH值为6.1。布局设计完全随机,每次加入和处理10株。gydF4y2Ba
在培养和实验过程中,植物生长在瓦伦西亚理工大学(UPV, Valencia, Spain)的温室中,自然光条件(800-1000 μmol m)下gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba),温度范围为18℃~ 25℃,相对湿度为50 ~ 70%。gydF4y2Ba
除光合参数在胁迫诱导后第7天(7DAT)和第14天(14DAT)测定外,其余参数均在胁迫诱导后第14天测定。gydF4y2Ba
生物量测定gydF4y2Ba
在14DAT的生物量参数下,每次添加和处理6个复制体。将气生器官和根系分离并称重(FW)。随后,将它们置于65°C的烤箱中72小时,使其干燥。在此之后,再次称量所有材料以确定干重(DW)。gydF4y2Ba
气体交换的测量gydF4y2Ba
有限公司gydF4y2Ba2gydF4y2Ba固定利率(gydF4y2BaNgydF4y2Baμ摩尔公司gydF4y2Ba2gydF4y2Ba米gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba气孔导度(ggydF4y2Ba年代gydF4y2Ba摩尔HgydF4y2Ba2gydF4y2BaO mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba), substomatal有限公司gydF4y2Ba2gydF4y2Ba浓度(Ci, μmol COgydF4y2Ba2gydF4y2Ba摩尔gydF4y2Ba−1gydF4y2Ba)和蒸腾速率(E, mmol HgydF4y2Ba2gydF4y2BaO mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)用便携式LI-COR 6400 (LI-COR Inc.)红外气体分析仪在7DAT和14DAT进行测定。测量是在饱和光条件下进行的(1000 μmol量子米)gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba),参考公司gydF4y2Ba2gydF4y2Ba400 μmol COgydF4y2Ba2gydF4y2Ba摩尔gydF4y2Ba−1gydF4y2Ba在24℃和75%的相对湿度下,在完全展开的叶片(从顶端开始的第3 -4叶)上生长。测量时间为09:00 - 12:00 (UT + 01:00)。布局是随机的,每次加入和处理5次重复。gydF4y2Ba
离子测定gydF4y2Ba
每添加6个重复,收集处理后的叶和根,在65°C下干燥72 h,试验结束(14DAT)。干燥的样品用砂浆研磨,用于离子分析。gydF4y2Ba
与钠gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba样品(叶0.2 g,根0.1 g)在550°C的马弗炉中焚化12 h。离子用2%硝酸在40°C超声浴中提取30分钟。这种离子的浓度由ICP发射光谱法(iCAP 6000, Thermo Scientific)测定。英国剑桥大学,英国)。gydF4y2Ba
关于氯浓度(ClgydF4y2Ba−gydF4y2Ba),用0.1 N HNO提取干植物材料(0.125 g根和叶)gydF4y2Ba3.gydF4y2Ba在10% (v/v)醋酸中,用AgNO电位滴定法定量gydF4y2Ba3.gydF4y2Ba氯化物分析仪(Sherwood, MKII 926)。gydF4y2Ba
渗透势gydF4y2Ba
每加入和处理4个重复进行分析。首先,叶片样品在液氮中冷冻,保存在−80°C。之后,将样品导入1.5 mL的试管中,在9000倍的温度下离心10分钟gydF4y2BaggydF4y2Ba.用渗透计测量叶液(Digital渗透计,Wescor, Logan, UT, usa)。渗透物含量(mmol kggydF4y2Ba−1gydF4y2Ba)由范霍夫方程转化为MPa。gydF4y2Ba
淀粉含量gydF4y2Ba
淀粉测定按[gydF4y2Ba86gydF4y2Ba,每个基因型和治疗使用4个复制。新鲜样品在液氮中冷冻和研磨,保存在−80°C。样品(0.3 g叶片)与80% (v/v)的加热乙醇混合,在85°C下煮10 min 3次。之后,样品在10000的温度下离心gydF4y2Bax ggydF4y2Ba.沉淀物在35% (v/v)的高氯酸中重悬,室温静置24小时。之后,样品用水稀释,然后过滤。滤液与蒽醌酸溶液混合,放入沸水中浸泡7.5 min。冷却样品后,在630 nm处测量吸光度。以d -葡萄糖为标准。gydF4y2Ba
总酚含量gydF4y2Ba
总酚含量按[gydF4y2Ba87gydF4y2Ba与修改)。每个基因型和处理4个复制体冷冻,在液氮中研磨,保存在−80°C。样品(0.1 g叶)与1.5 mL 80%甲醇(v/v)混合,在室温超声浴中提取30分钟。然后将叶提取物在提取液中稀释(稀释倍数为1:4)。当样品被稀释时,0.7 mL Folin-Ciocalteu溶液(Sigma-Aldrich®;1:10稀释)和0.7 mL 6% (w/v) NagydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba加入样品中,在室温下黑暗条件下孵育1小时,然后在765 nm处测量吸光度。用没食子酸含量测定标准曲线。gydF4y2Ba
过氧化氢含量gydF4y2Ba
HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba量化内容如下[gydF4y2Ba88gydF4y2Ba,gydF4y2Ba89gydF4y2Ba),与修改。每个基因型和处理4个复制体冷冻并在液氮中研磨,然后在−80°C保存。样品(0.25 g叶片)与2 mL 0.1% (w/v)三氯乙酸(TCA)混合,在10,000离心gydF4y2Bax ggydF4y2Ba在4℃下放置8分钟。用0.6 mL 0.1% (w/v) TCA稀释0.4 mL样品。然后,加入0.5 mL 100mm磷酸钾缓冲液(pH = 7)和2 mL 1m KI,在室温下黑暗条件下孵育1 h。吸光度在390 nm处测定。标准曲线由已知H浓度确定gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba.gydF4y2Ba
脯氨酸测定与CaP5CS基因表达gydF4y2Ba
脯氨酸含量按[gydF4y2Ba90gydF4y2Ba].每个基因型和处理6个重复用于其测定。叶片在65°C下干燥72 h,然后用研钵研磨。将0.02 g样品与3%磺基水杨酸混合,然后在12000 x离心gydF4y2BaggydF4y2Ba为5分钟。然后在样品中加入冰醋酸和茚三酮试剂。在100°C下煮1小时。冷却样品后,在520 nm处测量吸光度。用已知的标准曲线计算脯氨酸含量。gydF4y2Ba
此外,根据“实时定量PCR (RT-qPCR)微阵列分析的验证”章节描述的方法,在14DAT条件下测定了与脯氨酸合成有关的辣椒delta -1-吡咯-5-羧酸合成酶(CaP5CS, CA06g06110)基因。用于其测定的引物为(5 ' -3 '):TTTAGTGATGGGTTCCGCTTTG(正向)和CAATCCCTCGAVCTCCAACTC(反向)。gydF4y2Ba
总RNA的提取及质量测定gydF4y2Ba
每次处理和添加三个重复的叶片在收获后立即在液氮中冷冻,并在- 80℃14DAT保存。在提取RNA的时候,样品被研钵和液氮磨成细粉末。使用machery - nagel NucleoSpin®RNA试剂盒提取总RNA。称量约0.1 g,按照生产者“从培养细胞和组织中纯化RNA”的方案获取RNA;DNA酶处理用于去除来自同一生产者的样品中的DNA。总RNA在50 μL不含rnase的水中洗脱,立即alias,−80℃保存。RNA总样品的260/280和260/230比值> 2(用NanoDrop ND1000测量)和RNA完整性(RIN)值> 7.0(用Agilent 5067-1511生物分析仪2100系统测量)用于微阵列杂交。gydF4y2Ba
微阵列杂交gydF4y2Ba
从叶片样本中提取的RNA由安捷伦技术公司在西班牙巴伦西亚IBMCP研究所(Instituto de Biología Molecular y Celular de Plantas)基因组服务中心制备,用于微阵列杂交。利用安捷伦单色RNA插入试剂盒和安捷伦低输入快速安捷伦标记试剂盒在安捷伦番茄微阵列上进行cDNA合成和标记。接下来用安捷伦基因表达杂交试剂盒和基因表达洗涤缓冲液进行微阵列杂交和洗涤。选用Agilent微阵列4*44 k (Agilent G2519F)进行杂交(参考文献AMADID 22270)gydF4y2Ba番茄gydF4y2Ba).使用GenePix 4000B (Axon Molecular Devices, Sunnyvale, USA)进行微阵列扫描,使用Agilent Feature Extraction软件9.5.1版本提取数据。gydF4y2Ba
微阵列数据分析gydF4y2Ba
得到的光斑强度值在Babelomics 5平台上进行分析[gydF4y2Ba91gydF4y2Ba].首先,对原始数据进行归一化处理,其中包括背景校正,将所有微阵列缩放到唯一的最终分布,并将数据重塑为合适的分布。在这一点上,数据从番茄探针转换到胡椒和gydF4y2Ba拟南芥gydF4y2Ba西班牙巴伦西亚IBMCP研究所的生物信息学服务,然后对同一辣椒基因的所有探针取平均值。然后将原始数据分为类别(加入和处理),并通过类比较检验进行分析。所有的差异表达基因(DEGs),无论是上调的还是下调的,都被描述为他们的同源基因gydF4y2Ba答:芥gydF4y2Ba通过Araport 11数据库进行分析。利用所得的DEGs,利用植物生物学生物分析资源平台(gydF4y2Bahttp://bar.utoronto.ca/#gydF4y2Ba),分类为“生物过程”、“分子功能”和“细胞成分”。此外,利用DAVID功能注释工具对DEGs进行KEGG富集分析[gydF4y2Ba92gydF4y2Ba].gydF4y2Ba
实时定量PCR (RT-qPCR)对微阵列分析的验证gydF4y2Ba
用于微阵列分析的叶片RNA也被用于验证从类比较中获得的结果。为此,我们首先用PrimeScript RT试剂试剂盒(Takara Bio)反转录RNA样本,总体积为20 μL。之后,将所有样本稀释50倍进行RT-qPCR。每孔取2 μL稀释样品(总体积为20 μL),用SYBR预混料Ex Taq (Tli RNseH plus, Takara Bio)进行反应。每个生物重复评价3个技术重复。设计相对标准曲线,得到平均相对表达式,得到最终结果。RT-qPCR采用StepOnePlus Real-Time PCR系统(Life Technologies)进行,反应顺序为95°C孵育10 min, 95°C孵育15 s, 60°C孵育1 min,循环40次。如果在分析的每个基因的熔解曲线中发现一个独特的峰值,则估计扩增特异性。EF1α和β-TUB作为内参基因,描述为[gydF4y2Ba93gydF4y2Ba,gydF4y2Ba94gydF4y2Ba],因为他们的结论是,他们适合于研究辣椒植物的盐胁迫。引物序列和得到的结果已在附加文件中详细说明gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
统计分析gydF4y2Ba
实验布局完全是随机设计。从生物量,气体交换测量,离子浓度分析,渗透势,淀粉,总酚,HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba脯氨酸含量和基因相对表达进行双向方差分析(Statgraphics Centurion XVI for Windows,统计图形公司),其中加入和处理都被认为是分析的因素。利用光合作用参数分别对7DAT和14DAT进行分析。由于这两个因素之间的相互作用显著,将双向方差分析的两个因素相加,进行单向方差分析。进一步比较采用Fisher最小显著性差异(LSD)检验gydF4y2BaPgydF4y2Ba使用相同软件时< 0.05。gydF4y2Ba
使用Babelomics平台对微阵列进行分类比较分析。采用Limma检验比较同一加入的不同处理(Salt/Control)和同一加入的不同处理(A25/A6)的基因比较,并采用Benjamini和Hochberg检验以降低误发现率。的调整gydF4y2BaPgydF4y2Ba-value选择在0.05。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究期间产生和/或分析的所有数据均包含在本文及其补充信息文件中。gydF4y2Ba
缩写gydF4y2Ba
- 7 dat:gydF4y2Ba
-
治疗后7天gydF4y2Ba
- 14 dat:gydF4y2Ba
-
治疗后14天gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- 一个gydF4y2BaNgydF4y2Ba:gydF4y2Ba
-
有限公司gydF4y2Ba2gydF4y2Ba固定利率gydF4y2Ba
- AKT1:gydF4y2Ba
-
拟南芥KgydF4y2Ba+gydF4y2Ba转运体1gydF4y2Ba
- BAM1:gydF4y2Ba
-
beta-amylase 1gydF4y2Ba
- BAM5:gydF4y2Ba
-
beta-amylase 5gydF4y2Ba
- BASS1:gydF4y2Ba
-
胆汁酸钠转运体家族gydF4y2Ba
- CAMTA5:gydF4y2Ba
-
钙调素结合转录激活因子5gydF4y2Ba
- CBL9:gydF4y2Ba
-
钙调磷酸酶b样蛋白gydF4y2Ba
- CCB3:gydF4y2Ba
-
辅助因子组合,配合物C (B6F)gydF4y2Ba
- CcdA:gydF4y2Ba
-
细胞色素c生物发生蛋白家族gydF4y2Ba
- CDC2:gydF4y2Ba
-
细胞分裂控制2gydF4y2Ba
- CEL5:gydF4y2Ba
-
纤维素酶5gydF4y2Ba
- CER1:gydF4y2Ba
-
Eceriferum 1gydF4y2Ba
- 置信区间:gydF4y2Ba
-
Substomatal有限公司gydF4y2Ba2gydF4y2Ba浓度gydF4y2Ba
- CSD1:gydF4y2Ba
-
铜/锌超氧化物歧化酶1gydF4y2Ba
- CSLE1:gydF4y2Ba
-
纤维素synthase-like E1gydF4y2Ba
- CYP38:gydF4y2Ba
-
还有38gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- DW:gydF4y2Ba
-
干重gydF4y2Ba
- 艾凡:gydF4y2Ba
-
蒸腾速率gydF4y2Ba
- 电子商务:gydF4y2Ba
-
导电性gydF4y2Ba
- EXLB1:gydF4y2Ba
-
Expansin-like B1gydF4y2Ba
- EXPA4:gydF4y2Ba
-
棒曲霉素A4gydF4y2Ba
- EXPA13:gydF4y2Ba
-
棒曲霉素A13gydF4y2Ba
- FIB1A:gydF4y2Ba
-
FIBRILLIN 1gydF4y2Ba
- 弗兰克-威廉姆斯:gydF4y2Ba
-
鲜重gydF4y2Ba
- g:gydF4y2Ba
-
气孔导水率gydF4y2Ba
- HAB1:gydF4y2Ba
-
对ABA1高度敏感gydF4y2Ba
- HAI3:gydF4y2Ba
-
高aba诱导的PP2C蛋白3gydF4y2Ba
- J8:gydF4y2Ba
-
伴侣dnaj结构域超家族蛋白gydF4y2Ba
- 是:gydF4y2Ba
-
JasmonategydF4y2Ba
- JAR1:gydF4y2Ba
-
Jasmonate耐1gydF4y2Ba
- KASI:gydF4y2Ba
-
3-酮酰基酰基载体蛋白合成酶IgydF4y2Ba
- LACS2:gydF4y2Ba
-
长链酰基辅酶a合成酶gydF4y2Ba
- MIOX1:gydF4y2Ba
-
肌醇加氧酶1gydF4y2Ba
- MIOX5:gydF4y2Ba
-
肌醇加氧酶5gydF4y2Ba
- NDHG:gydF4y2Ba
-
NADH,泛素/质体醌氧化还原酶,链6gydF4y2Ba
- OCT4:gydF4y2Ba
-
有机阳离子/肉碱转运蛋白gydF4y2Ba
- PHT1; 4:gydF4y2Ba
-
磷酸盐转运蛋白1;4gydF4y2Ba
- PME1:gydF4y2Ba
-
果胶methylesterase 1gydF4y2Ba
- PMEI13:gydF4y2Ba
-
植物转化酶/果胶甲基酯酶抑制剂超家族蛋白gydF4y2Ba
- PORA:gydF4y2Ba
-
原叶绿素酸脂氧化还原酶的gydF4y2Ba
- PP2C:gydF4y2Ba
-
蛋白磷酸酶2摄氏度gydF4y2Ba
- PPD1:gydF4y2Ba
-
光系统II反应中心PsbP家族蛋白gydF4y2Ba
- PRX66:gydF4y2Ba
-
过氧化物酶66gydF4y2Ba
- PRX71:gydF4y2Ba
-
过氧化物酶71gydF4y2Ba
- PSII:gydF4y2Ba
-
光系统IIgydF4y2Ba
- PSAE-2:gydF4y2Ba
-
光系统I亚基E-2gydF4y2Ba
- PSAG:gydF4y2Ba
-
光系统I亚基GgydF4y2Ba
- PSAO:gydF4y2Ba
-
光系统I亚基OgydF4y2Ba
- PSBP-1:gydF4y2Ba
-
光系统II亚基P-1gydF4y2Ba
- RH:gydF4y2Ba
-
相对湿度gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- SnrK2.5:gydF4y2Ba
-
snf1相关蛋白激酶2.5gydF4y2Ba
- SnRK2.10:gydF4y2Ba
-
snf1相关蛋白激酶2.10gydF4y2Ba
- SPDS3:gydF4y2Ba
-
亚精胺合成酶3gydF4y2Ba
- 直到:gydF4y2Ba
-
温度引起lipocalingydF4y2Ba
- 控制:gydF4y2Ba
-
类囊体rhodanese-like蛋白质gydF4y2Ba
- TT4:gydF4y2Ba
-
查尔酮和二苯乙烯合成酶家族蛋白gydF4y2Ba
- TTA1:gydF4y2Ba
-
I类热休克蛋白,推定/二氧化钛1gydF4y2Ba
- TUB8:gydF4y2Ba
-
β微管蛋白8gydF4y2Ba
- WS6D:gydF4y2Ba
-
o-酰基转移酶(WSD1-like)家族蛋白gydF4y2Ba
- XK-1:gydF4y2Ba
-
木酮糖激酶1gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
辣椒作物:简介。作者:Ramchiary N, Kole C,编辑。辣椒基因组。瑞士:施普林格;2019.1 - 8页。gydF4y2Bahttps://doi.org/10.1007/978-3-319-97217-6_1gydF4y2Ba.gydF4y2Ba
- 2.gydF4y2Ba
conde罗德里格斯低频。辣椒。在:Maroto Borrego JV, Baixauli Soria C,编辑。栽培hortícolas al aire libre。Cajamar。Cajamar;2017.p . 471 - 507。gydF4y2Ba
- 3.gydF4y2Ba
艾尔斯RS,韦斯科特DW。农业用水水质。罗马:粮农组织;1985.gydF4y2Ba
- 4.gydF4y2Ba
Bojórquez-Quintal E, Velarde-Buendía A, Ku-González Á, Carillo-Pech M, Ortega-Camacho D, Echevarría-Machado I,等。辣椒植株耐盐机制:脯氨酸积累、离子动态和钠根梢的分配和分隔。植物科学进展2014;5:1-14。gydF4y2Bahttps://doi.org/10.3389/fpls.2014.00605gydF4y2Ba.gydF4y2Ba
- 5.gydF4y2Ba
Zaman M, Shahid SA, Heng L.使用核和相关技术的盐度评估、缓解和适应指南。可汗:施普林格;2018.gydF4y2Bahttps://doi.org/10.1007/978-3-319-96190-3gydF4y2Ba.gydF4y2Ba
- 6.gydF4y2Ba
王晓燕,王晓燕,王晓燕。辣椒对盐胁迫和干旱胁迫的生理响应。现代社会科学。2003;28(2):47 - 52。gydF4y2Bahttps://doi.org/10.21273/JASHS.128.1.0048gydF4y2Ba.gydF4y2Ba
- 7.gydF4y2Ba
Bojórquez-Quintal JE, Echevarría-Machado L, Medina-Lara Á, Martinez-Estevez M.盐碱化世界中的植物挑战:以辣椒为例。中国生物医学工程学报,2012;11(72):13614-26。gydF4y2Bahttps://doi.org/10.5897/AJB12.2145gydF4y2Ba.gydF4y2Ba
- 8.gydF4y2Ba
杨志强,杨文华,杨文华,等。植物耐盐机理。植物学报2008;59(1):651-81。gydF4y2Bahttps://doi.org/10.1146/annurev.arplant.59.032607.092911gydF4y2Ba.gydF4y2Ba
- 9.gydF4y2Ba
Isayenkov SV, Maathuis FJM。植物盐胁迫:仍有许多未解之谜。植物科学进展2019;10:1-11。gydF4y2Bahttps://doi.org/10.3389/fpls.2019.00080gydF4y2Ba.gydF4y2Ba
- 10.gydF4y2Ba
侯赛因先生,巴塞尔GW,普里查德J,夏尔马GP,福特-劳埃德BV。通过微阵列修饰显著性分析确定水稻不同基因型盐胁迫响应基因的特异表达谱。植物科学进展2016;7:1-17。gydF4y2Bahttps://doi.org/10.3389/fpls.2016.00567gydF4y2Ba.gydF4y2Ba
- 11.gydF4y2Ba
Aktas H, Abak K, Cakmak I.辣椒对盐度响应的基因型变异。Sci Hortic(阿姆斯特丹)。2006年,110(3):260 - 6。gydF4y2Bahttps://doi.org/10.1016/j.scienta.2006.07.017gydF4y2Ba.gydF4y2Ba
- 12.gydF4y2Ba
Penella C, Nebauer SG, Lopéz-Galarza S, San Bautista A, Gorbe E, Calatayud A.作为砧木的辣椒基因型的耐盐性评价。食品与农业环境学报,2013;11:1101-7。gydF4y2Ba
- 13.gydF4y2Ba
Özdemir B, Tanyolaç ZÖ,乌鲁卡布基K, Onus AN。部分辣椒品种耐盐性的评价。国际农业创新学报2016;5:2319-1473。gydF4y2Ba
- 14.gydF4y2Ba
López-Serrano L, Penella C, San-Bautista A, López-Galarza S, Calatayud A.辣椒品种对盐度和水分胁迫的生理变化。西班牙农业学报2017;15(3):1-10。gydF4y2Bahttps://doi.org/10.5424/sjar/2017153-11147gydF4y2Ba.gydF4y2Ba
- 15.gydF4y2Ba
Penella C, Nebauer SG, Quiñones A, San Bautista A, López-Galarza S, Calatayud A.部分根茎通过离子调节提高辣椒对轻度盐的耐受性。植物科学。2015;230:12-22。gydF4y2Bahttps://doi.org/10.1016/j.plantsci.2014.10.007gydF4y2Ba.gydF4y2Ba
- 16.gydF4y2Ba
López-Serrano L, Canet-Sanchis G, Vuletin Selak G, Penella C, San Bautista A, López-Galarza S,等。处理盐胁迫的辣椒杂交种砧木的生理特性。植物物理与生物化学,2020;148:207-19。gydF4y2Bahttps://doi.org/10.1016/j.plaphy.2020.01.016gydF4y2Ba.gydF4y2Ba
- 17.gydF4y2Ba
李涛,徐旭,李勇,王辉,李智,李卓。热胁迫下热感辣椒和耐热辣椒品种转录组差异分析。植物生物学杂志,2015;58(6):411-24。gydF4y2Bahttps://doi.org/10.1007/s12374-015-0423-zgydF4y2Ba.gydF4y2Ba
- 18.gydF4y2Ba
王杰,吕杰,刘铮,刘勇,宋杰,马勇,等。辣椒(Capsicum annuum L.)转录组学和代谢组学在热胁迫下的整合。国际分子科学杂志2019;20(20):5042。gydF4y2Bahttps://doi.org/10.3390/ijms20205042gydF4y2Ba.gydF4y2Ba
- 19.gydF4y2Ba
Rai VP, Rai A, Kumar R, Kumar S, Kumar S, Singh M,等。微阵列分析鉴定辣椒抗卷曲叶病毒基因。基因组学数据。2016;9:140-2。gydF4y2Bahttps://doi.org/10.1016/j.gdata.2016.08.002gydF4y2Ba.gydF4y2Ba
- 20.gydF4y2Ba
李江,杨P,康J, Gan Y, Yu J, Calderon-Urrea,等。对辣椒(Capsicum annuum)的转录组分析揭示了24-表油菜素内酯在低温反应中的作用。植物科学进展2016;7:1-17。gydF4y2Bahttps://doi.org/10.3389/fpls.2016.01281gydF4y2Ba.gydF4y2Ba
- 21.gydF4y2Ba
林长平,林少华,白伟,李sc .辣椒胚胎晚期丰富蛋白CaLEA1在调控脱落酸信号通路和干旱、盐胁迫响应中的作用。杂志。2015;154(4):526 - 42。gydF4y2Bahttps://doi.org/10.1111/ppl.12298gydF4y2Ba.gydF4y2Ba
- 22.gydF4y2Ba
王金娥,刘克坤,李东伟,张艳玲,赵强,何艳梅,等。辣椒过氧化物酶CanPOD基因参与了辣椒植物病的防御反应和非生物胁迫的耐受性。国际分子生物学杂志,2013;14(2):3158-77。gydF4y2Bahttps://doi.org/10.3390/ijms14023158gydF4y2Ba.gydF4y2Ba
- 23.gydF4y2Ba
转基因辣椒对盐胁迫的耐受性增强(gydF4y2Ba甜椒gydF4y2BaL.)植株中过量表达小麦反转运蛋白(TaNHX2)基因。摩尔品种。2016;36。gydF4y2Bahttps://doi.org/10.1007/s11032-016-0451-5gydF4y2Ba.gydF4y2Ba
- 24.gydF4y2Ba
Penella C, Landi M, Guidi L, Nebauer SG, Pellegrini E, Bautista AS,等。耐盐砧木通过维持光合作用和下沉强度来提高盐胁迫下辣椒的产量。植物生理学报2016;193:1-11。gydF4y2Bahttps://doi.org/10.1016/j.jplph.2016.02.007gydF4y2Ba.gydF4y2Ba
- 25.gydF4y2Ba
柳洪,赵永根。植物抗盐胁迫激素。植物生物学杂志,2015;58(3):147-55。gydF4y2Bahttps://doi.org/10.1007/s12374-015-0103-zgydF4y2Ba.gydF4y2Ba
- 26.gydF4y2Ba
丁宏,赖军,吴强,张松,陈磊,戴永生,等。茉莉酸补充了拟南芥脂氧合酶3在盐胁迫响应中的功能。植物科学。2016;244:1-7。gydF4y2Bahttps://doi.org/10.1016/j.plantsci.2015.11.009gydF4y2Ba.gydF4y2Ba
- 27.gydF4y2Ba
Balfagón D,森古普塔S, Gómez-Cadenas A, Fritschi FB, Azad RK, Mittler R,等。茉莉酸是植物适应强光和热胁迫的必要条件。植物杂志。2019;181(4):1668 - 82。gydF4y2Bahttps://doi.org/10.1104/pp.19.00956gydF4y2Ba.gydF4y2Ba
- 28.gydF4y2Ba
Ghaffari H, Tadayon MR, Nadeem M, Razmjoo J, Cheema M.叶片应用茉莉酸调节甜菜在水分不足生长下的抗氧化防御。西班牙农业论文集2020;17(4):1-12。gydF4y2Bahttps://doi.org/10.5424/sjar/2019174-15380gydF4y2Ba.gydF4y2Ba
- 29.gydF4y2Ba
北冈N,松原T,佐藤M,高桥K,若田S,川德H,等。拟南芥CYP94B3编码茉莉酰-l-异亮氨酸12-羟化酶,这是茉莉酸氧化分解代谢的关键酶。植物细胞学报,2011;52(10):1757-65。gydF4y2Bahttps://doi.org/10.1093/pcp/pcr110gydF4y2Ba.gydF4y2Ba
- 30.gydF4y2Ba
Ahmad P, Azooz MM, Prasad MNV。植物在盐胁迫下的生态生理及响应。纽约:施普林格;2013.gydF4y2Bahttps://doi.org/10.1007/978-1-4614-4747-4gydF4y2Ba.gydF4y2Ba
- 31.gydF4y2Ba
外源茉莉酸调节不同芸苔属植物生理、抗氧化防御和乙二醛酶系统,使芸苔属植物具有抗旱性。植物生物技术学报2014;8(3):279-93。gydF4y2Bahttps://doi.org/10.1007/s11816-014-0321-8gydF4y2Ba.gydF4y2Ba
- 32.gydF4y2Ba
费尔南多VCD,施罗德DF。ABA在拟南芥耐盐、耐干旱和耐旱性中的作用。在:Shanker A, Shanker C,编辑。植物非生物和生物胁迫研究进展与展望。IntechOpen。2016.507 - 24页。gydF4y2Bahttps://doi.org/10.5772/61957gydF4y2Ba.gydF4y2Ba
- 33.gydF4y2Ba
在两种盐胁迫下快速循环的芸苔属植物中,脱落酸浓度与叶面积减少有关。土壤植物。1996;179(1):男性。gydF4y2Bahttps://doi.org/10.1007/BF00011639gydF4y2Ba.gydF4y2Ba
- 34.gydF4y2Ba
Saez A, Apostolova N, Gonzalez-Guzman M, Gonzalez-Garcia MP, Nicolas C, Lorenzo O,等。蛋白磷酸酶2C HAB1的功能获得和功能丧失表型揭示了其作为脱落酸信号传导的负调控因子的作用。植物j . 2004; 37(3): 354 - 69。gydF4y2Bahttps://doi.org/10.1046/j.1365-313X.2003.01966.xgydF4y2Ba.gydF4y2Ba
- 35.gydF4y2Ba
王铮,姬宏,袁斌,王硕,苏超,姚斌,等。ABA信号通过拮抗HAB1变体进行微调。Nat Commun。2015;6:1-12。gydF4y2Ba
- 36.gydF4y2Ba
植物PP2C磷酸酶:在胁迫信号传递中的新功能。植物科学进展2004;9(5):236-43。gydF4y2Bahttps://doi.org/10.1016/j.tplants.2004.03.007gydF4y2Ba.gydF4y2Ba
- 37.gydF4y2Ba
魏明,徐旭,李晨。生物和非生物胁迫下赤杨CAMTA基因的鉴定与表达。Sci众议员2017;7(1):17910。gydF4y2Bahttps://doi.org/10.1038/s41598-017-18219-8gydF4y2Ba.gydF4y2Ba
- 38.gydF4y2Ba
王晓燕,王晓燕,王晓燕。植物钙调控转录的研究进展。摩尔。2010;3(4):653 - 69。gydF4y2Bahttps://doi.org/10.1093/mp/ssq019gydF4y2Ba.gydF4y2Ba
- 39.gydF4y2Ba
谢铮,Nolan T,姜浩,唐博,张明,李铮,等。AP2/ERF转录因子TINY在拟南芥中调节油菜素激素调节的植物生长和干旱响应。植物细胞。2019;31(8):1788 - 806。gydF4y2Bahttps://doi.org/10.1105/tpc.18.00918gydF4y2Ba.gydF4y2Ba
- 40.gydF4y2Ba
Galon Y, naave R, Boyce JM, Nachmias D, Knight MR, Fromm H.拟南芥钙调素结合转录激活因子(CAMTA) 3介导生物防御反应。2月。2008;582(6):943 - 8。gydF4y2Bahttps://doi.org/10.1016/j.febslet.2008.02.037gydF4y2Ba.gydF4y2Ba
- 41.gydF4y2Ba
Doherty CJ, Van Buskirk HA, Myers SJ, Thomashow MF。拟南芥CAMTA转录因子在冷调节基因表达和抗冻性中的作用。植物细胞。2009;21(3):972 - 84。gydF4y2Bahttps://doi.org/10.1105/tpc.108.063958gydF4y2Ba.gydF4y2Ba
- 42.gydF4y2Ba
Shkolnik D, Finkler A, Pasmanik-Chor M, Fromm H.钙调素结合转录激活因子6:发芽过程中Na+稳态的关键调节因子。植物杂志。2019;180(2):1101 - 18。gydF4y2Bahttps://doi.org/10.1104/pp.19.00119gydF4y2Ba.gydF4y2Ba
- 43.gydF4y2Ba
Kusvuran S, Yasar F, Ellialtioglu S, Abak K.利用一些筛选方法测定甜瓜(Cucumis melo L.)的耐盐性。农业生物学报2007;3:40-5。gydF4y2Ba
- 44.gydF4y2Ba
Tiwari JK, Munshi AD, Kumar R, Pandey RN, Arora A, Bhat JS,等。盐胁迫对黄瓜Na+ - K+比值、渗透液浓度、酚类物质和叶绿素含量的影响。植物学报,2010;32(1):103-14。gydF4y2Bahttps://doi.org/10.1007/s11738-009-0385-1gydF4y2Ba.gydF4y2Ba
- 45.gydF4y2Ba
费雷拉JFS,刘X,苏亚雷斯DL。田间栽培和盐胁迫下5个草莓商品品种的产量和成活率Sci Hortic(阿姆斯特丹)。2019; 243:401-10。gydF4y2Bahttps://doi.org/10.1016/j.scienta.2018.07.016gydF4y2Ba.gydF4y2Ba
- 46.gydF4y2Ba
Bartha C, Fodorpataki L, Del Carmen M-BM, Popescu O, Carvajal M.盐积累对莴苣品种耐盐性的影响。应用机器人食品质量。2015;88:42-8。gydF4y2Ba
- 47.gydF4y2Ba
刘颖,李红,石颖,宋颖,王婷,李颖。玉米脱水早期响应基因ZmERD4增强了拟南芥的耐干旱和耐盐能力。植物分子生物学报告2009;27(4):542-8。gydF4y2Bahttps://doi.org/10.1007/s11105-009-0119-ygydF4y2Ba.gydF4y2Ba
- 48.gydF4y2Ba
王晓燕,王晓燕,王晓燕。盐胁迫对植物生长的影响。植物对盐胁迫的适应机制。农学。2017;7(1):1-38。gydF4y2Bahttps://doi.org/10.3390/agronomy7010018gydF4y2Ba.gydF4y2Ba
- 49.gydF4y2Ba
孙燕,孔霞,李超,刘燕,丁铮。盐胁迫下拟南芥钾存留与耐盐性的自然变异相关。《公共科学图书馆•综合》。2015;10 (5):e0124032。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0124032gydF4y2Ba.gydF4y2Ba
- 50.gydF4y2Ba
戚峰,张峰。植物对逆境响应的细胞周期调控。植物科学进展2020;10:1765。gydF4y2Bahttps://doi.org/10.3389/fpls.2019.01765gydF4y2Ba.gydF4y2Ba
- 51.gydF4y2Ba
王晓燕,何鹏华,王晓燕,等。水分胁迫对小麦叶片细胞分裂和cdc2样细胞周期激酶活性的影响。植物杂志。1998;117(2):667 - 78。gydF4y2Bahttps://doi.org/10.1104/pp.117.2.667gydF4y2Ba.gydF4y2Ba
- 52.gydF4y2Ba
马洛瓦,丁安,孔燕。扩展剂在植物生长中的作用及其在作物改良中的潜在应用。植物细胞学报2016;35(5):949-65。gydF4y2Bahttps://doi.org/10.1007/s00299-016-1948-4gydF4y2Ba.gydF4y2Ba
- 53.gydF4y2Ba
陈琳,邹伟,费晨,吴刚,李旭,林红,等。α-Expansin exp4对烟草非生物胁迫耐受性的正向调节作用及对病原菌抗性的负向调节作用。植物细胞物理学报2018;59:2317-30。gydF4y2Bahttps://doi.org/10.1093/pcp/pcy155gydF4y2Ba.gydF4y2Ba
- 54.gydF4y2Ba
Geilfus C- m, Zörb C, Mühling KH。盐胁迫对抗性玉米和敏感玉米生长中介β-膨胀蛋白的影响差异。植物生理与生物化学。2010;48(12):993-8。gydF4y2Bahttps://doi.org/10.1016/j.plaphy.2010.09.011gydF4y2Ba.gydF4y2Ba
- 55.gydF4y2Ba
淀粉作为非生物胁迫下植物适应性的决定因素。新植醇。2017;214(3):943 - 51。gydF4y2Bahttps://doi.org/10.1111/nph.14491gydF4y2Ba.gydF4y2Ba
- 56.gydF4y2Ba
李晓燕,王晓燕,王晓燕,等。盐胁迫对玉米生长的影响(gydF4y2Ba玉米gydF4y2BaL.)通过补充硫。Pak J Bot. 2020; 52:763-73。gydF4y2Bahttps://doi.org/10.30848/PJB2020-3 (38gydF4y2Ba.gydF4y2Ba
- 57.gydF4y2Ba
王晓燕,王晓燕。干旱和盐胁迫下植物光合作用的调控机制。安机器人。2009;103(4):551 - 60。gydF4y2Bahttps://doi.org/10.1093/aob/mcn125gydF4y2Ba.gydF4y2Ba
- 58.gydF4y2Ba
Zanella M, Borghi GL, Pirone C, Thalmann M, Pazmino D, Costa A,等。β-淀粉酶1 (BAM1)降解暂时性淀粉以维持干旱胁迫下的脯氨酸生物合成。科学通报,2016;67(6):1819-26gydF4y2Bahttps://doi.org/10.1093/jxb/erv572gydF4y2Ba.gydF4y2Ba
- 59.gydF4y2Ba
Valerio C, Costa A, Marri L, Issakidis-Bourguet E, Pupillo P, Trost P,等。硫氧还蛋白调节的β-淀粉酶(BAM1)在渗透胁迫下诱导保护细胞和叶肉细胞的淀粉日降解。中国生物医学工程学报2011;32(2):545-55。gydF4y2Bahttps://doi.org/10.1093/jxb/erq288gydF4y2Ba.gydF4y2Ba
- 60.gydF4y2Ba
基因与耐盐性:将它们结合在一起。新植醇。2005;167(3):645 - 63。gydF4y2Bahttps://doi.org/10.1111/j.1469-8137.2005.01487.xgydF4y2Ba.gydF4y2Ba
- 61.gydF4y2Ba
Hasegawa PM, Bressan RA, Zhu JK, Bohnert HJ。植物细胞和分子对高盐度的响应。植物学报,2000;51(1):463-99。gydF4y2Bahttps://doi.org/10.1146/annurev.arplant.51.1.463gydF4y2Ba.gydF4y2Ba
- 62.gydF4y2Ba
Chartzoulakis K、Psarras G、Vemmos S、Loupassaki M、Bertaki M.两个橄榄品种对盐胁迫和补钾的响应植物营养学报,2006;29(11):2063-78。gydF4y2Bahttps://doi.org/10.1080/01904160600932682gydF4y2Ba.gydF4y2Ba
- 63.gydF4y2Ba
吴红,张旭,Giraldo JP, Shabala S.这不仅仅是关于钠:揭示了钾在植物对盐胁迫反应中的组织特异性和信号作用。土壤植物。2018;431(1 - 2):1。gydF4y2Bahttps://doi.org/10.1007/s11104-018-3770-ygydF4y2Ba.gydF4y2Ba
- 64.gydF4y2Ba
Spalding EP, Hirsch RE, Lewis DR, Qi Z, Sussman MR, Lewis BD.缺乏AKT1通道活性的植物钾吸收支持生长。中国生物医学工程学报,1999;29(6):369 - 369。gydF4y2Bahttps://doi.org/10.1085/jgp.113.6.909gydF4y2Ba.gydF4y2Ba
- 65.gydF4y2Ba
张芳,李磊,焦铮,陈勇,刘辉,陈曦,等。玉米钙调神经磷酸酶b样(CBL)基因家族的特征及其在脱落酸和非生物胁迫下ZmCBL9的功能分析。植物科学。2016;253:118-29。gydF4y2Bahttps://doi.org/10.1016/j.plantsci.2016.09.011gydF4y2Ba.gydF4y2Ba
- 66.gydF4y2Ba
徐静,李宏东,陈丽琴,王赟,刘丽丽,何磊,等。在拟南芥中,一种蛋白激酶与两个钙调磷酸酶b样蛋白相互作用,调节K+转运蛋白AKT1。细胞。2006;125(7):1347 - 60。gydF4y2Bahttps://doi.org/10.1016/j.cell.2006.06.011gydF4y2Ba.gydF4y2Ba
- 67.gydF4y2Ba
Bhaskara GB, Nguyen TT, Verslues PE。aba诱导的蛋白磷酸酶2Cs具有独特的抗旱功能。植物杂志。2012;160(1):379 - 95。gydF4y2Bahttps://doi.org/10.1104/pp.112.202408gydF4y2Ba.gydF4y2Ba
- 68.gydF4y2Ba
李淑珍,兰文忠,金伯国,李丽,郑永华,潘迪,等。蛋白质磷酸化/去磷酸化网络调节植物钾通道。中国生物医学工程学报,2007;29(4):447 - 447。gydF4y2Bahttps://doi.org/10.1073/pnas.0707912104gydF4y2Ba.gydF4y2Ba
- 69.gydF4y2Ba
拟南芥空泡Na+/H+反端蛋白过表达的耐盐性。科学。1999;285:1256-8。gydF4y2Bahttps://doi.org/10.1126/science.285.5431.1256gydF4y2Ba.gydF4y2Ba
- 70.gydF4y2Ba
王晓燕,王晓燕,王晓燕。不同盐胁迫条件下辣椒植株水分关系和营养物质的木质部运输。植物生长学报2003;41(3):237-45。gydF4y2Bahttps://doi.org/10.1023/B:GROW.0000007515.72795.c5gydF4y2Ba.gydF4y2Ba
- 71.gydF4y2Ba
Munns R, Husain S, Rivelli AR, James RA, Condon AG, Lindsay下院议员,等。提高作物耐盐性的途径和生理选择性状的作用。土壤植物。2002;247(1):93 - 105。gydF4y2Bahttps://doi.org/10.1023/A:1021119414799gydF4y2Ba.gydF4y2Ba
- 72.gydF4y2Ba
查考亚E,考克森KM,惠特尼HM,艾舍斯特JL,阿贝尔C,史密斯AG。高等植物泛酸盐生物合成:进展与挑战。杂志。2006;126(3):319 - 29。gydF4y2Bahttps://doi.org/10.1111/j.1399-3054.2006.00683.xgydF4y2Ba.gydF4y2Ba
- 73.gydF4y2Ba
黄磊,Pyc M, Alseekh S, McCarty DR, de Crécy-Lagard V, Gregory JF,等。在泛酸盐合成中具有潜在作用的可塑性泛酸盐转运体。j . 2018, 475(4): 813 - 25所示。gydF4y2Bahttps://doi.org/10.1042/BCJ20170883gydF4y2Ba.gydF4y2Ba
- 74.gydF4y2Ba
ab - ogiala A, Carsjens C, Diekmann H, Fayyaz P, Herrfurth C, Feussner I,等。温度诱导脂钙素(TIL)在盐胁迫下易位,保护叶绿体免受离子毒害。植物生理学报,2014;29(4):447 - 447。gydF4y2Bahttps://doi.org/10.1016/j.jplph.2013.08.003gydF4y2Ba.gydF4y2Ba
- 75.gydF4y2Ba
Küfner I, Koch W.植物有机阳离子转运蛋白家族的应激调节成员定位于液泡膜。BMC Res Notes。2008;1(1):43。gydF4y2Bahttps://doi.org/10.1186/1756-0500-1-43gydF4y2Ba.gydF4y2Ba
- 76.gydF4y2Ba
王晓燕,李志强,李志强,等。从动物和微生物的知识看左旋肉碱在植物中的生理作用。植物科学。2018;274:432-40。gydF4y2Bahttps://doi.org/10.1016/j.plantsci.2018.06.020gydF4y2Ba.gydF4y2Ba
- 77.gydF4y2Ba
Stepien P, Johnson GN。拟南芥和盐生芥光合作用对盐胁迫的响应对比:质体末端氧化酶作为替代电子汇的作用。植物杂志。2009;149(2):1154 - 65。gydF4y2Bahttps://doi.org/10.1104/pp.108.132407gydF4y2Ba.gydF4y2Ba
- 78.gydF4y2Ba
Yang Y, Sulpice R, Himmelbach A, Meinhard M, Christmann A, Grill e。纤维蛋白蛋白表达受脱落酸反应调控因子调控,参与脱落酸介导的光保护。中国生物医学工程学报,2006;43(5):369 - 369。gydF4y2Bahttps://doi.org/10.1073/pnas.0501720103gydF4y2Ba.gydF4y2Ba
- 79.gydF4y2Ba
尤军,陈忠忠。作物非生物胁迫响应中活性氧的调控。植物科学进展2015;6:1-15。gydF4y2Bahttps://doi.org/10.3389/fpls.2015.01092gydF4y2Ba.gydF4y2Ba
- 80.gydF4y2Ba
Pérez-Labrada F, López-Vargas ER, Ortega-Ortiz H, Cadenas-Pliego G, Benavides-Mendoza A, Juárez-Maldonado A.盐胁迫下番茄叶片对纳米铜的响应。植物。2019;8(6):151。gydF4y2Bahttps://doi.org/10.3390/plants8060151gydF4y2Ba.gydF4y2Ba
- 81.gydF4y2Ba
巴努MNA, Hoque MA,渡边杉本M,松冈K,中村Y,下石Y,等。脯氨酸和甜菜碱诱导盐胁迫下烟草细胞抗氧化防御基因表达和抑制细胞死亡。植物生理学报,2009;26(2):366 - 366。gydF4y2Bahttps://doi.org/10.1016/j.jplph.2008.03.002gydF4y2Ba.gydF4y2Ba
- 82.gydF4y2Ba
Saleethong P, Sanitchon J, Kong-ngern K, Theerakulp P.亚精胺预处理逆转了两个耐盐性不同的水稻品种对盐胁迫的抑制作用。植物科学学报2011;10(4):245-54。gydF4y2Bahttps://doi.org/10.3923/ajps.2011.245.254gydF4y2Ba.gydF4y2Ba
- 83.gydF4y2Ba
杨晓燕,王晓燕,王晓燕。盐胁迫下氮和亚精胺对柑橘幼苗叶绿素荧光、光合作用和抗氧化酶活性的影响。56 Photosynthetica。2018;(4):1313 - 25。gydF4y2Bahttps://doi.org/10.1007/s11099-018-0839-zgydF4y2Ba.gydF4y2Ba
- 84.gydF4y2Ba
Roychoudhury A, Basu S, Sengupta DN。外源施亚精胺或精胺对三种耐盐水平不同的籼稻的盐胁迫改善作用。植物生理学报,2011;32(4):326 - 326。gydF4y2Bahttps://doi.org/10.1016/j.jplph.2010.07.009gydF4y2Ba.gydF4y2Ba
- 85.gydF4y2Ba
szymazynska KP, Polkowska-Kowalczyk L, Lichocka M, Maszkowska J, Dobrowolska G. snf1相关蛋白激酶SnRK2.4和SnRK2.10在植物盐胁迫响应中调节ROS稳态。国际分子科学2019;20:143。gydF4y2Bahttps://doi.org/10.3390/ijms20010143gydF4y2Ba.gydF4y2Ba
- 86.gydF4y2Ba
McCready RM, Guggolz J, Silviera V, Owens HS。蔬菜中淀粉和直链淀粉的测定在豌豆中的应用。肛门化学1950;22(9):1156 - 8。gydF4y2Bahttps://doi.org/10.1021/ac60045a016gydF4y2Ba.gydF4y2Ba
- 87.gydF4y2Ba
Koç E, İşlek C, Üstün AS。低温对两个辣椒品种蛋白质、脯氨酸、酚类化合物和叶绿素含量的影响。谷科学,2010;23:1-6gydF4y2Bahttp://gujs.gazi.edu.tr/article/view/1060000016gydF4y2Ba.gydF4y2Ba
- 88.gydF4y2Ba
Sergiev I, Alexieva V, Karanov E.精胺、阿特拉津及其组合对植物一些内源保护系统和胁迫标记的影响。中华科学学报1997;51:121-4。gydF4y2Ba
- 89.gydF4y2Ba
Velikova V, Yordanov I, Edreva A.外源多胺对酸雨处理大豆植株氧化胁迫和某些抗氧化系统的保护作用。植物科学。2000;151(1):59 - 66。gydF4y2Bahttps://doi.org/10.1016/s0168 - 9452 (99) 00197 - 1gydF4y2Ba.gydF4y2Ba
- 90.gydF4y2Ba
贝茨LS,沃尔德伦RP,蒂尔ID。水胁迫研究中游离脯氨酸的快速测定。39:205-7。gydF4y2Bahttps://doi.org/10.1007/BF00018060gydF4y2Ba.gydF4y2Ba
- 91.gydF4y2Ba
Medina I, Carbonell J, Pulido L, Madeira SC, Goetz S, Conesa A,等。Babelomics:转录组学、蛋白质组学和基因组数据分析的综合平台。核酸学报2010;38(suppl_2): W210-3。gydF4y2Bahttps://doi.org/10.1093/nar/gkq388gydF4y2Ba.gydF4y2Ba
- 92.gydF4y2Ba
黄DW, Sherman BT, Lempicki RA。利用DAVID生物信息学资源对大型基因表进行系统综合分析。Nat Protoc。2009;4(1):44-57。gydF4y2Bahttps://doi.org/10.1038/nprot.2008.211gydF4y2Ba.gydF4y2Ba
- 93.gydF4y2Ba
宾卫伟,魏立林,平德伟,李铮,魏刚,兵利杰,等。用实时荧光定量PCR方法筛选辣椒基因表达研究的内参基因。摩尔品种。2012;30(3):1393 - 400。gydF4y2Bahttps://doi.org/10.1007/s11032-012-9726-7gydF4y2Ba.gydF4y2Ba
- 94.gydF4y2Ba
万辉,袁伟,阮明,叶强,王锐,李铮,等。辣椒逆转录实时定量PCR归一化内参基因的鉴定。生物化学与生物物理学报。2011;416(1-2):24-30。gydF4y2Bahttps://doi.org/10.1016/j.bbrc.2011.10.105gydF4y2Ba.gydF4y2Ba
确认gydF4y2Ba
我们衷心感谢IBMCP (Valencia, Spain)的Javier Forment和Lorena Latorre-García对转录组学研究的表现和分析的帮助。gydF4y2Ba
资金gydF4y2Ba
这项工作由INIA(西班牙)、科学部、Innovación y Universidades (RTA2017-00030-C02-00)和欧洲区域发展基金(ERDF)资助。Lidia López-Serrano是博士奖学金(ppi - inia)的受益者。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
所有作者都对实验的概念化和设计做出了相同的贡献。LLS、AC和SLG进行实验;ls、AC、RS和EB对数据进行了分析和讨论;LLS、AC、SLG、EB撰写初稿并审核;所有作者都认可了手稿的最终版本。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1-S12。gydF4y2Ba
在对照和盐胁迫条件下(表S1-S6)比较A25和A6,在对照和盐胁迫条件下(表S7-S12)比较A25和A6的总差异表达基因(表S7-S12)。当发现有统计学意义时纳入KEGG通路。gydF4y2Ba
附加文件2:图S1-S4。gydF4y2Ba
GO分类中发现的DEGs类比较。gydF4y2Ba
附加文件3:表S13,图S5。gydF4y2Ba
选择一组deg,用RT-qPCR验证微阵列分析。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献放弃书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
López-Serrano, L.,卡拉塔尤德,Á。、Lopez-Galarza年代。gydF4y2Baet al。gydF4y2Ba揭示辣椒植物的耐盐机制:一种生理和转录组学方法。gydF4y2BaBMC植物杂志gydF4y2Ba21,gydF4y2Ba169(2021)。https://doi.org/10.1186/s12870-021-02938-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-02938-2gydF4y2Ba
关键字gydF4y2Ba
- 脱落酸gydF4y2Ba
- 增长gydF4y2Ba
- 离子体内平衡gydF4y2Ba
- 光合作用gydF4y2Ba
- 盐胁迫gydF4y2Ba
- 宽容登记入册gydF4y2Ba
- 胡椒gydF4y2Ba