摘要
背景
由于盐碱胁迫对作物生产力的负面影响,盐碱是农业的一个主要威胁。在本研究中,我们分离了根际细菌,并评估了它们在盐胁迫条件下促进作物生长的能力。
结果
本文从韩国浦项海滩沙丘区系中分离出根际细菌,并对其进行植物促生长(PGP)性状筛选。在55个分离的细菌中,14个产生吲哚-3-乙酸(IAA), 10个产生铁载体,12个产生胞外聚合和磷酸盐溶解。基于这些PGP性状,我们选择了11个菌株进行耐盐性评价。其中,ALT29和ALT43对盐胁迫的耐受性最高。接下来,我们对菌株ALT29和ALT43的培养滤液进行IAA和有机酸的检测,以确定这些PGP产品的存在。为了研究ALT29和ALT43对大豆耐盐性的影响,我们分别在0 mM、80 mM、160 mM和240 mM NaCl处理下育苗,接种一半菌株。接种ALT29和ALT43显著增加了茎长(13%)、根长(21%)、茎干鲜重(44和35%)、根干鲜重(9%)、叶绿素含量(16-24%)、的背影一(8-43%),b的背影(13-46%)和类胡萝卜素含量(14-39%)。接种ALT29和ALT43显著降低了内源ABA水平(0.77倍),增加了内源SA含量(6-16%),提高了总蛋白(10-20%)和谷胱甘肽(10-20%)含量,降低了脂质过氧化(0.8 - 5倍)、超氧化物阴离子(21-68%)、过氧化物酶(12.14-17.97%)、过氧化氢酶(12.14-17.97%)和过氧化氢酶(12.14-17.97%)。多酚氧化酶含量(11.76 ~ 27.06%)。此外,用ALT29和ALT43处理的大豆钾含量较高+(9.34-67.03%)+内容(2 - 4.5倍)。与耐盐性有关的基因GmFLD19和GmNARK,在NaCl胁迫下上调;然而,显著下降GmFLD19(3-12-fold)和GmNARK(1.8 - 3.7倍)表达在细菌接种的植物中。
结论
综上所述,菌株ALT29和ALT43能够缓解盐胁迫,促进植物生长,为农业生产系统解决盐胁迫提供了一种生态途径。
背景
土壤盐分是对作物生产产生负面影响的最具破坏性的环境压力因素之一,影响到世界各地数百万公顷的土地,每年造成重大经济损失[1,2,3.].大约6200万公顷(20%)的灌溉土地目前受到高含盐量的影响[1,2],据估计,到2050年,超过50%的可耕地将盐碱化[4,5].土壤盐分通过影响根系生长、养分吸收和代谢过程来限制作物产量[1,2,3.].根际活性区因根系生长发育受损而减少,影响养分吸收效率。
此外,盐胁迫影响生理、形态和生化过程,降低作物生物量和生产力[2,3.].过量的Na和Cl离子通过与K离子竞争导致离子失衡和离子毒性。离子毒性干扰植物的许多生理过程,导致萎黄和坏死[6,7].类似地,钠通过与K竞争结合位点和干扰K稳态来抑制重要的细胞过程和酶活性,而这些过程和酶活性需要K来发挥功能[6].有研究表明,植物在盐胁迫下存活需要高的胞质钾浓度和维持细胞质和胞质中低的钠浓度[8,9].在所有生长阶段,包括萌发期、幼苗期、营养期和成熟期,都观察到了盐胁迫下的形态变化[10.].盐胁迫诱导的生物化学变化包括植物激素的调节(应激激素脱落酸[ABA]的减少和防御激素水杨酸[SA]的增加),离子摄取(离子的积累或去除)的变化,抗氧化酶的激活,活性氧(ROS)的产生和积累,以及光合作用途径的破坏[2].在分子水平上,植物的盐胁迫也影响基因调控。此外,盐胁迫通过影响叶绿素和类胡萝卜素和降低PSII活性来阻碍光合作用[11.,12.,13.].光合作用的下降最终会耗尽能量储备,导致植物饥饿、叶片扩张和衰老[14.].
大豆是一种经济上重要的豆科作物,用于植物油,矿物质和全球蛋白质资源的栽培[5,15.].大豆对盐胁迫具有半耐性;然而,高盐度可通过抑制种子萌发和萌发后的生长而降低大豆产量[16.,17.,18.].盐度应力产生负面影响大豆生长,种子质量和数量,产量[19.].对于大豆,整个基因组序列的可用性增强了我们对盐度相关基因表达和调节的基本机制的理解[20.].几个具有耐盐性的大豆基因已经被鉴定出来[21.].GmFLD19已被证明通过减少Na离子和丙醛含量,上调抗氧化酶活性和增加叶绿素含量来增强对盐应激的耐受性[15.].同样的,GmNARK诱导产生ABA,提高大豆对盐胁迫的耐性[22.].
盐碱条件对许多国家的农业生产构成重大挑战[23.,24.,25.].诸如传统育种、耐盐转基因植物基因工程和化学应用等策略被用于解决高盐问题[26.,27.].然而,这些方法并不总是可行的,有些甚至可能对生态系统产生额外的不利影响[28.].因此,确定和发展生态友好策略来管理高盐度对农业系统至关重要。利用植物根际促生菌(PGPR)诱导植物耐盐机制已成为提高植物在恶劣环境中的适应和资源利用效率的一种有前景的方法[17.,18.,29.,30.].PGPR通过产生促进生长和增加养分利用率和吸收的植物激素和有机物质来促进植物生长和发育[17.,23.].几项研究报告了PGPR在非生物胁迫下改善作物生长的有效性,包括盐度应力。细菌菌株如假单胞菌,Burkholdera,芽孢杆菌,节细菌属已被鉴定为在盐碱条件下的作物植物生长促进剂,如黄瓜、番茄、小麦和大豆[23.,29.,30.,31.].本研究的目的是分离、鉴定和表征耐卤PGPRs。通过多株植物生长促进(PGP)性状筛选分离菌株ALT29和ALT43。研究了耐盐菌株ALT29和ALT43在80 mM、160 mM和240 mM NaCl胁迫下对大豆生长特性、离子吸收、ROS生成和抗氧化能力以及盐相关基因表达的影响。
结果
分离、筛选和鉴定
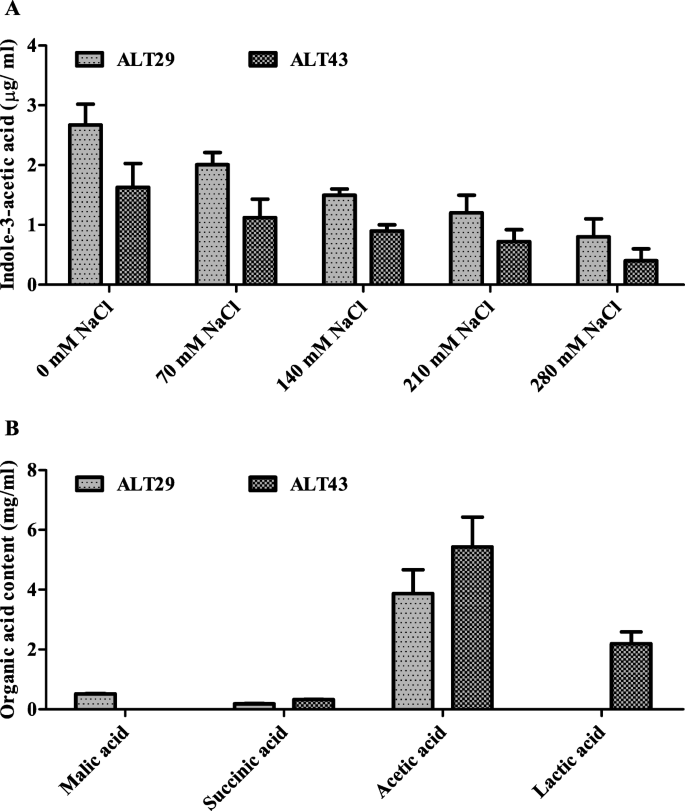
分离出55株细菌(S. Table1),筛选植物促生长性状(吲哚-3-乙酸[IAA]、铁载体产生、胞外聚合物[EPS]形成、磷酸盐溶解和耐盐性)。Salkowski试剂检测结果显示,14株分离株具有IAA活性,12株分离株具有EPS活性并能溶解磷酸盐,10株分离株产生铁载体(S. Fig.;1).基于多种PGP特征,我们选择11个分离物,以不同浓度的NaCl(70mm,140 mm,210 mm和280 mm)筛选。在ALT29和ALT43中观察到最高的NaCl耐受性(S.2)因此选择进一步调查和分子鉴定。鉴定结果表明,ALT29和ALT43表现出高序列相似之处芽孢杆菌aryabhattai和Arthrobacter Woluwensis.,分别。序列提交至NCBI GenBank,登录号为。MW077247和MW077246 (S.图。3.).
体外IAA定量分离物ALT29和ALT43
采用气相色谱-质谱联用技术测定添加不同浓度NaCl的菌株ALT29和ALT43培养滤液中IAA的产量。ALT29和ALT43都产生了大量的IAA,但ALT29产生的IAA含量最高(图2)。1).
菌株ALT29和ALT43调控盐胁迫下大豆的生长
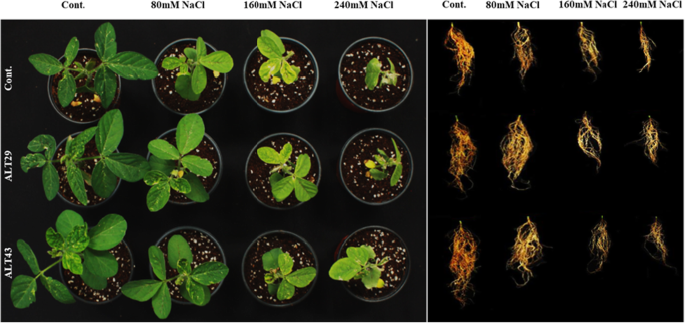
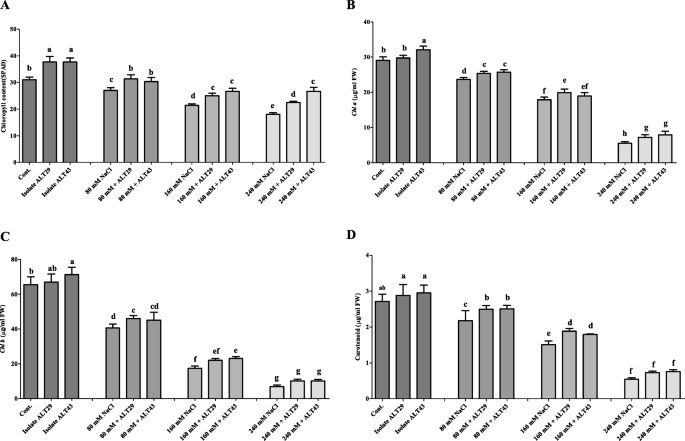
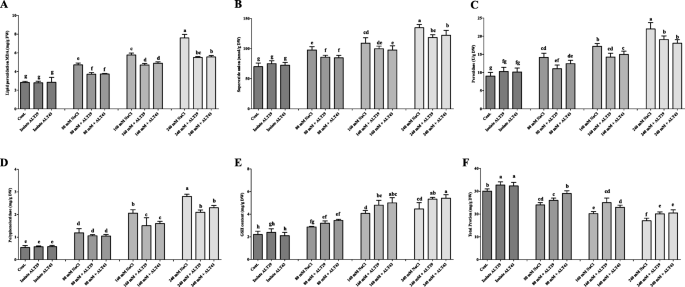
盐度应力抑制生长属性并降低了大豆植物的叶绿素含量。然而,盐度的负面影响衰减在接种用ALT29和ALT43的大豆植物中(图。2).与对照相比,受盐胁迫的植株茎长(15%)、根长(29%)、茎干鲜重(49和35%)和根干鲜重(22和34%)均下降。与nacl胁迫相比,接种菌株ALT29和ALT43可以缓解盐胁迫,提高茎长(13%)、根长(21%)、茎干鲜重(44和35%)和根干鲜重(9%)。2;表格1).此外,正常情况下,叶绿素含量增加(21%),的背影一(10%),b的背影与对照相比,接种ALT29和alt43的大豆植株中类胡萝卜素含量分别为8%和8%。3.).而在NaCl胁迫下(80、160、240 mM),叶绿素含量下降12-42%,的背影一(18 - 80%),b的背影(38-89%),类胡萝卜素含量(19-79%)。3.).接种耐盐的ALT29和ALT43可以缓解NaCl胁迫,提高叶绿素含量(16-24%);的背影一(8-43%),b的背影在大豆接种植物中观察到(13-46%)和类胡萝卜素(14-39%)含量,而仅与NaCl胁迫植物(80mm,160mm和240mm)相比(图。3.).
盐胁迫下内源植物激素的调控
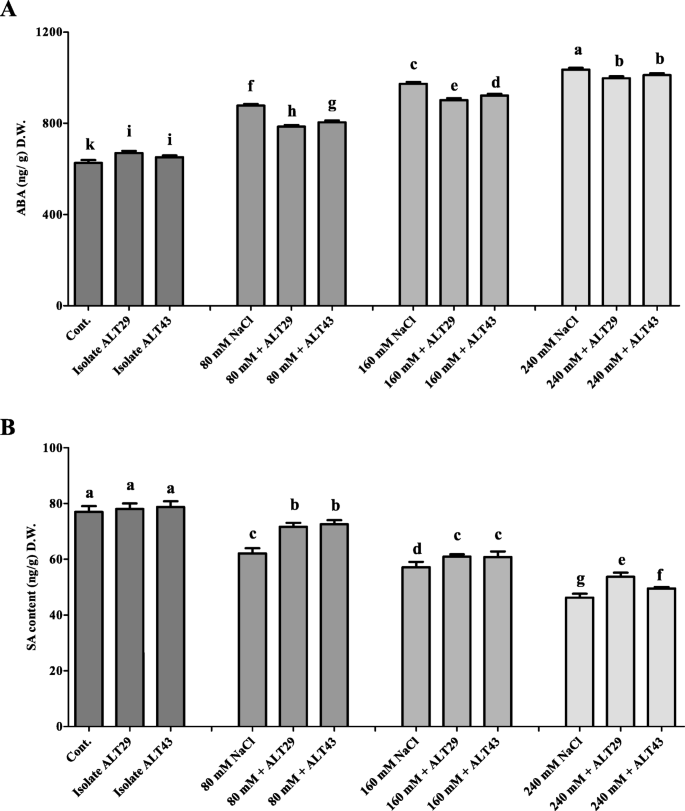
与对照相比,在盐度应力下在大豆植物中观察到ABA含量(1.57倍)的显着增加(图。4a).但在NaCl胁迫下(80、160和240 mM),接种菌株ALT29和ALT43的植株ABA含量下降了0.77倍(图4)。4a). SA结果与ABA结果相反;在正常条件下,接种ALT29和ALT43的植株内源SA含量增加了2%。在NaCl胁迫下,接种ALT29和ALT43的大豆植株产量增加了6-16%。4b)。
盐胁迫下大豆植株抗氧化能力的测定
研究了在NaCl胁迫下接种菌株ALT29和ALT43和不接种菌株ALT29和ALT43对大豆植株抗氧化能力的影响。测定丙二醛(MDA)含量,评价脂质过氧化(LPO)程度。NaCl胁迫(80 mM、160 mM和240 mM)处理的大豆MDA含量为2.3 - 6.3倍,高于接种ALT29和ALT43(0.8 - 5倍)处理的大豆(图2)。5a).同样,超氧阴离子(SOA)含量随NaCl处理而变化(图4)。5b)。然而,与NaCl胁迫植物(38-91%)相比,ALT29和ALT43接种大豆植物(21-68%)在ALT29和ALT43接种的大豆植物中产生显着抑制SOA。在过氧化物酶歧化酶(POD)含量和多酚氧化酶(PPO)含量中观察到类似的趋势,其盐度胁迫大豆植物较低,其中分离物ALT29和ALT43(图。5为进一步阐明ALT29和ALT43缓解盐胁迫的能力,在NaCl胁迫下,接种ALT29和ALT43的大豆植株中GSH含量显著高于未接种的大豆植株(37-136%)(图2)。5e).此外,与对照相比,盐胁迫下总蛋白含量显著降低(20-43%)。然而,接种耐盐的ALT29和ALT43可使nacl胁迫植株的蛋白质含量增加10-20%(图2)。5f)。
在盐度应力的离子吸收中的细菌分离株Gerole
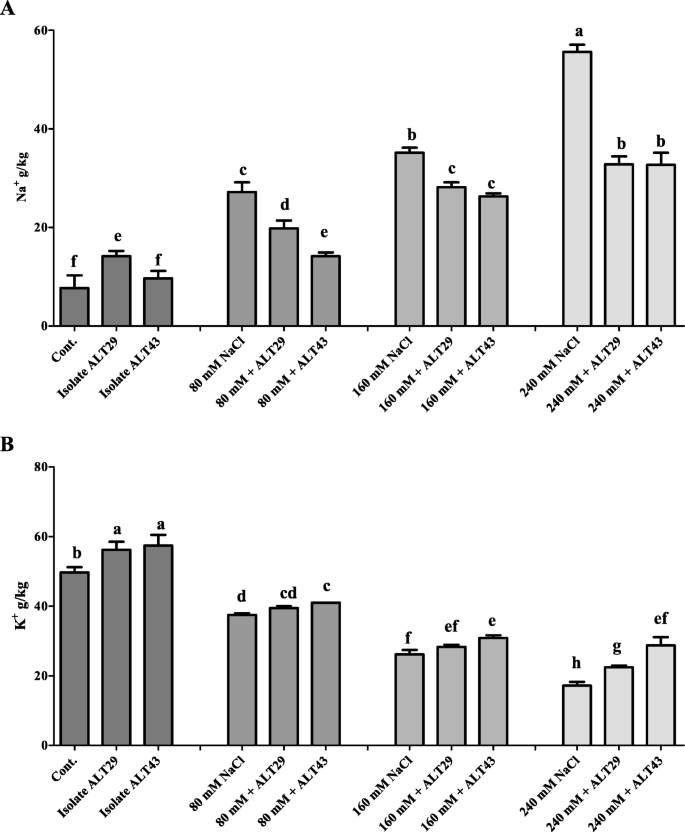
电感耦合质谱(ICP)分析钠+和K.+内容进行。NaCl (80 mM、160 mM和240 mM)处理的大豆植株表现出较高的钠含量+内容(4-8-fold)(图6一种)。然而,Alt29和Alt43接种植物在NA中显示出显着减少+内容(2 - 4.5倍)(图6一种)。与NA相比+, K+与对照相比,在盐度胁迫下(24.5 ~ 65.39%)含量显著降低(图2)。6然而,b)。K+与未接种植物相比,摄取伴有ALT29和ALT43接种的盐度应激大豆植物中增加(9.34-67.03%)(图。6b)。
盐度应力和细菌接种下的基因表达
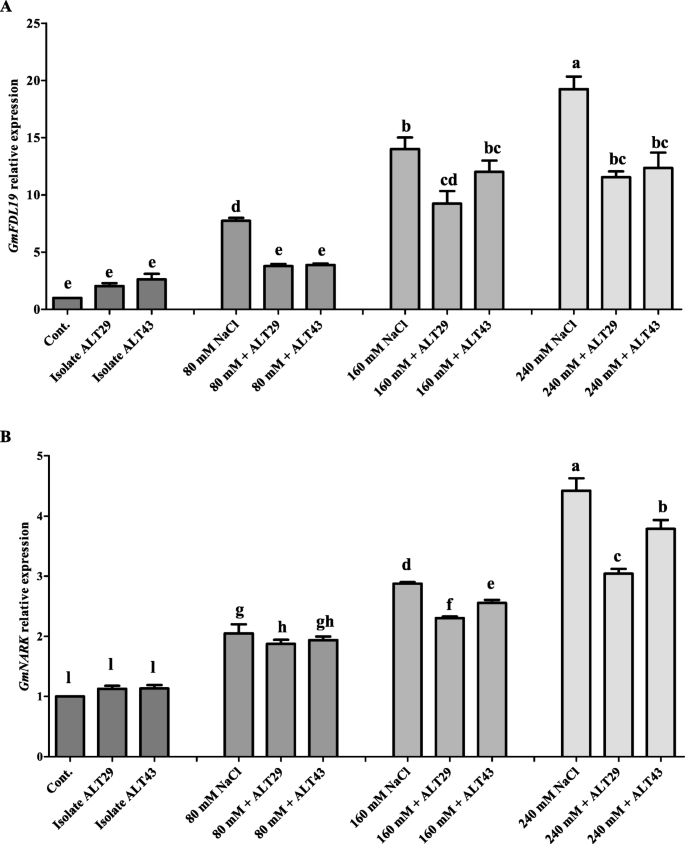
GmFLD19在NaCl胁迫下,大豆植株的表达量增加了7 - 18倍(图2)。7一种)。然而,ALT29和ALT43接种改善了对NaCl应力的大豆适应性,导致显着降低GmFLD19在NaCl (80 mM - 240 mM)胁迫下,大豆植株的表达量增加了3 - 12倍(图2)。7a).同样,表示的显著增加GmNARK结果表明,NaCl胁迫对大豆植株的影响为2 ~ 4.6倍。7b).然而,接种ALT29和ALT43增强了大豆对NaCl胁迫的抗性,降低了抗逆性GmNARK(1.8-3.7倍)暴露于NaCl应激的大豆植物(图。7b)。
讨论
土壤盐分是全世界严重的农业问题[23.,24.,25.].在植物中,盐胁迫会导致氧化损伤、离子毒性和营养失衡,从而降低光合速率,抑制植物生长,降低作物产量和质量[17.,30.].盐度压力下的植物经历了几种妨碍了生长和发展的形态和生理变化[30.,32.].然而,有益的植物促生菌已被证明在缓解植物的盐胁迫、改善作物生长和盐环境下产量方面发挥着重要作用[17.,30.,32.].据报道,PGPR可减轻棉花、水稻、小麦、番茄和大豆的盐胁迫[23.,29.,30.,31.,32.,33.,34.,35.,36.].
在本研究中,NaCl胁迫降低了大豆植株的生长、根和茎的长度以及鲜和干生物量。然而,接种分离菌ALT29和ALT43可以缓解盐胁迫的影响,与未接种相比,接种植株的生长特性得到了改善(图2)。2;表格1).同样,叶绿素含量在光合作用中起着至关重要的作用,然而盐胁迫对叶绿素含量的影响取决于盐的水平[37.,38.].在盐胁迫下,植物叶绿素含量降低。然而,在接种了ALT29和ALT43的大豆植株中,nacl诱导的叶绿素和类胡萝卜素含量下降有所减弱(图2)。3.).这些结果与先前发现的结果一致,用Halotolerant PGPR接种增加盐度压力下的植物中的叶绿素含量,包括罗勒属basilicum[39.],茄属植物lycopersicum[33.],甘氨酸最大[34.),而栽培稻[40].此外,Yoo等人[33.Siddikee等人[41, Fan等[42, Khan等人[18.)报道芽孢杆菌aryabhattai和Arthrobacter Woluwensis.在番茄,油菜籽和大豆植物中抵抗盐度胁迫,并据报道,接种细菌的植物分离出显着提高植物生长,NaCl应力下的叶绿素含量。
所选择的卤素细菌分离株(ALT29和ALT43)对大豆生长的有益效果可归因于这些分离株表现出的盐度耐受性和植物生长促进性状(EPS形成,有机酸和IAA生产)(S。1和无花果。1).Vurukonda [27.]和Selvakumar [28.]报道了产生eps的细菌有助于维持植物的耐盐性,提供抵御盐胁迫的保护[43,44].同样地,有机酸通过提供碳和能量的重要来源以及调节非生物耐受性而有益于植物[45].在目前的研究中使用的细菌产生几种有机酸(图。1B,它们被证明能促进植物生长。此外,IAA是一种必需的植物激素,大量研究表明,IAA产生的耐盐细菌提高了植物的耐盐性。在本研究中,分离菌株ALT29和ALT43在含NaCl的LB培养基中产生IAA(图。1一种)。因此,接种用ALT29和ALT43接种的盐胁迫大豆植物的生长促进可能是由这些PGP特征介导的。
盐胁迫导致Na和Cl的积累,影响植物中其他重要元素的存在和分布,降低植物的生理活性和生长[2,3.].Na离子的浓度增加产生渗透胁迫,影响细胞间K流动[6].K是植物生长所必需的元素[46];本研究结果表明,在盐胁迫下,大豆植株的钾含量降低,钠含量增加(图。6).然而,接种ALT29和ALT43提高了nacl处理植株对钾的吸收,降低了钠的吸收(图。6).
此外,植物激素是植物在应激条件下受调节的重要信号分子[47,48].特别是,盐胁迫已被证明会增加植物激素脱落酸的生物合成[49,50].以前的研究表明,高内源性ABA含量抑制了生长芸苔属植物显著,玉米,菜豆[47,48,51].接种卤素PGPR调节非生物胁迫,包括盐度应激,并减少ABA生物合成[35.,52,53,54].在本研究中,我们发现NaCl胁迫下大豆植株内源ABA含量显著增加;然而,接种ALT29和ALT43可以减轻这种影响(图。4a)。同样,salt-stressed陆地棉和小麦接种耐盐假单胞菌putida,节细菌属protophormiae,枯草芽孢杆菌ABA积累减少,植株生长增强[32.,36.].
水杨酸是一种防御信号植物激素,作为活性氧清除剂,保护植物免受氧化应激[55,56,57].Hamayun等人[3.Wang等人[58]报告了内源性SA的减少甘氨酸最大和虹膜hexagona在盐度下压力。NaCl降低了大豆中SA的含量;然而,接种分离株ALT29和ALT43的大豆植株中SA含量较高。4b).我们目前的发现证实了Kang等人之前的报道[59]和Khan等人。[60,61报道了细菌接种可提高非生物胁迫下植物的SA含量。
Na在植物组织中的积累增加了ROS(超氧阴离子,单线态氧)的形成,扰乱了正常的代谢,产生细胞毒性和蛋白质降解[62].为了减轻盐胁迫和ROS增加的影响,植物激活抗氧化防御系统,如谷胱甘肽还原酶(GR)、LPO和其他抗氧化酶(PPO、POD、TPP),以清除自由基和保护细胞免受应激。盐胁迫下,接种ALT29和ALT43的大豆植株GSH和TPP含量增加,LPO、SOA和PPO含量降低(图4)。5).在玉米、水稻和罗勒植物接种耐盐细菌后也观察到类似的结果,这些细菌显著提高了ros清除酶的活性[39.,40,63,64].
此外,耐盐基因的鉴定对于耐盐作物的基因工程具有重要意义。在大豆中已经鉴定和报道了许多候选基因。GmFLD19,一个新的a组bZIB基因,被确定在大豆的非生物胁迫耐受性中发挥重要作用[15.,65].GmNARK(甘氨酸最大结节自调节受体激酶)也有助于非生物胁迫耐受性并调节ABA [22.].ABA的研究结果表明,NaCl胁迫下大豆植株中ABA含量较高可能是由于诱导了ABA的相对表达GmNARK和GmFLD19(无花果。5a).此外,Li等人[15.也有报道称钠含量较低GmFLD19转基因大豆植物和报告GmFLD19可能通过提高大豆的耐盐性来调节钠的吸收。我们的研究结果表明,盐胁迫上调了GmFLD19和GmNARK(无花果。6).而接种ALT29和ALT43可刺激表达GmFLD19和GmNARK盐胁迫下的大豆植株(图。6).以往的报告表明,过度表达GmFLD19和GmNARK通过降低Na离子和丙二醛含量,提高抗氧化活性和叶绿素含量,提高转基因大豆的耐盐性[15.,22.].过度的GmFLD19和GmNARK在大豆中表明,这些基因是育种抗逆性品种的典型候选基因[15.,22.].
结论
目前的研究结果表明,Halotolerant分离alt29和Alt43具有植物生长促进的性状,包括耐盐性,EPS形成和有机酸和IAA生产。此外,Alt29和Alt43在NaCl应力(80mm,160mm和240mm)下盐度应力和增加生长,生物质和叶绿素含量的影响。由分离物ALT29和ALT43诱导的大豆生长的改善可归因于这些细菌调节内源性植物激素(ABA和SA),抗氧化剂(GSH,LPO,TPP,PPO和POD),离子吸收(NA和K.)和基因表达(GmFLD19和GmNARK)。因此,我们证明,接种ALT29和ALT43菌株提供了一种有价值的、生态友好的、低成本的生物技术方法,以提高受盐影响地区的可持续农业生产。
方法
分离、筛选和鉴定
正如Khan等人之前报道的那样,根际细菌是从韩国浦项海滩分离出来的[17.,18.,23.].将附着土壤的植物根转移到锥形瓶中(99毫升消毒蒸馏水,摇匀3薄荷)。将样品经一系列1倍稀释后,将0.1 ml溶液涂布于LB琼脂平板上,28℃孵育。根据菌落形态采集菌落,保存在75%甘油中,待进一步分析。
所有菌株均具有吲哚-3-乙酸、铁载体产生、磷酸盐溶解、EPS产生和耐盐等植物生长促进性状。为了评估IAA的产量,首先使用Salkowski试剂(混合2ml 0.5 M FeCl)对细菌分离株进行评估3.;49ml 70%高氯酸和49毫升H.2o)通过加入1ml上清液和1ml Salkowski试剂,并保持在黑暗中30薄荷。粉红色的发展表示IAA生产[27.].用于磷酸盐溶解胰蛋白酶大豆琼脂介质补充有CA3.(PO4)2将培养皿在30℃下孵育7天,观察每个菌落周围透明晕的形成[27.[虽然使用和EPS形成刚果红色测定使用[LB肉汤(25g / L),根据方法评估刚果红色(0.8g / L),蔗糖(5%),琼脂(2%)]和yuna等。[66此外,对于铁载体的生产,使用铬蓝酚“S”琼脂平板,在30°C孵育,在蓝色背景下出现橙色晕[27.].制备了5种浓度的NaCl(购自韩国DAEJUNG) (0 mM、70 mM、140 mM、210 mM和280 mM)。将0.1%的培养液接种到100ml无菌LB培养基中,30℃摇瓶培养,用分光光度计在600nm处测量细菌密度。基于高耐盐性,选择菌株ALT29和ALT43进行进一步评价。利用基因组DNA和16S rrna特异性引物进行扩增鉴定[61,67].利用BLAST NCBI和EzTaxon程序确定所选分离株不同核苷酸序列的同源性,使用MEGA 6.1软件进行系统发育分析[68].
ALT29和ALT43 IAA和有机酸生产
分离菌株ALT29和ALT43在LB培养基中培养3 d, 4℃离心15 min (500×g),分析IAA和有机酸含量。IAA分析采用Khan等人的详细方法[27.].细菌培养滤液经0.45 μm醋酸纤维素过滤器过滤,酸化至pH 2.8,加入50 μg/ml [D5]-IAA。再用等量的乙酸乙酯萃取培养滤液三次,通过旋转蒸发器完全蒸发。干燥后的提取液在5 ml 0.1 M乙酸中重新溶解,经反相C18柱色谱。将残渣溶解在1ml甲醇中,加入1.5 ml重氮甲烷制备甲醇馏分。甲基化后的样品在乙酸乙酯中重新溶解,GC-MS SIM分析IAA含量(S.表)2).通过将IAA的峰面积与通过GC-MS / SIM的人的那些进行比较来计算肉汤中IAA的浓度。为了分析有机酸含量,通过0.22μLmaripore过滤器(优点;乳糜 - 25cs)过滤细菌培养液,将10μl的每个样品注入高性能液相色谱(HPLC:Shimadzu Co.,Model突出)柱[Waters 600e,包括反光指数探测器,RI模型RID-10A,柱子:PL HI-PEX H(7.7×300mm]。HPLC分析的等异构条件0.005M H2SO4流动相,0.6ml /薄荷流量,65°C温度(表3.).色谱图的保留时间和峰面积与美国Sigma-Aldrich标准品进行了比较[61].
生长条件和处理
大豆种子(丰山无尾金刚品种)取自韩国大邱庆北大学大豆遗传资源中心。首先,用2.5%次氯酸钠对种子表面消毒15分钟,然后用高压灭菌的双蒸馏水清洗三次。无菌种子放置在塑料托盘中,托盘中装满了园艺基质,基质中含有椰泥(45-50%)、珍珠岩(35-40%)、泥炭苔(10-15%)和沸石(6-8%),并添加NO3.(~ 0.205 mg/g), KO (~ 0.1 mg/g), NH+(~ 0.09 mg/g)和PO (~ 0.35 mg/g) [17.].幼苗在生长室中生长:30℃昼夜循环14 h, 25℃昼夜循环10 h;相对湿度60 - 70%;光强250 μmol/m- 2年代- 1为10天。在VC期(张开单叶叶片),选择大小相同的幼苗,转移到塑料盆(10 cm × 9 cm),填充相同的园艺基质,用于萌发盘。
实验设计包括(a)控制:有实力的(b)细菌接种ALT29和ALT43 (c)治疗1:80毫米氯化钠压力有或没有隔离ALT29和ALT43 (d)治疗2:160毫米氯化钠压力有或没有隔离ALT29 ALT43和(e)治疗3:240毫米氯化钠压力有或没有隔离ALT29和ALT43。在NaCl胁迫下,测定50 ml (4.0 × 10)的ALT29和ALT43的植物保护活性8cfu/ml)接种,以蒸馏水作对照。2周后测定生长性状(根/茎长)、生物量(鲜/干重)和叶绿素含量。采用叶绿素仪(SPAD-502 Minolta,东京,日本)进行叶绿素测量。收获的植株立即在液氮中冷冻,并转移到−80°C冷冻干燥机,直到进一步分析。跟随Khan等人[60],用80%丙酮提取叶绿素A、B和总类胡萝卜素,用分光光度计在663 nm、465 nm和480 nm处测定。叶绿素a、b和类胡萝卜素含量计算公式如下:
式中A+各波长的吸光度;W =鲜重,V =萃取体积。
内源脱落酸和水杨酸的定量分析
内源性ABA的定量和提取依据Qi等[69].对于内源性ABA分析,用30mL萃取溶液(95%异丙醇和5%冰醋酸)和10 Ng ME-[2H6] -ABA标准,处理3mg粉末。过滤悬浮液,使用旋转蒸发器浓缩滤液。将残余物悬浮在4ml 1N NaOH溶液中并用3ml二氯甲烷冲洗三次,以消除脂质化材料的痕迹。通过加入6 N HCl将水相的pH降低至3.5后,通过用乙酸乙酯萃取萃取溶液萃取。然后蒸发乙酸乙酯提取物并在磷酸盐缓冲溶液(pH8)中重新悬浮干燥,其通过聚乙烯吡咯烷酮(PVPP)柱。在用6N HCl调节pH 3.5后,再次将洗脱的磷酸盐缓冲溶液再次用EtOAc分隔3次。将所有三种等分试样萃取并通过旋转蒸发器蒸发。馏分用重氮甲烷甲基化用于检测,并且使用GC-MS(6890N网络气相色谱仪,安捷伦技术)定量ABA。来自英国的Thermoquest Corp.的软件用于监测ME-[2H6] -ABA的信号离子(M / Z 162和190,用于ME-ABA; M / Z 166和194)(表4).SA分析:0.2 g冻干细粉与2 ml 90和100%甲醇混合,在10,000×g处离心15分钟。上清液在真空中蒸发,样品重新悬浮在3ml 5%三氯乙酸中。然后将上层有机层与异丙醇、乙酸乙酯和环戊烷(49.5:49.5:1)的溶液混合并剧烈旋转。上层被转移到一个4ml的管和真空干燥。在进行高效液相色谱之前,将干燥的颗粒与1ml高效液相流动相混合,使用岛津配备荧光指示剂(岛津RF-10AxL)的设备,激发波长为305 nm,发射波长为。采用荧光检测定量SA (S. Table)5)[70,71].
抗氧化酶的活动
对于蛋白质分析,使用冰冷的杵和砂浆研磨冷冻植物组织,然后加入50mM磷酸盐缓冲盐水,0.1%聚乙烯吡咯烷酮(PVP)和1mM乙二胺四乙酸(EDTA)的溶液中。将匀浆在4℃下以10000×g离心10分钟。立即收集上清液并用于蛋白质和抗氧化酶定量。根据Bradford测量蛋白质含量[72,73以BSA为标准。Khan等人测定了超氧化物歧化酶(SOD)活性[60].LPO、GSH、POD、PPO活性的测定方法参照Chaoui等[74通过使用T60紫外-可见分光光度计在290 nm、470 nm和420 nm处测量吸光度。用愈创木酚法测定POD和PPO活性[75将0.1 ml上清加入含有1.0 ml 2% H的反应混合物中2O2, 2.9 ml 50 mM磷酸盐缓冲液(pH 5.5)和1.0 ml 50 mM愈创木酚。以磷酸缓冲液为对照,不添加酶。在470nm处测量吸光度3 min,计算POD活性单位为每分钟变化量。
RNA提取,cDNA合成,qRT-PCR分析
按照Khan等人的方案进行RNA提取[61].使用1mlTrizol®试剂(Invitrogen,USA)从100mg碎叶片的大豆中孵育,在室温(10mint)和离心机(12,000g; 10薄荷; 4℃)中孵育来简要地提取总RNA。将上清液转移到新的管(1.5mL)并加入200μl氯仿,剧烈(15秒),在冰(3薄荷)上设置,再次离心(12,000g; 15薄荷; 4℃)。将上层(300-400μl)转移到新管,并加入500μl的等丙酮和1.2M NaCl / 0.8M Na-柠檬酸盐,在室温下保持10薄荷并离心(12,000g; 10薄荷; 4°C).用1ml 75%EtOH洗涤沉淀并再次离心(7500g,5颗薄荷室温),丢弃上清液并重新悬浮在40μldep水中的颗粒。虽然来自PCRBiosystems的QPCRBIO cDNA合成试剂盒用于cDNA合成。使用来自PCRBIOSystem的QPCRBIO Syber绿色试剂盒进行QRT-PCR,使用作为模板和基因特异性引物的合成(1μl)CDNA。为了使每个基因的相对表达水平正常化,actin用于每次反应,并且在对照植物中计算表达水平,对照植物,处理植物(表6).在含有7μLDDH2O,1μL引物,10μLSyberGreg和1μLcDNA的20μl体积中进行反应。对50μl的总样品体积进行以下条件:在94℃下初始变性5薄荷,40个变性在94℃下,在58℃下退火30秒,在72℃下延伸。在72°C时为1件薄荷和最终延伸,5薄荷[76,77].
植物吸收钠、钾的测定
根据Khan等人对NaCl处理中的细菌接种和非接种植物样品芽中的Na和K含量进行了研究。[61电感耦合等离子体质谱(ICP-MS;Optima 7900DV, perkins - elmer,美国)。
统计分析
通过使用SAS 9.4软件分析方差分析结果进行了统计评估。将所有实验重复三次,并将每次重复的数据收集在一起。所有数据呈现标准错误(SE)的平均值。通过使用单向分析方差(ANOVA)的单向分析,分析平均值,然后在SAS(V9.1,CARY,NC,USA)中的邓肯的多个范围试验(DMRT)进行了显着差异。
可用性数据和材料
使用GenBank登录No提交到当前研究中使用的数据集或分析的和菌株的数据集。MW077246和MW077247。
缩写
- PGPB:
-
植物生长促进细菌
- 国际宇航科学院:
-
Indole-3-acetic酸
- 阿坝:
-
脱落酸
- 山:
-
水杨酸
- APX型:
-
抗坏血酸过氧化物酶
- SOD:
-
超氧化物歧化酶
- 谷胱甘肽:
-
谷胱甘肽
参考文献
- 1。
硅通过调节活性氧和活性氮,增强大豆对盐胁迫的抗性。植物学报。2019;10:1725。
- 2。
Yoon JY, Hamayun M, Lee S-K, Lee I-J。茉莉酸甲酯缓解大豆盐分胁迫。作物科学与生物技术,2009;12(2):63-8。https://doi.org/10.1007/s12892-009-0060-5.
- 3.
Hamayun M, Khan SA, Khan AL, Shinwari ZK, Hussain J, Sohn E-Y,等。盐胁迫对黄金刚大豆生长特性和内源生长激素的影响植物学报。2010;42(5):3103-12。
- 4.
盐胁迫下植物的基因表达谱分析。植物学报。2011;30(5):435-58。https://doi.org/10.1080/07352689.2011.605739.
- 5.
Hamayun M, Khan SA, Khan AL, Shin J-H, Ahmad B, Shin D-H,等。外源赤霉酸重编程大豆以提高生长和耐盐胁迫。农业食品化学学报,2010;58(12):7226-32。https://doi.org/10.1021/jf101221t.
- 6.
阿尔梅达DM,奥利维拉MM,赛博NJM。植物Na+和K+稳态的调节:对提高作物耐盐性的作用。生物谷biool . 2017;40(1增刊1):326-45。https://doi.org/10.1590/1678-4685-gmb-2016-0106.
- 7.
Roy SJ, Negrao S, Tester M.耐盐作物。《生物技术》2014;26:115-24。https://doi.org/10.1016/j.copbio.2013.12.004.
- 8.
Gao Y,Lu Y,Wu M,Liang E,Li Y,Zhang D等人。除Na +并保留K +的能力与两种玉米自交系幼苗中的耐盐性相关。前植物SCI。2016:7(1716)。
- 9.
Assaha DVM,Ueda A,Saneoka H,Al-Yahyai R,Yaish MW。Na(+)和K(+)转运蛋白在糖胁迫适应中的作用。前面的physiol。2017; 8:509。https://doi.org/10.3389/fphys.2017.00509.
- 10。
Tavakkoli E, Rengasamy P, McDonald GK。盐胁迫下,土壤溶液中Na+和Cl-离子浓度过高对蚕豆的生长也有不利影响。中国农业科学。2010;61(15):4449-59。https://doi.org/10.1093/jxb/erq251.
- 11.
张志强,张志强,张志强,等。盐胁迫对植物光合作用的影响——多胺的保护作用。生物物理学报。2007;1767(4):272-80。https://doi.org/10.1016/j.bbabio.2007.02.020.
- 12.
张志强,张志强,张志强,等。盐胁迫对蓝藻螺旋藻细胞光系统II功能的影响。杂志。2002;114(3):405 - 13所示。https://doi.org/10.1034/j.1399-3054.2002.1140310.x.
- 13。
Misra An,Srivastava A,Strasser RJ。利用快速叶绿素A荧光技术评估绿豆和芸苔幼苗的盐/离子敏感性。J植物理性。2001; 158(9):1173-81。https://doi.org/10.1078/s0176 - 1617 (04) 70144 - 3.
- 14。
Hniličková H, Hnilička F, Martinkova J, Kraus K.盐胁迫对水稻水分状况、光合作用和叶绿素荧光的影响。植物生态学报。2017;63(8):362-7。
- 15.
李义,陈Q,南H,李X,吕S,赵X等。GMFD119的过度表达增强了大豆中干旱和盐胁迫的耐受性。Plos一个。2017; 12(6):E0179554。https://doi.org/10.1371/journal.pone.0179554.
- 16.
舒凯,齐勇,陈飞,罗雪峰,帅华,等。盐胁迫通过负调控GA生物合成而正向调控ABA生物合成来抑制大豆种子萌发。植物科学学报2017;8(1372)。
- 17.
Khan MA, Asaf S, Khan AL, Jan R, Kang S- m, Kim K-M,等。根际细菌AK1通过调节大豆内源激素和基因表达来修复盐胁迫的毒性效应。j . 2019; 476(16): 2393 - 409。https://doi.org/10.1042/bcj20190435.
- 18.
Khan Ma,Ullah I,Waqas M,Hamayun M,Khan Al,Asaf S等人。卤素疏流性梭杆菌Woluwensis Ak1减轻盐胁迫并在大豆中诱导GMST1和GMLAX3的生理激素变化和表达。共生。2019; 77(1):9-21。https://doi.org/10.1007/s13199-018-0562-3.
- 19.
Khan Ma,Asaf S,Khan Al,Ullah I,Ali S,Kang S-M等人。细菌分离凝胶杆菌SP的大豆植物中盐应激反应的缓解。Sak1。Ann microbiol。2019年。
- 20.
黄志强,张志强,张志强,等。大豆耐盐1 (GmST1)对拟南芥生长发育的影响。植物科学学报2016;
- 21。
李某,王,姬d,张w,王y,yu y等。GMSIN1 / GMNCED3S / GMRBOHBS前馈回路充当信号放大器,该信号放大器调节暴露于盐胁迫的大豆的根生长。植物细胞。2019; 31(9):2107-30。https://doi.org/10.1105/tpc.18.00662.
- 22。
程C,Li C,Wang D,Zhai L,Cai Z.大豆Gmnark影响转基因中的ABA和盐反应拟南芥.植物科学学报2018;9(514)。
- 23。
汗马,阿萨夫S,汗AL, Adhikari A, Jan R,阿里S,等。耐盐根际细菌可以缓解盐胁迫对大豆幼苗的不利影响。Biomed Res Int. 2019;
- 24。
Shokat S, Großkinsky DK。在可持续农业中解决盐碱化问题——发展中国家可以从发达国家的方法中学到什么。可持续性。2019;11(17):4558。https://doi.org/10.3390/su11174558.
- 25。
11世纪盐水农业盐水农业:使用盐污染资源来应对食品要求。j bot。2012; 2012:310705。
- 26。
Fatma M,沥青M,Masood A,Khan Na。通过增加谷胱甘肽的产量,过量的硫磺补充剂可提高盐胁迫下的芥末肿大的光合作用和生长。Environ Exp Bot。2014; 107:55-63。https://doi.org/10.1016/j.envexpbot.2014.05.008.
- 27.
汗马,阿萨夫S,汗AL, Adhikari A, Jan R,阿里S,等。植物促生内生细菌增强水稻植株的生长和耐盐性。植物医学杂志》2020。
- 28.
Kumar A, Singh S, Gaurav AK, Srivastava S, Verma JP。植物促生细菌:减缓植物盐分胁迫的生物工具。Microbiol前面。2020;11(1216)。
- 29.
Kang S- m, Shahzad R, Bilal S, Khan AL, Park Y-G, Lee K-E,等。产乳酸菌Leclercia adecarboxylata MO1的吲哚-3-乙酸和ACC脱氨酶通过内源次生代谢产物调控提高番茄茄的生长和耐盐性。BMC Microbiol。2019;19(1):80。https://doi.org/10.1186/s12866-019-1450-6.
- 30.
姜思敏,汗A, Waqas M, You Y-H, Kim J-H, Kim J-G,等。植物促生菌通过调节植物激素和抗氧化剂来降低盐胁迫和渗透胁迫对黄瓜的不利影响。植物学报,2014;9(1):673-82。https://doi.org/10.1080 / 17429145.2014.894587.
- 31.
Nadeem SM, Zahir ZA, Naveed M, Asghar HN, Arshad M.能产生acc -脱氨酶的根际细菌可能减轻小麦的盐胁迫。土壤学报;2010;40(2):533 - 536。https://doi.org/10.2136/sssaj2008.0240.
- 32.
植物根际促生菌通过改变小麦内源激素水平和TaCTR1/TaDREB2的表达,增强小麦对盐胁迫和干旱胁迫的耐受性。杂志。2017;161(4):502 - 14所示。https://doi.org/10.1111/ppl.12614.
- 33。
Yoo SJ,Weon Hy,Song J,Sang Mk。番茄植物中的Halotolerant细菌芽孢杆菌H19-1和B.Mesonae H20-5诱导盐度胁迫的耐受性。J microbiol biotechnol。2019; 29(7):1124-36。https://doi.org/10.4014/jmb.1904.04026.
- 34。
Yasmin H, Naeem S, Bakhtawar M, Jabeen Z, Nosheen A, Naz R,等。耐盐根际细菌假单胞菌假碱性杆菌和枯草芽孢杆菌介导水培大豆的系统性耐受(甘氨酸最大抗盐胁迫。PLoS ONE。2020; 15 (4): e0231348。
- 35。
Tiwari S,Prasad V,Chauhan PS,Lata C.芽孢杆菌淀粉醇溶血素通过渗透保护和基因表达调控,使水稻对各种非生物胁迫具有耐受性。植物科学学报2017;8(1510)。
- 36。
姚林,吴志华,郑勇,李超。腐殖假单胞菌Rs-198对棉花生长和盐胁迫的保护作用。土壤生物学报,2010;46(1):49-54。https://doi.org/10.1016/j.ejsobi.2009.11.002.
- 37。
王志强,王志强,王志强,等。盐胁迫对两种罗勒基因型生长、叶绿素含量和渗透成分的影响。生物技术学报。2012;11(2):379-84。
- 38。
杨智,李建林,刘丽娜,谢强,隋楠。盐胁迫下甜高粱光合调控及耐盐机理。植物科学学报。2020;10(1722)。
- 39.
王志强,王志强,王志强,等。干旱胁迫和接种根际促生菌对罗勒光合色素和抗氧化活性的影响。中国农业科学,2012;11(1):57-61。https://doi.org/10.1016/j.jssas.2011.09.001.
- 40.
陈志强,陈志强,陈志强,等。细菌介导的干旱胁迫对水稻抗旱性和敏感品种的影响。生物技术学报。2015;14(9):764-73。
- 41.
Siddikee Ma,Chauhan PS,Anandham R,Han G-H,SA T-M。盐胁迫下植物生长促进的分离,表征和用途,ACC脱氨酶产生沿海地土壤的卤素酶的卤化菌细菌。J microbiol biotechnol。2010; 20(11):1577-84。https://doi.org/10.4014/jmb.1007.07011.
- 42.
范鹏,陈东,何勇,周强,田勇,高磊。盐碱地野生植物根际节节杆菌和巨芽孢杆菌对番茄幼苗盐胁迫的缓解作用。植物修复学报,2016;18(11):1113-21。https://doi.org/10.1080/15226514.2016.1183583.
- 43.
Vurukonda SSKP,Vardharajula S,Shrivastava M,Skz A.通过植物生长促进robobacteria的植物生长增强庄稼的干旱胁迫耐受性。microbiol res。2016; 184:13-24。https://doi.org/10.1016/j.micres.2015.12.003.
- 44.
Selvakumar G,Panneerselvam P,Ganeshamurthy。细菌介导的作物中非生物胁迫的缓解。在:农业学中的细菌:压力管理:斯普林克;2012. p。205-24。
- 45。
Gupta S,Schillaci M,Walker R,Smith PMC,Watt M,Roessner U.通过内科植物 - 真菌共生的植物中缓解盐度胁迫:当前的知识,观点和未来方向。植物土壤。2020。https://doi.org/10.1007/s11104-020-04618-w.
- 46。
王M,郑Q,沉Q,郭S.钾盐胁迫反应的关键作用。int j mol sci。2013; 14(4):7370-90。https://doi.org/10.3390/ijms14047370.
- 47。
他t,克莱默gr。脱落酸浓度与两种盐胁迫快速循环芸苔属物种中的叶面积减少相关。植物土壤。1996年; 179(1):25-33。https://doi.org/10.1007/BF00011639..
- 48。
Cramer Gr,Quarrie Sa。脱落酸与血液四种基因型的叶生长抑制与其对盐度的反应不同的叶片生长抑制。Funct植物Biol。2002; 29(1):111-5。https://doi.org/10.1071/pp01131..
- 49。
穆赫兰BJ,泰勒IB,杰克逊AC,汤普森AJ。ABA能否介导番茄盐度胁迫的响应?环境实验机器人。2003;50(1):17-28。https://doi.org/10.1016/s0098 - 8472 (02) 00110 - 7.
- 50.
植物激素信号转导的研究进展。大自然。2009;459(7250):1071 - 8。https://doi.org/10.1038/nature08122.
- 51.
acta botanica sinica(云南农业大学学报),2017,39(4):559 - 563。植物学报。1998;21(1):54-62。https://doi.org/10.1046/j.1365-3040.1998.00249.x.
- 52.
Park Y-G, Mun B-G, Kang S-M, Hussain A, Shahzad R, Seo C-W,等。aryabhattai SRB02能耐受氧化和硝化胁迫,并通过调节植物激素的产生促进大豆的生长。《公共科学图书馆•综合》。2017;12 (3):e0173203。https://doi.org/10.1371/journal.pone.0173203.
- 53.
Curá JA, Franz DR, Filosofía JE, Balestrasse KB, Burgueño LE。接种偶氮螺旋菌和草本螺旋菌提高了玉米对干旱胁迫的耐受性。微生物。2017;5(3):41。
- 54.
Ilangumaran G,Smith DL。植物生长促进盐度压力改善的根瘤菌:系统生物学视角。前植物SCI。2017; 8(1768年)。
- 55.
王庆军,孙辉,董庆林,孙天宇,金志新,郝永军,等。通过胞质苹果酸脱氢酶基因修饰氧化还原状态和水杨酸含量,提高转基因苹果植株的耐盐性和耐冷性。植物生态学报;2016;14(10):1986-97。https://doi.org/10.1111/pbi.12556.
- 56.
杨颖,齐敏,梅春梅。内源水杨酸对水稻衰老及生物和非生物胁迫下的氧化损伤的保护作用。植物j . 2004; 40(6): 909 - 19所示。https://doi.org/10.1111/j.1365-313X.2004.02267.x.
- 57。
Radhakrishnan R, Lee I-J。亚精胺对黄瓜(Cucumis sativus L.)水杨酸、茉莉酸和脂肪酸的调控促进了植物对盐胁迫的生长。植物生理学报。2013;35(12):3315-22。https://doi.org/10.1007/s11738-013-1364-0.
- 58。
王勇。盐度对六角鸢尾内源ABA、IAA、JA和SA的影响化学学报。2001;27(2):327-42。https://doi.org/10.1023/a:1005632506230.
- 59。
姜s -M, Khan AL, Waqas M, You Y-H, Kim J-H, Kim J-G,等。植物根际促生细菌通过调节植物激素和抗氧化剂来降低盐胁迫和渗透胁迫对黄瓜的不利影响。植物学报,2014;9(1):673-82。https://doi.org/10.1080 / 17429145.2014.894587.
- 60。
Khan MA, Asaf S, Khan AL, Jan R, Kang S- m, Kim K-M,等。植物促生芽孢杆菌SA1对热胁迫下大豆的耐热效应BMC Microbiol。2020;20(1):175。https://doi.org/10.1186/s12866-020-01822-7.
- 61.
Khan MA, Asaf S, Khan AL, Jan R, Kang S- m, Kim K-M,等。蜡样芽孢杆菌SA1分离株对番茄幼苗耐热性的影响及其与外源腐植酸的比较《公共科学图书馆•综合》。2020;15 (4):e0232228。https://doi.org/10.1371/journal.pone.0232228.
- 62.
甘露醇胁迫对西兰花芽形态、生化和多酚参数的影响。应用生态环境学报2018;16(2):2043-58。https://doi.org/10.15666/aeer/1602_20432058.
- 63.
Sandhya V,Ali Sz,Grever M,Reddy G,Venkateswarlu B.植物生长促进假鼠SPP的影响。在干旱胁迫下玉米的相容溶质,抗氧化状态和植物生长。植物生长调节。2010; 62(1):21-30。https://doi.org/10.1007/s10725-010-9479-4.
- 64.
陈志强,王志强,王志强,等。枯草芽孢杆菌对干旱胁迫下玉米生长、渗透和抗氧化性能的影响。植物学报。2011;6(1):1 - 14。https://doi.org/10.1080 / 17429145.2010.535178.
- 65.
Nan H,Cao D,张D,Li Y,Lu S,Tang L等。GMFT2A和GMFT5A通过与大豆在大豆中的Bzip转录因子GMFDL19的相互作用和上调的相互作用冗余和差异地调节开花。Plos一个。2014; 9(5):E97669。https://doi.org/10.1371/journal.pone.0097669.
- 66.
Yu-Na K, Muhammad Aaqil K, Sang-Mo K, Muhammad H, In-Jung L.增强抗旱性芸苔甘蓝醛。italica.由新分离的variovorax sp. YNA59。中国生物医学工程学报。2020;0(0)。
- 67.
分子克隆:实验室手册。第三版《冷泉港》:冷泉港实验室出版社;2001.
- 68.
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析版本6.0。生物医学进展。2013;30(12):2725-9。https://doi.org/10.1093/molbev/mst197.
- 69。
Qi Q, Rose PA, Abrams GD, Taylor DC, Abrams SR, Cutler AJ。甘蓝型油菜(brassica napus)胚胎(+)脱落酸代谢、3-酮酰基辅酶a合酶基因表达和极长链单不饱和脂肪酸生物合成。植物杂志。1998;117(3):979 - 87。https://doi.org/10.1104/pp.117.3.979.
- 70.
Jan R, Khan MA, Asaf S, Lubna, Lee I-J, Kim KM。耐金属内生菌通过调节水稻的抗氧化机制和内源激素,降低镉、镍毒性,促进水稻生长,增强金属胁迫相关基因的表达。植物。2019;8(10):363。https://doi.org/10.3390/plants8100363.
- 71。
Waqas M,Khan A,Hamayun M,Shahzad R,Kim Y-H,Choi K-S等人。内生感染通过调节防御激素,抗氧化剂和功能性氨基酸来减轻向日葵中的生物压力。EUR J植物途径。2015; 141(4):803-24。https://doi.org/10.1007/s10658-014-0581-8.
- 72。
利用蛋白质-染料结合原理的一种快速、灵敏的微量蛋白质定量方法。肛门。1976;72(2):248 - 54。https://doi.org/10.1016/0003-2697(76 )90527-3.
- 73.
Hamayun M,Hussain A,Khan SA,Kim H-Y,Khan Al,Waqas M等。赤霉素生产内心真菌浮子豆腐蛋白Spadiceum agh786拯救受影响大豆的生长。前微生物。2017; 8(686)。
- 74.
镉、锌对菜豆脂质过氧化的诱导及抗氧化酶活性的影响。植物科学。1997;127(2):139 - 47岁。https://doi.org/10.1016/s0168 - 9452 (97) 00115 - 5.
- 75.
张建军,张建军。干旱胁迫对小麦超氧化物歧化酶、过氧化氢酶和过氧化物酶活性的影响。植物生理学报。1994;35(5):785-91。https://doi.org/10.1093/oxfordjournals.pcp.a078658.
- 76.
Jan R,Khan Ma,Asaf S,Lee I-J,Bae J-S,Kim K-M。OSCM的过度表达通过植物激烈的植物综合累积和转录调节来缓解BLB应力。SCI代表2020; 10(1):19520。https://doi.org/10.1038/s41598-020-76675-1..
- 77.
Jan R,Khan Ma,Asaf S,Lee I-J,Kim K-M。OSF3H的过度表达通过在Oryza Sativa的转录组和代谢物水平上改变苯基丙醇途径来调节WBPH胁迫。SCI代表2020; 10(1):14685。https://doi.org/10.1038/s41598-020-71661-z.
确认
不适用
资金
本研究获得教育部韩国国家研究基金基础科学研究计划(2017R1D1A1B04035601)资助。资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有作用。
作者信息
从属关系
贡献
MAK和AAS进行了实验。MAK, SA和MH撰写了手稿。MI, AA和SMK进行了激素分析。RJ和KMK进行qRT-PCR分析。IJL设计、监督和资助了这项研究。所有作者已经阅读并同意手稿的内容,这符合杂志的政策。作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用
同意出版
不适用。
相互竞争的利益
两位作者宣称没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
汗,m.a., Sahile, a.a., Jan, R。等等。通过调节次级代谢物和分子反应,卤化细菌减轻了盐度胁迫对大豆生长的影响。BMC植物杂志21,176(2021)。https://doi.org/10.1186/s12870-021-02937-3
收到了:
接受:
发表:
关键词
- Halotolerant PGPR
- 盐度应力
- 激素
- 抗氧化剂
- 基因表达
- 大豆