- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 出版:gydF4y2Ba
花粉母细胞减数分裂过程中的染色体行为gydF4y2BaSaccharum OfficinArum×Erianthus arundinaceusgydF4y2BaFgydF4y2Ba1gydF4y2Ba混合动力车gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21gydF4y2Ba, 文章编号:gydF4y2Ba139gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
近年来,甘蔗因能量作物而引起了不断的关注。野生资源广泛用于改善甘蔗的狭窄遗传碱基。但是,F的不孕症gydF4y2Ba1gydF4y2Ba之间的混合动力车gydF4y2Ba甘蔗gydF4y2Ba(gydF4y2BaS药用植物gydF4y2Ba) 和gydF4y2Ba斑茅gydF4y2Ba(gydF4y2BaE. arundinaceus.gydF4y2Ba)已经阻碍了甘蔗滋生努力。为了发现这种不孕症的原因,我们从细胞学角度研究了杂交过程。gydF4y2Ba
结果gydF4y2Ba
我们在三个f中检查了花粉母细胞(PMC)的减数分裂过程gydF4y2Ba1gydF4y2Ba之间的混合动力车gydF4y2BaS药用植物gydF4y2Ba和gydF4y2BaE. arundinaceus.gydF4y2Ba.细胞学分析表明,父本海南92-77和海南92-105减数分裂正常。而FgydF4y2Ba1gydF4y2Ba杂种显示出各种异常现象,包括滞后染色体,微核,不均匀的偏析,染色体桥和无法形成细胞板。原位杂交(GISH)的基因组在细胞分裂期间显示出不等染色质分布。有趣的是,96.70%的滞后染色体来自gydF4y2BaE. arundinaceus.gydF4y2Ba.以45S rDNA和5S rDNA为探针,进行了荧光原位杂交(FISH)。在异常减数分裂过程中,45S rDNA位点或5S rDNA位点丢失,四分体染色体分离不均匀现象明显。gydF4y2Ba
结论gydF4y2Ba
通过细胞遗传学分析,发现FgydF4y2Ba1gydF4y2Ba. GISH进一步证实96.70%的滞后染色体来自于染色体gydF4y2BaE. arundinaceus.gydF4y2Ba.通过进一步研究重复序列发现染色体损失。我们的研究结果提供了对甘蔗染色体遗传的洞察力,以帮助甘蔗种质资源中的创新和利用。gydF4y2Ba
背景gydF4y2Ba
典型的CgydF4y2Ba4gydF4y2Ba作物,甘蔗有很大的生物量,占世界糖产量的75% [gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].gydF4y2Ba甘蔗gydF4y2Ba(2n = 8x = 80)属于gydF4y2Ba糖gydF4y2Ba,是品种中糖基因的重要来源。现代甘蔗品种主要来自甘蔗品种或杂种之间的间隙杂交,导致越来越窄的遗传背景[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].为了拓宽甘蔗的遗传基础,提高其杂合性,甘蔗育种工作者利用野生甘蔗属等gydF4y2BaErianthus.gydF4y2Ba,gydF4y2BaSclerostachyagydF4y2Ba(黑客)gydF4y2Ba答:加缪gydF4y2Ba,gydF4y2BaNarengagydF4y2BaBor,gydF4y2Ba芒草gydF4y2Ba作为近交种质资源[gydF4y2Ba5gydF4y2Ba].gydF4y2Ba
斑茅gydF4y2Ba(2n = 4x = 40或2n = 6x = 60)具有良好的抗虫、抗旱、抗病等特性[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].gydF4y2BaE. arundinaceus.gydF4y2Ba分蘖能力强,生长性强,再生性好[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].作为一种强大的野生遗传资源,gydF4y2BaE. arundinaceus.gydF4y2Ba在世界各地的甘蔗育种项目中经常使用。本种是我国重要的野生甘蔗种质资源gydF4y2Ba糖gydF4y2Ba复杂,早在1885年就与甘蔗杂交[gydF4y2Ba6gydF4y2Ba];大约在同一时间gydF4y2BaS. Spontaneum.gydF4y2Ba开始用于杂交。尽管FgydF4y2Ba1gydF4y2Ba在1931年成功获得了FgydF4y2Ba1gydF4y2Ba杂种发展非常缓慢,主要是由于雄性不育程度高[gydF4y2Ba7gydF4y2Ba].经过几十年的努力,甘蔗育种者成功地获得了一个真正的BCgydF4y2Ba1gydF4y2Ba一代的gydF4y2Ba糖gydF4y2Ba杂交种和gydF4y2BaE. arundinaceus.gydF4y2Ba在海南甘蔗育种站。FgydF4y2Ba1gydF4y2Ba染色体遗传模式gydF4y2BaS药用植物gydF4y2Ba×gydF4y2BaE. arundinaceus.gydF4y2Ba杂交是n + n [gydF4y2Ba8gydF4y2Ba]和FgydF4y2Ba1gydF4y2Ba无性系雄性不育。当FgydF4y2Ba1gydF4y2Ba被用作与母亲交配的对象gydF4y2Ba糖gydF4y2BaSPP。,染色体遗传模式似乎是2n + n [gydF4y2Ba11gydF4y2Ba].然而,关于F .的高花粉不育机制的报道很少gydF4y2Ba1gydF4y2Ba或者bc.gydF4y2Ba1gydF4y2Ba染色体遗传模式(2n + n)。因此,对甘蔗杂交后代的染色体行为进行了研究gydF4y2BaE. arundinaceus.gydF4y2Ba在减数分裂期间仍然不清楚。gydF4y2Ba
荧光原位杂交(Fluorescence in situ hybridization, FISH)通常使用基因组DNA或基因组DNA的一部分,如重复序列和单拷贝基因序列,作为探针[gydF4y2Ba12gydF4y2Ba].45s RDNA和5S rDNA中的保守的重复序列被广泛用于分析植物的进化来源,鉴定染色体和染色体倍增物[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].基因组探针被广泛用于区分两个或多个异源多倍体物种的染色体,以及区分因染色体易位而产生的多倍体物种的不同来源的形成和进化[gydF4y2Ba16gydF4y2Ba,染色体丢失[gydF4y2Ba17gydF4y2Ba],基因插入[gydF4y2Ba18gydF4y2Ba,或染色体引起的变化[gydF4y2Ba19gydF4y2Ba].gydF4y2Ba
为了分析花粉母细胞在减数分裂过程中的染色体行为和细胞分裂,我们对雄性进行了细胞学分析gydF4y2BaE. arundinaceus.gydF4y2Ba(海南92-77和海南92-105)和三楼gydF4y2Ba1gydF4y2Ba杂交种(崖城96-40、崖城96-66和崖城95-41)。用FISH探针45srdna和5srdna研究染色体行为。本研究结果可为植物资源的开发利用提供依据gydF4y2BaE. arundinaceus.gydF4y2Ba在甘蔗育种项目中。gydF4y2Ba
材料和方法gydF4y2Ba
植物材料gydF4y2Ba
表型显著不同的崖城96-40和崖城95-41为FgydF4y2Ba1gydF4y2Ba巴迪拉(gydF4y2BaS药用植物gydF4y2Ba♀)和海南92-77(gydF4y2BaE. arundinaceus.gydF4y2Ba♂)。崖城95-41有28条染色体gydF4y2BaE. arundinaceus.gydF4y2Ba崖城96-40有29条染色体gydF4y2BaE. arundinaceus.gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba].崖城96-66系由巴迪拉(gydF4y2BaS药用植物gydF4y2Ba♀)和海南92-105(gydF4y2BaE. arundinaceus.gydF4y2Ba三种子代茎的颜色不同(图SgydF4y2Ba1gydF4y2Ba).崖城01-134是公元前gydF4y2Ba1gydF4y2Ba崖城96-40(♀)与ROC20(♀)杂交后代gydF4y2Ba糖gydF4y2Ba混合动力车♂)。植物材料由中国海南甘蔗育种站提供和保存。gydF4y2Ba
方法gydF4y2Ba
取样和保存gydF4y2Ba
在8:00-10:00中,在4℃下用农民的固定剂(乙醇:乙酸= 3:1)固定在其中的分裂体中的雄性芽。通过显微检测证实了分数阳阶段的芽并储存在70%乙醇中。gydF4y2Ba
使用acetocarmine染色的花蕾的分期gydF4y2Ba
将2 ~ 3个固定芽置于载玻片上,加入50 μl法默氏定影剂。用解剖针轻轻挤压花药,释放减数分裂细胞,去除杂质。然后加入20微升乙酰胭脂胺溶液(Solarbio, China, G1390-100 mL)染色染色体。然后在顶部放置一个覆盖滑块,并用橡胶水泥密封。gydF4y2Ba
鱼滑准备gydF4y2Ba
收集到的分阶段花药在200 μL的试管中用75 mM KCl洗涤5 min, 10 mM柠檬酸缓冲液(pH = 4.5)洗涤2次5 min。然后,加入8%纤维素酶“ONOZUKA”R-10 (Yakult,日本,MX7352) 20 μL, 2%果胶酶(生工生物技术,中国,A605099) 20 μL, 1%果胶酶Y-23 (Yakult,日本,MX7354) 20 μL,在37℃下轻轻混合酶解90 min。最后用10 mM柠檬酸缓冲液4°C处理2次5 min,然后预冷Farmer’s固定液,4°C保存。gydF4y2Ba
花粉活力测定gydF4y2Ba
海南92-77、FgydF4y2Ba1gydF4y2Ba公元前,gydF4y2Ba1gydF4y2Ba收集。取两个花药放在载玻片上,滴一滴ddHgydF4y2Ba2gydF4y2Ba加入O,用镊子压碎花药释放花粉粒。然后,20 μL碘gydF4y2Ba2gydF4y2Ba加入-KI(1%)溶液缓慢覆盖载玻片,显微镜下观察花粉粒并拍照。观察3张幻灯片,每张幻灯片拍摄10张照片。深色花粉被认为是活性的,而浅色花粉被认为是活性差的。gydF4y2Ba
基因组原位杂交(GISH)gydF4y2Ba
酶解后芽用镊子迅速粉碎。芽中的PMC轻轻挤出以除去杂质,将5μl悬浮液沉积在良好清洁的载玻片上。在液体干燥之前,将一滴农场的固定剂迅速加入载玻片中,以将花粉均匀地涂抹在载玻片上。gydF4y2Ba
采用CTAB法提取基因组DNA[gydF4y2Ba21gydF4y2Ba].我们使用一个刻痕翻译试剂盒(罗氏,瑞士,10,976,776,001)来标记探针。基因组DNAgydF4y2BaE. arundinaceus.gydF4y2Ba(海南92-77基因组DNA)用地高辛-11- dutp (Roche, Switzerland, 11093,088,910)标记。Bio16-dUTP (Roche, Switzerland, 11093070910)用于标记基因组DNAgydF4y2BaS药用植物gydF4y2Ba(Badila基因组DNA)。准备包含两个DNA探针的杂交溶液,滴在载玻片上,在37℃的潮湿室内进行杂交过夜。在42°C下用2× SSC洗涤10min,然后在室温下分别用2× SSC和4× SSC/Tween洗涤5min。检测信号从digoxigenin和生物素探针,幻灯片和anti-digoxigenin-fluorescein孵化(瑞士罗氏公司,11207741910)和罗丹明抗体(向量、美国、a - 2005) 1 h在37°C,然后用4×SSC /洗了三次渐变为8分钟37°C。使用抗褪色安装介质4’-6-二氨基-2-苯吲哚(DAPI, Vector, USA, H-1200)进行反染色。使用AxioScope A1成像显微镜进行荧光成像,用AxioVision软件进行处理。gydF4y2Ba
结果gydF4y2Ba
花粉活力测试gydF4y2Ba
我gydF4y2Ba2gydF4y2Ba-KI(1%)染色法检测FgydF4y2Ba1gydF4y2Ba(崖城96–40)花粉。深色和浅色分别被认为是可行的和不可侵犯的。海南92-77花粉育性率为98.39%(488/496)。gydF4y2Ba1gydF4y2Baa),而FgydF4y2Ba1gydF4y2Ba花粉粒完全不育(图。gydF4y2Ba1gydF4y2Bab). BC花粉育性gydF4y2Ba1gydF4y2Ba崖城01-134恢复至21.24%(452/2128)。gydF4y2Ba1gydF4y2Bac)。gydF4y2Ba
PMCs的减数分裂染色体行为gydF4y2BaE. arundinaceus.gydF4y2Ba和FgydF4y2Ba1gydF4y2Ba混合动力车gydF4y2Ba
pmc用乙酸品红染色。对减数分裂期间观察到的细胞进行拍照,并对所有照片进行分类和计数;具体情况如下。gydF4y2Ba
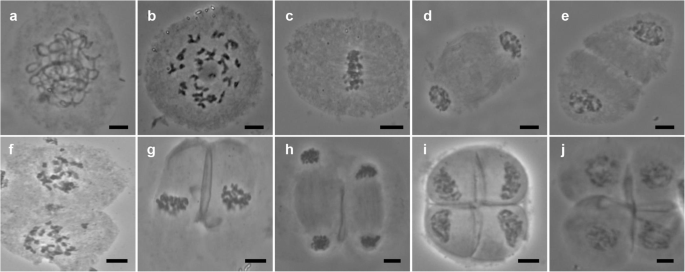
PMC肥沃雄性父母海南92-77(图。gydF4y2Ba2gydF4y2Baa-j)和海南92-105(图SgydF4y2Ba2gydF4y2Ba)呈正常分裂。gydF4y2Ba
海南92-77具有正常的减数分裂行为。gydF4y2Ba一个gydF4y2Ba:pachytene。gydF4y2BabgydF4y2Ba:终变期。gydF4y2BacgydF4y2Ba:Metaphase I.gydF4y2BadgydF4y2Ba:Anaphase I.gydF4y2BaegydF4y2Ba:我末期。gydF4y2BafgydF4y2Ba:一对。gydF4y2BaggydF4y2Ba:Metaphase II。gydF4y2BahgydF4y2Ba:后期II。gydF4y2Ba我gydF4y2Ba第二:末期。gydF4y2BajgydF4y2Ba:四分体。比例尺 = 10 微米gydF4y2Ba
在父本中,没有观察到任何时期的异常行为(图。gydF4y2Ba2gydF4y2Baj)。然而,三个FgydF4y2Ba1gydF4y2Ba个人在减数分裂时表现出多种异常行为;八胜96-40(48.11%),八胜95-41(44.65%),八胜96-66(46.44%)表现出异常,特别是在外文I中,其中超过60%的异常发生(表gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
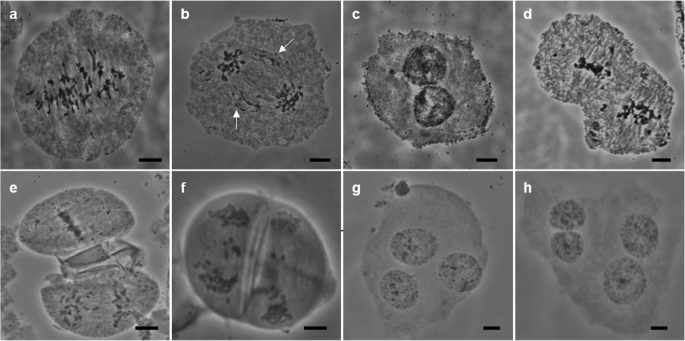
例如,在中期I有几个染色体不同步(整齐地排列在细胞板上)。gydF4y2Ba3.gydF4y2Baa).在后期I,存在滞后染色体(图。gydF4y2Ba3.gydF4y2Bab).细胞板在末期I没有完全形成(图1)。gydF4y2Ba3.gydF4y2Bac),导致中期II下的双核(图。gydF4y2Ba3.gydF4y2Bad).同样,染色体分离在后期II没有同步(图4)。gydF4y2Ba3.gydF4y2Bae),观察滞后染色体(图。gydF4y2Ba3.gydF4y2Baf).在末期II观察到多个核(图。gydF4y2Ba3.gydF4y2Ba崖城96-66和崖城96-40在减数分裂过程中具有相似的特征(图SgydF4y2Ba3.gydF4y2Ba和SgydF4y2Ba4gydF4y2Ba).综上所述,我们的结果表明FgydF4y2Ba1gydF4y2Ba巴迪拉和gydF4y2BaE. arundinaceus.gydF4y2Ba减数分裂异常,可能是导致花粉不育的关键因素。gydF4y2Ba
在八胜95-41 f中观察到典型的异常现象gydF4y2Ba1gydF4y2Ba减数分裂过程。gydF4y2Ba一个gydF4y2Ba:中期I,不同步。gydF4y2BabgydF4y2Ba:后期I,白色箭头表示滞后染色体。gydF4y2BacgydF4y2Ba:Telophase I,Dikaryocyte。gydF4y2BadgydF4y2Ba:中期II,未形成细胞板。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba:后期II,染色体分裂不同步。gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba:多核细胞,没有形成细胞板。秤条=10μmgydF4y2Ba
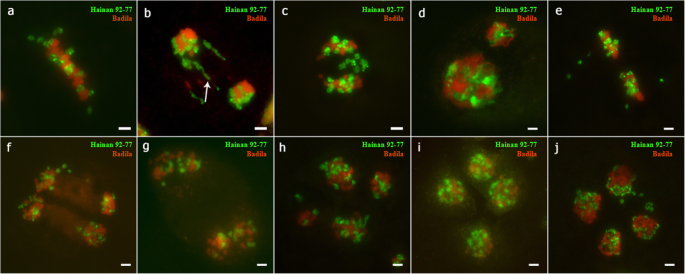
GISH结果分析gydF4y2Ba
从预先从预先形成到斑氏肌瘤的正常过程,然后GISH(图)gydF4y2Ba5gydF4y2Ba).有趣的是,我们在观察到一些二价之间gydF4y2BaS药用植物gydF4y2Ba和gydF4y2BaE. arundinaceus.gydF4y2Ba在终变期(图SgydF4y2Ba5gydF4y2Bab).然而,也观察到许多异常现象。在中期I,当染色体排列在细胞板上时,所有的滞后染色体属于gydF4y2BaE. arundinaceus.gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Baa).有多条染色体桥接(图。gydF4y2Ba4gydF4y2Bab)。我们还检测到来自的滞后染色体gydF4y2BaE. arundinaceus.gydF4y2Ba在外阴Ⅰ(图。gydF4y2Ba4gydF4y2Bac).在前期II,由于分离延迟或不等分裂,细胞大小差异显著(图)。gydF4y2Ba4gydF4y2Bad)。在Metaphase II中,gydF4y2BaE. arundinaceus.gydF4y2Ba染色体滞后(无花果。gydF4y2Ba4gydF4y2Bae) 是的。在第二阶段后期,出现了一条落后的染色体(图。gydF4y2Ba4gydF4y2Baf).在末期II,没有细胞板形成(图。gydF4y2Ba4gydF4y2Bag).非同步分离(图)gydF4y2Ba4gydF4y2Bah) 染色体的不平等分离导致了大的细胞核大小(图。gydF4y2Ba4gydF4y2Bai).四分体间染色质的数量差异很大,经常出现染色体滞后和微核的细胞(图5)。gydF4y2Ba4gydF4y2Baj)。gydF4y2Ba
在f中的pmcs的gishgydF4y2Ba1gydF4y2Ba在减数分裂异常。gydF4y2Ba一个gydF4y2Ba:中期I的迟滞染色体。gydF4y2BabgydF4y2Ba:箭头指向染色体桥梁。gydF4y2BacgydF4y2Ba:后期I染色体滞后。gydF4y2BadgydF4y2Ba:双核细胞。gydF4y2BaegydF4y2Ba:末期II的迟滞染色体。gydF4y2BafgydF4y2Ba:末期II的迟滞染色体。gydF4y2BaggydF4y2Ba:末期II无细胞板形成。gydF4y2BahgydF4y2Ba:四分体的不同步分离。gydF4y2Ba我gydF4y2Ba:四分体中的不平等隔离。gydF4y2BajgydF4y2Ba:四分体中的滞后染色体和微核。比例尺= 5 μmgydF4y2Ba
FISH结果分析gydF4y2Ba
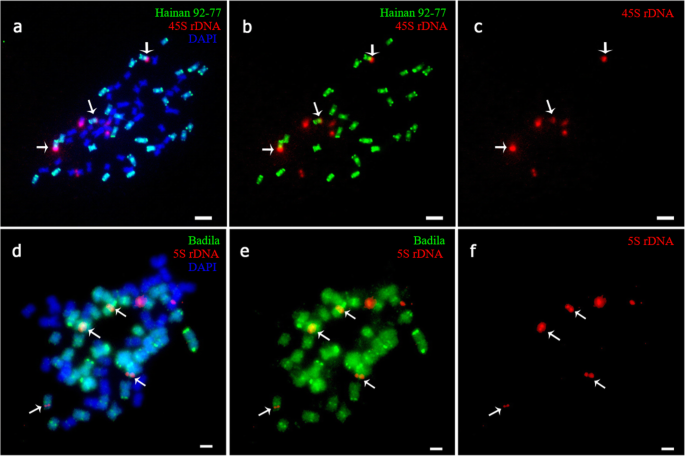
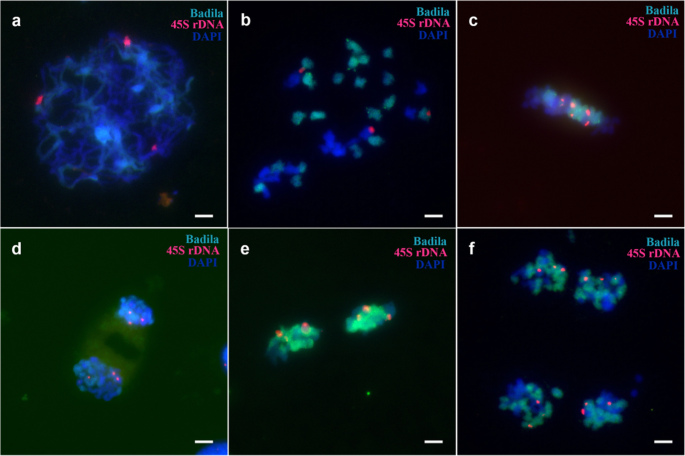
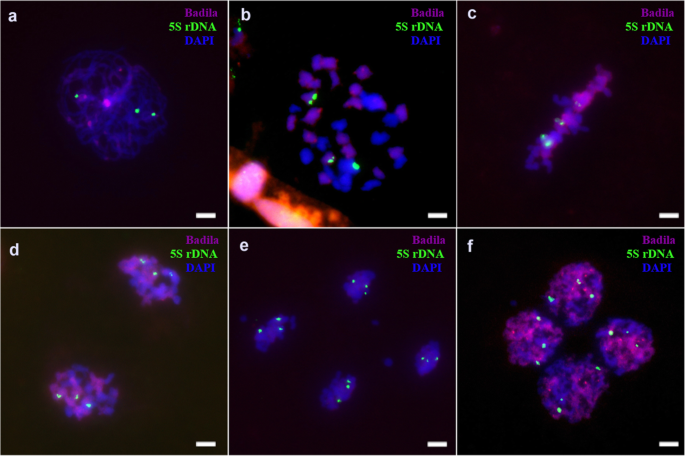
根据以往的报告[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba22gydF4y2Ba[]、45S和5S rDNA在Badila和gydF4y2BaE. arundinaceus.gydF4y2Ba.海南92-77有丝分裂时有6个45S位点和6个5S rDNA位点(gydF4y2Ba图Sa、bgydF4y2Ba),巴德拉有八45秒和八5岁的菌丝病症(gydF4y2Ba图Sc, dgydF4y2Ba).FgydF4y2Ba1gydF4y2Ba体细胞有7个45S rDNA位点。gydF4y2Ba5gydF4y2BaA-c),包括四个gydF4y2BaS药用植物gydF4y2Ba三个来自gydF4y2BaE. arundinaceus.gydF4y2Ba.FgydF4y2Ba1gydF4y2Ba细胞为2n = n (gydF4y2BaS药用植物gydF4y2Ba) +名词(gydF4y2BaE. arundinaceus.gydF4y2Ba).同时,体细胞中有六个5s rdna位点,其中四个和两个地点来自gydF4y2BaS药用植物gydF4y2Ba和gydF4y2BaE. arundinaceus.gydF4y2Ba分别(无花果。gydF4y2Ba5gydF4y2Bad-f)。gydF4y2Ba
然而,在FgydF4y2Ba1gydF4y2Ba花粉减数分裂时,只有6个45S rDNA位点出现,少于崖城95-41体细胞的7个位点。gydF4y2Ba6gydF4y2Ba).另外,45s rdna基因座通常在减数分裂期间通常在每个细胞中分布。在减数分裂时,在六个位点始终检测到5S rDNA(图。gydF4y2Ba7gydF4y2Ba).我们的结果显示,在减数分裂II期间丢失了一个45S rDNA位点(图SgydF4y2Ba7gydF4y2Ba),而在减数分裂期间各种细胞中的5s rdNA位点的数量(图。gydF4y2Ba8gydF4y2Ba). 在四分体时期发现异常(图gydF4y2Ba9gydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
不育性是阻碍杂交育种和资源利用的关键问题gydF4y2BaE. arundinaceus.gydF4y2Ba.杂种的低育性也影响其他物种的远缘杂交,如大麦[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba],小麦[gydF4y2Ba25gydF4y2Ba],还有土豆[gydF4y2Ba26gydF4y2Ba].许多以前的研究已经使用细胞学来了解导致这种低生育能力的现象。Bremer假设,属间杂交产生的后代倾向于表现出染色体分布不平衡,称为“不平衡杂交”[gydF4y2Ba27gydF4y2Ba].甘蔗作为一种异源多倍体植物,被认为能够相对容易地容纳外源基因资源,从而产生种间和种间的杂种,特别是与外源基因杂交的杂种gydF4y2BaE. arundinaceus。gydF4y2Ba不平衡杂交也发生在甘蔗和gydF4y2BaE. arundinaceus.gydF4y2Ba[gydF4y2Ba27gydF4y2Ba].PMC在FgydF4y2Ba1gydF4y2Ba用杂交穗的发芽率检测,而gydF4y2BaE. arundinaceus.gydF4y2BaFgydF4y2Ba1gydF4y2Ba植物(gydF4y2Ba28gydF4y2Ba].本报告证实了本研究中减数分裂期间染色体损失现象。只有29个gydF4y2BaE. arundinaceus.gydF4y2Ba使用GISH检测染色体,杂交种中缺少一个染色体[gydF4y2Ba29gydF4y2Ba].由于FgydF4y2Ba1gydF4y2Ba男性不育,FgydF4y2Ba1gydF4y2Ba只能作为母本,通过回交获得后代材料,且染色体传递2n + n或2n + n以上,也使BCgydF4y2Ba1gydF4y2Ba物质上更富有各种阻力和活力。gydF4y2BaE. arundinaceus.gydF4y2Ba5个杂种的染色体也丢失(28 ~ 29)[gydF4y2Ba30.gydF4y2Ba].当这些杂交种与商业品种作母本杂交时,BC呈“2n + n”或“2n + n”以上的模式gydF4y2Ba1gydF4y2Ba杂种,23 ~ 36gydF4y2BaE. arundinaceus.gydF4y2Ba染色体存在于这些植物中。公元前的肥沃gydF4y2Ba1gydF4y2Ba恢复了材料,恢复了后代的生育能力,获得了高糖、抗病、分蘖力强的“高贵”杂交种[gydF4y2Ba30.gydF4y2Ba]. 一般来说,后代的低生育率和不平衡杂交很可能与异常的减数分裂过程有关。gydF4y2Ba
本研究观察到在FgydF4y2Ba1gydF4y2Ba.特别是在减数分裂后期I和II,异常细胞数量达到约70%。其他物种也有类似的结果。如小麦、黑麦、FgydF4y2Ba1gydF4y2Ba的gydF4y2Ba小麦属植物timopheeviigydF4y2Ba×六倍体野生燕麦染色体桥异常、微核异常等行为[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,这可能是低生育率的原因。染色体配对的甘蔗和gydF4y2BaE. arundinaceus.gydF4y2Ba显示终变,与染色体易位和交换相吻合gydF4y2Ba1gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba].棉花杂交种有丝分裂中期染色体排列遵循有规律的基因组空间分离[gydF4y2Ba33gydF4y2Ba].远缘杂交引起染色体重排[gydF4y2Ba34gydF4y2Ba]. 基因组之间的竞争;亲本间着丝粒分裂时间、染色体数目和细胞周期长度的差异;细胞核和细胞质之间的相互作用可能是染色体滞后的原因[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].我们的结果显示来自染色体gydF4y2BaS药用植物gydF4y2Ba倾向于聚集在一起。此外,许多外源染色体的入侵可能导致了滞后现象。大约3x染色体来自gydF4y2BaE. arundinaceus.gydF4y2Ba传递给FgydF4y2Ba1gydF4y2Ba杂种,促进异常染色体配对。因此,所有滞后染色体都来自gydF4y2BaE. arundinaceus.gydF4y2Ba.微核的形成是由于染色体延迟导致染色体不能进入新形成的细胞。许多细胞在末期没有形成细胞板,导致出现两个或多个细胞核的细胞。这一现象与水稻花粉(珍汕97A及其保持系珍汕97B)的减数分裂异常现象相似[gydF4y2Ba38gydF4y2Ba];核膜和细胞板在减数分裂ⅰ期迅速解体,绒毡层细胞也迅速解体。着丝粒组蛋白H3的变异对物种杂交起着障碍作用,这可能是杂交过程中父本染色体消失的原因[gydF4y2Ba39gydF4y2Ba].染色体的空间分离和父系染色体的结构重组导致微核和单倍体的形成[gydF4y2Ba40gydF4y2Ba]. 概述了影响细胞板形成的几个因素,包括温度、分子调控和胼胝质沉积[gydF4y2Ba41gydF4y2Ba].然而,甘蔗中这些观察的详细机制还不清楚。gydF4y2Ba
以45S rDNA为探针,我们只观察到3个45S位点在终变异体中,这并不排除三价复合物的可能性。在染色体加倍之前,减数分裂期间存在6个45S rDNA位点。45S rDNA位点缺失的原因和机制有待进一步研究。一个gydF4y2BaTragopogon胶束gydF4y2Ba在新同种异体四倍体杂种中的染色体复合期间,基因丢失,这可能是由异常染色体配对引起的[gydF4y2Ba42gydF4y2Ba].利用5S rDNA作为染色体追踪探针,在四分体期的4个子细胞中检测到2、2、4、4个位点和2、2、3、5个位点的2个明显异常类型。这一结果表明,在减数分裂过程中,带有5S rDNA的染色体发生了不均匀的分离。不平等的隔离很可能是由于落后造成的gydF4y2BaE. arundinaceus.gydF4y2Ba染色体。gydF4y2Ba
结论gydF4y2Ba
FgydF4y2Ba1gydF4y2Ba甘蔗的杂种和gydF4y2BaE. arundinaceus.gydF4y2Ba显示出高的无菌率。这些杂种在减数分裂期间也表现出多种异常现象,例如染色体滞后,异步染色体分离,微核的存在,并且无法形成细胞板。此外,在96.70%(176/182)的细胞中,具有滞后染色体,滞后染色体来自gydF4y2BaE. arundinaceus.gydF4y2Ba.45S rDNA和5S rDNA的定位表明FgydF4y2Ba1gydF4y2Ba私营军事公司。结果表明,其不育性是由减数分裂紊乱、不等分离和染色体损伤引起的。本研究首次为揭示这些杂种PMC在减数分裂过程中染色体异常行为提供了细胞学证据,并直接为F . PMC不育提供了机制依据gydF4y2Ba1gydF4y2Ba混合动力车。研究结果为进一步开展甘蔗属间种质资源的相关研究奠定了基础。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用和分析的数据集均可从通讯作者处获得,实验材料已被海南省甘蔗育种站批准使用。遵循机构、国家或国际的指导方针。gydF4y2Ba
缩写gydF4y2Ba
- PMC:gydF4y2Ba
-
花粉母细胞的gydF4y2Ba
- 吉斯”:gydF4y2Ba
-
基因组原位杂交gydF4y2Ba
- 鱼:gydF4y2Ba
-
荧光原位杂交gydF4y2Ba
- CTAB:gydF4y2Ba
-
Cetyltrimethylammonium溴化gydF4y2Ba
- DAPI:gydF4y2Ba
-
4 ' 6-diamidino-2-phenylindolegydF4y2Ba
- SSC:gydF4y2Ba
-
盐酸盐钠gydF4y2Ba
参考gydF4y2Ba
- 1.gydF4y2Ba
Racedo J,Gutierrez L,Perera MF,Ostengo S,Pardo Em,Cuenya Mi,Welin B,Castagnaro AP。甘蔗育种群中定量性状的基因组关联映射。BMC植物BIOL。2016; 16(1):142。gydF4y2Ba
- 2.gydF4y2Ba
关键词:甘蔗,gSSR,亲本,遗传多样性科学世界J. 2013;2013(2013): 1-11。gydF4y2Ba
- 3.gydF4y2Ba
Rajeswari S,Sekar S,Krishnamurthi M:从甘蔗种间杂交种的亚克隆变体的开发。2006年生物技术和可持续农业2006年及以后的2007年:433。gydF4y2Ba
- 4.gydF4y2Ba
甘蔗种间杂交种的形态特征及遗传多样性分析。中国生物医学工程学报,2017;gydF4y2Ba
- 5.gydF4y2Ba
关于“海参”成员的分类gydF4y2Ba糖gydF4y2Ba复杂的'。Genet Resources Crop Evol。2006; 53(1):35-41。gydF4y2Ba
- 6.gydF4y2Ba
李文峰,王学勇,黄玉坤,单海林,罗志明,应晓明,张永英,沈坤,尹军。高粱花叶病毒抗性甘蔗种质资源的筛选。作物保护。2013;(1):43次。gydF4y2Ba
- 7.gydF4y2Ba
何SC,杨庆华,肖福华,张福财,何LL。甘蔗基本种质的收集与描述(gydF4y2Ba糖精复合体gydF4y2Ba) 在中国。INT糖J.999; 101(1201):84-85,88-89,92-93。gydF4y2Ba
- 8.gydF4y2Ba
甘蔗最终用途多样化的育种意义。国际糖业期刊2009;111(1331):676。gydF4y2Ba
- 9。gydF4y2Ba
黄志明,李建平。2n卵配子在甘蔗高贵化和育种中的意义。Euphytica。1985;34(2):377 - 84。gydF4y2Ba
- 10.gydF4y2Ba
Zu-hu D,Mu-Qing Z,Wei-Le L,Fu C,Chui-Ming Z,Yu-Zl,Li-Ping L,Yan-Quan L,Ru-kai C.杂交中的不平衡杂交分析回复后代gydF4y2Ba甘蔗gydF4y2BaxgydF4y2Ba斑茅gydF4y2Ba.积分农业学报,2010,9(9):1271-7。gydF4y2Ba
- 11.gydF4y2Ba
Hermann SR, Aitken KS, Jackson PA, George AW, Piperidis N, Wei X, Kilian A, Detering F.证据表明二次分裂恢复是2n + N母体染色体传递的基础。Euphytica。2012;187(3):359 - 68。gydF4y2Ba
- 12.gydF4y2Ba
Kim C, Robertson JS, Paterson AH。通过重叠寡核苷酸杂交推断种间杂交甘蔗品种bac的亚基因组起源。基因组。2011;54(9):727 - 37。gydF4y2Ba
- 13.gydF4y2Ba
杨晓东,李建平。45S rDNA位点在植物染色体上的分布:结构和进化意义。中国生物医学工程学报,2012;gydF4y2Ba
- 14.gydF4y2Ba
德梅洛NF,格拉M。西番莲5S和45srdna位点的变异性。基染色体数目不同的物种。安·博特。2003;92(2):309–16.gydF4y2Ba
- 15.gydF4y2Ba
D'Hont A, Grivet L, Feldmann P, Glaszmann JC, Rao S, Berding N.现代甘蔗品种双基因组结构特征(gydF4y2Ba糖gydF4y2Ba通过分子细胞遗传学。(4): 405-13。gydF4y2Ba
- 16.gydF4y2Ba
Kopecky D,Martis M,Cihalikova J,Hribova E,Vraina J,Bartos J,Kopecka J,Cattonaro F,Stoces S,Novak P等人。流量分选和测序草甸染色体4f。植物理性。2013; 163(3):1323-37。gydF4y2Ba
- 17.gydF4y2Ba
关键词:异种渐渗,草种,入侵,遗传gydF4y2Ba多年生黑麦草gydF4y2Ba(黑麦草)和gydF4y2Ba羊茅属pratensisgydF4y2Ba草地羊茅:七个单体代换系的建立及其分子和细胞学特征。安·博特。2011;107(8):1313–21.gydF4y2Ba
- 18.gydF4y2Ba
Moscone EA, Matzke MA, Matzke AJ。利用FISH/GISH联合DAPI反染色法鉴定双二倍体烟草中含有转基因插入物的染色体。Chromosoma。1996;105(4):231 - 6。gydF4y2Ba
- 19。gydF4y2Ba
利用基因组原位杂交技术(GISH)和RFLP分析,对马铃薯(+)番茄融合杂种回交后代的外源染色体进行鉴定。遗传。1995;74(3):250 - 7。gydF4y2Ba
- 20.gydF4y2Ba
吴杰,黄奕,林奕,傅C,刘S,邓Z,李Q,黄Z,陈R,张M。意外的继承模式gydF4y2Ba斑茅gydF4y2Ba染色体之间的属间子代gydF4y2Ba糖gydF4y2Ba种虫害和gydF4y2Ba斑茅gydF4y2Ba.《公共科学图书馆•综合》。2014;9 (10):e110390。gydF4y2Ba
- 21.gydF4y2Ba
Porebski S, Bailey LG, Baum BR。含高多糖和多酚成分植物CTAB DNA提取方法的改进。中国生物医学工程学报。1997;15(1):8-15。gydF4y2Ba
- 22.gydF4y2Ba
关键词:玉米,45S, 5S rDNA, FISH,物理定位Hereditas。2001;134(2):141 - 5。gydF4y2Ba
- 23.gydF4y2Ba
Molnár-lángm,Galiba G,KovácsG,Sutka J.大麦生育和减肥行为的变化(gydF4y2Ba普通大麦gydF4y2Ba) ×小麦(gydF4y2Ba小麦gydF4y2Ba)组织培养再生的杂种。基因组。1991;34(2):261–6.gydF4y2Ba
- 24.gydF4y2Ba
关键词:大麦,种间杂交种,细胞遗传学gydF4y2Ba大gydF4y2Ba.51基因组。2008;(11):897 - 904。gydF4y2Ba
- 25.gydF4y2Ba
Lukaszewski AJ。小麦单价染色体中着丝粒的行为与中心错分裂。中国生物医学工程学报,2010;gydF4y2Ba
- 26.gydF4y2Ba
自异源四倍体(AAAB)种间杂交马铃薯的染色体配对。New Zeal J Crop Hort. 2019;47(1): 11-8。gydF4y2Ba
- 27.gydF4y2Ba
甘蔗育种中存在的问题及细胞学研究——ⅲ。甘蔗细胞学杂交研究。Euphytica。1961;10(3):325 - 42。gydF4y2Ba
- 28.gydF4y2Ba
关键词:甘蔗,种间杂交,分子生物学,分子生物学gydF4y2Ba斑茅gydF4y2Ba. 基因组。2000;43(6):1033–7.gydF4y2Ba
- 29.gydF4y2Ba
D'Hont A,Rao PS,Feldmann P,GRIVET L,ISLAM-FARIDI N,Taylor P,Glaszmann JC。甘蔗酸酯杂交种的鉴定与表征gydF4y2Ba甘蔗gydF4y2BaxgydF4y2Ba斑茅gydF4y2Ba,分子标记和DNA原位杂交。Al Appl Genet。1995; 91(2):320-6。gydF4y2Ba
- 30.gydF4y2Ba
Pachakkil B,Terajima Y,Ohmido N,Ebina M,Ires,Hayashi H,Takagi H.细胞遗传学和农艺表征之间的基础杂种gydF4y2Ba糖gydF4y2Ba种虫害混合动力和gydF4y2Ba斑茅gydF4y2Ba. Sci代表,2019年;9(1):1748.gydF4y2Ba
- 31.gydF4y2Ba
Silkova Og,Adonina Ig,Krivosheina Ea,Shchapova Ai,舒米弗吉克。部分肥沃小麦/黑麦杂交种的减数分裂染色体配对。植物团体。2013; 26(1):33-41。gydF4y2Ba
- 32.gydF4y2Ba
安洪,胡敏,李平,耿刚,张强,张世坡。后代减数分裂期间的染色体行为gydF4y2Ba小麦属植物timopheeviigydF4y2Ba×六倍野生燕麦;2015.gydF4y2Ba
- 33.gydF4y2Ba
韩建林,周立波,单文斌,于立,吴伟,王凯。四倍体棉花体细胞中期A和D基因组的空间分离:多倍体植物基因组配置的证据。植物J。2015;84(6)(-):1167–77.gydF4y2Ba
- 34.gydF4y2Ba
王诗,杨qh,李fs,他ll,他sc。代表性杂交染色体染色体的表征gydF4y2Ba糖gydF4y2Ba种虫害和gydF4y2BaErianthus fulvusgydF4y2Ba通过基因组原位杂交。作物科学。2010;(5):1642 - 8。gydF4y2Ba
- 35.gydF4y2Ba
Silkova og,peresmyslova ee,shchapova ai,shumnyńvk。白聚乙酸中染色体中黑麦和小麦单位染色体中的Centromere分裂遗传调节。2008; 44(1):102-11。gydF4y2Ba
- 36.gydF4y2Ba
关键词:同源配子,未还原配子,形成Euphytica。2010;175(3):323 - 9。gydF4y2Ba
- 37.gydF4y2Ba
柳西科夫,贝科,希切科,戈尔迪。黑麦-黑麦(rrabb,2n=42)细胞质双二倍体的构建:黑麦-小黑麦杂种f1(RRABR,5x=35)的减数分裂特征。罗斯杰奈特。2005;41(7):735–41.gydF4y2Ba
- 38.gydF4y2Ba
夏克峰,王玉强,叶秀林,梁春英,许欣兰。Ca~(2+)在水稻不育系珍汕97A及其保持系珍汕97B绒毡层中的分布云南植物学报。2005;27(4):413-8。gydF4y2Ba
- 39.gydF4y2Ba
摘要/ abstract Sanei M, Pickering R, Kumke K, Nasuda S, Houben A.在种间大麦杂种单亲本染色体消除之前,着丝粒组蛋白H3 (CENH3)丢失。美国国家科学研究院学报2011;108(33):13373 -。gydF4y2Ba
- 40gydF4y2Ba
Dorota Gernand TR,Varshney A,Rubtsova M,Prodanovic S,Brüssc,kumlehn j,matzk f,Houben A.在小麦和珍珠小麦的细胞分离和间之间的发十进染色体消除涉及微核形成,渐进式异质色素化和DNA碎片。植物细胞。2005; 17(9):2431-8。gydF4y2Ba
- 41gydF4y2Ba
De Storme N,GEELEN D. Cytokinesis在植物雄性十分病中。植物信号表现。2013; 8(3):E23394。gydF4y2Ba
- 42.gydF4y2Ba
陈建平,李建平,陈建平,等。新异源四倍体染色体核型重组的研究进展gydF4y2BaTragopogon miscellusgydF4y2Ba(菊科)。染色体研究》2013;21(1):75 - 85。gydF4y2Ba
致谢gydF4y2Ba
我们感谢广州甘蔗工业研究所的海南甘蔗养殖站,为这项研究提供了植物材料。gydF4y2Ba
资金gydF4y2Ba
本研究由国家自然科学基金(31771863,gydF4y2Bahttp://www.nsfc.gov.cn/gydF4y2Ba国家现代农业技术专项基金(CARS-170106)资助。亚热带农业生物资源保护与利用国家重点实验室(SKLCUSA-a201912, SKLCUSA-b201806)资助。福建省农林大学科技创新专项资金(KFA17168A、KFA17525A、KFA17169A)和福建省科技计划项目(2018 N1002)资助。资助者在研究设计、数据收集、分析、决定出版或手稿准备方面没有任何作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
ZD、YH和MZ设计了本研究;四十、 FH和JC进行了实验;四十、 QW和FH分析数据,JW和QW提供资料。我写了手稿的草稿。MZ修改了手稿。所有作者都阅读并批准了最后的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者们宣称他们没有相互竞争的利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商说明gydF4y2Ba
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
FgydF4y2Ba1gydF4y2Ba. 答:崖城96-40茎显示大部分红色色素沉着。b:崖城95-41茎呈绿色。丙:崖城96-66茎呈淡黄色。gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
海南92-105显示正常减数分裂行为。终变期。b:中期i。c和d:后期i。e:末期i。f:中期II。g:后期II。h:四分体。比例尺= 10 μm。gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
FgydF4y2Ba1gydF4y2Ba(崖城96 - 40)。a: I中期染色体滞后b: I中期染色体滞后c、d、g: I末期、II中期、II末期细胞板未完全形成。d:细胞板没有完全形成。e:后期为异步分割。f:后期II迟滞染色体。h:三合会。比例尺= 10 μm。gydF4y2Ba
附加文件4:图S4。gydF4y2Ba
FgydF4y2Ba1gydF4y2Ba(崖城96–66)。a:中期Ⅰ染色体不同步。b:后期I染色体滞后。c:染色体末期I。d:中期Ⅱ未见新细胞板形成。e、f:后期Ⅱ异步除法。g:四核细胞。h:末期的异步分裂。比例尺 = 10 μm。gydF4y2Ba
附加文件5:图。S5。gydF4y2Ba
《F的gydF4y2Ba1gydF4y2Ba普通减数分裂期间的PMC。A:pachytene。B:Diakinesis,白色箭头是指配对二使。C:Metaphase I. D:Anaphase I. E:Telophase I. F:Metaphase II。g:后期II。h:四分体。比例尺= 5 μm。gydF4y2Ba
附加文件6:图S。gydF4y2Ba
海南92-77和巴迪拉体细胞染色体45S rDNA和5S rDNA的FISH定位结果。a、b:海南92-77体细胞。c、d:巴迪拉体细胞。箭头指向45S rDNA和5S rDNA焦点。比例尺= 5 μm。gydF4y2Ba
附加文件7:图S7。gydF4y2Ba
FgydF4y2Ba1gydF4y2Ba由45S rDNA FISH图谱结果得出。a:粗线45S部位。b:中期I的45S位点。c:中期I的45S位点,方形表示45S rDNA的滞后染色体。比例尺= 5 μm。gydF4y2Ba
附加文件8:图S8。gydF4y2Ba
FgydF4y2Ba1gydF4y2Ba通过5s rdna鱼类映射结果。- 答:5S位点在后期I. B:AIT中的5S位点。C:Tetrad中的5S rDNA位点。比例尺= 5 μm。gydF4y2Ba
附加文件9:图S9。gydF4y2Ba
FgydF4y2Ba1gydF4y2Ba达到45s rdna和5s rdna鱼绘图结果。A和B:45s RDNA和Tetrad中的5S rdNA位点。比例尺= 5 μm。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.“创作共用公共领域”豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用本文gydF4y2Ba
李,X.,黄,F.,柴,J。gydF4y2Baet al。gydF4y2Ba花粉母细胞减数分裂过程中的染色体行为gydF4y2BaSaccharum OfficinArum×Erianthus arundinaceusgydF4y2BaFgydF4y2Ba1gydF4y2Ba混合动力车。gydF4y2BaBMC植物杂志gydF4y2Ba21日,gydF4y2Ba139(2021)。https://doi.org/10.1186/s12870-021-02911-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
内政部gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-02911-zgydF4y2Ba
关键字gydF4y2Ba
- 染色体gydF4y2Ba
- 减数分裂gydF4y2Ba
- 花粉gydF4y2Ba
- 鱼gydF4y2Ba
- 细胞遗传学gydF4y2Ba