抽象的
背景
基因组印记导致后代在后代的原因特异性等位基因的表达。芸苔属植物显著是一种具有多倍体研究价值的油料作物。中印迹基因的鉴定显著将丰富双子叶植物基因组印记的知识。
结果
在这项研究中,我们在其中进行了互核性十字显著L用扬优6号(Y6)和中双11号(ZS11)在20和25日采集胚乳 RNA序列的授粉后天数(DAP)。根据Y6与ZS11的单核苷酸多态性,共鉴定出297个印记基因,其中母亲表达基因283个,父亲表达基因14个。只有36个基因(35个MEGs和1个PEG)在20和25个DAP胚乳中被连续印迹。我们发现15、2、5、3、10和25个印记基因也存在于细胞中拟南芥,大米,蓖麻豆,玉米,b·拉伯和其他显著分别为行。只有26个印记基因在胚乳中特异表达,其他基因也在小麦的根、茎、叶和花芽中表达显著. 油菜染色体上共有109个印迹基因。我们发现LTR/Copia转座因子(TEs)在印迹基因的上游和下游富集最多,在印迹基因周围富集的TEs多于非印迹基因。此外,5的表达航空地面照明系统杂交胚乳的6个果胶相关基因与亲本胚乳相比发生了显著变化。
结论
本研究提供了一种全面的印迹基因鉴定方法显著,丰富了双子叶植物的基因印迹,为进一步研究基因印迹如何调控种子发育提供了理论依据。
背景
基因组印记是与古典孟德尔遗传法相反的表观遗传调节,其主要在植物胚乳和哺乳动物中的不同组织/器官中报告[1.,2.,3.].具有亲本起源特异性表达或亲本偏倚表达的基因被定义为印记基因[4.,5.].因此,将印迹基因分为母系表达基因(MEGs)和父系表达基因(PEGs)。双受精是一种特殊的现象,来自雄配子体的两个精细胞分别与一个卵细胞和一个同二倍体中央细胞融合形成二倍体受精卵和三倍体胚乳[6.]. 三倍体胚乳是一种不为后代提供遗传物质的种子组织,在为胚胎发育和种子形成提供营养方面具有与哺乳动物胎盘相似的功能。由于父本和母本基因组的不平衡贡献,使得亲本特异性效应更加复杂[7.,8.,9].迄今为止,亲本冲突理论是解释印迹基因对植物胚胎发育的亲本特异性作用的主要理论,但基因印迹是一种复杂的现象,一些印迹位点需要非冲突理论[10.,11.].
第一个印迹基因R1是通过基因试验在玉米中发现的[12.].但植物印迹基因的研究远远落后于哺乳动物[6.,12.,13.,14.]. 直到1999年,通过对单亲遗传的等位基因的转录表达水平、报告基因活性或DNA甲基化水平的分析,植物中的印记基因才逐渐被鉴定出来。这些基因包括多边环境协定,FIS2,货币政策委员会,HDG3/8/9型,FH5.在里面拟南芥,FIE1,FIE2,PEG1号,MEG1在玉米9,15.,16.,17.,18.,19.,20.,21.].高通量测序技术极大地促进了亲本衍生等位基因的表达分析,因此越来越多的推定印迹基因在植物中被识别,包括拟南芥,小麦,水稻,高粱,风疹[22.,23.,24.,25.,26.,27.,28.,29.].虽然大多数印迹基因与种子发育有关,但它们在不同的植物中不保守。迄今为止,在不同的植物物种中重叠了一点百分比的印迹基因[27.,29.]. 此外,已证实印记基因主要通过剂量效应影响胚乳发育过程中的营养需求和分配,这对种子发育和活力至关重要[30.,31].
在哺乳动物中,大约80%的印记基因聚集在染色体上,通常可以跨越数百万碱基或更多碱基,并且附近基因的表达可以被这些印记调控区调控[32,33]. 染色体上成簇的印迹基因通常受印迹中心的调控[4.]. 在植物中,大多数印记基因分散在染色体上,只有少数印记基因聚集在染色体上[24.,29.,34].植物中印迹基因的聚集数量远远少于哺乳动物。据报道,在植物和哺乳动物中,印迹基因的表达主要是通过DNA甲基化和染色质修饰来调控的,然后印迹基因通过DNA甲基化和染色质修饰来调控其他基因的表达独联体——或者反式规定(7.,35]. 然而,也有报道称基因组DNA甲基化与印记基因的表达无关[29.,36].此外,转座因子(transposable elements, TEs)被认为是基因组印迹的主要驱动力,被广泛鉴定为胚乳基因组的低甲基化,这对种子发育至关重要[27.,36,37]. TEs是真核生物基因组中大量的重复元素,在植物基因组进化和结构变化中起着重要作用[38].在物种之间的杂交和外来片段的迟钝期间可以激活TES,然后调节下游基因表达[39]. 在CA.stor bean, two types of TEs (LTR/Gypsy and LTR/Copia) were significantly enriched in the vicinity of imprinted genes, and these TEs were extensively demethylated during seed development [27.]. 因此,推测LTR/Gypsy和LTR/Copia-TEs的甲基化状态可能是导致基因印迹的主要原因。但这一现象在临床上没有观察到拟南芥和玉米,这可能是由于TE在不同植物物种中的特定分布[26.,34]. 在答:芥,镇压类阿伽摩斯MADS-BOX基因(航空地面照明系统)印记基因的突变与胚乳细胞化异常有关。糖代谢相关基因(尤其是编码多聚半乳糖醛酸酶的基因)的下调会影响果胶的水解答:芥印迹基因,最终影响胚乳细胞化和种子活力[40].
世界第三大油料作物,芸苔属植物显著L(AACC,2n = 38),是一种异源多倍体,来源于两个二倍体之间的自然杂交b·拉伯(AA, 2n = 20)和b . oleracea(cc,2n = 18)[41].由于它是食用油、生物燃料和动物饲料的主要资源,对其进行遗传和表观遗传研究显著对其繁殖课程很重要[42]. 水稻印记基因的综合鉴定显著将有助于阐明种子发育的遗传调节。由于细胞化胚乳显著不像单子叶作物(如玉米、小麦、水稻)和蓖麻那样增殖,但随着种子的发育逐渐消失。采集油菜籽胚乳进行基因组印迹分析是一项具有挑战性的工作[43,44].到目前为止,基因组印记很少被报道芸苔属植物,除了两项关于b·拉伯和显著,该研究在胚乳的一个发育阶段确定了假定的印迹基因[45,46].因此,鉴定来自于互生胚乳的印迹基因显著对双子叶植物基因组印记的遗传机制研究具有重要意义。
在本研究中,我们对两种杂交的胚乳进行了高通量RNA-seq分析显著品种,中顺11(ZS11)和阳友6(Y6)。鉴定母体和父母特异性单核苷酸多态性(SNPs)用于印记基因的基因组筛选。基于亲本特异性表达,我们确定了297个印迹基因,其中包括283mmgs和14杆。有趣的是,在胚乳发育期间,297个印迹基因中的36个含量不断印迹。在胚乳中仅特异性表达了26个印迹基因,而其他基因也在其他组织中表达显著,而不是胚乳特有的。109个印迹基因聚集在油菜籽染色体上,发现LTR/Copia TEs在印迹基因的上游和下游富集最多。本研究提供了更全面的印迹基因鉴定显著,丰富了双子叶植物的基因印迹,为进一步研究基因印迹如何调控种子发育提供了理论依据。
结果
转录组测序与亲本特异性SNP调用
为了区分亲本衍生的等位基因在杂交种中的表达,我们对20个杂交种进行了高通量RNA测序 以ZS11和Y6为材料,在授粉后3d(DAP)和25dap胚乳中发现双亲间的单核苷酸多态性。共获得39.978万对末端读写,其中ZS11(zs1120dap)的20dap胚乳、ZS11(zs1120dap)的25dap胚乳、Y6(y620dap)的20dap胚乳和Y6(y620dap)的25dap胚乳的平均读写量分别为35.33、30.2、35.46和3197万。这些阅读被定位到61278、60174、60604和59801个基因显著每千碱基每百万碎片数(FPKM) > ZS11\u20dap、ZS11\u25dap、Y6\u20dap、Y6\u25dap胚乳中各有1个。RNA-seq数据的三个生物复制用相关系数进行了验证R = 0.96 ~ 0.99(附加文件)1.:图S1)。将ZS11和Y6的单核苷酸多态性与对照组进行比较显著欧洲冬季油籽品种Darmor-BZH.')使用Hisat2和Samtools参考基因组。基于91.22,93.03,92.95和92.96%读入zs11_20 dap,zs11_25 dap,y6_20 dap和y6_25 dap映射到参考基因组,唯一映射的读数被保留用于严格的SNP筛选,只有至少识别的纯合子SNP每次测序库中的两个生物复制和≥10读数覆盖被保留进一步分析。在20个DAP和25个DAP胚乳中鉴定了ZS11和Y6之间的总共35,928和28,775个SNP。这些SNP覆盖了15,738和13,721个基因,其中10,672个基因在20 dap和25 dap endosperm中重叠(附加文件2.:表S1;附加文件3.:表S2)。同样,利用杂交后代(20和25 DAP杂交后代)胚乳的特异标记reads(7.55万和557万reads)进行SNP鉴定,提取具有父系或母系特异SNP的reads进行等位基因表达分析(附文件)4.:表S3;额外的文件5.:表S4)。
杂交胚乳印记基因的全基因组鉴定
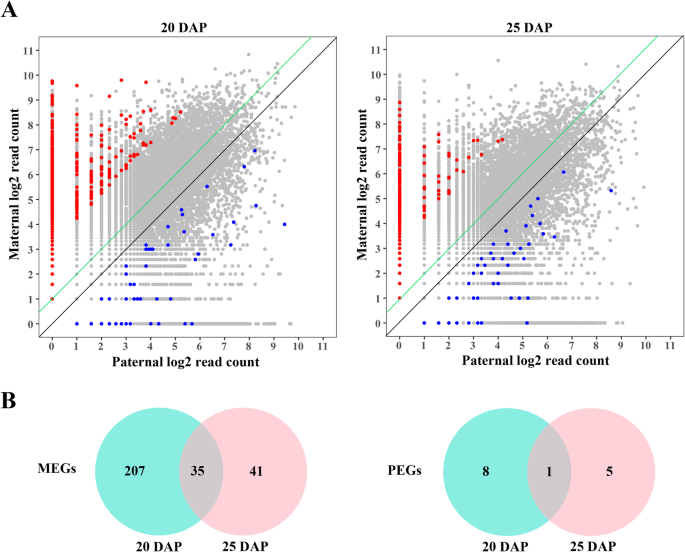
基于maternal-derived的比率和paternal-derived读取在每个SNP位点,我们用严格的标准屏幕兆应遵守的印迹基因等位基因的表达率的孕产妇:父亲≥10:1(5 *的孕产妇:父亲= 2:1,≥90%母亲般地偏见表达),和挂钩的比例的筛选:在两个互交杂种胚乳中,母性≥3:2(3倍父性:母性= 1:2,父性偏倚表达≥60%)4.:表S3;额外的文件5.:表S4)。在互交杂种胚乳的三个生物学重复中亲本偏表达的基因被鉴定为印迹基因(Q< 0.05)。结果表明,在DAP的20个和25个胚乳中,这些基因大多数服从父本= 2∶1的比例,只有1.132%的基因在等位基因表达上存在亲本差异(χ2.测试,Q < 0.05) (Fig.1.a) 是的。总共,我们在20个DAP胚乳中鉴定了251个印记基因(242个meg和9个peg),在25个DAP胚乳中鉴定了82个印记基因(76个meg和6个peg)6.:表S5;额外的文件7.:表S6)。在20和25个dap胚乳中,仅36个基因(35mmgs和1 peg)连续印刷。剩余的261个基因在胚乳的不同阶段印记,其中215个基因印在20个dap胚乳(207megs和8 pegs)和46个基因中印在25个dap胚乳(41megs和5 pegs)中(图。1.B附加文件8.:表S7)。这说明大多数印迹基因在不同胚乳发育阶段表现出不一致的表达模式显著. 在阶段特异性印记基因中,73个基因在杂种胚乳的一个发育阶段被印记,而在另一个发育阶段则表现出双等位基因的表达模式。其余118个基因只在一个发育阶段有印记,或在两个发育阶段有印记,但在一个发育阶段只有不到10个片段。此外,我们在A和C亚基因组中发现了8对同源基因(BnaA05g00640D和BnaC04g51420D,BnaA06g07630D和bnac05g09100d,BnaA10g22530D和BnaC03g49920D型,BnaA08g18690D型和BnaC03g58190D,bnaa03g21790d.和BnaC03g26060D型,BnaA10g19500D和BnaC09g54550D型,BnaA09g42740D和BnaC08g35220D,BnaA01g23480D和BnaCnng44170D).对于剩余的281个未配对基因,200个基因(71%)印在亚基因组上,81个基因(29%)印在C亚基上。这表明大多数印迹基因被偏向于亚基组。
基因印迹候选基因的实验验证显著
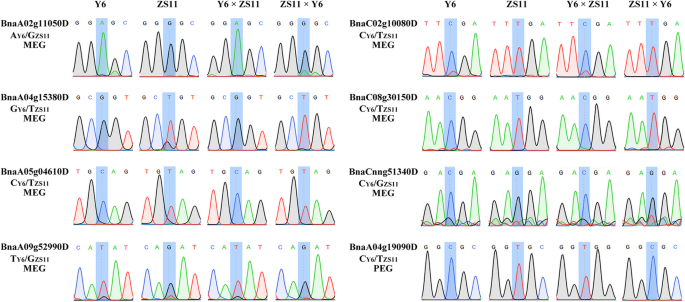
为了确认印迹基因显著,在随机选择的基因(7megs和1 peg)上进行等位基因特异性表达分析。测序来自往复交叉和自授粉父母的胚乳的扩增的RT-PCR片段,以鉴定治愈性SNP。与RNA-SEQ数据鉴定的SNP一致,在杂交胚乳中用ZS11或Y6特异性SNP确认所有8个基因,表明这些基因具有原始母细胞表达模式(图。2.).例如,megs(BnaA02g11050D,BnaA04g15380D型,bnaa05g04610d.,BnaA09g52990D型,bnac02g10080d.,BnaC08g30150D,BnaCnng51340D型)均为母系特异性snp。而PEG (bnaa04g19090d.)均以父本特异性SNP进行验证。
要知道是否确定了这些印迹基因显著在其他植物物种中被保守,我们在其他物种中爆破了它们的同源基因对,并且在本研究中发现了15,2,5,3,10和25个印迹基因也被印记拟南芥[22.,23.],大米[24.,蓖麻豆[27.],玉米[25.],b·拉伯[45),和其他显著行[46),分别为(表1.).有趣的是,大多数重叠的基因是meg(除了三个peg与meg重叠b·拉伯),以及烙印基因显著对其他双子叶比单子叶更保守。我们发现了BnaA06g38220D型也被印在水稻和玉米上。这与之前的报告一致,即基因印迹在不同物种中保存不佳[27.].
印迹基因的功能表征显著
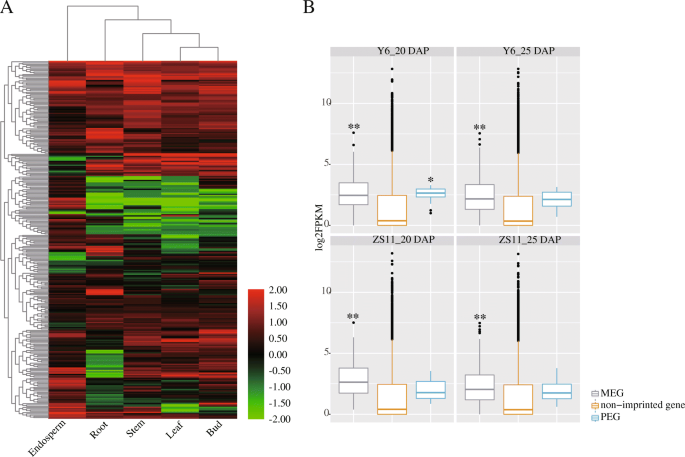
在其它植物中,印记基因主要存在于胚乳中,并具有胚乳特异性或胚乳偏好的表达模式[22.,24.,47].在此,我们分析了油菜印迹基因在不同组织中的表达模式显著简历。ZS11,包括根,茎,叶,芽和胚乳(图。3.一种;额外的文件9:表S8)。与之前的报道不一致的是,我们只发现了26个油菜印迹基因在胚乳中特异性表达。而其他印迹基因在根、茎、叶和花芽中均有表达显著,而不是胚乳特有的。因此,我们可能怀疑大多数印记基因在油菜籽的发展中具有功能,不仅对胚乳的特定影响。此外,我们还将印度基因和非印记基因的表达进行了比较了母体胚乳中的表达。结果表明,在20 dap和25 dap胚乳中,对印迹基因高于非印记基因。此外,肠胚胎中Megs的表达高于PEG的肠子(图。3.b) 是的。
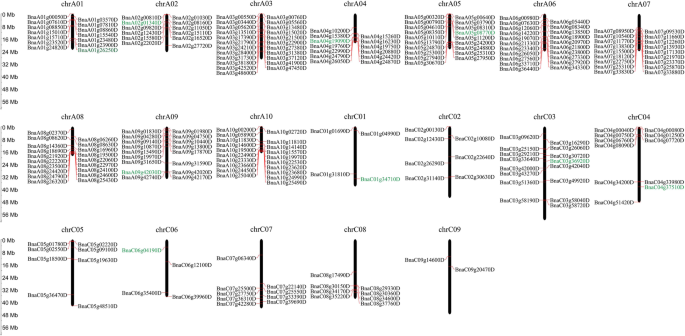
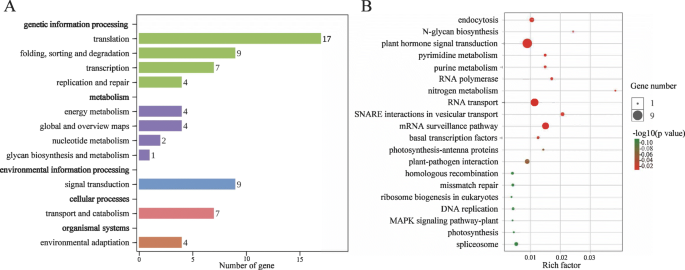
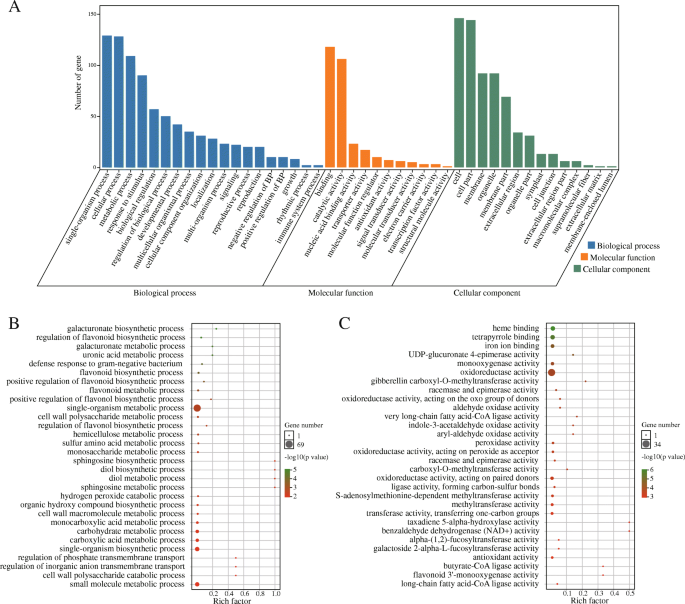
在哺乳动物中,大多数印迹基因在染色体上聚集,它们的表达由印迹调节区域调节[48]. 但在植物中(例如。拟南芥(如水稻、高粱和蓖麻),只有少数印迹基因聚集在染色体上。本研究将245个印迹基因(除47个meg和5个peg分散在Ann_random或Cnn_random染色体外)定位到19条染色体上显著.我们一共鉴定出35个不均匀分布在A和C亚基因组上的簇(图。4.; 附加文件10.:表S9),其中A基因组有29个簇(92个印迹基因),C基因组有6个簇(17个印迹基因)。这些聚集基因可能受区域调控的控制。此外,我们还发现了5个最大的聚类,包括A05末端的聚类16(5个印迹基因),A08上的聚类24(5个基因)和聚类25(6个基因),A10上的聚类28(5个基因)和聚类29(5个基因)。通过对24/25/28/29聚类附近的基因进行KEGG分析,发现大部分基因参与转录、翻译、能量代谢、聚糖生物合成和代谢、运输和分解代谢、植物激素信号转导和环境适应(图)。5.).基因本体论(GO)富集分析显示,大多数印迹基因被划分为生物功能(细胞过程、单生物过程、代谢过程、对刺激的响应和生物调控)、分子功能(结合活性和催化活性)、细胞成分(细胞和细胞部分)(图1)。6.一种;额外的文件11.:表S10)。在三倍体行政部和suvh7型突变体的答:芥种子拯救与基因表达降低密切相关航空地面照明系统进一步影响胚乳细胞化,引起胚停滞。这些突变体中果胶水解相关基因的抑制也与胚乳细胞化和种子活力异常有关[40].在富集最高的氧化石墨烯项中,我们发现半乳糖酸生物合成和代谢过程、细胞壁多糖和大分子代谢过程、UDP-glucuronate 4- epimase活性和alpha-(1,2)-focusyltransferase活性均富集(图1)。6.b,c)。这表明许多印迹基因涉及细胞壁生物合成和与胚乳细胞化相关。在油菜籽中,胚乳累积和细胞化直至18至32个dap,然后在将营养物转移到胚胎后消失[43].因此,这些与细胞壁生物合成有关的基因的印迹将影响果胶水解、胚乳细胞化和种子活力。进一步研究这些印迹基因的分子功能将丰富我们对种子发育的认识显著.
印迹基因周围转座因子富集
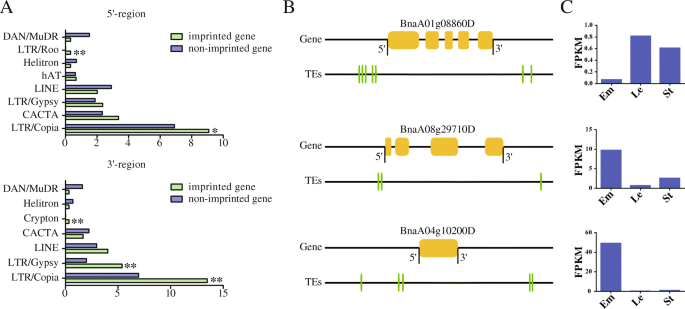
在拟南芥广泛去甲基化的TEs被认为是基因印迹的主要驱动力[36,49].因此,我们调查了在5 kb内的印迹和非印迹基因的上游和下游TEs的数量和类型显著. 我们发现在印迹基因周围富集的TEs数量明显高于非印迹基因。在印迹基因5′区富集的TE类型多于3′区(图1)。7.a).有趣的是,我们发现LTR/Copia TEs在印迹基因的上游和下游均富集。这与蓖麻子中LTR/Copia和LTR/Gypsy型TE基因在印迹基因周围富集的情况相似。而DNA/MuDR型TEs则富集于印迹基因周围拟南芥和c .风疹玉米中CACTA型TEs在印记基因周围富集[26.,27.,28.,34]. 此外,我们还分析了在5′和3′两个区域都富集了TEs的印迹基因。我们发现了5′和3′区域bnaa01g08860d.分别用5和2个TEs富集。表达水平bnaa01g08860d.在胚乳中比其他组织低得多。5'-区域BnaA08g29710D和BnaA04g10200D型含有2和3 TES,以及3'区域分别包含1和2 TES。BnaA08g29710D和BnaA04g10200D型胚乳中表达量高于其他组织(图。7.b、 (三)。我们怀疑这些印记基因周围富集的TE可能影响它们的表达模式。
表达式的分析航空地面照明系统以及与果胶降解相关的基因
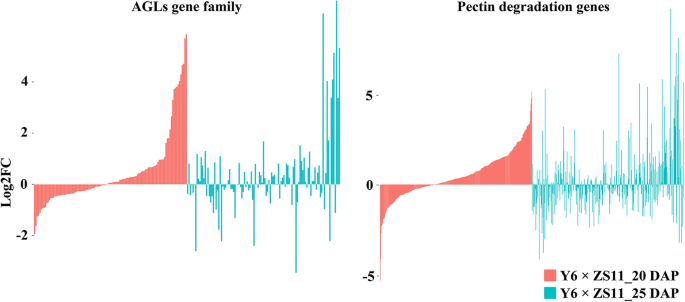
如中所述答:芥的表达水平航空地面照明系统与碳水化合物代谢相关的基因(如编码聚半乳糖醛酸酶的基因)影响了三倍体突变体的胚乳细胞化和果胶水解答:芥印记基因[40,50]. 由于油菜中的一些印迹基因也富含与细胞壁合成相关的GO基因,因此我们分析了113航空地面照明系统以及在互交杂种胚乳中参与果胶降解途径的189个基因。8.).与双亲比较,我们发现5航空地面照明系统(BnaC02g01970D,BnaA03g29530D,BnaA06g12900D,BNAC02G40410D和BnaC01g28010D)用|log修改2.杂种胚乳中| > 5的Fold变化最多,且表达量最多航空地面照明系统没有明显的变化。对于果胶降解途径相关基因,我们发现了表达BnaC08g30060D,BnaA09g16050D型,BnaC04g24110D型,BnaA01g04630D,BnaC01g06140D型和BnaA06g16310D杂种胚乳中的蛋白质含量与亲本胚乳相比有显著变化。
讨论
基因组印记是一种与经典孟德尔定律相悖的表观遗传现象。迄今为止,已在几种植物中鉴定出印迹基因,包括拟南芥(341个基因)、水稻(262个基因)、玉米(356个基因)、蓖麻(209个基因)、小麦(372个基因)[23.,24.,25.,27.,47].这些印迹基因的功能注释显示,它们主要富集于调控色素沉着、蛋白存储、转录调控、催化和染色质修饰等方面[26.].然而,对印迹基因的功能研究几乎没有报道,这对于植物发育的遗传调节应该是至关重要的,特别是种子发展[15.,51,52,53].显著是世界上第三大经济作物,但目前只有一篇关于30个DAP胚乳基因组印记的报道[46].不同基因印记的研究显著品种的选育将拓宽我们对种子发育的认识,为油菜高产优质的遗传育种奠定基础。
小麦胚乳中的基因组印记模式显著
在这项研究中,我们获得了两个不同品种胚乳发育过程中的转录组测序数据显著栽培品种(Y6和ZS11)及其互核杂种。基于严格标准,用于筛选具有父母或母体的SNP的基因,我们在杂交胚乳中鉴定了297个印迹基因,其中包括283megs和14杆。钉的数量显著比meg少得多,这与答:芥玉米、高粱和A.天琴座[29.,34,54,55].植物中MEGs和peg的不平衡符合母系-子代共适应理论,表明在自然选择中母系基因更受青睐[56].20和25 DAP油菜胚乳中印迹基因的数量不同,与文献报道的印迹基因随植株发育而变化的结论一致。Xin等发现玉米DAP胚乳中MEGs的数量在10个胚乳中最大,而peg的数量在7个胚乳中最大[57]. 在wheat, 47.3% genes exhibited consistent imprinted expression pattern in 15, 20, and 25 DAP endosperm [47].此外,40%基因在10和12 Dap的玉米胚乳中始终印记[26.,54].该稿件中一致印迹基因的百分比远低于小麦和玉米的百分比。由于印记基因芸苔属植物由于对不同品种胚乳不同发育阶段基因组印记的研究还不够深入,对不同品种胚乳不同发育阶段基因组印记的鉴定有助于阐明不同品种胚乳的印记特征芸苔属植物. 在20和25个DAP胚乳的印记基因中,我们发现BnaA03g05560D是一个同源物OsCWA1 /群体BC1编码眼镜蛇蛋白。OsCWA1/BC1在次生细胞壁生物合成中起重要作用[58].bnaa05g04610d.是一个同源物AtPME17,可以改变果胶的物理化学性质,诱导半乳糖醛酸的减少,从而改变细胞壁结构[59].BnaC05g18500D是一个同源物AtPME6型,它编码一种果胶甲基酯酶,该酶参与细胞壁的果胶代谢和胚胎细胞的扩张和发育[60,61].
水稻A、C亚基因组的基因组印迹偏倚显著
显著作为一个异源四倍体,可以提供一个模型来确定基因组印记是否在a和C亚基因组的同源性之间表现出表达偏差。在人类的297个印记基因中显著,我们发现14对同源物,但分别位于A和C胎聚物上只有8对。对于剩余的281个未配对基因,200个基因(71%)印在亚基因组上,81个基因(29%)印在C亚基上。这表明大多数印迹基因被偏向于亚基组。在多倍化期间显著, Li等人发现大多数基因对(~ 86.7%)在显著在两个二倍体祖细胞中保持了它们的表达模式,约78.1%的基因对表现出偏向于a亚基因组的表达[62]. 吴等人也表明~ 36.5%的表达基因对被重新合成显著表现出表达偏倚,对a基因组有轻微偏好[63].因此,我们可以推测,印迹基因数量的偏好性可能与油菜多倍体化过程中的表达偏好性有关。
基因组印记在不同物种间并不保守
研究拟南芥、水稻、玉米等植物证实了印迹基因在植物物种间不具有保守性,只有21个印迹基因在植物物种间具有保守性拟南芥和c .风疹,两个基因在水稻和水稻中都有印记拟南芥[28.,29.]. 在the present study, we found 15, 2, 5, 3, 10, and 25 rapeseed imprinted genes with homologs imprinted in拟南芥,大米,蓖麻豆,玉米,b·拉伯和其他显著行,分别22.,23.,24.,25.,26.,27.]. 在植物中,种与种之间,甚至同一种不同品系之间的印记基因很少重叠,这可能是由于数据分析的过滤造成的。在拟南芥,只有19个基因印记l和列-0大多数基因(81%)是单一研究所独有的[64]. 在the four available studies of maize, the majority of the imprinted genes (65% MEGs and 41% PEGs) were proposed by a single study, only 14 MEGs (8%) and 23 PEGs (13%) were commonly identified by all four studies [64]. 在这里,我们只发现了10个和25个基因的同源印记b·拉伯以及其他显著分别为(YN171和93275)行[45,46]. 在物种间保守的印记基因中,BnaA06g38220D型在玉米和水稻中发现了同源基因,编码一种类似伸展蛋白的蛋白质,可能参与木质素生物合成和种间生殖障碍[65,66]. 同系物BNAC07G22140D在里面答:芥(AT2G03210)编码木聚糖岩藻糖基转移酶2(FUT2),可能参与细胞壁组织[67].bnaa05g08350d.是一个同源物阿特菲斯2,它在受精前抑制种子发育,在双受精后调节胚胎和胚乳的发育[16.,68]. 在this study, we found 10 genes with homologs imprinted inb·拉伯哪个是二倍体双亲显著. 这些基因具有调控DNA甲基化的功能(BnaA05g08770D型和bnaa05g08350d.)及纤维素合成(BnaA0826321D和BnaA08g26320D)(额外的文件6.:表S5;额外的文件7.:表S6)。迄今为止,在30个DAP胚乳中只有一个基因组的报告显著[46]25个印记基因(8.42%)与本研究重叠。这些基因具有调控胚珠发育的功能(BnaA03g24210D型)细胞壁修饰(BnaA04g24790D),细胞凋亡(BnaA10g23660D型)和对氧化应激的反应(BnaC09g54550D型和BnaA09g31650D型)(额外的文件6.:表S5;额外的文件7.:表S6)。BnaA0826321D是一个同源物OsMYB61并印在b·拉伯以及其他显著线。在水稻中,OsNAC29/31直接激活OsMYB61,进而激活纤维素合成酶基因的表达,最终调控次生壁纤维素的合成[69].BnaA05g08770D型,一个重叠的印迹基因b·拉伯,是的同源词AtSUVH5型.AtSUVH5与AtHDA19相互作用负调控种子休眠[70].
印迹基因在大肠杆菌中的表达模式及聚类分析显著
以前的研究报道80%的印迹基因拟南芥胚乳特异性或胚乳优先表达基因在高粱中占70%,在水稻中占78%。然而,蓖麻的印迹基因中只有40%是胚乳特异性基因[24.,27.,29.,34]. 在the present study, we found 26 imprinted genes were endosperm-specific expressed genes, while other genes were also expressed in different tissues of显著,表明他们可能在整个油菜发上发挥作用,不仅在种子发展中。
在哺乳动物中,大多数印记基因聚集在染色体上[32,33,48]. 在Plants, only 28 imprinted genes were assigned to 12 clusters in sorghum, 77 genes in 33 clusters were identified in maize, and 7 imprinted genes in 3 clusters were reported in castor bean [26.,27.,29.]. 在油菜中,我们发现109个印记基因被分配到染色体上的35个簇中。这些簇周围的染色体区域可能是印记控制区,可能影响印记基因的表达。我们在这些簇中还发现了同源基因对,这表明基因组复制也使油菜的基因印迹更加复杂[34].
印记基因在调控胚乳发育中的作用
印记基因在胚乳发育中具有重要作用[40,50]. 我们发现油菜印记基因在细胞壁生物合成过程中也有富集,推测可能与胚乳发育有关。例如,BnaA03g05560D编码不规则木质部6,富含植物型次生细胞壁生物发生(GO:0009834)。它在水稻中的同源基因对次生细胞壁的组装至关重要[58].bnaa01g03570d.在细胞壁组织中富集(GO:0071555),其同源物拟南芥在细胞壁中的Xylan分支延伸需要[71.]. 此外,大多数印迹基因具有丰富的结合和催化功能(如水解酶和转移酶活性)。我们还发现了在生物过程中富集的印记基因,如碳代谢、细胞代谢和生物大分子的生物合成。在拟南芥,印迹基因突变体的三倍体种子败育与胚乳细胞壁合成和降解相关基因的表达有关[40,50].在显著在这项研究中发现的印记基因,bnaa05g04610d.,BnaC05g18500D和BnaA04g24790D参与果胶代谢,可能参与胚乳细胞化。此外,基因的表达也发生了变化航空地面照明系统可以阻碍胚乳细胞壁的形成和降解,最终影响胚乳细胞化并导致种子流产。在这里,我们只发现了5的表达航空地面照明系统杂种胚乳中的蛋白质含量与亲本胚乳相比发生了显著的变化。其中,BnaA03g29530D(一个同源物ATAGL91.)以及BnaA09g16050D型在互惠杂种的20和25个DAP胚乳中均发生了显著变化。在拟南芥的时空表达AGL91受母体siRNA的监管,破坏或过度表达AGL91在胚乳中改变了种子的大小[72.].BnaA09g16050D型编码一种果胶裂解酶类超家族蛋白,可能是一种以结构多糖的形式出现在高等植物的中层和初生细胞壁上的果胶物质[73.].BnaC04g24110D型编码果胶裂解酶类超家族蛋白及其同源蛋白拟南芥(ADPG1)调节木质素含量和组合[74.].bnaa05g04610d.是一个同源物AtPME17,可以改变果胶的物理化学性质,诱导半乳糖醛酸的减少,从而改变细胞壁结构[75.].Bnaanng26700D是一个同源物OsFIE1它是多丛抑制复合体2 (polycomb repression complex 2, PRC2)的一个重要成员,PRC2通过调节胚乳细胞化和种子大小在早期种子发育中发挥重要作用[76.,77.].
基因印迹的推测调控显著
TEs通过影响基因组结构(基因结构、倒置、易位和重组)和基因表达,在推动植物基因组扩展和物种进化方面发挥着重要作用[78.,79.,80,81.,82.]. 有报道称,在印记基因附近富集的TEs在胚乳中被广泛去甲基化,表明TEs可能是基因组印记的驱动力[27.]. 在the present study, we also found significant enrichment of LTR/Copia and LTR/Gypsy TEs in the upstream and downstream of the imprinted genes. This was similar to castor bean, but the type of TEs enriched around imprinted genes of拟南芥、玉米和c .风疹是不同的26.,27.,28.,34].
基因组DNA甲基化也被认为是植物基因组印迹的驱动力,大多数已鉴定的差异甲基化区域(DMRs)在母系等位基因中被低甲基化,而在父系等位基因中被高甲基化[26.,27.].然而,只有11个印迹基因(0.06%)显著被DMRs识别,包括一个MEG被证实有高气相甲基化[46]. 在the present study, DNA methylation analysis was not performed. But we correlate the imprinted genes with the miRNA regulation of显著[83.[发现12个印迹基因可能由miR158,miR171,miR160,miR399,miR394和其他六个新的miRNA靶向。在拟南芥,miR171的功能性损失引起胚胎发生异常,并且证明了miR171和ham1之间的正确关系对于正常胚胎发生是必要的[84.].miR160、miR171、miR394和miR399可能参与玉米早期胚胎发育和形态发生拟南芥,通过转录调控其靶基因[85.,86.]. 在A.ddition, miR160 controls somatic embryogenesis induction by negatively regulating auxin-related genes (ARF10型,ARF16型,ARF17型)[87.].
结论
本研究共鉴定了297个印记基因,包括283个MEGs和14个PEGs,分别位于正反杂交胚乳中显著品种(Y6和ZS11)。在20和25个DAP胚乳中,只有36个基因被连续印迹。此外,油菜中的许多印记基因被注释为与细胞壁生物合成和胚乳细胞化有关的GO术语。在印迹基因和非印迹基因附近进行的TEs分析表明,LTR/Copia-TEs最为丰富,表明它们可能影响印迹基因的表达模式。此外,5的表达航空地面照明系统与亲本胚乳相比,杂种胚乳中6个果胶相关基因发生了显著变化,这有助于解释杂种种子正常发育的原因。一般来说,印迹基因的鉴定和表征显著富集了在二榫植物中印记的基因,并为进一步研究基因印记如何调节种子发育而提供基础。
材料和方法
组织采集和RNA制备
两个显著L.品种(ZS11和Y6)由林岛区江苏农业科学研究所提供,并在中国江苏扬州举行的临时。对F1杂种进行两种品种之间的相互循环。从20和25个DAP的未成熟种子收集RNA-SEQ的胚乳,包括来自互易血流的胚乳和自授粉ZS11和Y6。为了避免组织污染,胚乳用喷射器吸入,喷射器插入由种子顶部的针(与胚胎相对)冲压的孔中。然后,汇集胚乳并立即存储在RNA提取缓冲液中[46]. 每个样本包括三个生物复制品。
rna序列分析和数据处理
用RNAprep植物纯化试剂盒(TIANGEN, China)提取总RNA。采用琼脂糖凝胶电泳、Nanodrop、Qubit和Agilent 2100检测胚乳RNA的纯度、浓度和完整性。将符合条件的RNA样本在Illumina Novaseq 6000平台上进行mRNA文库构建和高通量测序[88.]. 亲本和正反杂种胚乳的原始数据分别为269.84gb和268.73gb。用FastQC-0.11.8软件对测序的碱基质量和读取质量进行评价(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/).使用trimmomatic0.36软件剔除原始数据中的低质量和适配器序列(http://www.usadellab.org/cms/uploads/supplementary/Trimmomatic/)[89.]. 然后,保留干净的数据用于进一步分析SNP和基因表达。对每个样本的三个生物复制品之间的相关系数进行数据可靠性评估(R> 0.95)。读取被映射到显著参考基因组v4.1(http://www.genoscope.cns.fr/brassicanapus/data/)使用Hisat2-2.1.0软件(https://ccb.jhu.edu/software/hisat2/index.shtml.)[90.,91.]在配对末端比对中只允许两个核苷酸错配。所有样本的映射率均> 90%.
SNP调用与印记基因的鉴定
利用ZS11和Y6的RNA序列数据进行SNP筛选。为了增加可信度,只保留唯一映射的读取以供分析。SNP调用是使用Samtools-1.4执行的(http://samtools.sourceforge.net/)命令Mpileup和Bcftools程序来识别ZS11和Y6之间的snp [92.,93.],只有在至少两个生物重复中存在且每个文库中reads数≥10的纯合子SNPs被保留为亲本特异性SNPs。
为了鉴定印记基因,保留了来自正反杂交胚乳的独特图谱,用于单核苷酸多态性和表达分析。利用Perl脚本对含有母系或父系单核苷酸多态性的杂交胚乳进行测序分析。从理论上讲,杂种胚乳中母本等位基因与父本等位基因的比例应为2:12.对ZS11(♀)× Y6(♂)和Y6(♀)× ZS11(♂)中各基因的父本等位基因数比值进行检测。对亲本等位基因偏差为2:1的两个互交杂种的生物学重复进行筛选,确定其为潜在的印迹基因。我们采用严格的标准筛选印迹基因。基因的比例maternal-derived读取paternal-derived读取≥10:1(5 *的孕产妇:父亲= 2:1,≥90%母亲般地偏见表达)在两个相互混合动力车是作为兆,而基因的比例paternal-derived读取maternal-derived读取≥3:2(3倍的父亲:孕产妇= 1:2,≥60%的父系偏倚表达)定义为peg。所有印迹基因的筛选阈值为Q < 0.05.
逆转录和位点特异性测序
用亲本和互交杂种胚乳的RNA进行印迹基因的确认。利用HiScript III RT SuperMix for qPCR (Vazyme, China)合成cDNA。使用Primer Premier 5.0设计用于序列扩增的引物,并在附加文件中列出12.:表S11。利用Sanger测序技术(中国青岛生物技术公司)对亲本和互交杂种的扩增片段进行测序,确认meg或peg中存在母本或父本特异性snp。
基因表达分析
目的探讨烙印基因在不同组织中的表达模式显著,收集根、茎、叶、芽和胚乳3个生物学重复进行rna测序分析。测序数据如上所述进行映射,并使用FPKM值对映射的reads进行归一化。根据日志生成不同组织印迹基因的热图10.FPKM的转换值。对亲本胚乳中印迹基因和非印迹基因的表达量进行对数拟合2.FPKM。
基因本体论分析
使用OmicShare网站分析GO丰富性(http://www.omicshare.com/tools/)和Blast2GO软件(https://www.blast2go.com/),并更正P < 0.05. 采用Samtools-1.4对基于印记基因id的核酸序列进行可视化,输出文件用于Blast2GO的GO注释。生物标记工具(http://plants.ensembl.org/biomart/martview/)编写Omicshare网站的输入文件。
聚类分析
为了进行聚类分析,我们将245个印迹基因定位到19个基因上显著使用MG2C(染色体)(位于Ann_Random和CNN_Randomes中的52个候选印迹基因除外)(http://mg2c.iask.in/mg2c_v2.0/). 为分析基因在染色体上的分布,采用滑动窗法对1 Mb,步长为0.1 用Mb比较标记的参考基因数目,并将这些印迹基因分为簇(P< 0.05)进行进一步分析。
印记基因附近的富集分析
为了验证印迹基因与TEs之间的关系,我们使用了转座子PSI软件(https://sourceforge.net/projects/transposonpsi/)和Bioperl::SearchIO模块(http://www.bioperl.org/wiki/Installing_BioPerl)分析印迹基因的上游和下游的5 kB内的类型和数量和非印记基因的类型和数量。
数据和材料的可用性
所有与本研究有关的数据已包含在手稿的表格和图表中,作者很高兴在合理的要求下分享所有的数据和植物材料。
缩写
- 梅格:
-
母亲的基因表达
- 挂钩:
-
父亲的基因表达
- TE:
-
转座因子
- 航空地面照明:
-
类阿伽摩斯MADS-box基因
- ZS11型:
-
中双11
- 第六年:
-
Yangyou 6
- 苏格兰国家党:
-
单核苷酸多态性
- DAP:
-
授粉后的几天
- FPKM:
-
每千碱基每百万分之一的碎片
- Kegg:
-
京都基因和基因组百科全书
- 走:
-
基因本体论
- FUT2:
-
Xyloglucan focusyltransferase 2
- DMR:
-
差异甲基化区
参考
- 1。
鲍尔·MJ,费舍尔RL。胚乳中基因组的去甲基化和印迹。植物生物学杂志。2011;14(2):162-7。
- 2。
弗罗斯特JM,Moore Ge。印记在人胎盘中的重要性。Plos Genet。2010; 6(7):E1001015。
- 3.
基因组印记和胎生在哺乳动物中的起源和进化。Soc B. 2013;368(1609):20120151。
- 4.
沃尔特·J·赖克·W。基因组印记:父母对基因组的影响。纳特·雷夫·吉内特。2001;2(1):21–32.
- 5.
费尔,伯杰。植物和哺乳动物基因组印记的趋同进化。趋势Genet。2007;23(4):192–9.
- 6.
双受精-被发现的行为。植物科学学报,2008;
- 7.
基因组印记:来自植物的洞见。Annu Rev Genet. 2013; 47:187-208。
- 8。
李杰,伯杰F。胚乳:人类的食物和科学发现的饲料。新植物醇。2012;195(2):290–305.
- 9。
Raissig Mt,Baroux C,Grossniklaus U.种子发展过程中基因组印记的调节和灵活性。植物细胞。2011; 23(1):16-26。
- 10.
Moore T,Mills W.推出的进化理论 - 足够!Adv Exp Med Biol。2008; 626:116-22。
- 11.
Spencer Hg,Clark Ag。基因组印记进化的非冲突理论。遗传。2014; 113(2):112-8。
- 12.
Kermicle路。玉米R-斑驳糊粉酮表型对性传播方式的依赖性。遗传学。1970;66(1):69–85.
- 13。
Bartolomei, Zemel, Tilghman。小鼠H19基因的亲代印记。大自然。1991;351(6322):153 - 5。
- 14.
Barton SC,Surani MA,Norris ML.父系和母系基因组在小鼠发育中的作用。自然。1984;311(5984):374–6.
- 15.
Grossniklaus U, Vielle-Calzada JP, Hoeppner MA, Gagliano WB。母体对胚胎发生的控制美狄亚,一种多元组基因拟南芥.科学。1998;280(5362):446 - 50。
- 16.
关键词:父母-起源效应,表达,父母-起源效应FIS2,多边环境协定,f在胚乳和胚中发育拟南芥种子。国家自然科学基金资助项目:国家自然科学基金资助项目;
- 17.
关键词:胚乳,印记,杂交,杂交中国科学技术出版社2003;
- 18。
Gutierrez Marcos JF、Costa LM、Biderre Petit C、Khbaya B、O'Sullivan DM、Wormald M、Perez P。狄金森汞:母系表达基因1是一个新的玉米胚乳转移细胞特异性基因,具有母本起源的表达模式。植物细胞。2004;16(5):1288–301.
- 19。
Hermon P,Srilunchang Ko,Zou J,Dresselhaus T,Danilevskaya。激活印迹Polycomb集团Fie1玉米胚乳基因需要母体等位基因去甲基化。中国生物医学工程学报,2007;
- 20.
哈JH,鲍尔MJ,谢TF,费希尔RL。植物基因印迹的细胞编程。细胞。2008;132(5):735 - 44。
- 21.
Jullien Pe,Berger F.特定于品种基因组印记。CurrOp植物BIOL。2009; 12(5):637-42。
- 22.
关键词:基因工程,同源性,基因表达,基因组分析拟南芥种子。《公共科学图书馆•综合》。2011;6 (8):e23687。
- 23.
Hsieh TF, Shin J, Uzawa R, Silva P, Cohen S, Bauer MJ, Hashimoto M, Kirkbride RC, Harada JJ, Zilberman D,等。基因印迹表达的调控拟南芥胚乳。中国科学院学报2011;
- 24.
罗M,泰勒JM,斯普里格斯A,张H,吴X,罗素S,辛格M,科尔图诺A。对水稻种子印记基因的全基因组研究表明,印记主要发生在胚乳中。公共科学图书馆Genet。2011;7(6):e1002125。
- 25.
Waters AJ,Makarevitch I,Eichten SR,Swanson-Wagner Ra,Yeh CT,Xu W,Schnable PS,Vaughn MW,Gehring M,Springer NM。对玉米胚乳中基因表达和DNA甲基化的父母的原因效应。植物细胞。2011; 23(12):4221-33。
- 26.
张敏,赵辉,谢松,陈杰,徐勇,王凯,赵辉,管辉,胡鑫,焦勇,等。玉米胚乳发育中蛋白质编码和非编码rna的广泛、聚集性亲本印迹。国家自然科学基金资助项目:国家自然科学基金资助项目。
- 27.
关键词:蓖麻,胚乳,基因印迹,甲基化,亲本效应核酸研究进展[j]。
- 28.
关键词:油菜科植物,基因组印迹,快速进化植物细胞。2016;28(8):1815 - 27所示。
- 29.
关键词:高粱,胚乳,胞嘧啶甲基化,基因标记,全基因组筛选植物j . 2016; 85(3): 424 - 36。
- 30.
【关键词】亲本基因组失衡Brassica oleracea.导致不对称三倍体阻滞。植物J。2012;71(3):503–16.
- 31.
张清,罗米,约翰逊SD,朱XW,刘升,黄F,刘yt,徐Pz,吴Xj。父母基因组失衡导致患儿后种子致死性和稻米印迹的放松酸盐。米。2016; 9(1):43。
- 32.
Yang T、Adamson TE、Resnick JL、Leff S、Wevrick R、Francke U、Jenkins NA、Copeland NG、Brannan CI。Prader-Willi综合征印记中心突变小鼠模型。纳特·吉内特。1998;19(1):25–31.
- 33.
哺乳动物基因组印记。中国生物医学工程学报。2011;3(7):839-48。
- 34.
Wolff P,Weinhofer I,Seguin J,Roszak P,Beisel C,Donoghue MT,Spillane C,Nordborg M,Rehmsmeier M,Kohler C.高分辨率分析父母的原产地表达式拟南芥胚乳。Plos Genet。2011; 7(6):E1002126。
- 35。
基因组印记的机械学观点。安奴Rev Genom Hum G. 2008; 9:197-216。
- 36。
在种子发育过程中,重复元素的广泛去甲基化是基因印迹的基础。科学。2009;324(5933):1447 - 51。
- 37。
泽马奇A、金米、席尔瓦P、罗德里格斯A、多特森B、布鲁克斯MD、齐伯曼D。水稻胚乳局部DNA低甲基化激活基因。美国国家科学院学报。2010;107(43):18729–34.
- 38.
Petit M,Guidat C,Daniel J,Denis E,Montoriol E,Bui Qt,Lim Ky,Kovarik A,Leitch Ar,Grandbastien Ma,等。在合成交条件中调动逆转滴体烟草。新植物。2010; 186(1):135-47。
- 39.
王楠,王慧,王慧,张丹,欧旭,刘胜,董卓,刘波。水稻渐渗杂交株系中省道转座子家族的转座激活Zizania latifolia. BMC植物生物学。2010;10:190.
- 40
关键词:亲本表达,印迹基因,杂交障碍,杂种优势拟南芥. 伊莱夫。2015;4.
- 41
Kim CK, Seol YJ, Perumal S, Lee J, waaminal NE, Jayakodi M, Lee SC, Jin S, Choi BS, Yu Y, et al.;重新探索U的三角形芸苔属植物基于叶绿体基因组和45S nrDNA序列的物种。Sci众议员2018;8(1):7353。
- 42
Wittkop B, Snowdon RJ, Friedt W.新的近红外校准纤维组分显示广泛的遗传变异芸苔属植物显著种子质量。农业食品化学杂志。2012;60(9):2248–56.
- 43
(1) Borisjuk L, Neuberger T, Schwender J, Heinzel N, Sunderhaus S, Fuchs J, Hay JO, Tschiersch H, Braun HP, Denolf P等。种子结构决定油菜胚的代谢。植物细胞。2013;25(5):1625 - 40。
- 44.
斯雷尼瓦苏卢,沃布斯。种子发育计划:双子叶植物和单子叶植物的系统生物学比较。植物生物学年鉴。2013;64:189–217.
- 45.
吉田T、川端康成T、博Y、藤本R、川部A。芸薹科植物胚乳亲本等位基因表达的全基因组分析,油菜.植物生理学杂志。2018;59(12):2590-601。
- 46.
刘杰,李杰,刘海峰,范世华,辛格S,周XR,胡志,王赫兹,华W。油菜印记基因的全基因组筛选与分析(芸苔属植物显著l .)胚乳。DNA研究》2018;25(6):629 - 40。
- 47.
杨刚,刘铮,高玲,于凯,冯敏,姚勇,彭慧,胡智,孙青,倪铮,等。在小麦多倍体化过程中,基因组印记具有进化上的保守性。植物细胞。2018;30(1):37-47。
- 48.
巴洛DP。基因组印记:哺乳动物表观遗传学发现模型。Annu Rev Genet, 2011; 45:379-403。
- 49.
Hsieh TF,Ibarra Ca,Silva P,Zemach A,Eshed-Williams L,Fischer RL,Zilberman D.基因组 - 范围内的去甲基化拟南芥胚乳。科学。2009;324(5933):1451–4.
- 50
关键词:受精后,生殖隔离,基因印迹,遗传拟南芥.DEV细胞。2013; 26(5):525-35。
- 51
Costa LM、Yuan J、Rouster J、Paul W、Dickinson H、Gutierrez Marcos JF。植物种子营养分配的母体控制。电流生物学。2012;22(2):160–5.
- 52
Kinoshita T、Yadegari R、Harada JJ、Goldberg RB、Fischer RL。印记美狄亚polycomb基因的拟南芥胚乳。植物细胞。1999;11(10):1945–52.
- 53.
Kinoshita T, Miura A, Choi Y, Kinoshita Y, Cao X, Jacobsen SE, Fischer RL, Kakutani T.单向控制FWA公司印在拟南芥DNA甲基化的胚乳。科学。2004; 303(5657):521-3。
- 54.
董X,张M,陈J,彭L,张N,王X,赖J。控制玉米胚乳印记基因表达的动态和拮抗等位基因特异性表观遗传修饰。摩尔植物。2017;10(3):442–55.
- 55.
Klosinska M、Picard CL、Gehring M。保守印记与细胞内独特的表观遗传特征有关拟南芥属。Nat植物。2016;2:16145。
- 56.
WOLF JB,HART R.一种母体后代的基因组印记进化的辅助理论。Plos Biol。2006; 4(12):E380。
- 57.
辛M,杨R,李G,陈H,劳里J,马C,王D,姚Y,Larkins BA,孙Q,等.玉米胚乳发育过程中印记基因的动态表达与母本控制营养分配的关系。植物细胞。2013;25(9):3212–27.
- 58.
Sato K、Ito S、Fujii T、Suzuki R、Takenouchi S、Nakaba S、Funada R、Sano Y、Kajita S、Kitano H等。类碳水化合物结合模块(CBM)序列对于水稻CWA1/BC1在次级细胞壁材料的正确组装中的功能至关重要。电厂信号行为。2010;5(11):1433–6.
- 59。
Roig Oliver M、人造丝C、Roulard R、Fournet F、Bota J、Flexas J。光合作用降低拟南芥atpme17.2和第11.1节突变体与细胞壁组成的改变有关。植物生理学。2020https://onlinelibrary.wiley.com/doi/epdf/10.1111/ppl.13186.
- 60
王敏,袁丹,高伟,李勇,谭军,张旭。一种比较基因组分析方法中外职业和PMEI.家族揭示了植物细胞壁中果胶代谢的演化。《公共科学图书馆•综合》。2013;8 (8):e72082。
- 61
Levesque Tremblay G、Muller K、Mansfield SD、Haughn GW。高甲基酯化种子是一种果胶甲基酯酶参与胚胎发育。植物生理学。2015;167(3):725–37.
- 62
李明,王R,吴X,王J。天然四倍体四种组织同源表达偏倚和表达水平优势(ELD)芸苔属植物显著.BMC基因组学。2020;21(1):330。
- 63
关键词:异源多倍体,同源基因,表达偏性,表达水平芸苔属植物显著.BMC基因组学。2018;19(1):586。
- 64
美国格罗斯尼克劳斯州赖西格山怀德S。利用广义线性模型对植物全基因组印记研究的一致性再分析增加了数据集的一致性。Sci代表,2019年;9(1):1320–32.
- 65
Alves CML, Noyszewski AK, Smith AG。种间生殖障碍中III类雌蕊特异性伸展素样蛋白的结构与功能。中国生物医学工程学报,2019;
- 66
柯森,栾翔,梁杰,洪永红,谢廷芳,张秀琴。水稻OsPEX1是一种类似伸展素的蛋白,影响木质素的生物合成和植物生长。中国生物医学工程学报,2019;
- 67
Sarria R, Wagner TA, O'Neill MA, Faik A, Wilkerson CG, Keegstra K, Raikhel NV.描述一个家族拟南芥木葡聚糖focusyltransferase1相关基因。植物杂志。2001;127(4):1595 - 606。
- 68.
Wang D,Tyson医学博士,Jackson SS,Yadegari R。两组结构域多梳组蛋白在控制水稻种子发育启动中的部分冗余功能Arabidopsi陈国强,刘建军,刘建军,等。2006 .中国科学:地球科学;
- 69.
黄德斌,王世光,张宝成,上官KK,史YY,张德明,刘XL,吴K,徐志平,傅XD,等。赤霉素介导的DELLA-NAC信号级联调控水稻纤维素合成。植物细胞。2015;27(6):1681–96.
- 70.
周勇,杨平,张福,罗×,谢杰。组蛋白脱乙酰酶HDA19与组蛋白甲基转移酶SUVH5相互作用调控小麦种子休眠拟南芥.植物医学杂志》2020。
- 71.
Mortimer JC、Miles GP、Brown DM、Zhang Z、Segura MP、Weimar T、Yu X、Seffen KA、Stephens E、Turner SR等。木聚糖缺乏分支拟南芥gux突变体揭示了木质纤维素生物质的简化潜力。Proc Natl Acad Sci U S A. 2010; 107(40):17409-14。
- 72.
Kirkbride RC、Lu J、Zhang CQ、Mosher RA、Baulcombe DC、Chen ZJ。母体小rna介导基因表达、印迹和种子发育的时空调控拟南芥. 美国国家科学院学报。2019;116(17):8633.
- 73
Yadav S,Yadav PK,Yadav D,Yadav KDS。果胶裂解酶:综述。加工生物化学。2009;44(1):1–10.
- 74
Gallego Giraldo L、Liu C、Pose Albacete S、Pattathil S、Peralta AG、Young J、Westpheling J、Hahn MG、Rao XL、Knox JP等。拟南芥开裂带多聚半乳糖醛酸酶1(ADPG1)在木质素含量降低的茎中释放潜在的防御信号。美国国家科学院学报。2020;117(6):3281–90.
- 75
Senechal F, Graff L, Surcouf O, Marcelo P, Rayon C, Bouton S, Mareck A, Mouille G, Stintzi A, Hofte H等。拟南芥果胶甲基酯酶17与枯草杆菌素样丝氨酸蛋白酶SBT3.5共表达并由其加工。安·博特。2014;114(6):1161–75.
- 76
Folsom JJ、Begcy K、Hao X、Wang D、Walia H。水稻非受精胚乳1通过控制早期胚乳发育来调节热胁迫下的种子大小。植物生理学。2014;165(1):238–48.
- 77.
程翔,潘敏哲,周勇,牛斌,陈超:两个重复的功能分化施肥独立胚乳水稻种子发育相关基因。植物J。2020;104(1):124–37.
- 78.
MC CB。玉米可变基因座的起源和行为。Proc Natl Acad Sci U S A. 1950; 36(6):344-55。
- 79.
Feschotte C.转换元素和监管网络的演变。NAT Rev Genet。2008; 9(5):397-405。
- 80
Fedoroff NV。总统地址。转置元素,表观遗传学和基因组进化。科学。2012; 338(6108):758-67。
- 81
利希D。玉米转座子突变系统的调控。方法分子生物学。2013;1057:123–42.
- 82
关键词:转座因子,植物基因组,结构,功能,进化植物生物学杂志。2014;65:505-30。
- 83
沈娥,邹杰,胡贝尔图斯·贝伦斯F,陈玲,叶超,戴胜,李瑞,倪敏,姜鑫,邱杰,等。异源多倍体中mirna的鉴定、进化和表达分区芸苔属植物显著. J实验机器人。2015;66(22):7241–53.
- 84
Takanashi H、Sumiyoshi H、Mogi M、Hayashi Y、Ohnishi T。Tsusmi N:miRNAs控制HAM1在单细胞层水平上的功能,并且对正常胚胎发生是必需的拟南芥.中国生物医学工程学报,2018;
- 85
Armenta Medina A、Lepe Soltero D、Xiang D、Datla R、Abreu Goodger C、Gillmor CS。拟南芥miRNAs促进受精卵中胚胎模式的形成。Dev杂志。2017;431(2):145 - 51。
- 86
李德,刘志,高乐,王乐,高梅,焦志,乔H,杨杰,陈梅,姚乐,等.水稻籽粒发育过程中microRNA的全基因组鉴定与鉴定玉米公共科学图书馆。2016;11(4):e0153168。
- 87
Wojcik AM,Nodine MD.Gaj MD:miR160和miR166/165有助于LEC2.-介导的生长素反应参与植物体细胞胚胎发生的诱导拟南芥.植物科学,2017;8:2024。
- 88
江j,朱思,袁y,王y,zeng l,batley j,王yp。黄色和黑色种子种子的转录组比较芸苔属植物显著揭示了基因对种子品质的影响。中国生物医学工程学报,2019;
- 89
Bolger AM, Lohse M, Usadel B. Trimmomatic:用于Illumina序列数据的灵活修剪器。生物信息学。2014;30(15):2114 - 20。
- 90.
Liu S, Parkin IA, Tang H, Wang X, Chiquet J, Belcram H, Tong C, Samans B,等。新石器时代后的早期异源多倍体进化芸苔属植物显著油籽基因组。科学。2014;345(6199):950–3.
- 91.
HISAT:一种低内存要求的快速拼接对准器。Nat方法。2015;12(4):357 - 60。
- 92.
Li H、Handsaker B、Wysoker A、Fennell T、Ruan J、Homer N、Marth G、Abecasis G、Durbin R。序列对齐/映射格式和SAMtools。生物信息学。2009;25(16):2078–9.
- 93.
关键词:单核苷酸多态性,突变发现,关联映射,群体遗传参数估计生物信息学。2011;27(21):2987 - 93。
确认
不适用。
资金
本研究得到了国家自然科学基础(31771824,31771825),江苏省的自然科学基金(BK20180101,BE2018356),中国重点研发计划(2018YFE0108000),江苏的优先学术计划发展教育机构。创始人在设计,分析,解释本研究或相关数据中没有发挥任何角色。
作者信息
从属关系
贡献
HR进行实验并起草稿件,HR、WY和BJ对植物材料进行取样。HR和HZ对测序数据进行分析。JJ和YW对手稿进行了修改。所有作者通过了最终稿件。
相应的作者
伦理宣言
伦理批准并同意参与
这项研究没有直接涉及人类或动物。将这些材料用于实验目的不需要特别许可。这些幼苗按照标准做法生长在中国扬州大学的试验田,并在要求的时间收获样品。我们遵守《濒危野生动植物种贸易公约》。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充资料
附加文件1:图S1
. RNA-seq数据三个生物复制的个体相关系数分析。
附加文件2:表S1
.在Y6和ZS11的20个DAP胚乳之间有snp。
附加文件3:表S2
.在Y6和ZS11的25个DAP胚乳之间有snp。
附加文件4:表S3
.母体和父亲读数的比例在互惠杂交种20个DAP胚乳中。
附加文件5:表S4
. 正反交杂种25个DAP胚乳的母本和父本阅读比例。
附加文件6:表S5
. 20个正交杂种DAP胚乳中的印记基因。
附加文件7:表S6
. 在25个正交杂种DAP胚乳中鉴定的印记基因。
附加文件8:表S7
.互交杂种20个DAP胚乳与25个DAP胚乳的印迹基因比较。
附加文件9:表S8
.组织印迹基因表达模式(FPKM)。
附加文件10:表S9
.基因印迹的聚类分析显著染色体。
附加文件11:表S10
.印迹基因GO富集分析。
附加文件12:表S11
. 用于验证印迹基因的引物。
权利和权限
开放访问本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用本文
荣洪,杨伟,朱洪。等。互交杂种胚乳的基因组印迹基因芸苔属植物显著.BMC植物杂志21,140 (2021). https://doi.org/10.1186/s12870-021-02908-8
收到了:
认可的:
发表: