抽象的
背景
香蕉植物高度是园艺实践和半矮种品种的重要特征,表现出风雨和雨水损害的更好抵抗力。然而,控制伪尖端高度的分子机制仍然明显差。在此,我们研究了Semi-Dwarf香蕉突变体AIFEN No.1的假潜的分子变化(穆萨利用转录组和代谢组联合方法对其野生型矮秆品种进行了比较。
结果
在突变体和野生型之间检测到总共127个差异表达基因和48个差异累积的代谢物。属于氨基酸及其衍生物,类黄酮,木兰,香豆素,有机酸和酚酸的代谢物在突变体中调节。转录组分析表明,与嗜酸甘油蛋白途径,蟾蜍素转运,细胞伸长和细胞壁改性有关的基因的差异调节。基于赤霉素和相关途径相关基因的调节,我们讨论了甘草蛋白在突变香蕉中的假统伸长率中的参与。探讨了与细胞壁相关的基因和代谢物,并讨论了它们的参与细胞延伸。
结论
结果表明,胃纤维素和相关途径可能与细胞伸长率和细胞壁改性一起开发观察到的半矮化假刺激表型。结果增加了对香蕉茎高度的机制的理解,并为进一步解剖特异性基因功能提供新的线索。
背景
在香蕉(穆萨SPP。)生产,工厂建筑提供独特的园艺实践,包括花卉去除,束管理,控制害虫和疾病等。高香蕉Pseudostem在台风中很容易破碎,需要额外的输入成本。通过操纵香蕉植物高度可以实现生产率优化。半矮人香蕉栽培品种对大风和雨引起的损害造成良好的抵制[1].此外,与较短茎相关的屈服增益也与增加的收获指数相连[2].尽管半矮杆的基本和战略重要性,香蕉株高的基因操作进展已经相对有限,部分因为分之一叶的个体发育特征是不易至于其他器官,其外部形态的复杂性并不是那么有吸引力与叶片相比,根和花[3.].
体外技术通常用于香蕉工业,用于生产具有更高产量潜力的大规模无病的植物。然而,由于这种处理的结果,通常出现索华际变化,这被认为是这种技术的主要缺点之一[4.].在香蕉组织培养植物中经常观察侏儒症和巨型变体[1那5.那6.].另一方面,来自组织培养处理的变体是适用于对比转录组和代谢分析的研究材料的良好来源。Pisang Awak(穆萨SPP。)是一种高产培养的香蕉亚组,其含量高,亚洲国家作为沙漠水果广泛种植,但在非洲国家的果汁/酿造[7.].通常,Pisang Areak品种的植物剧烈,高度约为4.5-5.5米。在我们的穆萨收藏品,有一个矮人Pisang Awak品种'Aifen No.1'(野生型,WT),其高度约为2.0-2.5米。最近,通过筛选来自“亚胺文1”组织培养植物的糖髓变化来鉴定高度2.8-3.5m的半矮种突变体(MT)。以前的研究表明,激素生物合成途径对这种变化负责[1].
到目前为止,与茎高相关的关键途径是赤霉素(gibberelic acid, GA)的代谢和信号转导、扩张细胞细胞壁的弹性以及GA与生长素、油菜素内酯(brassinosteroids, BR)、脱落酸(ABA)等激素代谢和信号转导途径的交叉[3.].陈等人,[1]研究了“威廉姆斯”繁殖的矮人突变体,并展示了Ga在侏儒症中的作用。在桃树中,横囊矮主义特质(DW.)与GA受体中的无意义突变有关PPEGID1C.[8.].GA生物合成途径相关酶如ent-Copalyl二磷酸合酶,ent-kaurene合成酶,ent-Kaurene 19-氧化酶,Ga12-醛7-氧化酶,Ga 20-氧化酶,Ga3β-羟化酶和Ga 2-氧化酶已成功地鉴定在拟南芥,南瓜和牛群豆中[9.].对香蕉的GA监管茎发育中威廉姆斯香蕉及其矮种突变型灯的GA代谢研究,并确定了调节差分GA含量的六个主要基因[1].虽然该研究的重点是GA新陈代谢相关的基因,但与干延伸相关的其他途径仍然探索了9.那10.].
在植物中,茎在芽顶部分页(SAM)和种子植物的情况下,它起源于SAM的子顶部区域(称为肋区,RZ)[11.].另外,单码片杆伸长率由间歇分生剂(IM)促进。RZ和IMS都是茎生长在GA刺激下开始的主要网站[3.].GA降解Della蛋白并刺激RZ区的细胞分裂。Dellas,控制茎中细胞分裂的蛋白质在功能上与转录因子(TFS)有关。达拉斯结合并抑制Ⅰ类Teosinte支链1(TCP),环淋氧和增殖细胞因子TFS的活性,进一步激活与茎中细胞周期进展相关的其他基因[12.].最近的研究突出了RZ中塞拉斯和细胞增殖的直接链接,这不仅影响干延伸,而且影响SAM尺寸。除了Dellas之外,通过限制控制杆伸长的信号,含有横向器官界限(LOB)含有结构域基因的器官边界基因也与杆伸长率有影响[13.].在茎发育的早期阶段的血管模式的建立是一个关键阶段,并且是在疾病流动的影响下。在这方面,蟾蜍素渗透载体蛋白的作用与根表皮细胞中的细胞伸长率有关,但在干伸长率中的作用尚未探讨[14.].在基于细胞增殖的初始生长之后,细胞扩张融入了节水性的作用。通过快速差异生长调节茎生长至可变的条件。对于细胞增殖以及膨胀,细胞壁相关基因的突出作用也是一个重要的考虑因素。最后,通过信号传导的组织层之间的协调也在茎伸长期间起着重要作用。生长素在BR生产和合成中的作用以及表皮中BR和非常长链脂肪酸之间的信号是良好的例子[15.那16.].
随着香蕉基因组的可用性,现在有可能对调控植株高度的机制有更深入的了解[17.那18.那19.].无偏见的现代高通量技术,如整个转录组和代谢物,都会发现控制植物中不同特征的遗传因素,包括生物和非生物应激,农艺性状[20.那21.那22.那23.].此外,多个OMIC技术的组合导致香蕉中的不同途径,例如剥离成熟和褪黑素对延迟炭疽病发生率的影响[24.那25.那26.].在这项研究中,我们旨在鉴定Pisang Auak Aifen No.1dwarf野生型及其半矮种突变体的Pseudostems中的差异表达的基因和代谢物。转录组和代谢物响应涉及荷尔蒙信号传导,包括GA,毒素,BR,ABA和乙烯,以及细胞增殖和伸长率。
结果
植物表型
在该领域,成人矮化野生型(WT)香蕉anifen No.1(Musa SPP。ABB Group)植物展示了从2.0-2.5米的短件,茎长范围为95.5-98.5厘米。此外,WT的束重量为15-20千克。鉴定的疾病的疾病No.1突变体(MT)植物具有半矮小地形,植物高度为2.8-3.5米,茎长92.5-95.0厘米,而且相对较重的束即是25-30kg(表1;无花果。1A&B)。
转录组分析
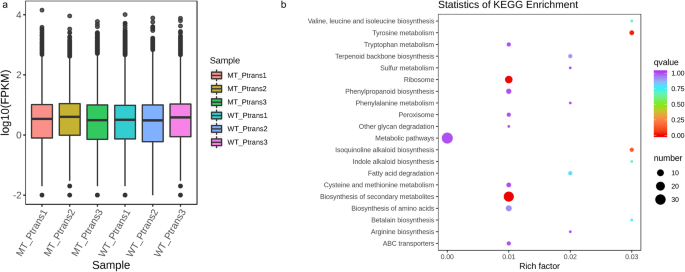
我们研究了WT和MT植物的假刺痛中基因表达谱的变化。患有三种生物学重复,六个样品的转录组测序总共产生56.78 GB的清洁数据,平均为94.46%的基础评分Q30(附加表1).总清洁读数,83.68至90.25%是与Musa Genome的独特比赛(Musa Acuminata.DH Pahang V2和Musa Balbisianadh pkw)[18.那27.].总的来说,当使用FPKM> 1作为确定基因表达的阈值时,与WT相比,映射的每百万片段(FPKM)的数百万片段的数千次映射(FPKM)的片段更高,以确定基因表达的阈值(图。2a). WT和MT重复之间的Pearson相关系数(PCC)范围为0.25到0.87(附加图)。1).这是预期的,因为MT由组织培养物从WT获得,并且可能只突变少数基因。我们还观察到,Pseudostem转录组有很高的体内变化。因此,我们建议在与假期稳定增长相关的未来研究中提供更多的复制。
WT和MT之间的差异表达基因
DESEQ2分析显示,在WT和MT之间总共有127个基因差异表达(DEG);与WT相比,25和102℃显现下降和增加MT的表达增加。这些结果意味着很少有基因参与了香蕉的假索德高度。基于每个差分组的基于基因表达聚类分析在附加图中呈现。2.在次数中,只有五个基因被完全在wt中表达。NR注释显示这些基因被预测为大颗粒1样E同种型X1(基因-C4D60_MB04T03190),蛋白质SRG1样(基因-C4D60_MB11T04180),S-NORCOClaurine合成酶1状(基因-C4D60_MB11T04200),一种不表征蛋白质(MA02_G04590.),和Stellacyanin同种型x1(MA05_G16810)(附加表3.).只有一个基因(基因-C4D60_MB07T24780)在MT香蕉中专门表达,LOG2FOLD值为7.082。该基因被预测为膜的整体部分。基因和基因组(Kegg)分析的京都百科全书显示,在WT Vs MT香蕉中显着富集的前五次重点生物途径是代谢途径,二次代谢物,核糖体,酪氨酸代谢和苯丙醇化生物合成的生物合成(图。2b;额外的无花果。3.).
与植物激素有关的差异表达基因
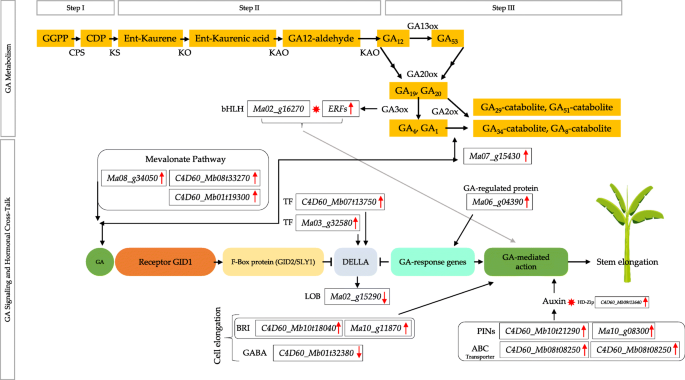
气体调节导致香蕉植物表现出矮化表型[1].因此,重要的是检查Ga生物合成途径相关基因的表达是否在wt和mt之间差异调节。我们发现N-乙酰葡糖胺氨基氨基 - 磷脂酰肌醇生物合成蛋白GPI1样(Gibberellin调节蛋白6)(Ma06_g04390)与wt相比,MT中的高度调节。我们还观察到一个可能的2-氧缺乏症依赖性的二恶英酶(MA07_G15430)在Mt中上调。由于BR和天然气之间的串扰,我们寻求表达我们的参数中的相关基因,并观察到两个BRI基因的上调(基因 -C4D60_MB10T18040和MA10_G11870).因为含有LOB域的基因是达拉靶向的,所以含有一种LOB域基因的表达的降低差异表达[28.].戴尔斯与TCP等TCS相互作用,例如含有含有含有含有含氮域域的蛋白质(Jaz)。在这方面,我们发现两个基因在mt中上调;一个jaz(基因-C4D60_MB07T13750)和一个TCP(MA03_G32580).在MT的高表达基因中,两个白细胞介素-1受体相关激酶4基因的表达增加(gene-C4D60_Mb08t19920和基因-C4D60_MB10T14420)分别折叠变化值为172.317和93.8,是一个重要的观察。以前众所周知,植物与植物相关的受体样激酶2(PSRK2)起到确定茎伸长叶片在水稻中的反应的因素[29.].
甲羟戊酸途径对GA生物合成途径有微小的贡献[10.].在这方面,我们观察到两个GHMP激酶基因(MA08_G34050和基因-C4D60_MB08T33270)具有甲戊二醇酯激酶活性(基于GO注释)在MT中提高了表达。还已知细胞溶质乙酰-CoA进一步参与甲戊酯衍生的异戊二烯的生物合成[30.].一个基因(基因-C4D60_MB01T19300以细胞溶质乙酰基 - COA注释显示,表达MT的表达降低。
乙烯响应因子(ERF)(ERF / AP2)家族的四个成员(Ma02_g02820、Ma05_g04880 Ma09_g22060,和基因-C4D60_MB02T03000)与WT相比,在MT中表现出增加的表达。与GCN5相关的N-末端乙酰转移酶(GNAT)直接参与MERISTEM调节基因如WUSCHEL的转录调节[31.].我们观察了一个GNAT的表达增加(基因-C4D60_MB10T18260)在我们的转录组数据集中(附加表3.).
就蟾蜍素在Br合成和信号传导中的作用而言,以及休氏伸长率,两种基因的表达(基因-C4D60_MB10T21290和MA10_G08300.)在MT中相对较大,表明植物毒素在香蕉假刀伸长率的作用。WT中的一个完全表达的基因是大颗粒1状,已知参与生长素转运[32.].HB-HD-ZIP TF的表达(基因-C4D60_MB09T13640)在Mt中增加。我们的转录组数据显示了两个基因(MA06_G03830.和基因-C4D60_MB08T08250)分别属于ABC转运蛋白G和C族,在MT中上调,表明极性养蛋白输送在茎伸长中的累积[33.].
在MT中高表达的基因中,对Tify-5a样蛋白(MA07_G01220).该基因以其作为茉莉酸抑制反应的作用而闻名[34.那35.].作为磷脂酶A1-II 5的三种基因表示在Mt中的表达增加(基因-C4D60_MB07T09300那MA02_G10300.那和Ma08_g26980).磷脂酶如根伸长率以及养肝信号传导[36.].
与细胞壁,细胞生长和茎高有关的差异表达基因
涉及果胶甲基酯酶抑制剂(PMEI)的专用机制控制了细胞壁刚度并降低其粘弹性[37.].一个PMEI的表达下降(基因-C4D60_MB03T05630)在MT中可能被认为是杆伸长率的策略[38.].我们还观察到纤维素合酶样蛋白的表达减少(Ma08_g05160)和糖基转移酶的成员,如家庭2(纤维素合酶样蛋白E2),而两个可能的甘露甘露合酶(基因 -C4D60_MB07T06270和MA07_G22600.)在MT中表现出增加的表达(附加表3.).
我们观察到脂肪酰基-CoA合酶的表达在Mt Banana中增加。此外,表达四种咖啡酸3-O-甲基转移酶(COMT)(MA09_G18140那MA09_G18200.那基因-C4D60_MB09T20170,基因-C4D60_MB09T20150)在Mt中增加了[39.那40].
我们还观察到与淀粉降解有关的基因的相对较低的表达I.。不活性β-淀粉酶9(MA03_G08740)[41., 1-酰基-sn-甘油-3-磷酸酰基转移酶PLS1,也有报道参与黄瓜幼苗的生长[42.]和Stellacyanin,3-酮酰基CoA合酶4样(MA05_G16810)(催化脂肪酸伸长的第一反应并确定底物特异性的关键酶)[43.](附加表格3.).除了细胞伸长的激素和细胞壁结构控制之外,已知可核酸3-O-去甲基酶通过单甲基化赖氨酸-4残基的去甲基化与植物细胞分裂和茎伸长相连组蛋白亚单位3.我们发现一种可待因的3-O-脱甲基酶(基因-C4D60_MB11T04180)在MT中几乎没有表达[44.](附加表格3.).已知GABA积累引起细胞伸长率缺陷。我们的转录组数据显示了一个跨膜氨基酸转运蛋白(基因-C4D60_MB01T32380;可能的gaba转运蛋白1)在mt中具有较低的表达(附加表3.)[45.].白棕色复合同源蛋白15(MA06_G03830.)(ABC转运蛋白)显示在MT中的表达增加。该基因在开发棉纤维细胞中高度表达,与棉纤维伸长率相关[46.].
与WT(表达92.9倍的增加)相比,在MT中高度表达可能的羧基酯酶18。通过基因组关联研究,这些基因与玉米植物高的功能相关[47.].9-CIS-环氧基丙藤蛋白二恶英酶(MA04_G38030)在MT中高度表达。这些与萌发后的早期幼苗生长有关,与未转化的植物相比,在萌发后的幼苗生长显着更长的根和芽[48.].
我们还发现了三种氨基环丙烷羧酸氧化酶(ACO) (基因-C4D60_MB05T08270那MA05_G09360,基因-C4D60_MB06T13490)与WT相比,在MT中表现出增加的表达。ACO1显示在水稻中的标题阶段影响节间伸长[49.].
众所周知,核糖体亚基蛋白调节叶形形态以及植物建筑[50.].在这方面,我们观察到核糖体蛋白S7P / S5E(gene-C4D60_Mb00t01000)具有较低的表达MT,具有-5.149的log2fold变化值(附加表3.).
通过定量RT-PCR验证DEGS
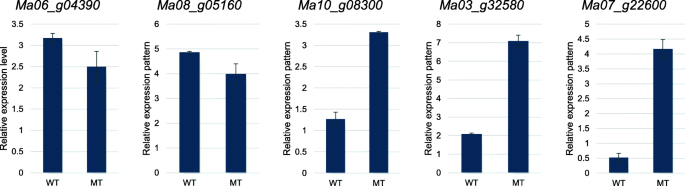
为了验证基于RNA-Seq的基因转录本丰度的有效性,对5个deg进行了qRT-PCR分析;MA10_G08300.(膜输送蛋白),MA03_G32580(TCP系列转录因子),MA07_G22600.(可能的人类合成酶11同种型X1),Ma06_g04390(赤霉素调节蛋白6),和Ma08_g05160(纤维素合酶样蛋白)。这施和组蛋白基因被用作内部对照。与基于RNA-SEQ的结果匹配的五种选定基因的QRT-PCR谱验证了illumina测序结果的可易感性(图。3.).
WT和MT之间的差异累积代谢物
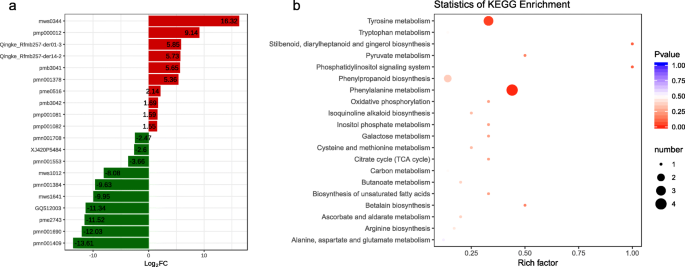
我们还研究了WT和MT Banana Pseudostem代谢物,了解代谢物在茎伸长中的作用。总共检测到412个代谢物。这些检测到的代谢物可以分为10个主要课程(附加表4.).为了评估WT和MT之间代谢物离子强度的差异,我们应用了PLS-DA模型。建立的PLS-DA模型显示出良好的健身(附加图。4.).在wt vs mt anifen no中差异累积四十八个代谢物。1香蕉pseudostem(附加图。5.;额外表5.).Seventeen metabolites belonging to six classes i.e. amino acid and its derivatives (1), flavonoids (5), lignans and coumarins (4), organic acids (1), phenolic acids (3), and others (3), were higher in MT. The down-accumulated metabolites belonged to class alkaloids, amino acid and its derivatives, flavonoids, lignans and coumarins, lipids, nucleotide and its derivatives, organic acids, phenolic acids, tannins, terpenes, and others. The hierarchical clustering clearly differentiated the metabolites (Additional Fig.6.).MT中的前10位下降倒置代谢物是亚亚酸(PMN001708),羟基胍(XJ420P5484),Cimidahurinine(PMN001553),香豆素(MWS1012),异氯酸C(PMN001384),醇林(MWS1641),FER-agmatine(GQ512003),N-苯基乙酰甘氨酸(PME2743),3-羟基-4-异丙基苄基醇3-葡糖苷(PMN001690)和植物植物A(PMN001409)。MT中的前10位上调的代谢物是D-二甲酸锂盐(MWS0344),Scutellarin(PMP000012),Pinoresinol-Hex(Qingke_RFMB257-Der01-3),Pinoresinol-Aceglu(Qingke_RFMB257-Der14-2),Tricin O- 糖(PMB3041),萜烯醇单葡糖苷(PMN001378),肌醇(PME0516),三蛋白5-O-己醚(PMB3042),SUDACHIIN B(PMP001081)和SMOACHIIN C(PMP001082)(图。4.一种)。我们进一步用来注释了Kegg数据库中的差分累积代谢物(坝),发现最显着的富集途径是苯丙氨酸代谢,苯丙醇丙烷生物合成和酪氨酸代谢(图。4.b)。
组合转录组和代谢物分析
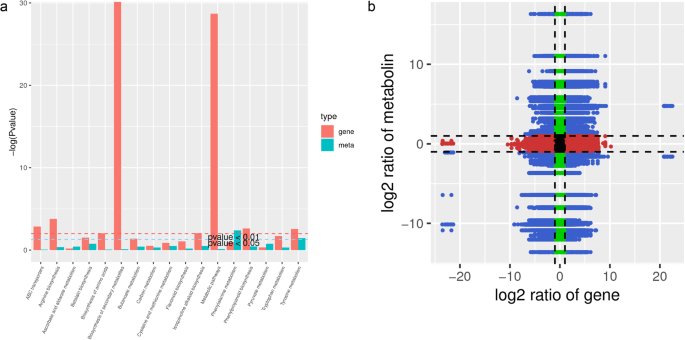
为了建立不同水平的分子之间的关系,即转录组和代谢物,我们首先在视觉上进行了比较了PCA的单独结果。Degs和Dams的PC1分别有23.07和26.11%的变化。Degs和Dams的PC2分别显示36.41和37.51%的变化,表明变化量或更少(附加图)。7.).共同关节Kegg途径分析表明,折叠垫和坝被映射到十五条途径上(附加表6.;无花果。5.一种)。共同关节Kegg途径富集分析表明,富含转录组或基于代谢物的个体富集分析的途径相同。显着富集的途径如图2所示。5.一种。选择LOG2 DAM和DEG的转换数据,其具有PCC> 0.8。然后,我们生成了九个象限图以可视化具有上述PCC的坝和DEG之间的相应变化(图。5.b;额外的无花果。8.).通过构建子网来确定转录物 - 代谢物相关性。这些网络揭示了基因和代谢物的调节和合成特征(附加图。9.).相关网络表明,转录物和代谢物在四个途径中相关,即抗坏血酸和醛酸盐代谢,半胱氨酸和蛋氨酸代谢,苯丙醇化生物合成和氨基酸的生物合成。此外,第3和第7次象限中的相对较高数量的坝和灰度表明基因的差异表达模式和代谢物的差异累积是一致的;基因和代谢物具有阳性相关性,并且代谢物的变化可以通过基因积极调节(图。5.一种)。
讨论
自从早期的香蕉改善通过组织培养,侏儒症和茎高度变体繁殖以来,已经观察到[5.].已经取得了显着进展,了解香蕉和其他果树的植物高度的机制。然而,茎高/伸长是一种复杂的生理和生物过程,涉及各种生物途径(Ga代谢,Br,ABA和养肝剂),细胞壁的机械性能,以及生长细胞/组织之间的协调信号传导[3.].在这里,我们研究了基于联合转录的转录组和MT和MT的组合的转录组和MT的DEGS和MT的DEGS探讨,用于洞察与香蕉植物高度有关的机制。我们讨论了学习的可见和水坝相关的主要途径。
通过键GA生物合成调节酶中的功能丧失突变众所周知,显示矮化表型[51.].除了生物合成相关的基因外,戴尔斯是GA信号转导途径中的关键基因,玉米和芸苔中的Della缺失突变与侏儒症相关[52.那53.].在WT和MT Banana Pseudostems之间的比较转录组分析中未记录Dellas的差异表达。以前在Autotetroploid苹果中记录了类似的观察结果,其中作者没有找到塞拉斯的差异调节。然而,作者得出结论,茎高度受到GA调节54.].我们还提出了MT中的类似GA受管制的假性高度调节。这个命题基于许多观察结果。首先,36.66倍上调一个胃蛋白蛋白调节蛋白(Ma06_g04390)是一种重要的观察,如在黄瓜缺口中,据报道,该基因编码了经典的阿拉伯半乳蛋白,并且参与干伸长率[55.].其次,我们还观察到由Ga I. Inter介素-1受体相关激酶诱导的另外两种基因的表达增加,具有非常高的折叠变化值。这种观察结果与大米的事实一致,通过Ga诱导了名为PSRK2的受体样激酶,并且仅在茎中发现[56.].第三,观察到可能的2-氧缺乏依赖性二恶英酶(MA07_G15430)表现出增加的表达,进一步支持我们对Ga在假索德的可能参与的主张。该基因属于2- Fe(II)氧合酶超家族,其同源物在GA生物合成途径中催化后的作用中已知其作用[9.].第四,已知芸苔类固醇(BRS)和GA是调节植物细胞伸长的两种主要激素。其中任何一个导致植物生长和侏儒症的缺陷导致缺陷。BRI是BR的主要受体和拟南芥中BRI1的过表达已经显示出膜级分中的细胞伸长和增加的芸苔醇素结合位点的增加[57.].MT中的两个Bri1基因表达的显着增加表明BR通过细胞伸长率增加假刺痛的高度。这种观察结果与自身传递一次苹果中的BR含量降低的结果一致,导致矮化表型[54.].此外,BR分解代谢由含LOB域的蛋白质激活,所述蛋白质在茎伸长率的控制中尤为重要[58.].我们观察到含有LOB域的基因在重量下具有更高的表达。含有LOB域的基因由Della蛋白靶向。LOB基因被分类为器官边界基因。因此,器官边界基因可以通过限制控制茎伸长的信号(例如BR)来调节茎生长,这进一步调节GA合成[28.].它已经在水稻中建立了BR调节Ga生物合成,因此调节细胞伸长率。第五,JAZ和TCP的监管还支持GA在假索德高度调节中的可能参与。最后,甲丙酮途径对GA生物合成途径也有贡献,因为通过甲氧基依赖性或非甲戊酯途径合成了天竺葵二磷酸二磷酸酯[10.].与甲羟戊酸激酶活性相关的基因的表达增加表明,Ga代谢正在影响表型,并且Ga生物合成可能是由于甲戊酸依赖性途径的变化[9.].
天然气还配合与BR,ABA,养蛋和其他激素进行干生长调节[59.那60.].生长素生物合成,运输和敏感性与植物中的细胞伸长相关[61.那62.].植物蛋白在次杆伸长率期间具有表皮的特定作用,并控制BR合成和信令[63.].表皮坐标坐标诱导的茎生长,因此细胞中的毒素通量的变化可以通过唾液流出载体蛋白(也称为销)与细胞伸长率连接[14.那16.].MT中两个pin的上调表明香蕉茎中可能存在类似的机制。我们在MT中发现了一个HD-zip蛋白的上调,这一事实支持了这一观察。生长素和HD-zip蛋白的成员之间也建立了联系。HD-zip基因(ATHB2.)根据养蛋白运输系统控制幼杆子的伸长[64.那65.].此外,ABC运输商也在养肝运输中发挥作用。拟南芥中的矮化表型也涉及由于他们参与养肝转运而涉及ABC运输扣[33.].因此,任何ABC转运体在MT中的上调都将进一步证实生长素在伸长假茎中的内流可能是一种可能的调控机制。在本研究中,两个ABC转运体有较高的表达。此外,ABC转运体是转录组和代谢组中显著富集的途径之一(图。2b)。另外,磷脂酶的相对较高的表达与帕特蛋白样蛋白2与这些结果相当相关,因为已经确定磷脂酶(包括粉蛋白相关的磷脂仿酶)具有疾病信号转导的功能[66.].这些研究结果表明,假昭统治的毒素通量受到显着影响,可能导致茎的伸长率。
磷脂酶 - 由于拟南芥中的细胞伸长率没有很好地表征[67.].因此,磷脂酶的较高表达也表明MT中的细胞伸长率可能的作用。茎伸长或植物高度通过细胞膨胀/伸长率来实现,这是一个紧密的过程。在拟南芥中,细胞伸长率进一步负责缺口生长,而在棉花中归因于纤维伸长率。昆霉菌素的独家积累(PMP000012.)在MT中建议MT Pseudostems正在经历伸长率。Scutellarin是一种促进根伸长率的滑路前[68.](附加表格5.).总体而言,所有植物器官都欠他们的最终尺寸至一段时间的显着细胞伸长率[69.].关于细胞伸长,我们的结果表明,可能的GABA转运蛋白具有较低的表达,而白棕色复合同源蛋白15显示出增加的表达。这些观察结果表明,如拟南芥和棉,香蕉细胞伸长也以复杂的方式调节[45.那46.].随着植物细胞的尺寸通过其壁的表面的程度决定,可以作为细胞壁表面的任何永久性增加来定义细胞伸长率[70].因此,当比较WT和MT香蕉假索德稳定性时,细胞壁改性是重要的考虑因素。我们进一步检查了在香蕉的假刀伸长期间是否影响了细胞壁弹性或孔隙率。以前在拟南芥中的研究表明,在茎伸长期间,纤维素组合物和细胞壁厚度很少受到影响。果胶和纤维素的作用是相当于控制间伸长率的控制[38.].我们在MT Pseudostem的观察结果表明,香蕉可能采用一种策略来控制细胞壁刚性,并通过下调PMEI来降低其粘弹性。可能的甘露甘露甘露甘露甘露甘露甘露甘露甘露甘露合酶的表达增加和纤维素合酶样蛋白的表达可能与核心时钟驱动的蛋白质介导的细胞壁可伸展性的变化相关联,这应该通过未来的研究进一步验证(附加表3.)[71.那72.].此外,4种COMTs表达量的增加与之前有关抗倒伏小麦木质素含量高、机械强度和茎秆强度高的报道一致[39.那40].在这方面,D-木糖的81.968倍倍数累积是一个重要观察,WT中没有积累(附加表5.).已经发现D- Xylonon酸作为石榴中的半纤维素的主要成分,因此表明MT中正在进行大规模的细胞壁改性[73.].从MT中的Pinoreinol-Hex和Pinoreinol-Aceglu的57和53折叠中进一步明显,分别在MT中分别在MT(附加表5.)[74.].
根据我们的结果和已知不同荷尔蒙的角色及其与TFS的交叉交谈,我们提出了BRS,毒素和ERF与GA代谢和信号的相互作用可能是MT AIFEN NO.1的伪尖端高度的增加负责。香蕉(图。6.).这种新颖的理解开启了新的研究途径,进一步深入地研究了每种指定激素和相关蛋白质或TFS的单独和交互作用。
结论
在这项研究中,我们旨在通过使用突变体及其野生型植物的组合转录组和代谢分析来描绘对香蕉中的假刺激高度的可能机制。在代谢水平,苯丙烷化生物合成,酪氨酸代谢和苯丙氨酸代谢途径显示差异调节。在转录组水平上,我们观察到次级代谢物,代谢途径,核糖体和酪氨酸代谢的生物合成浓缩。Gibberellin调节蛋白,白细胞介素-1受体相关激酶,可能的2-氧化抑制依赖性的二恶酶和MT中的BRI基因的较高表达与与甲羟戊酯途径相关的基因表达的变化相结合,表明GA是一个重要的Pseudostem高度调节的贡献者。我们的结果还确认了株式会病毒气体的已知协调作用,以及用于干生长调节的其他激素。通过细胞壁相关基因,细胞伸长和膨胀的表达的变化,MT中的假索德高度也受到调节。
方法
植物材料
植物材料是矮人香蕉'AIFEN No. 1'的野生型(WT)(穆萨SPP。Pisang awak小组ABB)及其半矮小突变体(MT)。本文的广东广州市农业科学研究所的组织 - 培养诱导的躯体培养物躯体变化中的躯体培养物躯体变化,由本文的相应作者(欧胜教授)。本研究中使用的标本既没有报告,也没有提交任何植物征。MT和WT在营养土中生长四周的生根和两天的硬化。此后,生长幼苗以达到5至六个叶阶段(6周龄)。相对湿度,温度和光周期分别为28℃,60〜80%和12小时(1500±200升)。六周后,香蕉植物有五到六个真实的叶子。然后切割WT以及MT的三份假索,并用于转录组和代谢物分析(图。1一种)。
RNA提取,文库制剂和Illumina Hiseq测序
我们使用标准程序从WT和MT假茎中提取总RNA,其中包括使用Spin Column Plant total RNA纯化试剂盒(Tiandz, Beijing, China) [75.].此外,评估RNA的纯度,量化萃取的RNA,并检查它们的完整性。遵循这些步骤,准备序列文库并在Illumina Hiseq平台(Illumina Inc.,San Diego,USA)上进行测序,如前所述[76.那77.].
测序数据分析
我们雇用了FASTQC(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)处理测序读取并获得清洁读取,然后确定GC内容分发。Hisat2用于在清洁读数和参考基因组之间进行序列对准I.e.MUSA Genome(Musa Acuminata.DH Pahang V2和Musa Balbisianadh pkw)[18.那27.那78.那79.].先计算比较效率(mapping reads到clean reads的百分比),然后计算reads在不同染色体上的位置分布统计量[80].将读取的区域分布进行比较并绘制为图表。结果在IGV软件中可视化[81.].通过MRNA碎片的随机性测试评估转录组文库的质量,然后通过在插入件的末端的参考基因组上的读取的开始和终点之间的距离和终点之间进行插入长度检查。将基因表达量化为每百万片段的每千碱基映射(FPKM)的每千碱基的片段。然后使用基因表达数据表达基因丰度和基因表达的总体分布,计算相关性和主成分分析(PCA)的趋势。对于功能注释,我们将基因与各种数据库(如Kegg)对齐[82.], 去 [83.],簇蛋白群(COG)群[84.]和真核生物同源群(KOG) [85.]使用BLAST [86.] e-value <1.0×10的阈值- 5.
鉴定差异表达基因,途径富集和实时QRT-PCR
差异基因表达分析和富集分析如前所述[76.].简而言之,我们在将读数与折叠变化和假发现率(FDR)或> 2的过滤标准归一计数之后使用DESEQ2至差异表达基因(DEGS)。P. < 0.01, respectively [87.].分层群集分析完成并表示为使用紧身胸部的热图(https://code.google.com/p/corset-project/).
在Kobas2.0的Keggg中映射了所识别的次数[88.].注意,以最小化我们使用FDR校正的假阳性预测P. < 0.05.
在分析基因的表达后,我们选择了五次(附加表7.)在WT和MT Pseudostems中显示出不同的表达,并在转子-Cene 6000机器(Qiagen,Shanghai,China)上进行定量实时PCR(QRT-PCR)如下所示。使用高容量cDNA逆转录试剂盒(Applied Biosystem,Ma,US)从RNA合成CDNA。两个组成型表达基因即。施(f:ctcctatgttgctcgcttatg,r:ggctacttcggtttttttc)和组蛋白H3.3(f:gcggtaataggagtgaagtc,r:tcagcctcagccaatgcac)用作参考[89.那90.那91.].PCR反应的温度曲线,试剂和体积与先前描述的条件相似[76.那92.].
代谢分析
在武汉Metuke Biotechnology Co.,Ltd,在-80°C储存的组织培养的MT和WT硫化芬No.1香蕉培养的组织培养MT和WT硫化芬的1号。(www.metware.cn.).样品处理、提取和代谢物检测的其余步骤如前所述[93.].
代谢组学数据分析
代谢物的强度在分析师1.6.1软件(AB Sciex,安大略省,加拿大)和缺失值的代谢物中被认为低于检测限,并用最小记录值替换。通过对数转换归一化离子强度,通过使用Dunnett的测试计算代谢物丰度,并且通过FDR控制多种测试。为了获得处理之间的最大差异,我们使用了部分最小二乘判别分析(PLS-DA)和投影中的可变重要性,用于屏幕水坝用于计算所识别的水坝对PLS-DA模型的相对重要性.通过使用R(r)完成包括PCA,分层聚类和途径富集的其他分析(www.r-project.org.)据早先报道[20.那24.那82.那94.].
组合转录组和代谢物分析
除了单独的转录组测序和代谢物分析外分析外,我们还对DEG和DAM进行了共同关节分析,以确定途径的富集程度。R中的CORERON程序用于计算基因的PCC和代谢物,并绘制了DEG和坝的相关系数簇热敷。使用PCC> 0.8的基因 - 代谢物网络用于构建转录物代谢网络。
可用性数据和材料
RNA-SEQ数据可在SRA数据库中获得国家生物技术信息中心的数据库,并附有登录号PRJNA609266(https://www.ncbi.nlm.nih.gov/sra//term=prjna609266.).
缩写
- GA:
-
甘蓝酸
- BR:
-
芸苔类固醇
- 阿巴:
-
脱盐酸
- 山姆:
-
拍摄顶端公司
- RZ:
-
罗纹区
- TF:
-
转录因子
- TCP:
-
第1级Teosinte分支1
- 高球:
-
横向器官边界
- WT:
-
野生型
- 公吨:
-
突变体
- FPKM:
-
每百万次碎片每千碱基碎片映射
- DEG:
-
表达差异化
- Kegg:
-
Kyoto基因和基因组的百科全书
- 杰兹:
-
含含含含型含域的蛋白质
- PSRK2:
-
植物身材与相关受体样Kinanse 2
- 去:
-
基因本体论
- ERF:
-
乙烯响应因子
- GNAT:
-
GCN5-related氨基乙酰转移酶
- PMEI:
-
果胶甲基酯酶抑制剂
- COMT:
-
咖啡酸3-O-甲基转移酶
- PLS-DA:
-
部分最小二乘歧视分析
- PCA:
-
原理成分分析
- 坝:
-
差异累积的代谢物
- PCC:
-
Pearson相关系数
- COG:
-
直际蛋白质群体
- Kog:
-
真核生物的同源组
- QRT-PCR:
-
定量实时PCR
参考文献
- 1。
Chen J,谢J,Duan Y,Hu H,Hu Y,Li W.基因组 - 范围鉴定和表达分析揭示了组织特异性表达和差异调节的基因,涉及威廉姆斯香蕉及其矮种突变体之间的嗜酸性胃泌素代谢。BMC植物BIOL。2016; 16(1):123。
- 2。
Peng J, Richards DE, Hartley NM, Murphy GP, Devos KM, Flintham JE, Beales J, Fish LJ, Worland AJ, Pelica F. ' Green revolution '基因编码突变型赤霉素响应调节剂。大自然。1999;400(6741):256。
- 3.
Serrano-Mislata A,Sablowski R.土地植物的支柱:新的洞察干部发展。CurrOp植物BIOL。2018; 45:11-7。
- 4.
SandOval J,Kerbellec F,Cote F,Doumas P.矮化嗜酸纤维素的分布,侏儒和巨型非型香蕉(Musa AAA,CV.'grand Nain')植物免于体外繁殖。植物生长调节。1995年; 17(3):219-24。
- 5。
CôteF-X,桑托尔J,Marie P,Auboiron E.微扑达香蕉和植物的变化:文献调查。水果。1993; 48(1):15-23。
- 6。
小繁殖雌性手指香蕉异型的特征和早期检测。中国农业科学。1999;39(8):1017-23。
- 7。
De Beer Z,Sigawa A.香蕉(Musa SPP。)南非的果汁生产。:IV国际香蕉国际研讨会:非洲的香蕉和大蕉国际会议:利用国际879:2008;2008. p。233-8。
- 8。
Hollender Ca,Hadiarto T,Srinivasan C,Scorza R,Dardick C.桃树中的龟甲矮化特征(DW)是由甘油酸受体Ppegid1c内的非本意突变引起的。新植物。2016; 210(1):227-39。
- 9。
Hedden P,Phillips al。Gibberellin新陈代谢:基因揭示的新见解。趋势植物SCI。2000; 5(12):523-30。
- 10.
拟南芥中T-P S.Gibberellin代谢,感知和信号通路。在:拟南芥书/美国植物生物学家学会;2008. p。6。
- 11.
Gaillochet C,Daum G,Lohmann Ju。o细胞,你艺术吗?拍摄射击的机制图案。CurrOp植物BIOL。2015; 23:91-7。
- 12.
DavièreJ-M,Wild M,Regnault T,Baumberger N,Eisler H,Genschik P,Achard P.Cupp-Della相互作用在花序射击顶点确定植物高度。Curr Biol。2014; 24(16):1923-8。
- 13。
贝尔em,林w-c,丈夫ay,yu l,jaganatha v,jablonska b,mangeon a,neff mm,girke t,springer ps。拟南芥横向器官界限负调节芸苔类固醇积累,以限制器官界限的增长。PROC NATL ACAD SCI。2012; 109(51):21146-51。
- 14。
Kleine-Vehn J,Leitner J,Zwiewka M,Sauer M,ABAS L,Luschnig C,Friml J.通过回报式真空靶向通过回报式真空靶向差异劣化。PROC NATL ACAD SCI。2008; 105(46):17812-7。
- 15.
Nobusawa T, Okushima Y, Nagata N, Kojima M, Sakakibara H, Umeda M.表皮中极长链脂肪酸的合成通过限制细胞增殖来控制植物器官的生长。公共科学图书馆杂志。2013;11 (4):e1001531。
- 16。
Procko C,Burko Y,Jaillais Y,Ljung K,Long Ja,Chory J.表皮坐标响应阴影而致响应毒素诱导的茎生长。基因开发。2016; 30(13):1529-41。
- 17。
D'Hont A,Denoeud F,yury J-M,Baurens F-C,Carreel F,Garsmeur O,Noel B,Bocs S,Droc G,Rouard M.该香蕉(Musa Acuminata)基因组和单子叶植物的演变。自然。2012; 488(7410):213。
- 18。
Martin G,Baurens F-C,Droc G,Rouard M,Cenci A,Rilian A,Hastie A,DoleëelJ,yberti A,Alberti A.使用NGS数据和半自动生物信息学方法改进香蕉“Musa Acuminata”参考序列。BMC基因组学。2016; 17(1):243。
- 19。
王Z,苗族,刘俊,徐b,姚x,xu c,赵某,方x,贾c,王J. musa balbisiana基因组揭示了亚基因进化和功能性分歧。自然植物。2019; 5(8):810-21。
- 20。
Drapal M,De Carvalho EB,Rouard M,Amah D,Sardos J,Van Denwe I,Brown A,Roux N,Swennen R,Fraser Pd。代谢物分析表征了Musa二倍体和青少年和预开花生长阶段的三倍体的化学型。SCI批准。2019; 9(1):4657。
- 21。
Gamez RM,Rodríguezf,vidal nm,ramirez s,Alvarez Rv,Landsman d,Mariño-ramírezl.香蕉(Musa Acuminata)转录组仿形响应rhizobacteria:Bacillus淀粉氨酸氨基吡喃酮BS006和假单胞菌荧光荧光灯PS006。BMC基因组学。2019; 20(1):378。
- 22。
Sun J,Zhang J,Fang H,Peng L,Wei S,Li C,Zheng S,Lu J.比较转录组分析揭示了抗抵抗力相关的基因和途径在Musa Acuminata'guijiao 9'对镰刀菌的反应。植物理性生物化学。2019; 141:83-94。
- 23。
徐米,曾康C-B,He R,Yan Z,Qi Z,Xiong R,Cheng Y,Wei S-S,唐H.香蕉(Musa Qumuminate L.)对低钾胁迫的转录组分析。农艺学。2019; 9(4):169。
- 24。
李T,吴Q,朱,周Y,江y,高H,云Z。比较转录组和代谢分析揭示了褪黑素对胰岛素果皮延迟炭疽病发病率的影响。BMC植物BIOL。2019; 19(1):289。
- 25。
Nascimento TP,Castro-Alves VC,Castelan FP,Calhau MFN,Saraiva La,Agopian Rg,Cordenunsi-Lysenko Br。代谢物分析表明,香蕉作物周围的自然生物多样性可能会积极影响成熟水果的营养/传感器轮廓。食物res int。2019; 124:165-74。
- 26。
YUN Z,LI T,GAO H,ZHU H,GUPTA VK,Jiang Y,Duan X.综合转录组,蛋白质组学和代谢组科分析揭示了自然条件下收获香蕉的剥落成熟。生物分子。2019; 9(5):167。
- 27。
Rouard M,Droc G,Martin G,Sardos J,Hueber Y,Guignon V,Cenci A,Geigle B,Hibbins MS,Yahiaoui N.三个新的基因组组件支持Musa Acuminata(野生香蕉)的快速辐射。基因组Biol Evol。2018; 10(12):3129-40。
- 28。
佟华,肖勇,刘东,高胜,刘玲,尹勇,金勇,钱强,楚超。油菜素内酯通过调节水稻赤霉素代谢调控细胞伸长。植物细胞,2014,26(11):4376 - 93。
- 29。
Baum G,Lev-Yadun S,Fridmann Y,Arazi T,Katsnelson H,Zik M,Zik M.Sumpodulin与谷氨酸脱羧酶的结合需要调节谷氨酸和GABA代谢和植物正常发育。Embo J. 1996; 15(12):2988-96。
- 30。
Fatland Bl,Nikolau BJ,Wurtele es。ATP-柠檬酸盐酶在拟南芥中的逆向遗传表征。植物细胞。2005; 17(1):182-203。
- 31。
Boycheva I,Vassileva V,Iantcheva A.组蛋白乙酰转移酶在植物开发和可塑性。Curr基因组学。2014; 15(1):28。
- 32.
刘丽,童华,肖勇,车锐,徐飞,胡斌,梁超,储军,李军,储昌。大粒1的激活对水稻生长素转运的调控作用。中国科学院院刊。2015;112(35):11102-7。
- 33.
YE L,Liu L,xing A,康D.拟南芥MDR样ABC转运蛋白ATPGP1基因患者患者的表征。Biochem Biophys Res Communce。2013; 441(4):782-6。
- 34.
Chung HS,Howe Ga。通过拟南芥中斋甲酸Zim-结构域蛋白jaz10的稳定的剪接变体抑制茉莉酮酸盐信号传导中的Tify基序的关键作用。植物细胞。2009; 21(1):131-45。
- 35.
Shyu C, Figueroa P, DePew CL, Cooke TF, Sheard LB, Moreno JE, Katsir L, Zheng N, Howe GA。JAZ8缺乏一个典型的degron,并且有一个EAR基序,介导拟南芥茉莉酸盐反应的转录抑制。植物细胞,2012;24(2):536 - 50。
- 36。
Rietz S,Dermendjiev G,Oppermann E,Tafesse FG,Effendi Y,Holk A,Parker Je,Teige M,Scherer GF。拟南芥粉的角色相关的磷脂仿酶A根系发育与毒素反应和磷酸盐缺乏有关。莫尔植物。2010; 3(3):524-38。
- 37。
Nawaz Ma,Rehman HM,Imtiaz M,Baloch FS,Lee JD,Yang Sh,Lee Si,Chung G.系统识别和细胞壁重组和降解相关基因的表征甘氨酸最大(L.)MERILL,生物能源豆类。SCI批准。2017; 7(1):10862。
- 38。
Wormit A,USADEL B.果胶甲基酯酶抑制剂(PMEIS)的多方面作用。int j mol sci。2018; 19(10):2878。
- 39。
马Q-H。咖啡酸3- o -甲基转移酶在抗倒伏差异小麦基因型中的表达中国农业科学。2009;60(9):2763-71。
- 40。
王M,朱X,王k,鲁c,罗m,山t,张z.小麦咖啡酸3-o-甲基转移酶tacomt-3d对抗尖锐眼镜疾病和茎机械强度造成耐受抗性。SCI批准。2018; 8(1):1-14。
- 41。
李俊,周伟,Francisco P,黄锐,张东,Smith SM。麦芽糖对拟南芥叶绿体β-淀粉酶BAM3的抑制表明了一种控制暂时性叶片淀粉流动的机制。《公共科学图书馆•综合》。2017;12 (2):e0172504。
- 42。
Bu R,Wang R,Wei Q,Hu H,Sun H,Song P,Yu Y,Liu Q,Zheng Z,Li T.使用新建立的病毒诱导基因的甘油-3-磷酸酰基转移酶6(GPAT6)基因的沉默黄瓜中的沉默(Vigs)系统可缓解由肉桂酸(CA)模仿的自诱毒性。植物土壤。2019; 438(1-2):329-46。
- 43。
王X,guan y,张d,dong x,tian l,qu lq。β-酮酰基-CoA合酶参与水稻叶子切割蜡合成,并且需要Cer 2样蛋白作为辅因子。植物理性。2017; 173(2):944-55。
- 44。
Farrow Sc,Facchini PJ。植物代谢中2-氧代摩洛盐/ Fe(II)依赖性二恶英酶的功能多样性。前植物SCI。2014; 5:524。
- 45。
Renault H, El Amrani A, Palanivelu R, Updegraff EP, Yu A, Renou J-P, Preuss D, Bouchereau A, Deleu C. GABA accumulation causes cell elongation defects and a decrease in expression of genes encoding secreted and cell wall-related proteins in Arabidopsis thaliana. Plant Cell Physiol. 2011;52(5):894–908.
- 46。
朱永强,徐克新,罗波,王建伟,陈晓宇。一种atp结合的盒式转运体GhWBC1,来自于棉纤维的伸长。植物杂志。2003;133(2):580 - 8。
- 47。
Vanous A,Gardner C,Blanco M,Martin-Schwarze A,Lipka AE,Flint-Garcia S,Bohn M,Edwards J,LübberstedtT.玉米种质增强的开花和高度特质的关联映射加倍(Gem-DH)线条。植物基因组。2018; 11(2)。https://doi.org/10.3835/plantgenome2017.09.0083.
- 48。
黄益,郭啊,张F,王Z,王H,王F,李德,茂D,栾S. 9-CIS-环氧萘二氧化酶3调节植物生长,增强水稻中多生物胁迫耐受性。前植物SCI。2018; 9:162。
- 49。
Iwamoto M,Baba-Kasai A,Kiyota S,Hara N,Takano M. ACO1,氨基环丙烷-1-羧酸盐氧化酶的基因:对水稻标题阶段的节间伸长作用。植物细胞环境。2010; 33(5):805-15。
- 50。
郑米,王Y,刘X,Sun J,Wang Y,Xu Y,LV J,Long W,Zhu X,Guo X.稻米仔细的1(RML1)基因,编码核糖体大亚基蛋白L3b,调节叶片稻米的形态和植物建筑。J Exp Bot。2016; 67(11):3457-69。
- 51。
Otani M, Meguro S, Gondaira H, Hayashi M, Saito M, Han D-S, Inthima P, Supaibulwatana K, Mori S, Jikumaru Y. Overexpression of the gibberellin 2-oxidase gene from Torenia fournieri induces dwarf phenotypes in the liliaceous monocotyledon Tricyrtis sp. J Plant Physiol. 2013;170(16):1416–23.
- 52。
律师SJ,WYCH HM,XU D,Kundu S,Tomes DT。玉米Della蛋白矮化植物8和矮化植物9作为植物开发的调节剂。植物细胞生理。2010; 51(11):1854-68。
- 53。
刘C,王继,黄T,王F,元F,Cheng X,张Y,Shi S,Wu J,Liu K.Della蛋白的vhynp基序中的畸形突变导致芸苔的半矮突变体表型插口。Al Appl Genet。2010; 121(2):249-58。
- 54。
Ma y,xue h,张l,张f,ou c,王f,张z.植物素和芸苔类固醇中的嗜肝和芸苔类固体术(Malus×dibustaa)的参与。SCI REP。2016; 6:26719。
- 55。
Park MH,Suzuki Y,Chono M,Knox JP,Yamaguchi I. CSAGP1,来自黄瓜胚囊的嗜酸甘油蛋白响应基因,编码经典的阿拉伯乳酰胺蛋白,涉及干伸长率。植物理性。2003; 131(3):1450-9。
- 56.
李Y,唐D,Li L,Zhao X,Lin J,Liu X.植物身材与植物状相关的受体Kinanse2(PSRK2)作为确定水稻中吉布林素响应的茎伸长的因素。Biosci。2018; 82(11):1931-41。
- 57.
Wang Z-Y,Seto H,Fujioka S,Yoshida S,Chory J.Bri1是植物类固醇等离子体膜受体的关键组成部分。自然。2001; 410(6826):380。
- 58.
生长控制:油菜素内酯活性得到背景。中国生物医学工程学报。2015;66(4):1123-32。
- 59.
Unterholzner SJ,Rozhon W,Papacek M,Ciomas J,Lange T,Kugler Kg,Mayer Kf,Sieberer T,Poppenberger B. Brassinesteroids是拟南芥中吉布林素生物合成的母稳态因素。植物细胞。2015; 27(8):2261-72。
- 60。
最佳NB,Hartwig T,Budka J,Fujioka S,Johal G,Schulz B,Dilkes BP。Nana Plant2编码了拟南芥芸苔类化合物生物合成基因Dwarf1的玉米矫形器,鉴定了芸苔类固醇和赤霉素之间的发育相互作用。植物理性。2016; 171(4):2633-47。
- 61。
MA L,Li G.避免避免响应期间的依赖于依赖的细胞伸长率。前植物SCI。2019; 10:914。
- 62。
Le B,Nawaz Ma,Rehman HM,Le T,Yang Sh,Golokhvast Ks,Son E,Chung G.在大豆和常见豆中养蛋响应因子(ARF)基因家族的基因组宽表征和表达模式。基因基因组学。2016; 38(12):1165-78。
- 63。
Reed JW,Wu M-F,Reeves ph,Hodgens C,Yadav V,Hayes S,Pierik R.三种式助长响应因子促进缺口伸长率。植物理性。2018; 178(2):864-75。
- 64。
Steindler C,Matteucci A,Sessa G,Weimar T,Ohgishi M,Aoyama T,Morelli G,Ruberti I. Shade避免响应是由ATHB-2 HD-ZIP蛋白介导的基因表达的负调节剂。发展。1999; 126(19):4235-45。
- 65。
Turchi L,Baima S,Morelli G,Ruberti I. HD-ZIP II和III转录因子的相互作用在疾病调节的植物开发中。J Exp Bot。2015; 66(16):5043-53。
- 66。
Scherer GF,Labusch C,Effendi Y.磷脂酶和AUXIN信号转导的ABP1和TIR1作为两个受体:全面和挑衅的模型。前植物SCI。2012; 3:56。
- 67。
Lee Hy,Bahn Sc,Kang Y-M,Lee Kh,Kim Hj,Noh Ek,Palta JP,Shin JS,Ryu SB。分泌低分子量磷脂酶A2在拟南芥中起在细胞伸长和射碎中的重要作用。植物细胞。2003; 15(9):1990-2002。
- 68。
李维琪LY,徐龙Z,传球局促进植物根伸长率及其应用;2013年。
- 69。
Azpiroz r,wu y,Locascio JC,Feldmann Ka。拟南芥芸苔类固醇蛋白依赖于细胞伸长率。植物细胞。1998; 10(2):219-30。
- 70。
Heyn A.细胞伸长的生理学。BOT Rev. 1940; 6(10):515。
- 71。
Ivakov A,Flis A,Apelt F,FünfgeldM,Scherer U,STITT M,Kragler F,Vissenberg K,Person S,Suslov D.纤维素合成和细胞膨胀由生长拟南芥缺点的不同机制调节。植物细胞。2017; 29(6):1305-15。
- 72。
Nawaz Ma,Lin X,Chan T-F,Imtiaz M,Rehman HM,Ali Ma,Banoch Fs,Atif Rm,Yang Sh,Chung G.在拒仅诊断中的纤维素合酶A(CESA)基因家族的表征。生物摄影群。2019; 57(2):248-72。
- 73。
秦克,刘开,李继,齐y,高z,张x,yi x,潘h,明r,徐y。石榴内外种子涂层中代谢产物积累模式的多样性:探索其与遗传机制的关系种子涂层发育。园艺res。2020; 7(1):1-14。
- 74。
Huis R,Morreel K,Fliniaux O,Lucau-Danila A,FénartS,Grec S,中介带G,Chabbert B,Mesnard F,Boerjan W.自然拮抗剂与亚麻茎中的广泛寡核苷醇积累有关。植物理性。2012; 158(4):1893-915。
- 75。
Lee Si,Muthusamy M,Nawaz Ma,Hong JK,Lim M-H,Kim Ja,Jeong M-J。芸苔属rati中的天空血雄性基因表达模式对花器官发育的基因组分析。Mol Genet基因组。2019; 294(6):1403-20。
- 76。
陈L,吴Q,他W,他,吴Q,苗Y.副转录组组合和代谢物分析对镰刀虫镰刀菌的常见豆响应。sp。phopololi感染。int j mol sci。2019; 20(24):6278。
- 77。
庄H,娄Q,刘H,韩H,王Q,唐Z,MA y,王H.副转录组组合揭示的绿色和紫色萝卜中的花青素差异调节。int j mol sci。2019; 20(18):4387。
- 78。
陈Q,韩义,刘H,王X,Sun J,Sun J,Zhao B,Li W,Tian J,Liang Y,Yan J.基因组 - 范围协会分析揭示了替代拼接在多样化基因功能中的重要性和调控表型变异的重要性玉米。植物细胞。2018; 30(7):1404-23。
- 79。
Kim D,Paggi JM,Park C,Bennett C,Salzberg SL。基于图的基因组对齐和基因分型与Hisat2和Hisat-基因型。NAT BIOTECHNOL。2019; 37(8):907-15。
- 80。
凝胶B, Serra e核型绘图仪:一个R/生物导体包,绘制可定制的基因组显示任意数据。生物信息学。2017;33(19):3088 - 90。
- 81。
ThorvaldsdóttirH,罗宾逊JT,Mesirov JP。综合基因组学观察(IGV):高性能基因组学数据可视化和探索。简短生物形式。2013; 14(2):178-92。
- 82。
Kanehisa M, Goto S, Kawashima S, Okuno Y, Hattori M. KEGG资源解码的基因组。核酸学报2004;32(sup1): D277-80。
- 83。
Ashburner M,球,Blake Ja,Botstein D,Butler H,Cherry JM,Davis AP,Dolinski K,Dwight SS,EPPIG JT等人。基因本体:生物学统一的工具。NAT Genet。2000; 25(1):25。
- 84。
Tatusov RL,Galperin My,Natale da,Koonin EV。COG数据库:蛋白质功能和演化的Fenome级分析工具。核酸RES。2000; 28(1):33-6。
- 85。
Koonin ev,Fedorova Nd,杰克逊JD,Jacobs Ar,Krylov Dm,Makarova Ks,Mazumder R,Mekhedov SL,Nikolskaya A,Rao BS。完全真核基因组中编码的蛋白质综合进化分类。基因组Biol。2004; 5(2):R7。
- 86。
Altschul SF,Madden TL,SchäfferAA,张J,张Z,米勒W,Lipman DJ。Papped Blast和Psi-Blast:新一代蛋白质数据库搜索程序。核酸RES。1997年; 25(17):3389-402。
- 87。
安德斯S,麦卡锡DJ,陈Y,Okoniewski M,Smyth GK,Huber W,Robinson MD。基于RNA测序数据的基于计数的差异表达分析使用R和BIOCOOM。NAT协议。2013; 8(9):1765。
- 88。
谢C,毛X,黄家,丁Y,吴家,董某,孔L,高G,Li C-Y,Wei L. Kobas 2.0:用于富集途径和疾病的批量识别和鉴定的Web服务器。核酸RES。2011; 39(SUPPLE_2):W316-22。
- 89。
薛锐,吴军,朱震,王磊,王旭,王胜,Blair MW。抗性和易感普通菜豆的差异表达基因(菜豆L.)基因型响应于Fusarium oxysporumF。sp。phopololi..《公共科学图书馆•综合》。2015;10 (6):e0127698。
- 90。
陈立,钟H-y,匡j-f,李j-g,lu w-j,chen j-y。不同实验条件下香蕉果实基因表达的参考基因验证。Planta。2011; 234(2):377。
- 91。
苏伟,袁勇,张丽,蒋勇,甘欣,白勇,彭杰,吴杰,刘勇,林胜。枇茅不同材料表达分析中内参基因的选择。工厂方法。2019;15(1):7。
- 92。
Silvia Sebastiani M,Bagnaresi P,Sestili S,Biselli C,Zechini A,OrrùL,Cattivelli L,Ficcadenti N.转录甜瓜镰刀孢子F.sp。甜瓜种族1.2易受抗性植物中的病理系统。前植物SCI。2017; 8:362。
- 93。
莹,施贤,张某,平加,王某,赵福,崔y,曾X.转录组和代谢组成品在特殊的野生桃树氏菌果实发育和肉体着色中提供了新的洞察力。BMC植物BIOL。2019; 19(1):463。
- 94。
杨X,夏x,张z,nong b,zeng y,吴y,xiong f,张y,梁h,潘y,戴g,邓g,李d。使用pcamp鉴定水稻果皮中的花青素生物合成基因。植物Biotechnol J. 2019; 17(9):1700-2。
致谢
不适用。
资金
本研究受到国家重点研发项目(2018YFD10002,2019YFD1000200),广东科技项目(2019B030316007),科学创新战略 - 高级农业科学研究的专项资金(R2018PY-QY001,R2017PY-QY001,广州国家现代农业产业科技创新中心项目(2018KCZX06)和国家香蕉工业和技术系统项目(CARS-31-01)的R2017PY-JX002)。该资助者在研究设计,数据收集和分析中没有作用,决定发布或准备手稿。
作者信息
隶属关系
贡献
O. S.,C.H.和g.y.构思了研究并设计了实验。G. D.,F.,B.,J.L.和W.H. H.进行了实验。O. S.,C. L.,X.和G. D.参与资金收购。G. D.,C.H.,T. D.,Q.。Y.和H. G.分析了数据。G. D.,M.P.和T.D。参与获得材料。G. D.和O. S.与其他作者的贡献写了稿件。所有作者都已读取并批准了稿件的最终版本。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图1
.Pearson在Wt VS MT Banana Pseudostem重复的相关性。图2.Heatmap在WT VS Banana Pseudostem中的差异表达基因的分层聚类,其中横坐标表示样品名称(WT和MT),并且纵坐标表明差异表达的基因。图3..Kegg浓缩分析WT VS MT Banana Pseudostems的差异表达基因。图4..部分最小二乘歧视性分析。图5..投影分数图中的可变重要性。图6..差分累积代谢物的Heatmap分层聚类。图7..主成分分析(a)差异表达基因和(b)差异累积的代谢物。图8..差异表达基因的相关系数聚类热图和具有Pearson相关系数> 0.8的差异累积代谢物。图9..香蕉茎伸长的转录代谢物相关网络。KEGG路径在每个网络的顶部给出。基因和代谢物id对应于附加表3.和其他表格5., 分别。
附加文件2:表1
:测序输出统计摘要。表2.:从WT和MT Banana Pseudostem映射RNA-SEQ数据的结果。表3:WT VS MT Banana Pseudostem的差异表达基因的完整列表。表4.:所有检测到的代谢物中的所有检测到的代谢物vs msudostem。表5.:WT VS MT Banana Pseudostem中的差异表达代谢物列表。表6.:共同Kegg分析。该列表显示差异调节基因和差异累积代谢物映射到该途径。表7.:用于QRT-PCR的基因的引物序列。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
邓,G.,Bi,F.,Liu,J.等等。转录组和代谢物质分析提供了在香蕉中伪杆伸长率的分子机制的见解。BMC植物BIOL.21,125(2021)。https://doi.org/10.1186/s12870-021-02899-6
收到了:
公认:
发表:
关键词
- 植金蛋白流出载体蛋白质
- 香蕉假司机
- 侏儒症
- 乙烯反应因素
- 赤霉素