抽象的
背景
电极系统II(PSII)是一种高度保守的整体膜多亚基颜料 - 蛋白质复合物。PSII中的蛋白质,颜料,脂质和离子需要精确地组装以确保适当的PSII生物发生。D1是PSII核心反应中心(RC)的主亚基,通常合成为前体D1。D1通过C末端加工蛋白酶CTPA成熟对于PSII组件是必不可少的。然而,到目前为止,还没有明确阐明D1成熟如何影响PSII组件的详细机制。在这项研究中,拟南芥CtpA突变体(atctpa:SALK_056011)缺乏D1成熟过程的缺乏D1成熟过程,以研究更多细节在PSII组件上的这种过程的功能。
结果
没有前体D1的c端加工,PSII组装,包括PSII单体、二聚体,特别是PSII超配合物(PSII SCs),如之前报道的那样,很大程度上受到损害。通过BN-2D-SDS PAGE进行Western blotting检测发现,虽然PSII核心蛋白D2、CP43和CP47的组装受到D1成熟过程缺失的影响,但CP43的加入受到的影响最大,这表明CP43在PSII SCs中的组装效率降低最大。此外,与成熟D1和CP43共转化的酵母细胞相比,与pD1和CP43共转化的酵母细胞生长较慢,证实D1 c端尾部的存在,阻碍了D1与CP43的相互作用效率。说明D1成熟过程对PSII组装和生物健康生长的生理重要性。
结论
淘汰赛Arabidopsis atctpa.突变体是研究D1成熟和PSII SCS组件之间意外链接的良好材料。D1成熟的损失主要影响Psii核心蛋白Cp43,内部天线结合蛋白的掺入,其在LHCII复合物的结合期间在PSII SC的形成期间在PSII二聚体中起作用。我们的调查结果提供了D1成熟在高等工厂中PSII SCS组件期间D1成熟的作用的详细支持。
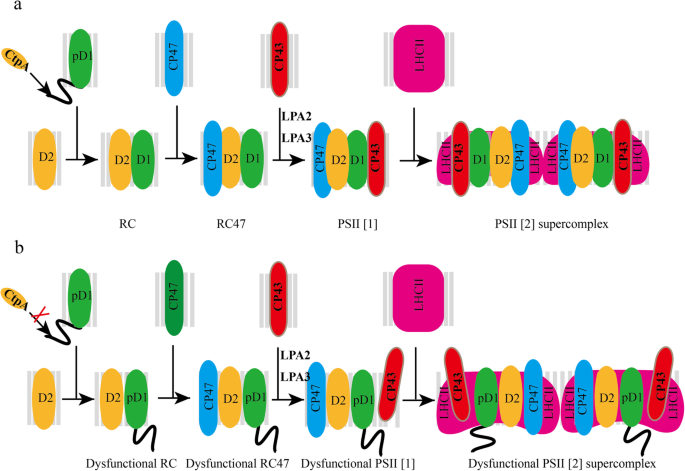
背景
光合作用利用阳光来吸化二氧化碳,生产几乎所有生命都必须的生物量。光合作用的初始步骤是PSII催化的水塑醌氧化氧化氧化。PSII是一种高度保守的整体膜多亚基颜料 - 蛋白质复合物,在蓝藻,藻类和植物中发现。PSII组分包括核心蛋白,低分子量(LMM)蛋白,外部氧化复合物(OEC)蛋白,以及光收获复合物(LHC)蛋白[1,2,3.,4,5,6].为了确保适当的psii生物发生,至少20种不同的亚基蛋白,以及不同的颜料,脂质和离子需要精确地组装[7].PSII在高等植物中的DE Novo组装是流量:首先组装由D1,D2,PSBE,PSBF和PSBI组成的核心“反应中心”(RC)复合物。随后,CP47模块随着内天线蛋白CP47和LMM蛋白的附着而组装,例如PSBH,PSBM,PSBT,PSBR,RC。接下来,随着CP43,OEC蛋白和LMM蛋白如PSBK,PSBW,PSBZ,RC47复合物的后续结合,转化为PSII核心单体。后来,随着PSII单体的二聚化和LHCII的附着,形成PSII-LHCII超复合物[7,8,9,10.,11.,12.].
D1蛋白,由叶绿体基因编码PSBA.,是PSII的核心亚基,涉及PSII光局部和修复周期。PSII修复是叶绿体免受过度照明引起的损伤的保护机制。在此过程中,最常损坏的D1劣化并用新副本替换为形成新的RC [13.].虽然小PSBA.基因家族中存在3 ~ 4个基因拷贝,D1蛋白是由单个基因编码的PSBA.塑料中的基因[14.,15.].所有光合生物体均以C末端的各种长度延长为前体形式(PD1)作为前体形式(PD1)。D1的成熟形式是Mn的先决条件4曹5簇形成和外部蛋白质与psii的结合[16.].
在RC复合物形成过程中,pD1的c端延伸被c端加工蛋白酶(CtpA)加工,生成成熟的D1。CtpA是一种丝氨酸内肽酶,具有丝氨酸/赖氨酸催化二联体[17.,18.,19.].在SyneChocystis PCC 6803.在美国,已经发现了三个Ctp同源物(CtpA、CtpB和CtpC),只有CtpA可以裂解pD1的c端延伸。SyneChocystis PCC 6803.缺乏pD1 c端加工的突变体更容易受到光损伤[20.,21.].符合SyneChocystis PCC 6803.,三个假定的CtpA同系物(At4g17740, At3g57680, At5g46390)也在拟南芥.损失功能ctpa.导致PSII活性和氧气演化受损[16.,22.].D1蛋白的成熟形态缺失,其他PSII核心蛋白的丰度降低Arabidopsis atctpa.缺乏D1成熟过程的突变体[23.].基于分歧,需要进一步探索D1成熟的分子功能。
在本研究中,我们从actpa.null突变体拟南芥蒂利亚纳并更详细地研究了D1成熟在PSII组装过程中的作用。我们的结果表明,成熟D1蛋白的缺失导致PSII SCs的组装受损,这是由RC复合物的异常组装引起的,特别是CP43亚基的异常组装,揭示了D1成熟过程在PSII SCs组装过程中独特而重要的功能。
结果
CTPA的损失导致PD1的积累拟南芥
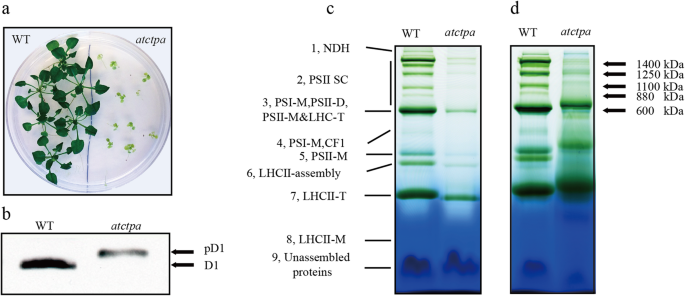
我们之前的工作表明,PD1蛋白不能在没有CTPA功能的情况下加工成熟的D1蛋白[23.].进一步研究D1成熟过程的生理作用,先前使用的拟南芥本文分别插入突变体atctpa.(AT4G17740,Salk_056011)在我们目前的研究中使用了D1成熟过程。4周龄atctpa.与WT相比,在生长条件下,突变体在生长条件下表现出广泛的缺陷,包括发育不良的生长和黄叶(图。1一种)。接下来,我们确认了D1蛋白的形式atctpa.突变和WT蛋白质印迹。结果表明,只有PD1形式被检测到atctpa.突变体,而WT中存在的D1蛋白是成熟的形式(图。1一种)。所有这些结果与上一份报告一致[23.].基于此,我们认为atctpa.突变体是研究D1成熟在PSII组装中的作用的理想材料拟南芥.
描述的atctpa.突变体。一个wt和atctpa.在16小时光/ 8小时暗循环和20μmol光子的条件下,在1/2 ms培养基上生长3.0%蔗糖4周- 2 s- 1光周期期间的光强度。bD1蛋白的免疫斑分析。从wt和wt中分离蛋白质蛋白质atctpa.突变植物。加载5μg叶绿素并随后用D1抗体免疫。C,DWT和HAKOID膜复合物的蓝色本地凝胶分析(BN-PAGE)atctpa.突变体基于相同的鲜重c和等同的叶绿素(CHL)d.NDH、NADPH脱氢酶复合物;PSII SCs、PSII- lhcii超配合物;PSI-M PSI单体;PSII-D PSII二聚体;PSII-M PSII单体;CF1:腺苷三磷酸酶复杂;LHCII-T LHCII三聚;LHCII-M, LHCII单体
PSII SCS的组装是不成熟D1的异常
D1蛋白的C末端加工对于青霉菌和高等植物中的PSII组装是必不可少的拟南芥[17.,20.,21.,23.,24.];然而,尚未明确阐明关于PSII组装,特别是在高等植物中的D1成熟过程功能的机制。为了更详细地研究D1成熟功能,通过使用WT和使用WT的蓝色天然凝胶分析检查具有和不具有D1成熟过程的类囊体膜复合物的组装状态。atctpa.突变体,然后进行定量分析。结果表明,除了PSII单体和二聚体存在组装缺陷外,这与之前的研究结果一致[17.,20.,24.]发现PSII SCS的显着降低atctpa.突变体与WT相比,根据两种分析,基于相等的新鲜称重(图。1c)或相同的叶绿素(图。1d)。
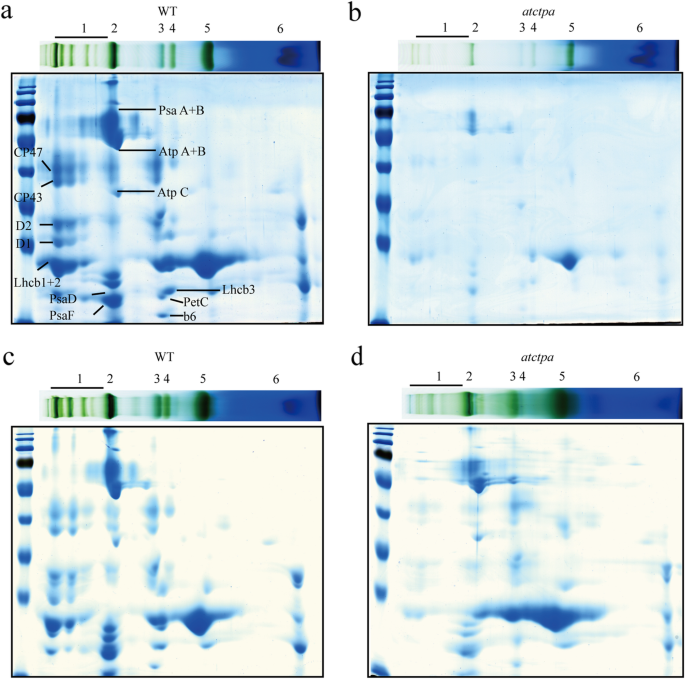
为进一步评估缺乏D1成熟过程的PSII SCs组装缺陷,对蓝色天然凝胶片进行2D SDS- PAGE双向电泳和CBB染色。如图所示,与PSII SCs组装缺陷一致。1c、d, D1 (PsbA)、D2 (PsbD)、CP43 (PsbC)、CP47 (PsbB)在PSII SCs中的组装效率显著降低atctpa.与WT相比的突变体,当基于相等的鲜重进行分析时(图。2a,b)或等同的叶绿素(图。2C,D)。
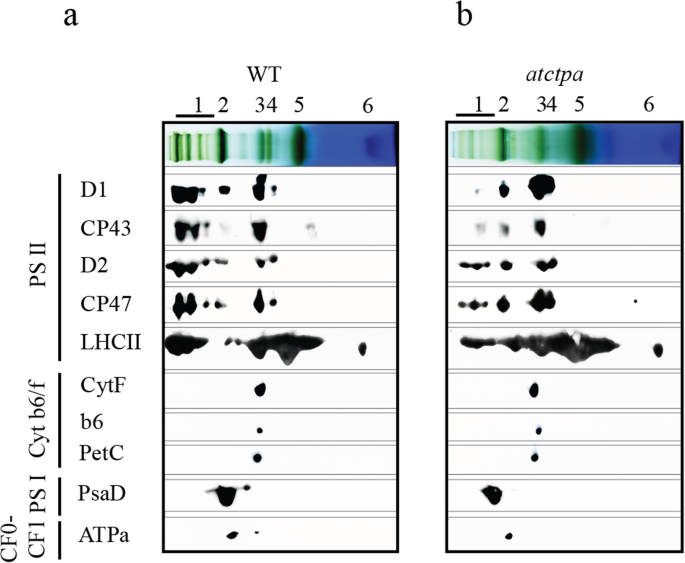
为了确认上面观察到的更改,执行了2D-SDS-PAGE之后的免疫印迹。始终如一地,PSII主亚单元的组装效率的变化与图2所示相同。2.作为对照,细胞色素b的组装6/f复合物(Cyt b6/ f),psi和cfocf1根据在等同叶绿素的基础上进行的分析,复杂亚基保持不变(图。3.a,b)。结果是使用在不同温室种植的植物具有相同的生长环境(图S1a, b和Tab。年代1).
成熟D1流程损失通过损害CP43组装来扰乱PSII SCS组件
正如我们之前提到的那样,PSII SCS组装是一个良好的组织和顺序过程,涉及精确的蛋白质 - 蛋白质相互作用和许多辅助蛋白的援助[7].为了解PSII核心亚基和缺失pD1 c末端的LHCII蛋白的组装模式,利用ImageJ (https://imagej.nih.gov/ij/) (桌子1).蓝色天然凝胶分析分为六个部分:泳道1,psii scs;泳道2,PSI单体(PSI-M),PSII二聚体(PSII-D)和PSII单体(PSII-M)与LHCII三聚体(LHCII-T)结合;泳道3,psii-m和cyt b6/F;泳道4,LHCII组装,PSII核心缺乏CP43;泳道5,LHCII-T;泳道6,LHCII单体(LHCII-M)。结果,PD1可以几乎不能组装到PSII SC中而没有PD1的C末端加工,并且主要累积在PSII-M和RC47中(分别在PSII-M和RC47中的分布比为49.63和30.42%)(表1).有趣的是,在其他PSII核心蛋白中,仅CP43显示了类似的组装图案作为PD1,而D2和CP47可以在PSII SC中保持一定水平的组件,尽管与WT中的组装效率较低。
因此,LHCII的组装效率显示出与CP43相似的趋势,PSII SCs的积累较少,并且在LHCII-T中的增加。在PSII de Novo组件期间,D1将D2结合到D2,然后插入CP47以形成RC47复合物。只有在插入CP47之后,CP43可以以正确的方式插入以形成PSII RC复合体[7,8,9,10.].综上所述,pD1的c端存在主要影响CP43的组装,这导致LHCII蛋白组装形成PSII SCs的效率较低,因为LHCII复合物主要通过天线结合蛋白与PSII二聚体复合物结合,如CP43 [27.].
D1成熟过程的丧失阻碍了D1与酵母 - 两个杂化分析表明的D2和CP43的相互作用
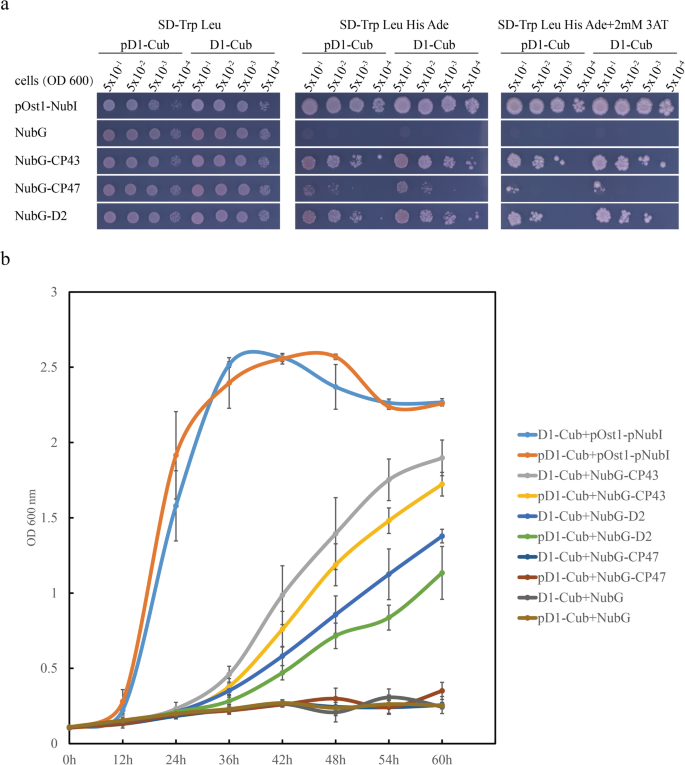
为了确认我们上面提到的假设,我们使用了交配的酵母分裂泛素系统,其可以识别积分(囊体)膜蛋白之间的蛋白质 - 蛋白质相互作用[28.来检测D1与PSII其他核心亚基之间的互作效率是否受c端影响。采用全长成熟D1(氨基酸1-344)和pD1(氨基酸1-353)作为诱饵,全长D2、CP43和CP47作为猎物。结果表明,虽然成熟D1和pD1均可与CP43和D2互作,但D1 / pD1与D2的互作效率低于与CP43的互作效率,说明成熟D1 / pD1与CP43的结合强于与D2的结合(图2)。4一种)。此外,表达成熟D1和CP43 / D2的酵母细胞比表达PD1和CP43 / D2的合成定义的(SD)培养基的CP43 / D2的酵母细胞增长得更快,缺乏TRP,Leu,他和腺嘌呤(SD-TRP Leu His Ade)(无花果。4a),表明PD1的C末端的存在阻碍了D1与CP43 / D2的相互作用。为了鉴定与上述基因的转化酵母细胞中的差异更清楚,我们接下来监测转化的酵母细胞的生长曲线,如图2所示。4B和标签。年代2.实际上,具有PD1的转化酵母细胞的生长速率比用成熟D1转化的转化酵母细胞的生长速率较慢,确认没有D1成熟过程的受影响的相互作用效率。
PD1的C末端延伸阻碍了D1与酵母双杂化分析中RC复合蛋白的相互作用。一个成熟D1 / pD1与RC复合物蛋白互作的酵母双杂交分析。将表达不同NubG-X (CP43, CP47和D2)结构的D1-Cub或pD1-Cub酵母细胞培养至对数期(OD)600= 0.5),并在SD-TRP-Leu板上发现5μl部分的串联稀释液,并在SD-TRP-Leu-His-Ade板上没有或2mm 3-AT,并在30℃下孵育2天。使用Pds1-NX载体作为阴性对照,NUBI被用作阳性对照。b含有30μg/ mL卡那胺的SD-TRP-Leu-His-Ade液体培养基中培养的酵母菌株的生长曲线。将细胞在30℃下以200rpm生长,用于指定的时间。标签显示统计分析。年代2.不同的字母表示不同的值之间的显着差异。邓肯的多个范围测试,p≤0.05,n = 6
讨论
在蓝杆菌中SyneChocystus 6803.,去除PD1的C末端尾部是锰簇组装的粗遗传术,这对于一个完全官能的PSII复杂是必不可少的[10.,17.,29.].还指出,D1成熟过程对于将PSII外本蛋白结合到PSII中是必要的[16.].然而,在高等植物中丧失D1成熟过程引起的缺陷并不与上述完全相同。在atctpa.突变体,其D1成熟过程丧失,尽管水氧化锰簇变得具有氧气进化的缺氧减少表明的功能失调,但外蛋白(PSBO,PSBP和PSBQ)的结合不受影响[23.].最明显的变化是PSII SCs组装的减少(图2)。1,2),在蓝藻中不存在SyneChocystis.PCC 6803 sp。
PSII是一个多亚单元复合体,其装配是一个精确控制的顺序过程。如图所示。5,PD1与PSII引发复合物相互作用,该粘合复合物包含D2以形成PSII最小RC复合物。稍后,招募CP47以形成PSII RC47复合物。然后组装CP43以产生PSII单体,并且PSII二聚体形成为PSII单体的二聚化[7].在血管植物中,PSII主外周天线蛋白形成LHCII三聚体,其通过与PSII核心蛋白的关联以强烈或中等界定的方式借助于次要的LHCII物种(CP24,CP26和CP29)与PSII二聚体结合CP43 / CP47 [24.,30.,31.].
它指出,PD1可以与D2-CYT B559复合物相互作用以形成D1-D2复合物,而CP47和CP43在PD1的C末端处理之后结合到D1-D2复合物中[12.].始终如一地,我们还发现,D2的有效组装不受PD1的存在影响。但是,CP43的有效组装显然是影响。有趣的是,尽管在CP47的适当组装之后仅发生CP43的插入时,CP47的组装并不多大于D1成熟的影响(图。3.、表1和图.. s1选项卡。年代1).这是可解释的,因为CP47定位于D2,而CP43根据PSII SCS结构定位为D1 [27.,32.,33.,34.].此外,无花果。4与成熟D1和CP43之间的PD1和CP43的较低的相互作用效率进行了比较,与用PD1和CP43共转化的酵母细胞的较慢生长速率表示,与用成熟D1和CP43共转化的酵母细胞的较慢生长速率。总的来说,这些数据表明,没有D1成熟的PSII SCs的有缺陷组装主要由CP43的令人不安的高效组装引起,从而影响随后的PSII SCS组装过程。例如,将LHCII的差异与PSII二聚体的关联(图。3.、表1和图.. s1选项卡。年代1),其与PSII的关联主要涉及内触角蛋白,如高等植物中的CP43 [27.,35.].另外,作为PSII缺乏的二次效果,降低了PSI组分和ATPα水平(图。3.).
已经获得了许多信息,关于CP43与PSII RC复合物的结合。两个研究的CP43装配因子是低PSII积累2(LPA2)和低PSII积累3(LPA3)[36.,37.].LPA2是一个小的固有类囊体膜蛋白,而LPA3没有跨膜结构域。虽然它们不同源,但它们被鉴定为通过与类囊体膜蛋白Albino 3(一种cpSRP转位酶)的相互作用来协助CP43进入PSII。我们的研究结果表明,pD1的c端加工蛋白酶AtCtpA也在CP43有效融入PSII SCs中发挥重要作用。从当前工作中总结出的D1成熟工艺功能方案如图所示。5: pD1与D2-cyt b559配合物结合形成RC配合物,RC配合物由pD1、D2、PsbE、PsbF和PsbI组成。在RC复合物形成过程中,pD1在其c端被AtCtpA延伸,生成成熟的D1。在D1未成熟的情况下,虽然对内天线蛋白CP47的结合影响不大,但形成的RC47复合物功能失调。接下来,CP43以低得多的组装效率插入到功能失调性RC47复合物中,形成功能失调性单体PSII (PSII [1])。最后,功能失调PSII [1]形成功能障碍二聚体psii(psii [2])。在此过程中,PD1的C-Terminus延伸将改变PD1-RC47复合物的空间构象,其影响CP43的正确组装和随后的其他亚基组装。除此之外,PSII SCS亚基的关联由于PD1的存在而变得松散地变得松散,这导致在洗涤剂存在下的囊膜膜隔离和溶解过程中从PSII SCS的某些亚基的更容易地脱离,这包括减少psii scsatctpa.我们发现的突变体(图。2,3.,4和表格1).
结论
通过使用该细节的更多详细研究PSII SCS组装atctpa.缺乏PD1的C末端加工过程的突变体,我们发现PSII SCS组件中的缺陷由D1成熟的损失引起的主要位于PSII核心蛋白CP43,内部天线结合蛋白的缺乏掺入中PSII SCS形成过程中LHCII复合物与PSII二聚体的关系。我们的发现表示D1成熟过程如何在高等工厂中PSII SCS组装过程中的功能。
方法
植物材料和生长条件
拟南芥(Columbia-0)和T-DNA插入突变株(SALK_056011, locus At4g17740)拟南芥资源中心(哥伦布,哦)。在16小时光/ 8h暗循环的条件下含有3.0%蔗糖(pH5.7)的1/2 ms培养基中的1/2 ms培养基中生长4周,20μmol光子m- 2 s- 1光周期期间的光强度。
蓝色本机PAGE和2D SDS-PAGE
分别从50株野生型和50株野生型中提取叶绿体atctpa.- 植物。如前所述进行蓝色天然凝胶电泳[25.,38.].对于2D SDS-PAGE,用剃刀刀片切除蓝色天然凝胶泳道,并在75℃下孵育2×SDS样品缓冲液20分钟,然后在75℃下孵育20分钟。在25°C下20分钟。将具有变性蛋白质的泳道置于12%SDS凝胶的顶部,然后进行第二尺寸分离。
免疫印迹分析
对于免疫印迹,在12%SDS凝胶上分离蛋白质样品并转移到硝化纤维素膜(Biotrace TM Nitrocellulose,Mexico),然后进行Western印迹分析。在用5%牛奶封闭后,随后将膜与针对所指示的蛋白产生的一抗孵育,并使用Super Simply TM West Pico Plus化学发光底物试剂盒(Thermo Scientific,USA)检测。
酵母双杂交测定和生长曲线分析
酵母双杂交试验使用分裂泛素系统(DUAL membrane, Dualsystems Biotech)进行,如前所述[39.,40].将成熟氨基酸D1(氨基酸1-344)和pD1(氨基酸1-353)克隆到编码Cub-LexA-VP16片段的pCCW-STE载体中,作为相互作用的诱饵。将CP43、CP47和D2克隆到pDSL-Nx载体(编码NubG片段)中进行检测。酵母菌株NMY32分别与诱饵和猎物结构体共转化。用不含或含2 mM 3-氨基- 1,2,4 -三唑(3-AT)的合成定义(SD)培养基(SD-Trp Leu His Ade, FunGenome)测定酵母细胞在琼脂平板上的相互作用。在600 nM (OD)处测定吸光度,得到液体培养酵母细胞的生长曲线600).每种转化的六种菌落在SD-TRP Leu含有30μg/ ml卡那胺的ADE培养基中培养。od.600在不同的时间点记录值。使用Pds1-NX载体作为阴性对照,NUBI被用作阳性对照。
统计分析
imagej(https://imagej.nih.gov/ij/)来确定PSII亚基在不同亚配合物中的分布比例。
可用性数据和材料
本研究中产生或分析的所有数据都包含在本文及其补充材料中。在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。本研究中使用的生物材料可从合理的请求后从相应的作者获得。
缩写
- LHCII:
-
聚光复合物
- LHCII-M:
-
LHC单体
- lhcii-t:
-
LHCII三角形
- LMM:
-
低分子量亚基
- 描述:
-
Oxygen-evolving复杂
- PSI:
-
光系统I
- psii:
-
拍照II
- psii scs:
-
Psii超级复合物
- psii-d:
-
psii二聚体
- PSII-M:
-
Psii单体
- PSI-M:
-
PSI单体
- RC:
-
反应中心
参考文献
- 1。
Kashino Y,Lauber Wm,Carroll Ja,Wang Q,Whitmarsh J,Satoh K,Pakrasi HB。高活跃的光学系统II蛋白质组学分析来自蓝藻的制备Synechocystis sp. PCC 6803揭示了新型多肽的存在。生物化学。2002; 41(25):8004-12。
- 2。
刘Z,闫H,王k,kuang t,张j,gui l,x,chang w.菠菜主要光收获复合物的晶体结构2.72分辨率。自然。2004; 428(6980):287-92。
- 3.
Aro Em,Suorsa M,Rokka A,Allahverdiyeva Y,Paakkarinen V,Saleem A,Battchikova N,RINTAMAKI E.照相系统II的动态:蛋白质蛋白复合物的蛋白质组学方法。J Exp Bot。2005; 56(411):347-56。
- 4.
Nield J,Barber J.更高等植物照相系统II超复杂结构模型的改进。Biochim Biophys Acta。2006; 1757(5-6):353-61。
- 5。
陈志强,陈志强,陈志强,等。光系统II的晶体结构及其光学性质。物理学报。2011;37(4):451 - 457。
- 6。
Suga M,Akita F,Hirata K,Ueno G,Murakami H,Nakajima Y,Shimizu T,Yamashita K,Yamamoto M,以前H,等。通过Femtosecond X射线脉冲观看的光学系统II的本机结构。自然。2015; 517(7532):99-103。
- 7。
Nickelsen J,Rengstl B. Photosystem II组装:从Cyanobacteria到植物。Annu Rev植物Biol。2013; 64:609-35。
- 8。
NanBa O,Satoh K.分离由D-1和D-2多肽和细胞色素B-559组成的光系统II反应中心。Proc Natl Acad Sci U S A. 1987; 84(1):109-12。
- 9。
rokka a,suorsa m,saleem a,battchikova n,aro em。囊体蛋白复合物的合成与组装:光学系统II的多重组装步骤。Biochem J. 2005; 388(PT 1):159-68。
- 10。
尼克松PJ,Michoux F,Yu J,Boehm M,Komenda J。最近的进展了解光照系统II的装配和修复。Ann Bot。2010; 106(1):1-16。
- 11.
Komenda J,Knoppova J,Kopecna J,Sobotka R,Halada P,Yu J,Nickelsen J,Boehm M,Nixon PJ。PSB27组装因子与蓝藻光系统II的CP43复合物结合Synechocystis sp. PCC 6803.植物理性。2012; 158(1):476-86。
- 12.
柯曼达,索博特卡,尼克松。在叶绿体和蓝藻中组装和维持光系统II复合体。植物学报。2012;15(3):245-51。
- 13。
Mulo P,Sakurai I,Aro Em。青霉菌,绿藻和高等植物中PSBA基因表达的策略:从转录到PSII修复。Biochim Biophys Acta。2012; 1817(1):247-57。
- 14。
来自甘蓝和烟草的M(r) 32,000类囊体膜蛋白基因的核苷酸序列预测了一个完全保守的M(r) 38,950的初级翻译产物。中国科学(d辑:地球科学)1982;79(24):7699-703。
- 15.
Curtis Se,Haselkorn R.来自蓝藻的32kD囊膜膜蛋白基因家族的两个成员的分离,序列和表达Anabaena 7120..植物mol biol。1984; 3(4):249-58。
- 16。
罗斯JL,Pakrasi HB。证据表明,D1处理需要锰结合和外部蛋白组装到照射系统II中。J Biol Chem。2004; 279(44):45417-22。
- 17。
Anbudurai Pr,Mor Ts,Ohad I,Shestakov SV,Pakrasi HB。CTPA基因编码光束II反应中心复合物的D1蛋白的C末端加工蛋白酶。Proc Natl Acad Sci U S A. 1994; 91(17):8082-6。
- 18。
前体D1蛋白羧基末端加工蛋白酶的过表达及其特性:分子环境对酶-底物相互作用的调控。生物化学学报。2001;276(10):7518-25。
- 19。
Lu Y.照片系统II集装,稳定性和修复因素的识别和角色拟南芥.植物科学学报2016;7:168。
- 20。
Ivleva NB, Shestakov SV, Pakrasi HB。光系统II前体D1蛋白的羧基端延伸是蓝藻最佳光合性能的必需条件Synechocystis sp. PCC 6803.植物理性。2000; 124(3):1403-12。
- 21。
类囊体管腔蛋白酶Deg1从光抑制中参与光系统II的修复拟南芥.植物细胞。2007; 19(3):1039-47。
- 22。
Satoh K,Yamamoto Y.光系统II反应中心的前体D1蛋白的羧基末端加工。Photosynth Res。2007; 94(2-3):203-15。
- 23。
Che Y,Fu A,Hou X,McDonald K,Buchanan BB,Huang W,Luan S.反应中心蛋白D1的C末端加工对于照相系统II的功能和组装是必不可少的拟南芥.Proc Natl Acad Sci U S A. 2013; 110(40):16247-52。
- 24。
Komenda J,Kuvikova S,Granvogl B,Eichacker La,Diner Ba,Nixon PJ。残留物Ala352在C末端延伸中的裂解是照相系统II的D1亚基成熟的早期步骤SyneChocystis PCC 6803..Biochim Biophys Acta。2007; 1767(6):829-37。
- 25。
侯晓霞,傅安,王志强,王志强,栾淑芳。PSB27:一种类囊体蛋白的激活拟南芥以适应不断变化的光照强度。中国科学院院刊2015;112(5):1613-8。
- 26。
傅A,HE Z,Cho HS,Lima A,Buchanan BB,Luan S.一种叶绿体环旋蛋白在集装和维护照片中拟南芥蒂利亚纳.中国科学(d辑:地球科学)2007;104(40):15947-52。
- 27。
苏旭,马军,魏旭,曹鹏,张伟,常伟,李敏。植物c2s2m2型PSII-LHCII超配合物的结构与组装机理。科学。2017;357(6353):815 - 20。
- 28。
欧阳明,李旭,张军,冯鹏,蒲辉,孔林,白志荣,徐旭,池伟等:液-液相转变驱动叶绿体内货物分拣。电池学报,2019,40 (6):1143 - 1159 e1120。
- 29。
张丽娟,张丽娟,张丽娟。植物叶绿体编码D1蛋白的合成、膜插入和组装。2月。2002;512(1 - 3):13-8。
- 30。
Caffarri S,Kouril R,Kereiche S,Boekema ej,Croce R.高等植物照相系统II超级复杂的功能架构。Embo J. 2009; 28(19):3052-63。
- 31。
潘晓霞,李敏,万涛,王丽,贾超,侯志刚,赵旭,张建军,常伟。菠菜光采复合体CP29的能量调控。中国生物医学工程学报。2011;18(3):309-15。
- 32。
曹鹏,苏旭,潘晓霞,刘志强,常伟,李明。植物光系统II超配合物的结构、组装和能量传递。生物物理学报。2018;1859(9):633-44。
- 33。
van bezouwen ls,caffarri s,羽衣甘蓝rs,kouril r,thunnissen awh,Oostergetel gt,Boekema ej。植物照相系统II超复杂的亚基和叶绿素组织。Nat植物。2017; 3:17080。
- 34。
Wei X,Su X,Cao P,Liu X,Chang W,Li M,Zhang X,Liu Z.Pru Z.3.2分辨率的菠菜光照系统II-LHCII Supercople的结构。自然。2016; 534(7605):69-74。
- 35。
植物四吡啶的代谢、结构和功能:叶绿素生物合成的控制机制和叶绿素结合蛋白的分析。Adv Bot res 2019;91: xiii - xii。
- 36。
蔡伟,马建军,迟伟,邹敏,郭军,陆超,张磊。LPA3和LPA2协同作用对光系统II组装的影响拟南芥.植物理性。2010; 154(1):109-20。
- 37。
马军,彭磊,郭军,卢强,卢超,张磊。LPA2是光系统II高效组装所必需的拟南芥蒂利亚纳.植物细胞。2007; 19(6):1980-93。
- 38。
redox-active FKBP-type immunophilin在光系统II超复合物积累中的作用拟南芥蒂利亚纳.Proc Natl Acad SCI U S A. 2006; 103(33):12631-6。
- 39。
基于分裂泛素的遗传系统用于分析体内膜蛋白间相互作用。中国科学(d辑:地球科学)1998;95(9):5187-92。
- 40.
彭L,MA J,Chi W,Guo J,朱S,Lu Q,Lu C,张L.低PSII积累1涉及照相系统II的有效装配拟南芥蒂利亚纳(第18卷,第955页,2006)。植物细胞。2018;30(1):245 - 8。
致谢
我们感谢Aigen Fu博士在稿件修订中的富有洞察力和贡献。
资金
该工作得到了国家重点研究和发展计划(2016YFD0100604)的支持。资金机构在设计的研究,收集,分析和解释方面没有发挥作用,并撰写稿件。
作者信息
隶属关系
贡献
YFC,SL和XH设计了实验,YFS,YFC,YKW和XH进行了实验,YFS起草了稿件,YFC和XH修订了手稿。所有作者阅读并认可的终稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
类囊体膜复合物蛋白在野生型和野生型中的组装状态atctpa.突变体。(a,b)囊体蛋白(15μgchl)wt(a)和atctpa.突变体(B)通过2D BN / SDS-PAGE分离,并如图所示进一步进行免疫印迹。分别使用D1、CP43、D2、CP47、LHCII、CytF、b6、PetC、PsaD、ATPα等特异性抗体对相应蛋白进行免疫检测。标签。S1。WT和WT和HAPIAL MATHAKOID膜蛋白的组装分析atctpa.如图S1所示。如图S1中检查的主要类囊体膜蛋白的组装分析。通过图像J. - ,未检测到。标签。S2。在图2中检查的生长曲线的统计分析。4湾不同的字母表示不同的值之间的显着差异。邓肯的多个范围测试,p≤0.05,n = 6.标签。S3。本研究中使用的引物。红色字母代表酶的消化遗址。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
史勇,车勇,王勇。等等。成熟D1的缺失会导致CP43在体内的组装受损拟南芥蒂利亚纳.BMC植物BIOL.21,106(2021)。https://doi.org/10.1186/s12870-021-02888-9
已收到:
接受:
发表:
关键词
- 前体D1
- 拍照II
- Psii超级复合物
- 反应中心
- ctpa.
- 拟南芥蒂利亚纳