- 研究文章
- 开放存取
- 发布:
濒临灭绝的避税科的OMIC分析Pseudotaxus chienii.揭示了紫杉醇生物合成途径的差异假框图和云南红豆杉树
BMC植物生物学体积21文章编号:104(2021)
抽象的
背景
紫杉醇是一种高效的抗癌药物水松物种。Pseudotaxus chienii.是红豆杉科的一个重要成员,然而,六个紫杉类的水平在P. Chienii.在很大程度上是未知的。
结果
10-DAB、紫杉醇和7-E-PTX的高积累表明P. Chienii.是一种适宜大规模栽培的紫杉醇高产品种。通过组学方法,共检测和注释了3387个代谢物和61,146个unigenes。与代表相比水松树(云南红豆杉),将大部分差异积累的代谢物和差异表达基因划分为10条一级和二级代谢途径。通过比较分析,发现紫杉醇生物合成前体和中间产物的差异P. Chienii.和t将云南.紫杉素样代谢物在P. Chienii.,表明有更广泛的价值P. Chienii.在制药行业。
结论
在我们的研究中,类紫杉的发生P. Chienii.确定了。紫杉醇生物合成途径中涉及的关键基因的差异表达是划紫杉木差异堆积的主要原因。此外,鉴定许多差异表达的转录因子提供了更多税醇生物合成的候选调节因子。我们的研究可能有助于揭示之间的差异假框图和水松树木,促进资源的濒危和利用,很少研究P. Chienii..
背景
紫杉醇(通用名称紫杉醇)及其相关产品已被广泛采用并批准用于各种类型的癌症,包括乳腺,肺,非小细胞肺癌的有效治疗[1].多年来,驯鹿植物的吠声和树枝,水松特别是树木,是天然产物紫杉醇及其衍生物的主要来源[2,3.].随着市场对紫杉醇的需求每年增加,非法伐木继续存在[4].由于过度开发和人类活动,红豆科植物的种群规模正在缩小[5,6].
红杉科是针叶树中最小的科,由6个属组成,其中包括头杉科(amentotaxus.和头孢菌)和四个所谓的“核心”的税后植物(南极洲S假框图,水松和Torreya) [6,7].由于紫杉醇的经济价值,近年来紫杉科树木的研究引起了人们的广泛关注[8].
紫杉醇是超过400个定义的划分赛的经典代表,其中包含独特的紫杉烷骨架[9].不仅有紫杉醇,还有其他一些划分的丁拓表现出有效的抗肿瘤活动[10,11].迄今为止,越来越多的紫杉烷核心的化合物已被分离并在各种避税结构树中鉴定[12].从紫杉全草乙醇提取物中分离得到4个具有较高抗癌活性的紫杉烷衍生物T. Wallichiana.[13].13种紫杉烷二萜的抑制作用t对在评价HeLa宫颈癌细胞的上,分解了它们的化学结构[14].三尖杉碱,最初从属中分离出来头孢菌,是癌症化疗的另一个天然产物[15,16].然而,紫杉醇和其他紫杉醇类物质的发生的信息P. Chienii.非常有限。
以前的研究揭示了三个代表性的紫杉木,包括13种 - 羟基化番茄酱(Bactatin III,紫杉醇等),14-羟基化的紫杉醛(Taxuyunnanin C,Yunnaxan等)和11(15→1) -abeo-taxoids [17].紫杉醇作为最重要的13-羟基化紫杉醇类化合物之一,其特异性合成分支涉及到从二萜祖香叶酰香叶酰二磷酸(GGPP)到紫杉醇(Taxol)的19个步骤[9].为了形成紫杉烷骨架,通过缓慢起动酶,巨脂素合酶(TS)来催化GGPP至Taxa-4(5),11(12)-Diene的环化[18]. 然后,多种修饰酶,特别是来自CYP450、酰基转移酶、芳酰转移酶和苯甲酰转移酶家族的修饰酶,参与了骨架的结构修饰[19,20,21].一系列CYP450S,包括2α-,5α,7β-,9α-,10β-和13α-羟基酶,参与C税前的氧化步骤− 2., C-5, C-7, C-9, C-10和C-13位置[22].同时,其他一些转移酶也被认为参与紫杉醇的生物合成,如紫杉二烯-5α-醇o -乙酰转移酶(TAT)、紫杉-2α- o -苯甲酰转移酶(TBT)、10-去乙酰baccatin iii -10- o -乙酰转移酶(DBAT)、baccatin iii -3-氨基、3-苯丙酰基转移酶(BAPT)和3 ' -N-debenzoyl-2 -deoxytaxol -N-苯甲酰转移酶[23].
紫杉醇的生物合成途径不是线性途径,而是由各种不同途径组成的复杂网络。例如,cyp450介导的氧化步骤产生许多类似红豆杉素的中间代谢物,如2α-羟基taxusin和7β-羟基taxusin [22]. 红豆杉素C是一种14-羟基化的紫杉醇,在小鼠细胞悬浮培养中具有显著的增强神经元生长因子活性的作用水松物种(24,25].14β-羟化酶(T14OH)参与趋向于14β-羟基的紫杉木的途径,例如Taxuyunnanin C [26].
t将云南濒危和生长缓慢的树,主要分布在中国云南[27].植物化学研究已经分离,并鉴定了许多具有来自种子和树枝的生物活性的番茄和其他化合物t将云南.例如,从树枝和叶子的乙醇提取物中分离出三种新的紫杉烷二萜类萘屈剂量,即沉淀蛋白VIII,毕曲霉IX和BAccatin X.t将云南[28].具有体外抗肿瘤活性的新型杂多糖(TMP70W)是从中鉴定的结构t将云南[29].P. Chienii.,单调型属的唯一物种假框图,是另一种濒危红豆杉,主要分布于华南[5].形态学分析表明两者具有较高的相似性P. Chienii.以及来自水松,在假种皮的颜色上彼此明显不同:白色假框图而且是红色的水松[6].但是,划分的绳索之间的差异累积假框图和水松在很大程度上是未知的。
基因和代谢物大规模鉴定的技术进步促进了研究两个相近物种之间的变异[30,31].最近,几种转录om和代谢物t将云南已被报道[32,33,34].到目前为止还没有经济数据P. Chienii.可用。在本研究中,采用综合代谢组和转录组方法来阐明番茄之间的差异累积P. Chienii.和t将云南和潜在的机制。我们的研究可以为这两个濒临灭绝的避税科物种的保护和综合利用提供有价值的信息。
结果
定量分析确定了紫杉醇的存在P. Chienii.以及类群的变异P. Chienii.和t将云南
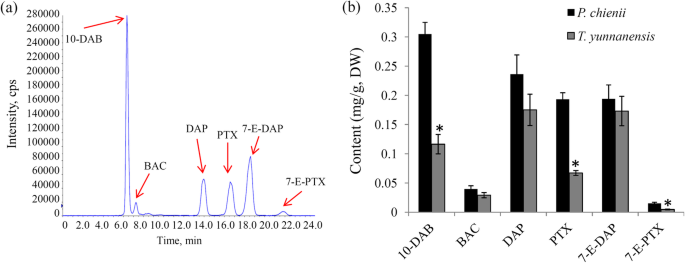
到目前为止,紫杉醇的发生在P. Chienii.是未知的。在此,我们应用目标LC-MS方法检查紫杉醇和其他紫杉醇类物质,如7-E-DAP、10-DAB、BAC、DAP和7-E-PTX的出现P. Chienii..我们的数据显示,所有入选的类紫杉均被检测到,证实了类紫杉在P. Chienii.(图。1a) 是的。定量分析揭示了不同品种紫杉醇含量的差异P. Chienii.和t将云南.特别是10-DAB,PTX和7-E-PTX高度积累P. Chienii..BAC,DAP和7-E-DAP的内容没有显着差异在P. Chienii.和t将云南(图。1b)。
代谢物概述
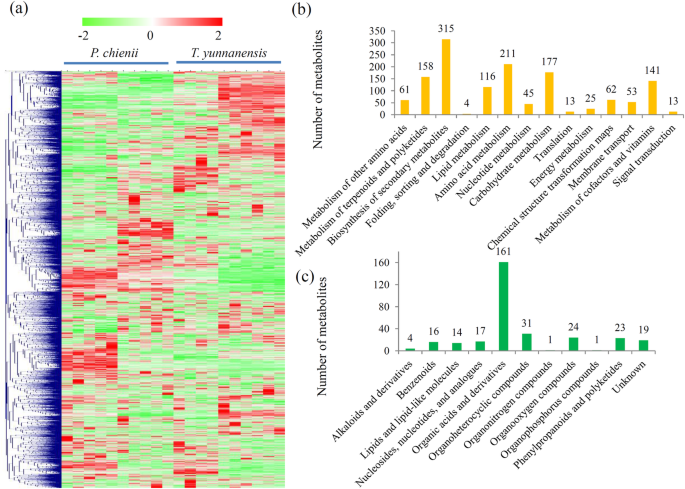
非靶向代谢组学分析鉴定了3387个具有注释的代谢物(附加文件1).三个质量检查参数,包括总离子色谱图,m / z.测试宽度和保留时间宽度,指示数据生成高度重叠,UPLC-MS / MS分析达到所需的标准(附加文件2).PCA表明,PC1和PC2的解释值的百分比分别为42.12和18.63%,表明来自代谢物的清晰分离P. Chienii.和t将云南(附加文件3.). 这两种红豆杉科植物的代谢物谱显示其代谢组有很大的差异(图。2一种)。
根据他们的注释,许多代谢物被分配到不同的代谢途径。KEGG富集分析表明,大多数代谢产物属于氨基酸代谢、碳水化合物代谢、萜类和聚酮类代谢以及辅助因子和维生素代谢(图1)。2b). HMDB Super Class分析显示,311种代谢物被归为11大类,如“有机酸及衍生物”(161种代谢物)、“有机杂环化合物”(31种代谢物)、“有机氧化合物”(24种代谢物)、“苯丙类和多酮类”(23种代谢物)、“核苷类、核苷酸、(17种代谢物)(图。2c)。
转录组概述
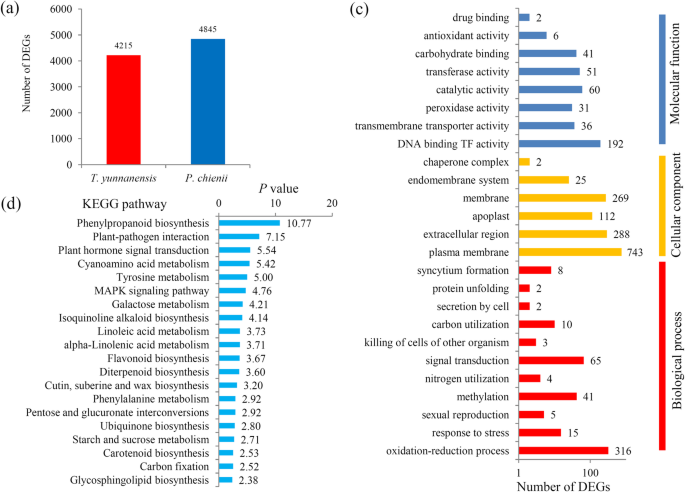
使用类似的样品,RNA测序产生50.35 GB的序列数据,包括25.40 GBP. Chienii.24.95 Gbt将云南(附加文件4). 这个clean reads were assembled and produced 133,507 transcripts (N50: 1561), with a mean length of 513 bp, and 61,146 unigenes (N50: 1606), with a mean length of 419 bp (Additional file5).所有转录物的大小分布分析表明,11.48%的转录物11.01%的unigenes的长度为2000英镑(附加文件5).在注释方面,61,146个unigenes被几个公共数据库注释(附加文件5). 这个species distribution suggested that the majority of the unigenes displayed significant similarities to known proteins from云杉sitchensis,Amborella trichopoda,Quercus Suber.(附加文件5).
Degs分析显示4,215t将云南高度表达的unigenes和4845P. Chienii.高度表达的unigenes(图。3.一种)。大多数DEG被分配到属于三个主要类别的不同GO术语(图。3.b和附加文件6).KEGG分析结果显示,34条KEGG通路显著富集于之间的DEGs中t将云南和P. Chienii.(附加文件7). 这个top 20 enriched KEGG pathways, such as the ‘phenylpropanoid biosynthesis’, ‘plant-pathogen interaction’, and ‘plant hormone signal transduction’ pathways, were shown (Fig.3.c)。
初级和次级代谢的变化t将云南和P. Chienii.
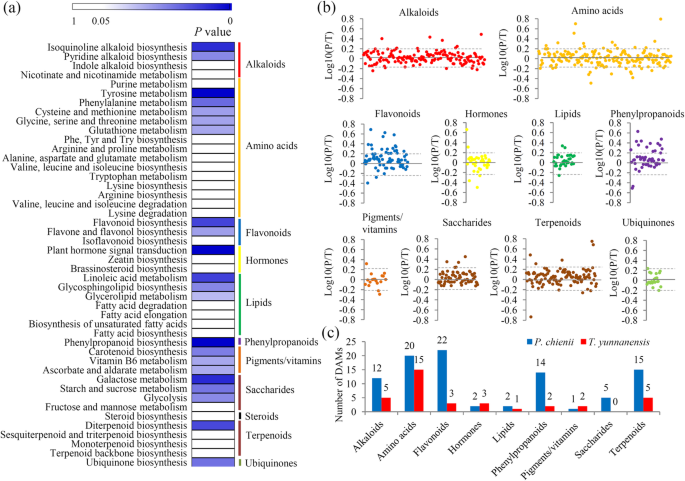
根据他们的注释,大量的DEG参与了Primay和次生新陈代谢,大部分Degs被分组为46 kegg术语,属于11个主要类别。计算每个KEGG术语的显着性值,并在附加文件中显示8.详细、2 alkaloid-related途径,5氨基acid-related途径,两个flavonoid-related通路,与荷尔蒙相关的途径之一,三lipid-related通路,phenylpropanoid-related途径之一,所有三个颜料/维生素通路,三saccharide-related通路,terpenoid-related途径之一,和一个ubiquinone-related通路,显示了显著的差异t将云南和P. Chienii.(图。4一种)。
非靶向代谢组学分析确定了313个差异累积代谢物(DAMs),其中129个DAMs被分为不同的初级和次级代谢物类别(图。4b).各类别的大坝数量如图所示。4c。
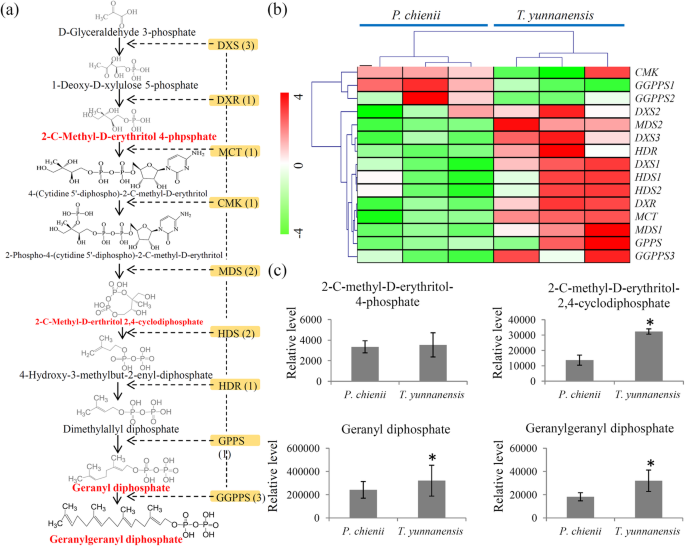
紫杉醇生物合成前体的变化t将云南和P. Chienii.
MEP途径为紫杉醇生物合成提供了关键前体GGPP [35].根据序列与模型植物的相似性,预测的MEP路径如图所示。5a.我们的转录组数据显示,至少有一个单基因编码一种参与MEP途径的酶(附加文件9).在MEP途径中,三个DXS编码unigenes,一个DXR编码UNIGene,一个MCT编码Unigene,一个CMK编码Unigene,编码Unigene的两个MD,编码Unigene的两个HDS编码Unigene,一个编码Unigene的HDR编码Unigene,编码Unigene的三个GGP分别,被识别出来。大多数MEP途径相关基因高度表达t . yunanensis,除了CMK,GGPPS1和GGPPS2(图。5b)。
此外,我们的代谢组数据确定了MEP途径的四个中间代谢物,包括2- c -甲基- d -赤藓糖醇4-磷酸、2- c -甲基- d -赤藓糖醇2,4-环二磷酸、香叶酰二磷酸(GPP)和GGPP。在这些中间产物中,2- c -甲基- d -赤藓醇2,4-环二磷酸、GPP和GGPP富集于t将云南(图。5c)。
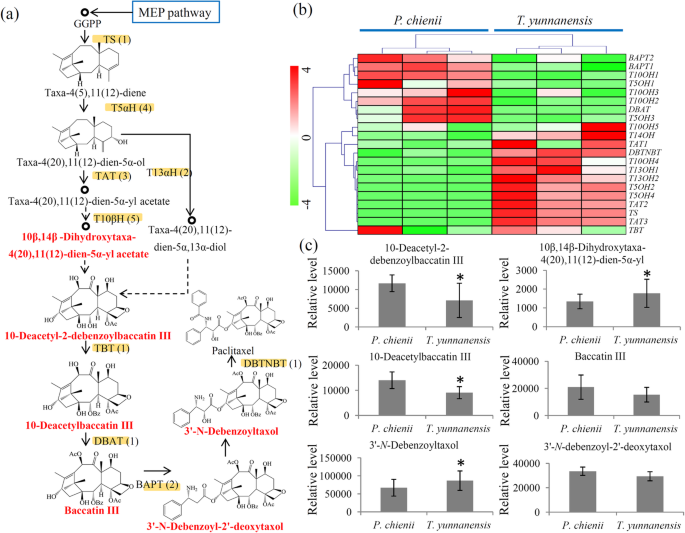
紫杉醇生物合成途径的差异t将云南和P. Chienii.
紫杉醇的生物合成涉及一个复杂的代谢途径,包括几个中间产物及其催化酶[9].在我们的研究中,鉴定了20个编码涉及紫杉醇生物合成途径的九个关键酶的未成熟,包括一个TS编码基因,四个T5α编码基因,三个TAT编码基因,两次T13αh编码基因,5T10βH编码基因,一个TBT编码基因,一个TBT编码基因,一个DBTNBT编码基因,一个DBAT编码基因和两个BAPT编码基因(图。6a和附加文件10). 这个BAPT1/2型,DBAT.,T5αH1/3,T10βH1/2/3基因高度表达P. Chienii.以及Tat1 / 2/3,DBTNBT.,T10βH4,T13αH1/2,技术性贸易壁垒和TS.在t将云南(图。6b)。
我们的代谢物数据鉴定了六种中间代谢物,参与了紫杉醇生物合成。在这些中间代谢物中,10-deaetyl-2-debenzoylbaccatin和10-deaetylbaccatin高度积累P. Chienii.和10β,14β-二羟基塔克妥-4(20),11(12) - 乙酸-5α-炔胺和3'-N-脱苯甲酰紫杉醇在t将云南(图。6c)。
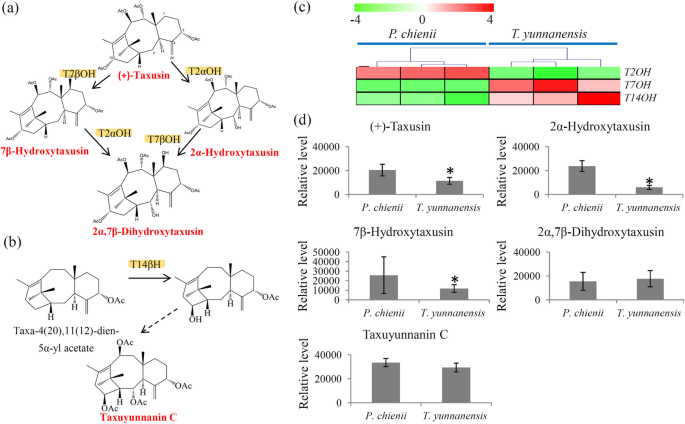
紫杉醇生物合成的末端代谢物与14-羟基紫杉醇类化合物之间的差异t将云南和P. Chienii.
我们的转录组鉴定了涉及涉及税儿宁C的生物合成的Taxusin代谢物的代谢和T14βH的编码基因的T2αh和T7β的编码基因,这是一种经典的14-羟基化番茄蛋白(图。7a和b)T2αH高表达基因P. Chienii.,而T7βH和T14βH基因主要表达于t将云南(图。7c) 是的。此外,通过代谢组学分析鉴定了几种死端代谢物,如(+)-紫杉醇、2α-羟基紫杉醇、7β-羟基紫杉醇和2α,7β-二羟基紫杉醇,以及一种14-羟基化紫杉醇,紫杉木聚糖C。结果表明,(+)-taxusin、2α-羟基taxusin和7β-羟基taxusin在细胞内高度积累P. Chienii.. 2α,7β-二羟紫杉醇和紫杉醇甲素C在两组间无显著性差异P. Chienii.和t将云南obersved(图。7d)。
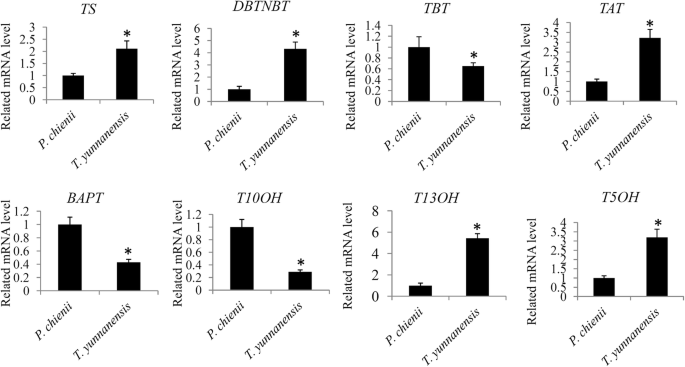
紫杉醇途径关键基因的表达验证
为了探讨紫杉醇途径中涉及的关键基因的表达水平的差异,通过QRT-PCR分析测定了8种随机选择的紫杉醇途径相关基因的相对水平。TS.,DBTNBT.,答,T13OH.,T5OH基因高度表达t将云南和技术性贸易壁垒,BAPT公司,十哦基因高度表达P. Chienii.(图。8).
讨论
迄今为止,水松植物是紫杉醇提取的唯一天然资源,限制了紫杉醇的供应[36].紫杉醇巨大的经济价值使得选择高产量紫杉醇的紫杉科树种成为热门研究领域[2,32,33].我们的数据证实了紫杉醇和其他类紫杉醇的出现P. Chienii.首次表明紫杉醇不是紫杉醇的唯一代谢物水松属。进一步分析表明P. Chienii.包含更高水平的紫杉醇比t将云南,表明P. Chienii.紫杉醇产量高,适合大规模种植。拿t将云南作为一个代表水松采用整合代谢组学和转录组学的方法,研究了两种植物之间的物种特异性积累P. Chienii.和水松树。
作为第一个转录组P. Chienii.,我们的数据提供了61,146个全长或部分序列的unigenes,这是研究紫杉醇生物合成途径的重要基础P. Chienii..基于unigene库,我们预测了MEP通路P. Chienii.,它为二萜类紫杉烷核心提供关键前体[35(图。5a).根据代谢组学,两者均检测到GGPPP. Chienii.和t将云南.另外,还预测了紫杉醇生物合成途径的概述,包括编码九个关键enyzmes的20个未成熟,如图20所示6a).在紫杉醇生物合成途径中,鉴定出6个必需中间体P. Chienii..我们的数据表明存在一个经典的紫杉醇生物合成途径P. Chienii..
MEP途径提供三个单位的IPP和一个单位的DMAPP来合成二萜紫杉烷核[37].MEP通路的上调被认为对前体供给有积极的影响[38].例如,DXS和DXR被认为是质体衍生萜烯类生物合成的催化慢步骤[39]. GGPPS是另一种重要的酶,在紫杉醇的产生中起调节作用[40,41].相比t将云南,表达水平为三个DXS.基因,一个DXR.基因和一个GGPPS基因相对较低P. Chienii.(图。5b).代谢组学证实MEP途径的两个主要终端产物GPP和GGPP在t将云南,建议更丰富的前体供应t将云南.
除紫杉醇外,紫杉醇生物合成的几个重要的直接产物也表现出不同的积累P. Chienii.和t将云南.TS催化中间产物taxa-4(5),11(12)-二烯的形成,是紫杉醇生物合成途径中的限速酶[18,42].TAT催化紫杉醇生物合成的一个重要步骤,该步骤负责紫杉醇-4(20),11(12)-二烯-5α-醇的乙酰化[43].在我们的研究中,发现了一个编码TS的unigene和三个编码TAT的unigene,它们主要表达于t将云南. DBAT是另一种限速酶,催化10-脱乙酰巴卡亭Ⅲ形成巴卡亭Ⅲ[44].bpt负责c13侧链向baccatin III的转移[45].这里,鉴定了一个编码DBAT和两个未编码BAPT的未成语的UNIGENE,它们主要表达P. Chienii..在制药工业中,baccatin III和10-DAB是紫杉醇的关键起始原料[46].我们的数据显示,baccatin III和10-DAB在P. Chienii.,表明…的巨大经济价值P. Chienii.提取物。这些关键基因的差异表达水平提供了对紫杉醇生物合成的差异积分的可能解释t将云南和P. Chienii..
中存在末端代谢物和14-羟基紫杉类化合物紫杉科以前有报道说有树[17]. 例如,(+)-taxusin是红豆杉心材的一种重要代谢物,是一种与紫杉醇形成不同的死端代谢物[47]. Taxusin样代谢产物具有良好的抗炎和抗伤害活性,是检测微粒体加氧酶活性的替代底物[47]. 有趣的是,(+)-taxusin及其羟基化产物在体内高度积累P. Chienii.,表明有更广泛的价值P. Chienii.在制药行业。
近年来,大量TFs被认为参与紫杉醇生物合成的调控[48].例如,TcJAMYC1/2/3、TcERF12/15和TcWRKY1/8/47通过与启动子结合来调控紫杉醇生物合成基因的表达[49,50,51].在我们的研究中,鉴定出12个差异表达的bHLH基因、24个差异表达的ERF基因和16个差异表达的WRKY基因,为紫杉醇的生物合成提供了更多的候选调控因子。MYC转录因子是茉莉酸(JA)信号通路的关键调控因子,MeJA可以提高紫杉醇的产量[52].在T媒体,许多生物合成基因启动子可以被MYC2、MYC3和MYC4激活[53]. 在我们的研究中,4个MYC-TFs中有3个表现出差异表达,这表明MYC介导的JA信号转导在两个细胞之间存在潜在的差异P. Chienii.和t将云南[54].差异表达的MYC转录因子可能在紫杉醇的生物合成中发挥重要作用。有趣的是,据报道,一种韧皮部特异性TmMYB3参与了紫杉醇生物合成的转录调控[55].近年来,研究了R2R3-MYB转录因子家族的表达谱和转录后调控t对已被充分分析[56].在我们的研究中,发现了许多MYB基因,这表明这两种基因中可能存在组织特异性的类群积累P. Chienii.和t将云南.
结论
总之,紫杉醇和其他划分品的发生P. Chienii.通过UPLC-MS / MS方法确认。几个绳索,如10-dab,taxol和7-e-ptx,高积累P. Chienii.暗示它是一种良好的紫杉醇产量,用于大规模培养。比较代谢组和转录组分析揭示了紫杉醇生物合成的前体,中间产物和死终代谢物的变化P. Chienii.和t将云南.此外,许多差异表达的TFs之间P. Chienii.和t将云南也被鉴定,提供新的候选调控紫杉醇生物合成。我们的研究可能有助于更好地理解两者的区别假框图和水松树木,促进资源综合利用P. Chienii.,一种濒危且很少被研究的红豆杉科树木。
方法
植物材料及取样
培养5岁P. Chienii.和t将云南以杭州师范大学校园内的温室为研究对象,采用光照/暗循环12/12 h,相对湿度60% ~ 70%,温度为25±1℃。负责的当局水松资源有天目山国家级自然保护区,谁提供了采集天目山样品的许可P. Chienii.,以及墨脱国家级自然保护区,他们提供了采集t将云南.该植物材料的正式鉴定由张磊博士(华盛顿州立大学)进行。这种材料的凭据标本没有保存在一个公开提供的植物标本室。实验研究Tauxs这些树木符合杭州师范大学的规定。为进行代谢组学分析,从10棵独立的乔木中采集新鲜枝条P. Chienii.和t将云南,分别。为了进行转录组学分析,从3棵独立的乔木中采集新鲜嫩枝P. Chienii.和t将云南,分别。所有样品都在液氮中研磨并转移到一个管中。
代谢物提取和样品制备
每个样品加入500 μL预冷的50%甲醇和几个钢球混合。使用2010 Geno/Grinder (SPEX SamplePrep, Metuchen, NJ, USA)以1900冲程/分钟的速度摇匀混合物溶液2分钟。4000 g离心20分钟后,将上清液转移到新的96孔板中。UPLC-MS/MS分析前,样品保存在−80℃。另外,每一种提取液混合10 μL制备质量控制样品。
未确定的代谢组成品
根据我们之前的工作,所有样品均采用UPLC-MS/MS系统进行分析[32].首先,使用超高效液相色谱(UPLC)系统(SCIEX, UK)进行所有的色谱分离。采用ACQUITY UPLC BEH Amide柱(100 mm × 2.1 mm, 1.7 μm, Waters, Milford, MA, USA)进行反相分离。柱式烘箱保持在35℃。流速为0.4 mL/min,流动相为A溶剂(25 mM乙酸铵和25 mM NH)4H2O)和溶剂B(IPA:CAN = 9:1,V / V和0.1%的甲酸)。梯度洗脱条件设定如下:0〜0.5分钟,95%的溶剂B;0.5〜9.5分钟,95至65%的溶剂B;9.5〜10.5分钟,65%〜40%的溶剂B;10.5〜12分钟,40%的溶剂B;12〜12.2分钟,40%〜95%的溶剂B;12.2〜15分钟,95%的溶剂B.每个样品的注射体积设定为4μl。
使用高分辨率的MS/MS TripleTOF 5600 plus (SCIEX, UK)识别柱洗脱的代谢产物。TOF在正离子和负离子两种模式下进行。UPLC-MS/MS分析的详细参数是根据我们之前的工作设定的[32].此外,为了评估全数据采集过程中UPLC-MS / MS系统的稳定性,每10个样品后检测一个质量控制样品。
代谢组数据集的生物信息学
利用XCMS软件对采集到的质谱数据特征进行分析,包括峰选择、峰分组、保留时间(RT)、第二峰分组、同位素和加合物的注释[57]. 结合RT和m/z数据对每个离子进行了鉴定。记录每个峰的强度,并生成包含每个指定峰指数(保留时间-m/z对)、样品名称和离子强度的三维矩阵。
通过将样本的精确m/z与在线KEGG和PLANTCYC数据库中的样本进行匹配,对代谢物进行注释。通过同位素分布测量,进一步验证了所有注释代谢物的分子式。峰值数据的强度由内部软件metaX进一步预处理。在不到50%的质量控制样本或80%的实验样本中检测到的低质量特征被去除。采用k-最近邻算法计算高质量峰,进一步提高其质量。利用预处理数据集进行PCA检测和批处理效果评价。此外,计算所有质量控制样本的代谢特征的相对标准差(SD),以去除SD值为> 30%的特征。
筛选差异累积代谢物,默认设置参数,如VIP > 1,P< 0.05,使用。代谢组学的统计分析,包括单变量分析和多变量PLS-DA分析,并有相应的VIP值,进行。单因素分析采用Wilcoxon检验PBH校正纠正的值。
RNA提取和测序
总rna提取使用RNeasy植物迷你试剂盒(Qiagen, Hilden, Germany),根据其手册。每个RNA样本10 μg(3个生物重复)用于文库构建。按照Yu等人之前描述的方法构建cDNA文库[30]. 根据其方案,使用Illumina Hiseq 4000平台(LC-Bio,中国杭州)进行测序。
对于长度小于25bp的低质量reads,对原始RNA-seq reads进行裁剪。基于干净的reads,使用Trinity软件进行转录组组装[58].原始序列数据已提交到NCBI短读档案,登录号为GSE121523和GSE121831。
转录组数据集的分析
基因注释采用非冗余蛋白(Nr)、基因本体(GO)、SwissProt、京都基因和基因组百科全书(KEGG)等数据库检索。我们使用dismond软件中的blastx函数,根据不同的数据库搜索组装好的基因组,设置值< 0.00001。当一个基因序列可以与多个蛋白质对齐时,选择值最小的结果作为该基因的最终注释。根据蛋白质ID,得到相应的基因符号。
单基因的表达水平用百万分之转录本法计算。对数转化后,将不同样本组中每个单基因的转录丰度值转化为Z值。用log2(转录物丰度的倍数变化)筛选差异表达基因 > 1统计意义P< 0.05。通过内部perl脚本对deg进行GO和KEGG富集分析。热图是使用MultiExperiment Viewer(版本4.9.0)制作的。使用samtools软件对默认参数的SNP进行分析和过滤。所有mindepth小于100的snp都被剔除。
靶向杉木的定量分析
从每种树种的6棵独立的树中收集新鲜的树枝。样品在40℃下彻底干燥,然后磨成细粉。一种先前发表的方法的改进版本被用于制备粗提取物[30]. 采用UPLC-MS/MS法对6种常见的紫杉醇进行了定量分析,包括10-脱乙酰巴卡亭III(10-DAB)、巴卡亭III(BAC)、10-脱乙酰紫杉醇(DAP)、紫杉醇(PTX)、7-表位10-脱乙酰紫杉醇(7-E-DAP)和7-表位紫杉醇(7-E-PTX)。在UPLC-MS/MS分析之前,粗提物以1:10的比例稀释,并通过0.22 μm膜过滤器。
为了分离这些类群,Kinetex C18使用柱(100×4.6mm,2.6μm,现象,托尔徒,CA,USA)。使用与SCIEX Qtrap 6500ms(Applied Biosystems)耦合的LC-30 AD UPLC(Shimadzu,日本)进行这些鲍拓的测定。应用多量子软件(3.0版)用于数据采集和处理。在正电离模式中使用多重反应监测(MRM)。过渡m / z.567.4→445.3 10-DAB,m / z.609.5→427.3 for BAC,m / z.834.4→308.2为DAP,m / z.876.4→308.2用于PTX,m / z.876.4→591.4 7-E-PTX,和m / z.7-E-DAP采用834.4→308.2定量。采用LC-30 AD UPLC系统(日本岛津)和SCIEX QTRAP 6500质谱仪(Applied Biosystems)对7种紫杉类化合物进行定量。结果以至少3个重复±标准误差的平均值表示。
实时PCR验证
根据我们之前的工作进行了实时PCR实验[30].简而言之,使用Sybr预混件(Takara,Dian,China)和DNA序列检测系统(ABI PRIM 7700)。独立cDNA样本来自P. Chienii.和t将云南用于实时PCR实验。用肌动蛋白序列用作内部标准基因,以通过比较循环阈值的值计算相对折叠差异(2−ΔΔCt). 这个expression analysis was performed for three biological replications. The primer sequences were listed in Additional file12.
统计分析
使用SPSS软件版本19.0(美国伊利诺伊州芝加哥SPSS公司)进行统计分析,并采用单因素方差分析比较两个样本组之间紫杉醇含量的差异。Wilcoxon试验用于检测两个物种之间代谢物浓度的差异。这个P使用FDR (benjami - hochberg)进行多次测试调整。监督PLS-DA通过metaX进行区分两组之间的不同变量。计算VIP值。VIP截断值为1.0用于选择重要特征。
数据和材料的可用性
原始序列数据已提交给NCBI短读取存档,其中包含加入号GSE121523和GSE121831。
缩写
- GGPP:
-
天竺葵二磷酸二磷酸酯
- IPP:
-
异戊烯焦磷酸
- 应用程序:
-
Dimethylallyl二磷酸
- 议员:
-
2-C-methyl-D-erythritol磷酸
- TS:
-
Taxadiene合酶
- 10-DAB:
-
10-deacetylbaccatin-III
- 10-DAB III:
-
10-deacetylbaccatin三世
- HPLC-MS /女士:
-
高效液相色谱-串联质谱分析
- 方差分析:
-
方差分析
- PCA:
-
主成分分析
- 大坝:
-
微分代谢物积累
参考文献
- 1.
傅勇,李S,祖勇,杨庚,杨Z,罗明,等。紫杉醇及其类似物的药物化学。当前医学化学。2009;16(30):3966–85.
- 2.
Zhou T,Luo X,Yu C,Zhang C,Zhang L,Song Y-B,et al.转录组分析揭示了三种紫杉醇生物合成相关基因的表达模式和序列相似性水松物种。BMC植物BIOL。2019; 19(1):33。
- 3.
李燕,秦飞,王思敏,郭瑞霞,张云飞,顾永昌,等。化学的研究Taxus Canadensis..化学Biodivers。2013;10(10):1729 - 53年。
- 4.
李st,张平,张敏,付春华,赵长飞,董永生,等。转录的红豆杉细胞响应茉莉酸甲酯。BMC基因组学。2012; 13:295。
- 5.
邓q,张h,他,王t,su y。叶绿体微卫星标记Pseudotaxus chienii.的整个叶绿体基因组发育而成红豆杉var。mairei(Taxaceae)。苹果厂SCI。2017; 5(3):apps.1600153。
- 6.
Dorken VM、Nimsch H、Rudall PJ。红豆杉科假种皮的起源:中国种子球果畸形的进化意义Pseudotaxus chienii..Ann Bot。2019; 123(1):133-43。
- 7.
Hsu c-y,wu c-s,chaw s-m。古代核塑地DNA在紫杉族家庭(税皂科)。基因组Biol Evol。2014; 6(8):2111-21。
- 8。
Sanchez-Munoz R, Bonfill M, Cusido RM, Palazon J, Moyano E. Advances in regulation of vitro paclitaxel production: methylation of a Y-patch promoter region改变BAPT公司基因表达在水松细胞培养。植物生理学杂志。2018;59(11):2255-67。
- 9。
Croteau R, Ketchum RE, Long RM, Kaspera R, Wildung先生紫杉醇生物合成和分子遗传学。Phytochem启2006;5(1):75 - 97。
- 10.
Appendino G. Yew树的植物化学。NAT产品批准。1995; 12(4):349-60。
- 11
杨丽,郑ZS,程F,阮X,姜达,潘CD,等。新疆针叶中代谢物的季节动态Taxus Wallichiana.var。莫雅一世。分子。2016; 21(10):1403。
- 12
红豆杉的成分中有红皮水松baccataHPLC-MS/MS测定。Phytochem肛门。2018;29(5):446 - 51。
- 13
关键词:紫杉烷,新衍生物,有机化学,有机化学Taxus Wallichiana.对肿瘤细胞具有较高的抗癌效能。中国生物医学工程学报,2016;
- 14
刘Hs,高耶,刘LH,刘W,施QW,董M等。13个紫杉烷二萜类蛋黄的抑制作用(红豆杉var。mairei关于HeLa宫颈癌细胞的增殖。Biosci Biotechnol Biochem。2016; 80(10):1883-6。
- 15
癌症化疗的新天然产物。临床药理学报。1990;30(9):770-88。
- 16
曹伟,刘勇,张锐,张斌,王涛,朱旭,等。高三尖杉酯碱通过IL-6/JAK1/STAT3信号通路诱导吉非替尼耐药肺癌细胞凋亡并抑制STAT3。Sci众议员2015;5:8477。
- 17
王YF,Shi QW,Dong M,Kiyota H,Gu YC,Cong B.天然紫杉烷:自1828年以来的发展。Chem Rev.2011; 111(12):7652-709。
- 18
Ansbacher T,Freud Y,重大DT。慢起动酶:主动部位建筑在丙二烯合成酶中催化控制税二烯生物合成的作用。生物化学。2018; 57(26):3773-9。
- 19。
D'Auria JC。植物中的酰基转移酶:成为BAHD的好时机。CurrOp植物BIOL。2006; 9(3):331-40。
- 20。
紫杉醇生物合成的细胞色素P450加氧酶。Phytochem启2006;5(2 - 3):433 - 44。
- 21。
Walker K,Croteau R. Taxol生物合成:苯甲酰 - CoA的分子克隆:紫杉烷2alpha-O-苯甲酰基转移酶cDNA水松的函数表达式大肠杆菌. 美国国家科学院学报。2000;97(25):13591–6.
- 22。
江米,斯蒂芬洛斯G,Pfeifer Ba。紫杉醇微生物重构途径中的下游反应和工程。苹果microbiol biotechnol。2012; 94(4):841-9。
- 23。
紫杉醇生物合成的最终酰化步骤:克隆紫杉醇c13侧链n -苯甲酰转移酶水松.国家自然科学基金资助项目:国家自然科学基金资助项目。
- 24。
周璇,钟俊杰。内源水杨酸水平对紫杉醇C生物合成的定量影响红豆杉.Biotechnol Bioeng。2011; 108(1):216-21。
- 25。
Kochkin DV, Globa EB, Demidova EV, Gaisinsky VV, Galishev BA, Kolotyrkina NG等。不同种类红豆杉体外细胞培养中14种羟基化类紫杉的发生情况(水松spp)。生物化学与生物物理学报。2017;476(1):337-9。
- 26。
番茄酱RE、Rithner CD、Qiu D、Kim YS、Williams RM、Croteau RB。水松代谢组学:茉莉酸甲酯优先诱导C-13在C-13的促脱脂的生产红豆杉×中红豆杉细胞培养。植物化学。2003;62(6):901 - 9。
- 27。
苗玉成,郎晓东,张佐忠,苏建荣.濒危物种生境片段化的系统地理学和遗传效应云南红豆杉微卫星数据显示的中国西南地区。植物医学杂志。2014;16(2):365 - 74。
- 28
海萍,温淑珍,李艳,高原,蒋秀娟,王飞。新紫杉烷二萜化合物的合成。北京:化学工业出版社云南红豆杉.中国生物医学工程学报。2014;4(1):47-51。
- 29
严C,尹Y,张D,杨W,余R。一种新型多糖的结构表征及体外抗肿瘤活性研究云南红豆杉.Carbohydr石油。2013;96(2):389 - 95。
- 30.
俞超,郭浩,张勇,宋勇,皮恩,俞超,等。鉴定有助于两种植物类群含量变化的潜在基因水松物种(水松媒体和南方红豆杉).树生理。2017; 37(12):1659-71。
- 31.
Hao J,Guo H,Shi X,Wang Y,WAN Q,Song YB等。两种比较蛋白质组学分析水松物种(红豆杉×中红豆杉和南方红豆杉)揭示了与紫杉醇和其他代谢物相关的代谢变化。植物生理学杂志。2017;58(11):1878-90。
- 32.
于聪,罗×,詹×,郝杰,张莉,宋义博,等。比较代谢组学揭示了两种濒危红豆杉的代谢变异(T富安娜和t将云南)在喜马拉雅山。BMC植物BIOL。2018; 18(1):197。
- 33.
何春涛,李志林,周强,沈超,黄艳云,Mubeen S,等。转录组分析揭示了一种新的紫杉醇合成的特定模式云南红豆杉品种。植物理性生物化学。2018; 122:10-8。
- 34.
穆贝斯,李泽丽,黄QM,何CT,杨ZY。比较转录组分析揭示了紫杉烷在三个实验品系中的组织特异性积累云南红豆杉.农业化学学报。2018;66(40):10410-20。
- 35
Eisenreich W, Menhard B, Hylands PJ, Zenk MH, Bacher A.紫杉醇生物合成的研究:紫杉烷碳骨架并非甲戊甲酮类来源。国家自然科学基金资助项目:国家自然科学基金资助项目;
- 36
约翰·古德曼:紫杉醇的故事:抗癌药物制造中的科学和政治;2001.
- 37
弗拉诺瓦E,科曼D,格鲁塞姆W。类异戊二烯合成MVA和MEP途径的网络分析。植物生物学年鉴。2013;64:665–700.
- 38
Ketchum Re,Gibson DM,Croteau RB,Shuler ML。细胞悬浮培养中的紫杉木积累动力学水松茉莉酸甲酯诱导后。Biotechnol Bioeng。1999;62(1):97 - 105。
- 39
Estevez JM、Cantero A、Reindl A、Reichler S、Leon P。1-脱氧-D-木酮糖-5-磷酸合酶,植物类异戊二烯生物合成的限制酶。生物化学杂志。2001;276(25):22901–9.
- 40。
Laskaris G、Jong CFD、Jaziri M、Heijden RVD、Theodoridis G、Verpoorte R。香叶基香叶基二磷酸合酶活性与紫杉烷生成水松baccata细胞。植物化学,1999;50(50):939 - 46。
- 41。
外源和内源真菌GGPP的增加增加了真菌紫杉醇的产量。应用微生物生物技术。2017;101(20):7523-33。
- 42。
关键词:紫杉二烯合成酶,催化,分子动力学,分子动力学计算机化学学报。2018;39(19):1215-25。
- 43。
Walker K,Ketchum RE,Hezari M,Gatfield D,Goleniowski M,Barthol A等。乙酰辅酶A的部分纯化和表征:催化紫杉醇生物合成第一个酰化步骤的紫杉醇-4(20),11(12)-二烯-5α-醇O-乙酰基转移酶。Arch Biochem Biophys公司。1999;364(2):273–9.
- 44。
尤丽芳,魏涛,郑庆文,林建峰,郭立群,蒋炳辉,等。酶法合成baccatin的taxoid 10β - o -乙酰转移酶活性必需残留分析。应用生物化学。2018;186(4):949-59。
- 45。
Walker K,Fujisaki S,Long R,CROTEATH R. C-13苯基丙糖侧链COA酰基转移酶的分子克隆和异源表达,其在紫杉醇生物合成中起作用。Proc Natl Acad Sci U S A. 2002; 99(20):12715-20。
- 46。
Tatini LK, Rao NS, Khan M, Peraka KS, Reddy KV。10-去乙酰baccatinⅲ的伴生伪多态性。aap PharmSciTech。2013; 14(2): 558 - 68。
- 47。
杨晓东,李建平,张建平,等。红豆杉(Taxus baccata L.)的抗炎和抗伤害性研究[J] .中华民族药理学杂志,2003;89(2):267 - 271。
- 48。
匡X,孙S,魏J,李Y,孙C。Iso序列分析水松cuspidata转录组揭示了紫杉醇生物合成的复杂性。中国生物医学工程学报,2019;
- 49。
Lenka SK、Nims NE、Vongpaseuth K、Boshar RA、Roberts SC、Walker EL。紫杉醇生物合成基因在东北红豆杉培养细胞中的茉莉酸反应性表达受到bHLH转录因子TcJAMYC1、TcJAMYC2和TcJAMYC4的负调控。前植物科学。2015;6:115.
- 50.
张敏,李松,聂磊,陈强,徐鑫,于磊,等。两种茉莉酸反应因子TcERF12和TcERF15分别作为紫杉醇生物合成tasy基因的抑制因子和激活因子红豆杉. 植物分子生物学。2015;89(4–5):463–73.
- 51.
张敏,陈勇,聂磊,金鑫,廖伟,赵松,等。在转录组范围内鉴定和筛选参与紫杉醇生物合成调控的WRKY因子红豆杉. Sci代表,2018年;8(1):5197.
- 52.
杨艳芳,Z凯凯,Y丽颖,L星,W颖,L红卫,等。小鼠心肌细胞MYC转录因子的鉴定与鉴定水松sp。基因。2018; 675:1-8。
- 53.
崔毅,毛尔,陈杰,郭兹。茉莉酸信号通路中MYC家族转录因子对紫杉醇生物合成的调控机制。国际分子科学杂志。2019;20(8):1843.
- 54.
张明,金×,陈勇,魏明,廖W,赵S,等。碱性螺旋-环-螺旋转录因子TcMYC2a转导JA信号,调节紫杉醇的生物合成红豆杉.前植物SCI。2018; 9:863。
- 55.
yu c,luo x,张c,xu x,黄j,chen y等。茎干的特异性研究水松媒体识别患者涉及紫杉醇生物合成的转录调节的韧皮肌特异性TMMYB3。工厂J. 2020; 103(1):95-110。
- 56.
关键词:myb, R2R3-MYB,转录因子家族红豆杉:鉴定、特征、表达谱和转录后调控分析。PeerJ。2020; 8: e8473。
- 57.
Smith CA, Want EJ, O 'Maille G, Abagyan R, Siuzdak G. XCMS:使用非线性峰对齐、匹配和鉴定来处理质谱数据。肛门化学2006;78(3):779 - 87。
- 58.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I等。三位一体:利用RNA-Seq数据,在没有基因组的情况下重建全长转录组。生物科技Nat》。2011;29(7):644 - 52。
致谢
我们也非常感谢LC科学公司(中国杭州)的技术支持。感谢刘开东(岭南师范大学生命科学与技术学院)阅读本手稿。
基金
基金资助:浙江省自然科学基金资助项目;LY19C160001;浙江农林大学亚热带森林培育国家重点实验室开放基金(KF201708);中央财政重大增减项目(批准号:2060302);浙江省重点研发计划资助项目(2017C02011, 2018C02030)。在研究的设计、收集、分析和解释数据以及撰写手稿方面,资助机构没有任何作用。
作者信息
隶属关系
贡献
CS和HW对构想作出了实质性贡献,参与起草手稿,并授予最终批准发布的版本。CY,XL,CZ和XX对收购数据分析作出了实质性贡献,参与了修改稿件,并授予最终批准发布的版本。CY,XL,JH和YC对数据的分析和解释作出了实质性的贡献,涉及修改稿件,并授予最终批准发布的版本。所有作者都已读取并批准了稿件,并确保了这种情况。
通讯作者
道德宣言
伦理批准并同意参与
该项目使用植物材料,不利用转基因技术。我们遵守了所有相关的机构,国家和国际指南,并从天穆国家自然保护区和Motuo国家自然保护区获得了适当的权限。负责的当局水松资源有天目山国家级自然保护区,谁提供了采集天目山样品的许可P. Chienii.,以及墨脱国家级自然保护区,他们提供了采集t将云南,为我们的科学研究。
同意出版
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1。
3387个代谢物的详细信息,并附有注释。
附加文件2:图S1。
代谢组的质量控制参数。
附加文件3:图S2。
代谢组的PC分析P. Chienii.和t将云南.
附加文件4:表S2。
转录组的详细信息。
附加文件5:图S3。
组装转录本和单基因的长度分布。
附加文件6:表S3。
GO的所有类别之间的degt将云南和P. Chienii..
附加文件7:表S4。
KEGG富集分析t将云南和P. Chienii..
附加文件8:表S5。
属于初级和次生新陈代谢的每个KEGG术语的意义值。
附加文件9:表S6。
编码MEP通路中酶的unigenes的详细信息。
附加文件10:表S7。
编码涉及紫杉醇生物合成途径的酶的未成熟的详细信息。
附加文件11:表S8。
鉴定的TFs和差异表达的TFs的数量。
附加文件12:表S9。
qRT-PCR引物序列。
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
宇,C.,张,C.,徐,X.et al。濒临灭绝的避税科的OMIC分析Pseudotaxus chienii.揭示了紫杉醇生物合成途径的差异假框图和云南红豆杉树。BMC植物生物学21,104(2021)。https://doi.org/10.1186/s12870-021-02883-0
收到了:
接受:
发表:
关键字
- 代谢物
- 兜餐杉
- 紫杉醇生物合成途径
- 转录组
- 资源利用率