摘要
背景
晚期胚胎发生-丰富(Late Embryogenesis-Abundant, LEA)基因家族广泛存在于高等植物中,在调节植物对非生物胁迫的耐受方面发挥着重要作用。杨树是一种具有重要生态价值和经济价值的树种。但在杨树中对该基因家族的系统研究尚未见报道。
结果
在全基因组搜索的基础上,我们鉴定了88个LEA基因杨树trichocarpa并将它们重命名为PtrLEA.的PtrLEA基因具有更少的内含子,其启动子含有更多与非生物胁迫耐受性有关的顺式调节元件。我们的比较基因组学的结果表明PtrLEA基因是保守的,与其他物种的相关基因是同源的,例如大叶桉那Solanum lycopersicum.和拟南芥.使用从两个条件(具有和不含盐处理)的杨树收集的RNA-SEQ数据,我们分别检测到24,22和19个差异表达的基因(DEG),茎和叶片。然后我们对组织共享的四个上调的次数进行了时尚表达分析,构建基于基于基于基于基于基于网络的网络和研究基因函数注释。
结论
证据表表明PtrLEA基因在杨树生长和发展中起着显着的作用,以及对盐胁迫的反应。
背景
非生物胁迫,如高盐、干旱和低温,挑战植物的生长和发育,导致产量和质量下降[1].然而,在进化中,植物在分子,生理和生物化学水平下开发了序列机制,以最大限度地减少非生物应激的影响[2].例如,转录因子和蛋白激酶可以调节下游信号转导途径,最终导致对应激的生理反应[3.].另一方面,植物中的功能性蛋白质,例如晚期胚胎源性(LEA)蛋白质可以消除活性氧物质的细胞含量,以保护大分子物质并减轻由非生物应激引起的损伤[4.].
第一位Lea蛋白在棉花中被发现[5.].研究人员发现,棉花种子在脱水和成熟期大量积累这种蛋白质,以保护种子不受损害[5.].然后,已经确定了更多的Lea蛋白拟南芥[6.], 白饭 [7.],大麦[8.]和其他物种。Lea蛋白主要位于细胞质,线粒体和植物细胞核中,甚至位于内质网中的植物中9.].根据Lea蛋白的保守结构域,它们可以分为八簇,包括lea_1,lea_2,lea_3,lea_4,lea_5,lea_6,脱氢和种子成熟蛋白(SMP)[10.]. 然而,不同物种之间的分类存在差异[9.].
当植物受到挑战性环境时,如高盐和干旱,细胞系液的离子浓度将迅速上升,导致细胞的不可逆转损害[11.那12.].Lea蛋白在辅助植物耐受诸如脱水时的响应性的响应性[10.].这些蛋白质含有高比例的甘氨酸,赖氨酸和组氨酸,但缺乏丙氨酸和丝氨酸[13.].因此,Lea蛋白,尤其是第一簇中的Lea蛋白具有高亲水性和热稳定性,重定向细胞中的水分子,结合盐离子,并消除由于脱水引起的细胞中积聚的活性氧自由基[14.].此外,Lea蛋白可以通过与细胞膜结合来防止细胞结构的塌陷[15.]. 此外,它们还可以通过分子伴侣与错误折叠的蛋白质结合,修复错误组装的蛋白质以恢复其生物活性[16.].
增加的证据表明,Lea蛋白在植物对非生物胁迫的反应中起重要作用。过度表达OsEml基因在挑战干旱胁迫时增加了水稻中的ABA敏感性和渗透性耐受性[17.]. 同样,转基因辣椒过度表达CaLEA1基因能够增强气孔的密封,增加干旱和盐应激响应基因的表达[18.].此外,拟南芥14[19.] 和Setaria Italica Silea14.[20.据报道,基因据据报道赋予耐盐性。最近,塔列亚在小麦21.],ZmLEA3在玉米22.], 和smlea.在丹参[23.)也被报道在应激耐受性方面有作用。然而,对杨树的研究还很缺乏。
在这项研究中,我们确定了杨树的88个Lea基因,并分析了Lea系列成员的进化关系,基因重复事件,顺式作用序列。此外,我们系统地分析了Lea基因的结构和功能,尤其是在不同组织中的杨树Lea基因的表达,而无盐胁迫。本研究提供了杨树系列基因的新信息,并提供了基因演化和功能的参考价值。
结果
杨树LEA基因的鉴定与鉴定
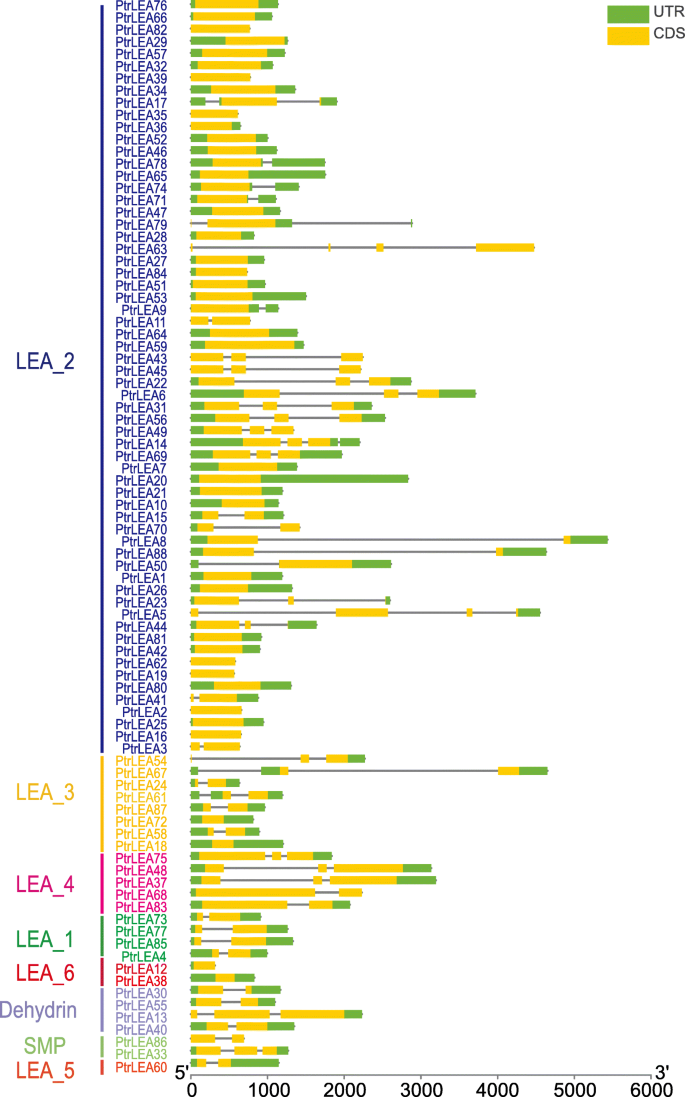
一共88个lea基因从杨树trichocarpa.由于这些基因与之前的研究不同[24.,我们将它们分别重命名为PtrLEA,然后根据其在杨树基因组上的定位数目。然后我们把PtrLEA基因分为八个簇,各种基因数量(附加文件1:表S1)。聚类LEA_2中基因数量最多(60个),其次是LEA_3(8个),LEA_6(5个),LEA_1和Dehydrin(4个),LEA_4和SMP(2个),LEA_5(1个)。内含子和外显子的结构特征PtrLEA基因见图。1.我们发现每个基因的内含子数在0 ~ 3之间,其中39个基因没有内含子,26个基因含有1个内含子,20个基因含有2个内含子,只有3个基因含有3个内含子。
由88PtrLEA基因表现出不同的物理化学性质1:表S1)。它们的分子长度和质量分别为82-616个氨基酸和9.018-66.913 kDa。理论等电点(pI)取值范围为4.6 ~ 10.38。对于亲水性的总体平均值,我们发现有25个蛋白的指数大于0,被视为疏水蛋白。相比之下,61种蛋白质的指数小于0,即亲水性蛋白质。脂肪族指数在31.25 ~ 118.06之间。蛋白质的不稳定性系数范围从12.44到68.11,其中三分之二的蛋白质的值小于40。
杨树和拟南芥LEA基因的系统发育分析
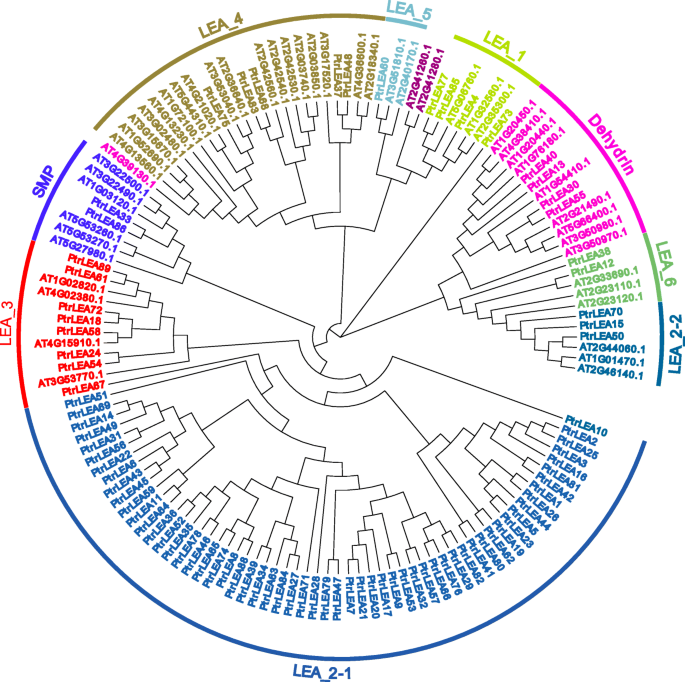
为了更好地了解来自杨树和拟南芥的LEA基因家族的进化关系,我们将基于蛋白质序列的相似性分类基因[25.]. 系统发育树如图所示。2.一般情况下,LEA_2可分为LEA_2 - 1和LEA_2 - 2两个子集群。相比之下,集群LEA_1、LEA_4和LEA_5可以分组成更大的分支。类似地,Dehydrin团簇、LEA_6和LEA_2-2形成了其他分支。
此外,我们仅用88株建立了系统发育树PtrLEA基因。同样,它们可以分为8个属于两个主要枝条的群集;也就是说,一个人的群集lea_2和集群lea_3的一部分,另一个人的其余基因(附加文件2:图。S1)。
猪的染色体分布PtrLEA基因和跨物种共同分析
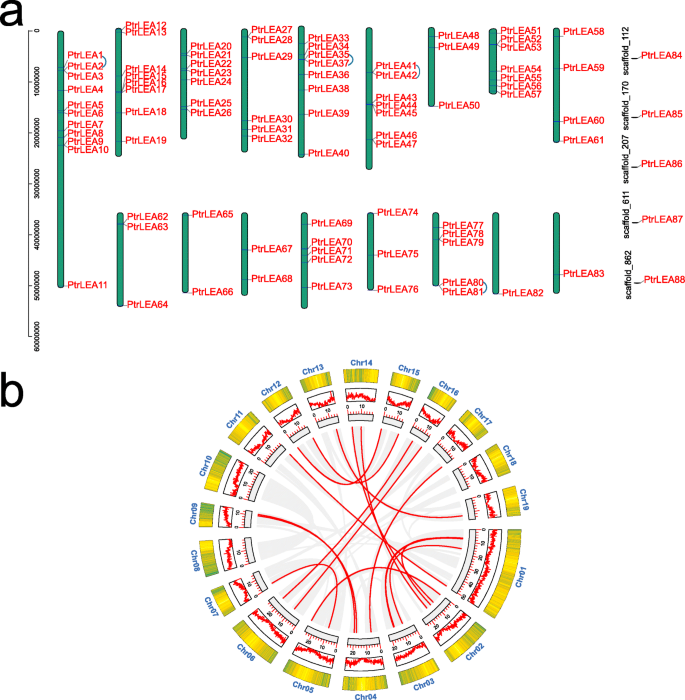
88的基因组分布PtrLEA基因因染色体或支架而异(图。3.).染色体1携带的基因数量最多(11)。相反,只有一个基因分别位于17号染色体和18号染色体上。此外,五PtrLEA基因分布在不同的支架上。有趣,没有PtrLEA在染色体8和19上发现基因。
88的基因组重复事件PtrLEA使用MCscan对基因进行分析[26.].我们发现各种染色体1,5,6和16上的八个基因显示四对串联复制事件(图。3.一种)。此外,我们还发现37个基因表现出均匀分布在相应的染色体上的19对片段复制事件(附加文件3.:表S2,图3.b)。
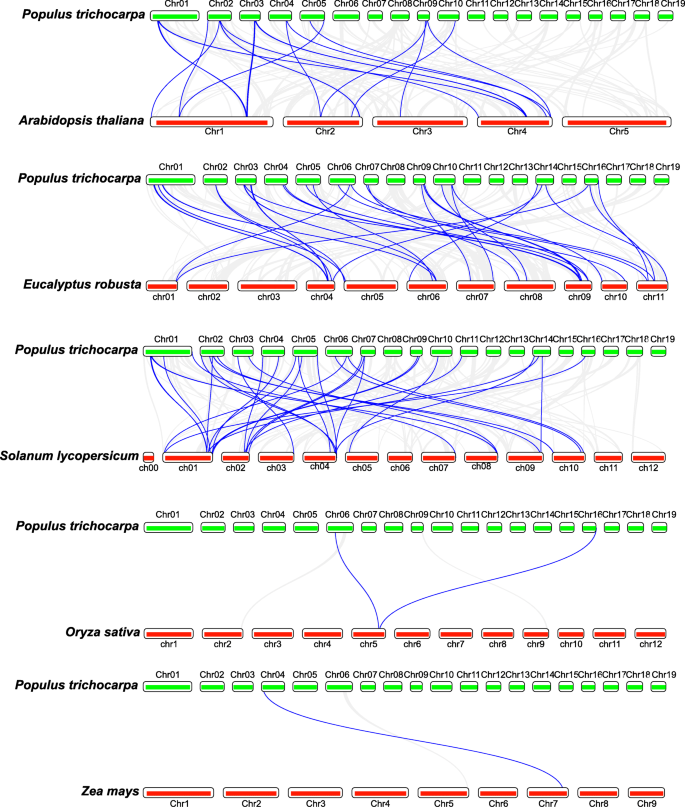
我们进一步比较了DNA序列相似性PtrLEA来自其他物种的相关基因的基因。我们构建了联合性地图杨树trichocarpa和三个双旋肌(大叶桉那Solanum lycopersicum.和拟南芥)和两种单圈子(Zea Mays.和栽培稻),分别。如图1所示。4.,我们确定了32个重复的事件大叶桉,34英寸Solanum lycopersicum.21岁的拟南芥,1 in.玉米,和2栽培稻(附加文件4.:表S3)。我们发现共线性块主要分布在杨树的前五个染色体上。一些PtrLEA基因,如Ptrea16.那Ptrea30.和ptrea55.,具有直际基因大叶桉那拟南芥和Solanum lycopersicum..同样,其他基因,如Ptrea80,有直接同源栽培稻和Solanum lycopersicum..
Ka/Ks的比值表示一对蛋白质编码基因的非同义替代率(Ka)与同义替代率(Ks)的比值。为物种选择进化提供了重要参考。比率 > 1表示正选择;比率 = 1表示中性进化;比例呢 < 1表示否定选择[27.].如附加文件所示3.:表S2,有关的比率PtrLEA基因落入0.11至1.05的范围,平均值为0.43。只有一对复制事件的比例大于1,而剩余的重复基因对具有小于1.这些比例少于1.这些表明PtrLEA基因已经在进化过程中进行了纯化选择。根据每年1.5×10-8的分歧率为1.5×10-8个同义替换率遗址[28.,我们预测散度时间PtrLEA基因重复事件约为4.72至106.72亿年(Mya),平均为25 mya。
顺式元素分析PtrLEA基因
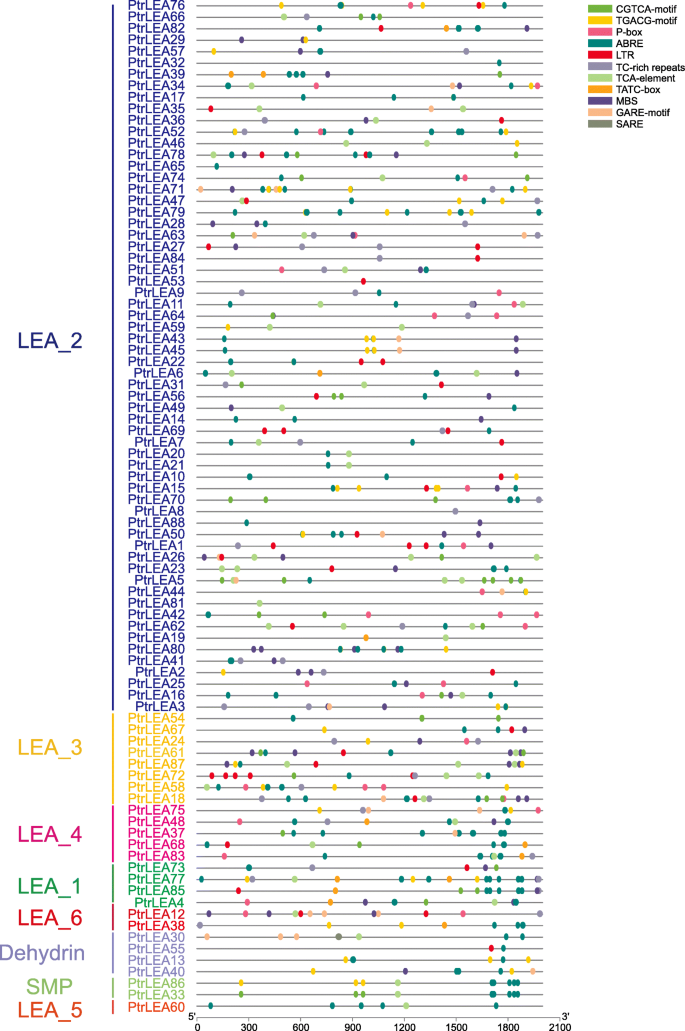
我们从每个样本中提取2000 bp的上游序列PtrLEA基因,然后使用植物的CIS元素预测(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)(额外的文件5.:表S4)。我们发现许多元素与非生物应激的调节有关(图。5.),例如干旱胁迫的MBS元素[29.],低温应力的LTR元素[30.],富含TC的植物保护和压力刺激的重复元素[31.].有趣的是,在激素相关元件(P-box, ABRE, GARE-motif, CGTCA-motif, TGACG-motif, SARE)中,ABRE元件均存在于所有的启动子中PtrLEA基因。该元素主要涉及反对ABA信号通路的非生物应力调节[32.].鉴于证据表明,与非生物胁迫相关的这些因素大量存在于促进者区域中PtrLEA这些基因可能在杨树非生物胁迫响应的调控中发挥重要作用。
PtrLEA无盐胁迫下组织间基因表达分析
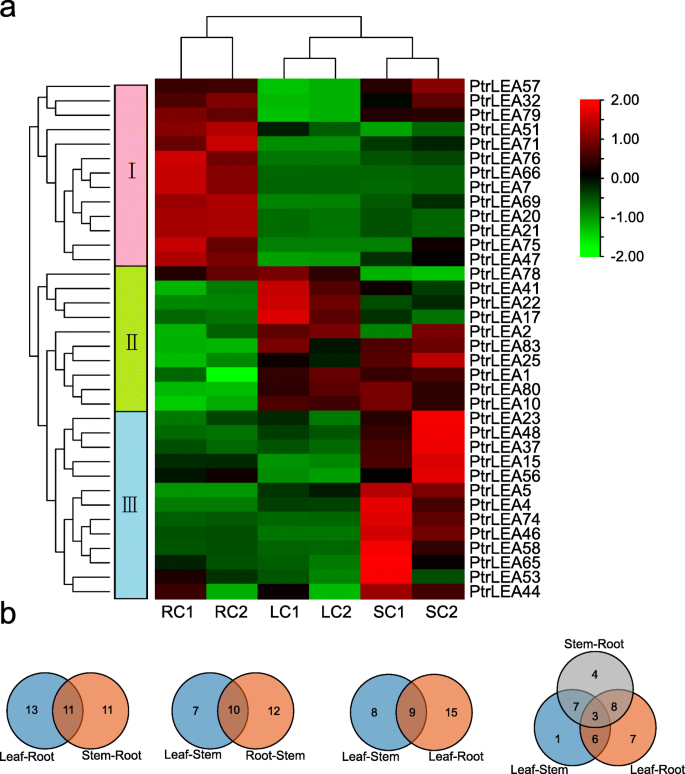
表征组织特异性基因表达模式PtrLEA通过RNA-Seq数据,我们比较了它们在三种组织(根、茎和叶)中的表达(附加文件6.表S5)。该基因可以分为分别以根,叶和茎的高度表达的三组(图。6.一种)。通过成对组织比较,我们在根茎中鉴定了22℃,茎叶中的17℃,并在根叶中24℃(图。6.b) 是的。然后,我们用一个普通组织鉴定了两个这样的比较中的共享DEG(图。6.b)。在根茎茎和茎叶的比较中发现了总共10种共同基因,11种根茎和根叶的这种基因,以及9种茎叶和根叶的这种基因。最后,我们确定了在所有比较中共享的5个基因。基因表达的折叠变化显示在附加文件中7.:表S6。
PtrLEA盐胁迫下基因表达分析
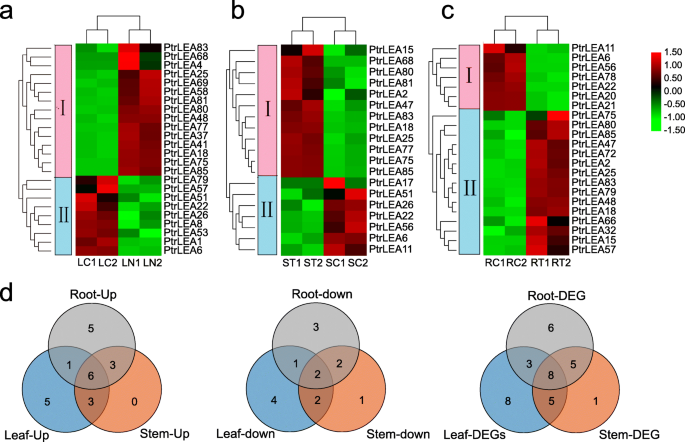
我们探索了PtrLEA利用RNA-Seq数据(附加文件6.表S5)。来自热爱图的统计证据清楚地表明该基因可以分为两组(图。7.a).一组基因在叶片中表达上调,在根中表达下调。另一组基因则表现出相反的模式。7.a).基因表达的折叠变化见附加文件8.: S7表。
对盐胁迫反应的二烷基糖苷类化合物的鉴定有助于揭示基因的功能。共鉴定出24个基因,其中上调基因15个,下调基因9个(URGs和DRGs)。根中有22个DEGs(15个URGs和7个DRGs),茎中有19个DEGs(12个和7个)。三种组织间urg的数量大于drg的数量。根据盐胁迫下基因表达变化的大小,Ptrea85.根系的倍数变化最大(7.25X)。相比之下,ptrea56.为同一组织中最大下调量(−5.85X)。在离开时,ptrea75.有最大折叠变化(10.73x),相反是PtrLEA6(−2.92 x)。在茎中,相似的基因对ptrea68.(8.10 x)Ptrea17(- 6.47x)。此外,我们在组织之间分析了共享的共用(图。7.d)。我们鉴定了根茎对中的13个共同基因,11种叶片中的这种基因,以及叶茎中的13个这样的基因。在三个组织中仅共享8次。
验证PtrLEART-qPCR基因表达
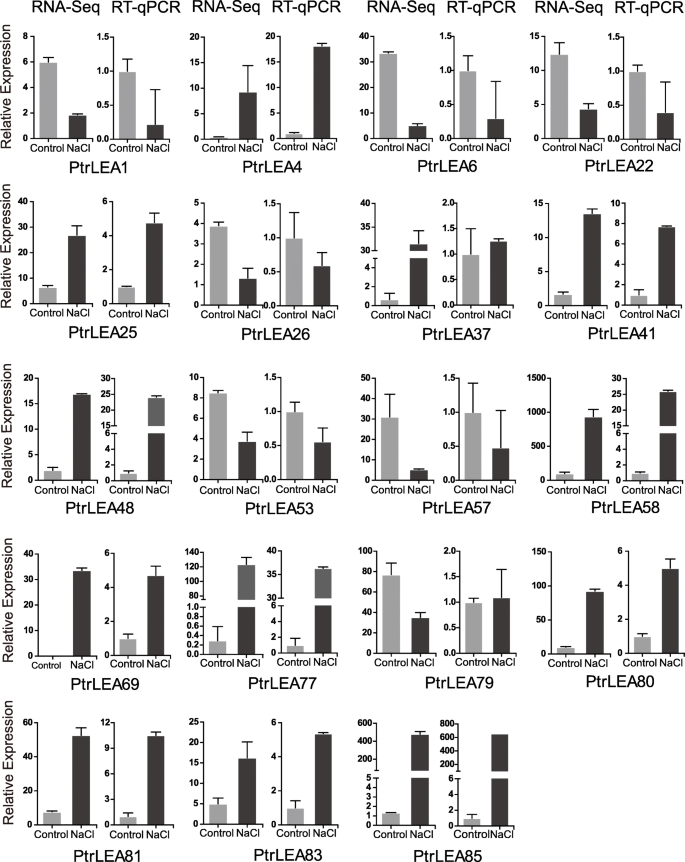
为了验证RNA-Seq数据的准确性,我们对每个组织中鉴定的所有deg进行RT-qPCR分析。总的来说,RT-qPCR和RNA-Seq的结果是一致的,只有少数例外(图。8.).在叶子中,表达数据Ptrea37.和Ptrea57.两种平台之间的差异(图。8.).在茎中,观察到类似的差异ptrea56.(附加文件9.:图。S2)。在根系中,找到了差异Ptrea11.和Ptrea20.(附加文件10.:图S3)。这些值得进一步调查。
节奏空间表达式模式PtrLEA基因响应盐胁迫
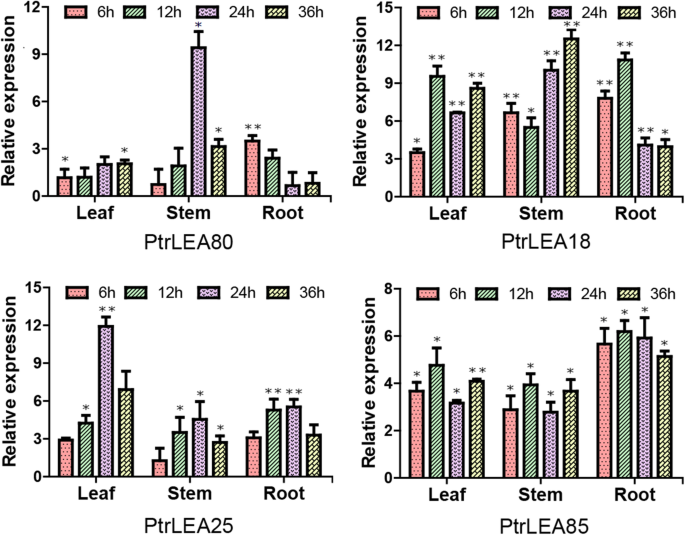
植物通常通过增加抗逆性基因的表达来应对非生物胁迫[33.].为了进一步探讨响应于组织的盐胁迫的动态基因表达模式,我们选择了由组织共享的4种显着上调的次数。使用RT-QPCR,我们探索了四种基因的潮气性表达模式。通常,四个基因在时间过程和三种组织上表示相对高的表达水平。叶子,两者Ptrea85.和Ptrea18.12小时的峰值,而Ptrea25基因在24h达到峰值(图。9.). 在茎中观察到类似的结果Ptrea80.和Ptrea25基因(24小时),相反Ptrea18.基因(12 h) (图。9.).在根中,对比基因介于Ptrea18.(12小时)和Ptrea80.(6小时)(图。9.).这些证据表明,这些基因在组织中表现出不同的表达模式。在同一组织中,不同的基因对盐胁迫表现出相似或独特的反应。
基因共表达与基因本体分析
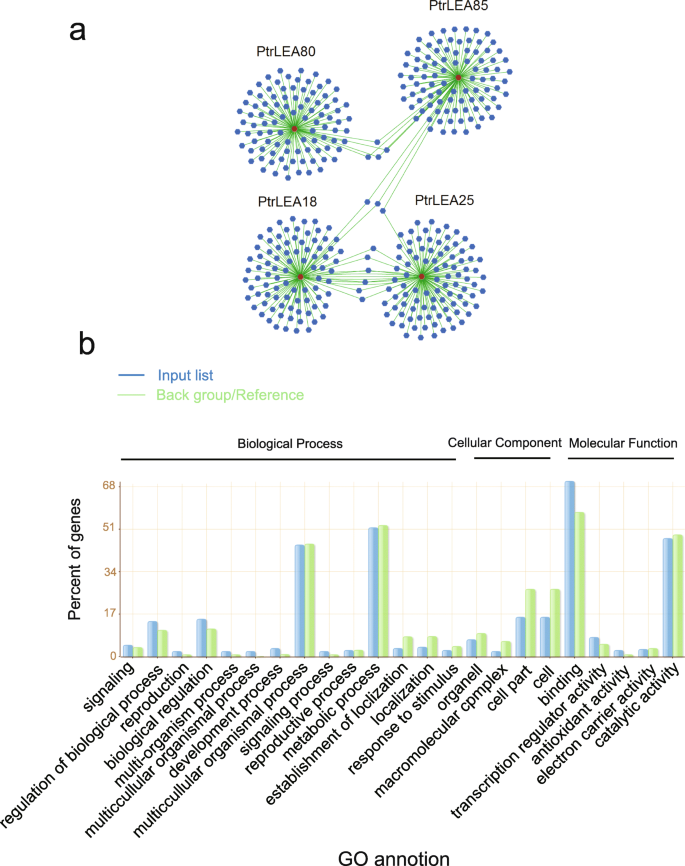
使用Spearman相关性,我们鉴定了用上述四个上调基因显着表达的基因。选择前100个这样的基因用于功能注释(附加文件11.:表S8)。如图1所示。10.a、 四个基因网络的中心对应于四个基因网络PtrLEA基因。有趣的是,一些基因在网络上共享。例如,Ptrea80.网络有四个与之共享的基因Ptrea85.网络。的Ptrea18.和Ptrea25网络共有七个基因(Potri.005G072100.1那Potri.014G070200.1.那Potri.T070900.1那Potri.019G037800.1.那Potri.003G13340.1.那邮政编码:012G092000.1和Potri.011g149300.1.).类似地,两个基因(Potri.001G150400.1和Potri.001G309100.1)由Ptrea85.和Ptrea18.网络。只有一个基因(Potri.017G094500.1.)是由Ptrea85.和Ptrea25网络。股基因可能反映基因规定的类似特征,以应对盐胁迫。
使用Agrigo在线软件(http://systemsbiology.cau.edu.cn/agrigov2/index.php.),我们基于所选基因进行基因设定富集分析。结果显示在图2中。10.我们发现了那么多PtrLEA基因参与各种生物过程,例如生物调节和对刺激的反应。关于分子函数,PtrLEA基因在与非生物应激相关的抗氧化活性中富集。
讨论
LEA基因家族广泛存在并在植物中发挥重要作用,特别是在非生物胁迫下的生长发育调控中[34.].本研究从杨树基因组中鉴定了88个LEA基因,可分为8个聚类。关于基因和集群的数量,我们的结果与以前的研究不同[24.].这种差异可能与植物基因组注释的改进有关,本研究也发现了更多的基因。我们发现LEA_2簇是最大的。在茶中也发现了类似的结果[35.],高粱二色的[36.和小麦[37.].这种变化可能归因于改善植物基因组注释,并且通过不同的分类方法在本研究中鉴定了更多的LEA基因。该群集可以进一步分为两个子集群,这类似于Upland Cotton的研究[38.].我们猜到杨树基因组在进化过程中经历了全基因组复制事件,并且基因组经历了多种染色体重排和融合,促进了许多基因家族的扩增[39.那40].
内含子的收缩PtrLEA基因可能会影响转录到翻译的时间,这可能促进基因的快速表达响应环境变化[41.].我们发现杨树Lea基因家族的内含子相对较少。有趣的是,多达44%的家庭成员不含内含子,53%的基因酸息0-1内含子,只有3%的基因具有3个内含子。这些结果与上一项研究的结果类似[42.].
基因家族进化的机制包括DNA片段重复,串联复制和转换事件[43.]. 重复事件可能导致新基因的出现,这些基因有助于基因功能的多样性,从而提高植物对环境的适应能力[44.].在本研究中,我们发现双串联重复和片段重复事件同时存在PtrLEA基因家庭。片段复制事件(19对)比串联复制事件(4对)更频繁,这表明前者可能是促进扩增的主力PtrLEA基因。此外,我们分析了重复基因对的Ka / Ks比率,其中大多数小于1.因此,我们怀疑PtrLEA基因在进化过程中经历了净化选择。
为了探讨lea基因家族跨越不同物种的进化关系(5),我们选择了双子叶(3)和单子叶(2)植物进行比较。我们发现了Ptrea.基因与桉树的那些分享最好的同源性,以及来自米饭的人的最佳。另外,我们发现了Ptrea.与单子叶植物相比,双子叶植物与基因有更多的共线性基因对。
启动子区顺式元件在基因调控和表达中起着重要作用。因此,对顺式元件的研究有助于鉴定与抗逆性和植物发育等特定功能相关的基因。许多已知的此类元件已被报道参与植物胁迫响应,如MBS、ABRE、P-box、LTR和TGACG-motif。我们发现ABRE元素存在于所有的启动子中PtrLEA基因和其他元素出现在一些基因中。这些结果与以往的研究结果相似[37.].这一系列的证据表明PtrLEA基因可能调节对杨树中非生物胁迫的反应。
使用RNA-SEQ数据,我们发现表达了PtrLEA无盐处理时,不同组织间基因差异显著。来自比较基因组学和功能注释的证据表明PtrLEA基因在调节杨树生长和发展中起重要作用。例如,AT2G46140型,这是同源的Ptrea15.,在调节初级和次生代谢物的调节中起重要作用[45.].两个都AT1G02820(同源的ptrea58.)以及AT2G46300(同源的Ptrea17.)影响花粉萌发和试管生长[46.].AT1G32560(同源的PtrLEA4)参与植物色彩A-信号通路[47.].
在盐胁迫下,植物会激活某些信号通路,以诱导相应的细胞反应[12.].应激对相应基因的诱导作用可以解释为这些基因可能参与了途径。在本研究中,我们通过对比盐处理确定了各组织中的DEGs。在根系中检测到24个,茎中检测到19个,叶中检测到23个。在这些基因中,有8个基因在组织中共享。很有趣,两个(ptrea79.和Ptrea57.)发现八个基因在组织中显示出相反的表达模式。然后,我们怀疑两种基因在调节杨树生长和发育和对盐胁迫的反应中起复杂功能。来自基因函数注释的证据表明,八个共享基因参与了复杂功能的调节。例如,AT5G06760.1(同源的Ptrea85.)参与碳水化合物代谢促进拟南芥生长和发展[48.]. 拟南芥基因AT2G36640.1(同源,Ptrea75)是否能够与之互动BHLH109增强细胞对紧急情况的耐受性[49.].两个都AT5G06760.1(同源的Ptrea85.)以及AT3G54200.1.(同源的Ptrea80.)在拟南芥中的ABA信号通路调节中发挥重要作用[50.那51.].AT4G02380.1(同源的Ptrea18.)与拟南芥的植物抗冻性有关[52.].我们利用四个共享的上调基因,分析了基因的时空表达模式。研究发现,这些基因在不同的时间过程和组织中表现出不同的模式,在同一组织中,不同的基因表现出相似或独特的对盐胁迫的响应,揭示了植物非生物胁迫过程调控网络的复杂响应。
如果某些基因在生理过程中或在不同的组织中总是有相似的表达变化,那么我们有理由相信这些基因在功能上是相关的。在本研究中,我们以上述四个共享基因为研究对象,构建了基因共表达网络。事实上,这四个基因网络通过每个网络中共享的基因相互交联,这表明基因的调控是复杂的PtrLEA基因对盐胁迫的反应。然后分析共表达基因的功能注释。我们鉴定了与非生物胁迫相关的富集氧化石墨烯术语,如生物调控、对刺激的反应和抗氧化活性。来自比较基因组学的证据表明,网络中的许多基因与植物发育和对非生物胁迫的反应有关。例如,AT4G35090.1(Ortholog的Potri.008G109100.1)调节植物根生长和盐胁迫耐受性[53.],它还通过去除反应性氧物种来调节花粉的叶片和脱落[54.].相似地,高铁1,这是直观的Potri.016G136500.1,参与种子成熟[55.].HSP101(同源的Potri.015G056900.1)调节对热应激的反应[56.].这些证据表明PtrLEA基因可能在这些复杂的生物学功能的调节中起着中心作用。
盐胁迫下,植物可以产生一系列的调节机制,如渗透平衡、抗氧化系统、ROS清除机制等[57.].这些机制相互作用,提高植物的抗逆性。包括LEA蛋白在内的大量非生物应激相关基因参与了该机制[34.),糖基转移酶(58.]和ROS缩放基因[59.].这些基因可以调节由非生物胁迫引起的生理代谢紊乱。Lea基因广泛参与非生物应激,并在改善植物胁迫耐受性方面发挥重要作用[34.].在这项研究中,我们分析了mRNA表达的PtrLEA基因。然而,对基因的机制理解需要进一步的研究。此外,还有大量与应激相关的基因有待挖掘。通过基因工程组合中心基因的筛选,对培育耐盐杨树具有广阔的应用前景。
结论
在这项研究中,我们对杨树的Lea基因家族进行了系统研究。我们确定了88.PtrLEA并根据蛋白质序列的相似性将它们分为8个簇。这些基因分布在杨树的16条染色体上。利用盐胁迫和非盐胁迫两种条件下的RNA-Seq数据,分别在根、茎和叶中检测到24、22和19个DEGs。然后,我们对组织共享的四个上调基因进行时序表达分析,建立基于基因共表达网络和功能注释。这些证据表明PtrLEA基因在杨树生长发育调控和对盐胁迫的响应中起着重要作用。
方法
lea蛋白的鉴定杨树trichocarpa
基因组数据杨树trichocarpa是从Phtozome在线网站获得的(https:///phytozome.jgi.doe.gov/pz/portal.html.),从Pfam数据库(PF10714、PF0492、PF00257)下载典型LEA蛋白结构域(PF03760、PF03168、PF03242、PF02987、PF0477、PF10714、PF0492、PF00257)。http://pfam.xfam.org/).通过使用HMMER3.0计划将潜在的杨树lea蛋白扫描杨树基因组[60],然后用SMART数据库进行人工验证(http://smart.embl-heidelberg.de/)及PFAM数据库(http://pfam.xfam.org/).去除没有LEA结构域的蛋白。利用ExPASy网站()预测PtrLEA蛋白的分子量和等电点http://web.expasy.org/protparam/).
LEA蛋白的基因结构和系统发育树分析
杨树基因组序列是从植物血红素数据库获得的(https:///phytozome.jgi.doe.gov/pz/portal.html.).将每种Lea基因的编码序列和基因组序列对齐以分析基因结构,然后用TBTOOLS软件进行可视化[61].两者LEA蛋白序列杨树trichocarpa和拟南芥从Phytozome数据库和皮重数据库下载(https://www.arabidopsis.org/),分别。使用全长蛋白质序列,我们使用ClustalW [62].系统发育分析使用MEGA7软件进行,包括1000次重复的最大似然法bootstrap分析[63].
染色体地点和杨树Lea基因的基因重复(PtrLEA)
LEA基因家族的DNA序列被绘制到杨树trichocarpa.通过TBtools软件计算基因在染色体或支架上的分布[61].的重复事件PtrLEA使用MCscan对计算基因[26.].此外,我们使用了双联合绘图器[61]来分析PtrLEA和来自其他物种的同源基因(大叶桉那Solanum lycopersicum.那拟南芥那Zea Mays.和栽培稻),然后使用TBtools软件进行可视化[61].我们使用了Kaks_calculator软件[64]计算重复基因对的非同义替代和同义替代(Ka / Ks)的比率。我们还应用了Koch的方法[65]来计算每个基因对的发散时间。
Cis-acting元素分析
对于每一个人PtrLEA开始密码子上游2000 bp的DNA序列从Phytozome v12.1数据库(https:///phytozome.jgi.doe.gov/pz/portal.html.).然后我们使用在线工具PlantCRAE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)提取通过使用TBTOOLS软件来可视化的CIS作用元素[61].
植物材料和应力处理
本研究中使用的植物材料是Di-Hpploid黑杨,其中在中国哈尔滨东北林业大学的实验领域种植。在25℃和16/8-H光/黑暗循环的温室中,在温室中为瓶子生长在瓶子中。对于盐胁迫,分别用150mM盐处理1个月大的杨树幼苗,分别为0h,6小时,12h,24h和36小时。然后在每个时间点收集各自根,茎和叶子的样品并用液氮处理,然后在-80°C冰箱中储存。所有治疗方法都有三种生物重复。
RNA序列的分析与验证
使用RNA-SEQ,W.E探索基因表达模式PtrLEA盐胁迫下不同组织的基因家族。数据在我们之前的研究中描述了[66].我们使用了deseq2 [67]用两个标准鉴定差异表达的基因(DEG),包括绝对LOG2(折叠变化)> = 1并调整P.值< = 0.05。为了验证RNA-Seq数据的准确性,我们还对差异表达基因进行了RT-qPCR分析。详情请参阅我们以往的研究[68].引物序列在附加文件中给出12.:表S9。
基因共表达分析和基因本体注释
我们选择了基于共表达的基因网络分析的有趣基因。我们将Spearman相关系数从RNA-SEQ数据中选择了所选相关基因[66].基因选择的基础P.-Value> 0.05。然后我们专注于使用Cytoscape软件进行网络分析的前100个基因[69]为了可视化。通过使用Agrigo V2.0进行基因本体(GO)基础的功能注释[70].
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。本研究中使用的原始测序数据已保存在NCBI SRA中,登录号为SRP267437。
缩写
- 李:
-
晚期胚胎发生丰富
- 米娅:
-
几百万年前
- 度:
-
差异表达基因
- SMP:
-
种子成熟蛋白
- K a:
-
非同义替代率
- Ks:
-
同义替换率
- 荨麻和DRGS:
-
上调和下调的基因
- 走:
-
基因本体论
- FPKM:
-
每千碱基每百万映射读取的片段数
参考文献
- 1。
植物分子胁迫响应面临气候变化。植物科学进展,2010;
- 2。
朱镕基JK。植物非生物胁迫信号传导与响应。细胞。2016;167(2):313 - 24。
- 3.
Campo S、Baldrich P、Messeguer J、Lalanne E、Coca M、San Segundo B。钙依赖性蛋白激酶的过度表达通过防止膜脂过氧化提高水稻的耐盐性和耐旱性。植物生理学。2014;165(2):688–704.
- 4.
yu y y x,yue w,杨q,张y,汉x,杨f,王r,李g.鉴别Caragana Korshinskii(Fabaceae)的Lea系列成员的识别和CKLEA2-3的功能表征,响应拟南芥的非生物胁迫.Braz J Botany。2019; 42(2):227-38。
- 5。
Dure L 3,Genlay Sc,Galau Ga。棉籽胚胎发生的发育生物化学和发芽:改变信使核糖核酸种群,如体外和体内蛋白质合成所示。生物化学。1981; 20(14):4162-8。
- 6.
芬克尔斯坦RR。脱落酸不敏感突变为拟南芥晚期胚胎发生丰富(lea)基因的表达提供了阶段性特异性信号通路的证据。中国生物医学工程学报。1993;238(3):401-8。
- 7.
关键词:水稻,LEA基因,基因组尺度,鉴定,遗传多样性植物科学。2007;172(2):414 - 20。
- 8.
斯泰西·拉、埃斯佩兰·M、塞博·拉尔森S、霍隆·K、赫尔森·E、雅各布森·KS。第1组晚期胚胎发生丰富(Lea)基因的进化:大麦leab19基因家族的分析。植物分子生物学。1995;28(6):1039–54.
- 9.
聪明的MJ。LEA蛋白的持续谜题。《自然科学》杂志上。2007;94(10):791 - 812。
- 10。
Hunaul G,Jaspard E. LeapdB:晚期胚胎发生丰富的蛋白质的数据库。BMC基因组学。2010; 11:221。
- 11.
法鲁克M、瓦希德A、小林N、藤田D、巴士拉SMA。植物干旱胁迫:效应、机制和管理。Agron Dev.2009年;29(1):185–212.
- 12.
巴厘岛AK,DAS AB。耐盐性和盐度对植物的影响:综述。Ecotoxicol环保安全。2005; 60(3):324-49。
- 13。
Garay-Arroyo A,Colmenero-Flores JM,Garciarrubio A,Covarrubias AA。在水赤字条件下,原核生物和真核生物中的高度亲水性蛋白质是常见的。J Biol Chem。2000; 275(8):5668-74。
- 14。
Tompa P,Banki P,Bokor M,Kamasa P,Kovacs D,Lasanda G,Tompa K.蛋白质 - 水和蛋白质缓冲液在本质上非结构化的植物脱氢液的水溶液中的相互作用:NMR强度和DSC方面。Biophys J. 2006; 91(6):2243-9。
- 15.
坎达特A、帕兹基维茨G、内韦乌M、高蒂埃R、洛根DC、阿维兰热马谢尔M-H、马谢尔D。在拟南芥中,胚胎发育后期丰富的蛋白质普遍分布在细胞室中,为抵御非生物胁迫提供了量身定制的保护。植物细胞。2014;26(7):3148–66.
- 16.
Chakrabortee S, Tripathi R, Watson M, Schierle GSK, Kurniawan DP, Kaminski CF, Wise MJ, Tunnacliffe A.本质上无序蛋白作为分子盾牌。摩尔BioSyst。2012; 8(1): 210 - 9。
- 17.
俞j,赖ym,wu x,wu g,guo ck。编码Iea蛋白的OSEM1的过度表达赋予米饭中的增强耐旱性。Biochem Biophys Res Communce。2016; 478(2):703-9。
- 18.
LIM CW,LIMS,BAEK W,LEE SC。辣椒晚期胚胎发生丰富的蛋白质CALEA1作用于调节脱落酸信号传导,干旱和盐应激反应。physiol植物。2015; 154(4):526-42。
- 19.
关键词:拟南芥,胚胎发育晚期,盐胁迫,过量表达,耐盐性生物化学与生物物理学报,2014;
- 20。
王M,李鹏,李C,潘y,江x,朱d,赵q,yu J.Silea14,一种新型非典型lea蛋白,赋予福克斯尾部的非生物胁迫阻力。BMC植物BIOL。2014; 14:290。
- 21。
王L,李X,陈S,刘G.具有组成型麦塔(3)的转基因lemus植物中转基因leymus植物的增强耐旱性。Biotechnol Lett。2009; 31(2):313-9。
- 22。
刘y,王l,xing x,sun l,pan j,kong x,张m,zhm,zmlea3,来自玉米(zea mays l的lea蛋白),参与生物和非生物胁迫。植物细胞生理。2013; 54(6):944-59。
- 23。
关键词:SmLEA,耐盐性,耐干旱,大肠杆菌,丹参原生质。2014;251(5):1191 - 9。
- 24。
蓝涛,高洁,曾庆燕。毛叶杨胚胎发育晚期丰富蛋白基因家族的全基因组分析。中国生物医学工程学报,2013;
- 25。
Jones Dt,Taylor WR,Thornton JM。蛋白质序列的快速产生突变数据矩阵。计算Appl Biosci。1992年; 8(3):275-82。
- 26。
王颖,唐浩,DeBarry JD,谭鑫,李俊,王鑫,Lee T-h, Jin H, Marler B, Guo H,等。MCScanX:一个用于基因共线性和共线性检测和进化分析的工具包。2012;40(7):e49。
- 27。
张Z,李继,赵XQ,王家,黄酸,yu J.Kaks_Calculator:通过模型选择和模型平均计算KA和KS。基因组学蛋白质组学生物信息学。2006; 4(4):259-63。
- 28。
张W,王某,俞F,唐家璇,山X,宝酸,yu l,王h,fei z,李j。甘蓝甜叶的基因组特征及表达探讨(芸苔甘蓝醛。Capitata.L.)揭示了他们在寒冷和干旱疾病的作用中的作用。BMC基因组学。2019; 20:93。
- 29。
关键词:玉米,胁迫诱导基因,ZmRXO1,启动子,克隆,功能分析Plant Mol Biol Rep. 2015;33(2): 200-8。
- 30.
邓恩马,白宫,秋千,休马。鉴定来自大麦(Hordeum Vulgare L.)的低温响应基因(BLT4.9)中的启动子元素。植物mol biol。1998年; 38(4):551-64。
- 31。
Sun Q,Gao F,Zhao L,Li K,Zhang J.鉴定Thellungiella Halophila盐胁迫反应的TSVP1启动子中新的130bp CIS作用元件。BMC植物BIOL。2010; 10:90。
- 32。
关键词:水稻,干旱响应,启动子,基因工程,功能分析足底。2014;239(1):47-60。
- 33。
朱JK。植物耐盐性。植物科学趋势。2001;6(2):66–71.
- 34。
王WX,维诺卡尔B,奥特曼A。植物对干旱、盐分和极端温度的反应:植物抗逆基因工程研究进展。足底。2003;218(1):1–14.
- 35。
金XF,Cao D,Wang ZJ,MA LL,TIAN KH,LIU YL,GONG ZM,ZHU XX,Jiang CJ,LI YY。茶叶植物LEA蛋白基因家族的基因组鉴定及表达分析揭示了种子发育和非生物应激反应的参与。SCI REP。2019; 9:15。
- 36。
关键词:非生物胁迫,晚期胚胎形成丰富(late embrgenesis abundant, LEA)基因,转录组,转录组高粱二色的《科学公共科学图书馆·综合》2019;
- 37。
小麦胚胎发育晚期丰富蛋白编码基因家族的全基因组鉴定与表征:发育和胁迫过程中的进化和表达谱。基因。2020;14446:736。
- 38。
Magwanga-RO,Lu P,Kirungu-JN,Lu H,Wang X,Cai X,Zhou Z,Zhang Z,Salih H,Wang K,等.陆地棉晚胚发生丰富蛋白家族的特征及其在抗旱性中的作用。BMC基因。2018;19:6.
- 39。
托斯康········乔西奥,詹森斯,波利曼·j,格里戈里艾尔,我,地狱,普通n,拉尔夫斯,rombauts s,萨拉玛夫A等。黑色棉布的基因组,Populus trichocarpa(&灰色)。科学。2006; 313(5793):1596-604。
- 40.
李X,尹x,王h,李俊,郭c,高h,zheng y,风扇c,王x。苹果(Malus x domestica borkh)的基因组识别与分析。树遗传学基因组织。2015; 11(1):808。
- 41.
Jeffares DC,Penkett CJ,巴勒J.快速调节基因是内含子贫困。趋势类型。2008; 24(8):375-8。
- 42.
刘D,Sun J,Zhu D,Lyu G,张C,刘J,王H,Zhang X,Gao D.在小麦谷物成熟过程中晚期胚胎发生 - 丰富(LEA)基因的基因组鉴定和表达谱(Triticum Aestivum.l .)。基因。2019;10(9):696。
- 43。
Kong H,Landerr Ll,Frohlich MW,Leebens-Mack J.Ma H,Depamphilis CW:植物SKP1基因家族的基因复制模式在植物植物中的多种机制的探讨,用于快速基因出生的多种机制。工厂J. 2007; 50(5):873-85。
- 44。
弗莱格尔,文德尔。植物中的基因复制和进化新颖性。新植醇。2009;183(3):557 - 64。
- 45。
Hanada K, Sawada Y, Kuromori T, Klausnitzer R, Saito K, Toyoda T, Shinozaki K, Li WH, Hirai MY。拟南芥中重复基因对初级和次级代谢物的功能补偿。中国生物医学工程学报,2011;
- 46。
王y,张w-z,歌曲l-f,zou j-j,su z,wu w-h。转录组分析显示基因表达的变化伴随着拟南芥的花粉萌发和管生长。植物理性。2008; 148(3):1201-11。
- 47。
Hudson Me,Lisch Dr,Quail ph。FHY3和FAR1基因编码通过植物浮味途径对参与基因表达调节的转座酶相关蛋白。工厂J. 2003; 34(4):453-71。
- 48。
Veyres N、Danon A、Aono M、Galliot S、Karibasappa YB、Diet A、Grandmottet F、Tamaoki M、Lesur D、Pilard S等。拟南芥甜味突变体在碳水化合物代谢方面受到影响,在生长、发育和衰老的控制方面存在缺陷。植物J。2008;55(4):665–86.
- 49。
nowak k,gaj md。BHLH109在拟南芥体细胞胚胎诱导中的胁迫相关功能。J植物理性。2016; 193:119-26。
- 50。
黄酸,林W-C,程W-H。盐过敏突变体9是一种核仁APUM23蛋白,对于拟南芥中的ABA信号通路相关联的盐敏感性必需。BMC植物BIOL。2018; 18:40。
- 51。
宝益,歌曲wm,张hx。Arabidopsis NHL家族在ABA和压力反应的作用。植物信号表现。2016; 11(5):E1180493。
- 52。
拟南芥BZR1通过cbf依赖和非cbf依赖途径正向调控拟南芥的冻融耐受性。摩尔。2017;10(4):545 - 59。
- 53。
Velinov V,Vaseva I,Zehirov G,Zhiponova M,Georgieva M,Vangheluwe N,Beeckman T,Vassileva V. OfMig1gene编码Nudc结构域蛋白的过度表达增强了根本生长和非原生胁迫耐受性。前植物SCI。2020; 11:815。
- 54。
徐P,Chen H,Cai W.转录因子CDF4通过调节拟南芥中的脱落酸和反应性氧物种途径促进叶片衰老和花器官脱落。Embo Rep。2020; 21(7):E48967。
- 55。
周Y,Tan B,Luo M,Li Y,Liu C,Chen C,Yu C-W,Yang S,Dong S,Ruan J,等。组蛋白Deaetylase19与HSL1相互作用并参与拟南芥幼苗中的种子成熟基因的抑制。植物细胞。2013; 25(1):134-48。
- 56。
吴j-r,王l-c,林y-r,weng c-p,yeh c-h,wu s-j。对ABA 1(ERA1)突变体的拟南芥热不宽容5(HIT5)/增强响应揭示了蛋白质法尼基化在植物反应中对热应激的关键作用。新植物。2017; 213(3):1181-93。
- 57。
梁wj,马xl,万p,liu ly。植物盐水耐受机制:综述。Biochem Biophys Res Communce。2018; 495(1):286-91。
- 58。
Ahrazem O,Rubio-Moraga A,Trapero-Mozos A,Gómez-cadenas A,Gómez-cadenas A,Gómez-gómezL。来自甘油烷烃的应激诱导糖基转移酶的异位表达增强了拟南芥中的盐和氧化应激耐受性,而改变锚固根部形成。植物SCI。2015; 234:60-73。
- 59。
Apel K,Hirt H.反应性氧物种:代谢,氧化应激和信号转导。Annu Rev植物Biol。2004; 55:373-99。
- 60。
Finn Rd,Clement J,Eddy SR。HMMER Web服务器:交互式序列相似性搜索。核酸RES。2011; 39:W29-37。
- 61.
关键词:生物信息学,大数据,交互分析,TBtools摩尔。2020;13(8):1194 - 202。
- 62.
Thompson JD、Gibson TJ、Higgins DG。使用ClustalW和ClustalX的多重序列比对。生物信息学。2002;2(2):3.
- 63.
Kumar S、Stecher G、Tamura K。分子进化遗传学分析7.0版,用于更大的数据集。分子生物学。2016;33(7):1870–4.
- 64.
王D,张Y,张Z,朱家,余J.Kaks_Calculator 2.0:一种工具包,包括伽马系列方法和滑动窗策略。基因组学蛋白质组学生物信息学。2010; 8(1):77-80。
- 65.
Koch Ma,Haubold B,Mitchell-Olds T.拟南芥,阿拉伯药和相关属(Brassicaceae)中的Chalcone合成酶和酒精脱氢酶基因酶的比较进化分析。mol Biol Evol。2000; 17(10):1483-98。
- 66.
赵K,李S,姚W,周B,李R,蒋T。杨树碱性螺旋-环-螺旋基因家族特征及其盐胁迫下的组织差异表达。皮尔。2018;第6章:e4502。
- 67。
爱情MI,Huber W,Anders S.使用DESEQ2的RNA-SEQ数据的折叠变化和分散的调节估计。基因组Biol。2014; 15(12):550。
- 68。
关键词:杨树,耐盐性,NAC13基因,功能特性植物科学。2019;281:1-8。
- 69。
关键词:细胞景观,生物分子相互作用网络,软件环境,细胞景观基因组研究》2003;13(11):2498 - 504。
- 70.
田T,刘y,yan h,你q,yi x,du z,xu w,su z.农业多v2.0:2017年农业社区的GO分析工具包,2017年更新。核酸RES。2017; 45(W1):W122-9。
致谢
我们感谢仁华李议员在修订本文中的努力。我们还感谢同事在实验室进行有用的技术援助。我们还感谢编辑和审稿人的批判性评估。
资金
中央大学的基本研究资金(2572018CL03)和111个项目(B16010)的基础研究资金支持了高通量排序的费用,通过国家自然科学基金(31570659)支持定量实时聚合酶的费用(31570659)。发布费用由黑龙江省的应用技术研发计划(GA20B401)支持。
作者信息
隶属关系
贡献
TJ和BZ设计的研究。ZC进行实验,数据分析并写了稿件。在数据分析中执行XZ,KZ,GF和LL。RL和WY修订了稿件。所有作者均阅读并批准了手稿。
相应的作者
伦理宣言
伦理批准并同意参与
本研究中使用的植物材料是Di-Hpploid杨树simonii×Populus nigra.已在东北林业大学,哈尔滨,中国的实验领域种植,植物样本所需的允许没有许可。本研究不需要道德批准或同意,而不涉及任何濒危或受保护的物种。
同意出版
不适用。
相互竞争的利益
作者声明他们没有利益冲突。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
本文鉴定的88个LEA基因列表。
附加文件2:图S1。
Poplar Lea蛋白的系统发育分析。
附加文件3:表S2。
Poplar Lea基因中的23对重复事件及其KA / KS比例。
附加文件4:表S3。
杨树LEA基因与其他物种的同源关系。
附加文件5:表S4。
CIS-COMPERTOTY元素列表PtrLEA基因启动子.
附加文件6:表S5。
表达数据的PtrLEA在盐下三种不同组织中的基因,无盐胁迫。
附加文件7:表S6。
差异表达的折叠变化PtrLEA不同组织的基因没有盐胁迫。
附加文件8:表S7。
差异表达的折叠变化PtrLEA盐胁迫下的基因。
附加文件9:图S2
.茎中RNA-Seq和RT-qPCR的DGE水平。
附加文件10:图S3。
根中RNA-Seq和RT-qPCR的DGE水平。
附加文件11:表S8。
基因表达的前100个相关基因Ptrea85.那Ptrea18.那Ptrea25和ptrea80。
附加文件12:表S9。
本研究中使用的引物序列。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
程卓,张晓,姚伟。等等。杨树晚期胚胎发生 - 丰富(LEA)基因家族的基因组视图和结构和功能分析。BMC植物BIOL.21,110(2021)。https://doi.org/10.1186/s12870-021-02872-021-02872-3.
已收到:
公认:
发表:
关键字
- 杨树
- lea
- 进化分析
- 表达式模式
- 盐胁迫