摘要
背景
香蕉是一种热带水果,在世界范围内具有很高的经济影响力。冷胁迫对香蕉的发育和生产有很大的影响。
结果
在本研究中,我们研究了MaMAPK3而且MaICE1涉及香蕉的耐寒性。RNAi的作用MaMAPK3打搅(穆萨spp。“打搅”;对ABB集团的耐寒性进行了评估。树的叶子MaMAPK3RNAi转基因植株表现出萎蔫和严重坏死的症状,而宽型(WT)植株在低温暴露后仍保持正常。RNAi的MaMAPK3显著改变了冷反应基因的表达,氧化还原酶活性在WT植株中发生了显著变化,而在转基因植株中未见变化。MaICE1与MaMAPK3互作,表达水平MaICE1显著降低了MaMAPK3RNAi转基因植物。表达的MaICE1在卡文迪什香蕉(穆萨spp. AAA组)表明,转基因植株的抗寒性优于WT植株。的豆荚P7基因显著上调MaICE1-过表达的转基因植株与WT植株相比,POD P7被证实与MaICE1互作。
结论
综上所述,我们的工作为MaMAPK3-MaICE1-MaPOD P7通路积极提高单子叶香蕉的耐寒性提供了新的和可靠的证据,为耐寒香蕉或其他农业品种的分子育种提供了新的启示。
背景
香蕉(穆萨),包括甜点和烹饪类型,是大型草本植物,多年生但单果性[1].Musa起源于东南亚和西太平洋地区,驯化过程大约开始于7000年前[2].它涉及到由人类迁移培养的不同物种和亚种之间的杂交[3.],选择无籽二倍体和三倍体,以及通过营养繁殖广泛分散的孤雌杂种。目前一半的生产依赖于来自单一三倍体基因型(卡文迪许)的一些无性系[4].香蕉是数百万人的主食和水果,是几个发展中国家的主要出口商品之一,代表着最大的国际水果贸易[5,6,7].
温度是香蕉生长发育和产量的重要制约因素,当温度低于12℃时,香蕉的生长和产量会受到不可逆转的影响[8].和许多起源于热带和亚热带的重要作物一样[9),穆萨不同品种表现出不同的抗寒性,其中大蕉(穆萨spp。“打搅”;ABB集团的耐寒性比Cavendish Banana (穆萨spp。卡文迪什;AAA集团)。了解香蕉冷信号通路的调控机制,对提高香蕉品种的耐寒性具有重要意义。由于分子生物学研究中基因型的高度杂合性和遗传背景的复杂性,如重要性状相关基因功能的验证,长期以来香蕉抗寒性的研究一直是一个挑战[1,2].
MAPK级联反应已被证实与许多非生物因素有关[10,11,12,13,14,15].植物质膜受体感知威胁并激活丝裂原激活蛋白激酶激酶(MAPKKK)。MAPKKK将丝裂原激活蛋白激酶(MAPKK)磷酸化,随后,丝裂原激活蛋白激酶(MAPK)将被激活的MAPKK磷酸化[16].MAPKKK1-MAPKK2-MAPK4/6级联已被证实参与冷处理的正向调控[15,17].MAPKK2过表达拟南芥结果增强了耐寒性,而mapkk2突变体表现出更高的冷冻敏感性[15].MAPK4/6被激活的MAPKK2磷酸化,用于调节下游成分以适应冷胁迫[15,18].之前的一篇报道表明,MYB15是MAPK6的磷酸化底物,它与抗寒性有关[19].然而,去年也报道了一项冲突的发现,即MPK6不是MAPKK2的下游元件,MAPKKK1-MAPKK2-MAPK4通路构成性地抑制了MAPK3和MAPK6增强抗寒能力的活动[20.].另一个级联MAPKK4/5-MAPK3/6也能对冷应激做出反应。然而,MAPK3/6在抗寒方面的功能存在争议。在烟草和水稻中,过表达MAPK3基因通过刺激的表达赋予耐寒性天哪基因(21,22].在拟南芥, ICE1的稳定性和转录活性。ICE1是一种调节蛋白表达的基本螺旋-环-螺旋转录因子(bHLH TF)CBF基因,被MAPK3和MAPK6的磷酸化减少,导致抗寒性受损[20.,23].总的来说,MAPKKK1-MAPKK2-MAPK4/6和MAPKK4/5-MAPK3/6级联在冷胁迫下被激活,而它们的潜在调控机制在不同的物种中似乎是不同的。
一些bHLH家族成员在MAPKs的下游发挥作用。它们的稳定性和转录活性因MAPK级联的磷酸化而受损[20.,21,23].在拟南芥, MAPKK4/5-MAPK3/6级联可通过调节ICE1蛋白的稳定性负向调节冷反应,而MAPKKK1-MAPKK2-MAPK4级联则构成抑制MAPK3和MAPK6的活性,在冷反应中发挥积极作用[20.,23].在水稻中,OsbHLH002/OsICE1被OsMAPK3磷酸化,相互作用抑制OsbHLH002/OsICE1的泛素化,促进表达OsTPP1并提高抗寒性[21].总共是162 167 152bHLH基因已被鉴定拟南芥、大米(24,以及番茄[25),分别。此外,植物中的bHLH蛋白参与多种生物活动,包括开花[26,表毛和根毛分化[27,28,类黄酮生物合成[29,叶绿体生长[30.,光形态发生31,异喹啉生物碱[32和花青素生物合成[33].大量证据表明bHLH转录因子(TFs)在植物中也有应对寒冷的基本功能。例如,bHLH tf ICE1和ICE2拟南芥和番茄的SlICE1a已经被证明参与了对冷胁迫的反应[34,35].由于低温暴露对果实的巨大伤害,bHLH - tf在抗寒方面的作用一直是果树科学研究的热点。在苹果中,MdCIbHLH1蛋白已被发现与的启动子结合MdCBF2并正向调节不同物种的抗寒性[36].在枳壳三叶的,一种名为PtrbHLH的bHLH TF调节过氧化物酶介导的过氧化氢清除,导致转基因烟草和柠檬的抗寒性增强[37),而PtrICE1三叶橙通过与精氨酸脱羧酶相互作用调节多胺含量,正向调节烟草和柠檬的抗寒性[38].在葡萄,VabHLH1是从耐寒的中国野生动物中克隆出来的葡萄属amurensis,赋予耐寒性拟南芥[39].
我们实验室从2012年开始,利用转录组学、蛋白质组学、磷蛋白质组学、遗传转化等多种生物学方法,对香蕉耐冷性的分子机制进行研究[40,41,42,43,44].我们发现MAPK级联、ICE1信号通路和抗氧化机制在香蕉的抗寒性中起关键作用。为了对MAPK级联和ICE1信号通路之间的相关性提供更有价值的见解,我们研究了MAPK级联和ICE1信号通路之间的作用MaMAPK3而且MaICE1在香蕉的低温信号。在本研究中,我们分析了宽型(WT)两个个体的表型、基因表达、潜在相互作用和抗氧化能力的差异MaMAPK3RNAi转基因‘大蕉’株系和两个个体MaICE-过表达转基因卡文迪许香蕉系。我们的数据表明,MaMAPK3-MaICE1-MaPOD P7通路可能正向调控香蕉的抗寒性。
结果
RNAi的MaMAPK3降低转基因植物的耐寒性
我们利用所有的序列在穆萨基因组中鉴定出20个独立的等价转录本拟南芥MAPK基因作为参考(无花果S1。A)所有人的表情MaMAPKs冷胁迫3 h后,采用实时荧光定量PCR (qRT-PCR)法检测基因组中的蛋白质含量。我们的数据表明,只有表达MaMAPK3a在冷胁迫下,卡文迪什香蕉和“大蕉”的含量显著增加(无花果S1。B).此外,表达MaMAPK3a大蕉的含量几乎是卡文迪什香蕉的5倍。作为一个结果,MaMAPK3a(MaMAPK3如下)为本研究的研究对象。
在本研究中,我们利用绿色荧光蛋白(GFP)的荧光来评估MaMAPK3在香蕉原生质体中的亚细胞定位。的开放阅读框(ORF)MaMAPK3与GFP n端和c端处于同一帧,MaMAPK3-GFP融合构建未检测到信号。用GFP-MaMAPK3融合构建物转化的细胞的细胞核和细胞质中均检测到绿色荧光(无花果S2。A),在用控制载体转化的细胞中也发现了同样的结果(无花果S2。B).这些结果表明MaMAPK3位于细胞核和细胞质中。
我们试图获得MaMAPK3过度表达,MaMAPK3 -“大蕉”植物的RNAi系。然而,所有MaMAPK3过表达植株在萌发和植株再生过程中出现褐变和死亡(S3无花果。).因此,只有转基因‘大椒’植株的表达量降低MaMAPK3RNAi方法是可行的,在本研究中有报道。共获得30个耐药RNAi系(命名从MRi-1到MRi-30)。成(1025 bp)和感觉链(200 bp)扩增自30条(无花果。S4).南方印迹分析显示,在MRi-14、MRi-15和MRi-22中有一个单一的拷贝(无花果S5。).
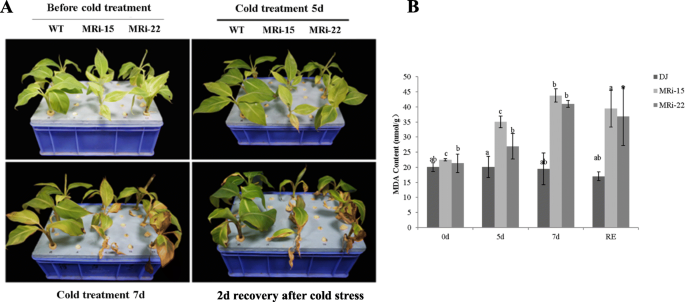
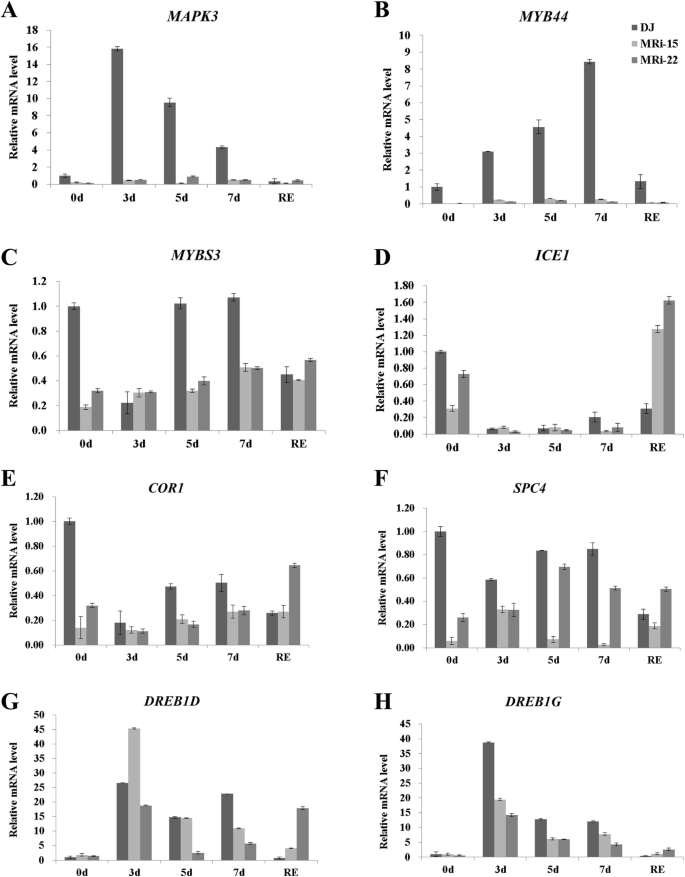
用MRi-15和MRi-22植株进行抗寒性评价。经过5 d的冷胁迫处理后,“大蕉”小株表型正常,而两个转基因株系的叶片变黄并出现失水症状。经过7天的冷胁迫,“大椒”WT植株的叶片出现了轻微的损伤,而“大椒”转基因植株的叶片则出现了严重的坏死和萎蔫症状(图1)。1a).在大多数胁迫条件下,丙二醛(MDA)是自由基链式反应后膜破坏最具代表性的标志之一[45].通过对转基因植株丙二醛含量的测定,探讨了转基因植株抗寒性下降的生理机制。“大蕉”野生型植株的MDA含量随低温暴露时间的增加而保持稳定。相比之下,两个“大蕉”转基因株系的MDA含量在冷胁迫后显著升高,且恢复2 d后仍保持较高水平(图2)。1b).这些结果表明MaMAPK3负调控“大蕉”植株的抗寒性。“大蕉”转基因植株的抗寒性下降表明与抗寒性相关的途径可能受到了负调控。为了验证这个猜想,表达式MaMAPK3和抗寒相关基因(包括MYB44,ICE1,MYBS3,DREB1G,DREB1D,COR1而且SPC4)在冷胁迫(10°C暴露0、3、5、7 d,恢复2 d)下进行qRT-PCR验证。的表达MaMAPK3在冷胁迫3 d后,“大椒”WT的表达显著增加,而MaMAPK3在冷胁迫下,“大蕉”转基因植株的无明显变化(图5)。2a).有趣的是MYB44,MYBS3,ICE1,COR1而且SPC4与“大椒”野生型植株相比,转基因植株的基因表达受到不同程度的抑制。2b-f)。的表达式DREB1G而且DREB1D在正常条件下,“大蕉”转基因植株未受影响。然而,表达DREB1G在冷胁迫下,与转基因植株相比,“大椒”WT植株的基因表达显著增加(图5)。2g和h)。
MaMAPK3与MaICE1相互作用
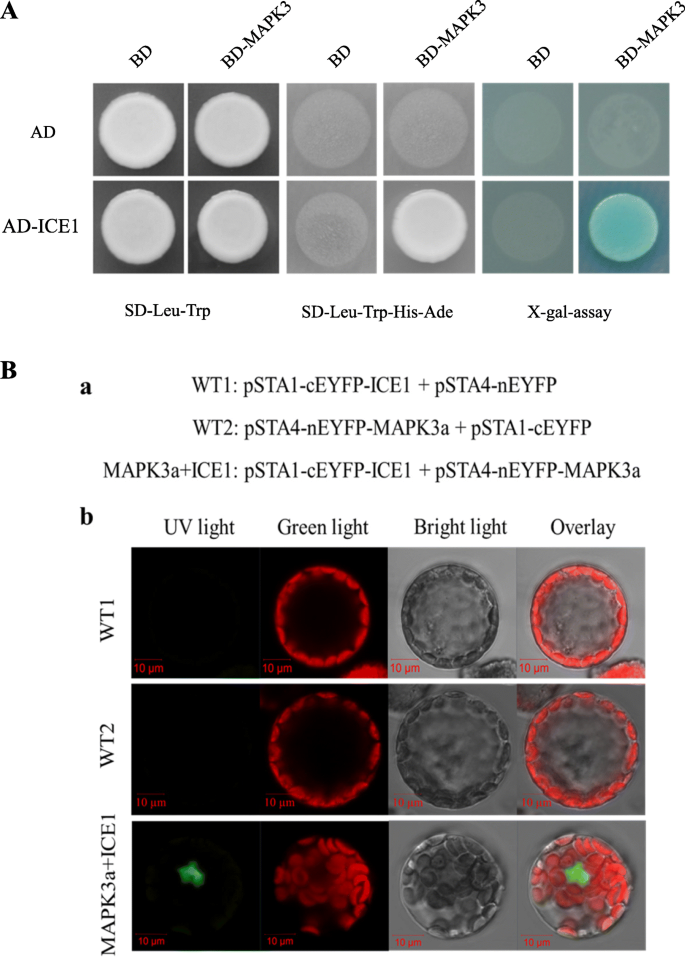
因为的表达式MaICE1是抑制MaMAPK3RNAi‘大蕉’转基因植物的功能及作用ICE1受MAPK3的影响拟南芥和大米(21,23,我们进行了酵母双杂交(Y2H)试验,以探索MaICE1和MaMAPK3之间的潜在关系。当与pGBKT7载体结合时,全长的MaICE1蛋白检测到较强的自激活活性,而AD-MaICE1(克隆到pGADT7中的MaICE1)没有自激活活性。因此,我们选择了MaICE1并将其克隆到pGADT7载体中。Y2H实验结果显示MaMAPK3和MaICE1之间存在相互作用。3.a).通过双分子荧光互补(BiFC)实验进一步探讨MaICE1与MaMAPK3在体内的相互作用。结果表明,cEYFP-中未检测到荧光信号MaICE1/ nEYFP和nEYFP -MaMAPK3/cEYFP(负组合),而cEYFP-共表达MaICE1和nEYFP -MaMAPK3在细胞核中产生强烈的信号。3.b).这种荧光检测表明MaICE1和MaMAPK3之间存在直接的蛋白-蛋白相互作用,进一步支持我们的Y2H结果。的功能MaICE1在后续的实验中进行了进一步的研究和讨论。
过度的MaICE1提高转基因植物的耐寒性
全长cDNA编码MaICE1(加入基因库。KM379133)从“大椒”中分离得到。利用GFP荧光技术研究了MaICE1基因在香蕉原生质体中的亚细胞定位。的子MaICE1与GFP n端和c端在同一框内,在MaICE1-GFP融合蛋白中未检测到信号。GFP- maice1融合蛋白位于细胞核中,而对照组的GFP蛋白在细胞质和细胞核中均被检测到(无花果S6。).
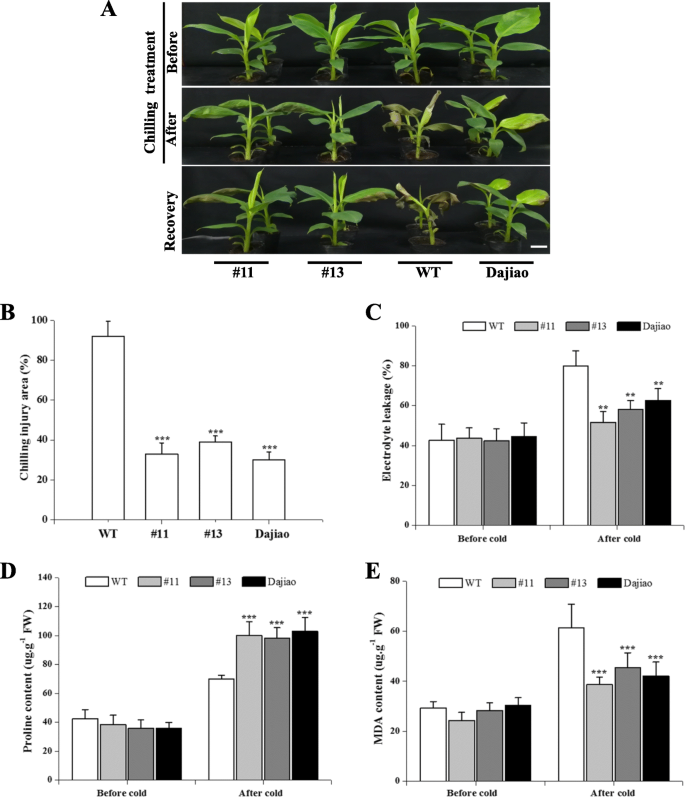
共有13种耐药MaICE1-过表达线得到。成(1025个基点)ICE1(200 bp)扩增自13株中的11株(图S7A和B)。两个单独的过表达卡文迪许香蕉系(#11和#13)显示单个拷贝(图S7C)和高水平的MaICE1表达式(图S7D)与卡文迪什香蕉WT和大蕉WT一起进行冷处理分析。卡文迪什香蕉,大蕉,2个月大MaICE1-过表达的转基因株系(#11和#13)暴露在10℃的温度下48小时,然后在常温下恢复。在正常条件下,转基因植株的表型可以区分“大蕉”和卡文迪什香蕉。当植株暴露在10°C下24小时,卡文迪什香蕉WT植株的叶片表现出严重的冷损伤,而转基因植株和大蕉WT植株仅观察到轻微的损伤(图1)。4a).在正常条件下恢复3天后,11号(35.7%)、13号(38.9%)和“大蕉”WT(32.6%)植株的冷损伤面积较WT(93.2%)显著提高(图4)。4b)。
通过分析丙二醛(MDA)水平、脯氨酸(Pro)含量和电解质泄漏,探讨其抗寒性改善的生理生化机制MaICE1过度表达香蕉植物。数字4c表明,经过冷胁迫后,“大蕉”和转基因植株的电解质泄漏量明显低于卡文迪什香蕉植株。在10°C下暴露2天后,所有植株的Pro含量都有所增加。然而,与卡文迪什香蕉WT植株相比,转基因植株中Pro的含量显著增加。4d)。4e显示,大鼠组MDA的积累明显较低MaICE1转基因株系和“大蕉”WT植株与卡文迪什香蕉WT植株在冷胁迫结束时的比较。这些结果支持MaICE1可提高卡文迪什香蕉的抗寒性。
作为一个转录因子,MaICE1可能调控多种下游因子,能够显著提高卡文迪什香蕉过表达系的抗寒性。为了验证这一假设,我们进行了转录组学分析,比较WT和一条过表达系(#13)在冷胁迫前后的表达谱。以2倍的变化作为截断阈值,13号与未经过冷处理的Cavendish香蕉WT植株相比,分别有222和496个基因上调和下调。表S1).然而,在第13系中,与卡文迪什香蕉WT植株相比,在仅冷暴露1 h后,分别有526和196个基因表达上调和下调(表S2).经4 h冷胁迫处理后,第13株系与卡文迪什香蕉WT株系相比,鉴定出上调基因1109个,下调基因540个(表S3),表明基因表达谱在转基因植株中发生了深刻的改变。在这些差异表达基因(DEGs)中,许多与冷反应相关的基因在冷胁迫下的转基因香蕉中表达显著上调,如SPC4 (Ma03_g02760)和COR2 (Ma06_g36560)。找出…的效果MaICE1在MAPK级联上的过表达,分析所有识别的MAPK级联基因在转录组中的表达。的表达式MaMAPKK2而且MaMAPK3在冷胁迫下,转基因植株与野生型植株相比发生了显著变化(表S4).在卡文迪许香蕉WT植株中,MaMAPKK2的表达在冷胁迫下下调,而在转基因植株中,MaMAPKK2的表达在冷胁迫下显著上调。冷胁迫1 h后,MaMAPK3在卡文迪什香蕉WT和转基因植株中的表达显著增加。冷胁迫4 h后,卡文迪什香蕉WT植株中MaMAPK3的表达量下降,而转基因植株中MaMAPK3的表达量保持在较高水平(表S4).
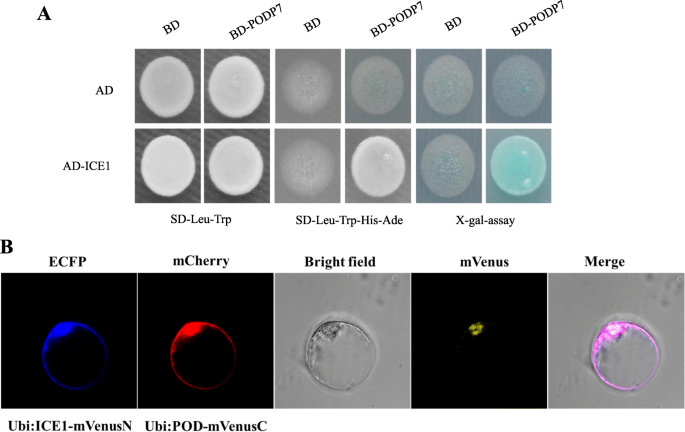
此外,在这些DGEs之外,a过氧化物酶P7(豆荚P7) (ID。Ma10_g27800)引起了我们的特别注意。在正常情况下,表达MaPOD P7与卡文迪许香蕉WT植株相比,其13号株系表达量显著上调,但在冷处理过程中仍保持高表达水平。在我们之前的研究中,该MaPOD P7蛋白定位于质膜和叶绿体中,对“大椒”的抗寒性起着关键作用(He et al., 2018)。此外,Y2H系统也证实了MaICE1与MaPOD P7之间的相互作用(图5)。5a)以及BiFC检测(图。5b)。
转基因植物抗氧化能力分析
豆荚P7是一种与抗氧化能力有关的基因。目的评价卡文迪什香蕉的抗氧化能力MaICE1-过表达转基因植物H2O2和O2−卡文迪什香蕉WT和MaICE1采用3,3 ' -二氨基联苯啶(DAB)和硝基蓝四唑(NBT)染色法检测过表达转基因卡文迪什香蕉叶片。我们的数据表明H2O2和O2−转基因卡文迪许香蕉植株与低温胁迫下的卡文迪许香蕉WT植株相比,含量显著降低(图1)。6).根据这些结果,我们推测MaICE1-MaPOD P7相互作用在抗寒性中起基础性作用MaICE1-过表达转基因卡文迪许香蕉。
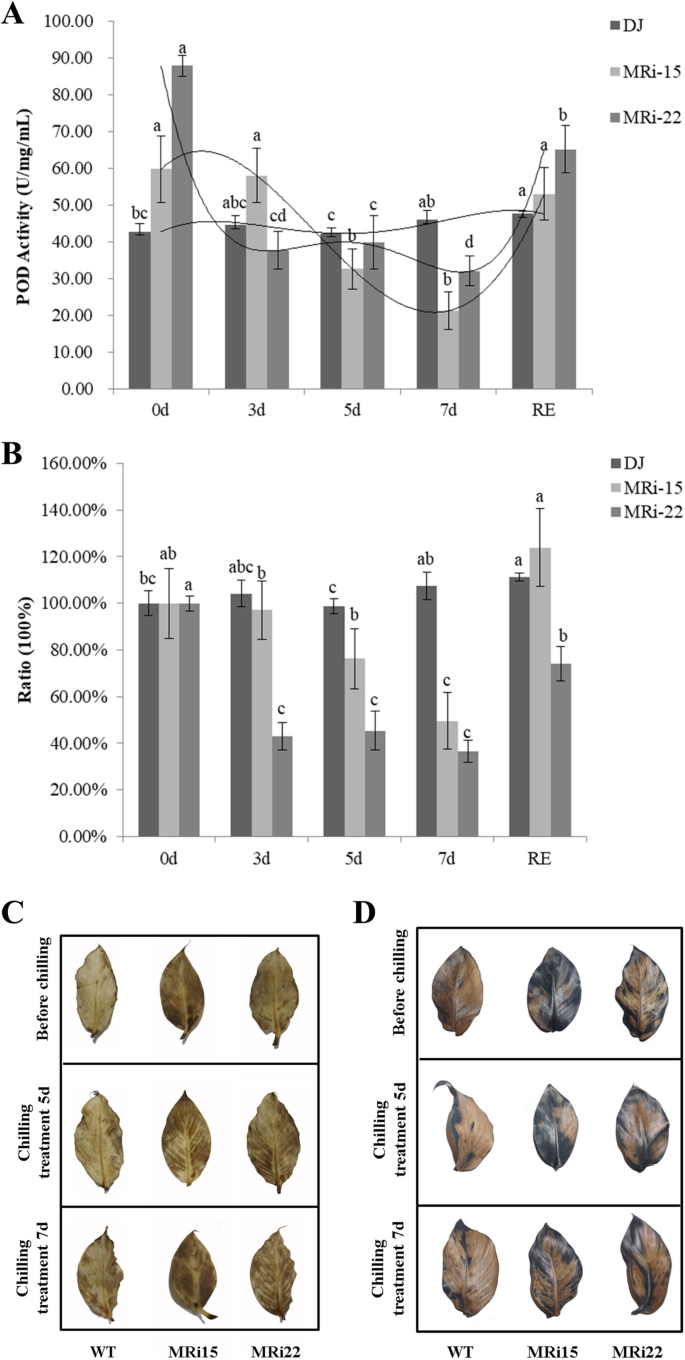
由于在转基因卡文迪什香蕉中发现POD P7发生了显著变化MaICE1MaMAPK3和MaICE1之间存在相互作用,我们推测maapk3和MaICE1之间存在氧化还原酶活性降低MaMAPK3RNAi转基因‘大蕉’植株具有抑制作用MaMAPK3RNAi。对“大椒”野生型和转基因植株的POD活性进行了测定。在正常条件下,转基因“大椒”植株的POD活性高于野生型“大椒”植株(图1)。7a).然而,经过冷处理后,‘大椒’WT植株的POD活性保持稳定,而转基因‘大椒’植株的POD活性显著下降(图1)。7b).找出在MaMAPK3采用RNAi转基因“大蕉”植株的H2O2和O2−DAB染色和NBT染色。我们发现H2O2和O2−转基因“大椒”植株与正常条件下的“大椒”WT植株相比显著增加(图1)。7c和d),这可能解释了在正常条件下,转基因大椒植株的POD活性更高。
讨论
植物已经进化出各种复杂的防御机制来应对不同的压力。在植物中,复杂而快速的信号通路负责对冷胁迫的响应和适应,这些通路可损害广泛的细胞活动,如生理或生物化学变化、转录调控、细胞分裂和形态发生、蛋白质折叠和营养通量的代谢变化[46,47,48].在我们的实验室里,我们对香蕉抗寒的分子机制进行了长期的研究。基于之前蛋白质组学、转录组学、基因功能分析、膜蛋白质组学和磷蛋白质组学的研究结果[40,41,42,43,49,我们已经找到了几个独立的证据,证明了抗寒机制的基础。在目前的研究中,我们旨在调查这些独立机制的潜在联系。
MaMAPK3是一种耐寒性正调控因子
转录组分析表明MaMAPK3在冷胁迫下,‘大蕉’的蛋白质含量显著高于卡文迪什香蕉[42].MAPKs介导的通路不仅在植物的发育中发挥重要作用,而且参与植物对胁迫的调控响应[10,50,51].MAPK家族根据序列和结构相似性分为4个亚群,分别是A、B、C、D亚群[52].众所周知,属于A和B亚群的MAPKs参与了对生物和非生物胁迫的反应。在水稻中,属于A亚群的OsMAPK3通过与磷酸化的OsbHLH002/ICE1蛋白相互作用,起到正调控作用[21],而AtMAPK3已被报道为抗寒性的负调控因子拟南芥[20.,23].在我们目前的研究中,MaMAPK3系统进化树分析表明,MaMAPK3基因属于A亚群(无花果S1。).因此,我们推测MaMAPK3参与了香蕉品种“大蕉”的抗寒性调控,“大蕉”比其他香蕉品种具有更强的抗寒性。
我们使用MaMAPKs的敲入和敲除(通过RNAi)转基因系研究了MaMAPK3。我们没有成功建立过表达系,因为显然过多的MaMAPK3蛋白可能会破坏生长平衡。然而,转基因植物具有抑制表达MaMAPK3与WT植株相比,植株表现出矮化特征和冷敏感性。此外,通过对转基因植株的表型分析,我们可以得出结论:MaMAPK3确实参与了“大椒”的冷反应,并正调控了“大椒”的抗寒能力。了解的效果MaMAPK3在全球转录水平上,我们首先研究了7个标记基因的表达谱[41,48,53,54,55,56],众所周知,它们参与了转基因系的抗寒能力。我们的数据表明,抑制MaMAPK3在转录水平上对“大椒”的抗寒性产生了负面影响。此外,我们还发现转基因“大椒”中氧化还原酶活性的降低可能进一步解释了POD功能的重要性。需要注意的是,MAPK3在不同的物种中可能发挥不同的作用。在拟南芥,只有AtMAPK4/6和AtMAPK3可以与AtICE1相互作用,AtMAPK3在冷胁迫下起负调制器的作用[20.,23,而香蕉中的22个MAPKs中有10个可以与MaICE1相互作用(图S8).这些结果表明,两者之间存在较大的差异拟南芥在mapk3介导的调控机制方面和香蕉。
MaICE1是一种耐寒性正调控因子
植物中最大的TF家族由bHLH蛋白组成[54,57].大量证据表明bHLH转录因子在植物对不同非生物胁迫(如干旱胁迫)的响应中具有基础性作用[58],盐度应力[59]、冷应激[35,37,54,60].bHLH蛋白由保守的bHLH特征结构域组成,该结构域由位于n端的一个基本区域和位于c端的一个HLH区域组成[24,38].dna -蛋白质相互作用的特异性是由约15个氨基酸组成的基本区决定的,包括几个基本残基[37].HLH区有两个两亲α-螺旋,它们由一个可变长度的环区连接,在同型二聚体或异型二聚体的形成中起着关键作用[24].基本区允许bHLH tf与一致E-box (5 ' -CANNTG-3 ')或G-box (5 ' -CACGTG-3 ')顺式元件结合,以调节基因表达[25].作为tf, myc型蛋白定位于细胞核发挥其调节功能,大多数分离的bHLH蛋白定位于细胞核[37,54,61].同样,在香蕉原生质体转化后,MaICE1被证实定位于细胞核(无花果S6。),表明MaICE1是一种核蛋白。
目前,bHLH同源物在“大椒”(一种非常耐寒的植物)中的作用在很大程度上仍未被探索。与卡文迪什香蕉相比,“大蕉”在冬季具有明显的耐寒性,可以承受0-4℃的低温[41,49].因此,为了阐明与抗寒性相关的冷信号通路,并为基因操作识别有用的候选基因,对‘大椒’bHLH基因的功能进行表征是非常必要的[41].我们改变了MaICE1卡文迪什香蕉是一种多年生冷敏感植物,具有很高的农艺价值。组成型表达的MaICE1导致转基因植物的抗寒性发生显著变化。表达的MaICE1显著降低了冷胁迫诱导的损伤(图。4a)和冷胁迫后的植株表型较WT更好(图1)。4b).上述结果还伴随着Pro水平的升高(图5)。4d), MDA含量降低(图。4e)和电解质泄漏(图。4c).总的来说,我们的结果表明MaICE1对抗寒起了有益的作用。之前的研究表明,香蕉植株过度表达胁迫响应型转录因子,如AtCBF1和MusabZIP5,经常表现出生长限制[41,44].但除生长期比WT植株长1个月外,无明显的表型变化MaICE1与正常生长条件下的野生型植株相比,MaICE1基因的表达量明显高于野生型植株,这意味着MaICE1基因有可能用于改善香蕉抗寒性的基因调控。
众所周知,作为一个高度复杂的过程,应激反应是由几种信号通路介导的[41].为了阐明提高抗寒性的分子机制,我们比较了卡文迪什香蕉WT植株和过表达转基因株系(#13)在正常条件和冷胁迫下的转录谱。我们发现,在转基因系中,过表达的基因可诱导全面的转录组修饰MaICE1.值得注意的是,在mRNA水平上,MaICE1既能促进也能抑制许多基因的表达,说明对表达图谱有积极和消极的影响。这一发现并非例外,因为许多研究都报道了与WT对照相比,在过度表达TF的转基因植物中存在大量的转录重编程[37,62].在转录组学中发现的所有DEGs中豆荚P7(Ma10_g27800)在冷胁迫前后差异最大。在我们之前对耐寒香蕉“大蕉”和冷敏感卡文迪许香蕉的定量蛋白质组学和膜蛋白质组学分析中,POD P7蛋白是唯一在质膜和叶绿体中含量增加的过氧化物酶。POD P7表达的增加似乎是一种关键的细胞适应,有助于“大椒”的耐寒性,通过减少脂质过氧化[49].此外,在我们新的蛋白质组学数据(数据未显示)中,4个SOD和27个POD蛋白的丰度显著增加MaICE1在27个pod中有10个是POD-P7(包括Ma10_g27800)或POD-P7样蛋白。此外,通过Y2H系统和BIFC分析证实了MaICE1和MaPOD P7之间的相互作用。5),表明ICE1-POD P7相互作用对转基因香蕉的耐寒性起着关键作用。
如补充表1、2、3所示,冷胁迫4 h后的DEGs数量(上调基因1109个,下调基因540个)显著高于正常条件下(分别为222个和496个)。我们推测,在低温胁迫下,MaICE1基因发生了某些未确定的修饰,导致植物胁迫响应信号网络中一组胁迫响应基因的表达或抑制。目前已有文献报道,OST1的磷酸化可以正向调控ICE1的活性[63]并由MAPK3磷酸化负性介导[20.,23在拟南芥冷应激。基于Y2H和BiFC的分析,发现MaMAPK3与MaICE1相互作用(图1)。3.).结果表明,MaMAPK3-MaICE1基因在香蕉的冷反应中起核心作用。
MaMKK2与MaMAPK3相互作用
MKK2是MAPKKK-MAPKK-MAPK级联中的中间节点。MKK2过表达通过磷酸化下游MPK6/MPK4影响CBF基因的表达,增强CBF基因的耐寒性拟南芥[15].然而,在香蕉中,我们发现MaMKK2的磷酸化水平在抗寒的“大椒”中显著升高,而在冷敏感的香蕉中没有检测到这种升高。这些结果揭示了MaMKK2在香蕉抗寒性中的重要作用。40].在我们发现MAPK3 RNAi ' Dajiao '植株表现出抗寒性下降的表型后,我们用Y2H方法评估了MKK2和MAPK3之间的相互作用,我们发现MaMKK2a确实可以与MaMAPK3 (图S11).因此,基于MKK2和MAPK3基因在ICE1我们认为MKK2和MAPK3之间的相互作用最有可能参与了香蕉的抗寒性。
结论
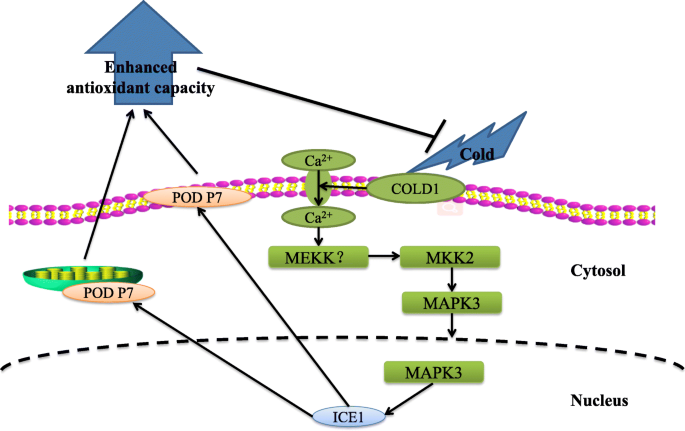
综上所述,MAPK3-ICE1-POD通路在香蕉抗寒性中发挥了关键作用。基于本研究的结果,我们提出了MAPK3-ICE1-POD通路的抗寒机制模型(图1)。8).在冷应激下,MEKK?-MKK2-MPK3 cascades were rapidly activated. Subsequently, the ICE1 expression was promoted by the activated MAPK3, thus facilitating the expression of membrane-associated gene豆荚P7基因。MKK2-MPK3-ICE1-POD P7通路正向影响冷反应。
方法
植物材料、生长条件和冷处理
“打搅”(穆萨spp。“打搅”;ABB集团;加入不。LCDJ_01)和卡文迪什香蕉(穆萨sp . AAA组)采自广东省农业科学院果树研究所国家香蕉种质资源库。冷处理时,盆栽植株在30/28℃(昼夜)、光子通量密度240 μmol m的生长室内培养至五叶期−2年代−1, 12小时光周期,相对湿度60-80%。将生长状态均匀的3株植物置于10°C的黑暗环境中,分别培养0、1、3、6、24和48 h。在一个生长室中重复进行三次温度处理。在指定的时间间隔内采集植株/植株顶部完全展开的叶片,立即在液氮中冷冻,并在−80°C保存,然后进行进一步分析。每个时间点的标本均采集三份。本研究中使用的每个单独的栽培品种的三个植株构成一个生物。
基因分离与序列分析
用植物RNA提取试剂盒(编码9767,TaKaRa,大连,中国)从‘大蕉’叶子中提取总RNA,然后使用PrimeScript RT Reagent kit根据制造商协议(TaKaRa)将1 μg纯化的RNA反转录为cDNA。根据的cDNA序列MaICE1从“大椒”转录组数据中获得[43),部分的打搅ICE1利用引物对cDNA片段进行PCR扩增Spe我和BamH I限制位点(GSP1,表S5).的顺序MaMAPK3的基因组数据库。http://banana-genome-hub.southgreen.fr/home)[1].使用ClustalW对齐序列[64],使用MEGA 7软件构建系统发育树[65].
亚细胞定位
MaMAPK3的ORF与GFP的n端和c端处于同一帧,MaMAPK3-GFP融合结构中未检测到信号,使用GFP-MaMAPK3的信号。的全长cDNAMaMAPK3亚克隆到pMD18-T载体(TaKaRa)。质粒pMD18-T包含MaMAPK3用引物GSP3 (表S5)包含萨尔我和班I限制位点来评估MaMAPK3的亚细胞定位。MaICE1的ORF与GFP的n端和c端处于同一帧,在MaICE1-GFP融合结构中未检测到信号,使用GFP-MaICE1的信号。的全长cDNAMaICE1亚克隆到pMD18-T载体(TaKaRa)。质粒pMD18-T包含MaICE1用引物GSP4 (表S5)包含萨尔我和班I限制位点来评估MaICE1的亚细胞定位。PCR产物经上述酶切后,导入含有GFP报告基因的pUC19-GFP载体,在花菜花叶病毒35S启动子(CaMV 35S)的控制下,生成融合结构。如前所述,融合构建物和控制载体(pUC19-GFP)分别引入卡文迪什香蕉原生质体[66].利用共聚焦激光扫描显微镜(LAM510, Carl Zeiss GmbH,耶拿,德国)从28°C生长的瞬时转化水稻原生质体细胞中捕获图像,并用Image-Pro软件进行分析。
转基因植物的世代由根癌土壤杆菌介导的转换
的全长cDNAMaMAPK3亚克隆到pMD18-T载体(TaKaRa,大连,中国)(图S10A).含有pMD18-T的质粒MaMAPK3用引物(GSP1)进行了扩增Spe我和BamH I限制位点。PCR产物经酶切后导入pCAMBIA 1301-GUS载体(图S10B)生成融合结构1301-MaMAPK3-GUS受Ubipromoter控制。双链RNA干扰(dsRNA)构造(图S10C)通过聚合酶链反应介导的方法产生,使用的扩增产物来自一个独特的n端区域(300 bp),该区域跨越了该基因的5 ' -非翻译区和邻近的编码区MaMAPK3基因。然后使用引物组合港湾放大感觉链BamH我和欣d III限制性位点位于产物的相对末端,而反义链则使用在产物相对末端包含Pst I和Mul I限制性位点的引物组合进行扩增。这两种产物在Ubi启动子的控制下导入pYL-RNAi。新建的1301-MaMAPK3导入-GUS植物表达载体和RNAi载体农热冲击菌株EHA105 [41].过表达载体用于‘大焦’悬浮培养细胞(ECSs)的转化,RNAi载体用于前面所述的‘大焦’ECSs的转化[41,67].筛选耐湿霉素植物,用PCR法鉴定(成而且MaICE1)使用两对引物(GSP5和GSP6,表S5).只有由两种引物产生预期PCR片段的被认为是阳性的。此外,表达MaMAPK3用qRT-PCR(引物集GSP6,表S5).的MaACT1基因(引物集GSP7,表S5)被选为管家基因。用离体植株的分生组织进行香蕉阳性植株的营养增殖。将生根的植株在温室中硬化,用于进一步的分析。
使用含有Spe I或BamH I限制位点的特异性引物(GSP2)进行扩增MaICE1互补脱氧核糖核酸。PCR产物用SpeI而且BamH我,再结扎成二元载体pOx驱动玉米l . polyubiquitin启动子。构造的二元向量记为pOx-MaICE1.新建的pOx-MaICE1将植物表达载体导入农热冲击菌株EHA105 [37].如前所述,过表达载体被用于卡文迪什香蕉ECSs的转化(Dou等人,2016;Hu et al., 2013)。利用2对引物(gsp5和GSP8),对耐湿霉素植株进行PCR鉴定。只有由两种引物产生预期PCR片段的被认为是阳性的。此外,表达MaICE1用qRT-PCR(引物集GSP9,表S5).的MaACT1选择引物集GSP7基因作为管家基因。用离体植株的分生组织进行香蕉阳性植株的营养增殖。将生根的植株在温室中硬化,用于进一步的分析。
的RNAi构造MaMPAK3用引物GSP10和GSP11扩增基因抑制,PCR产物克隆到pYLRNAi中,pYLRNAi由华南农业大学生命科学学院刘耀光博士提供。按照前面所述进行了以下程序。
生理的分析MaMAPK3RNAi转基因“大蕉”植物
在每个时间点(10°C 0、3、5、7天,冷胁迫后恢复2天)收集三株植物顶部的第一片幼叶,用于每个生物复制。MDA含量采用植物MDA测定试剂盒(Nanjing Jiancheng Bio, Nanjing, China)测定,POD活性采用过氧化物酶测定试剂盒(Nanjing Jiancheng Bio, Nanjing, China)测定。每个样品重复5次。三个独立实验作为生物重复进行。
的耐寒性试验MaICE1香蕉转基因植物
为避免植株大小和繁殖阶段的干扰,选择2月龄硬化转基因卡文迪什香蕉、卡文迪什香蕉WT和“大蕉”植株,在25°C光周期为16 h/8 h(明暗)的塑料花盆中,填充蛭石和土壤的混合物(1:1)。在此阶段,转基因植株和卡文迪什香蕉WT植株在植株大小和生长上没有明显差异。为了评估转基因系和WT植株的抗寒性,在未预驯化的情况下,将转基因系和WT植株直接暴露在10°C下48 h,然后在普通环境中恢复5天[41,42].对植株的冷害和恢复进行了记录和拍照。如前所述,在恢复后评估冷损伤程度[41].
本研究采用两个转基因株系(#11和#13),卡文迪什香蕉WT和“大蕉”植株,在10°C下处理48 h,然后在正常条件下恢复。在冷胁迫前后采集叶片,分析电解质泄漏、Pro含量和MDA水平。测量电解质泄漏的叶片被切成1厘米长的段,用超纯水冲洗3次。切片置于含5ml超纯水的试管中,25°C孵育。2 h后,测定浴液的导电性(L1)。然后在100°C孵育20分钟,然后在25°C孵育1小时,再次测量电导率(L2)。相对电解质泄漏量计算公式为(L1-L0)/(L2-L0) × 100(超纯水电导率L0) [53].使用市售试剂盒(南京建成生物工程研究所,中国)测定MDA水平和Pro含量。每个样品重复5次。三个独立实验作为生物重复进行。
RNA-Seq分析
北京华大基因(BGI)利用RNA-Seq分析技术对卡文迪什香蕉WT和过表达maice1的转基因株系(转基因株系#13)进行了转录分析。在正常条件和冷胁迫(10°C 1和4 h)下,每个基因型分别进行3个生物重复。RNA分离,文库构建,在BGISEQ-500平台上测序,pe100,每样本3000万读www.genomics.org.cn,华大基因,深圳,中国)。用RSEM软件包测定基因表达[68].为了进一步证实这些转录组数据的可靠性,我们用qRT-PCR检测了4个上调基因的表达,引物分别为GSP7、GSP8、GSP9和GSP10,如图所示表S5.采用DEGseq法筛选组间差异基因,标准为折叠变化≥2并进行调整p-value如前所述≤0.001 [69].基于GO数据库进行基因本体(GO)路径注释和富集分析(http://www.geneontology.org/)和KEGG通路数据库(http://www.genome.jp/kegg/),分别。
存在分析
简单地说,1 μg RNA使用ReverTra Ace (Toyobo, Osaka, Japan)和随机六聚体逆转录成cDNA。引物(表S5)使用Primer Premier 5.0 (Premier Biosoft, Palo Alto, USA)设计。在由10 μL 2 × SYBR Green PCR Master Mix (Toyobo)、200 nM引物和2 μL 1:40稀释的cDNA组成的20 μL反应体系中进行PCR,使用DNA Engine Option 2实时PCR检测系统和Opticon Monitor软件(Bio-Rad, USA)。MaACT1被选为管家基因。目的基因的相对表达量由2-△△Ct方法(70].用于qRT-PCR的引物列于表S5.
MAPK的系统发生树构建
基于注释和BLAST方法从穆萨基因组数据库(http://banana- genome-hub.southgreen.fr/home)中分离MAPK基因[71].首先下载属于MAPK的序列;然后,从基因组数据库中进一步获得一批相关序列拟南芥MAPK基因和BLAST算法(TBLASTN和BLASTP)。所有相似度最高的序列都被选为候选序列。非冗余香蕉MAPK序列和拟南芥使用ClustalX程序对同源物进行对齐,并根据用FigTree v1.3.1构建的系统发育树命名。推导出的氨基酸序列拟南芥mapk从The拟南芥信息资源(TAIR)。
南部印迹分析
用植物DNA分离试剂盒(TAKARA, Japan)从转MaMAPK3 RNAi的大椒植株和大椒WT植株的幼叶组织(3.0 g)中分离总基因组DNA。用植物DNA分离试剂盒(TAKARA, Japan)从过表达maice1植株和卡文迪什香蕉WT植株的幼叶组织(3.0 g)中分离总基因组DNA。纯化的DNA用EcoR V酶切,用1.0%琼脂糖凝胶分离。然后将DNA条带在20× SSC缓冲液中通过毛细管向上转移到尼龙膜上(Amersham, USA),如前所述[72,73].以HPT DNA为探针,从pYL-RNAi的Hind III限制性片段(Clontech)中制备,并用地高辛标记。使用DIG标记和发光检测试剂盒(Roche, Switzerland)进行标记、杂交和洗涤。
酵母两个杂交种化验
采用基于Gal-4记者的ProQuest™双杂交系统(Invitrogen, Darmstadt, Germany)来识别MAPKs和MAPKKs之间的相互作用。将Musa所有MAPK成员的编码序列(CDSs)克隆到猎物载体(pDEST32)中,并将MAPKKs的CDSs引入到诱饵载体(pDEST22)中。根据ProQuest™双杂交系统的协议,所有诱饵和猎物质粒的组合都被peg转化到酵母菌株MaV203。首先在不含亮氨酸和色氨酸的合成脱色(SD/ - Leu/ - Trp)培养基中选择阳性转化菌,然后转移到不含亮氨酸、色氨酸、组氨酸和腺嘌呤的选择培养基中培养。在选择板上添加3-氨基-1,2,4-三唑(3-AT)抑制猎物载体的自动激活。
BiFC化验
MaPOD P7和MaICE1同源开放阅读框分别用以下引物进行扩增:正向(5 ' -ggtgagctcggtaccaagctt atggccacctcctggagagctg -3 ')/反向(5 ' - agcggccgcctgcaatccaaccctt GTTCA ccttcctgcaatactt 5 ' -ggtgagctcggtaccaagctt ATGCTCTCGGGGATCAATGG-3 ')和正向(5 ' -ggtgagctcggtaccaagctt atgctcggggatcaatgg -3 ')/反向(5 ' -agcggccgcacta- gtaagctttgacact GTATTATCGAAGCCGG-3 '),然后引入pMD18-T载体进行测序。收集正确的MaPOD P7开放阅读框片段,并利用一步克隆试剂盒(Vazyme Biotech,南京,中国)亚克隆到含有红色荧光蛋白(mCherry)报告基因的prttvvc载体(提前用Hind III消化),在Ubi启动子控制下生成融合构建物Ubi: POD-mVenusC。以同样的方法,收集正确的MaICE1开放阅读框片段,亚克隆到含有CFP蛋白报告基因的pRTVnVN载体中,生成融合结构Ubi: ICE1-mVenusN。本研究中使用的BiFC系统如前所述,进行了轻微修改[74].在相互作用研究中,用5-10 μg质粒(Ubi:ICE1-mVenusN + Ubi:POD-mVenusC)经少量修饰的聚乙二醇(PEG)方法转化原生质体(100 μl) (1.5-2 × 106个细胞)[75].原生质体30°C孵育15 h。用共聚焦显微镜(Olympus BX61, Tokyo, Japan)评估mVenus蛋白及其标记物的定位或共定位。将MaMAPK3的全长CDS引入prttvvc载体,将MaMAPK3的全长CDS引入prttvvc载体MaICE1克隆到pRTVnVN载体中。原生质分离和瞬时表达如前所述进行。空向量共变换为阴性对照。
统计分析
本研究采用完全随机设计(CRD)。数据以均数±标准误差(SE)表示。采用DPS软件(3.01;浙江大学,中国杭州)。P< 0.05为有统计学意义。
限制
其局限性在于缺乏三个独立的转基因系用于基因功能分析和转基因分析。在我们的研究中,所有的转基因株系表型相同,因此我们选择了两个最具代表性的单拷贝株系进行后续的基因表达和生理数据测定等实验。每个处理采用3个生物重复,使研究结果具有良好的重复性和可靠性。
数据和材料的可用性
本文的测序原始数据已存入NCBI -的SRA数据库https://www.ncbi.nlm.nih.gov/Traces/study/?acc=PRJNA439180.
缩写
- WT:
-
野生型
- MAPKKK:
-
丝裂原激活蛋白激酶
- MAPKK:
-
丝裂原激活蛋白激酶
- MAPK:
-
增殖蛋白激酶
- bHLH TF:
-
basic-helix-loop-helix转录因子
- 存在:
-
定量实时聚合酶链反应
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 子:
-
开放阅读框
- MDA:
-
丙二醛
- 正方观点:
-
脯氨酸
- 度:
-
差异表达基因
- 豆荚P7:
-
过氧化物酶P7
- 轻拍:
-
3、3′-diaminobenzidine
- 电视台:
-
氮蓝四唑
- CaMV 35 s:
-
花菜花叶病毒35S启动子
- 极:
-
双链RNA干扰
- ecs:
-
悬浮培养细胞
- 信用违约互换:
-
编码序列
- 3:
-
3-Amino-1 2 4-triazole
- 挂钩:
-
聚乙二醇
- CRD:
-
完全随机设计
- SE:
-
标准错误
参考文献
- 1.
D'Hont A, Denoeud F, Aury JM, Baurens FC, Carreel F, Garsmeur O, Noel B, Bocs S, Droc G, Rouard M,等。香蕉(穆萨acuminata)基因组和单子叶植物的进化。大自然。2012, 488(7410): 213 - 7。
- 2.
王铮,苗红,刘娟,徐波,姚旭,徐超,赵松,方旭,贾超,王杰等.穆萨balbisiana基因组揭示亚基因组进化和功能分化.NAT植物。2019.
- 3.
Perrier X, De Langhe E, Donohue M, Lentfer C, Vrydaghs L, Bakry F, Carreel F, Hippolyte I, Horry JP, Jenny C等。香蕉的多学科研究(穆萨spp)驯化。中国生物医学工程学报,2011;29(6):691 - 698。
- 4.
香蕉遗传多样性的数字。FruiTrop。2008; 155:29-33。
- 5.
Paul J, Khanna H, Kleidon J, Hoang P, Geijskes J, Daniells J, zplin E, Rosenberg Y, James A, Mlalazi B,等。田间的金香蕉:一个香蕉转基因基因的表达提高了水果维生素a原。植物学报。2017;15(4):520-32。
- 6.
Davey MW, Gudimella R, Harikrishna JA, Sin LW, Khalid N, Keulemans J.草稿穆萨balbisiana多倍体、种间和种内杂交种的分子遗传学基因组序列。BMC基因组学。2013;14:683。
- 7.
朗和E, Vrydaghs L, de Maret P, Perrier X, Denham T.香蕉为什么重要:香蕉驯化的历史介绍。7. Ethnobot Res app . 2008;
- 8.
恶劣气候和天气对香蕉的伤害。香蕉病害,Abacá和Enset. 2000:351-79。
- 9.
朱军,朱建军。冷胁迫对植物基因表达的调控。植物科学进展;2007;12(10):444-51。
- 10.
李娟,李东,赵敏,全俊,安刚。OsMPK6在水稻(oryza sativa)早期胚胎发生过程中对细胞分化具有重要作用。中国科学(d辑:自然科学版)2016;
- 11.
李燕,金玉杰,金梅,郭金梅。MAPK在保护细胞信号转导中级联。7.植物科学进展,2016;
- 12.
金杰、禹德、金硕、李硕、朴宏、石宏、郑伟、文勇。拟南芥MKKK20通过调控MPK6活性参与渗透应激反应。植物细胞学报2012;31(1):217-24。
- 13.
孔晓,潘杰,张明,邢晓,周燕,刘燕,李冬,李冬。ZmMKK4玉米C族丝裂原活化蛋白激酶(玉米),赋予转基因拟南芥的耐盐性和耐寒性。植物细胞环境学报,2011;34(8):1291-303。
- 14.
Schweighofer A, Kazanaviciute V, Scheikl E, Teige M, Doczi R, Hirt H, Schwanninger M, Kant M, Schuurink R, Mauch F等。pp2c型磷酸酶AP2C1负调控MPK4和MPK6,调节先天免疫、茉莉酸和乙烯水平拟南芥.植物细胞。2007;19(7):2213 - 24。
- 15.
Teige M, Scheikl E, Eulgem T, Dóczi R, Ichimura K, Shinozaki K, Dangl JL, Hirt h拟南芥.摩尔细胞。2004;15(1):141 - 52。
- 16.
张敏,苏娟,张颖,徐娟,张松。传递内源和外源信号:MAPK级联在植物生长和防御中的作用。植物生物学杂志2018;45:1-10。
- 17.
古屋T,松冈D,南森T拟南芥通过Ca MEKK12 +信号是冷应激反应的一部分。植物学报,2013;26(6):833 - 408。
- 18.
杨涛,Chaudhuri S,杨磊,Du L, Poovaiah BW。受体激酶家族中钙/钙调素调节的成员赋予植物耐寒性。中国生物化学杂志2010;285(10):7119-26。
- 19.
金硕、金海生、柏硕、安杰、柳勇、金杰、郑卫士。由丝裂原激活的蛋白激酶6对转录抑制因子MYB15的磷酸化是植物抗冻能力所必需的拟南芥.核酸学报。2017;45(11):6613-27。
- 20.
赵超,王鹏,王磊,斯涛,徐超,扎耶德阿,于震,朱杰,朱勇,董杰,等。MAP激酶级联通过调节ICE1蛋白的稳定性来调节冷反应。43 Dev细胞。2017;(5):618 - 29。
- 21.
张智,李娟,李芳,刘红,杨伟,冲坤,徐莹。OsMAPK3磷酸化OsbHLH002/OsICE1,抑制OsbHLH002/OsICE1泛素化激活OsTPP1,提高水稻耐冷性。43 Dev细胞。2017;(6):731 - 43。
- 22.
于玲,闫娟,杨勇,朱伟。番茄丝裂原激活蛋白激酶的过表达SlMPK3增加烟草对低温胁迫的耐受性.植物细胞、组织和器官培养。2015;121(1):还是。
- 23.
李红,丁颖,石颖,张旭,张松,龚铮,杨松。MPK3-和mpk6介导的ICE1磷酸化负向调节了冰激冰激冰中ICE1的稳定性和耐冻性拟南芥.43 Dev细胞。2017;(5):630 - 42。
- 24.
李鑫,段鑫,姜辉,孙煜,唐勇,袁铮,郭杰,梁伟,陈磊,尹杰,等。水稻基本/螺旋-环-螺旋转录因子家族的全基因组分析拟南芥.植物杂志。2006;141(4):1167 - 84。
- 25.
王娟,胡铮,赵涛,杨颖,陈婷,杨敏,余伟,张斌。番茄bHLH转录因子及其参与黄曲叶病毒感染的全基因组分析(茄属植物lycopersicum).BMC基因组学。2015;16(1):39。
- 26.
Shogo I, Young Hun S, Josephson-Day AR, Miller RJ, Ghislain B, Olmstead RG, Takato I.开花BHLH转录激活子控制开花光周期调控因子CONSTANS的表达拟南芥.中国生物医学工程学报,2012;29(3):369 - 369。
- 27.
Tominaga-Wada R, Iwata M, Nukumizu Y, Sano R, Wada t。花青素上调需要一个完整的R-like基螺旋-环-螺旋转录因子,而n端区域调节表皮毛发的形成。植物科学。2012;183(1):115 - 22所示。
- 28.
Bogumil K, Lisa A, Christopher J, Shusei S, Satoshi T, Masayoshi K, Krzysztof S拟南芥基础螺旋-环-螺旋蛋白揭示了根毛发育的新参与者。植物杂志。2009;151(3):1175 - 85。
- 29.
大野S,细川M,星野A,北村Y,森田Y,朴基,中岛A,德口A, Tatsuzawa F, Doi M,等。bHLH转录因子,DvIVS,参与大丽花花青素合成的调节(大丽花摘要).实验学报2011;62(14):5105-16。
- 30.
M Kengo, ming喆Z, Manli Y, Betsy R, Alan L, Rebecca L, Erich g拟南芥bHLH因子GL3在毛状体启动调控事件中的作用。植物杂志。2007;145(3):736 - 46所示。
- 31.
Leivar P, Monte E, Oka Y, Liu T, Carle C, Castillon A, Huq E, Quail PH.多种光敏色素相互作用bHLH转录因子抑制幼苗在黑暗条件下的光形态建成。咕咕叫医学杂志。2008;18(23):1815 - 23所示。
- 32.
Yasuyuki Y, Yasuhisa K, Kaori C, Tadashi Y, Mai O, Sayumi Y, Nobuhiko K, Tomotsugu K, Fumihiko s日本黄连中异喹啉生物碱的生物合成受一种独特的bhlh型转录因子调控。植物与细胞生理学报,2011;52(7):1131-41。
- 33.
谢晓波,李松,张凤峰,赵杰,陈永春,赵强,姚亚烨,尤春霞,张秀生,郝玉杰。bHLH转录因子MdbHLH3促进苹果花青素积累和果实着色,以应对低温。植物细胞环境学报,2012;35(11):1884-97。
- 34.
冯海林,马乃宁,孟X,张硕,王俊杰,柴硕,孟QW。一种新的番茄myc型ice1样转录因子SlICE1a在转基因烟草中具有耐冷、耐渗透和耐盐能力。植物生理与生物化学,2013;33(3):369 - 369。
- 35.
李建康,李文华,李文华,李文华,李文华,李文华,李文华。冰激肽1:冷诱导转录组和抗冻性的调控因子拟南芥.基因Dev。2003;17(8):1043 - 54。
- 36.
冯XM。冷诱导的基本螺旋-环-螺旋转录因子基因MdCIbHLH1编码苹果中的一种类似ice的蛋白质。植物生物学杂志,2012;12(1):22。
- 37.
黄秀霞,王伟,张强,刘建华。一个基本的螺旋-环-螺旋转录因子,PtrbHLH的,枳壳trifoliata赋予耐寒性和调节过氧化氢酶介导的清除过氧化氢。植物杂志。2013;162(2):1178 - 94。
- 38.
引用本文黄秀霞,张强,朱东,付旭,王敏,张强,森口田,刘建华。ICE1的枳壳trifoliata通过与精氨酸脱羧酶相互作用调节多胺水平,发挥耐寒作用。中国生物医学工程学报2015;66(11):3259。
- 39.
徐伟,张楠,焦勇,李瑞,肖东,王铮。葡萄基本螺旋-环-螺旋(bHLH)转录因子正向调节cbf通路,赋予葡萄对冷胁迫的耐受性拟南芥.Mol Biol学报2014;41(8):5329-42。
- 40.
高健,张松,何伟,邵曦,李超,魏勇,邓刚,匡锐,胡超,易刚等.比较磷蛋白组学揭示MKK2在香蕉中的重要作用(穆萨冷信号网络.SCI REP-UK。2017;7(1): 40852。
- 41.
窦涛天,胡春春,孙xx,邵晓华,吴建华,丁丽娟,高军,何卫东,比斯瓦斯MK,杨启强。MpMYBS3作为香蕉冷信号的重要转录因子,决定了香蕉的耐冷性.植物细胞、组织和器官培养。2016;125(1): 93 - 106。
- 42.
杨强,高军,何伟,窦涛,丁磊,吴娟,李超,彭旭,张松,易刚。比较转录组学分析香蕉和大蕉对冷胁迫响应的关键基因表达差异。BMC基因组学。2015;16(1):446。
- 43.
杨强,吴杰,李超,魏勇,盛奥,胡超,匡锐,黄勇,彭旭,McCardle JA,等。定量蛋白质组学分析揭示芭蕉的抗氧化机制与抗寒性有关(穆萨paradisiacal;ABB集团)幼苗。分子细胞蛋白质组学。2012;11(12):1853-69。
- 44.
刘坤,胡超,杜峰,张晔,魏勇,易刚拟南芥CBF1东莞大蕉基因(穆萨ABB集团)及其抗寒性的检测.中国农业科学,2012。
- 45.
生物学与医学中的自由基。第三版.国际生物化学与细胞生物学杂志1999;31日(12):1454。
- 46.
Aslani Aslamarz A, Vahdati K, Hasani D, Rahemi M, Leslie CA波斯核桃抗寒性及其与脯氨酸含量的关系。园艺学报,2011;36(3):447 - 447。
- 47.
Aslani Aslamarz A, Vahdati K, Hasani D, Rahemi M, Leslie CA.波斯核桃品种和选种驯化和脱驯化芽茎的过冷和抗寒性。HortScience长的矮。2010; 45(11): 1662 - 7。
- 48.
Ruelland E, Vaultier M, Zachowski A, Hurry V。第二章植物的冷信号与冷驯化.:植物学研究进展“,”第49卷:学术出版社;2009: 35 - 150。
- 49.
何伟,高杰,窦涛,邵曦,毕芳,盛奥,邓刚,李超,胡超,刘杰,等。大椒早期冷诱导过氧化物酶和水通道蛋白与高耐寒性有关。植物科学,2018;9:282。
- 50.
辛格P,辛哈AK。由SUB1A1与丝裂原激活蛋白激酶3相互作用控制的正反馈回路赋予水稻的耐淹性。植物细胞。2016;28(5):1127 - 43。
- 51.
关艳,陆娟,徐娟,McClure B,张松。花粉管的丝裂原活化蛋白激酶MPK3和MPK6是花粉管的丝裂原活化蛋白激酶拟南芥.植物杂志。2014;165(2):528 - 33所示。
- 52.
张涛,陈胜。植物丝裂原激活蛋白激酶级联蛋白的相互作用。J Exp Bot 2016;67(3): 607-18。
- 53.
周敏,李伟,郑勇,林萍,姚旭,林杰危害bursa-pastoris调节活性氧内稳态,提高烟草的耐寒性。植物科学进展2016;7:1599。
- 54.
黄霞,李凯,金灿,张珊Pyrus ussuriensis通过增强耐寒性的作用PuDREBa通过与PuHHP1相互作用来提高转录水平。SCI REP-UK。2015; 5(1): 17620。
- 55.
赵春,郎铮,朱娟。冷反应基因转录变得更加复杂。植物科学进展,2015;20(8):466-8。
- 56.
perak H, Pitzschke a拟南芥转录因子MYB44可引起氧化损伤和对非生物应激的过敏。国际分子生物学杂志,2014;15(2):2517-37。
- 57.
cartero - paulet L, Galstyan A, Roig-Villanova I, Martínez-García JF, Bilbao-Castro JR, Robertson DL。转录因子bHLH家族的全基因组分类和进化分析拟南芥杨树、水稻、苔藓和藻类。植物杂志。2010;153(3):1398 - 412。
- 58.
刘建华,彭涛,戴伟。顺式关键作用元件和相互作用转录因子:与植物非生物胁迫反应相关的关键因子。植物生物学报2014;32(2):303-17。
- 59.
陈浩,谢峰V,廖鹏,程伟,刘亮,杨勇,赖敏,常敏OsbHLH068和它的同系物,AtbHLH112对盐胁迫响应的调节作用明显,而对花的调控作用相反拟南芥.植物分子生物学杂志,2017;94(4):531-48。
- 60.
赵毫升,王约,W,詹迷,旷摩根富林明,吴KQ李XP,陈,他财政年度,陈司法院等。茉莉酸信号调控因子MaMYC2s的诱导及其与MaICE1的物理相互作用植物细胞环境学报,2013;36(1):30-51。
- 61.
姚鹏,孙铮,李晨,赵晓,李明明,邓锐,黄燕,赵红,陈红,吴强Fagopyrum tataricum FtbHLH2增强转基因植物对冷胁迫的耐受性拟南芥.植物生理与生物化学。2018;125:85-94。
- 62.
宁涛,华志,李华,李中。转录因子的本构激活OsbZIP46提高水稻的耐旱性。植物杂志。2012;158(4):1755 - 68。
- 63.
丁勇,李宏,张旭,谢强,龚铮,杨松。OST1激酶通过增强ICE1的稳定性来调节冻性拟南芥.Dev细胞。2015;32(3):278 - 89。
- 64.
汤普森JD,希金斯DG,吉布森TJ。CLUSTAL W:通过序列加权、位置特定的间隙惩罚和权重矩阵选择来提高渐进式多序列对齐的灵敏度。核酸学报。1994;22(22):4673-80。
- 65.
Kumar S, Stecher G, Li M, Knyaz C, Tamura K. MEGA X:跨计算平台的分子进化遗传学分析。分子生物学与生物学报2018;35(6):1547-9。
- 66.
莫因M, Bakshi A, Madhav MS, Kirti PB。基于Cas9/ sgrna的基因组编辑和其他反向遗传方法在水稻功能基因组研究中的应用。短暂的功能基因组学。2018; 17(5): 339 - 51。
- 67.
胡超,魏燕,黄燕,易刚。转chit42基因富仁芝香蕉的高效生产工艺(英文)穆萨AA组)对尖孢镰刀菌有抗性。体外细胞与发育生物学植物学报,2013;49(5):584-92。
- 68.
杜威中国出版社。RSEM:从有或没有参考基因组的RNA-Seq数据中精确的转录物定量。BMC生物信息学。2011; 12(1): 323。
- 69.
黄超,赵峰,林艳,郑松,梁松,韩松。通过RNA-Seq分析,酿酒酵母FKS1突变体的整体转录组变化提示MAPK通路和碳代谢在细胞壁维持中的作用。生化与生物物理研究通讯。2018;500(3):603-8。
- 70.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相关基因表达数据。方法。2001; 25(4): 402 - 8。
- 71.
Martin G, Baurens FC, Droc G, Rouard M, Cenci A, Kilian A, Hastie A, dolezel J, Aury JM, Alberti A.香蕉的改良穆萨acuminata的参考序列,使用NGS数据和半自动生物信息学方法。BMC基因组学。2016;17(1):243。
- 72.
Matheka J, Tripathi JN, Merga I, Gebre E, Tripathi L.一种简单快速的基因转化方案象腿ventricosum.工厂方法。2019;15:130。
- 73.
南方电磁。凝胶电泳分离的DNA片段中特定序列的检测。中华分子生物学杂志1975;98(3):503 N3, 508-509, N5, 517。
- 74.
Wamaitha MJ, Yamamoto R, Wong HL, Kawasaki T, Kawano Y, Shimamoto K. OsRap2.6转录因子通过与激活激酶受体c1 (RACK1)的相互作用促进水稻先天免疫.大米。2012;5(1): 35。
- 75.
马克思杰。从原生质体再生的水稻植株:再生水稻原生质体的能力意味着一种主要谷物将首次成为现代生物技术方法的对象。科学。1987, 235(4784): 31-2。
致谢
感谢刘耀光提供pYL-RNAi载体。
资金
基金资助:国家重点研发计划项目(2018YFD1000302)、国家自然科学基金项目(31872939)、广东省现代农业创新团队项目(2018LM2150)、广东省重点领域研发计划项目(2018B020202005)、广东省科技计划项目(2015B070701011)、广州市科研计划项目(201904020033、201903010010)。感谢2018YFD1000302、31872939和2018LM2150号授权,我们能够支付试剂的费用;感谢2018B020202005和2015B070701011授权,我们能够支付各种试剂盒的费用;感谢201904020033和201903010010授权,我们能够支付引物和测序的费用。研究的设计、数据的收集、分析、解释和撰写手稿都是由所有作者完成的。资助机构只是提供财政支持。
作者信息
从属关系
贡献
q.y和G.Y.设计研究;j.g., t.d., w.h., c.h., o.s., f.bi,G.D.,H.G., T.D. and C.L., performed research; J.G., T.D. and S.Z. analyzed data; J.G., Q.Y., T.D. and W.H. wrote the paper. All authors have read and approved the manuscript
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1图S1
.(A) MAPKs的系统发育树穆萨渐尖而且拟南芥。(B)答案为BMAPK3 h冷胁迫下卡文迪什香蕉和大蕉的家族。无花果S2。.MaMAPK3的亚细胞定位分析。MaMAPK3的ORF与GFP的c端在同一框内。(A)用于亚细胞定位分析的结构示意图。(B) MaMAPK3在卡文迪什香蕉原生质体中的亚细胞定位(bar:10 μm)。S3无花果。.褐变现象MAMAPK3-过表达抗性胚性愈伤组织。无花果。S4.MaMAPK3 RNAi转基因“大蕉”株系(M: DNA分子量标记;P:质粒DNA)。无花果S5。.转MaMAPK3 RNAi转基因“大蕉”植株的Southern印迹分析。M: DNA分子量标记;P:质粒;WT:野生型。无花果S6。.MaICE1的亚细胞定位分析。MaICE1的ORF与GFP c端在同一框内。(A)用于亚细胞定位分析的结构示意图。(B) MaICE1在Cavendish香蕉原生质体中的亚细胞定位(bar:10 μm)。图S7.过表达MaICE1的转基因香蕉植株的生成及分子鉴定。使用(A) hpt特异性引物或(B) Pubi-MaICE1引物对耐湿霉素植物进行PCR确认。M, DNA分子量标记;WT,野生型;−、水;数字表示不同的转基因株系(株系1、5、11和13分别被指定为#1、#5、#11和#13);P,质粒DNA(用作阳性对照)。(C)南方印迹分析MaICE1-过度表达转基因“卡文迪什香蕉”株系。M: DNA分子量标记;P:质粒;WT:野生型。(D)表达分析MaICE1对4个转基因株系进行RT-PCR检测。的MaACT1基因被用作内部控制。图S8.Y2H实验验证物理相互作用热图。(A) MaICE1与MaMAPKs之间的物理相互作用。(B) MaMAPKs和MaMKKs之间的物理相互作用。图S9.通过Y2H实验验证MaMAPKs和MaMKKs之间物理相互作用的热图。图S10.本研究中用于转基因的所有结构的质粒图。
附加文件2表S1
.WT与Ox-ICE1 (line13)在冷处理0 h下的转录组学分析。
附加文件3表S2
.WT与line13在冷处理1 h下的转录组学分析。
附加文件4表S3
.WT与line13在冷处理4 h下的转录组学分析。
附加文件5表S4
.所有识别的MAPK级联基因在转录组中的表达模式。
附加文件6表S5
.
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
高俊,窦涛,何伟。et al。香蕉MaMAPK3-MaICE1-MaPOD P7基因通路是香蕉耐冷性的正向调控因子。BMC植物杂志21日,97(2021)。https://doi.org/10.1186/s12870-021-02868-z
收到了:
接受:
发表:
关键字
- MaMAPK3
- MaICE1
- MaPOD P7
- 抗氧化能力
- 耐寒性