摘要
背景
钙(Ca2+)在植物生长和发展中起着重要作用,并且对所有植物物种的存活是必要的钙稳态的维持。Ca2+/H+交换器(cax)是CaCA (Ca2+/阳离子altiporter)超家族。一般来说,Cax蛋白介导细胞溶质CA2+进入液泡以防止钙的过度积累2+在细胞质中。CaCA超家族已经在许多植物物种中被鉴定和表征;然而,苹果CAX蛋白的功能研究和CaCA超家族的特征还没有在苹果上进行(马吕斯×家蝇borkh。)。
结果
在此,我们首次在苹果中鉴定出21种CaCA家族蛋白。系统发育和基因结构分析以及保守基序的预测表明,这些蛋白质可分为四类:CAX、CCX、NCL和MHX。表达分析表明10MdCAX公司我们克隆的基因强烈反应钙和非生物胁迫治疗。Callinity分析和表征钙运输能力导致鉴定一对节段性重复基因:mdcax3l-1和mdcax3l-2;MDCAX3L-2显示出强烈的钙运输能力,而MDCAX3L-1没有显示钙运输能力。酵母双杂交(Y2H)测定表明,这两种蛋白质可以彼此相互作用。高序列相似性(94.6%)使其成为研究Cax蛋白钙运输的关键残留物和结构基础的良好模型。蛋白质相互作用网络的预测揭示了几种可以与Cax蛋白相互作用的几种蛋白质,并在植物应激响应中起重要作用,例如SOS2,CXIP1,MHX,Nramp3和MTP8。
结论
我们的分析表明,MDCAX蛋白质具有强大的钙运输能力,并参与苹果中的非生物应激反应。这些调查结果为苹果中的MDCAX蛋白的未来研究提供了新的洞察力和丰富的资源。
背景
钙(Ca2+)是植物生长和发展的重要因素。一方面,加利福尼亚州2+对于维持植物膜稳定、细胞壁稳定和细胞完整性的结构和代谢需求至关重要[1,2].另一方面,加州2+作为第二信使,调节植物对各种环境刺激的生理反应和基因表达变化[3.,4,5,6,7].钙的所有这些功能都依赖于对胞质钙的调节2+浓度,这依赖于钙的协调2+CA,CA的米特米尔离子通道2+atp酶和钙2+/H+交换器(CAX)[8,9].
通常,Cax蛋白位于真空膜中并介导细胞溶胶CA2+进入液泡以防止钙的过度积累2+在细胞溶质[10.,11.].维持基础Ca2+浓度还有助于素质产生细胞溶质CA2+信号[12.].Cax蛋白属于CA2+/阳离子逆向转运蛋白(CaCA)超家族,存在于从细菌到高等动植物的所有生物体中[9]. 该家族中的蛋白质长度约为300到1000个氨基酸残基,具有相似的拓扑结构[9,13.]. 这些蛋白质通常促进钙的流出2+与跨膜的浓度梯度相反,并促进一价阳离子的流入,如H+,na+,或k+作为交换 [13.,14.].CaCA超家族分为五个家族:YRBG家族,Na家族+/ Ca2+交换机(NCX)家族,Na+/ Ca2+K+交换机(NCKX)家庭,阳离子/加利福尼亚州2+交换机(CCX)家族和CAX家族[9,14.].YBRG家族只存在于原核生物中,NCX和NCKX家族存在于动物和藻类中,但在高等植物中不存在[13.,14.,15.,16.].高等植物中只有CCX和CAX科存在。其他研究描述了陆地植物中另外两组CaCA蛋白质,命名为NCX-like (NCL) [17.,18.]和mg2+/H+交换蛋白[9,11.,19.].
自从此以来CAX.这个基因是在拟南芥[20.[若干研究表明,Cax蛋白在生命树上普及,除哺乳动物,昆虫和线虫外,[9,11.,21.].Cax蛋白分为三类:I型,II和III [22.].在植物中,CAX蛋白被划分为I型CAX,它们可以进一步分为两个不同的亚组:I- a型和I- b型[21.,23.].I-A型亚群中的CAX蛋白最初被认为只与Ca有关2+运输[20.,24.];相比之下,I-B型可以促进几个离子的运输,例如CD2+,Zn.2+、锰2+除了Ca2+[9,25.,26.].随后的研究表明,I-A Cax蛋白也可以促进多个离子的运输[27.,28.,29.,30.].
CAX蛋白有11个跨膜螺旋,命名为TM1到TM11[23.].这些TM区的蛋白质序列在所有植物物种中高度保守,在环路和N-和C末端区域中发生大多数变化[21.].其中,TM2到TM11螺旋被细胞质环(酸性螺旋)分隔成两个弱同源部分(TM2 - tm6和TM7-TM11),这构成了Ca的核心结构2+运输[11.].在TM 2-3和7-8中,两个高度保守的α-重复区域对于离子选择性,结合和运输至关重要[9,14.].随着Ca晶体结构的释放2+/H+AntiPorter蛋白(SCVCX1)在真核生物中[31.[已探讨与钙离子传输有关的各种关键结构和残基[31.]. 结合ScVCX1,CAXèAf和YfkE的结构研究表明CAX家族蛋白形成同源二聚体(ScVCX1和CAXèAf)或三聚体(YfkE)[31.,32.,33.]. 植物中的研究也表明CAX蛋白可以形成同聚或异聚的寡聚物,这可能对其功能活性的调节很重要[10.,34.,35.].
除调节钙稳态外,Cax蛋白还在调节植物非生物胁迫性方面发挥着重要作用。在拟南芥而水稻,转录水平的很多CAX.基因响应各种非生物应激而增加或减少[11.].在拟南芥,Cax1.突变体(cax1–3级和cax1–4个)在冷驯化后,表现出冰冷耐受性,而在棉花中,负责冻融耐受的基因是ghcax3.[11.]. 过表达sscax1.在里面拟南芥导致转基因植株对盐的敏感性增加,同时也观察到这种表型AtCAX1型在烟草中异位表达[36.,37.].相反,过度表达GmCAX1型提高转基因植物的耐盐性拟南芥[38.].
苹果 (马吕斯有明显)是世界上最经济上最重要的水果之一。其培养和延伸受到各种非生物应激的限制,例如干旱,盐和低温,均与钙稳态和钙信号传导相关[3.,10.,11.,21.,23.]. 此外,对各种果树作物的研究表明,钙在调节果实发育、成熟、品质、贮藏以及防止不利环境对果实的伤害等方面起着重要作用[39.,40,41,42,43,44].因此,对钙转运相关蛋白的研究对于苹果的抗性育种是重要的。在这里,我们鉴定并表征了来自苹果中的Caca Superfamily的21个蛋白质。具体而言,CA下的表达分析2+用酵母突变株k667处理、异位表达和钙离子荧光染色法研究了Ca2+回应和加利福尼亚州2+运输能力的MdCAX公司基因。表达分析结果的结果表明这些MdCAX公司基因响应各种非生物胁迫处理。基于蛋白相互作用网络预测和Y2H分析,我们发现MdCAX蛋白可以通过蛋白相互作用形成同源或异源二聚体。该网络还表明,MdCAX蛋白可能通过与胁迫相关蛋白(如SOS2)相互作用来调节植物的抗逆性。这些结果为今后苹果中MdCAX蛋白的研究提供了丰富的资源。
结果
基因组鉴定属于苹果中的Caca Superfamily的蛋白质
为了鉴定苹果CaCA超家族基因,从Pfam数据库中下载Na_Ca_ex域HMM文件(PF01699),用HMMER软件(版本3.1b2)进行查询,筛选苹果蛋白质组(GDDH13)。使用默认的过滤器参数(E-value < 0.05),我们总共得到32个蛋白质(附加文件1:表S1和附加文件2). 其中两个(MD09G1157400、MD14G1008300)因其长度较短(附加文件)而被删除1:表S1和附加文件2)[9].其余30种蛋白,以及13种CaCA超家族蛋白拟南芥,用于系统发育分析(附加文件3.:图S1)。30种蛋白质中的大多数与Caca Superfamily蛋白聚集在一起拟南芥并包含四组:CAX,NCL,CCX和MHX1。然而,含有六种蛋白质的额外的蛋白质,该蛋白质不属于Caca Superfamily(附加文件)3.:图S1)。由于这一发现,还比较了守恒域(Na_Ca_ex域;类ef - hand域)之间拟南芥和苹果(附加文件1:表S1),这些蛋白在随后的分析中被删除。共鉴定出21个蛋白为苹果CaCA超家族成员,其中包含11个CAXs, 5个CCXs, 4个NCLs, 1个MHX1 (Table .1).
因为EF手域在具有PFAM的四个MDNCL蛋白中鉴定为,但不在ATNCL中(附加文件1:表S1),我们用SMART数据库进一步分析了这些蛋白质。AtNCL和四个MdNCL蛋白含有两个Na\u-Ca\u-ex结构域和两个EF-hand结构域(图S)2),进一步支持系统发育树(附加文件3.:图S1)。除MD03G1238700外,其他三个MdNCL蛋白,包括AtNCL, N端也有一个信号肽(附加文件4:图S2)。MD03G1238700在N端包含一个额外的跨膜区域(附加文件4:图S2)。
苹果CaCA超家族蛋白的染色体定位、基因复制及特性分析
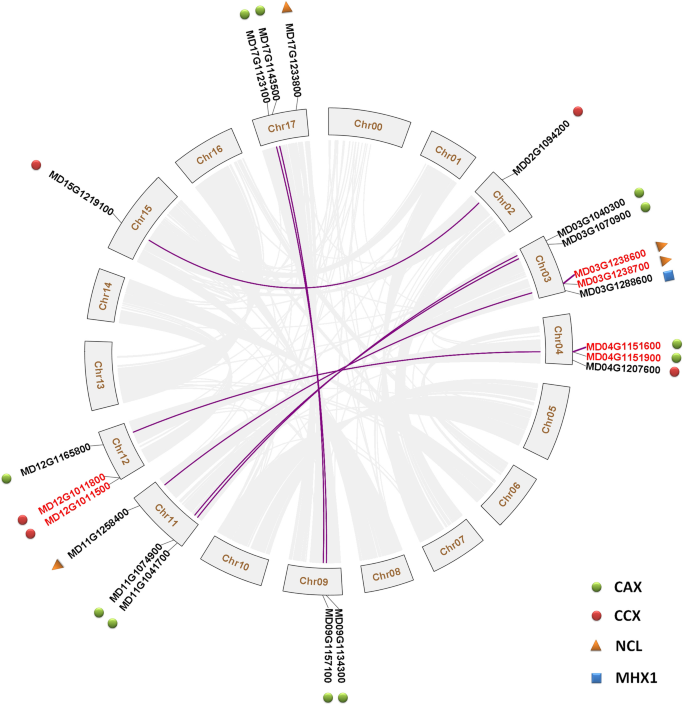
片段复制和串联复制是植物基因家族扩增的两个主要原因[45,46].因为苹果中的Caca家族基因的数量,特别是CAX.和NCL公司基因显着高于此拟南芥,我们分析了苹果中这些可可家族基因之间的共线关系。根据从GDR数据库下载的染色体位置数据(Gene_Models_20170612.GFF3),将这些21个CACA系列基因映射到八个苹果染色体,每条染色体的1至5(图。1).共线分析显示了不同染色体之间的共同性的复杂模式,例如CHR 2和CHR 15,CHR 3和CHR 11,CHR 4和CHR 12和CHR 9和CHR17之间的共同性。(图。1).这一结果与之前对苹果基因组的研究一致[47,48].共线分析还发现,14个CACA家族基因(七对)经历了节段性重复事件:五对CAX.,一对CCX.(MD02G1094200和MD15G1219100型)和一双NCL公司(MD03G1238600.和MD11G1258400.)(图。1). 此外,三对基因经历了串联重复事件和CAX(MD04G1151600和MD04G1151900.)、芝加哥气候交易所(MD12G1011500和MD12G1011800.)及NCL (MD03G1238600.和MD03G1238700),每个家族包含一对(图。1).
采用局部blastp方法,对这21个苹果CaCA家族蛋白的同源序列进行了鉴定拟南芥.然后基于系统发育树命名这些21种蛋白质(附加文件3.:图S1)拟南芥(桌子1).序列分析表明,这些蛋白质的长度为400至653AA,并且Cax系列蛋白通常约为450AA(表1).在表中总结了蛋白质长度,质量重量,pH 7.0的电荷,等电点(pi)和这些可可族蛋白的基因组位置1.在Caca系列中,CCX蛋白是唯一在pH7.0处显示阳性值的唯一值,而其PI值(> 7.0)相对于其他蛋白质也显着更高(表1).
苹果CaCA超家族蛋白的系统发育分析、基因结构展示及保守基序预测
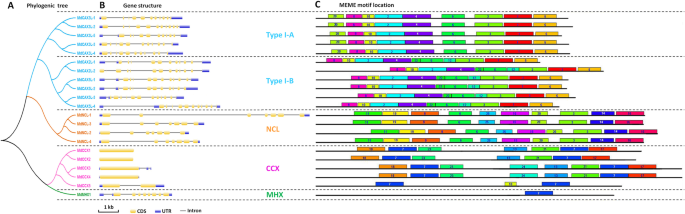
为了进一步研究这21个CACA超家族蛋白之间的关系,我们进行了详细的系统发育,基因结构和保守基序分析(图。2).系统发育分析表明,这些蛋白质可以完全分为四组:CAX,NCL,CCX和MHX [13.].另外,CAX系列可以进一步划分为两个亚组I-A和I型-B(图。2a) - 与其他植物中的Cax蛋白相似[9,13.].
基因结构分析也支持该分组。基因结构在Different系列之间变化很大(图。2b)。虽然内含子的长度变化,属于同一系列的基因具有相同的外部/内含子数和相同的外显子内组合物图案(图。2b)。但是,有两个例外:mdcax3l-5和MdCCX5.在I-A类型的基因中,仅限mdcax3l-5I-B型基因中5 '非编码区含有一个内含子,且5 '非编码区内含子较多。MdCCX5在编码区有一个内含子,这使得它不同于其他CCX家族基因(图。2b)。基因MdNCL-1另外值得注意的是其较长的内含子,使其序列几乎是CaCA超家族中其他基因的两倍。
除了基因结构分析,保守基序的预测进一步支持了系统发育分组。通过在线软件MEME,在这些蛋白质中发现了25个保守的基序(图。2C和附加文件5:图S3)。与系统发育树一致(图。2a) 同一组的蛋白质显示出相似的基序组成模式,而属于不同家族的蛋白质则由不同的基序组成,并显示出完全不同的组成模式(图。2C和附加文件5:图S3)。通过比较I-A型和I-B型亚群的基序组成,我们推断这三个基序(基序20、基序22和基序12)可用于区分两种类型的CAX蛋白(图。2c)。
MdCAX蛋白的基因克隆、序列比对及三维结构预测
为研究苹果CAX家族蛋白的结构和功能,我们克隆了该家族10个基因的全长序列;然而,一个基因的序列(mdcax3l-5)无法获得。基因克隆的结果表明,预测的编码序列(CD)为三个MdCAX公司基因(mdcax2l-1,mdcax2l-2, 和mdcax3l-2)在苹果基因组中是不正确的(表1).预测的转录发起站点(ATG)mdcax2l-1(MD17G1143500)以及mdcax2l-2(MD09G1157100.)分别被错误地向后移动,导致删除(附加文件6:图S4a)或附加序列(附加文件6:图S4b)在这两种蛋白质的N末端。为了mdcax3l-2(MD12G1165800),在其编码序列的C末端区域有四个碱基的错误插入(附加文件)6:图S4c),导致了编码帧的易位和氨基酸序列的变化(附加文件6:图S4d)。克隆的CDS和蛋白质序列MdCAX公司基因列在附加文件中7,所有后续分析均使用校正后的序列进行。
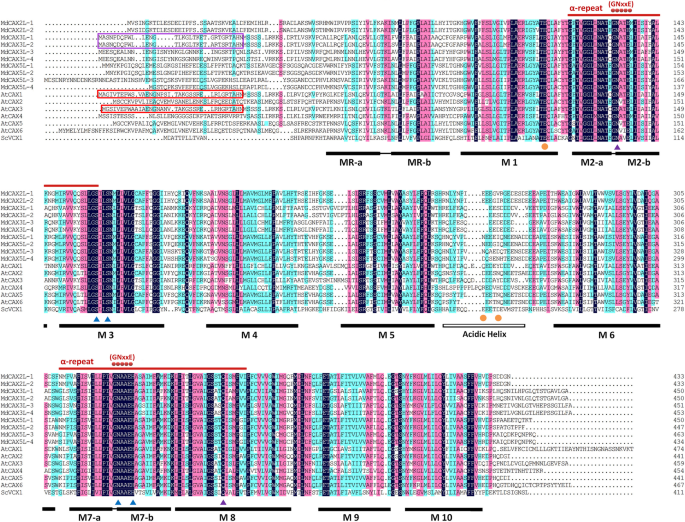
序列比对结果显示,与atcax和ScVCX1蛋白相似,MdCAX蛋白均包含11个TM区域(图1)。3.).除第一个TM螺旋区(MR)外,其余10个TM区域(M1-M10)也分为两半:TM 2 ~ 6和TM 7 ~ 11,由一个不保守的酸性螺旋区连接(图1)。3.).此外,还存在两个称为α-重复区域的高度保守的阳离子结合区域,其位于Tm 2-3和Tm 7-8内,并且每个α-Region含有“Gnxxe”基序(图。3.).基于序列对准,我们在MDCAX3L-1和MDCAX3L-2中鉴定了预测的N末端自动抑制域,其已在ATCAX1和ATCAX3中发现,并显示为影响钙离子转运[24.,49](图。3.).
随着酵母ScVCX1蛋白3D结构的释放,几个负责结构维护和离子转运的关键残基被鉴定出来[31.].通过序列比对,我们发现这些残基也存在,并且在MdCAX蛋白中具有很好的保守性。3.): E106 (M2)和E302 (M7)为关键氨基酸2+运输;残基E83 (M1)、E230(酸性螺旋)和D234(酸性螺旋)负责钙2+浓度;N103 (M2)和Q328 (M8)对M2和M8之间的结构维持起重要作用;残留S129 (M3)、S132 (M3)、N299 (M7)、H303 (M7)对M3和M7之间的结构维护很重要[31.].
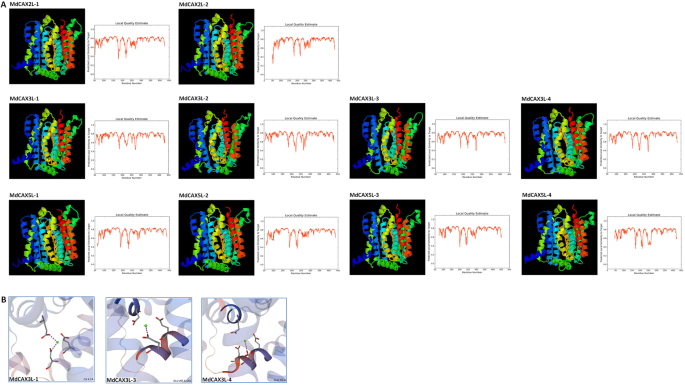
更深刻的表征MDCAX蛋白的结构和离子传输功能,我们基于SCVCX1(PDB ID:4K1C)的结构模型来预测其3D结构。正如我们所预期的那样,所有MDCAX蛋白质形成完美的空间结构,其与SCVCX1类似,其局部相似性大于0.7的大多数残基(覆盖率:0.83-0.93)(图。4a和附加文件8:表S2)。此外,在这些TM区域中,M2和M7在其中点处扭结形成沙漏状结构,离子(H+、钙2+)通过,导致M2a/M2b和M7a/M7b分离(图5)。4a).预测还确定了一些可能对Ca至关重要的残基2+MdCAX3L-1、MdCAX3L-3和MdCAX3L-4的结合(图。4b和附加文件8:表S2)。
表达分析mdcax在钙离子处理下
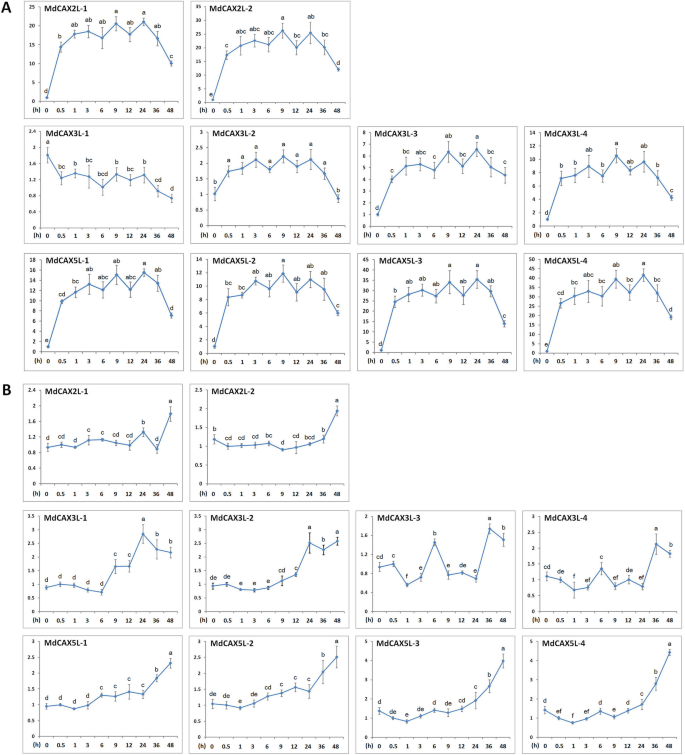
水培苹果幼苗用于研究响应MdCAX公司钙离子治疗的基因。MdCAX公司基因对钙离子处理反应显著,尤其是苹果叶片,其中表达量变化最多MdCAX公司超过十倍(图。5a) 是的。此外,表达MdCAX公司叶片中的基因显然与根中的基因不同。在钙离子处理下,最多的表达MdCAX公司在叶片中,基因表现出先上调后下调的模式,只有一个例外,mdcax3l-1,显示出显着的下调表达式图案(图。5a).相比之下,大多数MdCAX公司基因由CA不断上调2+根系处理显著(图。5b)。其中MdCAX公司基因,mdcax3l-1也是唯一在叶片中表现出与根完全相反的表达模式(图。5).
ⅠA型CAX蛋白钙转运活性的研究
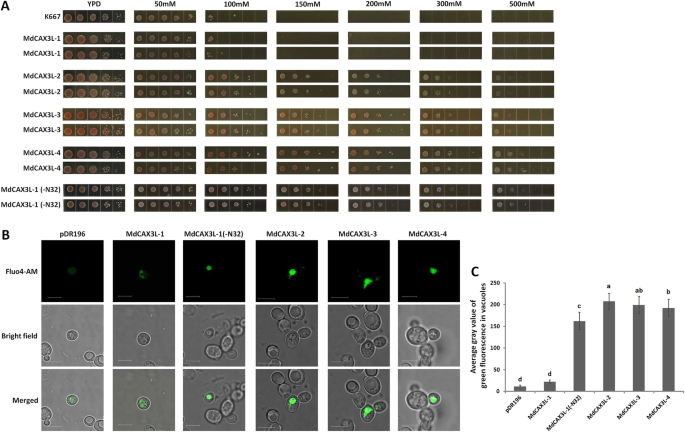
基于不同植物中CAX1/CAX3蛋白的钙离子转运功能[2,20.,29.]和明显的回应MdCAX公司加入基因2+治疗,钙运输能力四mdcax3l.I-A型基因(图。2)被研究。首先,我们使用CA表征其钙运输能力2+敏感酵母菌株K667。在YPD培养基中,K667正常增长(图。6a) 是的。然而,当Ca2+浓度增加到100毫米,其生长显着抑制;当加州2+浓度进一步增加,菌株根本没有存活(图。6a).相反,过度表达这三个中的任何一个MdCAX公司基因(mdcax3l-2,mdcax3l-3, 和mdcax3l-4)使转基因菌株在具有高浓度的钙中的培养基中存活,即使当浓度升高到> 500mm时,即使浓度也增加(图。6a).这一结果提示这三个基因可能具有较强的钙转运能力。
苹果CAX家族蛋白钙运输活性的特征。一个用不同浓度的钙离子处理的酵母细胞的表型。图上方的标签显示CACL的浓度2用于钙离子处理。b用钙敏感荧光探针Fluo4-AM标记的酵母细胞的明亮场和荧光显微镜。秤条表示5μm。MDCAX3L-1至MDCAX3L-4表示K667酵母菌株的转化,具有相应的全长MdCAX公司MdCAX3L-1(−N32)代表被截断的转化mdcax3l-1基因,其N末端的32个氨基酸被去除。以K667或用空载体pDR196转化的K667为对照。cK667酵母细胞液泡中绿色荧光的平均灰度值。表达指定的十酵e细胞的绿色荧光的灰度值MdCAX公司用基因计算绿色荧光的平均灰度值。标有不同字母的条形图表示不同位置的显著差异P< 0.05基于单因素方差分析和Duncan检验(SPSS软件,version 26)
没想到,过度的表达mdcax3l-1的片段复制基因mdcax3l-2(图。1)序列相似度高达94.6%(图。3.),未恢复K667的钙离子敏感表型(图。6一种)。鉴于N末端自动抑制区域对Cax蛋白钙运输能力的强烈抑制作用[2,50],我们从MdCAX3L-1 (32aa;无花果。3.)并且还在K667中转移截短的MDCAX3L-1(-N32)。如预期的那样,截短的MDCAX3L-1(-N32)恢复了K667的钙离子敏感表型(图。6a),暗示MDCAX3L-1的N末端区域可以以类似于ATCAX1的方式抑制其钙运输能力[50].
进一步描述四种钙转运能力MdCAX公司基因,我们进行了CA2+对k667细胞进行荧光染色实验MdCAX公司使用钙敏感探针Fluo4-AM的基因。荧光观察表明,k667酵母细胞表达截短的mdcax3l-1(−N32)或三个MdCAX公司基因(mdcax3l-2,mdcax3l-3,mdcax3l-4)在液泡中表现出强烈的Fluo4-AM荧光,表明在真空中大量积聚的钙离子(图。6b,c)。相反,表达PDR196或全长的细胞mdcax3l-1显示微弱的荧光,钙离子不积累在液泡中(图。6这些结果表明MdCAX公司基因可以促进钙离子在液泡中的积累,进一步说明基因在钙转运中的作用。
启动子分析MdCAX公司基因
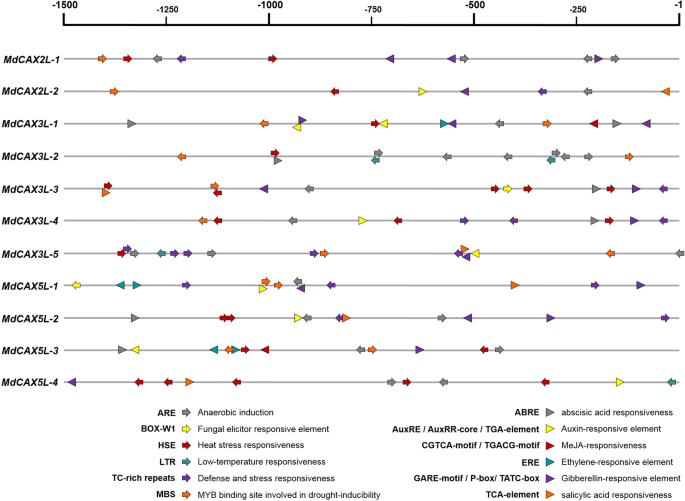
对植物的研究表明CAX.基因对各种非生物应激响应,例如低温,涝,盐,干旱和重金属[11.]. 研究MdCAX公司我们首先在这些基因的启动子区发现了与应激反应相关的顺式元件。上游序列长度为1500 bpMdCAX公司基因(附加文件9获得并用在线软件Plantcare进行分析并分析。发现各种与非生物应激反应性相关的顺式元素,如缺氧,热,低温和干旱,以及与植物激素有关的元素,例如ABA,毒剂,MEJA,乙烯,GA和SA,许多这些CIS元素出现多次(图。7;额外的文件10.:表S3和附加文件11.:图S5)。这个结果表明MdCAX公司基因在苹果非生物胁迫反应及其调控中起着重要作用。
表达谱的MdCAX公司非生物胁迫处理下的基因
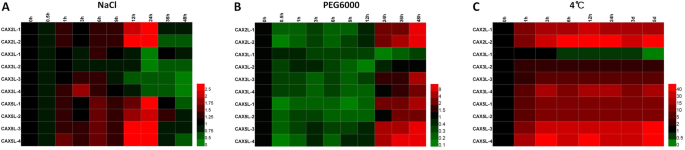
进一步研究响应MdCAX公司在不同的非生物胁迫条件下,用NaCl、PEG6000和低温(4 摄氏度)。在NaCl处理下,所有属于I-B亚型的基因(mdcax2ls.和MdCAX5Ls)显示上调的表达模式,然后进行下调(图。8a) 是的。对于属于I-A亚型的基因,基因表达的改变mdcax3l-1很微妙,但是mdcax3l-2受到NaCl治疗的下调。mdcax3l-3和mdcax3l-4表现出轻微上调后显著下调的表达模式(图。8一种)。表达相关性分析还表明属于I-B型组的基因在其表达式模式中高度相关(附加文件12.:图S6a和附加文件13.).在组类型I-A中,mdcax3l-1与mdcax3l-2, 和mdcax3l-3与mdcax3l-4(附加文件12.:图S6a)。
研究回应MdCAX公司利用PEG6000(10%,W/V)模拟干旱处理。大部分MdCAX公司基因表现出先下调后上调的表达模式mdcax3l-1,由PEG6000处理连续下调(图。8b).相关分析表明mdcax3l-1与其他基因无相关性MdCAX公司家庭(附加文件12.:图S6a和附加文件13.); 然而,I-B型之间有很高的相关性MdCAX公司基因。在低温下,大部分MdCAX公司基因被强烈上调,而mdcax3l-1表现出强烈的下调模式(图。8c)。相关性分析还表明表达式之间存在负相关性mdcax3l-1和其他mdcax(附加文件12.:图S6a和附加文件13.).我们还通过测量相关的生理参数,包括MDA和脯氨酸内容物,以及SOD和POD活性,评估苹果幼苗对这些应力处理的反应。这些指标的增加表明,苹果幼苗显着反应这些压力处理(附加档案14.:图。S7)。
进一步研究响应CAX.在NaCl、干旱和4°C处理下,我们下载了转录组数据CAX.基因(AtCAX1型到AtCAX5型)拟南芥并评估他们的表达模式。总的来说,这五个AtCAX公司不同的基因对不同的胁迫处理有不同的表达模式(附加文件15.:图S8)。苹果I-B型组基因的表达与基因的表达高度相关AtCAX5型氯化钠处理下(附加文件12.:图S6b及附加文件16.). 四的表达mdcax3l.I-A型基因与基因表达无高度相关性AtCAX1型或者AtCAX3型,但它们与AtCAX4型表达,也属于I-A组的基因(附加文件12.:图S6b)。此外,大多数mdcax3l.基因也表现出高的相关性与AtCAX4型表达式的PEG处理(附加文件12.:图S6b及附加文件16.).4°C处理下,表达最多MdCAX公司基因与基因表达呈负相关AtCAX1型或者AtCAX3型表达,而mdcax3l-1表达与这两个基因的表达呈高度正相关,尤其是与基因的表达呈高度正相关AtCAX1型(附加文件12.:图。S6B)。
CAX家族蛋白相互作用网络的预测
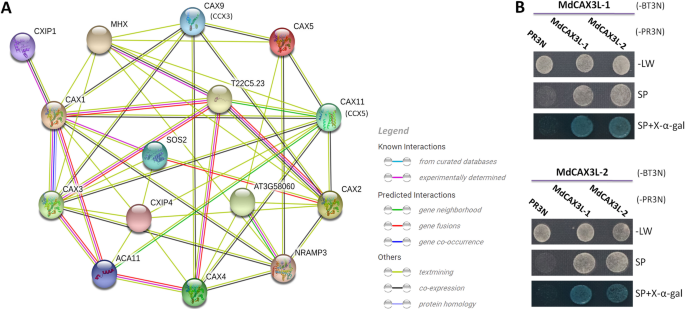
为了了解这些MDCAX蛋白中非生物应激反应的调节机制,我们预测了基于其邻近的MDCAX蛋白的蛋白质相互作用网络拟南芥.首先将其蛋白质序列输入在线数据库字符串(https://string-db.org/).在确认了他们的同源后拟南芥采用blastp方法,通过STRING预测和可视化cax相关蛋白相互作用网络。CAX家族蛋白内部存在复杂的相互作用,如CAX1和CAX3之间的相互作用(图1)。9a).功能注释表明这两种蛋白在调节植物体内离子稳态方面是至关重要的(附加文件17.:表S4)。此外,CAX与CCX家族蛋白之间也存在复杂的相互作用,如CAX1与CAX9 (CCX3)和CAX11 (CCX5)的相互作用(图5)。9a) 是的。此外,我们还鉴定了几种在植物胁迫反应中起重要作用的蛋白质,这些蛋白质可能与CAX蛋白相互作用(图。9一种)。例如,SOS2涉及调节细胞内NA+和K+稳态与耐盐性[51,52,53].CXIP1调节Cax阳离子转运蛋白,保护细胞免受蛋白质氧化损伤。MHX,NRAMP3和MTP8(AT3G58060)涉及传送各种金属离子,例如Fe,Mg,Zn,Mn和Cd,并调节植物金属公差(附加文件17.:表S4)。
MDCAX蛋白蛋白质相互作用网络的预测(一个)验证MDCAX3L-1和MDCAX3L-2之间的相互作用(b).一个与Cax蛋白相关的预测相互作用网络。该预测基于MDCAX Orthologs拟南芥使用联机数据库字符串。不同颜色的线表示预测的蛋白质相互作用关系的来源,紫色线表示这种相互作用已经在实验中得到验证拟南芥.b验证MDCAX3L-1和MDCAX3L-2之间的相互作用,并通过酵母双杂交(Y2H)测定。BT3N和PR3N分别表示Y2H测定中使用的诱饵和捕食载体。-Lw,没有亮氨酸和色氨酸的SD培养基。SP(选择板),没有亮氨酸,色氨酸,组氨酸和腺嘌呤的SD培养基,并补充含量2.5mm 3-at(3- aminotriazole)
考虑到高序列相似性,不同的钙转运能力和表达模式mdcax3l-1和mdcax3l-2,我们利用酵母双杂交膜蛋白系统(MoBiTec)研究了它们之间的相互作用。将这两个基因的全长CDS分别克隆到诱饵(pBT3N)和猎物(pBR3N)载体中,并以不同组合转化到酵母品系NMY51中。MdCAX3L-1和MdCAX3L-2既相互作用,又相互作用(图1)。9b).这一结果与之前的研究一致拟南芥并支持预测的交互网络。
讨论
CACA超家族的特征在于几种植物物种,例如拟南芥[20.,35.)、大米(13.], 小麦 [9], 棉布 [49],还有大豆[38.].虽然钙在应力阻力中起着重要作用[5,6,11.和水果品质[40,41,42,43,54,55,56CACA Superfamily尚未在苹果中表征。在这里,我们在苹果中进行了第一次详细描述了CACA系列。基因在CAX.对家系进行克隆,分析其对钙胁迫和非生物胁迫的反应。本研究通过对钙转运能力的表征和蛋白质相互作用网络的预测,为进一步研究CAX蛋白在苹果抗逆中的作用和机理奠定了基础。
苹果CaCA家族基因的扩展及其进化关系
串联和节段性重复事件是基因家族扩张的基本机制。在这项研究中,苹果中的Caca家族基因数量(表1)几乎是两倍拟南芥[9]. 考虑到苹果基因组较大(651 Mb)[48]相对于拟南芥(125 Mb)[57),苹果进化过程中发生的两次全基因组复制事件[47]苹果不同染色体间复杂的共线性关系[47,48],我们怀疑苹果CaCA家族的扩张主要是由片段复制驱动的。与这一假设相一致,共有14个基因(66.7%)与节段性重复事件有关(图。1).这种大部分基因表明,节段性重复是苹果中可可族膨胀的主要模式。串联复制也可能在CACA系列的扩增中发挥着重要作用(图。1).因此,这个家族主要是通过基因复制事件扩展的,类似于苹果的其他基因家族[58,59,60,61,62].
根据系统发育分析,21个CaCA家族蛋白被分为4组,如拟南芥[13.].通过基因结构分析和保护基序的预测支持蛋白质的该分裂(图。2).此外,这些分析还确定了几个不同于同一组内其他基因的基因,例如MD09G1157100.(mdcax2l-2),预测序列被基因克隆显示出不正确(附加文件6:图。S4)。还注意到了编码序列的错误规定MdCAX公司基因(附加文件6:图。S4)。因此,我们怀疑具有特殊基因结构的其他基因也可能具有序列预测误差,例如mdcax3l-5(图。2b)。这些错误还可以使用根据其预测序列在苹果基因组中的预测序列设计的引物来解释为什么我们不能获得该基因的CD。
苹果CAX蛋白I-A类钙转运能力的特征
ATCAX1和ATCAX3是钙转运蛋白,也是植物中最多研究的CAX家族蛋白[13.].因此,我们专注于评估苹果中同源蛋白的运输能力,其被命名为MDCAX3L-1至MDCAX3L-4。如预期的那样,K667酵母菌株中异源表达测定和钙荧光染色测定的结果表明,三种MDCAX3L蛋白应具有强钙输送到真空含量的强能力(图。6).然而,mdcax3l-1没有显示任何钙离子传输能力(图。6),虽然它的节段性重复基因mdcax3l-2做过。
序列对准表明MDCAX3L-1包含N末端自动抑制区域(图。3.).基于CAX蛋白中钙转运的抑制作用,我们怀疑该区域可以抑制MDCAX3L-1的钙运输能力,以类似于ATCAX1中记录的方式[50].本研究核实了这种粉丝(图。6).但是,这一结果提出了另一个有趣的问题。鉴于两个节段性重复基因之间的高序列相似性mdcax3l-1和mdcax3l-2,为什么MdCAX3L-2的钙转运能力不受该区域的抑制(图。6)?同一问题也适用于ATCAX3和ATCAX1 [24.].但是,序列相似AtCAX1型和AtCAX3型MdCAX3L-2的钙转运能力远强于AtCAX3[24.].
MDCAX3L-1和MDCAX3L-2之间的序列对准表明,在N末端自身抑制区域内仅存在三个氨基酸取代,并在11个跨膜区域内的几个氨基酸取代(图。3.). 基于ScVCX1的三维结构和钙离子输运机制[31.]我们假设N-末端自身抑制区的抑制作用是基于它与跨膜区特定部分的相互作用。当这些区域中的一些关键氨基酸发生变化时,这种相互作用被破坏,抑制作用被消除。这一假设与缺失的观察结果是一致的[2,29.,49,50或干扰[2] N末端自动抑制区域可以恢复植物Cax蛋白的运输能力;SOS2通过与CAX1的N末端自动抑制区域进行交互来激活CAX蛋白的传输容量[52]; ScVCX1蛋白质结构和钙离子转运活性的维持依赖于特定跨膜区域内特定氨基酸之间的相互作用(图。3.和4)[31.]. 因为大多数研究检测植物CAX蛋白的钙转运活性已经去除了N-末端自身抑制区[31.,63],与AtCAX1和AtCAX3相比,本研究鉴定的这两个蛋白MdCAX3L-1和MdCAX3L-2可以为研究CAX家族蛋白钙离子转运的关键氨基酸和机制提供更好的模型[63].
蛋白相互作用网络的表达分析和预测
CAX蛋白在调节植物对各种非生物胁迫的抗性中起着重要作用[10.,11.]. 在本研究中,表达分析表明MdCAX公司基因对钙和非生物胁迫处理反应显著(图。5和8)这表明这些基因在苹果逆境反应中也起着重要作用。此外,大多数MdCAX公司基因表现出相似的表达模式,尤其是在成对的重复基因之间(图。5和8和额外的文件12.:图。S6)。这表明属于同一亚组的复制基因,甚至属于属性的基因(图。2),可能在苹果应激反应中发挥类似或冗余的作用。
在这些当中MdCAX公司基因,mdcax3l-1与其他基因相比,表现出明显不同甚至相反的表达模式,特别是在钙(图。5a)和冷处理(图。8C和附加文件12.:图S6a)。结合MdCAX3L-1和MdCAX3L-2之间钙转运能力的差异(图。6)这些两种蛋白质之间的相互作用关系(图。9B),表明这两种蛋白可能在钙转运和应激反应中具有特殊的调控机制。例如,它们可以通过不同类型的蛋白质相互作用调节钙转运能力和植物钙信号反应。这一假设与AtCAX1和AtCAX3相互作用显著促进其钙转运能力的事实相一致[24.,35.].
最近关于SOS2相关钙转运蛋白ATANN4的研究提出了一种用于盐胁迫的反馈调节机制,其依赖于细胞溶质钙浓度的变化[51].在拟南芥, AtCAX1与AtSOS2相互作用并被AtSOS2激活[52,这对于抗盐胁迫至关重要[64].基于预测的网络(图。9a),我们可以推断MDCAX蛋白,例如MDCAX3L-1和MDCAX3L-2可以与MDSOS2相互作用,该蛋白质已被证明对于苹果中的耐盐性重要[65,66,67]. 这些观察进一步表明,两种MdCAX蛋白与SOS2之间可能存在钙依赖性调控机制。除SOS2外,该网络还鉴定了其他可能与MdCAX蛋白相互作用的蛋白质,如CXIP1、MHX、NRAMP3和MTP8(AT3G58060)(图。9),在应激反应及其调节中发挥重要作用(附加文件17.:表S4)。基于拟南芥中MdCAXs的直系同源序列预测蛋白质相互作用网络,这一预测依赖于两组蛋白质特异性结合残基的保守性。这对于CAX蛋白N端的残基尤其重要,因为许多CAX相互作用蛋白被发现与AtCAX1的N端尾部结构域结合,如SOS2和CXIP[21.,23.]CAX蛋白的N末端区域通常是非常可变的(图。3.). 需要更多的研究来验证这些预测的蛋白质相互作用关系。该网络有助于进一步研究MdCAX蛋白调节苹果胁迫反应的机制作用。
结论
在这项研究中,从苹果基因组中鉴定了属于苹果CACA超家族的21种基因。将这些基因分为四组:CAX,CCX,NCL和MHX。还确定了苹果中可可族家族成员的外显子系统结构,保守的基序分布和染色体位置。基因克隆和表达分析显示MdCAX公司基因参与了苹果的非生物胁迫反应。蛋白质相互作用网络的预测确定了几种可能与CAX蛋白相互作用并在非生物胁迫反应中发挥重要作用的蛋白质。结合钙转运能力的共线性分析和鉴定,一对片段复制基因(mdcax3l-1和mdcax3l-2)鉴定了表现出不同的钙运输能力。Y2H测定表明这两种蛋白质可以彼此相互作用。通常,这些结果为未来的研究提供了基础MdCAX公司在苹果的基因。
方法
苹果CaCA家族蛋白的序列检索与鉴定
苹果全基因组蛋白序列(GDDH13)从GDR数据库(Genome database for Rosaceae;https://www.rosaceae.org/)中CaCA家族蛋白的序列拟南芥从Tair(rabidopsis信息资源)数据库(https://www.arabidopsis.org/). 我们从Pfam数据库(pfam32.0)下载了钠钙交换蛋白的HMM(hiddenmarkovmodel)文件;http://pfam.xfam.org/),我们使用HMMER软件(版本3.1b2)对苹果蛋白质组进行查询,默认e值(e值< 0.05)。HMMER筛选结果中的蛋白质序列随后提交到pam和SMART数据库(http://smart.embl-heidelberg.de)验证保存的NA_CA_EX域是否存在。手动消除过于短(MD09G1157400,MD14G1008300)或未完成不完全域的蛋白质(附加文件1:表S1)。
苹果CaCA家族基因的染色体定位、共线性分析及特性研究
我们从GDR数据库中下载了包含苹果CaCA家族基因定位数据的GFF文件(gene_models_20170612.gff3)。利用MCScanX软件对不同苹果染色体进行共线性分析。利用TBtools软件对CaCA家族基因的染色体位置和共线性数据进行可视化分析。用DNAstar软件(版本7.1.0)测定蛋白质长度、质量质量、pH 7.0时的电荷和等电点pI值。最热门的歌曲拟南芥利用BioEdit软件(版本7.0.9.0)采用局部blastp法测定苹果CaCA家族蛋白。
系统发育关系,基因结构和保守基序分析
使用邻近加入(NJ)方法(参数设置:Bootstrap方法,1000复制;泊松模型;成对删除),用Mega-X软件(第10.0.5版)构建了系统发育树。用在线基因结构显示服务器(GSDS 2.0;)绘制苹果CACA系列基因的内外外显子示意图。http://gsds.cbi.pku.edu.cn)并基于从GDR数据库获得的信息(GENE_MODELS_20170612.GFF3)。使用以下参数使用Online Meme软件(5.0.2)来识别保守的图案:-Protein -oc。-nostatus -time 18,000 -mod ANR -NMOTIFS 25 -MINW 6 -MAXW 50 -objfun Classic -Markov_order 0。
MdCAX蛋白三维结构的序列比较和预测
SCVCX1的蛋白质序列是从国家生物技术信息数据库中获得的(NCBI,https://www.ncbi.nlm.nih.gov/)从蛋白质数据库(pdb)下载其晶体结构模板(4k1c.pdb),https://www.rcsb.org/).序列比对采用DNAMAN软件(版本6)进行,MdCAX蛋白的三维结构采用在线软件SWISS MODEL (https://swissmodel.expasy.org/),并用RasWin软件(2.7.5.2版本)进行可视化。
基因克隆与表达分析MdCAX公司钙离子和非生物应激处理下的基因
克隆全长CDS SequcnesMdCAX公司苹果中的基因,从西北A&F大学的园艺实验站生长的“Quinguan”苹果植物的成熟叶中提取了总RNA(中国陕西杨凌)。参与钙或非生物应激处理的实验在受控环境室中进行。用于表达分析MdCAX公司以组织培养的苹果幼苗(' Royal Gala ', GL-3)为试验材料。处理前,将幼苗移栽到生根培养基(MS + 0.1 mM IAA)上生根。1个月后,选择生长状态稳定的植株转入水培条件下(Hoagland营养液)培养10天。然后再次选择这些植株,用100 mM CaCl钙处理2)、NaCl (200 mM)、PEG6000 (10%;(W/V),或低温(4℃),在连续白光条件下的不同时期。光强设置为10,000 lx,湿度设置为70%。对于钙、NaCl和PEG6000处理,温度设置为25℃。RNA提取和实时定量RT-PCR分析遵循上述方法[62];基因特异性引物列于附加文件中18..用HEMI软件绘制了HEATMAPS(Impartrator for Heatmap,1.0版)。
用于表达分析AtCAX公司在不同的非生物胁迫条件下,GEO数据集用于拟南芥从NCBI数据库(salt-GSE5623、DREAH-GSE5624、cold-GSE5621)下载。群体间相关分析MdCAX公司基因与组内相关分析MdCAX公司和AtCAX公司基因与在线平台OMICSHARE进行(https://www.omicshare.com/tools/)采用Spearman相关分析。
酵母k667菌株的钙离子处理及钙离子荧光染色
获得用不同改变的酵母菌株MdCAX公司基因,这四种MdCAX公司基因(mdcax3l-1到mdcax3l-4)而被截断的mdcax3l-1被克隆到酵母表达载体PDR-196中,然后转移到钙离子敏感酵母突变菌株K667中。在选择SD培养基( - ura)和PCR筛选后,用于存在转基因的存在,每个以上的两种单克隆菌株MdCAX公司基因,并用于后续Ca2+治疗。
对于使用不同浓度钙离子的处理,对照酵母菌株(K667)或用不同浓度钙离子转化的K667菌株mdcax3l.基因在液体YPD培养基中培养至OD浓度600 = 1.0. The bacterial solutions were then diluted four times in a 10-fold gradient and placed on solid YPD or YPD medium varying in the concentration of CaCl2. 三天后,观察菌株的生长情况并拍照。
采用钙敏感荧光探针Fluo4-AM对钙离子进行观察2+pDR196(空载体)或不同的酵母细胞内水平转化MdCAX公司基因。在荧光观察之前,酵母细胞在液体SD培养基( - ura)上生长到指数相,然后稀释至OD600 = 0.2 ~ 0.3 in medium supplemented with 50 mM CaCl2.30°C培养4 h后,用PBS液洗涤3次,除去培养基,用5 μM Fluo4-AM在30°C孵育20 min。随后,用PBS洗涤酵母细胞3次,除去荧光染料,用激光扫描共聚焦显微镜(徕卡TCS SP8 SR)观察荧光。GFP荧光的激发波长和发射波长分别为488 nm和512-520 nm。使用LAS AF软件(Leica Application Suite Advanced Fluorescence, version 4.3)测定酵母细胞液泡中绿色荧光的灰度值。
启动子分析和蛋白质相互作用网络预测
分析MdCAX公司从GDR数据库中下载苹果基因组序列(GDDH13_1-1_formatted.fasta),序列长度为转录起始位点(ATG)上游1500 bpMdCAX公司提取基因。然后将这些序列进入在线计划PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),寻找与应激反应和植物激素相关的顺式作用元件。利用在线数据库STRING (version 11.0;https://string-db.org/),有机体指定为“拟南芥蒂利亚纳'。
酵母双杂交(Y2H)分析
由于cax是膜蛋白,因此采用了酵母双杂交膜蛋白系统(MoBiTec)。的全长CDmdcax3l-1和mdcax3l-2使用制造商的指示,分别使用每个制造商的一步克隆试剂盒(Vazyme)分别克隆到诱饵载体PBT3-N和捕食载体PPR3-N(MOBITEC)中。然后使用每种制造商的指示(Mobitec)使用锂乙酸锂方法将这些构建体转化到酵母菌株NMY51中。酵母细胞在SD培养基(-LEU / -TRP)上涂布培养,并通过PCR筛选进一步证实阳性克隆。然后将转化的菌落涂覆到具有或没有X-α-GAL(20μg/ mL)的选择培养基(SD-LEU / -TRP / -HIS / -HIS / -HIS / -LED)上,以测试可能的相互作用。
可用性数据和材料
我们上传了克隆的核苷酸序列MdCAX公司与加入号码MT820134的GenBank基因mdcax2l-1,MT820135用于mdcax2l-2,MT820136用于mdcax3l-1, MT820137mdcax3l-2, MT820138mdcax3l-3, MT820139mdcax3l-4,MT820140用于MdCAX5L-1型,MT820141 for.MdCAX5L-2型,mt820142 for.mdcax5l-3, MT820143为mdcax5l-4. 本研究中使用的剩余数据包含在文章及其附加文件中。
缩写
- PI:
-
Isoeletric点
- 光盘:
-
编码序列
- UTR:
-
非翻译区
- 阿巴:
-
脱落酸
- 梅贾:
-
甲基jasmonate
- GA公司:
-
赤霉素
- 山:
-
水杨酸
- NJ:
-
邻居加入
- QRT-PCR:
-
定量实时逆转录PCR;PBS:磷酸盐缓冲液;Y2H年
酵母双杂交
- 3-AT:
-
3-氨基唑.
- X-α-GAL:
-
5-bromo-4-chloro-3-indolyl -α-D-galactopyranoside。
工具书类
- 1。
Hirschi KD。钙难题。多功能营养和特定信号。植物理性。2004; 136(1):2438-42。
- 2。
zhao J, Cheng NH, Pittman JK, Yoo KS, Park J, Smith RH, et al. .增加钙水平和延长货架期番茄表达拟南芥H+/ Ca2+运输工具。植物生理学。2005;139(3):1194–206.
- 3.
杜德安,库德拉J,桑德斯D.钙信号语言。植物生物学。2010;61:593-620。
- 4.
Swarbreck SM、Colaco R、Davies JM。植物钙通道。植物生理学。2013;163(2):514–22.
- 5.
Edel KH, Marchadier E, Brownlee C, Kudla J, Hetherington AM。植物中钙基信号的进化。咕咕叫医学杂志。2017;27 (13):r667 - 79。
- 6.
Demidchik V,沙巴拉S。植物细胞质钙升高的机制:离子通道、钙挤压系统和NADPH氧化酶介导的ROS-Ca的作用2+中心'。Funct植物Biol。2018; 45(1-2):9-27。
- 7.
歌曲SJ,冯QN,李克,李娥,刘Q,康H等。在气孔运动期间,仪表塑性相关的钙信号调节模块阻尼ABA信号。植物理性。2018; 177(4):1666-78。
- 8.
关键词:植物钙离子,跨膜转运,钙离子,功能新植醇。2018;220(1):49 - 69。
- 9
Taneja M、Tyagi S、Sharma S、Upadhyay SK。加利福尼亚州2+/阳离子反转运体(CaCA):面包小麦的鉴定、特性和表达谱(小麦L.)。前植物科学。2016;7:1775.
- 10。
Ma Y,Berkowitz Ga。多聚体Cax复合物和CA2+信令 - 超越潮湿的家务。J Exp Bot。2017; 68(15):3997-9。
- 11.
皮特曼JK,赫斯基KD。网速:阳离子/H+金属修复和非生物应激信号传导的运输扣。植物BIOL。2016; 18(5):741-9。
- 12.
McAinsh先生,Pittman JK。塑造钙信号。新植醇。2009;181(2):275 - 94。
- 13。
皮特曼,赫希·KD。系统发育分析和蛋白质结构模型鉴定出不同的钙2+/阳离子逆向转运蛋白与拟南芥和水稻基因家族结构的保护。米饭。2016;9(1):3.
- 14
埃默里L,惠兰S,希尔斯基KD,皮特曼JK。Ca的蛋白质系统发育分析2+/阳离子altiporters和洞中的洞察力。前植物SCI。2012; 3:1。
- 15
利顿j . Na+/ Ca2+三个哺乳动物基因家族控制Ca2+运输。Biochem J. 2007; 406(3):365-82。
- 16
Khananshvili D.钠钙交换剂(NCX):组织特异性和全身职能下面的分子标志。pflug arch eur J PHY。2014; 466(1):43-60。
- 17
王P,李泽,魏杰,赵泽,太阳,崔SJ。一个na+/ Ca2+参与拟南芥盐胁迫的交换剂样蛋白(AtnCl)。J Biol Chem。2012; 287(53):44062-70。
- 18
李斐,张国荣,冈萨雷斯N,郭玉清,胡海华,朴S等.Ca2+-昼夜节律调节钠+/ Ca2+交换剂AtNCL影响开花时间和生长素信号转导拟南芥.植物细胞环境学报。2016;39(2):377-92。
- 19
Gaash R,Elazar M,Mizrahi K,Avramov-Mor M,Berezin I,Shaul O. Phylogy和植物MHX运输车的结构模型。BMD植物BIOL。2013; 13:75。
- 20.
许志伟,郑立国,康宁汉,李建平,李建平,李建平+/ Ca2+反向转运体拟南芥. 美国国家科学院学报。1996;93(16):8782–6.
- 21.
manhar M, Shigaki T, Hirschi KD。植物阳离子/小时+交换物(CAXs):生物功能和基因操作。植物医学杂志。2011;13(4):561 - 9。
- 22。
Shigaki T, Rees I, Nakhleh L, Hirschi KD。CAX阳离子/质子反转运体的三个不同系统发育群的鉴定。化学学报,2006;63(6):815-25。
- 23。
Shigaki T, Hirschi KD。CAX阳离子/H具有多种功能和分子性质+换热器在植物。植物医学杂志。2006;8(4):419 - 29。
- 24。
Cheng NH, Pittman JK, Shigaki T, Lachmansingh J, LeClere S, Lahner B等。功能性协会拟南芥正常生长和离子稳态需要Cax1和Cax3。植物理性。2005; 138(4):2048-60。
- 25。
Hirschi KD,Korenkov VD,Wilganowski NL,Wagner GJ。表达式拟南芥cax2.在烟草中改变了金属积累和锰耐受性。植物杂志。2000;124(1):125 - 33所示。
- 26。
Edmond C, Shigaki T, Ewert S, Nelson MD, Connorton JM, Chalova V等。cax2样阳离子转运体的比较分析表明其功能和调控的多样性。j . 2009; 418:145-54。
- 27
Baliardini C, Meyer CL, Salis P, Saumitou-Laprade P, Verbruggen N.阳离子交换器1在金属超蓄能器中具有镉耐受性rapidopsis halleri在限制氧化应激方面起着重要作用拟南芥SPP。植物理性。2015; 169(1):549-59。
- 28
Wu Q, Shigaki T, Williams KA, Han JS, Kim CK, Hirschi KD,等。拟南芥Ca2+/H+矮牵牛的抗纤维蛋白Cax1变体增强了镉的耐受性和积累。J植物理性。2011; 168(2):167-73。
- 29
Kamiya T,Akahori T,Maeshima M.米阳离子/ H基因的表达谱+酵母中交换器家族及其功能分析。植物生理学杂志。2005;46(10):1735-40。
- 30.
Shigaki T、Mei H、Marshall J、Li X、Manohar M、Hirschi KD。开放式阅读框架的表达拟南芥CAX1但不是其cDNA,赋予酵母的金属耐受性。植物BIOL。2010; 12(6):935-9。
- 31。
威特AB,Pedersen BP,Schlessinger A,Bonici M,Chau BH,Roe-Zurz Z等。真核钙/质子交换器交替进入的结构基础。自然。2013; 499(7456):107-10。
- 32。
Nishizawa T,Kita S,Maturana Ad,Furuya N,Hirata K,Kasuya G,等。h的反运转机制的结构基础+/ Ca2+交易者。科学。2013; 341(6142):168-72。
- 33。
关键词:钙离子,晶体结构,晶体结构,晶体结构2+/H+抗原蛋白yfke揭示了CA的机制2+流出及其pH调节。美国国家科学院学报。2013;110(28):11367–72.
- 34。
赵家,康纳顿jm,guo y,li x,shigaki t,hirschi kd等。拆分拟南芥的功能研究2+/H+交易所。J Biol Chem。2009; 284(49):34075-83。
- 35。
Zhao J,Shigaki T,Mei H,Guo YQ,Cheng NH,Hirschi KD。相互作用拟南芥Ca2+/H+交换器CAX1和CAX3。中国生物医学工程学报。2009;28(7):4605-15。
- 36。
韩南,兰威,他x,邵q,王bs,赵xj。表达A.碱蓬莎莎液泡H+/ Ca2+运输基因In.拟南芥有助于盐度的生理变化。Plant Mol Biol Rep. 2012;30(2): 480 - 7。
- 37。
Mei H,Zhao J,Pittman JK,Lachmansingh J,Park S,Hirschi KD。在拟南芥的Planta调节中2+/H+逆向转运CAX1。J Exp Bot。2007; 58(12):3419-27。
- 38
罗·戈兹,王鹤,黄吉,田伊思,王毅,张杰,等。来自大豆的推定的血浆膜阳离子/质子抗植物赋予耐盐性拟南芥.植物mol biol。2005; 59(5):809-20。
- 39
Michailidis M、Karagiannis E、Tanou G、Samiotaki M、Tsiolas G、Sarrou E等。通过高通量绘图揭示的樱桃果实发育中钙作用的新见解。植物分子生物学。2020https://doi.org/10.1007/s11103-020-01063-2.
- 40.
Michairidis M,Karagiannis E,Tanou G,Karamanoli K,Lazaridou A,Matsi T,等。甜樱桃果生理学中的代谢物和物理化学方法解开钙的钙动力调节。植物理性生物化学。2017; 116:68-79。
- 41.
于杰、朱明、王明、徐勇、陈伟、杨庚。钙诱导葡萄皮花青素积累的转录组分析。Sci Hortic(阿姆斯特丹)。2020;260:108871.
- 42.
马丁斯V, Billet K, Garcia A, Lanoue A, Gerós H.外源钙缺陷葡萄莓代谢产生更多的芪类化合物和更少的花青素。食品化学。2020;313:126123。
- 43.
Kafe GK、Khot LR、Zhou J、Bahlol HY、Si Y。向精确喷雾应用,以防止雨水诱导甜樱桃开裂:了解钙冲刷由于雨水和水果开裂的敏感性。Sci Hortic(阿姆斯特丹)。2016;203:152–7.
- 44.
Michailidis M、Karagiannis E、Tanou G、Sarrou E、Stavridou E、Ganopoulos I等。综合代谢组学和基因表达分析确定了甜樱桃果实采后衰老的热量和钙代谢网络。足底。2019;250:2009–22.
- 45.
植物抗病基因进化中的串联和片段复制与重组。趋势麝猫。2004;20(3):116 - 22所示。
- 46。
Li Al,Mao L.植物microRNA基因家族的演变。细胞res。2007; 17(3):212-8。
- 47。
Velasco R, Zharkikh A, Affourtit J, Dhingra A, Cestaro A, Kalyanaraman A等。驯化苹果(马吕斯×家蝇borkh。)。NAT Genet。2010; 42(10):833-9。
- 48。
(1) Daccord N, Celton JM, Linsmith G, Becker C, Choisne N, Schijlen E等。苹果基因组的高质量从头组装和早期果实发育的甲基组动力学。Nat麝猫。2017;49(7):1099 - 106。
- 49。
徐玲,扎西德,何立荣,张伟伟,何欣,张学利,等。ghcax3.基因,一种新的Ca2+/H+对棉花的低温反应和ABA诱导的信号转导进行调控。《公共科学图书馆•综合》。2013;8 (6):e66303。
- 50
皮特曼,赫希·KD。Cax1的调节,拟南芥CA2+/H+逆向转运器。N-末端自身抑制结构域的鉴定。植物生理学。2001;127(3):1020–9.
- 51
MA L,YE JM,Yang YQ,Lin HX,Yue LL,Luo J等。SOS2-SCABP8复合物在盐胁迫下产生和微调atann4依赖性钙签名。DEV细胞。2019; 48(5):697-709。
- 52
成恩,皮特曼杰克,朱杰克,赫尔西克。蛋白激酶SOS2激活拟南芥H+/ Ca2+整合钙转运和耐盐性的逆向转运蛋白CAX1。生物化学杂志。2004;279(4):2922–6.
- 53
刘禾,邓米,李兰,杨b,李鹤,邓hg等。与CBL相互作用蛋白激酶CIPK24相互作用的油菜籽钙素B样蛋白CBL4调节植物中的耐盐性。Biochem Bioph Res Co. 2015; 467(3):467-71。
- 54。
Sohail M, Ayub M, Khalil SA, Zeb A, Ullah F, Afrid SR等。氯化钙处理对桃果实采后冷藏品质的影响。2015;22(6): 2225-9。
- 55。
Ranjbar S,Rahemi M,Ramezanian A.纳米钙和氯化钙喷雾在苹果CV中的采后质量和细胞壁酶活性的比较。红色美味sci hortic-Amsterdam。2018; 240:57-64。
- 56。
Fortes Am,Granell A,Pezzotti M,Bouzayen M.与肉质果实质量相关的分子和代谢机制。前植物SCI。2017; 8:1236。
- 57。
Kaul S,Koo HL,Jenkins J,Rizzo M,Rooney T,Tallon LJ等。开花植物基因组序列分析拟南芥蒂利亚纳.自然。2000; 408(6814):796-815。
- 58。
Cao Zh,张Sz,王瑞克,张立,郝yj。基因组广泛分析苹果MYB转录因子家族允许识别促进植物中非生物应激耐受性耐受性耐受性的基因。Plos一个。2013; 8(7):E69955。
- 59。
Dong Ql,Duan Dy,Zhao S,Xu By,Luo JW,Wang Q等。苹果关系相关蛋白基因系列的基因组分析和克隆揭示了MDSAP15,其赋予转基因中干旱和渗透胁迫的耐受性拟南芥.国际分子科学杂志。2018;19(9):2478。
- 60.
王新飞,张淑珍,苏玲,刘鑫,郝永杰。基因家族LBD (LATERAL ORGAN BOUNDARIES Domain)的全基因组分析马吕斯有明显具有MdLBD11的功能特性。公共科学图书馆一号。2013;8(2):e57044。
- 61.
苏清,张思兹,元XW,陈CT,王XF,郝yj。苹果中NAM-ATAF1,2-CUC2转录因子家族胁迫响应基因的基因组分析与鉴定。植物理性生物生物。2013; 71:11-21。
- 62.
毛泽东,董Ql,李c,刘世,马fw。苹果BHLH转录因子的基因组鉴定与表征,响应干旱和盐胁迫的表达分析。前植物SCI。2017; 8:480。
- 63.
Shigaki T,Cheng Nh,Pittman JK,Hirschi K. CA的结构决定因素2+运输的拟南芥H+/ Ca2+逆向转运CAX1。中国生物医学工程杂志。2001;276(46):43152-9。
- 64.
Koster P、Wallrad L、Edel KH、Faisal M、Alatar AA、Kudla J。两个离子之战:Ca2+针对Na的信号+压力。植物医学杂志。2019;21:39-48。
- 65.
胡总,马庆杰,孙总,孙MH,游CX,郝YJ。一种CIPK蛋白激酶MdSOS2L1的过度表达增加了苹果和番茄的抗氧化代谢产物以增强其耐盐性。植物生理学。2016;156(2):201–14.
- 66.
胡dg,李米,罗h,董ql,姚yx,你cx等。分子克隆和功能表征MdSOS2型揭示了它与苹果愈伤组织耐盐性的关系拟南芥.Plant Cell Rep. 2012;31(4): 713-22。
- 67.
胡德东,孙春华,孙明华,郝永杰。MdSOS2L1磷酸化MdVHA-B1,以调节苹果酸盐的积累以响应盐度。Plant Cell Rep. 2016;35(3): 705-18。
致谢
感谢东北林业大学的布元元提供的k667酵母菌种,感谢沈阳农业大学的张志宏提供的gl3组培植株。我们感谢审稿人和编辑们的仔细阅读和对这份手稿有帮助的评论。
资金
国家重点研发计划项目(no . 2018YFD1000300/2018YFD1000301);国家自然科学基金项目(no . 31701894);陕西省重点科技专项(no . 2020zdzx03-01-02);国家农业科研专项资金(CARS-27)。
作者信息
从属关系
贡献
FM和KM设计了本研究。KM、JY、MW和HL进行了大部分的数据分析和实验。XG、SZ和QD进行了部分数据分析和实验。KM、JY和FM写了手稿。所有作者都阅读并批准了最后的手稿。
作者的信息
A&F大学园艺学院干旱地区作物压力生物学院校作物压力生物学卫生师范重点实验室,杨凌,陕西712100,712100。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者声明他们没有相互竞争的利益。
额外的信息
出版商说明
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1。
苹果和苹果中的CACA系列蛋白质筛选结果和保守域比较拟南芥.
附加文件2。
来自HMMER筛选结果的蛋白质序列。
附加文件3:图。S1。
苹果和可可西部蛋白质植入的肺泡家庭蛋白的系统发育分析拟南芥.红点表示可能不属于CaCA家族,需要在后续分析中移除的蛋白质。
附加文件4:图S2。
苹果和苹果中NCL蛋白的保守结构域分析拟南芥. 将AtNCL和四个MdNCL蛋白的序列输入到SMART数据库中,搜索保守结构域。
附加文件5:图S3。
苹果CaCA家族蛋白质序列中推测的保守基序。
附加文件6:图S4。
预测之间的序列比较CAX.苹果基因组中的基因及其进化CAX.在本研究中实际克隆的基因。
附加文件7.
克隆的CDS和蛋白质序列MdCAX公司这项研究的基因。
附加文件8:表S2。
苹果中Mdcax蛋白的3D结构预测的基本信息。
附加文件9。
启动子区序列(− 1500 bp)的MdCAX公司基因。
附加文件10:表S3。
在启动子区域中确定的顺式元素MdCAX公司在苹果的基因。正负符号表示顺式元件是位于正链还是负链。
附加文件11:图S5。
在启动子区域中确定的顺式元素MdCAX公司在苹果的基因。
附加文件12:图S6。
基因表达模式间的相关性分析MdCAX公司苹果(a)或之间的基因MdCAX公司和AtCAX公司基因(B)。
附加文件13。
的p-Value intragous相关分析的基质MdCAX公司基因。
附加文件14:图。S7。
MDA、脯氨酸含量及SOD、POD酶活性。标有不同字母的条形图表示不同位置的显著差异P< 0.05基于单因素方差分析和Duncan检验(SPSS软件,version 26).
附加文件15:图S8。
的表达模式AtCAX公司非生物胁迫条件下的基因拟南芥.
附加文件16.
的p-群体间相关分析的价值矩阵MdCAX公司和AtCAX公司基因。
附加文件17:表S4。
CAXS及其相互作用蛋白的功能诠释。
附加文件18。
中存在的引物MdCAX公司本研究中使用的基因。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
毛凯,杨洁,王敏。et al。苹果CaCA超家族的全基因组分析表明,MdCAX蛋白作为钙转运体参与了非生物胁迫反应。BMC植物生物学21,81(2021)。https://doi.org/10.1186/s12870-021-02866-1
已收到:
接受:
发表:
关键字
- 苹果
- 钙
- 新泽西州总科
- Ca2+/H+换热器
- 非生物压力