摘要
背景
gossypium hirsutumL.(由于其重要的纤维,饲料,食品,石油和生物燃料制品,棉花是世界上最经济上最重要的作物之一。然而,由于存在含有大量胶囊的小和黑色着色的腺体存在,棉籽的利用受到限制,这些腺体对人类和非反刍动物有毒。迄今为止,在颜料腺体形成中取得了一些进展,但其形成的潜在分子机制尚不清楚。
结果
在本研究中,我们通过对有腺体和无腺体植物叶片的比较转录组分析,鉴定了一个名为GhERF105 (GH_A12G2166)的AP2/ERF转录因子,该转录因子参与了腺体色素的调控。该基因编码了一个ERF蛋白,该蛋白位于核内,具有转录活性,并在棉酚含量较高的腺体棉中表达。病毒诱导的基因沉默(VIGS)Gherf105.造成了棉花腺体数量的急剧减少和棉酚含量的显著降低。Gherf105.展示了在腺体植物中的时空和诱导型表达的模式。
结论
这些结果表明Gherf105.有助于在腺体植物的部分器官中有助于颜料腺体形成和棉酚生物合成。它还提供了潜在的分子基础,以产生“无釉籽”和“玻璃植物”棉花品种。
背景
棉布 (Gossypium.由于其在纺织纤维、饲料、食品、石油和生物燃料产品中的经济价值,是世界上的主要作物[1那2].大约有50种Gossypium.属,其中四个在农业中培养,包括两个二倍体棉花(G.Herbaceum.和G.Arboreum.)及两种异源四倍体棉花(G.Hirsutum.和G.Barbadense.) [3.那4.那5.].在这些物种中,旱地棉花,G.Hirsutum.,是种植最广泛和主导世界棉花贸易的国家,每年超过90%的棉纤维产量[5.那6.].然而,由于棉籽和棉籽中存在对人类和非反刍动物有毒的棉酚腺,棉籽营养来源的潜力还不能充分实现[7.那8.].棉酚(Gossypol)是一种淡黄色酚类化合物,在锦葵科(Malvaceae)的某些种类的棉花中发挥保护作用,以抵御各种生物和非生物胁迫[9.那10那11].因此,用低棉醇种子和高棉醇植物的棉花成为研究人员的棉花繁殖的一个有趣区域。
这pigment glands, also called ‘gossypol glands’, ‘internal glands’ or ‘black glands’, located in the subepidermal layer of aerial organs in many parts of the plant, originate from a cluster of cells in the ground meristem, which differ from other cells in that they have a high-density gossypol and related terpenoids [7.].20世纪50年代“Hopi Moencopi”中颜料腺体腺体遗传机制的研究[12那13那14].到目前为止,许多研究表明,腺的形成是由至少6个独立位点的组合控制的,如GL.1那GL.2那GL.3.那GL.4.那GL.5.和GL.6.,占优势的不同组合(GL.)和隐性(GL.)等位基因调节不同器官的腺体形成[14那15那16那17那18].完全腺体表型由两对二份的纯合子隐性基因控制(GL.2GL.2GL.3.GL.3.)在异源四倍体中G.Hirsutum.[13那14,而显性等位基因(Gl2GL.2, Gl3.GL.3.)产生的腺体表型在不同器官中有不同的分布[14那19].这GL.2和GL.3.基因位于染色体(CHR.)A上T.12和维T.12G.Hirsutum.分别为(16那20.那21].等位基因GL.4.和GL.5.减少腺体的数量GL.6.与相比,对腺体形成的影响较弱GL.1[22那23].随后,GL.2arb那GL.2B.那GL.3.dav那GL.3.雷子那GL.3.rai.那GL.3.B.[7.],GL.2S.[24],GL.2E.[25],GL.3.N[26], 和GL.2B.[27与色素腺形成相关的基因也被鉴定出来。其中,GL.2E.是控制整个植物的无腺特征的最关键的基因。一个完全占主导地位的无照礼g .取得突变体(GL.2E.)命名为“Bahtim 110”(g .取得L),是一个显性等位基因GL.2这显示了上位效应GL.3.,最初是在埃及通过辐照诱变发现的海岛棉“吉萨45”种子32P,能有效抑制色素腺的形成[28那29那30.那31].从那时起,研究人员逐渐发现了几个腺体形成的基因。在2016年,GOPGF.通过基于地图的克隆方法鉴定了编码基本螺旋环 - 螺旋转录因子的基因(糖型颜料腺体形成基因),并位于A染色体上T.12 (32那33].CGF3.(棉质腺体形成),相同GOPGF.基因不仅直接调控腺体形态发生,还间接调控棉酚的生物合成[34].CGP1.(棉腺色素沉着1),与之相互作用GOPGF.,通过有腺体和无腺体棉花的比较转录组分析确定,参与了棉酚生物合成的调节,而不是腺体的形成[35].此外,小说RanBP2锌指蛋白(ZFP)和gaugras1.利用抑制消减杂交技术(SSH)从陆地棉‘湘棉18’[9.那36那37那38].近60年来,棉酚腺形成的分子机制以及棉酚与色素腺的关系等方面的研究取得了一些进展。然而,色素腺体形成的具体机制尚不清楚。
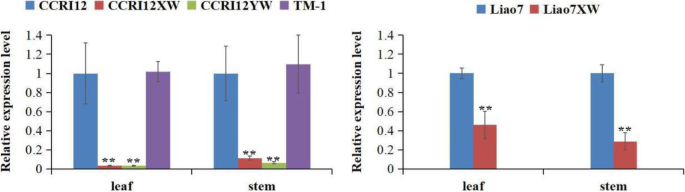
本研究通过对L7和L7XW、CCRI12和CCRI12XW两对有腺体和无腺体棉花叶片的转录组比较分析,鉴定出一个参与腺体色素沉着调控的乙烯反应因子GhERF105(图1)。1).该基因编码的ERF蛋白位于核内,具有转录激活活性,并包含一个转化的AP2结构域,在含有较多棉酚的腺体棉中表现出高表达。沉默Gherf105.结果表明,棉子酚处理后,棉子酚在叶片中的积累量显著下降,且叶片中棉子酚的积累量显著下降。此外,Gherf105.在有腺和无腺棉花的子叶、下胚轴、叶柄、叶和茎等气生器官中均有表达,且在乙烯诱导下均有表达。此外,CGF, GhERF105 CGP1和GOPGF.基因在叶片中高度表达,茎在腺体CCRI12和L7中,但在CCRI12XW,CCRI12YW和L7XW中具有较低的表达。
这些结果为全面分析棉花腺体形成和棉酚生物合成的分子机制提供了参考。然而,腺体性状遗传的多样性反映了腺体形成的调控复杂性。需要进一步的研究来更好地了解腺体发育的分子机制。
结果
克隆与序列分析
在该研究中,鉴定了CCRI12和CCRI12xW之间的2009摄氏度,其中下调1190个基因(补充表S1),鉴定了980℃,其中980℃,其中541个基因被下调(补充表S2),共获得了289个差异共表达基因,且在无腺基因中表现为下调。研究表明,多种转录因子可能对棉酚的形成和色素腺体的发育具有重要作用[39那40那41].因此,从289点鉴定了14个转录因子(补充表S.3.).编码bHLH (GhMYC2-like)的差异表达转录因子基因类别[32,接着是MYB (CGP1) [35],ERF(GHERF105),NAC和HSF。编程的细胞死亡(PCD)在颜料腺体的发展期间起着重要作用[42].有证据表明,乙烯通过激活基因与PCD相关[43那44那45].因此,我们专注于乙烯反应因素。这Gherf105.基因(GenBank ID:GH_A12G2166;从CCRI12的叶片克隆的加入号:XM_016865675)是711bp,其长度包含具有初始代码(ATG)和终端代码(TAA)的开放阅读框(ORF)(图。S.1).预测的蛋白质包含236个氨基酸,其中分子量为26.3kDa和7.72的等电点,含有ERF保守的DNA结合结构域(图2).棉花GHERF105属于AP2 / ERF的转录因子系列,在植物开发和环境压力反应以及激素信号和病原体防御中起重要作用46那47那48].
的表达式分析Gherf105.许多棉花品种的基因
表达水平Gherf105.分析了两对近ISO-eno-engic系(尼尔)和其他棉质涂抹,表明了这一点Gherf105.在叶子和茎的叶子中高度表达G.Hirsutum。(CCRI12, L7和TM-1),但CCRI12XW, L7XW和CCRI12YW的表达确实显著降低(图。2).基于不同的表达模式Gherf105.在六个棉花加入的部分器官中,Gherf105.可能与腺体的形成有关。但其在色素腺发育中的作用及调控机制有待于VIGS等技术的进一步研究。
沉默Gherf105.减少腺体形成和棉酚生物合成
在此,为了进一步探明其功能Gherf105.在色素腺体形成过程中。农杆菌利用TRV-based VIGS载体沉默植物烯去饱和酶基因(GhPDS) 和Gherf105.棉花幼苗的基因。结果表明,PDS的沉默,导致叶绿素和类胡萝卜素的损失[49].棉花植株的光漂白表型GhPDS与pTRV::00农杆菌渗透植株叶片相比,在渗透植株叶片后14-21天观察到-表达农杆菌(Fig。3.一种)。评估其功能,我们克隆了289 BP片段Gherf105.来自CCRI12植物并将其插入PTRV2以用于病毒诱导的基因沉默(VIGS),以抑制栽培腺体异丙醇棉中内源的表达。与未经处理的CCRI12中的相比,作为负孔T.ROL(图。3.B1-B2),Gherf105.-沉默的CCRI12植株在渗透后14-21d新叶腺体数量显著减少(图。3.B3-B6)。转录水平Gherf105.pTRV -Gherf10.5个叶片显著低于未处理CCRI12的叶片,但仍高于未处理CCRI12XW的叶片。3.C)。然而,新兴叶片的静脉具有较少的虚线,茎具有厚厚的腺体(图。3.b5-b6无花果。S3.).这些数据建议Gherf105.与之相反,它控制了叶片而不是茎的腺体形成,GOPGF.在包括叶子和茎的所有器官中显示腺体表型[29].我们采用高效液相色谱法测定了棉子酚在叶片中的含量,棉子酚含量降低了78%左右Gherf105.- 与未处理的CCRI12叶子相比,叶片仍然高于未处理的CCRI12xW中的叶子(图。3.d)。总而言之,结果表明Gherf105.可能参与颜料腺体形成和糖醇溶蛋白生物合成。
功能表征Gherf105.经验丰富。CCRI12中的棉花植物的光漂白表型接种PTRV :: GHPD和空载体。TRV :: GHPDS和TRV :: 00分别是积极的控制和负面控制。用PTRV :: GHERF105或空载体控制接种叶片GHERF105的相对转录水平。C在空载体(TRV ::00)和CCRI12.and CCRI12xW的GERF105沉默叶中的糖型含量,用作内部控制。d d1-d2表型gossypium hirsutum用pTRV::00载体接种CCRI12。d3-d6表型的gossypium hirsutumCCRI12接种PTRV :: GHERF105向量。D7-D8表型gossypium hirsutumCCRI12XW。d1-d8为图3中黄色方框所示位置的放大图。D1对应d2, d3对应d4, d5对应d6, d7对应d8。红色箭头表示叶子上腺体的位置。每个条形值代表三个独立实验的平均值±SD
时尚表达分析Gherf105.基因
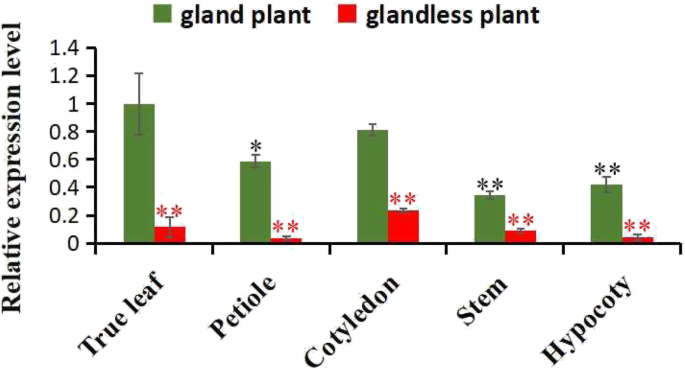
色素腺体位于茎、叶、萼片、花瓣和柱头的表面[17],Gherf105.基因与棉花颜料腺体的发育有关。因此,转录水平Gherf105.RT-qPCR检测了有腺体棉和无腺体棉不同器官腺体发育的相关基因。结果表明,腺植物的子叶、下胚轴、叶柄、叶和茎的mRNA水平分别是无腺植物的3.5倍、10.5倍、15.0倍、8.7倍和4.0倍。GhERF105在有腺植物器官中的mRNA水平显著高于无腺植物。同时,GhERF105在腺体植物叶片中的表达量最高,但在无腺体植物叶片与其他器官之间差异不显著(图1)。4.).此外,叶片和腺体叶片和子叶之间的Gerf105没有显着差异,但与叶柄,缺杆子和茎有显着差异。因此,这是Gherf105.基因在颜料腺体形成的腺体和无缘棉植物之间具有高度不同的表达模式。
核定位显示了GhERF105蛋白的转录活性
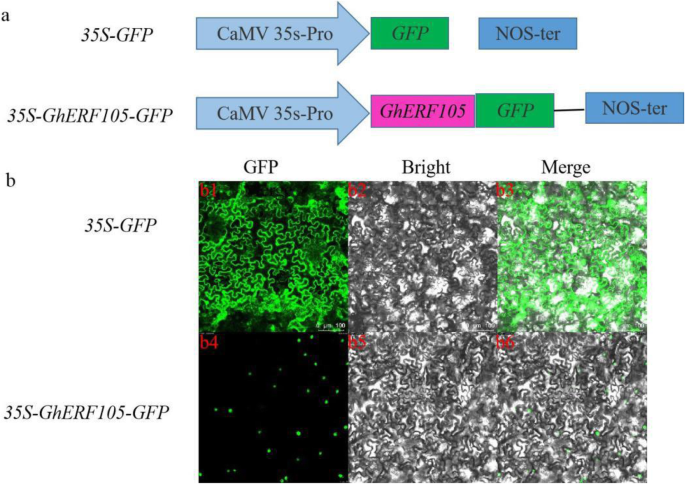
绿色荧光蛋白(green fluorescent protein, GFP)报告基因是蛋白质亚细胞定位的重要标记,在CaMV35S启动子的调控下,显示出很强的荧光信号,信号均匀扩散分布于整个细胞。基于功能注释信息,GhERF105被认为是一个转录因子。因此,核定位对于GhERF105的功能至关重要。的编码序列(CDS)来验证这一假设Gherf105.与绿色荧光蛋白(GFP)报告基因融合。在引入构建体之后(图。5.作为4.)通过农业浸润进入烟草细胞,Gerf105-GFP,融合到GFP的转录因子瞬时表示,并且仅位于烟草表皮细胞的细胞核中(图。5.b)。结果证实,GERF105-GFP是核局部蛋白质。
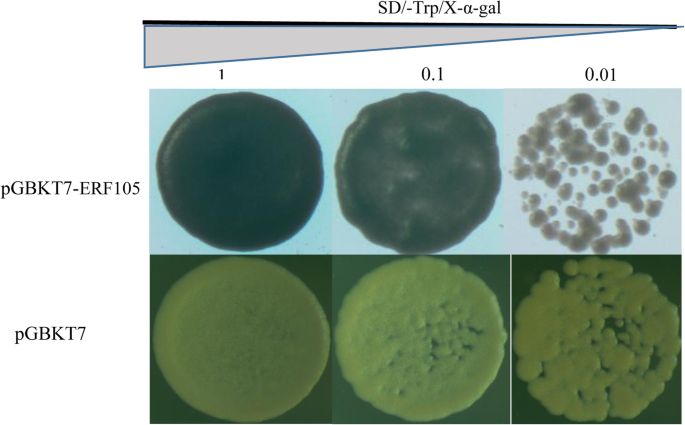
用PGBKT7-GHERF105转化的酵母菌株能够在选择性培养基SD / -TRP / -X-A-GAL上生长蓝色菌落,而具有空载体PGBKT7的那些菌株可以生长白色菌落(图。6.).这一结果表明GhERF105具有转录活性,说明GhERF105具有转录激活因子的作用。
表达式模式Gherf105.乙烯处理下棉花基因的研究
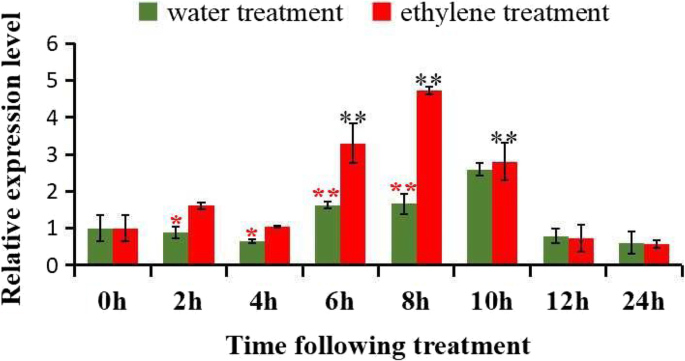
是乙烯信号转导途径中重要的植物特异性转录因子的ERF,已被证明在调节特定应激相关基因的表达时起着临界调节作用[50那51那52].乙烯与其他植物激素相互作用,并在乙烯介导的信号通路中调节致病相关(PR)基因的程序化表达[53].细胞程序性死亡(Programmed cell death, PCD)在色素腺的发育过程中起着重要作用gossypium hirsutum叶组织(42].乙烯在PCD过程中调节上游信号分子,通过ROS介导PCD信号[54].因此,研究的表达模式具有重要意义Gherf105.基因响应应激激素乙烯刺激。在该研究中,使用RT-QPCR分析来检测表达水平Gherf105.乙烯处理后不同时间的叶片中.与水处理植物相比,Gherf105.乙烯处理植株的mRNA在ET处理后8 h迅速积累达到最大值,12 ~ 24 h迅速下降,随后又下降到原来的水平Gherf105.在乙烯处理初期,胁迫激素乙烯在棉花叶片中诱导出较高水平,并在6 ~ 10 h保持在较高水平。7.).而GhERF105的表达变化与乙烯处理时间的长短没有正相关关系。这些结果表明Gherf105.在转录水平上对乙烯治疗有反应吗Gherf105.可能与乙烯信号转导途径或防御/应力信号传导途径有关。与此同时,推测棉花腺体形成和棉花合成的诱饵可以直接或间接地通过乙烯诱导和调节。
腺体形成中涉及基因的表达模式
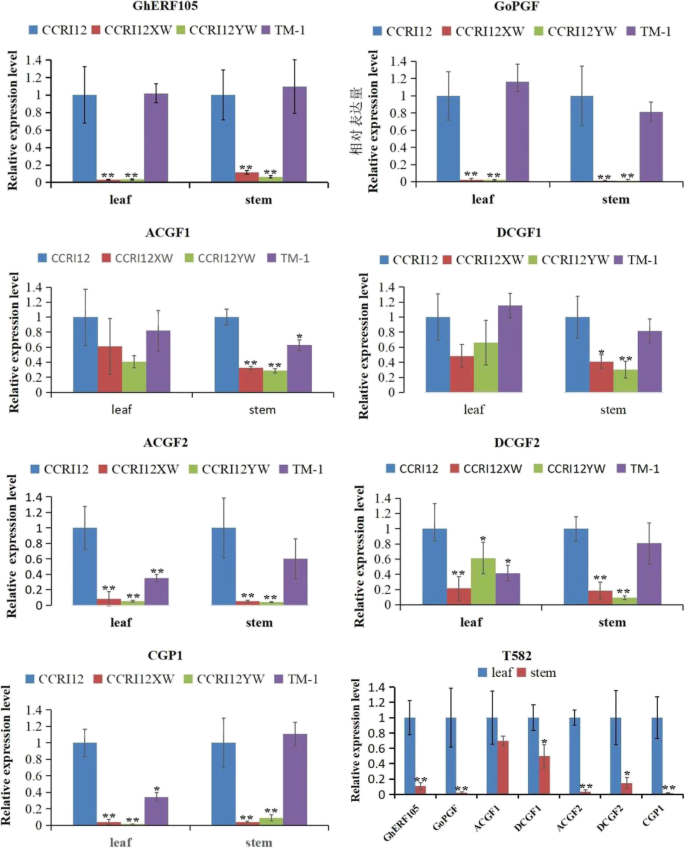
GOPGF./GhMYC2-like / CGF3同时控制腺体形态发生和棉酚合成[33那34那35],CGF1.显示了类似的功能GOPGF./ghmyc2样/CGF3.,CGF2.调节色素腺体的密度[35].尽管CGP1.受管制的棉酚合成[36].表达水平Gherf105.那CGF1.那CGF2.那CGP1.和GOPGF./ghmyc2样/CGF3.通过RT- QPCR在叶片中分析,茎的五个棉花载体,包括腺体g .分子(CCRI12和TM-1)、显性无腺CCRI12XW、隐性无腺CCRI12YW和无腺茎叶登录(T582)。RT- qPCR分析结果证实了这一点Gherf105.那CGF2.那CGP1.和GOPGF.而在CCRI12XW和CCRI12YW中表达量较低。的表达CGF1.CCRI12、CCRI12XW和CCRI12YW叶片中基因表达量差异不显著,但茎中差异显著(如图。8.).此外,我们还观察到这些基因的表达水平在叶子中显着高于茎G. Hirsutum(T582)(如图。8.).这些结果表明Gherf105.有没有类似的表达模式GOPGF.那CGF1.那CGF2.和CGP1.在一些棉织品中。最终,Gherf105.与叶子中的棉花颜料腺体发育有关。
讨论
迄今为止,开发生产低型棉花种子和高棉醇植物的棉花品种已成为棉花繁殖的重要课题。因此,了解颜料腺体形成的分子机制以及棉花棉花和腺体之间的关系非常重要。
近年来,研究人员在积累知识和鉴定一系列与色素腺体形成和棉酚合成有关的基因方面做出了相当大的努力。GoPGF / CGF3 / GhMYC2-like在腺体发育中起关键作用,独立调控腺体形态发生,通过与G-box基序结合,调控棉酚相关基因的表达,间接影响棉酚生物合成[34].CGF1.显示了类似的功能CGF3.,CGF2.调节颜料腺体的密度[35].沉默GOPGF.导致所有腺体棉的所有器官中没有腺体,导致几乎完全缺乏Gossypol [33那34那35].敲门声CGP1.通过CRISPR/Cas9和VIGS产生强烈的降低棉酚水平,表明它调节棉酚积累,但不调节腺体形态发生[36].沉默gaugras1.Vigs导致Glandless茎和叶柄,不会改变叶子中的腺体形成g .精华.此外,还测定了棉子酚的含量gaugras1.- 植物显着减少了[38].然而,低棉酚棉色素腺形成的分子机制尚不明确,制约了低棉酚棉育种的进展。因此,迫切需要探索棉花腺体形成的分子机制,从而促进棉花的遗传改良。
这项研究提供了几个证据Gherf105.基因与腺体植物的部分器官中的腺体形成有关。第一的,Gherf105.通过对有腺体和无腺体棉花叶片的比较转录组分析,鉴定了该基因。第二,Gherf105.在有腺体的增值中表达量高,而在无腺体增值中表达量低。第三,可拆卸的Gherf105.结果表明,通过VIGS可显著降低棉花叶片中可见色素腺体的含量,降低棉酚含量,但未改变茎上腺体的密度。此外,表达模式Gherf105.是否与已知的与腺体发育相关的基因相似(比如GOPGF.和CGF)在一些腺体和无腺的附加物中(图。8.).这些发现进一步表明Gherf105.可能参与了棉花腺体的形成。但两者对色素腺的调节机制略有不同Gherf105.和gaugras1..
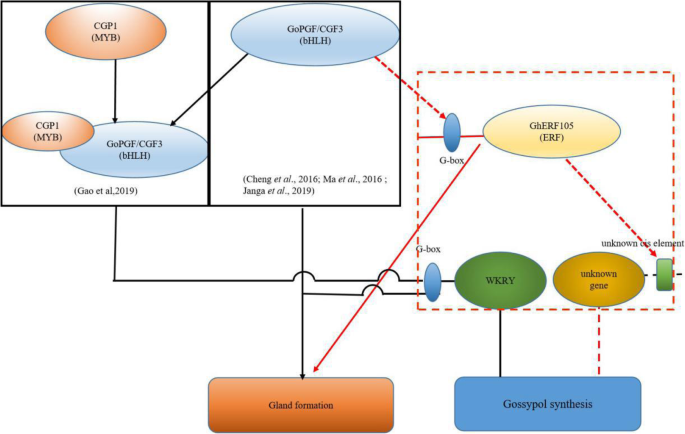
Gao等(2019)证实了CGP1a在烟草细胞核中与GoPGF相互作用,调控多个棉酚生物合成基因,控制棉酚等萜类化合物[36].马等人。(2016年)证实了这一点GOPGF.通过酵母单杂交测定分别结合Wrkys和萜烯合酶(TPSS)的启动子中存在的G型盒子基质,独立地调节腺体形态发生和糖易蛋白合成[34].启动子区Gherf105.包括g盒顺式作用元件。据推测GOPGF.调节表达Gherf105.通过在细胞核中结合G型盒CIS作用元件并通过直接和间接地结合其启动子的相关顺式作用元件来调节偶癣果相关基因的表达(图。9.).这种猜测将需要通过相关实验的结果进一步验证。
综上所述,克隆和鉴定了Gherf105.这为陆地棉腺体形成的分子机制及其功能的研究提供了新的信息。
结论
基于两对腺体和无毛棉植物的比较转录体分析,我们鉴定了名为的乙烯反应因素Gherf105.这参与了对腺染色素沉着的调节,Gherf105.从CCRI12的叶片中克隆的基因具有711bp,其长度含有初始码(ATG)和终端代码(TAA)的开放阅读框(ORF),预测蛋白质包含236个氨基酸,具有相对分子量的相对分子量26.3 KDA和等电点为7.72,含有ERF保守的DNA结合结构域。棉花GHERF105属于最大的AP2 / ERF族的调控转录因子。该基因在不同的器官中差异表达,来自腺体和无柔性棉涂层。沉默Gherf105.通过Vigs不仅减少了腺体的数量,而且还降低了治疗植物叶片中的棉酚的积累。Gherf105位于核中,其具有转录激活活性并被乙烯诱导。结果表明这部小说Gherf105.可能有助于调节颜料腺体和棉酚生物合成,以及激素信号传导和病原体防御。
一起参加,克隆和表征Gherf105.基因将开放新颖的机会来发现棉花腺体形成的分子机制。这些结果将进一步促进通过遗传工程改善棉花品种和腺体植物。
方法
植物材料和生长条件
CCRI12、CCRI12XW、CCRI12YW、L7、L7XW、TM-1、T582均来自中国农业科学院棉花研究所。其中,CCRI12(中国棉花研究所12号)和L7(辽棉7号)是陆地棉品种,具有深色的色素腺体,植株和种子中棉子酚含量高。而CCRI12XW、CCRI12YW和L7XW是显性的无腺近等基因系,它们在种子和植物中均无腺且棉酚含量较低,主要区别在于CCRI12和L7的腺体性状[55].' TM-1 '是种子和整株的腺性登录,' T582 '是植物无腺茎、无腺叶的腺性登录,被广泛用作遗传标准。所有的材料都是通过自交维持了数年。
发芽的种子浸在水里,紧随其后的是在高湿度环境中28°C在黑暗中2 d。Well-germinated种子随后被种植在0.3 L的7厘米直径有一种子在商用砂锅/土壤肥料混合和成长为2 - 3周28°C (16 h光和黑暗8 h)领导(Opple照明中国中山)温室内的灯具。
总rna的提取及cDNA的合成
将棉花不同器官的样本,包括一个或多个不同腺体的子叶、下胚轴、叶柄、叶片和茎作为总RNA的来源,立即在液氮中冷冻,并在−80℃保存。采用天根生物技术(北京)有限公司的RNAprep植物RNA试剂盒(富含多糖和多酚)从100 mg液氮叶地中分离总RNA。根据制造商的说明。以OD值为吸光度,测定rna的含量和纯度260/280(1.9-2.1)使用纳米二手C微体积紫外-可见分光光度计Wi-Fi (Thermo Fisher Scientific Inc., Waltham, MA, USA)紫外分光光度计,并采用1.0% (w/v)变性甲醛琼脂糖凝胶电泳检测其完整性。第一链cDNA由primescript™II第一链cDNA合成试剂盒(TaKaRa Bio,中国大连)按照制造商的反转录系统协议合成。
RNA测序
四倍体棉花近等基因系(gossypium hirsutum利用CCRI12、L7和无腺品系CCRI12XW、L7XW进行RNA-seq比较分析,鉴定与腺体形成有关的基因。采集各品系叶片制备文库,利用Illumina HiSeq 2000进行rna测序。采用DESeq2程序识别差异表达基因,以log fold change≥1 and FDR< 0.05为临界值确定差异表达基因[56那57那58那59].所有测序数据已储存于SRA (www.ncbi.nlm.nih.gov sra).注册编号为SRR1652340、SRR1652393、SRR1652399和SRR1652403。
分子克隆Gherf105.基因
全长cDNA序列Gherf105.从CCRI12的叶子中扩增,并克隆到PBI121载体中进行测序(Sangon,Shanghai,China或Genewiz,苏州,中国)。基因雷斯塔尔DNA聚合酶,DNTP和其他试剂由Takara Bio,(大连)有限公司提供PCR扩增Gherf105.基因进行的反应体积15μL包含模板1μL的cDNA、1.2μL的核苷酸混合物(2.5毫米),3 5μL×PrimeSTAR GXL缓冲区,0.3μL PrimeSTAR®GXL DNA聚合酶,0.4μL正向引物和0.4μL反向引物(10μΜ每个),和8.7μL ddH2O.反应程序:98°C, 5min;在98°C下循环10 s,在55°C下循环15 s,在68°C下循环1 min,最后在68°C下循环5 min;保持在10°C。PCR产物按照QIAquick PCR纯化试剂盒(250)(Qiagen, Düsseldorf,德国)的说明进行纯化,最终进样量为35 μL Qiagen EB缓冲液洗脱。用于Gherf105.克隆列于补充表S4..
GhERF105基因及其启动子的鉴定gossypium hirsutum
GhERF105的氨基酸序列和AP2结构域均来源于棉花fgd (https://cottonfgd.org/about/download.html.)及Prosite (https://prosite.expasy.org/)分别使用扩展程序计算Gerf105蛋白的预测分子量和等电点(http://web.expasy.org/protparam/).Gerf105的启动子的G盒从Plantcare获得(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).
实时荧光定量PCR分析基因表达
表达水平的Gherf105.通过使用ABI QuantStudio 5检测系统(Applied Biosystems,Carlsbad,CA)进行实时定量(RT-QPCR)分析进行。actin(Genbank登录号:AY305733)用作参考基因。使用TB Green Premix ExTaq TM(TLI RNASEH PLUS)进行20μLRT-QPCR实验(Takara Bio,China)。该反应含有0.5μl的每个引物(10μm),0.4μlrox参考DYEII(50x),1μl上述合成的cDNA模板,7.6μl灭菌DDH2O.条件如下:95℃的一个循环5分钟,40个循环为95℃,5s,55℃,30s,72℃。每个样品一式三份运行,每次生物复制一次进行三次。根据2计算基因的相对表达水平−ΔΔCT方法(59].使用Primer 5.0软件或在NCBI网站(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?link_loc = blasthome)并列入补充表s5..
重视程序
用于敲毁Gherf105.基因,使用先前公布的方法构建PTRV-VIGS载体[60那61那62那63].棉花PDS的cDNA片段(GHPDS1.,327 BP,GenBank登录号:HQ441184)和颜料腺体形成Gherf105.(337bp)使用PCR12通过PCR与基因特异性引物(在补充表S中列出的PCR12)扩增(Takara)扩增6.).将所得产物克隆到pTRV2中BamHI和kpni.生成名为PTRV2 :: PDS和PTRV2 :: GHERF105的重组矢量。然后将这些重组载体和空向量(PTRV2 ::00)引入农杆菌菌株GV3101(Weidi Bio,Shanghai,China)通过热休克方法。在1:1的比例中混合含有PTRV1和PTRV2或其衍生物(PTRV2 :: PDS和PTRV2 :: GHERF105)的农杆菌培养物。用完全扩张的子叶幼苗但没有插入的CCRI12的可见叶片渗透农杆菌含pTRV1和pTRV2、pTRV2- ghpds、pTRV2- gherf105的悬浮液分别通过注射器注入子叶。植株在25℃、16小时光周期/ 8小时暗周期和70%湿度下生长[33].提取RNA并进行RT-qPCR分析沉默效率。这施(GenBank登录号:AY305733)和Gherf105.被扩增为参考基因和靶基因[64].本研究调查2-3叶,统称总叶[65].本实验中使用的所有引物列于补充表S中6..
棉酚含量及分析
从CCRI12的叶片中提取棉酚,Gherf105.- 通过高效液相色谱(HPLC)(Agilent 1100,Agilent,Santa Clara USA)进行CCRI12和CCRI12xW植物[33那66].将每100mg植物样品冷冻干燥并使用液氮研磨成粉末,加入2ml叶片(乙腈/水/磷酸= 80:20:0.1)。将萃取以10000rpm离心10分钟,然后小心地将上清液仔细转移到新的EP管中。使用0.45μm尼龙过滤器过滤洗脱液进入小瓶。使用HPLC分析提取物。从Sigma Chemical Co. Ltd.购买了Gossypol参考标准
GhERF105蛋白亚细胞定位
为了研究Gherf105蛋白的亚细胞定位,通过在补充表S中列出的引物除去止芯密码子扩增Gherf105的编码区域7.,其中包含一个XBai.和Smai通过聚合酶链反应(PCR),克隆到遗址(下划线),在XBai.和Smai瞬时表达的部位PBI121-GFP载体,其在CAMV35S启动子的控制下映射编码绿色荧光蛋白(GFP)的ORF,并构建重组质粒P35S.-Gherf105.-GFP..P35S-GFP用作阳性对照。然后将GFP-GHERF105和GFP的质粒引入烟叶(尼古利亚娜·宾夕法尼亚州)分别通过农杆菌25°C光照下培养48-72 h。采用共聚焦激光扫描显微镜(德国Leica TCS SP8)观察绿色荧光信号,确定融合蛋白的定位。
GhERF105蛋白转活化活性测定
为了研究GhERF105蛋白的转活化活性,我们采用引物(Supplementary Table S)扩增了GhERF105 cDNA8.克隆到EcoRI和NotIpGBKT7载体生成pGBKT7- gherf105的位点。将空载体对照质粒转入酵母菌株AH109,分析其反转录活性。将OD600为0.1、0.01和0.001的酵母菌转化子置于SD/−Trp和SD/−Trp/−X-a-gal选择性培养基上,在30℃下孵育4 d。
乙烯处理
在溶解在水中时偏离乙烯的Ethephon(et)用作乙烯的替代品。在Trefoil阶段使用通常种植3至4周龄植物的叶子。与用水喷洒的叶片相比,作为阴性对照,通过用1mm / L Ethephon的混合物喷洒叶子来进行乙烯处理(Solarbio Bio,中国)。在取样叶片组织之前,将所有对照和处理的植物封闭在塑料袋中,用于不同的时间,并在25°C的密封室中放置16-H光/ 8-H-暗光周期。在治疗后在0,2,4,6,8,10,12和24小时收获整个植物。立即在液氮中冷冻并在-80℃下储存冷冻直至使用。用于表达分析的引物在补充表S中列出5..
统计分析
所有实验至少进行3次,结果代表3个重复的平均值±标准差(SD)。采用GraphPad Prism 8.0或SPSS软件(版本22.0)进行单因素方差分析(one-way ANOVA)评估数据的统计学意义。一种P-值<0.05被认为是显着的。一种P-值< 0.01被认为极显著。
可用性数据和材料
额外的数据被附加为补充桌子.所有测序数据已储存于SRA (www.ncbi.nlm.nih.gov sra).登录号为SRR1652340,SRR1652393,SRR1652399和SRR1652403可用https://www.ncbi.nlm.nih.gov/sra/.
缩写
- cd:
-
编码序列
- 度:
-
差异表达基因
- ERF:
-
乙烯响应因子
- 等:
-
etephon.
- FDR:
-
假发现率
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 子:
-
开放阅读框
- PCD:
-
编程细胞死亡
- 中收取:
-
病毒诱导基因沉默
参考
- 1.
Sunilkumar G,Campbell LM,Puckhaber L,Stipanovic Rd,Rathore Ks。通过组织特异性减少有毒棉毒蛋白的人工营养用工程棉籽。美国国家科学学会主办。2006; 103:18054-9。
- 2.
王k,王z,李f,ye w,王j,歌g等。二倍体棉花棉质raimondii的基因组草案。NAT Genet。2012; 44:1098-103。
- 3.
Bao Y, Hu G, Flagel LE, Salmon A, Bezanilla M, Paterson AH等。二倍体和异源多倍体棉花(Gossypium)独立驯化后profilin基因家族平行上调。美国国家科学学会主办。2011; 108:21152-7。
- 4.
Wendel的摩根富林明。多倍体中的基因组进化。植物生物学。2000;42:225-49。
- 5.
张赫伯,李烨,王立,Chee PW。棉基因组学的最新进展。int j植物基因组学。2008; 2008:742304。https://doi.org/10.1155/2008/742304.
- 6.
Yu J,Kohel RJ,史密斯CW。四倍体棉基因组广泛综合参考图的构建。基因组学。2010; 95:230-40。
- 7.
贝尔AA。和斯普坦诺维奇rd。棉花中颜料腺体的化学成分,生物活性和遗传学。在:1977年1月10日至12日的皮带棉花会议的诉讼程序,亚特兰大,乔治。孟菲斯:棉花基金会出版商;1997. p。244-258。
- 8.
张文杰,徐志荣,潘晓龙,闫晓华,王一波。奶牛全棉籽饲用棉酚毒性及加工效应研究进展。力所能及的科学。2007;111:1-9。
- 9.
蔡玉峰,谢玉峰,刘建国。棉花无腺种子及无腺植物研究。复习一下。农业支撑开发。2010;30:181-90。
- 10.
高伟,龙龙,朱立峰,徐玲,高文华,孙立强,等。蛋白质组学和病毒诱导基因沉默(VIGS)分析表明,棉酚、油菜素内酯和茉莉酸有助于棉花抗黄萎病。分子细胞蛋白质组学。2013;12:36 - 703。
- 11.
田鑫,阮建新,黄建强,杨长青,方旭,陈志伟,等。棉酚生物合成途径的表征。美国国家科学学会主办。2018; 115: E5410-8。
- 12.
陆地棉无腺铃及其在自然杂交研究中的应用。农学j . 1954; 46:527-8。
- 13.
McMichael SC。Hopi棉花,一种棉籽源的来源,无糖型颜料1.农艺J. 1959; 51:630。
- 14.
无腺基因gl2和gl3对棉花色素腺体的联合作用。农学j . 1960; 52:385-6。
- 15.
Gutierrez M,Vrdoljak J,Ricciardi A.开发Gossypol-Glandless棉花株。在诱导突变和植物改善中。维也纳:国际原子能机构;1972. p。397-404。
- 16.
李农协。陆地棉和巴巴多斯棉叶腺主要基因座的基因组定位。进化。1965;19:182-8。
- 17.
McCarty JC,Hedin Pa,Stipanovic Rd。棉质棉花型SPP。植物Gossypol所选GL的含量2和gl.3.等位基因。农业化学学报,1996;44:6 6。
- 18.
Scheffler JA, Romano GB。GVS1、GVS2和GVS3不同腺密度的陆地棉品系和GVS4和GVS5近等基因品系的登记。植物学报,2012;6:190-4。
- 19.
Miravalle RJ, Hyer AH。无腺棉籽育种中gl2gl2gl3gl3基因型的鉴定。作物科学。1962;2:395-7。
- 20。
Endrizi JE, Turcotte EL, Kohel RJ。棉属的遗传学、细胞学和进化。难以麝猫。1985;23:271 - 375。
- 21。
Percy R,Hendon B,Bechere E,Auld D.定性遗传学和突变体的利用。在:方dd,percy rg,编辑。棉布。麦迪逊:美国农业学会,Inc。,农作物科学学会,Inc。和美国土壤科学学会,公司;2015. p。155-86。
- 22。
李农协。旱地棉花和旱地棉花叶片颜料腺体分布的遗传研究。遗传学。1962; 47:131-42。
- 23。
无腺棉籽:前25年加工利用研究综述。J Am Oil Chem Soc. 1987; 64:839-54。
- 24.
Barrow Jr,Davis DD。GL.2S.-棉花色素腺体的新等位基因。作物科学。1974;14:325-6。
- 25.
Kohel RJ, Lee JA。埃及无腺棉的遗传分析。作物科学。1984;24:1119-21。
- 26.
张TZ,张XL,金尔,陈泽,郭WZ。旱地棉中新腺体形成基因的遗传鉴定。Acta Agron Sin。2001; 27:75-9。
- 27.
朱SJ,Reddy N,Jiang Yr,Ji DF。从Gosspium Bickii进入Upland棉质种质的延迟腺体形态发生性状的育种,血栓或遗传。Chin Sci Bull。2004; 49:2470-6。
- 28.
Afifi A, Bary AA, Kamel SA, Heikal I. Bahtim 110,无棉酚埃及棉新品系。1966年《帝国棉花种植Rev.》;43:112-20。
- 29。
卡瓦略LPD,维埃拉RM。巴巴多斯棉Gl2E.Gossypium hirsutum年棉花的基因。Rev de Oleaginosas纤维糖。2000; 4:39-44。
- 30.
董春,丁勇,郭伟,张涛。显性无腺基因Gl的精细定位2E.在海岛棉(Gossypium barbadense L.)。科学通报。2007;52:3105-9。https://doi.org/10.1007/S11434-007-0468-6.
- 31.
唐厘米,min lf,pan jj,金sy。HAI1菌株的遗传分析(G.Barbadence L.):GL的互动2E.和gl1。棉质SCI棉质SCI罪。1996; 8:138-40。
- 32.
程慧丽LCR,于建中,邹春生,张艳萍,王清良,等。棉花显性无腺基因Gl2e的精细定位与候选基因分析。Theor Appl Genet. 2016; 129:1347-55。
- 33.
马丹,胡勇,杨春青,刘宝林,方林,万强,等。棉花腺毛形成的遗传基础。Nat Commun。2016;7:10456。
- 34.
Janga MR, Pandeya D, Campbell LM, Konganti K, Villafuerte ST, Puckhaber L,等。调节棉花腺体发育的基因。植物生物技术[j];
- 35.
高伟,徐福才,卢璐,李勇,张建林,冲磊,等。定位于腺体的CGP1控制着棉花腺体的色素沉着和棉酚的积累。植物生物技术学报,2000,21(1):1 - 6。
- 36.
Cai Y,Mo Jc,Zeng Y,Ren WW,Xu Y,Wang Sh,等。通过抑制消减杂交克隆与淋巴色素腺体发育相关的CDNA。J北京林业大学。2003; 25:6-10。
- 37.
Cai Yf,Cai Xy,Wang QL,王P,张Y,CAI CW等。澳大利亚野生二倍体物种Gossypium Australe的基因组测序突出了抗病性和延迟腺体形态发生。植物生物技术J. 2019:1-15。https://doi.org/10.1111/pbi.13249.
- 38.
常攀,李斌,倪晓明,谢玉凤,蔡玉凤。陆地棉RanBP2锌指蛋白基因的克隆及表达分析。胶体表面B:生物界面。2007;55:153-8。
- 39.
徐毅,王杰,王某,王女,陈XY。Gawrky1的表征,棉花转录因子以重新培养倍二萜合酶基因(+) - δ-丁二烯合酶-A。植物理性。2004; 135:507-15。
- 40。
洪GJ,薛XY,毛泽东,王LJ,陈XY。Arabidopsis myc2与Della蛋白在调节倍二萜合酶基因表达中的蛋白质相互作用。植物细胞。2012; 24:2635-48。
- 41。
谢yf,王bc,李b,cai yf,xie l,xia yx等。棉花突变体(湘姆-18)文库cDNA文库的构建。胶体冲浪B生物界面。2007; 60:258-63。
- 42。
刘禾,周毅,王X,娇ZJ。在Gossypium hirsutum叶子中的颜料腺体形成期间编程的细胞死亡。植物BIOL。2010; 12:895-902。
- 43。
Rajhi I,Yamauchi T,Takahashi H,Nishiuchi S,Shiono K,Watanabe R等。利用激光微粉和微阵列分析在溶滤雾织物形成期间含有玉米根皮质细胞中表达的基因的鉴定。新植物。2011; 190:351-68。
- 44。
高桥等,研究了植物通气组织的形成。Plant Cell Monogr. 2014; 21:247-65。
- 45。
Takahashi H,Yamauchi T,Rajhi I,Nishizawa NK,Nakazono NK,玉米诱导的溶酶氧冷造成的氧化型型氧化性雾藻的皮质细胞中的成绩单型材在有氧条件下。Ann Bot。2015; 115:879-294。
- 46。
Müller M, Munné-Bosch S.乙烯反应因子:激素和应激信号转导的关键调控枢纽。植物杂志。2015;169:32-41。https://doi.org/10.1104/pp.15.00677.
- 47。
关键词:拟南芥,乙烯,免疫,应答因子实验机器人。2016;67:1231-41。
- 48.
Rotenberg D,Thompson Ts,德国TL,威利斯DK。病毒诱导基因沉默的有效实时RT-PCR分析的方法。J Virol方法。2006; 138:49-59。
- 49.
熊璐,舒梅克,朱家康。寒冷、干旱和盐胁迫期间的细胞信号。植物细胞(增刊)。2002; 14:165 - 83。
- 50。
Shinshi H,USAMI S,OHME-TAKAGI M.烟草I类丁质酶基因启动子乙烯响应区的鉴定。植物mol biol。1995年; 27:923-32。
- 51.
Sessa G, Meller Y, Fluhr R. A GCC元件和G-box基序参与了乙烯诱导的PRB-1b基因的表达。植物mol biol。1995年; 28:145-53。
- 52.
Sessa G, Meller Y, Fluhr R. A GCC元件和G-box基序参与了乙烯诱导的PRB-1b基因的表达。Plant Mol Biol(荷兰)。1995年; 28:145-53。
- 53.
元,陈毅,唐厘米,京瑞,刘股,潘JJ等。主导腺体基因GL的影响2E.旱地棉农艺和纤维特征。植物品种。2000; 119:59-64。
- 54.
关键词:陆地棉,腋芽,转录组,动态调节引用本文:中国生物医学工程学报(英文版)。
- 55.
Livak KJ,Schmittgen TD。使用实时定量PCR和2 -ΔΔct的相对基因表达数据分析方法。方法。2001; 25:402-8。https://doi.org/10.1006/meth.2001.1262PubMed:11846609。
- 56.
关键词:病毒,沉默,植物,基因功能植物j . 2004; 39:734-46。
- 57.
Gao X,Wheeler T,Li Z,Kenerley Cm,He P,Shan L.沉默Ghndr1和Ghmkk2损害了棉花抗性枯萎病。工厂J1111; 66:293-305。
- 58.
张政波,王fr,张海,张jh,陈y,刘gd等。AGRO接种棉籽的一种新型VIGS方法及其在盐应激反应中阐明GHBI-1的函数。植物细胞代表2018; 37:1091-100。
- 59.
农杆菌介导的病毒沉默棉花基因功能基因组分析中国生物医学工程学报,2013;https://doi.org/10.1007/978-1-62703-278-0_12.
- 60。
陈建平,李建平。乙烯在单子叶植物逆境响应中的调控作用。植物科学与技术,2015;
- 61。
关键词:程序性细胞死亡,植物,环境胁迫,适应性中国牛市生命科学。2005;3:267-70。
- 62。
关键词:芦苇,转录组,转录组分析,盐胁迫,入侵植物科学报告。2020; 10:5192 doi: 10.1038 / s41598 - 020 - 61857 - 8。
- 63。
唐ZM,范yj,张j,郑cc,陈艾,太阳yx,郭hx,吴捷,李tt,风扇yp,连x,gu hh,ma xf,chen hf,zeng fc。定量代谢物和转录组分析显示棉花抑制纤维颜色形成的复杂调节途径。基因。2020。https://doi.org/10.1016/j.gene.202020.145180.
- 64。
关键词:转基因,棉花,实时荧光定量PCR,基因拷贝数学生物化学肛门。2008;375:150-2。
- 65。
Stefan O,Grit K,Jonathan G.增加了棉花(Gossypium hirsutum)叶子的萜类覆盆子是一般的伤口反应。J Chem Ecol。2008; 34:508-22。
- 66。
Stipanovic Rd,Altman DW,开始DL。Greenblattga,本笃jh。高地棉花中的萜烯醛醛:苯胺和HPLC方法分析。JAgric Food Chem。1988年; 36:509-15。
致谢
我们感谢棉花研究所,中国农业科学院棉花生物学研究所的国家重点实验室,以提供种子g .分子,以及用于组装转换构造的基向量。
资金
该研究得到了中国国家重点R和D计划(2018年,2018年,美国专利No.2018yfd0100402)和中国国家自然科学基金(第31621005号和第31901511号)的支持。资金机构在研究和收集,分析和解释方面没有发挥作用,并在提供财政支持之外写作稿件。
作者信息
隶属关系
贡献
zx.l, H.L.C和C.F.W构思设计了该研究;C.F.W进行实验并撰写稿件;S.Y.L协助编制数字;D.Y.Z, Y.P.Z和L.M.L参与了讨论并提供了意见。Q.L.W负责测试数据的收集和分析,gl.s负责项目各个阶段的监督和稿件的修改。所有作者阅读并批准最终稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用.
同意出版
不适用.
相互竞争的利益
作者声明没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1表S1
z12和z12xw之间的下调的egs。表S2L7和L7XW之间的deg下调。表S3DEG的转录因子类别。表S4用于克隆Gherf105的引物列表。表S5实时荧光定量PCR引物用于GhERF105等基因的表达分析。T能S6VIGS实验所用引物清单。表S7亚细胞定位中使用的引物列表。表S8反应活性实验所用引物清单。
附加文件2图S1
的全长cDNA扩增Gherf105..1: DNA标记;2-3: cDNA全长Gherf105..无花果S2。的核苷酸和氨基酸序列Gherf105..符号'*'表示由TGA编码的氨基酸,保守的ERF域是黑色的。S3无花果。用PTRV :: GHERF105和空向量(PTRV :: 00)接种茎的表型.图S4双重消化XBai.和SmaipBI121-GhERF105-GFP的构建结果。1: DNA标记(DM15000), 2重组载体双酶切。3 . DNA标记(DM2000)。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
吴,C.,Cheng,H.,Li,S。等等。分子克隆和表征Gherf105.,一种调节陆地棉腺体形成的基因(gossypium hirsutuml .)。BMC植物杂志21,102(2021)。https://doi.org/10.1186/s12870-021-02846-5
收到了:
公认:
发表:
关键词
- 棉布 (gossypium hirsutum
- L.)
- Gherf105.
- 腺形成
- 转录因子