- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
异源表达GydF4y2Ba拟南芥而无GydF4y2Ba草莓中的基因(GydF4y2BaFragaria.GydF4y2Ba×GydF4y2BaananassaGydF4y2Ba提高耐旱能力GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba21GydF4y2Ba文章编号:GydF4y2Ba57GydF4y2Ba(GydF4y2Ba2021GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
草莓 (GydF4y2BaFragaria.GydF4y2Ba×GydF4y2BaananassaGydF4y2Baduch。)是全球的重要果实作物。由于其纤维和浅根系,它对干旱胁迫特别敏感。突变体GydF4y2BaRTY.GydF4y2Ba的GydF4y2Ba拟南芥GydF4y2Ba多根的(GydF4y2Ba而无GydF4y2Ba)会增加内源生长素水平,促进根和茎的生长。目前尚不清楚是否GydF4y2BaRTY.GydF4y2Ba基因改善了草莓中的应力耐受性。GydF4y2Ba
结果GydF4y2Ba
RTY.GydF4y2Ba基因被隔离GydF4y2Ba拟南芥GydF4y2Ba将花椰菜花叶病毒(CaMV) 35S启动子置于pBI121-rty二元载体的控制下,该载体携带可选择的新霉素磷酸酶II标记物(GydF4y2Ba《不扩散核武器条约》GydF4y2BaII)。通过PCR和Western印迹分析证实了七种转基因。转基因植物中IAA和ABA的累积显着增加。内源性IAA含量为46.5 ng gGydF4y2Ba−1GydF4y2Ba66.0 ng gGydF4y2Ba−1GydF4y2Ba分别在对照和转基因植物中。对照植株内源ABA含量为236.3 ng gGydF4y2Ba−1GydF4y2Ba在转基因植物中为543.8 ngGydF4y2Ba−1GydF4y2Ba.转基因植株的不定根和毛状体产量均有所提高。此外,在干旱条件下,转基因植株的IAA和ABA生物合成基因以及胁迫响应基因的转录水平均高于对照植株。转基因草莓植株的水分利用效率提高,失水率降低。转基因植株过氧化物酶和过氧化氢酶活性显著高于对照植株。实验结果揭示了一种新的功能GydF4y2BaRTY.GydF4y2Ba与ABA和干旱反应有关。GydF4y2Ba
结论GydF4y2Ba
这GydF4y2BaRTY.GydF4y2Ba基因改良转基因草莓的激素介导抗旱性。的异种表达GydF4y2BaRTY.GydF4y2Ba通过促进生长素和ABA的积累来提高草莓的抗旱性。这些植物激素共同带来了各种生理变化,通过增加根系产量、毛状体密度和气孔关闭度来提高抗旱性。本研究结果表明,在缺水条件下,转基因技术可以通过提高水分利用效率和降低失水率来克服植物生长与抗旱性之间的内在平衡。GydF4y2Ba
背景GydF4y2Ba
植物激素调节植物生长和发展的无数方面。植物素是植物生长激素,导致植物细胞壁的伸展性快速增加,血浆膜的离子通量改变离子通量,并导致基因表达的特异性变化[GydF4y2Ba1GydF4y2Ba].吲哚-3-乙酸(IAA)是一种典型的植物生长素,调节胚胎发生,热带生长,叶形成,茎伸长,果实发育和根的形成[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba].GydF4y2Ba
突变分析GydF4y2Ba拟南芥GydF4y2Ba揭示了生长素在植物生长发育中的重要作用。这GydF4y2Ba异常侧根形成1GydF4y2Ba(GydF4y2Baalf1.GydF4y2Ba),GydF4y2BaSuperroot1.GydF4y2Ba(GydF4y2Basur1GydF4y2Ba),GydF4y2Ba多根的GydF4y2Ba突变体(GydF4y2BaRTY.GydF4y2Ba)累积增加内源性菌素的水平,这导致了增加的根数[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].这些观察结果与之前的研究结果一致,即生长素促进侧根发育[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba那GydF4y2Ba11GydF4y2Ba].在GydF4y2Ba答:芥GydF4y2Ba,GydF4y2Ba多根的GydF4y2Ba(GydF4y2BaRTY.GydF4y2Ba)突变被证明是两者的等位基因GydF4y2BaSuperroot1.GydF4y2Ba(GydF4y2Basur1GydF4y2Ba)和乙烯反应突变体GydF4y2Ba钩住3.GydF4y2Ba(GydF4y2BaHLS3.GydF4y2Ba)[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba12GydF4y2Ba].GydF4y2BaRTY.GydF4y2Ba编码转氨酶或C-S裂解酶,催化IAA生物合成,可能影响生长素运输,并增加自由和共轭IAA的水平[GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].的基因表达GydF4y2BaRTY.GydF4y2Ba可以澄清其直接或间接调节蟾蜍素浓度,并阐明该基因座对植物生长和发育的影响,包括形成不定名和侧根,以及枝条的控制扩张[GydF4y2Ba8.GydF4y2Ba].GydF4y2Ba
编码的转氨酶GydF4y2BaRTY.GydF4y2Ba对脱落酸(ABA)也有响应,由于生长素和ABA生物合成和代谢途径之间的串音,脱落酸水平增加[GydF4y2Ba9.GydF4y2Ba].ABA和IAA在根中作为生长、发育和趋向性调节因子的功能相互作用[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba12GydF4y2Ba那GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba].GydF4y2Ba
ABA是一种经典的与应激相关的植物激素,可提高对非生物胁迫的耐受性[GydF4y2Ba16GydF4y2Ba].干旱胁迫是农业中最具破坏性的非生物胁迫之一。由于降雨量的变化,植物通常会经历季节性的水分胁迫[GydF4y2Ba17GydF4y2Ba].ABA是由于其对防护细胞发育,气孔孔径闭合的影响,气孔孔径闭合以及与旱润耐受相关的特定基因的表达,是植物中干旱应激反应的重要调节剂。GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba那GydF4y2Ba21GydF4y2Ba].植物对干旱的生理反应直接影响缺水条件下的生长、生产力和生存[GydF4y2Ba22GydF4y2Ba那GydF4y2Ba23GydF4y2Ba那GydF4y2Ba24GydF4y2Ba].尽管生长素和ABA在植物对干旱胁迫的响应中很重要,但很少知道如何GydF4y2BaRTY.GydF4y2Ba- 末端的氨基转移酶影响ABA积累,改善耐旱性,或者ABA积累的变异如何有助于环境适应。GydF4y2Ba
草莓 (GydF4y2BaFragaria.GydF4y2Ba×GydF4y2BaananassaGydF4y2Ba杜赫),是一种美味和受欢迎的水果作物,是世界上各种矿物质和维生素的重要来源[GydF4y2Ba25GydF4y2Ba那GydF4y2Ba26GydF4y2Ba].草莓基因组携带8组染色体(2n = 8x = 56),这些染色体来自4个二倍体祖先[GydF4y2Ba27GydF4y2Ba].由于这种混合亚种的卓越果实质量,它围绕宽度迅速分布[GydF4y2Ba28GydF4y2Ba].栽培的草莓已生长为全球最重要的水果作物植物之一,总年产量超过800万吨[GydF4y2Ba29GydF4y2Ba].由于它们的纤维和浅根系,草莓植物对干旱胁迫特别敏感。培养干旱地区的草莓挑战。GydF4y2Ba
在本研究中,我们分析了GydF4y2BaRTY.GydF4y2Ba草莓不定根发育的研究。我们的数据显示了一个新的功能GydF4y2BaRTY.GydF4y2Ba与ABA和干旱响应相关,表明该基因的作用超出了植物生长发育的调控。的异种表达GydF4y2BaRTY.GydF4y2Ba通过ABA介导的草莓气孔闭合调节增强植物耐受性。这些结果对干旱普遍地区的草莓培养具有潜在意义。GydF4y2Ba
结果GydF4y2Ba
的组成异体表达GydF4y2BaRTY.GydF4y2Ba增加ABA和IAA含量GydF4y2Ba
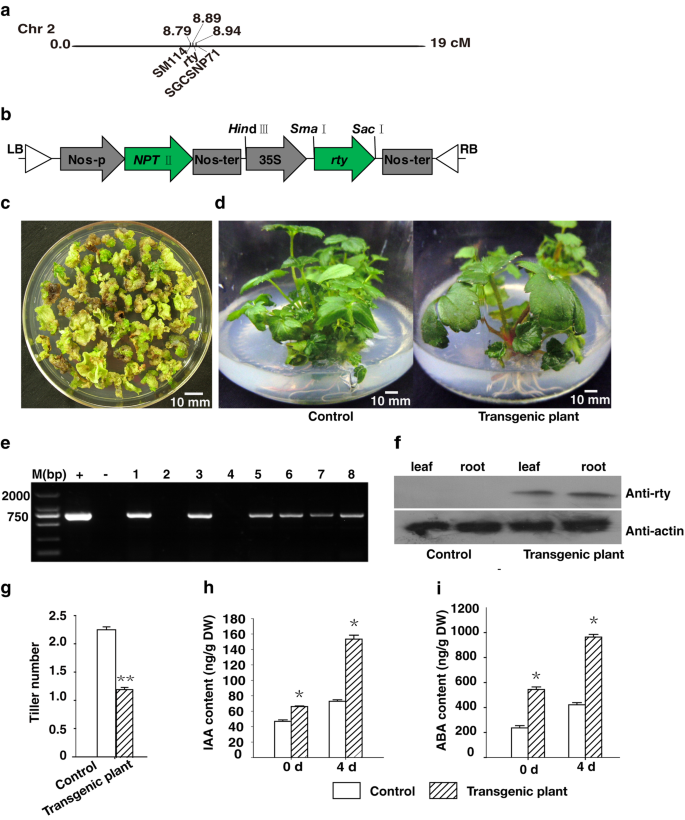
在GydF4y2Ba答:芥GydF4y2Ba那GydF4y2BaRTY.GydF4y2Ba是内源性生长素浓度的临界调节因子,对正常生长和发展产生后果[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba].这GydF4y2Ba而无GydF4y2Ba该基因位于第2染色体上标记SM114 (8.79 cM)和SGCSNP71 (8.94 cM)之间的8.89 cM(图)。GydF4y2Ba1GydF4y2Baa)确定的调控效果GydF4y2BaRTY.GydF4y2Ba草莓不定根的发育GydF4y2BaRTY.GydF4y2Ba是通过GydF4y2Ba农杆菌肿瘤术GydF4y2Ba(无花果。GydF4y2Ba1GydF4y2Bab)。通过筛选培养物来鉴定推注转化的芽(图。GydF4y2Ba1GydF4y2Bac)。通过PCR和Western印迹分析证实了七种转基因系(图。GydF4y2Ba1GydF4y2Bae, f,附加文件GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba).转基因草莓植物表现出强烈的生长,包括宽叶(图。GydF4y2Ba1GydF4y2Bad),根数增加(图。GydF4y2Ba2GydF4y2Bab, c)和叶毛(图。GydF4y2Ba5.GydF4y2Bab, d),但分蘖数减少(图2)。GydF4y2Ba1GydF4y2BaD, g)与对照植物相比。GydF4y2Ba
异源表达GydF4y2BaRTY.GydF4y2Ba在草莓中增加内源性IAA和ABA含量。GydF4y2Ba一种GydF4y2Ba拟南芥GydF4y2BaRTY.GydF4y2Ba位于染色体8.89厘米的位置2。GydF4y2BaB.GydF4y2BaPBI121的示意图GydF4y2BaRTY.GydF4y2Ba用于转换草莓的矢量结构。GydF4y2BaCGydF4y2Ba在MS + 6 - BA 3.0 mg L培养基上检测到抗性芽GydF4y2Ba−1GydF4y2Ba + 2, 4 - D 0.1 mg L−1GydF4y2Ba + kanamycin 5 mg L−1GydF4y2Ba.GydF4y2BaD.GydF4y2Ba对照与转基因植物异种表达的比较GydF4y2BaRTY.GydF4y2Ba.GydF4y2BaE.GydF4y2Ba通过PCR分析转基因植物。1-8代表各种转基因植物,而+(阳性对照)代表PBI121-GydF4y2BaRTY.GydF4y2Ba质粒和-代表未转化植物(阴性对照)。M (bp)表示DNA标记(碱基对)。全长凝胶图像显示在附加文件GydF4y2Ba2GydF4y2Ba.GydF4y2BaFGydF4y2Ba通过western blot检测抗rty和抗肌动蛋白。全长墨迹图像显示在附加文件GydF4y2Ba3.GydF4y2Ba和GydF4y2Ba4.GydF4y2Ba.GydF4y2BaGGydF4y2Ba对照和转基因植株的分蘖数。数据以平均值±SD (GydF4y2BaNGydF4y2Ba = 15) (Arunachal Pradesh,GydF4y2BaP
这GydF4y2BaRTY.GydF4y2Ba基因编码在IAA生物合成中涉及的转氨酶或C-S裂解酶[GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].GydF4y2BaRTY.GydF4y2Ba似乎对调节IAA浓度至关重要[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].因此,我们预期GydF4y2BaRTY.GydF4y2Ba导致IAA积累。因此,我们在第0天和第4天测定了对照和对照的内源IAA含量GydF4y2BaRTY.GydF4y2Ba在无外源生长调节剂的MS培养基上培养转基因植株。对照植株中IAA浓度为46.5 ng gGydF4y2Ba−1GydF4y2Ba第0天和72.7 ngGydF4y2Ba−1GydF4y2Ba在第4天,转基因植株为66.0 ng g和155.3 ng gGydF4y2Ba−1GydF4y2Ba分别。此外,在这两个分析时间点之间,转基因植株的IAA浓度显著增加,而对照植株的IAA浓度仅略有增加(图2)。GydF4y2Ba1GydF4y2Bah).因此,IAA浓度的定量显示异源表达GydF4y2BaRTY.GydF4y2Ba在第0天和第4天显著提高了转基因植株IAA的积累。GydF4y2Ba
澄清是否GydF4y2BaRTY.GydF4y2Ba由于生长素和ABA生物合成和代谢途径之间的串扰,增加了ABA水平[GydF4y2Ba9.GydF4y2Ba,我们接下来测试内源ABA浓度。对照植株ABA浓度为236.3 ng gGydF4y2Ba−1GydF4y2Ba第0天和421.7 ngGydF4y2Ba−1GydF4y2Ba在第4天,但在转基因植物中为543.8和963.4 ng gGydF4y2Ba−1GydF4y2Ba,分别。ABA水平表现出与IAA类似的趋势,内源性ABA浓度在转基因植物中显着高于对照植物(图。GydF4y2Ba1GydF4y2Bai).这些数据表明GydF4y2BaRTY.GydF4y2Ba在转基因草莓植物中刺激了大量IAA和ABA的积累。GydF4y2Ba
高内源性生长素含量导致早期根系发展GydF4y2Ba
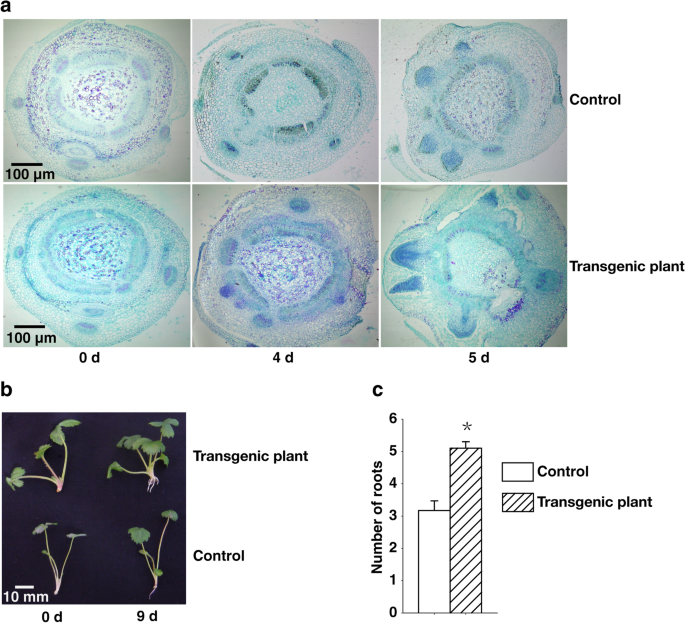
内源性IAA调节植物中的生长素依赖性发育过程,包括不定根形成[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba].为了评估转基因草莓植物中增加IAA浓度的影响,我们检查了在MS培养基上的控制和转基因植物根系的组织学,没有外源生长调节剂。根源在木质多年生植物中表现出一种共同的发育模式。包括exodermis,皮质和斯特勒的共同组织,在第一天仍未分化。在第4天没有差异。在第4天,对照和转基因植物之间的根部开发的差异是显而易见的。具体地,在该阶段的转基因植物中,木瓜杆的拱形性质丢失,萼片由外部形成围层的层,以及含有exodermis,皮质和内胚层的外部细胞层开始破裂并破裂,但这些现象仅在对照植物的第5天开始观察。GydF4y2Ba
第4天,对照植株初生木质部、初生韧皮部和内皮层开始分化,维管形成层形成,形成次生木质部和韧皮部组织。转基因植株的根在第5天仍然完好无损,而对照植株的周皮在这个时间点已经形成,外皮层、皮层和内皮层已经破裂。GydF4y2Ba2GydF4y2Baa).在第9天,大多数转基因植株有3-5根,而对照植株只有1-3根。GydF4y2Ba2GydF4y2Bab, c).这些结果表明,高IAA浓度的转基因植株诱导了早期根系发育,增加了根系数量。GydF4y2Ba
异源表达GydF4y2BaRTY.GydF4y2Ba使草莓耐旱GydF4y2Ba
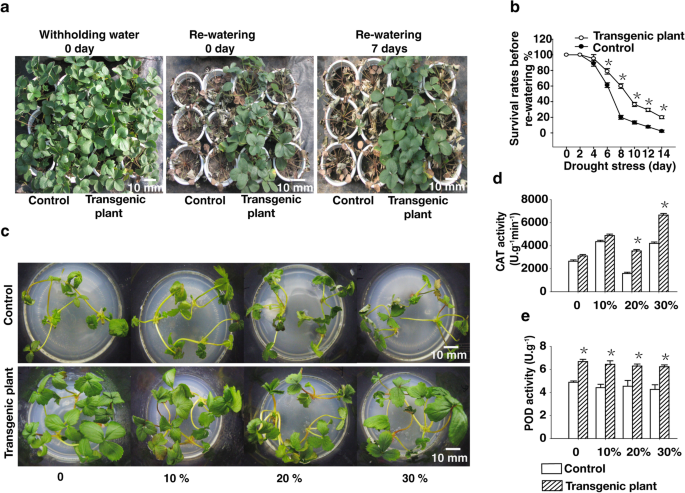
ABA在植物中的积累有望诱导许多抗旱机制[GydF4y2Ba21GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba31GydF4y2Ba].为了阐明外源ABA在转基因植株中积累的增加是如何增强抗旱性的,我们比较了干旱处理对对照植株和转基因植株的影响。具体来说,我们在花盆中种植对照和转基因植株2个月,然后通过保留水分2周诱导干旱条件。然后对植株进行复水,并对其生长进行1周的监测。14天干旱处理导致对照植株叶片卷曲、严重枯萎,大量叶片凋落。相比之下,转基因植株的叶片受干旱胁迫的影响较小,只有少数叶片卷曲、枯萎或枯萎(Fig. 2)。GydF4y2Ba3.GydF4y2Ba一种)。另外,80%的转基因植物和2%的对照植物在14天的干旱处理中存活(图。GydF4y2Ba3.GydF4y2Bab).这些结果表明,转基因植株抗旱性的增强可能是通过aba依赖途径介导的。GydF4y2Ba
异源表达GydF4y2BaRTY.GydF4y2Ba草莓的耐旱性提高。GydF4y2Ba一种GydF4y2Ba对照和转基因草莓植株分别进行0 d的干旱胁迫处理。GydF4y2BaB.GydF4y2Ba通过扣留水14天对照和转基因草莓植物进行干旱胁迫。在再次水日计算生存率。GydF4y2BaCGydF4y2Ba1月龄对照植株和转基因植株在MS + 6 - BA 0.2 mg L的传代培养基上培养GydF4y2Ba−1GydF4y2Ba+ IBA 0.1 mg LGydF4y2Ba−1GydF4y2Ba)在含0、10、20%或30% PEG 8000的培养基上浸泡48 h。GydF4y2BaD.GydF4y2Ba和GydF4y2BaE.GydF4y2Ba在PEG 8000处理条件下,对照和转基因植物的抗氧化酶活性进行分析。将数据呈现为平均值±SD(n = 3)(GydF4y2Ba*GydF4y2BaP
同时,我们在干旱胁迫下测量了土壤相对含水量。Whereas the relative soil water content was 100% in the control and transgenic plants on 0 d (i.e., the day of saturation with water), it was decreased from 19% on day 6 to 5.3% on day 14 in control, but decreased from 20% on day 6 to 6.6% on day14 in transgenic plants (Additional file5.GydF4y2Ba).这些数据表明,转基因植物通过减少蒸腾作用使土壤更湿润。GydF4y2Ba
为了进一步表征转基因植株的抗旱性,将30日龄对照植株和转基因植株在传代培养基上分别用不同浓度(0、10、20和30%)的PEG处理,模拟干旱条件。经过2 d PEG处理后,转基因植株与未转化的对照植株无明显差异。10% PEG处理2天后,对照植株叶片开始滚动萎蔫,且随着PEG浓度增加至30%,滚动萎蔫程度增加。这些症状在30%聚乙二醇治疗中最为严重。相比之下,转基因植株的叶子只有在20% PEG处理下才开始滚动和枯萎。即使在30% PEG条件下,转基因植株也比对照植株表现出更少的滚动和萎蔫(图2)。GydF4y2Ba3.GydF4y2Bac)。GydF4y2Ba
通过检测两种关键的抗氧化酶(POD和CAT)的活性来评估PEG处理的对照和转基因植物清除活性氧(ROS)的能力。转基因植株的CAT活性明显高于对照植株。此外,PEG处理显著提高了转基因植株的POD活性,最终导致转基因植株的POD活性显著高于对照植株(图2)。GydF4y2Ba3.GydF4y2Bad, e)。GydF4y2Ba
探讨基因植物的增加的耐旱性异构表达的分子机制GydF4y2BaRTY.GydF4y2Ba,通过RT-QPCR分析分析了在PEG处理期间应激响应基因的表达。具体地,我们分析了以下干旱反应基因的表达,涉及ABA生物合成,分解代谢,运输和信号:GydF4y2BaNCED3GydF4y2Ba(九碳酸环羧酸二氧化酶3)[GydF4y2Ba32GydF4y2Ba],GydF4y2BaABI1GydF4y2Ba(ABA不敏感1)[GydF4y2Ba33GydF4y2Ba],GydF4y2BaRD29AGydF4y2Ba(响应脱水29)[GydF4y2Ba34GydF4y2Ba],GydF4y2BaDREB2AGydF4y2Ba(脱水响应元素结合蛋白2a)[GydF4y2Ba35GydF4y2Ba], 和GydF4y2BaPP2C.GydF4y2Ba(2c型蛋白磷酸酶)[GydF4y2Ba36GydF4y2Ba].的表达GydF4y2BaRD29AGydF4y2Ba(压力反应的标志),以及GydF4y2BaDREB2AGydF4y2Ba(在PEG处理期间(许多水胁迫诱导基因的调节剂)在转基因植物中比在对照植物中更大程度地上调(附加文件GydF4y2Ba6.GydF4y2Ba).应激响应基因同样响应于转基因植物中的干旱胁迫而不是在对照植物中,表明应力信号在某种程度上放大GydF4y2BaRTY.GydF4y2Ba,引发更强的干旱反应(附加文件GydF4y2Ba6.GydF4y2Ba).这些结果表明GydF4y2BaRTY.GydF4y2Ba通过提高抗氧化酶活性降低了活性氧的积累。GydF4y2Ba
转基因植株的失水率低于野生型植株GydF4y2Ba
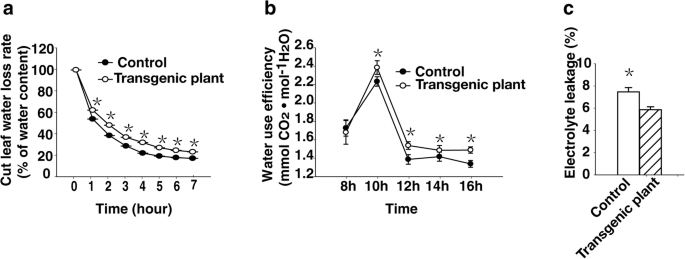
目的:探讨异源表达的影响GydF4y2BaRTY.GydF4y2Ba论草莓植物的生理状态,我们分析了转基因和对照植物的水分损失,水利用效率和电解质泄漏。从三种转基因植物中切除的同一位置处的一个月大植物的叶片水分损失率低于来自对照植物的叶片的叶片(图。GydF4y2Ba4.GydF4y2Ba一种)。在温室中盆中种植的两个月大的转基因植物的叶片的水分利用效率高于对照植物的植物(图。GydF4y2Ba4.GydF4y2Bab)。此外,转基因植株的新鲜叶片电解质泄漏量低于对照植株(图2)。GydF4y2Ba4.GydF4y2Bac),可能是由于具有较少细胞膜损伤的转基因植物。对照和转基因植物之间的防水速率,电解质泄漏和水利用效率的差异可能有助于改善转基因植物异构表达的耐药性GydF4y2BaRTY.GydF4y2Ba.GydF4y2Ba
外源表达的转基因植物GydF4y2BaRTY.GydF4y2Ba是否增加了aba诱导的气孔关闭GydF4y2Ba
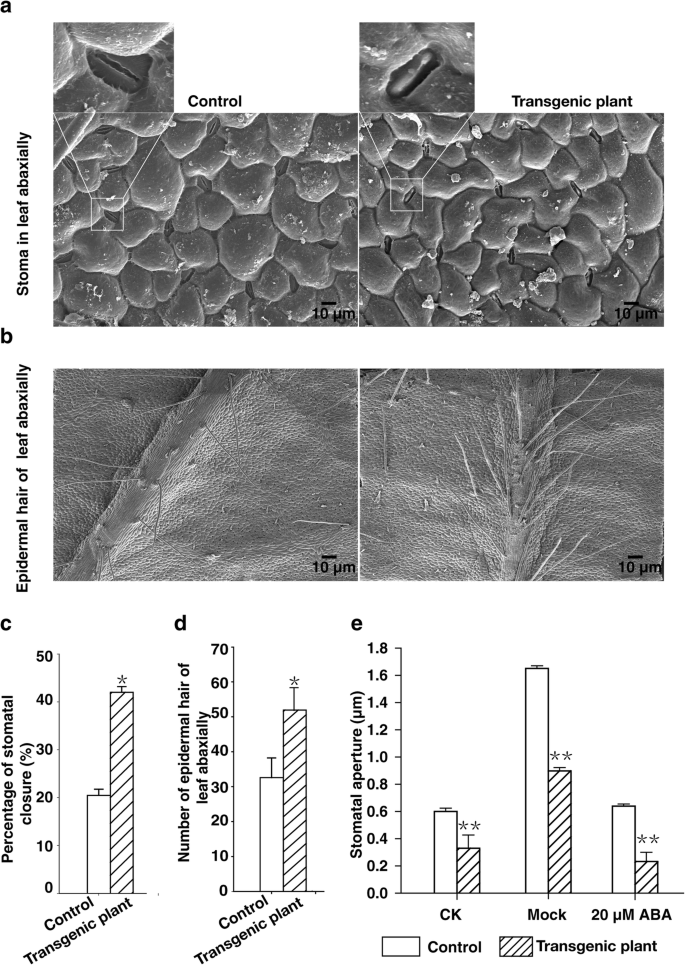
前人研究表明,ABA是气孔关闭的重要诱导剂,可以防止水分流失,从而促进耐旱性[GydF4y2Ba18GydF4y2Ba那GydF4y2Ba37GydF4y2Ba].因此,在ABA治疗后比较了转基因和对照植物的气孔孔径尺寸。扫描电子显微镜表明,在转基因植物中闭孔的百分比几乎高于对照植物(图。GydF4y2Ba5.GydF4y2Baa,c)。对照和转基因植物之间的平均口腔数没有显着差异。因此,与对照植物相比,观察到的水损失和转基因植物的水利用效率增加可能不是由于气孔数量的差异而是对气孔闭合的可变性(图。GydF4y2Ba5.GydF4y2Bac)。GydF4y2Ba
异源表达GydF4y2BaRTY.GydF4y2Ba促进aba诱导的气孔关闭,刺激叶背面毛状体的产生。GydF4y2Ba一种GydF4y2Ba基于扫描电子显微镜分析,中午对照和转基因植物的气孔闭合。图像是盒装区域的放大(GydF4y2Ba一种GydF4y2Ba).GydF4y2BaB.GydF4y2Ba对照草莓植株与转基因草莓植株叶片背面的毛状体。GydF4y2BaCGydF4y2Ba和GydF4y2BaD.GydF4y2Ba基于扫描电子显微镜分析,对来自对照和转基因植物的叶子的叶子的叶片叶片上的表皮毛细胞的百分比和总数。数据呈现为平均值±SD(n = 15)(GydF4y2Ba*GydF4y2BaP
为了评估在转基因植物中是否不同地诱导气孔闭合,我们比较了外源性ABA加入与模拟的影响。转基因植物气孔孔的平均宽度明显小于未处理(CK),模拟处理或20μMABA处理植物的对照植物的平均宽度。然而,对于经受20μmaba处理的植物更严重降低气孔孔的宽度(图。GydF4y2Ba5.GydF4y2Bae,额外的文件GydF4y2Ba7.GydF4y2Ba).因此,转基因植物异常表达GydF4y2BaRTY.GydF4y2Ba表现为aba诱导的气孔关闭增加。GydF4y2Ba
毛状物影响叶片表面的光学性质,并可通过降低蒸腾速率来保护植物免受应力损坏和降低水分损失[GydF4y2Ba38GydF4y2Ba那GydF4y2Ba39GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].在本研究中,我们发现转基因植株叶片背面表皮毛状体的密度和数量都高于对照植株。转基因和对照叶片单位面积背面平均分别为50和30个表皮毛。GydF4y2Ba5.GydF4y2Bab, d).转基因叶片上表皮毛状体的丰富程度可能有助于通过减少水分流失和降低蒸腾速率来提高抗旱性。这些结果表明,耐旱性的增加是由于表皮毛状体数量的增加和内源ABA浓度的增加,导致气孔变小。GydF4y2Ba
在转基因植物中,生长素生物合成和信号转导基因表达上调GydF4y2Ba
为了确定对照和转基因植物之间表型差异的分子机制,我们在干旱治疗过程中比较了对照和转基因植物的IAA含量。对照植物中IAA的浓度为31.8 ng gGydF4y2Ba−1GydF4y2Ba第0天,36.5 ngGydF4y2Ba−1GydF4y2Ba第4天,36.7 ngGydF4y2Ba−1GydF4y2Ba在第8天,转基因植株为43.0、46.2和40.1 ng gGydF4y2Ba−1GydF4y2Ba,分别。在干旱处理下,转基因植株的IAA含量始终高于对照植株(图2)。GydF4y2Ba6.GydF4y2Ba).然而,这些结果表明,在干旱处理期间,转基因植株和对照植株的IAA含量没有增加。GydF4y2Ba
为了阐明转基因和对照植物IAA含量差异的机制,我们检测了IAA生物合成和信号基因的表达水平,包括GydF4y2BaPIN1GydF4y2Ba那GydF4y2BaAAO1GydF4y2Ba那GydF4y2BaARF7GydF4y2Ba那GydF4y2BaMIX2GydF4y2Ba那GydF4y2BaYUC1GydF4y2Ba那GydF4y2BaYUC3GydF4y2Ba,GydF4y2BaGa3ox.GydF4y2Ba.RT-qPCR分析表明,干旱处理上调了IAA生物合成和信号转导基因在转基因植株中的表达。GydF4y2Ba
这些结果表明异源表达GydF4y2BaRTY.GydF4y2Ba在转基因植物中诱导IAA生物合成和信号基因的表达,进而增加IAA的积累。此外,干旱处理下ABA水平升高(图。GydF4y2Ba6.GydF4y2Ba)可能影响观察到的额外根的产生(图。GydF4y2Ba2GydF4y2Bab, c)和毛状体(图。GydF4y2Ba5.GydF4y2BaB, d)在转基因植物中。GydF4y2Ba
逆境诱导基因和ABA生物合成基因在转基因植物中表达上调GydF4y2Ba
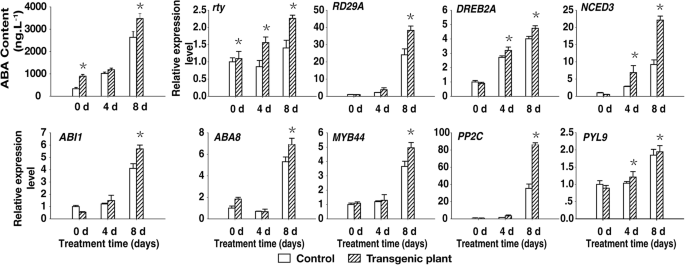
在干旱条件下,ABA浓度在中午时增加到一个特定的阈值,诱导离子外流,抑制保卫细胞对糖的吸收,此后,气孔的孔径在一天的其余时间内减小[GydF4y2Ba41GydF4y2Ba].为了阐明ABA在胁迫反应中的作用,我们比较了2月龄对照和转基因植株在干旱处理后的ABA含量。对照ABA浓度为334.0 ng gGydF4y2Ba−1GydF4y2Ba在第0天,1017.2 ng gGydF4y2Ba−1GydF4y2Ba第4天,2635.3纳克GydF4y2Ba−1GydF4y2Ba在第8天,转基因植株为939.3、1083.7和3471.3 ng gGydF4y2Ba−1GydF4y2Ba,分别。在对照和转基因植物中发起干旱处理后8天的ABA浓度明显高,但转基因植物中的较高1.3倍(图。GydF4y2Ba7.GydF4y2Ba).GydF4y2Ba
为了确定对照和转基因植株ABA含量差异的分子机制,我们检测了ABA生物合成、分解代谢、转运和信号转导相关基因的表达,以及干旱响应基因,包括:GydF4y2BaNCED3GydF4y2Ba[GydF4y2Ba32GydF4y2Ba],GydF4y2BaABI1GydF4y2Ba[GydF4y2Ba33GydF4y2Ba],GydF4y2BaRD29AGydF4y2Ba[GydF4y2Ba34GydF4y2Ba],GydF4y2BaDREB2AGydF4y2Ba[GydF4y2Ba35GydF4y2Ba], 和GydF4y2BaPP2C.GydF4y2Ba[GydF4y2Ba36GydF4y2Ba].水缺陷应力通过上调表达促进ABA生物合成GydF4y2BaNCED3GydF4y2Ba[GydF4y2Ba42GydF4y2Ba].RT-qPCR分析表明GydF4y2BaNCED3GydF4y2Ba在开始干旱治疗后8天,转录物水平显着高,随着转基因植物的增加,在转基因植物中更明显,暗示该基因被积极表达。另外,ABA诱导标记基因的表达水平(GydF4y2BaRD29AGydF4y2Ba和GydF4y2BaDREB2AGydF4y2Ba)、ABA生物合成基因(GydF4y2BaABI1GydF4y2Ba那GydF4y2BaABA8GydF4y2Ba,GydF4y2BaPYL9GydF4y2Ba),一个气孔关闭响应基因(GydF4y2BaPP2C.GydF4y2Ba),GydF4y2BaMYB44GydF4y2Ba在干旱处理期间,转基因植株比对照植株中含量更高(图。GydF4y2Ba7.GydF4y2Ba).高的GydF4y2BaPP2C.GydF4y2Ba和GydF4y2BaMYB44GydF4y2Ba转录本水平可能导致气孔关闭[GydF4y2Ba36GydF4y2Ba].GydF4y2Ba
因此,异源表达GydF4y2BaRTY.GydF4y2Ba显著增加了ABA的积累。胁迫诱导基因和ABA生物合成基因的表达可能通过ABA依赖途径触发气孔关闭,这可能有助于转基因植物抗旱性的观察。GydF4y2Ba
讨论GydF4y2Ba
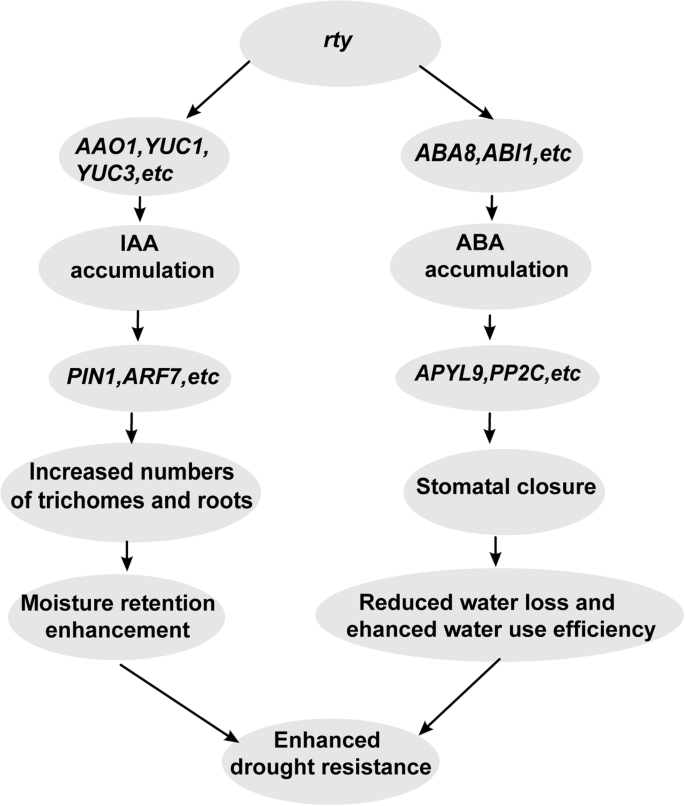
这GydF4y2BaRTY.GydF4y2Ba基因改善了植物中的激素介导的干旱耐受性(图。GydF4y2Ba8.GydF4y2Ba).在植物中,GydF4y2BaRTY.GydF4y2Ba促进IAA和ABA积累[GydF4y2Ba12GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba].IAA生物合成基因的转录水平包括GydF4y2BaAAO1GydF4y2Ba那GydF4y2BaYUC1GydF4y2Ba,GydF4y2BaYUC3GydF4y2Ba,增加养阴累积[GydF4y2Ba43GydF4y2Ba].蟾蜍蛋白诱导相关响应基因的转录物,包括GydF4y2BaPIN1GydF4y2Ba和GydF4y2BaARF7GydF4y2Ba,以及过量根的产物,并增加叶毛的密度,以保持水分[GydF4y2Ba44GydF4y2Ba那GydF4y2Ba45GydF4y2Ba].ABA生物合成基因的转录水平包括GydF4y2BaABI1GydF4y2Ba和GydF4y2BaABA8GydF4y2Ba,提高ABA积累[GydF4y2Ba33GydF4y2Ba那GydF4y2Ba46GydF4y2Ba].ABA诱导相关响应基因的转录物,包括GydF4y2BaPYL9GydF4y2Ba和GydF4y2BaPP2C.GydF4y2Ba,并促进植物中的气孔闭合,这增加了水使用效率并降低了水损失[GydF4y2Ba47GydF4y2Ba那GydF4y2Ba48GydF4y2Ba].植物的光合作用、呼吸作用和蒸腾作用都受到光合作用的影响GydF4y2BaRTY.GydF4y2Ba基因。这些变化增加了植物对干旱胁迫的耐受性[GydF4y2Ba49GydF4y2Ba那GydF4y2Ba50GydF4y2Ba那GydF4y2Ba51GydF4y2Ba那GydF4y2Ba52GydF4y2Ba那GydF4y2Ba53GydF4y2Ba].在本研究中,我们证明了rty在草莓中的异源表达通过促进生长素和ABA积累来改善抗旱性。这些植物激素共同带来了各种生理变化,如增加根系产量、毛状体密度和气孔关闭度,从而提高了抗旱性。GydF4y2Ba
的分子机制GydF4y2BaRTY.GydF4y2Ba激素介导植物抗旱性的基因改良。在植物中,GydF4y2BaRTY.GydF4y2Ba促进IAA和ABA的积累。IAA生物合成基因的转录水平包括GydF4y2BaAAO1GydF4y2Ba那GydF4y2BaYUC1GydF4y2Ba,GydF4y2BaYUC3GydF4y2Ba,增加养阴累积。蟾蜍蛋白诱导相关响应基因的转录物,包括GydF4y2BaPIN1GydF4y2Ba和GydF4y2BaARF7GydF4y2Ba以及过量根的产物增加,增加了叶子毛状体的密度,使水分保持保留。ABA生物合成基因的转录水平包括GydF4y2BaABI1GydF4y2Ba和GydF4y2BaABA8GydF4y2Ba,提高ABA积累。ABA诱导相关响应基因的转录物,包括GydF4y2BaPYL9GydF4y2Ba和GydF4y2BaPP2C.GydF4y2Ba,促进植物气孔关闭,提高水分利用效率,降低水分损失率。植物的光合作用、呼吸作用和蒸腾作用都受到光合作用的影响GydF4y2BaRTY.GydF4y2Ba基因。这些变化增加了植物对干旱胁迫的耐受性GydF4y2Ba
异源表达GydF4y2BaRTY.GydF4y2Ba增加转基因草莓植株的抗旱性GydF4y2Ba
转基因草莓植物外源表达GydF4y2BaRTY.GydF4y2Ba表现出较强的生长潜力(图。GydF4y2Ba1GydF4y2Bad),产生更多的根(图。GydF4y2Ba2GydF4y2Bab, c)和叶毛(图。GydF4y2Ba5.GydF4y2Bab, d),但分蘖较少(Fig.;GydF4y2Ba1GydF4y2BaG),比对照植物。IAA浓度的测定表明,异源表达GydF4y2BaRTY.GydF4y2Ba显著提高了转基因草莓植株的IAA水平。GydF4y2Ba1GydF4y2Bah).转基因草莓植株IAA含量高,根系发育早,根系数量增加。这些显性效应与一般功能相一致GydF4y2BaRTY.GydF4y2Ba在GydF4y2Ba答:芥GydF4y2Ba.而且,GydF4y2BaRTY.GydF4y2BaIAA的表达对IAA在GydF4y2Ba答:芥GydF4y2Ba.隐性GydF4y2BaRTY.GydF4y2Ba突变也产生高内源IAA浓度。最极端的表型效应GydF4y2BaRTY.GydF4y2Ba表达是不定根,横向根系的扩散,以及拍摄发育的限制。这些表型很可能是由悬停浓度的增加引起的[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba那GydF4y2Ba12GydF4y2Ba].因此,GydF4y2BaRTY.GydF4y2Ba在调节内源性生长素浓度方面发挥关键作用,以促进正常生长和发育。GydF4y2Ba
在目前的研究中,我们揭示了一个迄今未知的功能GydF4y2BaRTY.GydF4y2Ba与干旱耐受相关,揭示该突变基因的异源表达增加了响应干旱胁迫的ABA浓度。因此,GydF4y2BaRTY.GydF4y2Ba有助于调节植物生长和发展以及对非生物胁迫条件的反应。具体而言,异源表达GydF4y2BaRTY.GydF4y2Ba显著提高了转基因植株ABA含量(图。GydF4y2Ba1GydF4y2Bai)。与未转化的对照相比,转基因植株的失水率更低,电解质渗漏更少,水分利用效率更高(图2)。GydF4y2Ba4.GydF4y2Ba).在干旱处理下,转基因植株中ABA的积累表明,转基因植株抗旱性的提高是通过ABA依赖途径介导的。GydF4y2Ba
以往的研究表明,ABA对气孔关闭具有重要作用,气孔关闭可以限制水分流失,增强抗旱性[GydF4y2Ba18GydF4y2Ba那GydF4y2Ba54GydF4y2Ba].因为ABA有助于调节气孔关闭[GydF4y2Ba55GydF4y2Ba],我们推测这一点GydF4y2BaRTY.GydF4y2Ba表达在暴露于干旱胁迫下的植物中保持较窄的气孔孔,这降低了通过蒸腾的水分损失。我们确定了异源表达GydF4y2BaRTY.GydF4y2Ba在草莓中可能会增加转基因植物对ABA的敏感性,并提高其对干旱胁迫的耐受性。GydF4y2Ba
RTY.GydF4y2Baaba的表达通过调节气孔关闭促进干旱胁迫反应GydF4y2Ba
植物的干旱反应是一个由多种分子和细胞途径调控的复杂过程。一些基因的表达水平因暴露于非生物胁迫而上调或下调,这些基因的异种表达可以提高转基因植物对干旱或盐胁迫的耐受性[GydF4y2Ba56GydF4y2Ba那GydF4y2Ba57GydF4y2Ba那GydF4y2Ba58GydF4y2Ba那GydF4y2Ba59GydF4y2Ba].符合这一点,我们的结果表明,母性表达的表达GydF4y2BaRTY.GydF4y2Ba对草莓干旱的反应有关键影响。具体而言,异源表达GydF4y2BaRTY.GydF4y2Ba提高转基因草莓植株对干旱胁迫的耐受性。此外,与对照相比,转基因植株产生了更多的叶毛状体,气孔关闭率更高,气孔孔径更小(图2)。GydF4y2Ba5.GydF4y2Ba额外的文件GydF4y2Ba7.GydF4y2Ba).当植物进行干旱胁迫时,可能会迅速激活一些生理因素(例如,电解质泄漏和豆荚和猫活动),以使这些植物能够在极端的环境条件下存活[GydF4y2Ba60GydF4y2Ba那GydF4y2Ba61GydF4y2Ba那GydF4y2Ba62GydF4y2Ba那GydF4y2Ba63GydF4y2Ba].因此,与干旱引起的植物渗透应激相关的生理指标可能是快速准确地评估对非生物胁迫的植物抗性的有用措施。电解质泄漏,反映细胞膜损伤的程度[GydF4y2Ba60GydF4y2Ba[对照植物的叶子中比转基因植物的叶子更高(图。GydF4y2Ba4.GydF4y2Ba).结果表明,异源表达GydF4y2BaRTY.GydF4y2Ba可能增强植物细胞膜的完整性以应对干旱胁迫。此外,POD和CAT是保护植物免受非生物胁迫损伤的重要抗氧化酶[GydF4y2Ba64GydF4y2Ba那GydF4y2Ba65GydF4y2Ba].在本研究中,我们确定了CAT和POD在转基因植株中比在对照植株中更活跃(图2)。GydF4y2Ba3.GydF4y2Bad, e).这一信息可能有助于阐明转基因植物抗旱性增强的机制。GydF4y2Ba
在GydF4y2Ba答:芥GydF4y2Ba,许多阳性和负调节剂已被鉴定并表征为ABA生物合成和干旱信号的关键组分[GydF4y2Ba18GydF4y2Ba那GydF4y2Ba66GydF4y2Ba].生物胁迫上调几种ABA生物合成基因的表达[GydF4y2Ba67GydF4y2Ba那GydF4y2Ba68GydF4y2Ba那GydF4y2Ba69GydF4y2Ba那GydF4y2Ba70GydF4y2Ba那GydF4y2Ba71GydF4y2Ba那GydF4y2Ba72GydF4y2Ba].水胁迫引起的ABA积累前面是显着增加GydF4y2Baphoudolusulus vulgaris ced1GydF4y2Ba叶片和根部的转录本和蛋白质水平[GydF4y2Ba42GydF4y2Ba那GydF4y2Ba73GydF4y2Ba那GydF4y2Ba74GydF4y2Ba].在GydF4y2Ba答:芥GydF4y2Ba,五个GydF4y2Ba数控GydF4y2Ba参与ABA生物合成的基因,仅表达GydF4y2BaAtNCED3GydF4y2Ba是由脱水强烈诱导的,尽管在其他GydF4y2Ba数控GydF4y2Ba基因也有报道[GydF4y2Ba42GydF4y2Ba那GydF4y2Ba74GydF4y2Ba那GydF4y2Ba75GydF4y2Ba].此外,GydF4y2BaAtNCED3GydF4y2Ba超表达的转基因GydF4y2Ba答:芥GydF4y2Ba植株的ABA含量和抗旱性增加[GydF4y2Ba42GydF4y2Ba].同样,在目前的研究中,一些ABA生物合成和非生物胁迫应答基因,包括GydF4y2BaRD29AGydF4y2Ba那GydF4y2BaDREB2AGydF4y2Ba那GydF4y2BaNCED3GydF4y2Ba那GydF4y2BaABI1GydF4y2Ba那GydF4y2BaABA8GydF4y2Ba那GydF4y2BaPYL9GydF4y2Ba,GydF4y2BaPP2C.GydF4y2Ba[GydF4y2Ba67GydF4y2Ba那GydF4y2Ba68GydF4y2Ba那GydF4y2Ba69GydF4y2Ba那GydF4y2Ba70GydF4y2Ba那GydF4y2Ba71GydF4y2Ba那GydF4y2Ba76GydF4y2Ba那GydF4y2Ba77GydF4y2Ba那GydF4y2Ba78GydF4y2Ba,在干旱条件下,转基因植株比对照植株高表达。GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba).这些结果表明,转基因植物对干旱胁迫的耐受性可能受到这些基因在干旱条件下表达上调的影响。进一步的研究将集中在如何进行GydF4y2BaRTY.GydF4y2Ba在植物对干旱胁迫的响应中,ABA与这些生物合成途径相互作用,并与胁迫诱导的信号转导相互作用。本研究结果可为今后抗旱性研究提供基础,并可用于培育抗旱性较强的转基因草莓品种。GydF4y2Ba
结论GydF4y2Ba
在这项研究中,GydF4y2BaRTY.GydF4y2Ba基因被隔离GydF4y2Ba拟南芥GydF4y2Ba将花椰菜花叶病毒(CaMV) 35S启动子置于pBI121-rty二元载体的控制下,该载体携带可选择的新霉素磷酸酶II标记物(GydF4y2Ba《不扩散核武器条约》GydF4y2BaII)通过PCR和western blot分析证实转基因草莓植株。转基因草莓诱导IAA积累,增加了不定根和叶背面毛状体的产生。外源ABA的积累也促进了转基因草莓植株气孔关闭。这提高了水分利用效率,降低了失水率,提高了抗旱能力。揭示了一种新的功能GydF4y2BaRTY.GydF4y2Ba与ABA和干旱反应有关。转基因方法可用于通过提高水利用效率并降低水资源短缺条件下的水分损失,克服植物生长和耐旱性之间的固有权衡。本研究为未来的草莓遗传修饰提供了基础,以改善耐旱性。GydF4y2Ba
方法GydF4y2Ba
异源表达载体的构建GydF4y2BaRTY.GydF4y2Ba
先前的研究[GydF4y2Ba8.GydF4y2Ba]和BLAST分析(GenBank accession: AY050987)表明GydF4y2BaRTY.GydF4y2Ba编码氨基转移酶或C-S裂解酶,其催化IAA生物合成。在功能性上表征GydF4y2BaRTY.GydF4y2Ba草莓(GydF4y2BaFragaria.GydF4y2Ba×GydF4y2BaananassaGydF4y2Ba),我们通过pcr克隆建立了一个过表达结构。cDNA片段GydF4y2Ba答:芥GydF4y2Ba突变体(原拟南芥生物资源中心砧木编号CS8156),包含整个GydF4y2BaRTY.GydF4y2Ba如前所述,编码区被放大[GydF4y2Ba69GydF4y2Ba].将PCR产物与pBI121载体进行酶切GydF4y2BaSmaGydF4y2Ba我和GydF4y2Ba囊GydF4y2Ba然后用T4 DNA连接酶(Promega Corporation,Madison,USA)将消化的PCR和载体产物连接到消化的PCR和载体产物。GydF4y2BaRTY.GydF4y2Ba基因被隔离GydF4y2Ba拟南芥GydF4y2Ba并置于Cauliflower Mosaic病毒(CAMV)35s启动子的控制中,在PBI121-RTY二元载体中携带NeoMycinPhosphot转移酶II的选择标记。GydF4y2Ba
异源表达GydF4y2BaRTY.GydF4y2Ba在草莓植物中GydF4y2Ba
草莓品种“蜜莲”(GydF4y2BaFragaria×ananassa.GydF4y2BaDuch。)被用作实验材料。纽约州农业实验站的康奈尔大学在康奈尔大学开发了草莓品种,1979年发布。1983年,“Honeoye”被引入中国作为商业品种.PBI121-GydF4y2BaRTY.GydF4y2Ba二元载体转化为GydF4y2Ba农杆菌肿瘤术GydF4y2BaGV3101使用冻融程序[GydF4y2Ba79GydF4y2Ba].GydF4y2Ba农杆菌介导GydF4y2Ba根据金和王的协议进行“Honeoye”草莓的转型[GydF4y2Ba80GydF4y2Ba].采用叶盘法改造草莓。不育苗继代25 ~ 30天叶片切成3 ~ 5mmGydF4y2Ba2GydF4y2Ba叶子光盘。GydF4y2Ba农杆菌肿瘤术GydF4y2Ba携带目的基因的LBA4404在含100mg L的LB液体培养基中培养GydF4y2Ba−1GydF4y2BaKanamycin在28℃下16小时。将叶片置于这种培养物中5分钟,转移到再生MS培养基(Murashige和Skoog,1962)中含有6-Ba 3.0 mg L.GydF4y2Ba−1GydF4y2Ba2,4 - D 0.1 mg LGydF4y2Ba−1GydF4y2Ba,在黑暗中培养1 d;然后转移到含有400mg L的再生培养基GydF4y2Ba−1GydF4y2Ba头孢菌素5毫克LGydF4y2Ba−1GydF4y2BaKanamycin,在25±1°C,光循环为16小时,光强度为30μmolmGydF4y2Ba−1GydF4y2Ba s−1GydF4y2Ba.继代培养基(MS + 6-BA 0.2 mg L .GydF4y2Ba−1GydF4y2Ba+ IBA 0.1 mg LGydF4y2Ba−1GydF4y2Ba),形成3〜5cm的枝条,并且这些芽为根培养基(1/2 ms + Iba 0.2 mg lGydF4y2Ba−1GydF4y2Ba).卡那霉素抗性植物通过pcr检测进一步证实GydF4y2BaNPTIIGydF4y2Ba和GydF4y2BaRTY.GydF4y2Bagenespecific引物(表GydF4y2Ba1GydF4y2Ba).Western blot分析用于验证目标蛋白是否在转基因植物中产生,然后用于后续分析[GydF4y2Ba86GydF4y2Ba].未转化的草莓被用作对干旱胁迫分析的控制。GydF4y2Ba
培养培养基MS + 6-Ba 0.2 mg L培养的对照和转基因植物的根和叶组织。GydF4y2Ba−1GydF4y2Ba+ IBA 0.1 mg LGydF4y2Ba−1GydF4y2Ba放在液氮里,然后在研钵里磨碎。液氮蒸发后立即取2 mL萃取缓冲液,其中含50 mmol LGydF4y2Ba−1GydF4y2Ba三,50 mmol lGydF4y2Ba−1GydF4y2BaEDTA,100毫升L.GydF4y2Ba−1GydF4y2BaKCL, 2 mmol LGydF4y2Ba−1GydF4y2Ba二硫苏糖醇(DTT), 2 mmol LGydF4y2Ba−1GydF4y2Ba加入PMSF和10% (w/v)甘油(pH 7.5)。0°C提取2 h, 4°C 12,000×g离心15 min。用Bradford法测定上清液中的蛋白浓度。所有样品保存在−70°C。SDS-PAGE分离后,蛋白被电印迹到PVDF膜上。用抗rty血清(北京蛋白创新有限公司,中国)对电印迹膜进行western blot分析。为提高血清特异性,对atty蛋白二级结构、三级结构、疏水性、抗原性和特异性进行分析。重组表达的rty蛋白(1 - 131aa)作为免疫原产生抗体(附加文件)GydF4y2Ba1GydF4y2Ba).用碱性磷酸酶标记蛋白和山羊抗兔抗体(金桥,北京,中国)处理膜,然后用BeyoECL Plus试剂盒(Beyotime Biotechnology Co., Ltd, Shanghai, China)染色。GydF4y2Ba
吲哚-3-乙酸(IAA)和脱落酸的定量分析(ABA)GydF4y2Ba
3个独立的转基因品系3、6和8进行了所有生理和分子检测(图3)。GydF4y2Ba1GydF4y2Bae).本研究中转基因植株的数据是这三个独立株系的平均值。采用高效液相色谱-质谱法测定对照和转基因植株组织中吲哚-3-乙酸(IAA)和脱落酸(ABA)的含量,方法参照Pan等[GydF4y2Ba87GydF4y2Ba].1月龄对照和转基因植株接种在无外源生长调节剂的传代培养基上4天。继代培养基接种后第1天定为0天。在第0天和第4天取样对照和转基因植株的基本茎段(~ 0.4 cm)。大约50mg新鲜样品被冷冻在液氮中,磨成粉末,转移到2ml螺旋盖管中。在粉末状组织中加入500 μl提取溶剂(2-丙醇:HGydF4y2Ba2GydF4y2BaO:浓缩HCl, 2:1:0.002, v/v/v),在加入稳定同位素(用于同位素稀释定量)后,在4°C下,以100 rpm的速度,持续30分钟,放在振铃器上的每个试管中。加入1ml二氯甲烷重新提取样品,在4℃下以100 rpm转速旋转30分钟。然后样品在4°C下在13,000×g Avanti J-26XP离心机中离心5分钟(Beckman Coulter, USA)。在离心过程中形成了两个阶段,两层之间有一层植物碎片。用巴斯德移液管将约900 μL的液相转移到螺旋盖瓶中,并用氮气蒸发器进行浓缩。固体在0.1 mL甲醇中重新溶解,在13,000×g 4°C下离心5分钟。取50 μl的上清液注入安捷伦1260 Infinity系列高效液相色谱系统(安捷伦科技,圣克拉拉,CA)进行色谱分离,然后使用AB SCIEX QTRAP 5500 LC/MS/MS系统(AB SCIEX Deutschland GmbH, Darmstadt, Germany)进行串联质谱(MS/MS)检测。GydF4y2Ba
组织学观察GydF4y2Ba
进行了根本发展的组织学观察。在甲酚培养基上培养一个月的控制和转基因植物(MS + 6-Ba 0.2 mg L.GydF4y2Ba−1GydF4y2Ba+ IBA 0.1 mg LGydF4y2Ba−1GydF4y2Ba) 0-9天。对照和转基因植株基本茎段每天取样约0.2 cm。样品在甲醛-乙酸固定液(50%乙醇-福尔马林-乙酸=18:1:1)中固定48 h。下一种方法如前所述[GydF4y2Ba88GydF4y2Ba].GydF4y2Ba
干旱待遇GydF4y2Ba
对转基因植株和对照植株进行耐旱试验。盆栽(16 × 16 cm),同等养分土壤(泥炭土:田间土壤:蛭石1:1:1)。在0.8 L水饱和后,将30日龄对照和转基因植株在根培养基上种植(每盆一株)。2个月后,在0.8 L的水分饱和状态下进行14天的干旱胁迫。每个处理分别分析了78盆对照和转基因植株。在温室中,盆栽的位置经常被改变,以减少环境变化的影响。在干旱胁迫下,每2 d取样一次叶片。取样了三个罐子。干旱处理采用L99-TWS-1(上海丹丁国际贸易有限公司)土壤温湿仪,每2 d测定一次相对含水量。干旱处理前,蛭石与土壤的混合用0.8 L水饱和。干旱前土壤含水量设为100%,干旱14 d后土壤相对含水量设为GydF4y2Ba〜GydF4y2Ba6%。另外,在14天的干旱治疗后重新浇水,并在7天后计算存活率。GydF4y2Ba
PEG 8000模拟干旱胁迫GydF4y2Ba
制备聚乙二醇(PEG) - 戊二氢培养基如Verslues等[GydF4y2Ba89GydF4y2Ba].因为在浇注培养基之前不能溶解PEG在琼脂中溶解,所以通过在固化琼脂的顶部倒入含有PEG的液体介质来制备PEG注入培养基。等分试样的5 mmol lGydF4y2Ba−1GydF4y2Ba添加MES以稳定培养基pH(至pH 5.7),避免添加PEG后不得不调整pH。1 / 2 MS,含15 g LGydF4y2Ba−1GydF4y2Ba琼脂和5 mmol LGydF4y2Ba−1GydF4y2Ba为琼脂培养基制备MES。当琼脂培养基还是热的时候,将等量的琼脂培养基分成玻璃烧瓶,蒸压,然后冷冻。适当体积的½MS液体培养基,含5 mmol LGydF4y2Ba−1GydF4y2Ba然后制备MES (pH为5.7)。固体PEG 8000 (Sigma目录编号P-2139)在高压灭菌后以10、20、30% (w/v)称出液体介质,而它仍然是热的。用0.45 μm过滤器对注入聚乙二醇的液体介质进行过滤。将体积为0.04 L的聚乙二醇液体培养基移液到装有凝固琼脂的玻璃烧瓶上。将体积为0.06 L的液体培养基移液到装有凝固琼脂的玻璃烧瓶上,作为0处理。将琼脂按2:3的比例加入PEG液体培养基中。玻璃烧瓶在室温下平衡24小时。使用前,将PEG液体培养基倒出,注意不要将琼脂移出,否则琼脂可能不再紧密粘附在玻璃烧瓶底部。30日龄对照和外源表达的转基因植株GydF4y2BaRTY.GydF4y2Ba在亚培养基中,将介质转移到含有0%(CK),10,20和30%PEG注入的培养基的玻璃烧瓶,在21℃下,在温度控制的生长室,具有16-H光/ 8-H深色周周期。预计,观察,拍摄,取样并进行RT-QPCR和抗氧化酶活性分析。GydF4y2Ba
气体交换和水分损失的测量GydF4y2Ba
如Zhao等人所述测量光合参数。[GydF4y2Ba31GydF4y2Ba].对3株独立的对照和转基因植株进行分析,并进行重复实验。气体交换测量采用LI-6400 (LI-6400, Li-Cor, USA)。随机选取3株生长状态良好、位置适宜的转基因植株和野生型植株,每3片成熟、完全展开的叶片。这些测量是在2017年4月24日至25日的晴天,从8:00到16:00每小时进行一次。计算水分利用效率(WUE):净光合速率除以蒸腾速率[GydF4y2Ba90GydF4y2Ba].为了评估水分损失,用电子秤称重来自相同位置的一个月大的植物,然后将玻璃培养皿放在一层滤纸上并每小时称重。GydF4y2Ba
抗氧化酶活性测定GydF4y2Ba
为了测量抗氧化酶活性,将来自对照和转基因植物的新鲜叶子(0.2g)切成小块并用砂浆和杵在冰上研磨,在包含1ml 0.05M磷酸盐缓冲液(pH7.8),3g聚乙烯吡咯烷酮和0.1g石英砂。用2mL磷酸盐缓冲液(pH7.8)洗涤砂浆两次。将所得溶液倒入10ml离心管中,含有磷酸盐缓冲液(pH7.8)的最终体积为7ml。将管在4℃下以2500×g离心20分钟。收集上清液,用磷酸盐缓冲液(pH7.8)最多10毫升,用作随后分析抗氧化酶活性的酶解决方案。具体地,在240nm处测定过氧化氢酶(猫)活性。再次在后1分钟再次测定样品。在470nm处测定0.5ml等分试样的酶溶液中的过氧化物酶(POD)活性。再次在后1分钟再次测定样品。 The CAT and POD activities were calculated as described by Zhao et al [31GydF4y2Ba].GydF4y2Ba
植物气孔关闭和毛状体的扫描电镜分析GydF4y2Ba
用直径0.5 cm的打孔机分别在8 h、10 h、12 h、14 h、16 h和18 h采集2月龄对照和转基因植株的叶盘。收集的样品立即在固定液(90 mL 50% [v/v]乙醇,5 mL冰醋酸,5 mL甲醛)中固定24 h(使用真空泵去除附着在组织表面的气体)。用70、80、90、95和100%乙醇分别脱水15-20 min,然后用CO干燥GydF4y2Ba2GydF4y2Ba并涂上薄膜。采用日立S-4800扫描电镜系统对气孔和植物毛状体进行观察和拍照。进行了3次生物重复。GydF4y2Ba
在aba诱导下,在12:00用直径0.5 cm的打孔机从4个不同月龄的植株上获得叶片,然后在50 mmol L的气孔开放液中培养GydF4y2Ba−1GydF4y2Ba氯化钾,10 mmol LGydF4y2Ba−1GydF4y2BaCACL.GydF4y2Ba2GydF4y2Ba, 10 mmol LGydF4y2Ba−1GydF4y2BaMES (pH 6.15)处理2 h,光照强度为130 mmol mGydF4y2Ba−2GydF4y2Ba s−1GydF4y2Ba在22°C时。等分试样为20μmolGydF4y2Ba−1GydF4y2Ba在开口液中加入ABA(无水乙醇溶解)或mock(等量无水乙醇),再孵育2 h。然后,立即对所有样品进行固定、脱水、干燥和涂层。在扫描电镜下,分别获得了未加气孔开液和ABA处理的CK、ABA处理和模拟处理的叶盘的3张图像。测定了60个气孔的孔径(宽度和长度)。通过对4个叶盘的测量,测定了气孔的平均孔径。GydF4y2Ba
电解质泄漏的测量GydF4y2Ba
为了检测电解质泄漏,将对照和转基因植株(在传代培养基上培养一个月的植株)的新鲜叶片(0.2 g)切成更小的块,放入装有10 mL去离子水的玻璃管中。样品在室温下在旋转摇床上混合6小时(转速约为150转/分)。用DDS-307A电导率仪(Leici)测量样品的初始电导率(Ci)后,煮沸20 min,将电解质释放到溶液中。将样品冷却至室温后,测量死亡组织的电导率(Cmax)。相对电解质泄漏量计算为(Ci/Cmax) × 100%。GydF4y2Ba
逆转转录定量PCR分析GydF4y2Ba
使用逆转录量定量PCR(RT-QPCR)测定分析对照和转基因植物中特定基因的表达水平。如前所述制备总RNA和cDNA [GydF4y2Ba91GydF4y2Ba].RT-qPCR引物序列见表GydF4y2Ba1GydF4y2Ba.进行了两个独立的生物学重复和三个技术重复。结果数据根据2GydF4y2Ba−ΔΔCtGydF4y2Ba方法,由Livak和Schmittgen概述[GydF4y2Ba92GydF4y2Ba].将特定基因的表达水平归一化GydF4y2Ba施GydF4y2Ba表达水平。GydF4y2Ba
可用性数据和材料GydF4y2Ba
本研究期间生成或分析的所有数据都包含在已发布的文章及其补充数据文件中(图。GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba,GydF4y2Ba8.GydF4y2Ba和其他文件GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba,GydF4y2Ba7.GydF4y2Ba).本研究中使用和/或分析的数据集由通讯作者金婉梅提供。GydF4y2Ba
参考文献GydF4y2Ba
- 1.GydF4y2Ba
Jones AM, Im KH, Savka MA, Wu MJ, DeWitt NG, Shillito R, Binns AN。过表达生长素结合蛋白1介导的生长素依赖的细胞扩张。科学。1998;282(5391):1114 - 7。GydF4y2Ba
- 2.GydF4y2Ba
LI, LI S, De Oliveira C, Ivetac A, Brandt W, Armitage L, Sheard LB, Tan X, Parry G, Mao H, et al.;TIR1/AFB-aux/IAA组合共受体系统对生长素的差异感知。生物化学学报。2012;8(5):477-85。GydF4y2Ba
- 3.GydF4y2Ba
侧根起始。植物的根,隐藏的一半。1996; 24:149 - 73。GydF4y2Ba
- 4.GydF4y2Ba
戴维斯PJ。《植物激素、生理、生物化学和分子生物学》。荷兰:施普林格Science & Business Media;2013.GydF4y2Ba
- 5.GydF4y2Ba
拉斯科夫斯基,威廉姆斯,努斯鲍姆,苏塞克斯。侧根分生组织的形成是一个两阶段的过程。发展。1995;121(10):3303 - 10。GydF4y2Ba
- 6.GydF4y2Ba
Boerjan W, Cervera MT, Delarue M, Beeckman T, Dewitte W, Bellini C, Caboche M, Van Onckelen H, Van Montagu M, Inze D.超级根,一种拟南芥的隐性突变,导致生长素过量产生。植物细胞。1995;7(9):1405 - 19所示。GydF4y2Ba
- 7.GydF4y2Ba
Brumos J, Bobay BG, Clark CA, Alonso JM, Stepanova AN。ROOTY异杂合子等位基因间互补的结构-功能分析。植物杂志。2020;183:1110-25。GydF4y2Ba
- 8.GydF4y2Ba
国王JJ,Stimart DP,Fisher Rh,Bleecker AB。一种改变拟南芥植物稳态和植物形态的突变。植物细胞。1995年; 7(12):2023-37。GydF4y2Ba
- 9.GydF4y2Ba
拟南芥(Arabidopsis thaliana)根系ABA与生长素信号通路的串接Heynh。足底。2005;222(1):98 - 106。GydF4y2Ba
- 10.GydF4y2Ba
Celenza JL JR,Grisafi PL,Fink Gr。拟南芥侧根形成的一种途径。基因开发。1995; 9(17):2131-42。GydF4y2Ba
- 11.GydF4y2Ba
Buezo J,Esteban R,Cornejo A,Lopez-Gomez P,Marino D,Chamizo-Ampudia A,Gil MJ,Martinez-Merino V,Moran JF。IAOX在Medicago Truncatula Roots的不同类型氮营养下诱导IAA的Sur表型和差分信号。植物SCI。2019; 287:110176。GydF4y2Ba
- 12.GydF4y2Ba
张敏,金飞,李建军。一种新的拟南芥microRNA通过抑制超根促进IAA合成。植物生理学报。2015;56(4):715-26。GydF4y2Ba
- 13.GydF4y2Ba
植物激素反应途径的进化。植物生物学学报,2020;71:327-53。GydF4y2Ba
- 14.GydF4y2Ba
Perez-Alonso MM, ortizo - garcia P, Moya-Cuevas J, Lehmann T, Sanchez-Parra B, Bjork RG, Karim S, Amirjani MR, Aronsson H, Wilkinson MD,等。J Exp Bot. 2020。GydF4y2Bahttps://doi.org/10.1093/jxb/eraa1485GydF4y2Ba.GydF4y2Ba
- 15.GydF4y2Ba
关键词:白三叶,生长素,脱落酸,茉莉酸,抗衰老基因,吲哚乙酸植物学报。2020;20(1):150。GydF4y2Ba
- 16.GydF4y2Ba
施罗德·吉,郭杰姆,艾伦GJ。植物中的防护细胞脱落酸信号和工程干旱耐寒性。自然。2001; 410(6826):327-30。GydF4y2Ba
- 17.GydF4y2Ba
Raza A,Razzaq A,Mehmood SS,Zou X,Zhang X,LV Y,Xu J.气候变化对农作物适应和解决其结果的策略的影响:审查。植物(巴塞尔,瑞士)。2019; 8(2)。GydF4y2Bahttps://doi.org/10.3390/plants8020034GydF4y2Ba.GydF4y2Ba
- 18.GydF4y2Ba
Hauser F, Waadtl R, Schroeder JI。脱落酸合成及信号转导机制的进化。咕咕叫医学杂志。2011;21 (9):R346-55。GydF4y2Ba
- 19.GydF4y2Ba
金Th,Bohmer M,Hu Hh,Nishimura N,Schroeder Ji。保护单元信号转导网络:理解脱落酸,CO2和CA2 +信号传导的进步。Ann Rev植物Biol。2010; 61:561-91。GydF4y2Ba
- 20。GydF4y2Ba
栾S.在保护细胞中的信号干旱。植物细胞环境。2002; 25(2):229-37。GydF4y2Ba
- 21。GydF4y2Ba
朱杰克。植物中的盐和干旱胁迫信号转导。Annu Rev植物Biol。2002; 53:247-73。GydF4y2Ba
- 22。GydF4y2Ba
成WH,ENDO A,周L,佩尼J,陈HC,Arroyo A,Leon P,Nambara E,Asami T,SEO M等。拟南芥葡萄糖信号和脱落酸生物合成和功能的独特短链脱氢酶/还原酶。植物细胞。2002; 14(11):2723-43。GydF4y2Ba
- 23。GydF4y2Ba
Finkelstein rr,gampala ss,摇滚CD。种子和幼苗中的脱落酸信号传导。植物细胞。2002; 14(SUP):S15-45。GydF4y2Ba
- 24。GydF4y2Ba
Kalladan R, Lasky JR, Chang TZ, Sharma S, Juenger TE, Verslues PE。自然变异鉴定了影响拟南芥干旱诱导脱落酸积累的基因。中国科学(d辑:地球科学)2017;GydF4y2Ba
- 25。GydF4y2Ba
McNicol RJ, McNicol JW。草莓品种遗传多样性评价方法的比较。中国科学(d辑:地球科学)1996;93(3):402-6。GydF4y2Ba
- 26。GydF4y2Ba
Kher R,巴巴JA,Bakshi P.种植时间和覆盖材料对草莓CV生长和果产量的影响。钱德勒。印度j hortic。2010; 67(4):441-4。GydF4y2Ba
- 27。GydF4y2Ba
Shulaev V,Sargent DJ,Crowhurst RN,Mockler TC,Temperts O,Delcher Al,Jaiswal P,Mockaitis K,Liston A,Mane Sp,等。林地草莓(Fragaria Vesca)的基因组。NAT Genet。2011; 43(2):109-16。GydF4y2Ba
- 28。GydF4y2Ba
鞋匠JS。小水果文化。LWW。1995年; 79:410。GydF4y2Ba
- 29。GydF4y2Ba
王浩,张慧,杨勇,李梦峰,张永涛,刘军,董军,李军,布特利E,薛志,等。八倍体草莓(Fragaria x ananassa)果实中MYB转录因子家族对红色的控制。Plant Biotechnol J. 2020; 18:1169-84。GydF4y2Ba
- 30.GydF4y2Ba
熊利民,王荣刚,毛光辉,柯赞。通过根系对干旱胁迫和脱落酸的反应的遗传分析鉴定耐旱性决定因素。植物杂志。2006;142(3):1065 - 74。GydF4y2Ba
- 31.GydF4y2Ba
赵y,陈z,xing l,liu x,hou yj,chinnusamy v,王p,段c,zhu JK。ABA受体蛋白家庭在ABA和应力信号传导中的不同作用方式。细胞res。2013; 23(12):1380-95。GydF4y2Ba
- 32.GydF4y2Ba
9-顺式环氧类胡萝卜素双加氧酶3的自然变异与ABA积累。植物杂志。2019;179(4):1620 - 31所示。GydF4y2Ba
- 33.GydF4y2Ba
关键词:臭氧,拟南芥,ab1td插入突变体,蛋白磷酸酶2C ABI1, ABA,乙烯足底。2009;230(5):1003 - 17所示。GydF4y2Ba
- 34.GydF4y2Ba
熊亮,石谷明,朱建军。渗透胁迫、温度和脱落酸的相互作用对拟南芥基因表达的调控。植物杂志。1999;119(1):205 - 12所示。GydF4y2Ba
- 35.GydF4y2Ba
刘Q,Kasuga M,Sakuma Y,Abe H,Miura S,Yamaguchi-Shinozaki K,Shinozaki K.两种转录因子,DREB1和DREB2,eSBP / AP2 DNA结合结构域分别在干旱和低中分别两种细胞信号转导途径- 在拟南芥中分别进行浓度响应基因表达。植物细胞。1998年; 10(8):1391-406。GydF4y2Ba
- 36.GydF4y2Ba
在拟南芥中,AtAIP1和AtAIP1在aba信号转导和糖耐受性中的作用。植物科学。2012;187:83-8。GydF4y2Ba
- 37.GydF4y2Ba
Qi X,Torii Ku。引导气孔发育的激素和环境信号。BMC BIOL。2018; 16(1):21。GydF4y2Ba
- 38.GydF4y2Ba
杨科,杨科,杨科。AaMYB1及其同源基因AtMYB61对黄花蒿和拟南芥萜类代谢和毛状体发育的影响。植物j . 2017; 90(3): 520 - 34。GydF4y2Ba
- 39.GydF4y2Ba
宁平,王军,周勇,高丽,王军,龚超。黄土高原柠条毛状体对自然干旱胁迫的适应进化。生态另一个星球。2016;6(11):3786 - 95。GydF4y2Ba
- 40.GydF4y2Ba
茉莉酸、水杨酸和赤霉素对拟南芥毛状体诱导的交互作用。植物杂志。2003;133(3):1367 - 75。GydF4y2Ba
- 41.GydF4y2Ba
Daszkowska-Golec A,Szarejko I.在干旱胁迫条件下的植物激素控制下打开或关闭门 - 气孔动作。前植物SCI。2013; 4:138。GydF4y2Ba
- 42.GydF4y2Ba
Iuchi S,Kobayashi M,Takio T,Naramoto M,Seki M,Kato T,Tabata S,Kakubari Y,Yamaguchi-Shinozaki K,Shinozaki K.通过9-Cis-环氧树脂蛋白DiOxygenase的基因操作对干旱耐受的调节,一种关键酶在拟南芥中脱落酸生物合成。工厂J. 2001; 27(4):325-33。GydF4y2Ba
- 43。GydF4y2Ba
张X,Adamowski M,Marhava P,Tan S,Zan S,Zang Y,Rodriguez L,Zwiewka M,Pukysova V,Sanchez As,Raxwal VK等。Arabidopsis Flippases与ARF GTP酶交换因子配合,以规范销毒素转运蛋白的贩运和极性。植物细胞。2020; 32(5):1644-64。GydF4y2Ba
- 44。GydF4y2Ba
Doyle SM, Rigal A, Grones P, Karady M, Barange DK, Majda M, Parizkova B, Karampelias M, Zwiewka M, Pencik A, et al.;生长素前体邻氨基苯甲酸通过调控拟南芥PIN-FORMED蛋白极性和重定位在根向地性中的作用。新植醇。2019;223(3):1420 - 32。GydF4y2Ba
- 45。GydF4y2Ba
Yamauchi T,Tanaka A,Inahashi H,Nishizawa NK,Tsutsumi N,Inukai Y,Nakazono M.通过Aux / IAA-和ARF依赖性的养肝信号传导进行曝气性和侧根发育的细微控制。Proc Natl Acad Sci U S A. 2019; 116(41):20770-5。GydF4y2Ba
- 46。GydF4y2Ba
Millar Aa,Jacobsen JV,Ross JJ,Helliwell Ca,Poole At,Scofield G,Reid JB,Gubler F.种子休眠和Aba代谢在拟南芥和大麦中:ABA 8'-羟化酶的作用。工厂J. 2006; 45(6):942-54。GydF4y2Ba
- 47。GydF4y2Ba
Khandal H, Gupta SK, Dwivedi V, Mandal D, Sharma NK, Vishwakarma NK, Pal L, Choudhary M, Francis A, Malakar P,等。鹰嘴豆细胞分裂素氧化酶/脱氢酶6的根特异性表达可以增强根系生长、抗旱性和产量,而不影响结瘤。生物技术学报。GydF4y2Bahttps://doi.org/10.1111/pbi.13378GydF4y2Ba.GydF4y2Ba
- 48。GydF4y2Ba
Visentin I,Pagliarani C,Deva E,Caracci A,Tureckova v,Novak O,Lovisolo C,Schubert A,Cardinale F.一种新型滴水术 - MIR156模块在干旱恢复过程中控制气孔行为。植物细胞环境。2020。GydF4y2Bahttps://doi.org/10.1111/pce.13758GydF4y2Ba.GydF4y2Ba
- 49。GydF4y2Ba
木质组织光合作用减少了一半的茎干二氧化碳外排,并且在幼苗时期不受干旱胁迫的影响GydF4y2BaPopulus mrelulaGydF4y2Ba树。植物细胞环境。2019。GydF4y2Bahttps://doi.org/10.1111/pce.13711GydF4y2Ba.GydF4y2Ba
- 50.GydF4y2Ba
Jarvis AJ,Mansfield Ta,Davies WJ。上升二氧化碳下的气孔行为,光合作用和蒸腾。植物细胞环境。1999年; 22(6):639-48。GydF4y2Ba
- 51.GydF4y2Ba
米森L,利木赞,罗德里格斯R,莱茨MG。地中海冬青林叶片对极端干旱的生理反应。植物学报。2010;33(11):1898-910。GydF4y2Ba
- 52.GydF4y2Ba
Rascher U,Bobich Eg,林GH,Walter A,Morris T,Naumann M,Nichol CJ,Pierce D,Bil K,Kudeyarov v等。一种模型热带雨林中干旱期间光合作用的功能多样性 - 叶面积,光合电子传输和气孔电导降低净生态系统碳交换的贡献。植物细胞环境。2004; 27(10):1239-56。GydF4y2Ba
- 53.GydF4y2Ba
TUZET A,Perrier A,Leuning R.气孔电导,光合作用和蒸腾的耦合模型。植物细胞环境。2003; 26(7):1097-116。GydF4y2Ba
- 54.GydF4y2Ba
Li Cl,Wang M,MA XY,张W.NRGA1,推定的线粒体丙酮酸载体,鉴于拟南芥的防护细胞离子通道和干旱应激反应的ABA调节。莫尔植物。2014; 7(10):1508-21。GydF4y2Ba
- 55.GydF4y2Ba
Rowland L,Da Costa Acl,Oliveira Aar,Oliveira Rs,Bittencourt Pl,Costa Pb,Giles Al,Sosa Ai,Coughlin I,Godlee JL等人。干旱胁迫和树大小确定热带森林中的茎二氧化碳流出。新植物。2018; 218(4):1393-405。GydF4y2Ba
- 56.GydF4y2Ba
李强,王刚,关超,杨东,王勇,张勇,季军,金川,安涛。水杨酸结合蛋白2同源基因LcSABP的过表达对烟草抗旱性的影响。植物科学学报2019;10。GydF4y2Bahttps://doi.org/10.3389/fpls.2019.00200GydF4y2Ba.GydF4y2Ba
- 57.GydF4y2Ba
刘超,徐勇,冯勇,龙东,曹波,向志,赵安。桑树g蛋白异位表达对烟草耐旱盐胁迫能力的影响。中华医学杂志。2018;20(1):89-101。GydF4y2Ba
- 58.GydF4y2Ba
唐y,bao x,zhi y,wu q,gu y,yin x,zeng l,li j,张j,他w等。MYB家族基因,OSMYB6的过度表达增加了转基因水稻的干旱和盐度胁迫耐受性。前植物SCI。2019; 10:168。GydF4y2Ba
- 59.GydF4y2Ba
王强,倪军,沙凡,刘伟,王东,姚艳,胡华,黄胜,侯军,傅胜,等。胁迫诱导的SsMAX2过表达通过调节氧化还原稳态促进拟南芥抗旱性和耐盐性。中华医学杂志。2019;20(4)。GydF4y2Bahttps://doi.org/10.3390/ijms20040837.GydF4y2Ba.GydF4y2Ba
- 60.GydF4y2Ba
詹姆斯D,Borphukan B,Fartyal D,Ram B,Singh J,Manna M,Sheri V,Panditi V,Yadav R,Achary VMM等。OSGS1的同时过表达; 1和转基因水稻中的OSGS2基因(GydF4y2Ba栽培稻GydF4y2Ba(l):对非生物胁迫耐受性的影响。植物学报2018;9:786。GydF4y2Ba
- 61.GydF4y2Ba
关键词:花生AP2/ERF基因,水稻,盐胁迫,生长特性植物学报2017;8:306。GydF4y2Ba
- 62.GydF4y2Ba
干旱、高温和盐胁迫下水杨酸对脱壳和脱壳大麦根系活性氧调节和抗氧化防御的时间-过程分析。杂志。2019;(2)165:169 - 82。GydF4y2Ba
- 63.GydF4y2Ba
魏强,罗强,王锐,张飞,何勇,张勇,邱丹,李康,常军,杨刚,等。小麦r2r3型MYB转录因子TaODORANT1正调控转基因烟草对干旱和盐胁迫的响应。植物学报2017;8:1374。GydF4y2Ba
- 64.GydF4y2Ba
德尔里约热内卢。CF, López-Huertas E. & Palma JM。:Plant superoxide dismutases: function under abiotic stress conditions. . Antioxidants and Antioxidant Enzymes in Higher Plants Springer, Cham 2018.
- 65.GydF4y2Ba
干旱和盐胁迫对植物抗坏血酸过氧化物酶和过氧化氢酶活性的影响。中华医学杂志。2015;16(6):13561-78。GydF4y2Ba
- 66.GydF4y2Ba
干旱胁迫反应与耐受性的基因网络研究。中国生物医学工程学报。2007;58(2):221-7。GydF4y2Ba
- 67。GydF4y2Ba
陈志强,陈志强,陈志强,等。拟南芥生长素转录反应网络的自然变异研究[j]。植物细胞。2010;22(7):2184 - 200。GydF4y2Ba
- 68。GydF4y2Ba
弗里基利奥·M,阿拉巴迪·D,佩雷斯·戈麦斯·J,加西亚·卡塞尔·L,菲利普斯·AL,海登·P,布拉克斯·马。生长素信号对拟南芥中赤霉素代谢基因的转录调控。植物杂志。2006;142(2):553 - 63。GydF4y2Ba
- 69。GydF4y2Ba
李国栋,朱灿,甘玲,黄德华(3)通过调控植物生长素的转运和信号转导增强拟南芥对外源IAA的响应。植物学报2015;34(3):483-94。GydF4y2Ba
- 70。GydF4y2Ba
Omely Sharkuk Na,Kovrizhnykh VV,Oshchepkova Ea,Pasternak T,Palme K,Mironova VV。PIN1 AUXIN TRANSINGER的详细表达图GydF4y2Ba拟南芥GydF4y2Ba根。BMC Plant Biol. 2016;16(supl 1):5。GydF4y2Ba
- 71。GydF4y2Ba
沈华,朱丽,卜启云,胡琼。MAX2对多种激素促进光形态建成的影响。摩尔。2012;5(3):750 - 62。GydF4y2Ba
- 72。GydF4y2Ba
赵义,克里斯滕斯SK,Fankhauser C,Cashman Jr,Cohen JD,Weigel D,Chory J.在生长素生物合成中的黄液单氧基酶样酶的作用。科学。2001; 291(5502):306-9。GydF4y2Ba
- 73.GydF4y2Ba
qin x,zeevaart ja。9-CIS-环氧树脂蛋白切割反应是水胁迫豆中脱落酸生物合成的关键调节步骤。Proc Natl Acad Sci U S A. 1999; 96(26):15354-61。GydF4y2Ba
- 74.GydF4y2Ba
Thompson AJ, Jackson AC, Symonds RC, Mulholland BJ, Dadswell AR, Blake PS, Burbidge A, Taylor IB.番茄9-顺式环氧类胡萝卜素双加氧酶基因的异位表达导致脱落酸的过量产生。植物j . 2000; 23(3): 363 - 74。GydF4y2Ba
- 75.GydF4y2Ba
qin x,zeevaart ja。尼古拉氏菌植物中9-CIS-环氧丙酮蛋白基因酶基因的过度表达增加了脱落酸和相酸水平,增强了耐旱性。植物理性。2002; 128(2):544-51。GydF4y2Ba
- 76.GydF4y2Ba
拟南芥生长素超根t1突变体中醛氧化酶活性的研究。植物杂志。1998;116(2):687 - 93。GydF4y2Ba
- 77.GydF4y2Ba
兴L,赵y,高J,Xiang C,Zhu JK。ABA受体Pyl9与Pyl8一起在调节侧根生长方面起重要作用。SCI REP。2016; 6:27177。GydF4y2Ba
- 78.GydF4y2Ba
陈赵Y, Z,高J,邢L,曹M,于C,胡锦涛Y,你J, H,朱Y, et al。ABA受体PYL9促进抗旱性和叶片衰老。中国科学(d辑:地球科学)2016;113(7):1949-54。GydF4y2Ba
- 79.GydF4y2Ba
关键词:冻融法,根癌农杆菌,高效转化咕咕叫科学。2007;93(6):770 - 2。GydF4y2Ba
- 80。GydF4y2Ba
金文敏,王慧。草莓植物表达载体pCAMBIA2301-del-ros的构建及遗传转化。农业生物技术学报。2014;22(3):389-96。GydF4y2Ba
- 81。GydF4y2Ba
陈佩云,王正坤,宋世昌,To K-Y。双元载体pBI121的全序列及其在转基因植物T-DNA插入克隆中的应用摩尔品种。2003;11(4):287 - 93。GydF4y2Ba
- 82。GydF4y2Ba
Geldner N,Friml J,Stierhof Yd,Jurgens G,Palme K.助生传输抑制剂阻止Pin1循环和囊泡贩运。自然。2001; 413(6854):425-8。GydF4y2Ba
- 83。GydF4y2Ba
OKUSHIMA Y,Fukaki H,Onoda M,神学is,塔斯卡卡M.ARF7和ARF19通过直接激活拟南芥的LBD / ASL基因调节横向根部。植物细胞。2007; 19(1):118-30。GydF4y2Ba
- 84.GydF4y2Ba
Bu Q,LV T,沉H,鲁松P,王家,王Z,黄Z,肖L,工程师C,Kim Th,等。拟南芥F箱蛋白质MAX2对干旱耐受的调节。植物理性。2014; 164(1):424-39。GydF4y2Ba
- 85.GydF4y2Ba
李萨,jang s,yoon ek,heo jo,chang ks,choi Jw,Dhar S,Kim G,Choe Je,Heo JB等。ABA和GA之间的相互作用在拟南芥根系组织中调节非对称细胞分裂的时序。莫尔植物。2016; 9(6):870-84。GydF4y2Ba
- 86.GydF4y2Ba
李枫,李晓芳,韩志华,舒海瑞,李涛。两个中国梨(Pyrus bretschneideri Rehd.)自交亲和突变体颜庄和金珠的分子分析。植物生物(Stuttg)。2009; 11(5): 774 - 83。GydF4y2Ba
- 87.GydF4y2Ba
关键词:植物粗提物,高效液相色谱-质谱法,植物激素Nat Protoc。2010;5(6):986 - 92。GydF4y2Ba
- 88.GydF4y2Ba
王浩,李梦峰,杨勇,董杰,金文敏。草莓(Fragaria x ananassa cv.)叶片离体外植体不定芽再生的组织学和内源植物生长调节剂变化。“Honeoye”)。acta botanica yunnanica(云南植物研究),2015;GydF4y2Ba
- 89.GydF4y2Ba
朱军,朱家杰。对影响植物水分状况的抗旱性、抗盐性、抗冻性和非生物胁迫的量化方法和概念。植物j . 2006; 45(4): 523 - 39。GydF4y2Ba
- 90.GydF4y2Ba
Calatayud V, Cervero J, Calvo E, Garcia-Breijo FJ, Reig-Arminana J, Sanz MJ。常绿和落叶栎树物种对臭氧水平增强的响应。环境Pollut。2011;159(1):55 - 63。GydF4y2Ba
- 91.GydF4y2Ba
李凡,王浩,杨勇,金伟民。荠菜风疹TGA4是bZIP转录因子,可导致拟南芥开花延迟。中国生物医学工程学报。2016;68(1):187-95。GydF4y2Ba
- 92.GydF4y2Ba
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相对基因表达数据。方法。2001;25(4):402 - 8。GydF4y2Ba
致谢GydF4y2Ba
我们感谢惠张教授,从中国科学院植物学院镇雪博士为其进行了帮助。GydF4y2Ba
资金GydF4y2Ba
本研究由国家重点研发计划项目(No. 2019YFD1000800)和北京市科技创新计划项目(No. 2019YFD1000800)资助。KJCX20200205、KJCX202000602)、欧盟“地平线2020”科研创新计划项目(No. 679303)。资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有作用。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
WJ设计研究;ML、YY、SY、HW、JD、HZ、JL、CZ进行了研究;WJ、ML、YY、SY、YZ、AR、GW分析数据;WJ、AR和ML撰写了这篇论文。作者阅读并批准了最终的手稿。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
额外的文件1。GydF4y2Ba
RTY蛋白的免疫原序列分析。RTY蛋白二级结构,三级结构,疏水性,抗原性和特异性分析。RTY蛋白质(1-131AA)重组蛋白表达用作免疫原以远离蛋白质结合位点。GydF4y2Ba
额外的文件2。GydF4y2Ba
通过PCR确认转基因植物。GydF4y2Ba
额外的文件3。GydF4y2Ba
通过抗RTY进一步分析转基因植物。GydF4y2Ba
额外的文件4。GydF4y2Ba
通过抗肌动蛋白western blot进一步分析转基因植株。GydF4y2Ba
附加文件5.GydF4y2Ba
对照和转基因植株在干旱胁迫下0 ~ 14 d的相对含水量。在干旱胁迫的0 ~ 14 d内,每隔2d用土壤温湿仪测定土壤相对含水量。进行了三次生物复制。由于蛭石与土壤的混合被0.8 L的水饱和,因此干旱前的土壤相对含水量设为100%。数据以平均值±SD (GydF4y2BaNGydF4y2Ba= 3)。GydF4y2Ba
附加文件6.GydF4y2Ba
在对照和转基因植物中PEG处理期间的相对表达水平测定。通过使用的RT-QPCR测定量来定量相对表达水平GydF4y2Ba施GydF4y2Ba作为一个控制。30日龄对照和转基因植株进行外源表达GydF4y2BaRTY.GydF4y2Ba在MS培养基上培养6 - BA 0.2 MG L.GydF4y2Ba−1GydF4y2Ba和iba 0.1 mg lGydF4y2Ba−1GydF4y2Ba在21℃下在21℃下在21℃下将含有0%(CK),10,20%或30%PEG注入的培养基的100ml玻璃烧瓶,其具有16-H光/ 8-H深色光周期.四十八个小时后,对处理的植物进行取样以测定。每次治疗进行三种生物重复。数据显示为平均值±SD(n = 3)(GydF4y2Ba*GydF4y2BaP
额外的文件7。GydF4y2Ba
aba诱导对照和转基因植物气孔关闭的扫描电镜观察。(a)和(b)对照和转基因植株未使用气孔打开液和ABA处理;(c)和(d)气孔打开液处理2 h后,用相同体积的乙醇处理对照和转基因植株2 h;(e)和(f)在气孔开孔液处理2 h后,再用20 μM ABA处理对照植株和转基因植株。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
Li, M., Yang, Y., Raza, A.。GydF4y2Baet al。GydF4y2Ba异源表达GydF4y2Ba拟南芥而无GydF4y2Ba草莓中的基因(GydF4y2BaFragaria.GydF4y2Ba×GydF4y2BaananassaGydF4y2Baduch。)改善耐旱性。GydF4y2BaBMC植物杂志GydF4y2Ba21,GydF4y2Ba57(2021)。https://doi.org/10.1186/s12870-021-02839-4.GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-021-02839-4.GydF4y2Ba
关键字GydF4y2Ba
- 阿坝GydF4y2Ba
- 拟南芥GydF4y2Ba
- 干旱压力GydF4y2Ba
- 异源表达GydF4y2Ba
- 气孔闭合GydF4y2Ba
- 草莓GydF4y2Ba