- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
谷氨酰胺合成酶1b的1232bp上游序列gydF4y2BaEichhornia凤眼莲gydF4y2Ba是一种根优先启动子序列gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21.gydF4y2Ba, 文章编号:gydF4y2Ba66gydF4y2Ba(gydF4y2Ba2021.gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
谷氨酰胺合成酶(GS)是植物氮代谢的关键酶。了解GS在植物体内的表达调控具有重要意义。启动子可以启动其下游基因的转录。gydF4y2BaEichhornia凤眼莲gydF4y2Ba是一种最突出的水生入侵植物,对环境和经济发展都有负面影响。它还可用于水体污染物的生物修复以及饲料和能源燃料的生产。因此,GS启动子的鉴定与表征gydF4y2BaE.沉默斯gydF4y2Ba有助于阐明其GS表达的调控机制,进而调控其N代谢。gydF4y2Ba
结果gydF4y2Ba
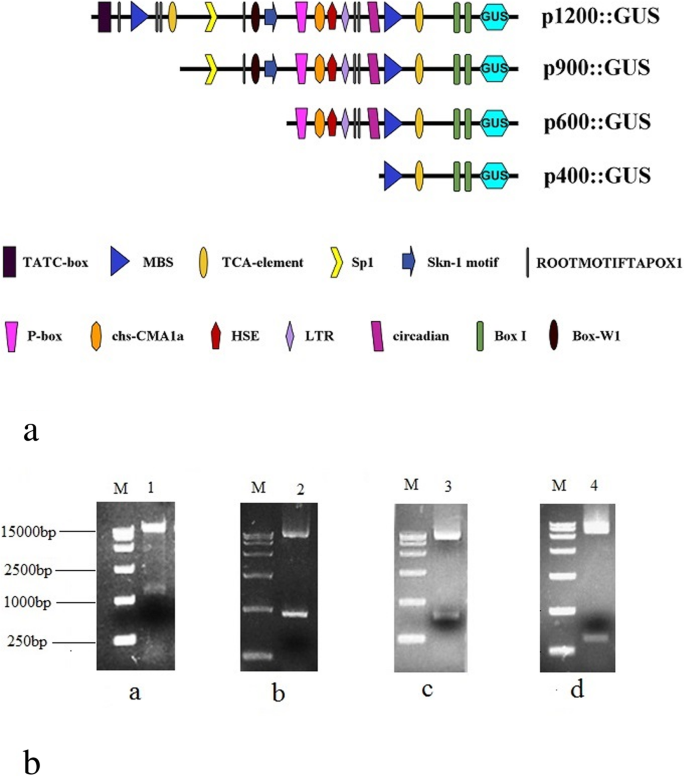
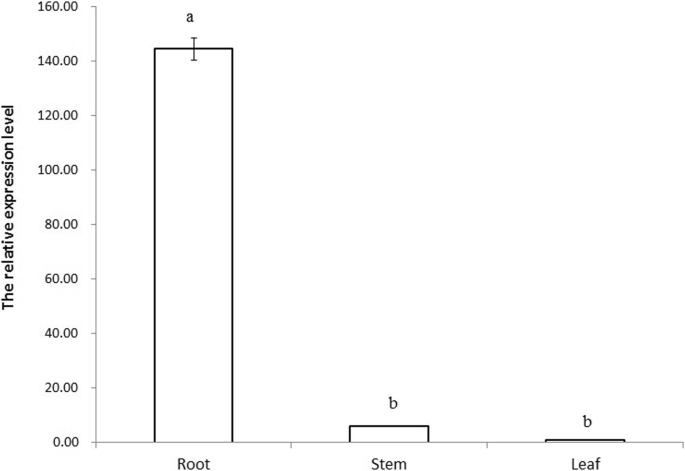
一个1232bp的基因组片段gydF4y2BaEcGS1bgydF4y2Ba序列从gydF4y2BaE.沉默斯gydF4y2Ba(gydF4y2BaEcGS1bgydF4y2Ba-P)已被克隆,分析和功能表征。TSP-TCM软件和PlantCare分析显示了塔塔盒芯元件,CAAT盒,根特异性表达元件,包括CHS-CMA1A,盒子I和SP1的光调节元件以及序列中的其他顺式作用元件。三个5'删除碎片gydF4y2BaEcGS1bgydF4y2Ba上游序列分别为400 bp、600 bp、900 bp和1232 bp片段,驱动烟草β-葡萄糖苷酸酶(GUS)的表达。定量检测结果显示,GUS活性随启动子长度的减小而降低,说明启动子中不存在负调控元件gydF4y2BaECGS1.gydF4y2Ba- p。的GUS表达式gydF4y2BaEcGS1bgydF4y2Ba-P在根中明显高于叶子和茎的根本,表明gydF4y2BaEcGS1bgydF4y2Ba-P是根优先启动器。实时定量逆转录 - 聚合酶链反应(QRT-PCR)分析gydF4y2BaEcGS1bgydF4y2Ba基因在根中也有较高的表达gydF4y2BaE.crassipesgydF4y2Ba而不是茎和叶。gydF4y2Ba
结论gydF4y2Ba
EcGS1bgydF4y2Ba-P是一种根优先启动子序列。它可以特异性地驱动其下游基因的转录根。本研究将有助于阐明监管机制gydF4y2BaEcGS1bgydF4y2Ba组织特异性表达及进一步研究其其他调控机制,以期利用gydF4y2BaE.crassipesgydF4y2Ba在富营养化水中的修复中,从营养代谢点控制其过度生长。gydF4y2Ba
背景gydF4y2Ba
Eichhornia凤眼莲gydF4y2Ba是最突出的水生侵入性植物[gydF4y2Ba1gydF4y2Ba],对环境和经济发展的负面影响[gydF4y2Ba2gydF4y2Ba那gydF4y2Ba3.gydF4y2Ba].此外,它被认为是具有几种独特性质的有价值的资源,之前的研究报告说gydF4y2BaE.沉默斯gydF4y2Ba具有高吸收效率的氮(n),磷(p)和重金属[gydF4y2Ba4.gydF4y2Ba那gydF4y2Ba5.gydF4y2Ba那gydF4y2Ba6.gydF4y2Ba].所以它用于水中存在的污染物的生物修复[gydF4y2Ba7.gydF4y2Ba那gydF4y2Ba8.gydF4y2Ba].此外,gydF4y2BaE.沉默斯gydF4y2Ba作为生产饲料和能源燃料的良好经济原料[gydF4y2Ba9.gydF4y2Ba那gydF4y2Ba10.gydF4y2Ba那gydF4y2Ba11.gydF4y2Ba].在污水中生长时,叶片中大约有33%的粗蛋白质积累,它还和一些微生物一起被用于生产乙醇、甲烷等燃料[gydF4y2Ba12.gydF4y2Ba那gydF4y2Ba13.gydF4y2Ba].因此,研究的生化代谢gydF4y2BaE.沉默斯gydF4y2Ba来自分子水平有助于进一步利用和控制这种杂草。gydF4y2Ba
植物中的谷氨酰胺合成酶(GS)用作N代谢的关键酶,转化无机N(NHgydF4y2Ba4.gydF4y2Ba+gydF4y2Ba或没有gydF4y2Ba3.gydF4y2Ba-gydF4y2Ba),通过GS(谷氨酰胺合成酶)-GOGAT(谷氨酸合成酶)循环从外部吸收到有机氮,并进一步并入其他生物大分子[gydF4y2Ba14.gydF4y2Ba].GS根据其蛋白结构和基因序列可分为GS1、GS2和GS3 [gydF4y2Ba15.gydF4y2Ba那gydF4y2Ba16.gydF4y2Ba],高等植物在根和叶中有GS1和GS2形态。GS2一般存在于叶组织中,而GS1则存在于根和维管组织中[gydF4y2Ba11.gydF4y2Ba那gydF4y2Ba17.gydF4y2Ba].许多研究表明,ROOTS中的GS1同化NHgydF4y2Ba4.gydF4y2Ba+gydF4y2Ba从土壤进入植物,叶片中的GS1再同化NHgydF4y2Ba4.gydF4y2Ba+gydF4y2Ba而GS2同化NHgydF4y2Ba4.gydF4y2Ba+gydF4y2Ba源自光呼吸和硝酸盐还原[gydF4y2Ba18.gydF4y2Ba].GS在N同化中发挥着重要作用,这对植物生长和发展至关重要。植物具有GS表达的精细调节机制,其与外部条件和植物的发育状况密切协调。张等人。据报道,GS同工酶的调节可能通过复杂的C-N代谢机制促进流动强度和增强N使用效率(NUE)[gydF4y2Ba19.gydF4y2Ba].在小麦中,GS1;1表达上调是对氮肥供应减少的响应[gydF4y2Ba20.gydF4y2Ba,而NH高gydF4y2Ba4.gydF4y2Ba+gydF4y2Ba供给特异性诱导了大麦和高粱GS1-3同工基因的表达[gydF4y2Ba21.gydF4y2Ba那gydF4y2Ba22gydF4y2Ba].GS表达受外部N申请调节,但该调节程度依赖于植物物种,N个源和植物组织[gydF4y2Ba18.gydF4y2Ba].GS表达的调控机制是什么?通过对GS基因启动子的研究,可以揭示GS表达的时空特性,进一步揭示GS在转录水平上调控的分子机制,从而更好地促进植物对N的吸收利用。gydF4y2Ba
启动子是基因5 '端上游序列,调控基因表达,包含RNA聚合酶和转录因子识别结合位点,能够启动转录。启动子序列包括核心元件和调控元件,这些调控元件所对应的条件可调控其下游基因的转录[gydF4y2Ba23gydF4y2Ba那gydF4y2Ba24gydF4y2Ba那gydF4y2Ba25gydF4y2Ba].大豆Gmhsp 17.3-B基因的热激元件参与烟草种子成熟过程中热激启动子的激活[gydF4y2Ba26gydF4y2Ba].由冷诱导型ATCOR15A启动子驱动的异戊烯基转移酶的表达可以在热带和亚热带区域中培养的甘蔗提供更大的冷应力的耐受性[gydF4y2Ba27gydF4y2Ba].根特异性启动子PsPR10来自gydF4y2Ba松果体strobusgydF4y2Ba含有许多非生物调节元件可以有效地在不同荷尔蒙或盐胁迫条件下引发下游基因的表达[gydF4y2Ba28gydF4y2Ba].因此,对该启动子及其调控的研究有助于阐明其下游基因的表达机制。在本研究中,我们分离和表征了启动子序列gydF4y2BaEcGS1bgydF4y2Ba基因。调查功能gydF4y2BaEcGS1bgydF4y2Ba-P, GUS驱动的转基因烟草gydF4y2BaEcGS1bgydF4y2Ba-P被开发出来,人们发现gydF4y2BaEcGS1bgydF4y2Ba磷能优先驱动基因在根中的表达。要进一步验证这一点,请使用gydF4y2BaEcGS1bgydF4y2Ba采用实时荧光定量pcr检测基因表达水平。gydF4y2Ba
结果gydF4y2Ba
克隆与分析gydF4y2BaEcGS1bgydF4y2Ba- pgydF4y2Ba
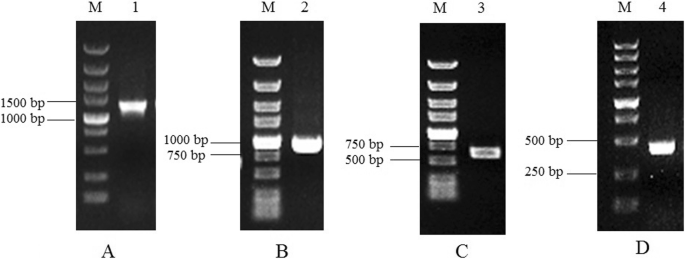
克隆…的调控区域gydF4y2BaEcGS1bgydF4y2Ba基因,从相应的cDNA序列设计引物对。用PCR技术在基因组DNA上行走gydF4y2BaE.沉默斯gydF4y2Ba,上游gydF4y2BaEcGS1bgydF4y2Ba用巢式pcr克隆了三次基因(图。gydF4y2Ba1gydF4y2Ba)然后被测序。这gydF4y2BaEcGS1bgydF4y2Ba获得基因上游序列(1232bp),命名为gydF4y2BaEcGS1bgydF4y2Ba- p。此序列被提交给NCBI数据库,并分配了登录号MT154418。使用BLAST程序的同源性搜索揭示了Genbank数据库中已知基因或启动子的相似性。转录开始站点(TSS)从上游的第105bp到ATG密码子开始。来自塔塔盒( - 30bp)和Caat-盒( - 96bp)的Tss距离与通常针对其他植物启动子描述的那些一致[gydF4y2Ba29gydF4y2Ba那gydF4y2Ba30.gydF4y2Ba].桌子gydF4y2Ba1gydF4y2Ba是TSSP-TCM软件和PlantCARE的预测结果,显示一些参与非生物胁迫耐受性的顺式作用元件(MBS、HSE、LTR、circadian)、胚芽和根特异性表达元件(Skn-1_motif、ROOTMOTIFTAPOX1)、光调控元件(chs-CMA1a、Box I和Sp1)、序列中存在水杨酸和赤霉素响应元件(TCA-element, P-box)。gydF4y2Ba2gydF4y2Ba).所以gydF4y2BaEcGS1bgydF4y2Ba-P含有核心启动子,组织特异性表达元件,光调节元件和其他顺式作用元件,其可能调节GS1B表达的时间和空间。gydF4y2Ba
不同长度启动子驱动的GUS表达的组织化学分析gydF4y2BaEcGS1bgydF4y2Ba- pgydF4y2Ba
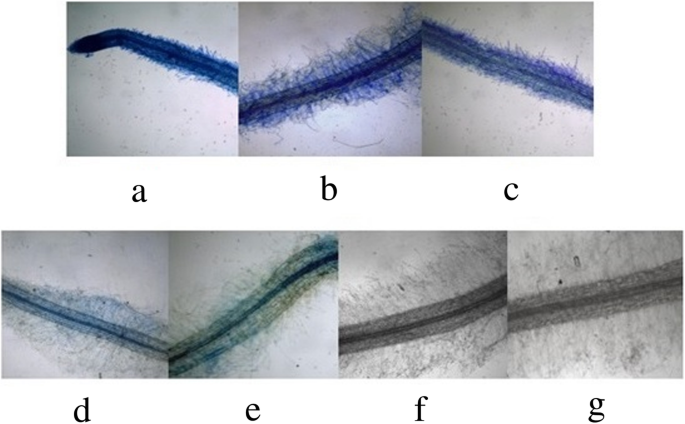
调查由不同长度驱动的GUS表达gydF4y2BaEcGS1bgydF4y2Ba-P,四个不同的长度gydF4y2BaEcGS1bgydF4y2Baps (gydF4y2BaEcGS1bgydF4y2Ba-P及其三个5'缺失片段,即P1200,P900,P600和P400)代替35秒的启动子与PBI121载体中的报告基因GUS融合(图。gydF4y2Ba3.gydF4y2Baa)分别。通过消化载体来验证融合的载体gydF4y2Ba后gydF4y2BaIII和gydF4y2BaBAMgydF4y2Ba嗨(图。gydF4y2Ba3.gydF4y2Bab)分别。之后,将PBI121S转化为烟草,通过PCR确认转基因烟草。组织化学分析表明,具有35升启动子(阳性对照)的PBI121载体的转基因Tobaccos的所有组织出现在显着的蓝色(图。gydF4y2Ba4.gydF4y2Ba一种,gydF4y2Ba5.gydF4y2Ba一种,gydF4y2Ba6.gydF4y2Baa),表明35 s启动子可以很好地驱动GUS基因在转基因烟草各组织中的表达。pBI101不含启动子驱动GUS表达的转基因烟草(阴性对照,Figs。gydF4y2Ba4.gydF4y2Baf,gydF4y2Ba5.gydF4y2Baf,gydF4y2Ba6.gydF4y2Baf)和野生型烟草(无花果。gydF4y2Ba4.gydF4y2BaG,gydF4y2Ba5.gydF4y2BaG,gydF4y2Ba6.gydF4y2Bag)由于缺乏GUS活性,因此表明,没有35s启动子的转基因烟草和非转基因烟草表明GUS活性。所有转基因的Tobaccos根源gydF4y2BaEcGS1bgydF4y2Ba-ps显示为蓝色(图。gydF4y2Ba4.gydF4y2BaB,C,D,E),其表明它们具有较强的GUS活动,特别是用较长的启动子转化的根(图。gydF4y2Ba4.gydF4y2Bab,c)。当5'-上游区域的长度gydF4y2BaEcGS1bgydF4y2BaGUS基因在根中的表达也呈现下降趋势。但在烟叶中,所有转基因烟草都含有gydF4y2BaEcGS1bgydF4y2Baps(无花果。gydF4y2Ba5.gydF4y2BaB, c, d, e)在刀片的切割边缘只显示出一点蓝色。这说明GUS表达受不同长度的驱动gydF4y2BaEcGS1bgydF4y2Ba-ps在叶子中都很脆弱。在茎中,所有不同的长度启动子gydF4y2BaEcGS1bgydF4y2Ba- p(无花果。gydF4y2Ba6.gydF4y2Bab, c, d, e)为白色,表明这些茎中无GUS表达。gydF4y2Ba
不同长度启动子的定量分析gydF4y2BaEcGS1bgydF4y2Ba-P由4-甲基umb蛋白酶-β-D-葡糖醛酸(Mug)测定gydF4y2Ba
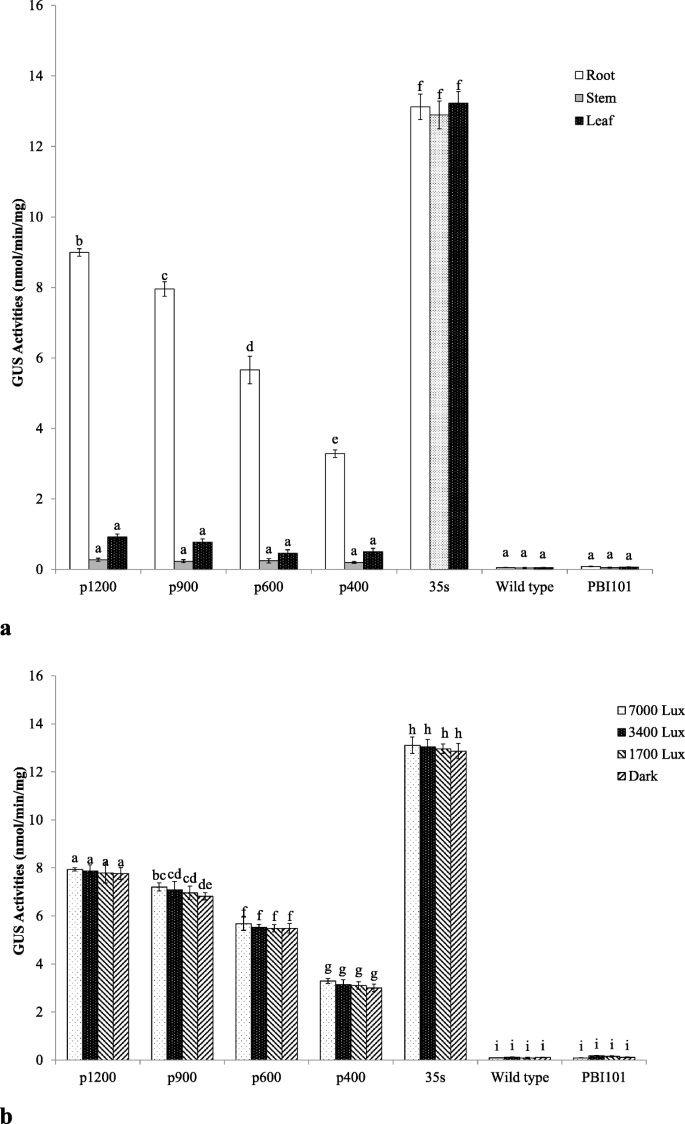
的影响gydF4y2BaEcGS1bgydF4y2Ba通过Mug测定对转基因烟草中的GUS活性测试启动子长度(图。gydF4y2Ba7.gydF4y2Baa).无论使用这四个不同长度启动子中的哪个启动子作为GUS驱动子,在三个不同组织中,GUS在根中的表达均最高。在根中,GUS表达量随启动子长度的减少而降低。不同长度启动子在叶片和茎中均无显著差异(gydF4y2BaP.gydF4y2Ba> 0.01)。转基因植物的GUS表达水平与PBI121载体(阳性对照)保持最高,甚至高于转基因植物gydF4y2BaEcGS1bgydF4y2Ba- p。阳性对照中不同组织没有显着差异(gydF4y2BaP.gydF4y2Ba> 0.01)。在阴性对照中,野生型和转基因植物的GUS活动几乎没有根部,叶和茎。gydF4y2Ba
确定GUS表达是否受gydF4y2BaEcGS1bgydF4y2Ba研究了不同光照强度(7000 Lux、3400 Lux、1700 Lux、暗)下,转基因烟草和野生型烟草根中GUS基因启动子的表达情况。如图所示。gydF4y2Ba7.gydF4y2BaB,在不同光强度观察到GUS表达的明显变化(gydF4y2BaP.gydF4y2Ba> 0.01),因此得出结论,GUS活性表达不受光强度的影响。在该实验中,我们还发现转基因烟草的GUS活性表达与长度有关gydF4y2BaEcGS1bgydF4y2Ba-P,确认长度越短gydF4y2BaEcGS1bgydF4y2Ba-P,GUS活动越低。gydF4y2Ba
表达gydF4y2BaEcGS1bgydF4y2Ba检测到存在gydF4y2Ba
总RNAgydF4y2BaE.沉默斯gydF4y2Ba提取,电泳验证,qRT-PCR检测gydF4y2BaEcGS1bgydF4y2Ba在不同的组织中。结果表明,相对表达gydF4y2BaEcGS1bgydF4y2Ba根部比茎和叶子更高(图。gydF4y2Ba8.gydF4y2Ba).没有显着差异gydF4y2BaEcGS1bgydF4y2Ba茎和叶的表达(gydF4y2BaP.gydF4y2Ba> 0.01)。gydF4y2Ba
讨论gydF4y2Ba
目前,研究gydF4y2BaE.沉默斯gydF4y2Ba主要专注于厌氧发酵,饲料资源,肥料资源,水处理和沼气生产[gydF4y2Ba31gydF4y2Ba那gydF4y2Ba32gydF4y2Ba].但目前对其生理生化特性的研究较少gydF4y2BaE.沉默斯gydF4y2Ba例如测定与N代谢有关的酶活性[gydF4y2Ba33gydF4y2Ba那gydF4y2Ba34gydF4y2Ba那gydF4y2Ba35gydF4y2Ba那gydF4y2Ba36gydF4y2Ba].此外,少数论文报告了关于机制gydF4y2BaE.沉默斯gydF4y2Ba在分子水平上[gydF4y2Ba37gydF4y2Ba那gydF4y2Ba38gydF4y2Ba].在我们之前的论文中[gydF4y2Ba38gydF4y2Ba,我们克隆了三个GS1基因gydF4y2BaE.沉默斯gydF4y2Ba并研究了它们在不同氮条件下的表达。在本研究中,我们从gydF4y2BaE.沉默斯gydF4y2Ba并分析了表达方式gydF4y2BaEcGS1bgydF4y2Ba调查法规gydF4y2BaEcGS1bgydF4y2Ba表达式。gydF4y2Ba
GS是N代谢过程中的关键酶,并且该途径的效率受其表达的影响[gydF4y2Ba14.gydF4y2Ba那gydF4y2Ba39gydF4y2Ba].通过转基因和基因沉默技术(如转基因和基因沉默技术)研究了GS1基因对作物生长和产量的影响[gydF4y2Ba40gydF4y2Ba那gydF4y2Ba41gydF4y2Ba].具有GS基因的转基因小麦植物中的冷轧,干旱,盐度和生物胁迫等逆变的根系干重,籽粒产率,氮抗性,比野生型植物中的逆转gydF4y2Ba42gydF4y2Ba那gydF4y2Ba43gydF4y2Ba].氮胁迫条件下GS植株的过表达仍能维持正常的光合效率[gydF4y2Ba44gydF4y2Ba],这有助于减少使用N肥料,制作更环保和经济的使用。转基因杨树过表达的GS1α基因的生长状态优于野生型杨树[gydF4y2Ba45gydF4y2Ba].但并不是所有的转基因植株都表现出了积极的效果。GS对转基因植株的影响与氮、碳代谢的协调有关[gydF4y2Ba46gydF4y2Ba].GS活动可能通过一系列机制下调,受环境条件强烈影响和代谢不平衡的机制[gydF4y2Ba39gydF4y2Ba].每个GS都有自己的表达机制,可以在不同植物的不同组织中适应不同的氮胁迫条件。因此研究GS的表达gydF4y2BaE.沉默斯gydF4y2Ba进一步探索GS在转录水平上的调控机制,有助于我们分析GS的功能,从而阐明水稻对水分氮的高效利用机制gydF4y2BaE.沉默斯gydF4y2Ba.gydF4y2Ba
根有许多特异性表达的基因,这些基因在根的结构和功能中起着重要的作用。例如,在拟南芥和李,根特异性基因gydF4y2BaDRO1gydF4y2Ba影响了根系统架构[gydF4y2Ba47gydF4y2Ba].在玉米中,9-Lipoxygenase ZmLOX3作为根特异性抑制因子控制了玉米对根结线虫的发育和抗性[gydF4y2Ba48gydF4y2Ba].启动子可在转录水平调控其下游基因的表达。例如,在拟南芥中gydF4y2BaAtgln1; 3gydF4y2Ba被MYB转录因子CCA1认识并绑定到预期的C供应[gydF4y2Ba49gydF4y2Ba那gydF4y2Ba50gydF4y2Ba].在水稻中,OsMYB55转录因子与水稻的启动子结合gydF4y2BaOSGS1; 2gydF4y2Ba在高温下启动氨基酸代谢的转录和介导调控[gydF4y2Ba51gydF4y2Ba].研究根特异性启动子可以促进基因在根中的基因功能分析,进一步控制植物发育和生长[gydF4y2Ba52gydF4y2Ba].根特异性启动子也可以应用于引发根特异性基因的转录,而不是在植物转基因育种过程中诸如35升启动子的组成型启动子[gydF4y2Ba53gydF4y2Ba].组织特异性启动子能够以空间控制的方式调节基因表达,以避免对转基因植物的不期望的影响或过量的能量成本。因此,寻找更多的组织特异性启动子并探索其调节机制对于转基因植物的繁殖中的组织特异性基因表达是重要的。采矿组织特异性启动子的努力主要集中在模型植物,作物和蔬菜,如拟南芥,米,玉米,番茄和土豆等。虽然这些水生更高的植物在修复中很重要,但很少有类似的研究生态工程中的富营养化水。gydF4y2Ba
在这项研究中,gydF4y2BaEcGS1bgydF4y2Ba-P从gydF4y2BaE.crassipesgydF4y2Ba用PlantCARE软件进行分离分析。结果表明,上游的启动子序列包含许多核心元素如着重(−30 bp)和CAAT-box(−96个基点),着重的距离或CAAT-box TSS符合描述的结果在先前的研究在其他植物启动子(gydF4y2Ba29gydF4y2Ba].除核心部件TATA-box和CAAT-box外,还有gydF4y2BaEcGS1bgydF4y2Ba-P还具有受光、热、激素和温度调控的根特异性功能基序和顺式作用元件,这也与以往的研究一致[gydF4y2Ba54gydF4y2Ba那gydF4y2Ba55gydF4y2Ba那gydF4y2Ba56gydF4y2Ba那gydF4y2Ba57gydF4y2Ba].值得注意的是gydF4y2BaGS1B.gydF4y2Ba启动子包含根特异性表达元素rootmotiftapox,其指示gydF4y2BaEcGS1bgydF4y2Ba可能是根优先表达基因。以前的研究报告了许多根特异性启动子或根 - 优先启动子,其含有rootmotiftapox1功能元素,其可以改善根部中的基因表达[gydF4y2Ba58gydF4y2Ba那gydF4y2Ba59gydF4y2Ba那gydF4y2Ba60gydF4y2Ba那gydF4y2Ba61gydF4y2Ba].gydF4y2Ba
通过组织化学分析和GUS活性的定量分析,验证了转基因烟草中GUS基因的功能gydF4y2BaEcGS1bgydF4y2Ba- p (gydF4y2Ba62gydF4y2Ba那gydF4y2Ba63gydF4y2Ba那gydF4y2Ba64gydF4y2Ba].我们发现GUS表达水平与启动子片段的长度有关。启动子片段越长,GUS表达量越高。这表明,没有负调控元素gydF4y2BaEcGS1bgydF4y2Ba- p。这与NIU等人和其他人的结果一致。牛牛的研究也表现出蓝色的颜色随着越来越减少而下降gydF4y2BazmpeamtgydF4y2Ba无胁迫条件下转基因烟草的启动子长度[gydF4y2Ba65gydF4y2Ba].5'截断的BVCPPOP(F3,F4和F5)还通过缩短启动子长度来驱动降低的GUS活动[gydF4y2Ba66gydF4y2Ba].然而,在Niu的研究中,非生物胁迫下GUS活性与启动子长度并没有正相关[gydF4y2Ba65gydF4y2Ba].Hongli Zhang还报道了467 BP(PZ7)核心片段的转录活性gydF4y2BaZIMPIS.gydF4y2BaPZ1-PZ8中的转基因烟草中的启动子仍然是最高的[gydF4y2Ba64gydF4y2Ba].在这些研究中,GUS活性水平的变化与启动子长度的那些变化不一致。这种矛盾的结论可能是由于启动子中不同功能元素的总效果。有些元素可能具有积极影响,而其他元素可能会产生负面影响[gydF4y2Ba67gydF4y2Ba那gydF4y2Ba68gydF4y2Ba].因此,对该启动子的核心元件和其他功能元件进行鉴定和表征,将有助于我们了解植物基因表达的分子调控机制,并进一步利用分子技术控制其表达。gydF4y2Ba
以往的研究表明,组织特异性启动子可以提高转基因植物组织中的GUS活性。叶片特异性GUS活性表达gydF4y2BaGapBgydF4y2Ba转基因烟草植物中的促进剂高于茎和根部的促进剂[gydF4y2Ba69gydF4y2Ba].绿色组织启动子的GUS表达gydF4y2Baorgsep.gydF4y2Ba在转基因植株的叶组织中保持较高水平gydF4y2Ba拟南芥gydF4y2Ba在不同的增长阶段[gydF4y2Ba70gydF4y2Ba].的endosperm-specificgydF4y2BaLPAATgydF4y2Ba启动子特别促进了转基因水稻胚乳中GUS的表达[gydF4y2Ba71gydF4y2Ba].花粉优先表达启动子gydF4y2BaOsUgp2gydF4y2Ba发现转基因水稻双核期花粉中GUS基因的高表达[gydF4y2Ba72gydF4y2Ba].我们对GUS染色结果的定性结果显示,GUS活性表达受gydF4y2BaEcGS1bgydF4y2Ba根系中-P含量最高。GUS基因在茎中无明显表达,在启动子较长的叶片中表达量较少。GUS活性表达定量结果和real-time RT-PCR实验结果与GUS染色定性结果一致。这些结果也与根系特异性基序ROOTMOTIFTAPOX1的存在相一致gydF4y2BaEcGS1bgydF4y2Ba上面已经分析过了。gydF4y2Ba
一般来说,GS基因启动子除了具有根系特异性基序外,还具有多种功能基序,因此其调控机制可能除了具有组织特异性外还较为复杂,这一点在之前的研究中已经有报道。GUS活动由595驱动gydF4y2BaRhVI1gydF4y2Ba和468.gydF4y2BaRhVI1gydF4y2Ba启动子在光照下比在黑暗中更高,这可能是由于芽中对光响应的启动子中存在关键的光响应元件GATA-box、I-box和GT-1box [gydF4y2Ba73gydF4y2Ba].绿色组织特异性的GUS活动gydF4y2BaCsVDEgydF4y2Ba在暴露于高光线4小时后,启动子增加,但在8小时照明后减少,其中包含许多光响应元件,如Box-I,Gag-MOTIF,G盒,AE-BOX,GA-MOTIF,SP1和GT-1主题[gydF4y2Ba74gydF4y2Ba].此外,SPAI和MYC2等下游信号成分的作用调节了不同组织中不同波长光中含有启动子的Z-box和G-box的GUS表达[gydF4y2Ba75gydF4y2Ba那gydF4y2Ba76gydF4y2Ba].虽然gydF4y2BaEcGS1bgydF4y2Ba启动子包含三个光响应元素Boxi,CHS-CMA1A和SP1,GUS活性表达水平的转基因植物gydF4y2BaEcGS1bgydF4y2Ba在我们的研究中没有通过不同的光强度诱导启动子。规定gydF4y2BaEcGS1bgydF4y2Ba启动子可能不受光控制,因为它是根系优先启动子。光响应元素可能是遗传进化遗留下来的。gydF4y2Ba
结论gydF4y2Ba
在本研究中,获得了一个1232bp的基因组片段gydF4y2BaEcGS1bgydF4y2Ba序列从gydF4y2BaEichhornia凤眼莲gydF4y2Ba已克隆,分析和功能特征。序列分析表明,其中存在核心元素、根特异性表达元素和其他功能元素。三个5'删除碎片gydF4y2BaEcGS1bgydF4y2Ba推动者(gydF4y2BaEcGS1bgydF4y2Ba短句来源-P)和1232 bp片段分别驱动GUS基因在烟草中的表达。定量检测和组织化学分析均显示,启动子长度越长,GUS活性越低。的GUS表达式gydF4y2BaEcGS1bgydF4y2Ba-P在根中明显高于叶子和茎的根本,表明gydF4y2BaEcGS1bgydF4y2Ba-P是根优先启动器。Real-time qRT-PCR分析gydF4y2BaEcGS1bgydF4y2Ba基因在根中也有较高的表达gydF4y2BaE.crassipesgydF4y2Ba而不是茎和叶。总共gydF4y2BaEcGS1bgydF4y2Ba-P是一种根优先启动子。本研究将有助于阐明监管机制gydF4y2BaEcGS1bgydF4y2Ba组织特异性表达及进一步研究其其他调控机制,以期利用gydF4y2BaE.crassipesgydF4y2Ba在富营养化水中的修复中,从营养代谢点控制其过度生长。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
E.crassipesgydF4y2Ba野生型,新叶2-3片,采自广东工业大学西区生活区附近的湖泊。这所大学的服务管理处允许我们抽样。这种植物材料是由傅mh博士鉴定的。该材料的凭证标本已在华南植物园保存。gydF4y2BaE.crassipesgydF4y2Ba在4l的容器中水培,溶液中含7mglgydF4y2Ba−1gydF4y2BaKHgydF4y2Ba2gydF4y2Ba宝gydF4y2Ba4.gydF4y2Ba24.5球型gydF4y2Ba−1gydF4y2BaMgSOgydF4y2Ba4.gydF4y2Ba·7小时gydF4y2Ba2gydF4y2Ba25.5 O,球型gydF4y2Ba−1gydF4y2Bakno.gydF4y2Ba3.gydF4y2Ba和59米gydF4y2Ba−1gydF4y2BaCa(不gydF4y2Ba3.gydF4y2Ba)gydF4y2Ba2gydF4y2Bah·4gydF4y2Ba2gydF4y2Bao,并每3天更换溶液。在栽培1-2周后,新的白色根部越来越多,新鲜的新根可用于提取DNA。gydF4y2Ba
烟草(gydF4y2Ba烟草benthamianagydF4y2Ba)在Murashige和Skoog(MS)培养基(pH 5.8)上萌发,含有0.8%琼脂,在25℃下,16小时光/ 8小时黑暗循环,并用于植物转化实验。转基因烟草在不同的照明(黑暗,7000勒克斯,3400勒克斯,1700勒克斯)下生长3天,然后用于执行GUS活动实验。gydF4y2Ba
孤立gydF4y2BaEcGS1bgydF4y2Ba- pgydF4y2Ba
使用GV-Plant基因组DNA提取试剂盒(GENVIEW)从水培系统中培养的植株中提取基因组DNA。1%琼脂糖凝胶电泳检测基因组DNA质量。PCR特异性引物设计(gydF4y2BaGS1B.gydF4y2BaSP1,gydF4y2BaGS1B.gydF4y2BaSP2,gydF4y2BaGS1B.gydF4y2BaSP3序列见表gydF4y2Ba2gydF4y2Ba)的基础是gydF4y2BaEcGS1bgydF4y2Ba序列(NCBI GeneBank登录号KJ881169)。Sangon Biotech合成了PCR特异性引物序列。5'-上游推动者区gydF4y2BaEcGS1bgydF4y2Ba采用基因组行走试剂盒(Takara)分离。50 μL,含5 μL DNA, 0.1 μmolgydF4y2Ba−1gydF4y2BadNTP 8 μL (10 mmolL .gydF4y2Ba−1gydF4y2Ba每个),5μL 10 x PCR缓冲,0.5μL LA Taq (5 U /μL)与下列条件:94°C 1分钟,1分钟98°C, 5 94°C的周期30年代,64.8°C 1分钟,2分钟72°C, 15周期94°C的30年代,25°C 3分钟,2分钟72°C;94°C 30 s, 64.8°C 1分钟,72°C 2分钟;30年代,94°C 64.8°C 1分钟,2分钟72°C,进入94°C 30年代,44°C 1分钟,2分钟72°C,最后10分钟到72°C。在那之后,1μL从主PCR产品是用作第二nested-PCR模板反应,剩下的是储存在−20°C。第二套PCR条件分别为94℃30 s、61.6℃1 min、72℃2 min,共15个循环;94°C 30 s, 61.6°C 1分钟,72°C 2分钟;30年代94°C, 1分钟44°C, 72°C 2分钟,然后进入10分钟。72°C和1μL从第二nested-PCR反应产物作为第三nested-PCR反应模板与下列条件:15周期94°C的30年代,64.6°C, 1分钟,2分钟72°C;94°C 30 s, 64.6°C 1分钟,72°C 2分钟;94°C for 30 s, 44°C for 1 min, 72°C for 2 min,然后进入72°C for 10 min。第三次巢式pcr反应产物使用琼脂糖凝胶DNA纯化试剂盒(TaKaRa)进行纯化,然后测序。gydF4y2Ba
分析gydF4y2BaEcGS1bgydF4y2Ba- p序列gydF4y2Ba
这gydF4y2BaEcGS1bgydF4y2Ba用NCBI的BLAST计划分析-PgydF4y2BaEcGS1bgydF4y2Ba- p序列。利用TSSP-TCM软件和PlantCARE (gydF4y2Bahttp://bioinformatics.psb.ugent.be/webtools/plantcare/html/gydF4y2Ba), 分别。gydF4y2Ba
质粒结构和植物转化gydF4y2Ba
一对引物(表中呈现的R1257和F66gydF4y2Ba2gydF4y2Ba)包含限制性位点gydF4y2Ba后gydF4y2BaIII和gydF4y2BaBAMgydF4y2Ba嗨被用来放大推定gydF4y2BaEcGS1bgydF4y2Ba将扩增片段克隆到pMD19-T载体中并测序。经pMD19-T载体与gydF4y2BaEcGS1bgydF4y2Ba磷被gydF4y2Ba后gydF4y2BaIII和gydF4y2BaBAMgydF4y2Ba你好,gydF4y2BaEcGS1bgydF4y2Ba-P亚克隆到pBI121中。类似地,另外3个5 '缺失促进因子gydF4y2BaEcGS1bgydF4y2Ba使用不同的引物(F340,F635和F838在表格中使用5'UTR(P900,P600和P400)以及表格gydF4y2Ba2gydF4y2Ba).克隆到pBI121上的不同启动子分别命名为p1200::GUS、p900::GUS、p600::GUS和p400::GUS。这些启动子结构被整合进gydF4y2Ba根癌土壤杆菌gydF4y2BaEHA105转化成烟叶盘。将pBI121和pBI101载体整合到EHA105中,分别转化烟草作为阳性对照和阴性对照。每个结构至少选择两个独立的转基因株系进行组织化学检测和GUS活性测定。gydF4y2Ba
GUS活性的组织化学测定gydF4y2Ba
不同转基因烟草叶片在25°C暗室中培养2天,然后用无菌水清洗5-6次。GUS表达的测定方法参照Jefferson [gydF4y2Ba77gydF4y2Ba].不同样品置于37℃GUS染色液中过夜。染色后将样品放入75%乙醇溶液中48 h,然后用肉眼和显微镜观察叶片脱色情况。gydF4y2Ba
GUS活动测量gydF4y2Ba
将转基因烟草的不同组织在N液中碾磨,然后放入GUS提取液(0.05 molLgydF4y2Ba−1gydF4y2BaNagydF4y2Ba2gydF4y2BaHPO.gydF4y2Ba4.gydF4y2Ba0.05摩尔gydF4y2Ba−1gydF4y2BangydF4y2Ba2gydF4y2Ba宝gydF4y2Ba4.gydF4y2Ba,0.01梅尔gydF4y2Ba−1gydF4y2BaEDTA,1mL 10%SDS,100μLTriton X-100和100μlβ-巯基乙醇,至100mL H.gydF4y2Ba2gydF4y2BaO)以100mg样品的比例为1ml GUS提取溶液。将混合样品以12,000g离心10分钟,然后使用50μl上清液用于GUS活性。此外,将20μl上清液转移到1.5ml离心管中,用于使用Bradford方法测量蛋白质浓度[gydF4y2Ba78gydF4y2Ba].在37℃加热后,将250μl反应溶液加入含有50μL上清液和200μLGUS反应缓冲液(加入25mL GUS提取溶液中的25mg 4-甲甲溶液)(4-Mug缓冲液2 mmoll后gydF4y2Ba−1gydF4y2Ba4-MUG)。然后将200 μL反应混合物溶液加入含有0.2 molL的1.8 mL停止缓冲液中gydF4y2Ba−1gydF4y2Ba纳科gydF4y2Ba3.gydF4y2Ba然后立即测量荧光水平。将剩余的反应混合物在37℃下孵育60 min,然后在停止缓冲液中加入200 μL反应混合物。4-甲基umbelliferone (4-MU)的荧光水平采用荧光分光光度计测定,激发/发射波长为350 nm/455 nm。然后根据标准曲线测定4-MU浓度。GUS活性为每分钟和每毫克蛋白4 mu nmol。将至少2个相同结构的不同品系的相同组织混合进行GUS活性测定,每个重复3次。数值以均数±标准差表示。采用SPSS 11.0软件(IBM, USA)采用Duncan方法检验差异的显著性。gydF4y2Ba
EcGS1bgydF4y2Ba实时QRT-PCR的表达分析gydF4y2Ba
CTAB使用植物RNA套件(华为阳生物技术)通过CTAB提取总RNA,然后除去混合基因组DNA。这用于使用Primescript TM RT试剂盒与GDNA橡皮擦(Takara)合成20μl反应混合物中的第一链cDNA。使用具有特定引物的SYBR PREMIX EXAQ™П(Takara)进行实时PCR,以及gydF4y2BaE.crassipesgydF4y2Baactin(登录号:KC505366)作为qRT-PCR的内参基因,规范目的基因的表达(引物qPCR-F, qPCR-R, Eact-F, Eact-R见表gydF4y2Ba2gydF4y2Ba).在Roche Lightcycler96 PCR仪器上进行实时PCR反应,下列条件:94℃,5分钟,30℃的30℃,58℃,30s,72℃,1分钟,1分钟,最后进入72°C 10分钟。QRT-PCR实施了三种生物学重复,并进行了三种技术复制。2gydF4y2Ba-ΔΔctgydF4y2Ba方法用于定量分析。数值以均数±标准差表示。采用SPSS 11.0软件(IBM, USA)采用Duncan方法检验差异的显著性。gydF4y2Ba
可用性数据和材料gydF4y2Ba
这gydF4y2BaEcGS1bgydF4y2Ba-P序列在NCBI的GenBank中沉积,并分配了登录号MT154418。可以使用以下链接访问此序列:gydF4y2Bahttps://www.ncbi.nlm.nih.gov/nuccore/mt154418gydF4y2Ba.本研究中产生或分析的所有其他数据均包含在这篇发表的文章中。gydF4y2Ba
缩写gydF4y2Ba
- GS:gydF4y2Ba
-
谷氨酰胺合成酶gydF4y2Ba
- E.crassipesgydF4y2Ba:gydF4y2Ba
-
Eichhornia凤眼莲gydF4y2Ba
- GUS:gydF4y2Ba
-
β葡萄糖醛酸酶gydF4y2Ba
- 存在:gydF4y2Ba
-
定量逆转录-聚合酶链反应gydF4y2Ba
- Gogat:gydF4y2Ba
-
谷氨酸合成酶gydF4y2Ba
- TSS:gydF4y2Ba
-
转录开始网站gydF4y2Ba
- 杯子:gydF4y2Ba
-
4-methylumbelliferyl -β-D-glucuronidegydF4y2Ba
- 小姐:gydF4y2Ba
-
Murashige和Skoog.gydF4y2Ba
- 4-MU:gydF4y2Ba
-
4-甲基伏丝gydF4y2Ba
参考gydF4y2Ba
- 1。gydF4y2Ba
燕舍,歌,郭jy。水产生态系统中侵入性水经济风信(Eichhornia rasipes)的管理和利用进展 - 综述。Crit Rev Biotechnol。2017; 37(2):218-28。gydF4y2Ba
- 2。gydF4y2Ba
Aboul-Enein AM, Al-Abd AM, Shalaby E, abull - ela F, Nasr-Allah AA, Mahmoud AM, El-Shemy HA。水葫芦:从水寄生虫到潜在的药物治疗。植物信号处理研究进展[j]。gydF4y2Ba
- 3.gydF4y2Ba
褚建军,丁勇,庄启军。我国水葫芦的入侵与防治。浙江大学学报(自然科学版)2006;7(8):623-6。gydF4y2Ba
- 4.gydF4y2Ba
水葫芦(Eichhornia Crassopes)和莴苣(Pistia Stratiotes)在水产养殖废水处理中的有效性评估。植物保护学报。2012;14(3):201-11。gydF4y2Ba
- 5.gydF4y2Ba
Henares MNP, Camargo AFM。水生浮游植物串联湿地养殖对虾的处理效果/水生浮游植物串联湿地养殖对虾的效果/水生浮游植物串联湿地养殖对虾的效果/水生浮游植物串联湿地养殖对虾的效果中国生物医学工程学报,2014;gydF4y2Ba
- 6.gydF4y2Ba
吴X,吴H,YE J.两个生态沟系统对中国软壳龟温室培养废水污染的净化效果。环境污染res int。2014; 21(8):5610-8。gydF4y2Ba
- 7.gydF4y2Ba
Rezania S,Ponraj M,Talaiekhozani A,Mohamad SE,DIN MFM,TAIB SM,Sabbagh F,Sairan FM。用水葫芦用水去除废水中的植物,有机和无机污染物的透视。J环境管理。2015; 163:125-33。gydF4y2Ba
- 8.gydF4y2Ba
Sipaúba-tavares LH,Florênciot,斯科洛丽 - Truzzi B.水产养殖生物废物作为文化培养培养Ankistrodesmus Gracilis(Reinsch)Korshikov。BRAZ J BIOL。2018; 78:579-87。gydF4y2Ba
- 9.gydF4y2Ba
[10]张国平,张国平,张国平,等。水葫芦生物转化过程中生物乙醇的研究进展[j] .中国生物医学工程学报,2014,33(1):1 - 5。生物技术。2016;6(1):70。gydF4y2Ba
- 10。gydF4y2Ba
卢伟,王聪,杨忠。水葫芦脱氢液化制备高热量燃料(HCF)。Bioresour抛光工艺。2009;100(24):6451 - 6。gydF4y2Ba
- 11.gydF4y2Ba
de Vasconcelos GA, Veras RM, de Lima SJ, Cardoso DB, de Castro SP, de Morais NN, Souza AC。Trop Anim Health Prod. 2016;48(3): 539-44。gydF4y2Ba
- 12.gydF4y2Ba
El-Shinnawi MM,El-Din MNA,El-Shimi Sa,Badawi Ma。沼气从作物残留物和水生杂草生产。恢复恢复。1989; 3(1):33-45。gydF4y2Ba
- 13.gydF4y2Ba
三岛D, Kuniki M, Sei K, Soda S, Ike M, Fujita M.从潜在能源作物:水葫芦(Eichhornia crassipes)和水莴苣(Pistia stratiotes L.)生产乙醇。Bioresour抛光工艺。2008;99(7):2495 - 500。gydF4y2Ba
- 14.gydF4y2Ba
Bernard SM, Habash DZ。胞质谷氨酰胺合成酶在氮同化和循环中的重要性。新植醇。2010;182(3):608 - 20。gydF4y2Ba
- 15.gydF4y2Ba
斯瓦布里克,德芬-普拉特尔M,辛德尔M,萨奇M,哈巴什DZ。草中谷氨酰胺合成酶研究的新进展。实验机器人。2011;62(4):1511-22。gydF4y2Ba
- 16.gydF4y2Ba
Van RJ,Belrhali H,Abratt V,Sewell Bt。III型谷氨酰胺合成酶的蛋白水解来自Brocilites Fragilis导致有利的晶体包装重排。Acta Crystallogr F. 2011; 67(3):358-63。gydF4y2Ba
- 17.gydF4y2Ba
Tingey SV,Walker El,Coruzzi Gm。豌豆的谷氨酰胺合成酶基因编码不同的多肽,其在叶子,根和结节中差异表达。Embo J. 1987; 6(1):1-9。gydF4y2Ba
- 18.gydF4y2Ba
谷氨酰胺合成酶对高等植物从器官到细胞的基因和蛋白质表达的调控。植物生理学杂志。1999;40(12):1187-93。gydF4y2Ba
- 19.gydF4y2Ba
张志勇,熊绍平,魏玉华,孟XD,王秀春,马晓明。谷氨酰胺合成酶同工酶在提高氮高效冬小麦氮素利用效率中的作用。Sci众议员2017;7:12。gydF4y2Ba
- 20.gydF4y2Ba
Caputo C,Criado MV,Roberts In,Gelso Ma,Barneix AJ。谷胺合成酶1和氨基酸在幼小小麦植物的韧皮中运输。植物理性生物生物。2009; 47(5):335-42。gydF4y2Ba
- 21.gydF4y2Ba
El Omari R, Rueda-Lopez M, Avila C, Crespillo R, Nhiri M, Canovas FM。高粱根中两种胞质谷氨酰胺合成酶的耐铵性及其调控。植物生物学杂志。2010;37(1):55-63。gydF4y2Ba
- 22。gydF4y2Ba
Goodall AJ, Kumar P, Tobin AK。大麦胞质谷氨酰胺合成酶基因的鉴定与表达分析。植物生理学杂志。2013;54(4):492-505。gydF4y2Ba
- 23。gydF4y2Ba
PN Benfey, Ren L, Chua NH。camv35s增强子亚域在植物发育早期的组织特异性表达。EMBO j . 1990; 9(6): 1677 - 84。gydF4y2Ba
- 24。gydF4y2Ba
Shahmuradov IA, Gammerman AJ, Hancock JM, Bramley PM, Solovyev VV。植物启动子序列数据库。中国生物医学工程学报,2003;31(1):114-7。gydF4y2Ba
- 25.gydF4y2Ba
Yamamoto YY,Ichida H,Matsui M,Obokata J,Sakurai T,Satou M,Seki M,Shinozaki K,Abe T.通过分析短序列分布局部分布植物启发子成分的鉴定。BMC基因组学。2007; 8(1):67。gydF4y2Ba
- 26.gydF4y2Ba
Prändl R, Schöffl F.热激元件参与烟草种子成熟过程中热激启动子的激活。植物生物学杂志。1996;31(1):157-62。gydF4y2Ba
- 27.gydF4y2Ba
Belintani Ng,Guerzoni JTS,Moreira RMP,Vieira Lge。通过在冷诱导型启动子下表达IPT基因来提高甘蔗的低温耐受性。Biol platarum。2012; 56(1):71-7。gydF4y2Ba
- 28.gydF4y2Ba
徐X,Guo S,Chen K,Song H,Liu J,Gu L,钱Q,王H.A 796 BP PSPR10基因启动子片段增加了烟草中非生物应力和信号分子下的GUS报告基因的根特异性表达.Biotechnol Lett。2010; 32(10):1533-9。gydF4y2Ba
- 29.gydF4y2Ba
一种与原核和真核DNA解旋酶相似的抑制因子控制着光合作用基因启动子上CAAT盒子结合复合体的组装。生物化学杂志。2001;276(26):23785-9。gydF4y2Ba
- 30.gydF4y2Ba
Joshi CP。79种植物基因推定塔塔盒与翻译开始域的域。核酸RES。1987; 15(16):6643-53。gydF4y2Ba
- 31.gydF4y2Ba
关键词:水葫芦,蓝藻菌,氮同化,氮吸收引用本文:Bioresour抛光工艺。2017;241:1197 - 200。gydF4y2Ba
- 32.gydF4y2Ba
张益,刘海,闫世,温XZ,秦HJ,王Z,张玉。用大型水葫芦栽培从超富士培养湖(中国)的磷去除。环境科学污染粉丝2019年; 26(13):12975-84。gydF4y2Ba
- 33.gydF4y2Ba
andrade hm,oliveira Ja,Farnese Fs,Ribeiro C,Silva Aa,Campos Fv,Neto JL。砷毒性:细胞信号传导及一氧化氮在Eichhornia沉思中的衰减效果。BIOL植物。2016; 60(1):173-80。gydF4y2Ba
- 34。gydF4y2Ba
De Souza Reis Inr,De Oliveira Ja,Ventrella MC,Otoni Wc,Marinato CS,De Matos LP。谷胱甘肽代谢在Eichhornia沉溺于砷的耐受性。植物BIOL。2020; 22(2):346-50。gydF4y2Ba
- 35。gydF4y2Ba
Malik A.环境挑战符见VIS机会:水葫芦的情况。环境int。2007; 33(1):122-38。gydF4y2Ba
- 36。gydF4y2Ba
Moura Júnior EG, Pott A, Severi W, Zickel CS。热带水库水位波动下水生植物生物量对湖沼变化的响应。中国生物医学工程学报,2019;gydF4y2Ba
- 37.gydF4y2Ba
[11]付敏,蒋玲,李艳,闫刚,金平。凤眼莲缺氮相关基因片段的鉴定。植物学报,2011,40(5):749 - 754。2014;62(4): 1637-48。gydF4y2Ba
- 38.gydF4y2Ba
关键词:凤眼莲,GS1a, GS1b, GS1c,氮源引用本文:关键词:生物信息学,遗传算法,生物信息学gydF4y2Ba
- 39.gydF4y2Ba
Thomsen HC, Eriksson D, Møller IS, Schjoerring JK。胞质谷氨酰胺合成酶:提高作物氮素利用效率的目标?植物生态学报,2014;gydF4y2Ba
- 40.gydF4y2Ba
高永杰,de Bang TC, Schjoerring JK。细胞质谷氨酰胺合成酶顺基因过表达提高了大麦在CO2升高条件下的氮素利用效率,防止了籽粒蛋白质的下降。植物生物技术学报(英文版);2019;gydF4y2Ba
- 41.gydF4y2Ba
胡我,赵xq,刘q,hong x,张w,张yj,太阳lj,李h,童捷。塑性谷氨酰胺合成酶的转基因表达增加了小麦中的氮吸收和产率。植物Biotechnol J. 2018; 16(11):1858-67。gydF4y2Ba
- 42.gydF4y2Ba
詹姆斯D,Borphukan B,Fartyal D,Ram B,Singho J,Manna M,Sheri V,Panditi V,Yadav R,Achary VMM等。同时过表达O F OSGS1; 1和OSGS2在转基因水稻中的基因(gydF4y2Ba奥雅萨苜蓿gydF4y2BaL.):对非生物胁迫耐受性的影响。植物科学。2018;9:19。gydF4y2Ba
- 43.gydF4y2Ba
俞高清,张扬,张泽,张继,魏毅,贾XT,王XC,马XM。探讨烟草增强干旱耐受性小麦细胞溶质和体液谷氨酰胺合成酶的分子机制的鉴定。植物理性生物化学。2020; 151:608-20。gydF4y2Ba
- 44.gydF4y2Ba
Fuentes Si。细胞溶质谷氨酰胺合成酶的过表达增加了低氮浓度的光合作用和生长。J Exp Bot。2001; 52(358):1071-81。gydF4y2Ba
- 45.gydF4y2Ba
Gallardo F,Fu J,Canton Fr,Garcia-Gutierrez A,Canovas FM,Kirby Eg。针叶树谷氨酰胺合成酶基因在转基因杨树中的表达。Planta。1999; 210(1):19-26。gydF4y2Ba
- 46。gydF4y2Ba
魏毅,施安,贾XT,张泽,马XM,古麦,孟XD,王XC。氮供应和叶龄影响由转基因烟草中的组成型启动子驱动的标签1或标签2的表达。基因。2018; 9(8):18。gydF4y2Ba
- 47。gydF4y2Ba
DRO1对拟南芥和Prunus根系结构的影响。工厂j . 2017, 89(6): 1093 - 105。gydF4y2Ba
- 48。gydF4y2Ba
高X,Starr J,GöbelC,Engelberth J,Feussner I,Tumlinson J,Kolomiets M.玉米9-脂氧合酶ZMLOX3对抗外防基因的开发,根特异性表达,以及根结线虫的抵抗力。莫尔植物微生物。2008; 21(1):98-109。gydF4y2Ba
- 49.gydF4y2Ba
Gutiérrezra。系统生物学增强植物氮营养。科学。2012; 336(6089):1673-5。gydF4y2Ba
- 50。gydF4y2Ba
Gutiérrez RA, Stokes TL, Thum K, Xu X, Obertello M, Katari MS, Tanurdzic M, Dean A, Nero DC, McClung CR, et al.;系统方法识别了一个由主时钟控制基因CCA1调控的有机氮响应基因网络。国家自然科学基金资助项目:国家自然科学基金资助项目:国家自然科学基金资助项目;gydF4y2Ba
- 51.gydF4y2Ba
El-Kereamy A,Bi Ym,Ranathunge K,Beatty ph,Good Ag,Rothstein SJ。水稻R2R3-MYB转录因子OSMYB55参与高温的耐受性,并调节氨基酸代谢。Plos一个。2012; 7(12):E52030。gydF4y2Ba
- 52.gydF4y2Ba
Klinkhammer I, Welter B, Leson L, Martyn A, Nauen J, Grabenhorst N, Mandelkow JF等。根特异性camalexin生物合成控制着多个菌株的植物促生长作用。中国科学院美国科学研究所2019;116(31):15735-44。gydF4y2Ba
- 53.gydF4y2Ba
Koyama T,Ono T,Shimizu M,Jinbo T,Mizuno R,Tomita K,Mitsukawa N,Kawazu T,Kimura T,Ohmiya K,等。拟南芥的启动子催化磷酸盐转运蛋白在水稻中驱动基因转基因的根特异性表达。J Biosci Bioeng。2005; 99(1):38-42。gydF4y2Ba
- 54.gydF4y2Ba
Chao D,Yuanchun M,Dan Z,Michael W,Zong-Ming C. Meta分析脱水响应元件结合家族基因对温度胁迫耐受性和相关反应的影响。前植物SCI。2018; 9:15。gydF4y2Ba
- 55.gydF4y2Ba
李Z,Srivastava r,唐家,郑z,豪威尔谢。CIS-效应条件诱导主要展开蛋白反应因子,ZMBZIP60响应于玉米热应激。前植物SCI。2018; 9:833。gydF4y2Ba
- 56.gydF4y2Ba
Nitz I,Berkefeld H,Puzio PS,Grundler FM。Pyk10,幼苗和根特异性基因和来自拟南芥的特异性基因和启动子。植物SCI。2001; 161(2):337-46。gydF4y2Ba
- 57.gydF4y2Ba
关键词:ABA,正反馈,种子,生物合成,信号转导植物j . 2014; 78(3): 527 - 39。gydF4y2Ba
- 58。gydF4y2Ba
关键词:拟南芥,萜烯合成酶,挥发性1,8-桉叶素,根特异性植物杂志。2004;135(4):1956 - 66。gydF4y2Ba
- 59。gydF4y2Ba
关键词:转基因拟南芥,毛状根,GmPRP2启动子,根优先表达中国生物医学工程学报,2014;gydF4y2Ba
- 60。gydF4y2Ba
娄X,李X,李阿,普米,嘘声M,刘d,孙j,张a,阳w。rht-b1i启动子的160bp插入在增加小麦高度时发挥着至关重要的作用。前植物SCI。2016; 7(307):307。gydF4y2Ba
- 61。gydF4y2Ba
Srivastava AC, Blancaflor EB。拟南芥胚后根发育需要folylpolyglutamate合成酶质体亚型。植物杂志。2011;155(5):1237 - 51。gydF4y2Ba
- 62。gydF4y2Ba
(1) Naqvi SMS: Naqvi SMS: Naqvi SMS: Naqvi SMS: Naqvi SMS;转基因分析显示5 '缩写的OsRGLP2启动子(s)对非生物胁迫具有响应性。生物科技摩尔》。2017;59(11 - 12):459 - 68。gydF4y2Ba
- 63.gydF4y2Ba
Siebantz B,Logemann J,Willmitzer L. Schell J:CIS-分析伤口诱导促进剂WUN1在转基因烟草植物中的组织化学定位。植物细胞。1989; 1(10):961-8。gydF4y2Ba
- 64.gydF4y2Ba
张H,Hou J,Jiang P,齐S,XU C,He Q,Ding Z,Wang Z,张k,Li K.鉴定玉米磷脂酰肌醇合成酶基因(ZMPIs)的467 BP启动子转基因烟草中的表达和盐度或渗透胁迫诱导性。前植物SCI。2016; 7:42。gydF4y2Ba
- 65.gydF4y2Ba
NIU GL,GOU W,HAN XL,秦C,张LX,ABOMOHRA AE,ASHRAF M.来自玉米磷乙醇胺甲基转移酶启动子的克隆和功能分析。int j mol sci。2018; 19(1):191-203。gydF4y2Ba
- 66.gydF4y2Ba
余泽,汉烨,小XG。一种从贝纳替肽的红瑞士甜菜中的PPO启动子,指示在生产植物中的外源基因的叶柄和根本优先表达。int j mol sci。2015; 16(11):27032-43。gydF4y2Ba
- 67.gydF4y2Ba
Rueda-Lopez M,Canivas R,Canovas FM,Avila C.通过单一DOF转录因子进行两种谷氨酰胺合成酶基因的差异调节。工厂J. 2008; 56(1):73-85。gydF4y2Ba
- 68.gydF4y2Ba
关键词:glnAp2,启动子,顺式调控元件,转录起始动力学中国生物医学工程学报。2016;44(22):10530-8。gydF4y2Ba
- 69.gydF4y2Ba
关键词:拟南芥,叶绿体甘油醛3-磷酸脱氢酶,B亚基,光响应区植物杂志。1994;105(1):357 - 67。gydF4y2Ba
- 70.gydF4y2Ba
acta botanica botanica(云南植物研究),2011,32 (5):589 - 593 . [11]中国生物医学工程学报。2018;19(7):2009-21。gydF4y2Ba
- 71.gydF4y2Ba
徐L,YE R,Zheng Y,Wang Z,周P,Lin Y,Li D.椰壳(Cocos Nucifera Lpaat基因启动子的分离及其在转基因水稻植物的功能分析及其功能分析。植物细胞批准。2010; 29(9):1061-8。gydF4y2Ba
- 72。gydF4y2Ba
黄泽,甘Z,李,李y,刘X,亩H.水稻晚期花粉丰富UDP-葡萄糖磷酸化酶(Osugp2)启动子的功能分析。Mol Biol rep。2011; 38(7):4291-302。gydF4y2Ba
- 73。gydF4y2Ba
Rabot A,ProTemer V,Peron T,MortReau E,LeDuc N,Hamama L,Coutos-anvenot P,Atanassova R,Sakr S,Le Gourrierec J.糖,光和嗜酸纤维素的相互作用在罗莎·蹄菌菌芳基转化酶1调节中的表达中。植物细胞生理。2014; 55(10):1734-48。gydF4y2Ba
- 74。gydF4y2Ba
关键词:拟南芥,黄瓜,紫黄质,去环氧化酶,启动子中国生物医学工程学报,2015;gydF4y2Ba
- 75.gydF4y2Ba
关键词:拟南芥,Z- box, G-box,光信号,启动子《公共科学图书馆•综合》。2013;8 (4):e62194。gydF4y2Ba
- 76.gydF4y2Ba
Hoecker U, Tepperman JM, Quail PH. SPA1,一个特定于光敏色素的wd重复蛋白信号转导。科学。1999;284(5413):496 - 9。gydF4y2Ba
- 77.gydF4y2Ba
杰斐逊镭,kavanagh ta,bevan mw。GUS Fusions:β-葡萄糖醛酸酶作为高等植物中的敏感和通用基因融合标记物。Embo J. 1987; 6(13):3901-7。gydF4y2Ba
- 78.gydF4y2Ba
布拉德福德mm。利用蛋白质染料结合原理定量微克数量蛋白质的快速敏感方法。肛门生物化学。1976; 72(1-2):248-54。gydF4y2Ba
致谢gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
这项工作由广州市科技项目提供资金(授予广东省201903010025)和科技规划项目(授予2016A010105020)。资金机构在设计和撰写稿件中的研究和收集,分析和解释方面没有作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
F-MH设计了这项研究并获得了资金支持。Z-YS和L-XD进行研究,分析数据并撰写草稿。他们对这篇论文有同样的贡献。D-ZW做了一些实验,并分析了一些数据。L-ZQ参与了稿件的修改和部分数据的分析。所有作者已阅读并批准最终稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
作者声明他们没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
钟勇,陆新,邓中。gydF4y2Ba等等。gydF4y2Ba谷氨酰胺合成酶1b的1232bp上游序列gydF4y2BaEichhornia凤眼莲gydF4y2Ba是根优先启动子序列。gydF4y2BaBMC植物杂志gydF4y2Ba21日,gydF4y2Ba66(2021)。https://doi.org/10.1186/s12870-021-02832-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
公认gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-02832-xgydF4y2Ba