摘要
背景
墨西哥被认为是辣椒种类的多样化中心,但这些作物易受病原体感染的影响炭疽菌通常会引起炭疽病和采后腐烂。对分离出的大肠杆菌菌株进行了研究炭疽菌在辣椒植物;然而,在生长条件下,微生物通常与其他微生物相互作用,导致其侵染植物根系的能力增加或减少C中国幼苗,从而导致疾病。
结果
接种24 h后,形态变化明显,主要由c . ignotum.在6 hai约6 hai发现高水平的二酰基甘油焦磷酸(DGPP)和磷脂酸(PA)。这个Se代谢变化可以与二酰基甘油激酶的高转录水平相关(cchdgk1.和CchDG31)对3、6、12 hai和病原菌基因标记物,如cchpr1.和CchPR5型。
结论
我们的数据构成了磷脂信号传导事件的第一种证据,特别是DGPP和PA参与磷脂酶C / DGK(PI-PLC / DGK)途径,在响应中辣椒到财团,对辣椒的防御反应提供了新的洞察抑制疾病。
背景
辣椒在墨西哥驯化,其中5种中有4种辣椒包括C弗鲁特森斯,C。阿努姆,C。短柔毛和C中国. 然而,C中国鉴于尤卡坦地区的定居者,包括传统用途,包括传统用途,包括传统用途,是吉利唯一的辣椒思想。在现场条件下,这些作物易于病原体感染,其中特别注意炭疽菌spp。
这个炭疽菌属与炭疽病疾病和采后腐烂在各种热带,亚热带和温带水果,农作物和观赏植物中有关[1.,2.,3.,4.].
物种,例如C阿库塔图姆,C。博尼内斯,c . brevisporum,C凯恩森,C。辣椒,C。君子兰,C。球茎,C。德马蒂姆,C。果珊瑚,C昆士兰州。斯科维莱,C. Siamense,C. Simmondsii,C. Truncatum,和C球孢子已在中检测到辣椒spp。患有炭疽病症状的植物[5.,6.,7.].
作用机理炭疽菌感染与防御机制辣椒已从与孤立进行的研究报告炭疽菌菌株[8.,9].
在植物-病原体相互作用过程中,精确的信号传递过程对于植物的成功适应和生存是必不可少的。目前有很多关于宿主植物防御系统和病原入侵效应因子及其激素相关途径的研究,如水杨酸(SA)和茉莉酸(JA) [10,11,12,13,14,15].然而,只有少数关于与对病原体的反应相关的磷脂信号转导途径有关,特别是涉及磷脂衍生分子作为第二信使的途径,或过敏反应(HR)[16,17].磷脂酸是一种非常重要的信号分子,可以调节激酶,磷酸酶,磷脂磷脂和其他蛋白质的活性,涉及膜运输,钙信号传导和生物和非生物应激反应[18,19,20.].
在以前的研究中,我们评估了水杨酸和茉莉酸甲酯(MJ)对磷脂信号传导的影响C中国Jacq。细胞悬液的文化。SA可抑制磷脂酶C (PLC)和磷脂酶D (PLD)活性,而MJ可增加这两种磷脂酶活性[20.]. 关于超敏反应,PA含量与HR和磷脂酶信号在防御反应线(烟草植株的疾病抑制1,DS1)过度激活中的开始有关,这些防御反应线受到青枯菌[17,21.]. 研究了PA和焦磷酸二酰甘油(DGPP)在番茄悬浮细胞中的瞬时积累[22.,23.].用病原体引发剂处理的细胞显示出高水平的PA,随后将其代谢为DGPP [22.].当添加DGPP和PA时,在缺乏激发子的情况下观察到了激发子应答基因的表达诱导[23.].
植物根系与根际存在的微生物建立了关系。这些相互作用可涉及有益或致病微生物[24.,25.].这两种类型的相互作用触发一个复杂的反应,决定了致病性增殖和发育的成功。近年来,植物细胞对病原微生物的响应研究主要采用单一病原种类[26.,27.,28.,29.].然而,细胞反应在现场条件下更复杂,因为微生物倾向于形成具有相容的微生物的子组件[30.]. 这些微生物可能对感染的发生和发展具有抑制或协同作用。在这里,我们建议研究从腐烂的根和果实中分离的微生物群落的细胞和生化反应C中国植物。
在目前的工作中,一个C中国悬浮细胞系统用于研究磷脂信号通路在联合感染反应中的作用。我们试图首先将重要的磷脂衍生分子的产生与相关基因的表达联系起来,以响应来自C中国植物为了了解在相互作用期间发生的磷脂信号转导C中国悬浮细胞和微生物联合体,主要由c . ignotum(93.6%).
材料
放射性标记的(32.γ-ATP来源于英国Amersham Pharmacia Biotech公司。bicinchoninic acid (BCA)蛋白检测试剂购自Pierce Chemical Co., Ltd,其他化学品由Sigma Aldrich提供。Murashige和Skoog (MS)培养基由植物技术公司提供。商业化的Zimo biomics DNA试剂盒购自Zimo Research。氯仿、甲醇、吡啶、甲酸购自J.T. Baker Co.。薄层色谱板由Merck®提供。
生物材料
黄灯笼辣椒通过对MS中的愈伤组织和培养的分解获得细胞悬浮液[31.] pH值5.6。根据以前的报道,该培养基中添加了0.5 mM肌醇、0.02 mM硫胺素、0.2 mM半胱氨酸、4 μM 2,4-二氯苯氧乙酸和3%蔗糖[20.].如之前报道的,细胞每14天传代培养一次[20.]在摇动中成长(100 rpm)在连续光照下25 摄氏度。
该菌群来源于植物根际C中国植物来自尤卡坦,墨西哥的症状。为了生长微生物联盟,由Dhingra和Burton描述了使用的方法[32.]. 财团(菌丝体)维持在25 在黑暗中,在改良琼脂培养基(2%Bacto琼脂,10%蔬菜汁(Herdez V8果汁,含8种蔬菜,胡萝卜、番茄、甜菜根、菠菜、甘蓝/卷心菜、芹菜、欧芹和柠檬汁)上培养90°C,以获得生殖结构[33.,34.]. 在培养皿中培养微生物群落;材料被水浸没,用无菌载玻片的末端报废。所得悬浮液经50%过滤 μm米拉布,如Sharma等人(2015)所述[35.]37℃孵育 3°C h、 正如希普顿(1985)所建议的那样[36.].
然后,维持在4 °C,使用前再次过滤[37.].滤液称为共分悬浮液(Cs,细胞/ ml)。为了标准化感染实验中使用的接种量,数量c . ignotum分枝蔓是量化的。所使用的所有CS通过在95℃下加热10分钟来衰减。
通过下一代测序分析联盟微生物图谱
使用商业化的Zimo biomics DNA试剂盒(Zimo Research)从微生物菌群中进行DNA分离。用1%溴化乙锭(0.01%)琼脂糖电泳检测提取的DNA质量,并在紫外光下观察。DNA样本送往LABSERGEN (CINVESTAV)进行分析,核糖体内部转录间隔区(智能交通系统)区域或16S扩增子以300,000个成对的末端读取产生,产生MISEQ序列。使用ReadPipeline和MG_RAST进行生物信息学分析[38.]. 通过大规模爆破对菌株进行鉴定[39.]在MG\ U RAST中搜索[38.],并使用以下数据库确定每个菌株的分类:生命百科全书(http://www.eol.org/) [40],微生物的全球目录(http://gcm.wfcc.info) [41.]综合分类信息系统(https://www.itis.gov/) [42.]和牲畜(http://lifemap-ncbi.univ-lyon1.fr/) [43.].
接种过程
为了接种过程,一克C中国将细胞(FW)悬浮在25ml新鲜的MS培养基中,并在CS加入之前使其在相同的培养条件下(在连续光以在100rpm以100rpm处的25℃)静置30分钟。使用不同浓度的原始Cs进行接种(1×101.1. × 104.或1×108.)在无菌条件下。这些浓度是根据以前的实验报告选择的炭疽菌[44.]. 在特定时间段(感染后数小时或hai后数小时)后采集细胞进行不同的分析;i、 e.第12、24和48页 h表示形态特征;1、3、6和12 h表示转录物丰度或6 h用于脂质定量。用于形态学特征、基因表达分析和脂质分析的cs浓度为1 × 104.细胞/毫升。
ePifoforegance分析
悬浮细胞C中国感染(或未感染)联合体,用0.1%磷酸盐缓冲液(PBS)冲洗三次 M和pH 将悬浮液在PBS中稀释1:10。细胞用以下染料染色:1 微米4′,6-二氨基-2-苯基吲哚盐酸盐(DAPI)(Sigma)核;1.76μmfm4-64染料(N-(3-三乙基氨丙基)-4-(6-(4-(二乙氨基)苯基)己三烯基)吡啶二溴化铵™) 内质膜;10 μM细胞膜™ 质膜染色(分子探针)™) 对于质膜,和2 μM钙氟白色染色剂(WCF)(Fluka™) 为了细胞壁。30岁以后 室温孵育min后,通过荧光显微镜观察荧光(Axioplan,蔡司,德国)。
细胞固定和扫描电子显微镜
对于扫描电子显微镜(SEM), MS培养基被丢弃,和C中国用PBS洗涤细胞(以消除任何MS培养基左),并在25℃下用40%甲醛,50%乙醇,5%乙酸,5%蒸馏水(FAA溶液),每3例温和搅拌 h. The samples were washed with PBS to eliminate the FAA solution. The cells were dehydrated in ethanol solutions in a sequential gradient of 30, 50, 70, 96, and 100% ethanol for 12, 12, 3, 2 and 1 h, respectively. After the cells were fixed, the samples were dried to the critical point with liquid CO2.使用Sandri-795临界点烘干机(Tousimis),镀金(Denton真空书桌II),并使用SEM (JEOL JSM 660lv)观察。
细胞活力测定
C中国感染联合体的悬浮细胞用磷酸盐缓冲液洗涤3次,1小时后再悬浮 mL PBS并轻轻混合。然后,3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化铵(MTT)[45.](Sigma)溶液添加至0.5的最终浓度 毫克 毫升- 1,并将混合物在25℃下在黑暗中孵育8小时。该方法是比色测定法可以基于吸光度测量来量化。评估活性细胞与活性代谢转化为甲烷盐的活性细胞作为细胞内部沉淀物的能力。将MTT用1.5ml甲醇溶液(50%终浓度)溶解,并在60℃下将细胞与该溶液温育30分钟。最后,将细胞以1500×g离心5分钟。回收上清液,用甲醇洗涤5或6次并混合以确定570nm处的吸光度。
蛋白质的提取和定量
冻结C中国以前感染或不感染的细胞在液氮中粉碎,用溶液(50mM HEPES,pH 7.2,0.25m蔗糖,5mMKCl和1mM EDTA)均化(1μgmL- 1亮肽,1 mM-苯基甲基磺酰氟(PMSF)和1 微克 毫升- 1aprotinine) [46.]. 提取物以20000×g离心30分钟 4分钟 °C,上清液以105000 x g离心1小时 h在4 摄氏度。所得沉淀物(膜部分)在200℃下再悬浮 50μL 嗯,赫普斯,pH 7.4. 用改进的双肌酸蛋白质测定试剂测定提取物中的蛋白质浓度[47.]以牛血清白蛋白(BSA)为标准。同样的条件用于蛋白质提取和cs的定量。
脂质激酶活性
脂质激酶的活性在[32.P] γ-ATP掺入相应的内源性底物[48.].Racagni-Di Palma等人报道了磷酸化实验[47.使用50 mM HEPES反应混合物,pH 7.4, 1 mM EDTA, 10 mM氯化镁2.,1mm ATP,0.2mM钒酸钠,0.5mm DTT,[32.γ-ATP (370 MBq)和80 μg膜组分蛋白。在30℃下孵育2 min,加入1.5 mL氯仿:甲醇(1:2,v/v)终止反应。
脂质提取与分离
提取脂质并进行碱性TLC以分离不同的磷脂物质。如先前通过Racagni-di Palma等人所述进行脂质提取。[46.]. 在每个样品中,0.5 2.4毫升 N HCl和0.5 加入mL氯仿,然后小心地提取底相并与2 1毫升 N甲醇:HCl(1:1,v/v)。将脂质在真空下干燥并在200℃下再悬浮 μL氯仿:甲醇(9:1,v/v)。最后,用薄层色谱(TLC)板浸渍溶液I[1%草酸钾,2]分析脂质 mM EDTA,甲醇:水(2:3,v/v)],活化40分钟 110分钟 摄氏度。用氯仿:甲醇:丙酮:乙酸:水(40:15:14:12:7,v/v)和氯仿:吡啶:甲酸(35:30:7,v/v)的溶液分别展开薄层色谱的第一和第二维度[46.]. 通过放射自显影确定放射性标记脂质的位置。
系统发育分析
使用从SOL基因组学网络数据库获得的完整氨基酸序列对DGK蛋白进行系统发育测试(https://www.sgn.cornell.edu/) [49.]. 使用ClustalW对序列进行比对[50.]并以MEGA 6显示[51.]软件,采用最大似然法,鲁棒性为1000个自助复制。这个C中国DGK同系物DGK1,Dgk2, dgk3, dgk5, dgk5l, dgk6和DGK7对番茄中的蛋白质进行了预测(美国lycopersicumITAG版本2.4),咖啡(C. Canephora.v1.0)和拟南芥获取它们的系统发育关系。
基因表达分析及数据分析
细胞培养C中国用1×10感染1,3,6和12小时4.CS,并分析了联盟。对于表达分析,使用Trizol TM RNA试剂(Invitrogen TM)分离RNA,并使用500ng的总RNA合成cDNA,再助助剂逆转录酶(Thermo Scientific)。对于逆转录定量聚合酶链反应(RT-QPCR)测定,使用Maxima Sybr Green / Rox QPCR主混合物(Thermo Sciencific)和Pikoreal 24实时PCR系统进行扩增(Thermo Fisher Scientific,Ratatsie 2,FI-01620 Vantaa,芬兰)。RT-QPCR的条件如下:1)初始变性步骤在95℃下10分钟;2)在95℃下进行两步循环40秒,TM为40秒,每个基因为40或45个循环;3)最终熔化曲线从56℃〜95℃。使用的引物是基于辣椒基因组序列设计的(c .建立简历。CM334基因组CDS)并进行测试C中国作为CCHDGK1,CCHDGK3,CCHNPC6,CCHPR1A,CCHPR5,CCHTUBA和CchEF2a3L型分别(表s1.).最后,对于折叠变化确定,a 2−ΔCT方法采用个别效率修正计算[52.],卡图巴和CchEF2a3L型作为参考基因。
结果
微生物谱分析
孤立的财团来自腐烂的根源C中国幼苗通过NGS鉴定存在的微生物。元数据存储在NCBI数据库中,注册号为PRJNA479448。序列的生物信息学分析使我们能够鉴定这个联合体中存在的微生物,并且c . ignotum占绝大多数的真核微生物(图S1.),而原核生物的优势属为伯曲面(图S)2.), 如Barnesiella sp.,Alistipessp ., Pantoea sp.,不动杆菌sp.,副弧菌属,马氏克鲁维酵母菌属,地毛半乳酵母菌属,Glomus sp., Exophiala sp.,限流马拉色菌属,胎盘后,艾尔merina caryae, Faecalibacterium,梭菌IV, Halanaerobium,细孔菌,Phascolarctobacterium, Phascolarctobacterium,玫瑰螺旋体,Desilfonatronovibrio,链球菌,(小于3%;S1)与从ITS扩增子获得的读数相比,从16S获得的读数比例较低,这并不限制它们与植物或大多数菌株的关系。因此,我们认为所确定的微生物集合作为一个财团。
感染机构
为了了解寄主和病原体之间的关系,C中国悬浮细胞接种的微生物群落主要包括c . ignotum.首先,我们通过确定感染条件和取样时间开始,这些时间是在形态学水平,生长率和/或死亡的恶化的对比响应中,因此可以提供有关调查主题的更多信息。
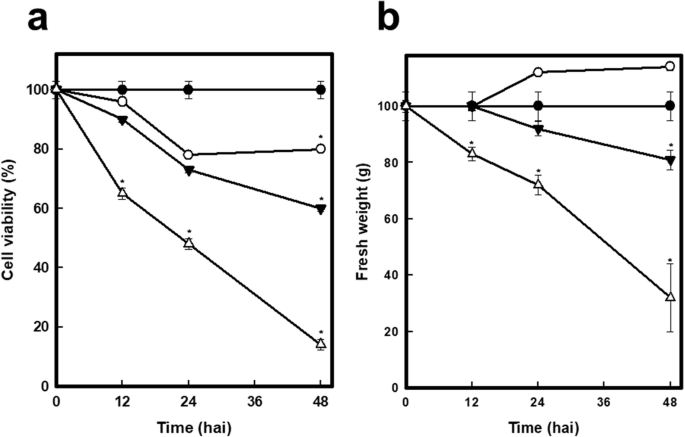
C中国感染了a1的细胞 × 108.cs(空三角形)在接种12 h后活力下降约35%,在接种24 h和48 h后活力分别下降高达50和90%。1.一种)。用1×10治疗4.cs(实心三角形)在12、24和48岁时分别减少了约15%、30%和40% 接种后1h,而接种a1 × 101.cs(开放圆),没有得到明显的趋势(图。1.a).活力的下降也与鲜重的下降有关(图1)。1.b).当细胞暴露于最浓cs时,细胞活力和鲜重下降更大(1 × 10)8.cs)。最后是1 × 104.cs使我们在24和48小时后产生轻微(30%)和/或严重的细胞损伤(50%) 治疗时间分别为1小时。
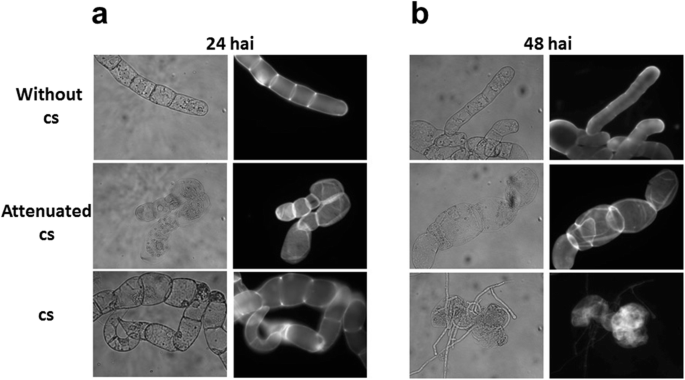
的图像C中国在24小时后,悬浮细胞在微生物联合体的存在下表现出扩大的细胞表型 在48小时时有更清晰的表型 与对照细胞相比(图。2.,3.).有趣的是,当一个活菌群与减毒菌群比较时,这两个菌群对放大细胞表型表现出相同的反应(图。2.). 最后,48岁 接种a1后h × 108.cs,细胞培养呈深棕色,无活力(数据未显示)。
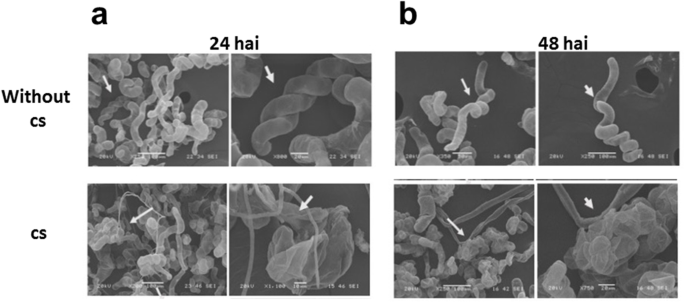
关于病原体,联盟在12小时后显示出显着的生长量;在接种时,在1×10时,在接种后48小时观察到亚腿丰度的重大变化4.使用cs(图。2.,3.), 1 × 10时菌丝丰度增加8.使用cs(数据未显示)。
感染过程中的形态学变化
C中国分别于24和48小时后接种细胞,观察悬浮细胞形态 h带1 × 104.来自微生物菌群的碳。接种24 h后,细胞呈现膨胀度增加、菌丝丰度降低等变化C中国分别为细胞和微生物菌团(图。3.).一些C中国当接种1×10时,细胞开始表现出破坏8.铯(6) h治疗后,数据未显示)。
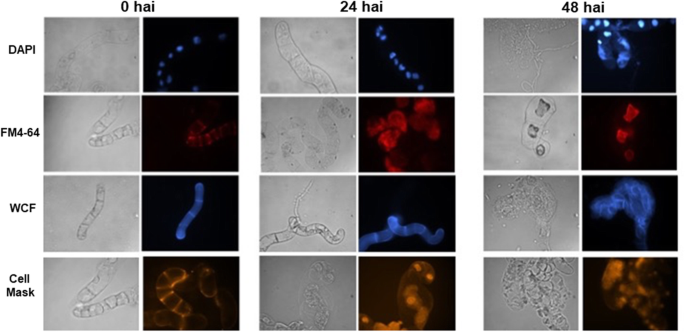
另一方面,用荧光团观察细胞壁(WCF)、细胞膜(CellMask)、内质膜(FM4-64)和DNA完整性(DAPI);图。4.).在没有联盟的实验期间,结构的结构C中国在模拟接种(未处理的细胞)(MS培养基)24至48小时后,细胞保持不变(图。4.). 当C中国接种细胞,它们在接种后表现出对等离子体和内质网膜的损害甚至12小时(图。4.).然而,接种后48小时,对膜(血浆和内质)和细胞壁的损伤严重(图。4.).
DAPI对DNA完整性的评价显示,24小时前 接种后48小时,细胞积累中度DNA损伤,DNA聚集和断裂 h(图。4.).
脂质激酶活性的变化涉及感染事件
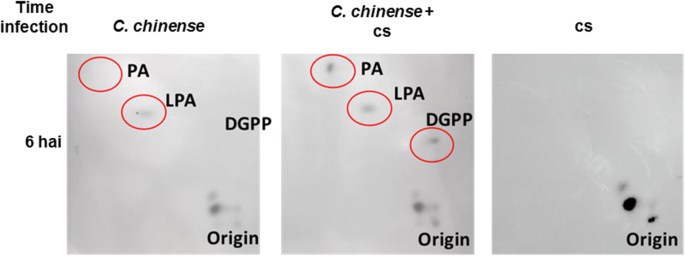
微生物群落对大豆磷脂衍生分子的影响C中国细胞被评估。无论有无菌体(1 × 104.CS)。测定脂质激酶活动。我们观察到,在6个Hai,接种细胞中Pa,溶血磷脂酸(LPA)和DGPP水平高于未处理的细胞(图。5.).
接下来,分析了感染事件期间DGK基因的转录谱,并进行了系统发育试验。在Silico搜索中,至少7个DGK同源物(CanDGK1、CanDGK2、CanDGK3、CanDGK6、CanDGK6-L、CanDGK6-L2和CanDGK7)都是在c .建立基因组(c .建立CV CM334基因组CDS)。这些良好的注释序列被用来保证设计的引物用于找到功能基因(图S3.).
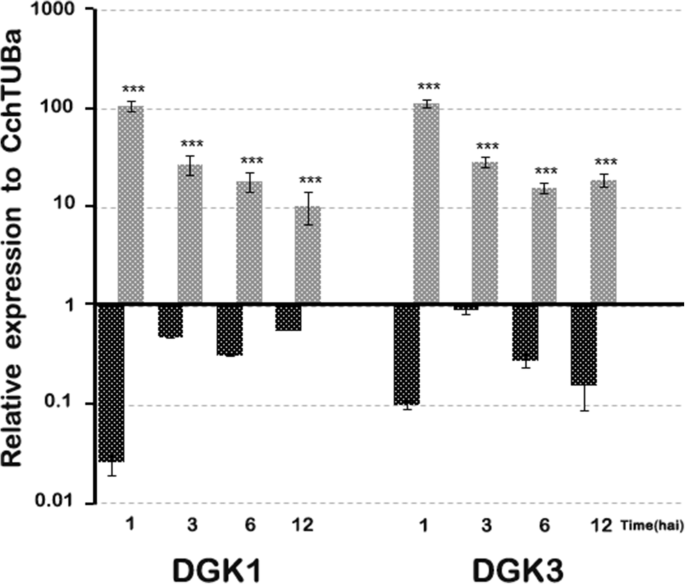
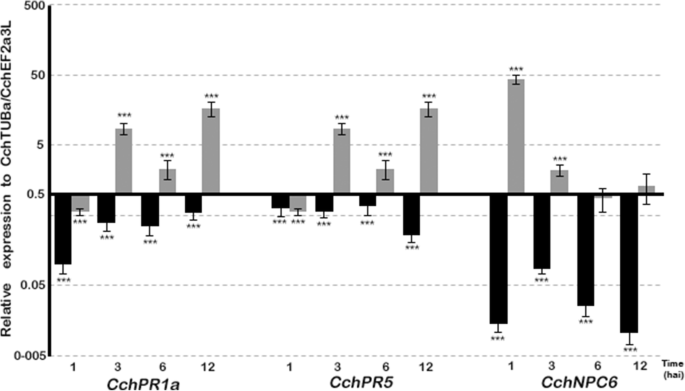
DGK同源物的基因的表达水平(cchdgk1.和Cchdgk3.),非特异性PLC(cchnpc6.)以及与发病机制相关的基因,如Pr(CchPR1a型和Cchpr5.)在12小时之前的几个感染阶段进行了监测,考虑到此时,细胞显示出形态变化,没有表现出广泛的损伤或细胞死亡。cchdgk1.和Cchdgk3.基因在接种后的第一个小时内显示出在成绩单中的最大增加,并且它们在最多12个海中保持增强表达C中国悬浮细胞用1×10攻击4.cs(图。7.).在未治疗的细胞中,两者cchdgk1.和Cchdgk3.在1hai后表现出一种重要的抑制作用(图。7.). 关于发病相关基因CchPR1a型和Cchpr5.1 Hai后,基因被压抑。此外,两种基因显示出高达12个海的增强表达,但比DKG同源物更低(图。8.).CchPR1a型和CcPR5公司在未处理的细胞中,在最初的12小时内显示出轻微的抑制(图。8.).值得注意的是提到这一点cchnpc6.在1小时后也呈现缓慢增加,随后减少(图。8.).
来自植物的DGK的系统发育测定显示3个明确的群体。第一个包括DGK1和DGK2(图S3., 穿蓝色衣服);第二包括DGK3和DGK7(图S3.,绿色);DGK6、DGK6-L和DGK6-L2在最后一组(图S)3.,红色)。
讨论
植物与病原微生物相互作用的机制已有许多作者报道;然而,为了再现在我们的研究模型中所发生的那些相互作用,我们必须考虑植物的根与微生物的共生体相互作用,以获得更广泛的植物微生物群落关系的观点。在目前的工作中,我们分离了一个联合体,然后通过宏基因组分析对其进行了表征,并将其应用于肿瘤细胞模型C中国,允许我们观察通过这种交互激活的细胞信令。偏心组合揭示了主要的微生物存在是淡色炭疽菌,与水果中的炭疽病有关[53.].
在本研究建立的体外感染系统中,所有C中国悬浮液中生长的细胞表现出相同的感染概率。可以将定义量的CS添加到标准化量中C中国在不同的时间用显微镜观察感染细胞(图。2.,3.和4.).接种后不久,菌丝穿透细胞,观察到初次感染和感染的影响,如细胞壁的恶化和质膜的崩溃,随后出现核碎裂的阶段(图)。3.和4.).细胞的破坏可能是由接种菌体引起的程序性细胞死亡引起的。相反,接种48 h后,植物细胞与菌丝的比例发生了完全逆转C中国当微生物群落达到最大的菌丝群时,细胞死亡(图。3.).
细胞壁的损伤可能是由于纤维素酶和果胶酶的分泌导致的,这些纤维素酶和果胶酶通过蛋白酶促进宿主的最初渗透和感染,从而降解细胞壁。2004年(54.KIM和合作者观察到核的变化和结构变化与果实的过敏反应相关辣椒。杰朱耶雷(易受影响)和Capsicum Baccatum.简历。接种炭疽病菌的PBC80(抗性)Collettrichum gleooosporioides,观察了病原菌分泌的酶对细胞壁的降解。胞质膜与细胞壁分离,内质网肿胀,液泡内密集包体堆积,胞质空泡化,胞质碎裂,DNA碎裂。因此,我们的结果表明,细胞壁损伤是病原菌攻击(cs)的特征C中国.
西非和同事[55.]观察到细胞活力降低和细胞悬浮液形态的变化Phytophthora Infestans..这些细胞在感染期间的变化是由于活性氧的形成,特别是产生脂质过氧化的高侵袭性氧自由基[56.,57.].cs在C中国产生的细胞死亡增加随着时间的推移而变得明显。
在本研究中,观察到细胞的结构损伤C中国(图。3.和4.)可能来源于主要发生在质膜中的各种生化事件。例如,不饱和脂肪酸可以被氧化并从脂质双层中清除,因为ROS (H2.O2.),作为细胞对病原体攻击的初始反应而产生,可触发脂氧合酶的激活[57.,58.].
在植物中,PA和DGPP被公认为是信号通路的第二信使,并对生物和非生物胁迫做出响应[19,22.,59.,60.,61.,62.]. 如前所述,当C中国悬浮细胞接种了一个微生物联合体,主要包括c . ignotum.许多作者报道,PA随后代谢成DGPP,以应对许多类型的生物或非生物胁迫,如病原体[21.]水赤字[59.]真菌诱导子[22.]、渗透胁迫[63.],节点因子[64.]盐胁迫[65.].
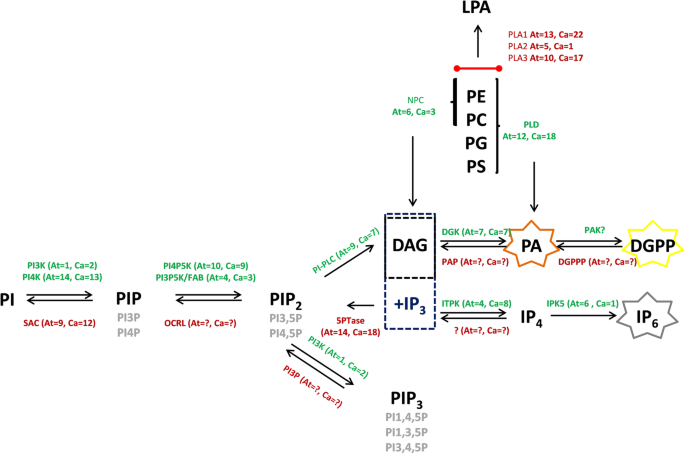
在植物中,磷酸化形式的PA和DGPP已经开始以涉及许多压力响应的信号分子来获得重要性[66.].在这里,我们报告了PI-PLC / DGK磷脂途径的推定活性和由PIP或PIP产生的磷脂衍生的分子2.水解形成第二信使,如PA和DGPP,最终调用下游信号传导反应对感染。通常,检测到的PA可以通过两种不同的途径获得:涉及PLD的一种,其通过水解诸如磷脂酰胆碱(PC)的结构磷脂直接产生PA,而另一个涉及产生DAG的PI-PLC,并且DAG随后磷酸化通过PLC / DGK的动作到PA [67.] (图。6.).然而,响应于病原体效应的病原体效应,增加了与PI-PLC / DGK活性相关的PA积累的证据表明[22.,68.],具体效果来自假单胞菌含油[69.]真菌,例如黄枝孢[67.] 和灰葡萄孢[70]. 以这种方式,可能在感染的第一阶段通过PIP转化产生PLC/DGK活性产生的PA(6) 接种后1h)。
通过磷酸化和去磷酸化介导的不同途径和互连反应的PA和DGPP的生产。绿色表示磷酸化反应,红色表示去磷酸化反应。其他颜色表示这些途径中的关键酶。在磷酸化途径:PI3K或PI4K,磷脂酰肌醇3-激酶或4-激酶分别;PI4P5K,磷脂酰肌醇4-磷酸5-激酶;PI3P5K,磷脂酰肌醇3-磷酸5-激酶;ITPK,肌醇四磷酸1-激酶;IPK5,肌醇五磷酸二磷酸2-激酶和DGK,二酰基甘油激酶。在去磷酸化途径:罂粟,磷脂酸磷酸酶;5ptase,肌醇多磷酸5-磷酸酶; PI3P phosphatidylinositol 3-phosphatase and PI5P, phosphatidylinositol 5-phosphatase. Key enzymes: PLD, phospholipase D; NPC, nonspecific phospholipase C; PI-PLC, phosphatidylinositol-specific phospholipase C and PLA, phospholipase A. PI, phosphatidylinositol; PIP, phosphatidylinositol phosphate; PIP2.,磷脂酰肌醇二磷酸盐;pip3.,磷脂酰肌醇三磷酸盐;DAG,二酰基甘油;Pa,磷脂酸;DGPP,二酰基甘油焦磷酸盐;IPX,肌醇多磷酸盐;PC,磷脂酰胆碱;Pe,磷脂酰乙醇胺;Pg,磷脂酰甘油和ps,磷脂酰丝氨酸
PA可能导致PIP2.通过PI-PLC活性转化,通过直接水解PIP2.或PIP到PIP的初始转换2.通过磷脂酰肌醇4-磷酸5激酶(PIP5K)的活性(图。6.) [71.,72.,73.].但是,LPA的水平(图。5.)与对照细胞相比未显示出显著变化,和/或磷脂酶A(PLA)活性通过可能涉及PA转换的途径产生微小变化(图。6.).在所有这些数据的基础上,我们假设PA的增加导致PI-PLC / DGK途径之间的协调措施。
当这些生化变化与感染过程中DGK的转录谱进行对比时,PA或DGPP的积累与DGK的特异性表达之间存在相关性(cchdgk1.和Cchdgk3.)结果表明,在1~12小时后,转录物的积累量最高 接种时间(图。7.)并且与与发病机制相关的标记基因的分析一致(CchPR1a型和Cchpr5.,图。8.), 什么时候C中国悬浮细胞受到微生物联合体的挑战。这些结果支持这样的假设,即较高的DGK转录物积累可能与两组感染事件中的PA-DGPP水平有关C中国悬浮细胞和微生物菌群。这些数据支持了在磷酸肌醇途径中DGK的活性可以产生更高水平的PA的观点C中国悬浮细胞对感染事件的反应。根据结果(活性和基因表达),DGK可能参与了该病原体的信号转导事件。然而,我们不排除图中显示的其他酶(和基因)的可能性。6.也参与了这个过程。此外,在本研究中还分析了三个PLC和四个PLC,并且我们没有观察到在测试时间内基因表达的增加(数据未显示)。
但是,表达非特定PLC的基因,例如cchnpc6.,仅在非常短的时间内(1小时)和基础水平上表现出显著的增加(图。8.),可能指向对细胞培养操纵的广义反应。相反,DGKS表达在接种后3,6和12小时后保持更高的水平,而cchnpc6.在同一时间大大减少(图。7.).Pathogenesis-related基因,特别是CchPR5型,表现出与DGKs相似的行为,在第一个小时内增加,在3或6时减少 h,然后再次增加(12 hai,图。8.). 这一模式表明,在开始时观察到的反应与一般反应相对应,而在12 h、 它变成了对微生物联合体的特殊反应(图。8.).
最近,Gonorazky等人[70]表明PLC/DGK通路是调节对坏死病原的防御反应所必需的b .灰质通过短暂的沉默SlPLC2型在番茄植物。张等人[74.]报道了水稻DGK基因在烟草中的过表达增强了烟草的抗病性疫霉parasitica变量。烟草科PA积累的增加赋予了抗病性。
结论
该研究证明了响应于微生物联盟的磷脂信号通路的激活。此外,DGK的表达以及与发病机制相关的其他其他人的表达受到联盟的存在。联盟的存在还诱导膜破坏和细胞活力的重要降低。研究中的下一步将是使用磷脂酶和激酶抑制剂,以区分每种途径对微生物联盟反应的贡献。还考虑了转录组织以检测微生物联盟和磷脂信号级联的其他活化途径差异激活的基因簇的研究。在未来的作品中,我们打算扩展我们的研究,以确定培养领域中形成的联盟类型以及植物的响应能力和发展中的相关性。
数据和材料的可用性
本研究中生成的所有数据都包含在纸张中以及支持信息文件中。可以使用偏见数据数据https://doi.org/10.17632/mmd6f2v9z8.1. 本研究中使用的生物材料可根据合理要求从通讯作者处获得。
缩写
- CS:
-
分生孢子悬浮液
- 达格:
-
二酰甘油
- DAPI:
-
4',6-二氨基-2-苯基吲哚二盐酸盐
- DGK:
-
二酰基甘油激酶
- DGPP:
-
焦磷酸二酰甘油
- DTT:
-
dithiothreitol.
- EDTA:
-
乙二胺丙烯酸四乙酸
- FAA解决方案:
-
40%甲醛、50%乙醇、5%醋酸和5%蒸馏水
- FM4–64:
-
(N-(3-三乙基铵丙基)-4-(6-(4-(二乙基氨基)苯基)六烷基吡啶二溴化物)
- 海:
-
感染后的小时数
- 玫瑰:
-
2-[4-(2-羟甲基)哌嗪-1-基]乙磺酸
- 5状态:
-
肌醇多磷酸5-磷酸酶
- 其:
-
内转录间隔区
- IPX:
-
肌醇聚磷酸盐
- IPK5级:
-
inositol-pentakisphosphate 2-kinase
- ITPK公司:
-
肌醇四磷酸1激酶
- 青年成就组织:
-
茉莉酸
- LPA:
-
溶血磷脂酸
- MJ:
-
茉莉酸甲酯
- 女士:
-
Murashige和Skoog培养基
- MTT:
-
3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑鎓溴
- NPC:
-
非特异性磷脂酶C.
- 私人助理:
-
磷脂酸
- 人民行动党:
-
磷脂酸磷酸酶
- PBS:
-
钠磷酸盐缓冲剂
- 个人电脑:
-
磷脂酰胆碱
- pe:
-
磷脂酰乙醇胺
- PG:
-
磷脂酰甘油
- 圆周率:
-
磷脂酰肌醇
- PIP5K:
-
磷脂酰肌醇4-磷酸5激酶
- PI3K:
-
磷脂酰肌醇3-kinase
- PI4K:
-
磷脂酰肌醇4-激酶
- PI3P:
-
磷脂酰肌醇3-磷酸酶
- PI5P:
-
磷脂酰肌醇5-磷酸酶。
- PI4P5K:
-
磷脂酰肌醇4-磷酸5-激酶
- PI3P5K:
-
磷脂酰肌醇3-磷酸5-激酶
- PIP:
-
磷脂酰肌醇磷酸
- pip2.:
-
磷脂酰肌醇二磷酸
- pip3.:
-
磷脂酰肌醇三磷酸
- 解放军:
-
磷脂酶A.
- PI-PLC:
-
磷脂酰肌醇特异性磷脂酶C
- 可编程逻辑器件:
-
磷脂酶D.
- PMSF公司:
-
氟甲基磺酰氟乙烯
- PS:
-
磷脂酰丝氨酸
- ROS:
-
活性氧物种
- RT pPCR:
-
逆转录-定量聚合酶链反应
- 扫描电镜:
-
扫描电子显微镜
- SA:
-
水杨酸
- TLC:
-
薄层色谱法
参考
- 1.
Damm U, Cannon PF, Woundenberg JH, Crous PW。这个炭疽菌物种复合体。真菌研究。2012;73(1):37–113.https://doi.org/10.3114/sim0010.
- 2。
Nam MH,Park MS,Lee HD,Yu SH.植物分类再评价Collettrichum gleooosporioides从草莓隔绝在韩国。植物Pathol J. 2013; 29(3):317-22。https://doi.org/10.5423/PPJ.NT.12.2012.0188.
- 3.
Aiello D,Carrieri R,Guarnaccia V,Vitale A,Lahoz E,Polizzi G.表征和致病性Collettrichum gleooosporioides和C. karstii.导致预征收疾病柑橘在意大利。植物病理学杂志。2015;163(3):168–177.doi.org/https://doi.org/10.1111/jph.12299
- 4.
Guarnaccia V,Aiello D,Cirvilleri G,Polizzi G,Susca A,Epifani F,Perrone G.与意大利鳄梨果实茎秆腐烂相关的真菌病原体的表征。III采购病理学国际研讨会:使用科学提高食品可用性。Acta Hort。2016; 1144:133-9。https://doi.org/10.17660/actahortic.2016.1144.19.
- 5。
刘芙、唐庚、郑×、李毅、孙×、齐×、周×、徐杰、陈H、常×、张S、龚庚。四川辣椒炭疽病炭疽菌的分子和表型特征。中国科学代表2016;6:32761.https://doi.org/10.1038/srep32761.
- 6。
de Silva DD,Ades PK,Crous PW,Taylor PWJ。澳大利亚植物病理到辣椒Anthracnose的胶凝物种2017年; 66:254-267 DOI:https://doi.org/10.1111/ppa.12572.
- 7。
De Silva DD,Groenewald JZ,Crous PW,Ades PK,Nasruddin A,Mongkolporn O,Taylor PWJ。引起炭疽病的胶凝物种的鉴定,患病率和致病性Capsicum Annuum.在亚洲。IMA真菌。2019;8。https://doi.org/10.1186/s43008-019-0001-y.
- 8.
Jayapala N、Mallikarjunaiah NH、Puttaswamy H、Gavirangappa H、Ramachandrappa NS。阿昔洛尔-S-甲基和β-氨基丁酸诱导的抗肿瘤生物化学防御上调Collettrichum Capsici辣椒感染(Capsicum Annuum.). 拱植病理植物保护。2020;53:3–4, 141-161.https://doi.org/10.1080 / 03235408.202010.1735138.
- 9.
Ranathunge NP,Mongkolporn O,Ford R,Taylor PWJ。炭疽菌truncatum辣椒致病系统:侵染、定殖和防御机制。澳大拉西亚植物病理学。2012;41:463–73.https://doi.org/10.1007/S13313-012-0156-0..
- 10
Kazan K,Lyons R.植物激素途径的介入病原体效应。植物细胞。2014; 26(6):2285-309。https://doi.org/10.1105/tpc.114.125419.
- 11
神奇神秘之旅:水杨酸信号。环境实验机器人。2015;114:117-28。https://doi.org/10.1016/j.envexpbot.2014.003.
- 12
Kalachova T,Puga-Fleitas R,Kravets V,Soubigou-Repellin L,Balzergue S,Zachowski A,Ruelland E.抑制基础磷酸肌酐依赖性磷脂酶C活性的抑制作用拟南芥由脱落或水杨酸诱导的悬浮细胞作为一个信号枢纽,在这些激素诱导的转录组重构中起到重要的重叠作用。环境实验机器人。2016;123:37-49。https://doi.org/10.1016/j.envexbot.2015.11.003.
- 13。
Cacas J-L、Gerbeau Pishot P、Fromentin J、Cantrel C、Thomas D、Jeannette E、Kalachova T、Mongrand S、Simon Plas F、Ruelland E。甘油二酯激酶激活烟草NADPH氧化酶依赖的氧化猝发反应。植物细胞环境。2017;40:585–98.https://doi.org/10.1111/pce.12771.
- 14。
D'Ambrosio JM,Couto D,Fabro G,Scuffi D,Lamattina L,Munnik T,Andersson MX,ÁlvarezMe,Zipfel C,Ana M. Laxalta AM。磷脂酶C2通过调节ROS生产来影响突发的免疫力。植物理性2017; 175:970-981。doi:https://doi.org/10.1104/pp.17.00173.
- 15.
Kalachova T, Janda M, Šašek V, Ortmannová J. Nováková peter Dobrev IP, Kravets V, Guivarc 'h a, Moura D, Burketová L, Valentová O, Ruelland E.鉴定拟南芥磷脂酰肌醇4-激酶β双突变体的水杨酸独立反应。安机器人。2020;125:774 - 84。https://doi.org/10.1093/aob/mcz112.
- 16。
Munnik T,Testerink C。植物磷脂信号:“一言以蔽之”。《脂质研究》2009年;50:S260–5。https://doi.org/10.1194/jlr.r800098-jlr200..
- 17。
中野M, Yoshioka H, Ohnishi K, Hikichi Y, Kiba A.细胞死亡诱导应激是ds1 -磷脂酸磷酸酶沉默防御激活的必要条件尼古利亚娜·宾夕法尼亚州. 植物生理学杂志。2015;184:15–9.https://doi.org/10.1016/j.jplph.2015.06.007.
- 18。
Testerink C,Munnik T.在植物中对磷脂酸形成的分子,细胞和生理反应。J Exp Bot。2011; 62(7):2349-61。
- 19.
HOU QC,UFER GD,Bartels D.植物对非生物应激的反应中的脂质信号传导。植物细胞环境。2016; 39(5):1029-48。https://doi.org/10.1111/pce.12666.
- 20。
Altuzar-Molina AR, Muñoz-Sanchez JA, Vázquez-Flota FA, Monforte-González M, Racagni-Di Palma G, Hernández-Sotomayor SMT。水杨酸和茉莉酸甲酯对磷脂信号转导和香兰素产生的响应黄灯笼辣椒J细胞。植物生理生化。2011;49(2):151–8.https://doi.org/10.1016/j.plaphy.2010.11.005.
- 21。
Nakano M,Nishihara M,Yoshioka H,Takahashi H,Sawasaki T,ohnishi K,Hikichi Y,Kiba A.抑制DS1磷脂酸磷酸酶的抑制证实了Nicotiana Benthamiana的Ralstonia Solanacearum抗性。Plos一个。2013; 8(9):E75124。
- 22。
Van der Luit Ah,Piatti T,Van Doorn A,Musgrave A,Felix G,Boller T,Munnik T.悬浮培养的番茄细胞的诱发触发磷脂酸和二酰基甘油焦磷酸酯的形成。植物理性。2000; 123(4):1507-15。
- 23。
Yamaguchi T,Minami E,Ueki J,Shibuya N. Elicitor诱导的磷脂肪激活对悬浮培养的水稻细胞诱导防御反应的重要作用。植物细胞生理。2005; 46(4):579-87。
- 24。
Kaushal M,Mahuku G,Swennen R.镰育枯萎病和非症状香蕉的根殖民微生物组的偏见洞察力。植物。2020; 9(2):263。
- 25。
关键词:根际微生物,根际微生物,根际微生物,根际微生物基因组医学杂志。2020;21:1-19。
- 26。
Robin GP、Kleemann J、Neumann U、Cabre L、Dallery J-F、Lapalu N、O'Connell RJ。炭疽菌候选效应子的亚细胞定位筛选鉴定了针对植物过氧化物酶体、高尔基体和微管的真菌蛋白。前植物科学。2018;9:562.https://doi.org/10.3389/fpls.2018.00562.
- 27。
关键词:炭疽菌,细胞壁完整性,附着胞发育,致病性,MAPKKK, cgmc1基因。2018;9(11):543。https://doi.org/10.3390/genes9110543.
- 28。
Mogg C、Bonner C、Wang L、Schernthaner J、Smith M、Desveaux D、Subramaniam R。禾谷镰刀菌中植物生物碱安托芬靶向TOR信号通路的基因组鉴定。微生物学。2019;10(3):e00792–19。https://doi.org/10.1128/mbio.00792-19.
- 29。
Teixeira PJL,Colaianni N,Fitzpatrick Cr,Dangl JL。除病原体外:微生物群与植物免疫系统相互作用。Currin微生物。2019; 49:7-17。https://doi.org/10.1016/j.mib.2019.08.003.
- 30
小拉米切恩、杜尔C、施万克AA、罗宾M-H、萨尔图J-P、塞利埃V、梅森A、奥伯托J-N。疾病综合治理。2017年可持续发展农学回顾;37(2):25。doi:https://doi.org/10.1007/S13593-017-0417-Y..
- 31
Murashige T,Skoog F.一种修订的培养基,用于快速生长和生物测定与烟草组织培养。physiol植物。1962; 15(3):473-97。https://doi.org/10.1111/j.1399-3054.1962.tb08052.x..
- 32
Dhingra OD,Burton J.基础植物病理方法。克利夫兰,俄亥俄州:CRC媒体;1995年。
- 33
高W。腐霉菌有性生殖的化学刺激。博特布尔阿卡德罪恶。1998;39:81–6.
- 34
郭利,高卫华。两种广泛使用的媒介用于生长和繁殖Phytophthora.和腐霉. 应用环境微生物学。1993;59(7):2323–2325.doi:0099–2240/93/072323–03$02.00/0。
- 35
Sharma M,Ghosh R,Tarafdar A,Telangre R.一种有效的Zoospore生产,感染和实时量化方法Phytophthora cajani.大气CO2浓度升高引起木豆疫病的研究。BMC植物生物学。2015;15:90.https://doi.org/10.1186/s12870-015-0470-0.
- 36
shipton wa。Zoospore诱导和释放腐霉导致马富胞菌。riss br mycol soc。1985; 84(1月):147-55。https://doi.org/10.1016/S0007-1536(85)80228-X.
- 37。
Kamoun S、Young M、Glascock CB、Tyler BM。疫霉胞外蛋白诱导子-宿主特异性及对细菌和真菌病原菌的抗性诱导。植物-微生物相互作用。1993;6(1):15–25.https://doi.org/10.1094/mpmi-6-015.
- 38。
Meyer F,Paarmann D,D'Souza M,Olson R,Glass Em,Kubal M,Paczian T,RodríguezA,Stevens R,Wilke A,Wilkening J,Edwards Ra。Metagenomics Rast Server - 一种公共资源,用于自动系统发育和Metagenomes的功能分析。BMC生物信息学。2008; 9(1):386。https://doi.org/10.1186/1471-2105-9-386.
- 39。
Altschul S,Gish W,Miller W,Myers E,Lipman D.基本的本地对准搜索工具。J Mol Biol。1990年; 215(3):403-10。https://doi.org/10.1016/S0022-2836(05)80360-2.
- 40.
生命百科全书(http://www.eol.org/).访问2017年3月10日。
- 41.
全球微生物目录(http://gcm.wfcc.info). 2017年6月22日查阅。
- 42.
综合分类信息系统(https://www.itis.gov/).2017年5月24日访问。
- 43。
实时地图(http://lifemap-ncbi.univ-lyon1.fr/).访问2017年6月6日。
- 44。
道德J,Bouhmidi K,Trapero A.果实成熟度,品种易感性和接种方法对Collettrichum Acutatum进行橄榄果感染的影响。植物DIS。2008; 92(10):1421-6。https://doi.org/10.1094/PDIS-92-10-1421.
- 45。
Berridge MV, Tan AS。3-4,5-二甲基噻唑-2-基)-2,5-二苯四唑溴化铵(MTT)细胞还原的表征:亚细胞定位底物依赖,线粒体电子传递参与MTT还原。生物化学与生物物理学报,1999;doi:https://doi.org/10.1006/abbi.1993.1311.
- 46。
Racagni G, Villasuso AL, Pasquare SJ, Giusto NM, Machado E.二酰基甘油焦磷酸抑制大麦糊粉中赤霉酸刺激的α -淀粉酶分泌。杂志。2008;134:381 - 93。https://doi.org/10.1111/j.1399-3054.2008.01148.x.
- 47。
Smith PK, Kronhn RI, Hermanson GT, Mallia AK, Gartner FH, Provenzano MD, Fujimoto EK, Goeke NM, Olson BJ, Klenk DC。用双胆碱酸测定蛋白质。肛门。1985;150(1):76 - 85。
- 48。
Racagni-di Palma G,Brito-Argaez L,Hernandez-Sotomayor SMT。信号磷脂中的磷酸化咖啡阿拉伯里卡细胞。植物理性生物化学。2002; 40(11):899-906。https://doi.org/10.1016/S0981-9428(02)01450-X.
- 49。
SOL基因组网络数据库(https://www.sgn.cornell.edu/).2017年8月18日通过。
- 50。
汤普森JD,Gibson TJ,Plewniak F,Jeanmougin F,Higgins DG。Clustalx Windows接口:通过质量分析工具提供多个序列对齐的灵活策略。核酸RES。1997年; 25:4876-82。
- 51。
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析6.0版。中国生物医学工程学报。2013;30(12):2725-9。https://doi.org/10.1093/molbev/mst197.
- 52。
饶X,黄X,周Z,林X。2′的改进(−定量实时聚合酶链反应数据分析的delta-CT方法。Biostat Bioinf Biomath公司。2013;3(3):71–85.
- 53
Sharma G,Shenoy Bd。Collettrichum Fructicola.和c . siamense参与印度的辣椒炭疽病。植物病理学和植物保护档案。泰勒&弗朗西斯,47(10),2014. p。1179-1194。doi:https://doi.org/10.1080/03235408.2013.833749.
- 54
Kim K-H,Yoon J-B,Park H-G,Park EW,Kim Yh。辣椒的结构修饰和编程细胞死亡与抵抗反应相关Collettrichum gleooosporioides感染。植物激素:遗传学与抗性。2004;94(12):1295–304.https://doi.org/10.1094/phyto.2004.94.12.1295.
- 55
Naton B,Hahlbrock K,Schmelzer E.快速细胞死亡与真菌感染培养的欧芹细胞的代谢变化的相关性。植物理性。1996; 112:433-44。https://doi.org/10.1104/pp.112.1.433.
- 56
萨瑟兰MW。在寄主植物对侵染的反应中氧自由基的产生。植物病理生理学。1991;39:79–93.
- 57
Tzeng DD,De Vay JE。氧自由基在植物病害发生中的作用。作者:Andrews JH,编辑。植物病理学进展,第10卷。伦敦:学术出版社;1993年。1–33.
- 58
Kulkarni AP、Mitra A、Chaudhuri J、Byczkowski JZ、Richards I。过氧化氢:大豆脂氧合酶双加氧酶活性的有效激活剂。生物化学Biophys Res Common。1990;166:417–23.https://doi.org/10.1016/0006-291x电话:(90)91961-Q.
- 59
Munnik T,Meijer HJ,Ter Riet B,Hirt H,Frank W,Bartels D,Musgrave A. Hypercrove rency刺激磷脂酶D活性,升高磷脂酸和二酰基甘油焦磷酸盐水平。工厂J. 2000; 22(2):147-54。https://doi.org/10.1046/j.1365-313x.2000.00725.x.
- 60
Zalejski C,Zhang Z,Quettier A-L,Maldiney R,Bonnet M,Brault M,Descketre C,Miginiac E,RONA J-P。斑点B,Jeanette E.二酰基甘油焦磷酸盐是脱落酸信号的第二个信使拟南芥悬浮细胞。植物J 2005; 42(2): 145 - 152。doi:https://doi.org/10.1111/j.1365-313x.2005.02373.x.
- 61
Testerink C,Munnik T.植物对压力的反应:磷酸酸作为第二信使。百科全书植物作物SCI。2004年:995-8。https://doi.org/10.1081/E-EPCS120010659.
- 62.
Ruelland E,伦敦弗洛瓦O.编辑:植物开发中的脂质信号和环境压力的反应。前植物SCI。2016; 7(324):1-3。https://doi.org/10.3389/fpls.2016.00324.
- 63.
高渗应激在衣藻中快速产生溶磷脂酸。植物j . 2001; 25(5): 541 - 8。https://doi.org/10.1046/j.1365-313x.2001.00990.x..
- 64.
Den Hartog M,Verhoef N,Munnik T. Nod因子和Elictors在悬浮培养的苜蓿细胞中激活不同的磷脂信号通路。植物理性。2003; 132(1):311-317。doi:doi.org/https://doi.org/10.1104/pp.102.017954.
- 65.
Darwish E、Testerink C、Khalil M、El Shihy O、Munnik T。盐胁迫下水稻叶片磷脂信号转导的研究。植物细胞生理学。2009;50(5):986–97.https://doi.org/10.1093/pcp/pcp051.
- 66.
Zonia L,Munnik T。打破绿色范式:植物胁迫反应中磷脂酰肌醇信号的功能编码。来源:肌醇和磷酸肌醇的生物学。Lahiri A和Biswas B(编辑)。荷兰:斯普林格;2006年。207–238.
- 67。
磷脂酸的积累是CF -4/Avr4相互作用的早期反应。植物j . 2004; 39(1): 1 - 12。https://doi.org/10.1111/j.1365-313x.2004.02110.x.
- 68。
Bargmann Bo,Munnik T.磷脂酶D在植物应激反应中的作用。CurrOp植物BIOL。2006; 9(5):515-22。https://doi.org/10.1016/j.pbi.2006.07.011.
- 69。
在AvrRpm1和avrrpt2诱导的抗病性应答中,磷酸酶依赖的信号转导是一种重要的信号转导机制拟南芥. 植物J。2006;47(6):947–59.https://doi.org/10.1111/j.1365-313X.2006.02844.x.
- 70
Gonorazky G,Guzzo MC,Abd-El-Haliem Am,Mhaj J,Laxalt Am。番茄磷脂酰肌醇 - 磷脂酶C2(SLPLC2)的沉默降低了植物易感性灰葡萄孢. 分子植物病理学。2016;17:1354–63.https://doi.org/10.1111/mpp.12365.
- 71
Goto K,Hozumi Y,Kondo H。二酰甘油,磷脂酸,和转换酶,二酰甘油激酶,在细胞核中。生物化学生物物理学报。2006;1761(5–6):535–41.https://doi.org/10.1016/j.bbalip.2006.04.001.
- 72
Van Den Bout I,Divecha N.PIP5K驱动的ptdins(4,5)p2.合成:调节和细胞功能。J Cell SCI。2009; 122:3837-50。https://doi.org/10.1242/jcs.056127.
- 73。
1 .董伟,吕辉,夏刚,王明,二酰基甘油在植物中是否作为信号分子?植物信号处理技术研究进展。2012;https://doi.org/10.4161/psb.19644.
- 74。
张WD,陈杰,张H,歌曲F.稻二酰基甘油激酶基因Osbidk1的过表达增强了转基因烟草的抗病性。Mol细胞。2008; 26(3):258-64。
致谢
我们要感谢安吉拉·库冈萨雷斯和I.Q.西尔瓦纳·安德拉德·坎托提供的技术援助,非常感谢。
同意发表
不适用。
基金
我们的研究得到了授予SMTH-S的国家科学与技术委员会(CONACyT)的资助(资助IFC 035/2015)。资助机构只提供资金支持或试剂、实地考察和博士后奖学金,不参与实验设计、数据收集、解释和分析以及起草手稿。同时还获得了(CONACyT)奖学金(166897),授予VMG博士后培训。
作者信息
隶属关系
贡献
MS、GR、VG、AR和TH构思和设计实验,执行实验,分析数据,并准备图表。YC进行了实验。JM进行实验,分析数据,准备图表。所有作者都审阅了论文的草稿并批准了手稿。
通讯作者
伦理宣言
道德认可和参与同意
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商说明
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充资料
补充文件1:补充图S1。
真菌种类的相对丰度;只有淡色炭疽菌显示>含量为1%
附加文件2:补充图S2。
细菌种群的相对丰度;仅显示相对丰度为> . 1%的属
附加文件3:补充图。S3。
系统发育树C中国DGK。对辣椒(Ca)、番茄(Sol)、咖啡(Cc)和拟南芥(At)的蛋白质序列进行了系统发育分析。该树使用最大似然法产生,进行1000个bootstrap重复测试,并使用MEGA 6显示。节点上的数字是引导值(> 10%),并显示从根到分支的长度。
附加文件4:补充图S4。
熔化曲线Cchdgk3.和CchPR1a型
附加文件5:补充图S5。
熔化曲线CchEF2a3L型和cchdgk1..
附加文件6:补充图S6。
熔化曲线Cchpr5.和cchnpc6..
附加文件7:补充图。S7。
熔化曲线卡图巴.
附加文件8:补充图。S8。
来自脂质的2D-TLC-autoradoIographyC中国细胞培养物。
附加文件9:补充图S9。
来自脂质的2D-TLC-autoradoIographyC中国细胞培养物用Cs感染6小时(1×104.).
附加文件10:补充图S10。
2D-TLC-Autoradooprography来自CS的脂质(1×104.).
附加文件11:表S1。
引物组来自C中国在引用中c .建立同系物
权利和权限
开放访问本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Sánchez-桑托,M.E.,Racagni Di-Palma,G.E.,González-Mendoza,V.M。等。Capsicum Chinense悬浮液中的磷脂信号通路作为联盟感染的关键反应。BMC植物BIOL.21,62(2021)。https://doi.org/10.1186/s12870-021-02830-z.
收到:
认可的:
出版:
关键词
- C中国
- 炭疽菌物种
- 磷脂酸
- 植物与
- 生化反应
- 磷脂酶