摘要
背景
在多年生树木的生命周期上,休眠状态使得能够避免非生物胁迫条件。生长周期可以分配成诱导,维护和释放,并受许多内源和环境因素之间的复杂相互作用来控制。虽然植物激素长期与休眠有关,但越来越多的规则证据大坝和CBF基因。揭示。的表达动力学cbf及其目标PtDAM1是否与生长停止和内休眠诱导有关杨树,研究了两个杂交杨树品种,其对休眠诱导条件具有已知的差异反应。
结果
生长停止、休眠状态和表达六种PTCBFS.和PtDAM1分析了。“奥海塞尔”杂交品种迅速停止生长,能够达到肺结大,并表现出几个数量PtCBF第10天的芽中的成绩单。“沃克”品种延迟了增长停滞,无法进入核心性,并显示得多CBF在芽中的表达。表达式PtDAM1在第10天峰值只在'okanese'的芽中。此外,PtDAM1在两个品种的叶片中都没有表达,而叶cbfexpression pattern was several fold higher in ‘Walker’, peaking at day 1. Leaf phytohormones in both cultivars followed similar profiles during growth cessation but differentiated based on cytokinins which were largely reduced, while the Ox-IAA and iP7G increased in ‘Okanese’ compared to ‘Walker’. Surprisingly, ABA concentration was reduced in leaves of both cultivars. However, the metabolic deactivation product of ABA, phaseic acid, exhibited an early peak on the first day in ‘Okanese’.
结论
我们的结果表明PTCBFS.和PtDAM1具有不同的动力学和空间定位,这可能与杨树在低夜温和短光周期条件下早期生长停止和诱导内休眠有关。不像花蕾,PTCBFS.和PtDAM1在这些条件下,叶片中叶中的表达水平与早期生长和休眠诱导无关。我们的研究提供了新的证据表明,叶子中的生长素和细胞素素的降解可能是CBF-DAM诱导的肺结肠中的重要调节点。进一步调查其他Ptdams.在芽组织中,有必要进行生长抑制和生长植物激素的降解的研究。
关键信息
关键调节基因的差分时间和表达水平cbf和5.叶片中细胞分裂素、IAA和ABA代谢的下调可能参与了对照营养芽生长停止和休眠发育的调控杨树品种对低夜间温度差异敏感。
背景
植物的同步与其环境使改善的温带常年植物能够避免受伤。在这些北部,温带地区,生长停止是冷置适应的必要前的必要条件,随后的冷冻应力阻力[1那2].生长周期受休眠的调节,而休眠又受内在因素和环境因素的控制。而缩短光周期一直被认为是木本植物诱导休眠的最重要的驱动因素[3.那4.那5.那6.],温度也一直是而且越来越被认为是这种反应的一个强有力的中介[7.那8.]有关审查,请参阅Tanino等。(2010)[9.].随着全球变暖,温度及其对休眠周期的影响越来越受到人们的关注。在这方面,对森林和农林树种的研究日益突出温度对休眠的影响[10那11那12那13和光合作用能力[14].在北美,凭借广泛适应和快速增长,杨树杂交种是经营土地上主要的农林复合树种。评估未来气候变化对杨树休眠周期对于选择更好地适应温度的品种是重要的。
温带树木的休眠分为三个阶段:Paradomancy,Encodormancy和Ecocormancy [15].芽休眠的定义是“任何含有分生组织的植物结构的可见生长的暂时中止”[15].Paradomancy被定义为通过植物内的生理因素控制的生长停滞,但受影响结构外部,核心性被定义为受影响结构内部的生理因素控制的生长停止,肌肉多变是由工厂外部环境因素控制的生长停止[16].因此,植物休眠的各种类型构成了一个广阔的研究领域。然而,由于秋季休眠诱导期对每年生长周期的其他组成部分有影响[17],温度介导休眠时间和深度的演示杨树混合动力汽车(13,在本文中,我们将重点讨论这两个方面。
此外,优秀的综述论文集中在分子变化、基因调控途径和激素在休眠中的调节[18那19那20.那21那22那23那24那25[但相对较少地是关于休眠和休眠相关的疯箱(DAM)基因中的C-重复结合因子(CBF)的潜在作用杨树杂交品种广泛应用于农林复合系统。
CBF基因,首次描述于拟南芥[26那27那28,是参与植物非生物逆境耐受,特别是冷驯化的最具特征的植物转录因子之一。脱水反应元件结合(DREB)蛋白/C-repeat结合因子基因(CBF)在低温下会迅速产生。编码蛋白结合到冷响应基因启动子中的CRT/DRE (C-repeat/脱水响应元件)调节DNA基序[29],从而诱导它们的表达,这导致增强的寒冷或冰霜容差[30.].CBF在大量的物种中都有描述,包括单子体和双子体。通常在一个物种中有几个或多个基因家族成员。此外,数量CBF即使在同一物种中,基因也可能以基因型依赖的方式(拷贝数变异)发生变化。许多CBFS在单子叶谷物中被描述(面包小麦中约40个/Triticum Aestivum /, 20大麦/Hordeum Vulgare /).虽然木质物种中描述了更少,但它们的基因组也编码了几次(3-6)CBF基因。他们的涉及冷适应也得到了证实。最近的评论[24综述了树木抗寒性的遗传调控。
越来越明显的是CBF基因也参与了休眠调节,特别是在巩固性的发展中[31.那32.那33.那34.].Benedict et al.(2006)研究了4CBF年代确定的杨树balsamifera无性系种群。Trichocarpa.并得出结论,CBFS参与休眠开发,其差异表达可确保不同年生组织中这些“主交换机”的特定角色[35.].
CBF - Dam - 休眠'途径的存在,并至少部分地显示了日本梨的几项研究[36.那37.]和日本杏[38.].在他的评论中,Horvath(2009)提出了一个理论模型,'可以制定,可以作为进一步测试的范式'[39.].Wisniewski等人(2011)证明转基因苹果(马鲁斯X有明显),表达桃子(碧桃)PPCBF1基因不仅表现出较高的抗冻性,而且对短光周期的响应也发生了改变,从而导致休眠早开始,叶片衰老早,芽断延迟[31.].作为下一步wisniewski等。(2015)分析cbf那水坝那rgls.,低潮转录因子基因,参与休眠调节[32.].几个苹果的表情大坝基因 - 已经与木质的休眠发育相关蔷薇科植物-表现出不同的表达模式。在苹果中发现CBF结合位点大坝发起人提出了一种监管模式连接的建议cbf和大坝S表达endocormancy开发[32.].大坝首先确定基因李属。突变的桃子,称为“不断增长”,即使在暴露于短的光周期或低温植物时,也无法进入肺胚胎[40那41.那42.].
大坝基因是MADS-box转录因子II型(MIKCc)亚家族成员。它们的序列包含四个主要结构域,MADS-box结构域(M)、介入结构域(I-)、角蛋白样结构域(K-)和C-末端结构域(C-)。这些结构域负责DNA结合、蛋白质二聚、复杂的形成和转录调控。详细的结构和功能表征大坝基因可以在Horvath(2015年)和Maravigna等人发布的审查中。(2019)[43.那44.].在后一篇文章中,提出了一个模型,介绍了参与休眠周期的调控基因的分子网络。
的表达模式大坝与休眠相关的基因主要存在于李属属,其中桃子(P. Persica)永远不断增长[45.和桃品种[46.]、日本杏(p .却已) [47.],还有苹果[48.]或日本梨(Pyrus普通的) [49.那50.].大坝基因表达似乎与休眠阶段有关(参见Falavigna等人(2019)的综述[44.])。在大多数物种中,大坝基因表达在休眠诱导期被诱导,但也可能参与维持和释放[46.].基于氨基酸序列,杨树5.和大坝表达与叶尖最密切相关疯了27-29与另一个不同大坝基因,5.和大坝(Chen (2008) [51.引用于Horvath等人(2010)[52.])。有趣的是,在后来的转录组研究中,这些结果没有得到证实。Howe等人(2015)研究了几个问题大坝- 在核心间处于下调的基因[53.].其中一个被检测的基因是Potri.002G105600,但在这项研究中,作者每月只取样一次。
转基因植物的分析显示CBF基因也参与了内休眠的调节。桃的异位表达PPCBF1苹果中的基因导致短日诱导的休眠和增加的冷硬度[31.]并影响苹果的表达水平MdDAM1和MdDAM3芽中的基因[32.].李等人。(2019)分析梨(Pyrus Pyrifolia)CBF和大坝发现了多个CBF基因选择性地调节大坝基因和参与内休眠调节[37.].有趣的是,该研究小组发现“PpCBF1-PpDAM2调控在内质休眠调节中主要响应低温,而PpICE3则进一步进行翻译后调控”。此外,表示PARCBF1被发现与杏子中的环境温度降低密切相关(李属armeniaca的表达水平Pardam5.和Pardam6.改变根据PARCBF1表达率[54.].
分子证据也支持CBF - DAM联系。据报道,在叶尖的推定启动子区域存在CBF转录结合位点大坝基因(52.].一种模型,说明了DREBS(CBF)和的潜在相互作用水坝随后建议[55.].PpCBF2蛋白与启动子的相互作用PPMADS13-1瞬时报告基因在梨中显示[56.].同样在梨中,酵母单杂交和瞬态测定显示PPCBF2增强PpDAM1和PpDAM3在诱导休眠期间的转录活动[38.].赵等人。(2018)表明p .却已CBFs可以绑定到PMDAM6.启动子通过不同的结合位点激活其表达[33.那34.].日本梨PPCBF.S能诱导表达PpDAM1-1和PPMADS13-3瞬时报告基因分析[56.].不同的生化方法揭示了梨PPCBF2和PPCBF4基因能够与启动子结合PpDAM1基因,激活其表达,并透露PpCBF1, PpCBF2, PpCBF3, PpCBF4基因可以激活PpDAM3基因(37.].这些结果证明了CBF - 坝信令途径参与了核心性发育,并且还展示了一定程度的CBF功能冗余。
在这里,我们使用两个对比的系统杨树杂交品种在生长停滞和休眠习得不同,其先前基于短夜间温度的短夜间温度分辨。生长停止和休眠诱导的假设与叶植物激素水平相关联,芽PtDAM1和芽PTCBFS.基因表达在杨树将被评估。
结果与讨论
在我们之前的工作中[13研究了温度对4个杨树品种生长停止、休眠发育和冷驯化的影响。这些温度机制改变了休眠发育模式的动力学,其中18/3℃处理诱导的休眠深度最宽。因此,要阐明在表达水平之间是否有关系CBF本研究在短日照条件下测定了2个不同品种在夜间温度响应下获得休眠的基因和休眠。
休眠开发
增长停止
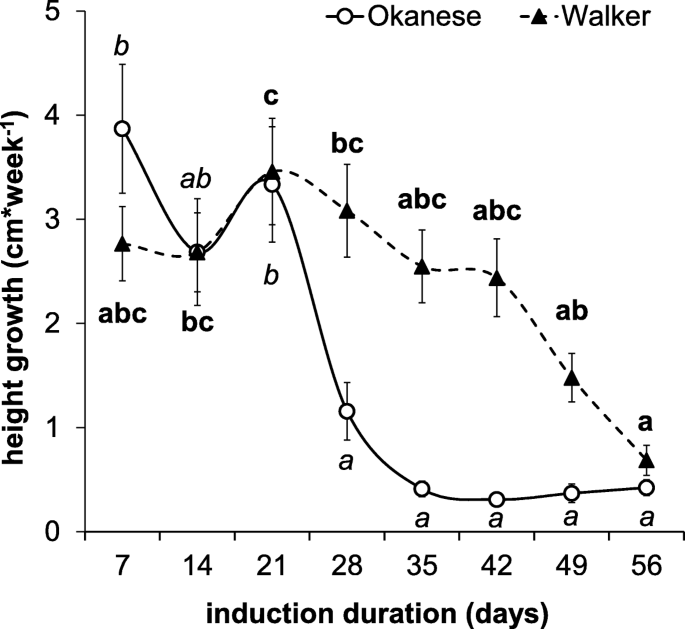
生长停止是诱导休眠的第一个迹象[57.],并诱导两种基因型(图。1).与Kalcsits等人一致。(2009年),与“奥海塞尔”相比,在休眠诱导条件的第3周和第4周之间,在“奥海塞尔”中可以观察到较早的和陡峭的下降。在第五周之后,没有记录进一步的增长。'Walker'在每次点时表现出更高的增长率,除了第1周之外。在实验结束时,这两个品种之间没有发现显着差异(0.36和0.51厘米*周- 1在奥帕尼斯和步行者)。
休眠诱导
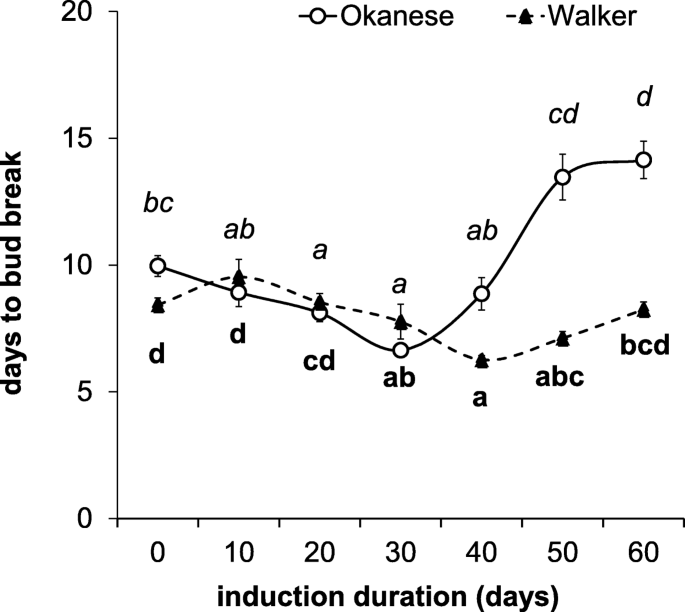
虽然生长停止是一个更敏感的指标,但从第40天开始,两个品种间的破芽天数有显著差异(图4)。2).在试验结束时(即第50天和第60天),该值有所增加,分别在13.5天和14.1天趋于稳定。相反,在整个60天的处理期间,Walker几乎没有改变芽的破芽时间,只有轻微的波动(图2)。2).在第一个和最后几天之间没有检测到差异(分别为萌芽的天数:8.4和8.2天)。
休眠深度被参数Δdbb反射(第一个和最后几天与芽衰之间的差异),并且在'walker'(Δdbb= 0.2)中根本没有诱导休眠。相反,在'okanese'中,休眠状态开始在30天后诱导。在实验结束时,辣椒的Δdbb为4.1(图。2).关于增长停止率和芽分解分析的数据表明,“奥帕尔斯”达到了比“Walker”更深的休眠状态。我们的结果与Kalcsits等人的结果一致。(2009)[13], who reported characteristic differences between these two cultivars – ‘Okanese’ was shown to be more capable of endodormancy development under the 18/3 °C day/night temperature treatment under 12 h and 10 h daylengths although a larger difference was found between the two cultivars (ΔDBB: 13.9) in that study.
表达式模式CBF基因
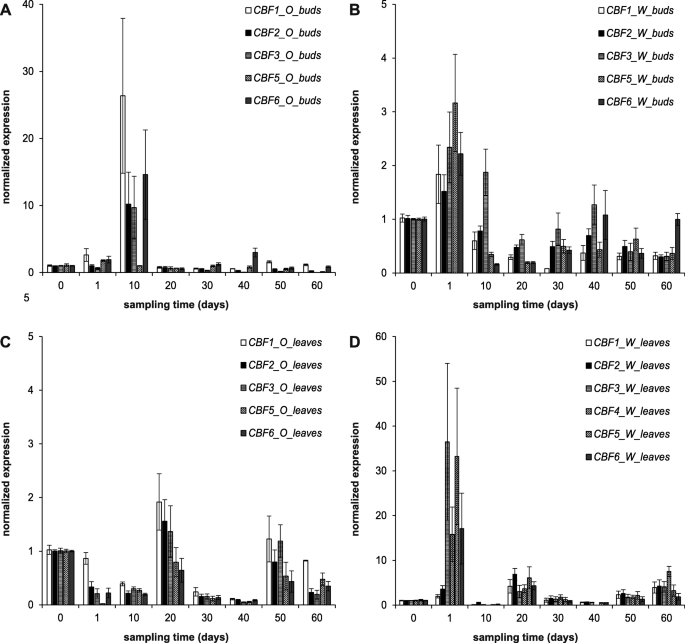
六的表达模式CBF整个实验都记录了基因。考虑到许多植物的昼夜节律,每10天采集一次叶片和芽组织样本CBFS,在一天的同一时期,即在光期开始后4-6小时。在给定的时间点中,每个基因的表达被标准化为在给定治疗的开始(即0天)测量的水平。
在动力学和空间定位上的整体差异CBF两个品种间均有表达。最高水平的CBF整个实验中的表达被记录在芽组织中,在第10天从'okanese'隔离(图。3.a)和第一天在“Walker”叶片样品(图。3.d).‘澳生’杨树芽的表达量在第10天达到顶峰,至少比‘沃克’芽高一个数量级(10-20倍),而且在试验期间的任何其他时间都是如此CBF(除…之外)PtCBF5)芽有差异表达PTCBFS.在两个品种之间PTCBF1和PTCBF5在‘Okanese’芽中表达量分别最高和最低,而在‘Walker’芽中表达量则相反。在《沃克第一天离开》中,PTCBF1和PTCBF2表达水平大致相当于'okanese',但是,'沃克'叶子表达PTCBF3,PTCBF4,PTCBF5和PTCBF6在第1天出现了峰值,是‘澳生’的150-200倍。3.c, d)。
独特的表达式模式CBF基因在补充图中有详细描述。1.在芽组织,PTCBF2那PTCBF3.和PTCBF5仅在试验开始第10天诱导,而PTCBF1和PTCBF6.不仅在开始时诱导,而且在治疗结束时,在50和60th(PTCBF1)或第40天(PTCBF6.).“Okanese”芽的诱导水平总是比“Walker”芽高一个数量级CBF.镇压CBF“沃克”芽中的基因更为明显。在实验中间记录了一个抑制期PTCBF1那PTCBF5和PTCBF6.在“沃克”芽中的基因,而在“奥诺伊”的中期只发现了一个压抑阶段PtCBF3表情(补充图1A, D, E和C)。
在叶片组织中,所有叶片样品均可观察到两种感应波CBF在《沃克》中,第一个是在开头(第1天和第20天),第二个是在结尾(第50天和第60天)。在‘Okanese’的叶子中也发现了感应波,但方向相反,因为所有的抑制CBFS在1 ~ 10日和30 ~ 40日,最后在60日被检测到。值得注意的是,不同品种在叶片组织中的反应存在差异,‘Walker’叶片中发现了CBF诱导,而‘Okanese’叶片几乎在所有情况下都发现了抑制(Supp. Figure .)1F-K)。因此,这两个品种具有相似但相反PtCBF基于芽或叶的休眠诱导条件下的表达。
差异CBF以杨树为研究对象,对木本植物分生组织(芽、茎和叶)的表达动力学和表达水平进行了研究。Benedict et al.(2006)描述了不同的CBF诱导模式p . balsamiferaSS.p。Trichocarpa.显示所有四个PtCBFS在叶片中是冷诱导的,而只有两个(PTCBF1和PTCBF3)是冷诱导的茎[35.].在短表达周期(24小时)下,他们总结道,“常年驱动的冬季休眠进化导致了非生物应激反应调节器的特殊作用的发展,比如CBFS,在年度和多年生植物组织中。CBF在叶片和叶芽组织中表达李属却已Zhao et al. (2018) [33.].他们还发现了所有六种差异基因表达模式CBF学习,具有特定的感应动力学。在那项研究中,所有六个cbf在冷期(11月- 1月),在营养芽中诱导;PmCBF4那PmCBF5和PmCBF6最强烈的表达。这三个CBFS也是叶组织中最诱导的。但有趣的是,在叶子中,所有6的最高表达CBF在6月到7月这段最热的时期,有记录。这一发现与我们的结果是一致的,即CBF非休眠品种的叶片表达更强烈,这可能表明它们在休眠发育中的作用是器官特异性的。六个PmCBF在7个不同的器官中确定了p .却已[33.].茎部的诱导水平较高,花芽、叶芽和叶片的诱导水平中等,花、果实和种子的诱导水平较低。
基因的复制和增殖产生了大量的CBF在许多物种中。这种冗余使功能的分歧成为可能,并使对任何环境刺激(如压力)的适当反应进行微调成为可能。正如上面所提到的,6CBFS编码在p .却已基因组在年内表现出不同的表达动力学:PMCBF1,PMCBF2,和PmCBF3不仅在寒冷季节,而且在晚春季节,茎秆组织中表达量均上调[34.].另外,低温调高8CBF年代李属却已是什么导致了这六起事故的发生大坝导致休眠发育的基因[36.].在天然休眠诱导条件下,3个中的3个CBFS在中表现出相似的表达趋势Pyrus Pyrifolia芽组织,而PPCBF1显示出不同的感应动力学[37.].在人工冷却测试期间,PPCBF1是唯一的CBF高度表达,而PPCBF2被强烈地抑制了PPCBF3.和PPCBF4是无法觉察的。
这些结果表明,尽管CBF表达动力学可能是相似的,但可以区分个体表达模式的差异。将光照周期缩短2小时/天来解释(在相同温度条件下)的性质差异可能在我们的实验中造成了适度的功能多态性。PTCBF4只有在“沃克”的叶子中是可检测的PTCBF1和PTCBF6.是'洋红色'芽中最强烈的表达基因。如图所示,他们是否有不同的功能PPCBF4[37.,目前还不清楚。同样值得注意的是PTCBF5是在“奥帕尼亚芽的第10天的CBF-BURST期间唯一没有诱导的基因,但在第1天的”Walker“芽中是最密集的上调。因此,我们假设PTCBF5与休眠发育无关。
叶样本的杨树balsamifera ssp。Trichocarpa.来自北方和南方人群的基因型被检测[58.].生长室研究显示了这一切PtCBF基因被冷诱导,表明功能冗余。另一方面,在野外条件下,描述了更多样化的基因表达模式。的表达PtCBF由于生长季节进展,但六个基因只有六个基因PTCBF3.横跨纬度略微差异化。在我们的实验中,叶样品还显示出一定的功能多态性水平,但两个系统的最常见结果是在叶子中,没有发现休眠依赖表达模式,这种关系仅在芽组织中存在。
PtDAM1鉴定及其表达动力学
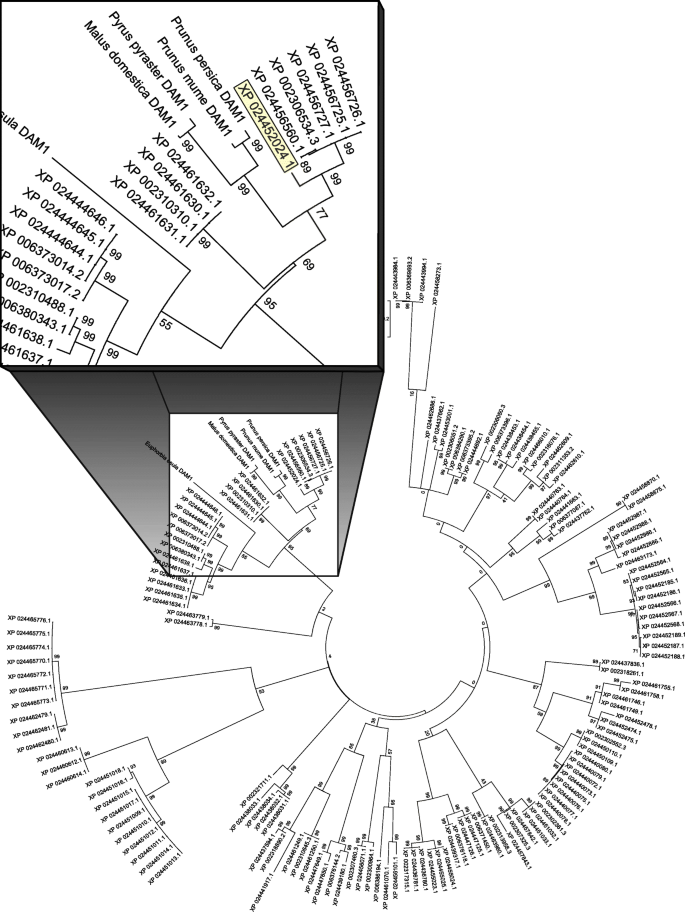
大坝s (休眠相关的疯子盒)在多年生植物中是具有良好特征的基因,与休眠循环的各种组成部分相关,但特别是休眠诱导。大坝序列已经发表在木质植物中,含有k盒和srf-tf图案[33.那59.那60.].这p . trichocarpa基因组已经测序[61.,然而,它的注释仍然很差。我们已经找到了151名候选人大坝基因。根据这些,我们建议XP_024452024.1蛋白质条目(可在NCBI蛋白质数据库中提供:https://www.ncbi.nlm.nih.gov/protein/)作为假定的PtDAM1产品(无花果。4.和5.).XP_024452024.1条目对应于旧版本MADS7, Potri.002G105600在PopGenIE数据库:https://popgenie.org/).Howe等人。(2015)通过微阵列的核心性诱导期间研究了转录组变化p . trichocarpa并发现了几个大坝样SVP基因表达有差异,但在休眠期间下调[53.].由于采样按照每月一次进行,因此如果错过了上调的峰,则尚不清楚。
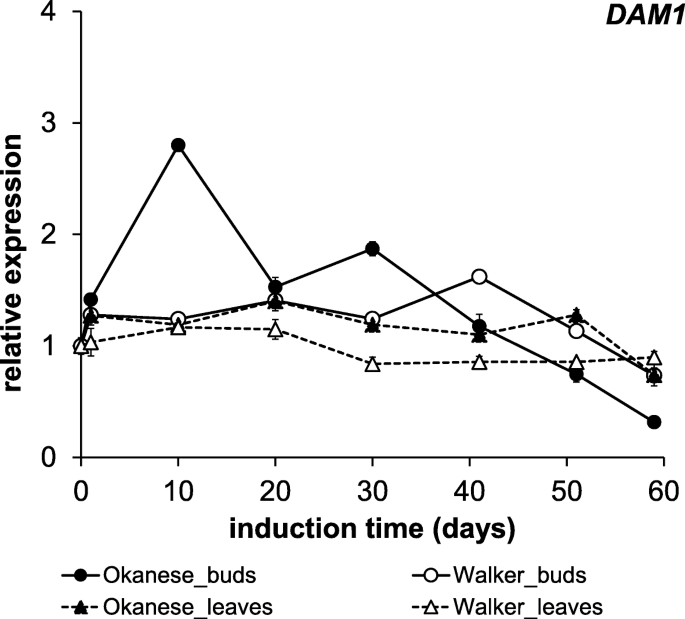
确定了一个PtDAM1基因杨树,我们决定评估其在休眠发育中的潜在作用,使用已知夜间温度差异差异的品种。因此,开发了引物以研究编码PtDAM1基因的表达。通过实验,与第一天取样时相比,‘Okanese’叶片中XP_024452024.1序列表达量轻微上调,而‘Walker’叶片中XP_024452024.1序列表达量较低。PtDAM1从实验中间开始受到抑制(图。6.)和的表达PtDAM1在整个60天的叶组织中几乎没有变化。芽组织比叶组织表现出更明显的诱导作用。在较休眠的' Okanese '中,在第10天达到最高表达量(2.8倍),然后诱导逐渐下降。在处理结束时,两个品种均出现抑制现象。PtDAM1在“Walker”处理的前半部分(1.1 ~ 1.6倍诱导)未进入内休眠,芽诱导较弱。
相似的表达式趋势PMDAM1基因在日本杏(李属却已)芽组织,但在叶子样本中不同[47.].在营养芽中,表示PMDAM1(也PMDAM2.和PMDAM3.)从6月到7月开始上调,即在增长开始前很久,然后表达开始减少。我们也展示了一个初创性的PtDAM1在生长停止或休眠发展开始之前,在我们的系统中诱导。然而,我们没有发现叶组织的特征变化李春乌岛,在这个器官中描述了不同的运动模式[47.].显示了两个季节性表达趋势P. Mume Dams.那PMDAM1(和...一起PMDAM2.和PMDAM3.)在春季迅速上调,在秋季逐渐下调。叶组织中表达的差异可能与两种不同的实验系统有关。在桃(碧桃)、微分大坝基因表达似乎与休眠诱导或满足的冷却需求阶段有关。基于不断增长的桃突变体系,Li等人。(2009)报道5.那大坝和大坝是与生长停止和休眠诱导相关的最有可能的候选人[45.].Yamane et al.(2011)使用相同的系统表明,在田间和受控环境条件下以及叶和茎中,达5.和达摩基因表达水平在肺胚泡诱导期间上调,在核心性释放期间下调,似乎与冷却需求满意相关[62.].此外,达5.和达摩基因表达水平在高寒冷的品种中较高,并且随着冷却要求满足而减少[63.].达5.和达摩基因是芽破的负调控因子。
休眠发展中激素变化的动态
植物激素已经很久以为患者参与休眠周期[23那25那64.那65.那66.那67.那68.那69.那70那71.那72.].最近,正在揭示植物激素和休眠之间的机械关系[36.那73.那74.].
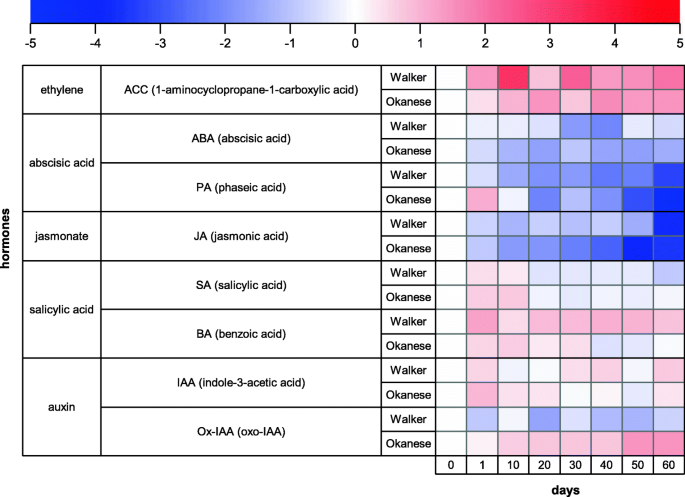
在我们的研究中,由于杨树芽的体积很小,生长室的容量有限,所以我们只对叶片样本进行激素分析。总体而言,‘澳生’与‘沃克’杨树杂交品种的植物激素反应不同,其中oxi - iaa、相酸、DAM1、独联体-Zeatin核苷-O-葡糖苷(CzROG)(图。7.和8.).杨树植物暴露于短的光周期和低夜间温度与两种基因型的叶片中的ABA含量下调有关(图。8.).然而,ABA代谢物的瞬时抬高(在第1天)的瞬时升高,转化酸,表明“奥卡莱斯”品种中的增强,表明在温度下降后早期的短期上调ABA含量。对冷应力小麦叶片的短暂上调报告支持这一假设[75.].乙烯前体ACC在两个克隆中均升高。Ruttink等人(2007)研究表明,在休眠诱导过程中,乙烯的升高先于ABA的升高[64.].已知茉莉酸盐与几种应激反应有关[76.].与ICE1和ICE2转录因子发生物理互作的JA信号通路的阻遏因子- jasmonate ZIM-domain (JAZ)蛋白失活后,可上调cbf[77.].CBF基因促进嗜酸甘油蛋白的失活,从而产生生长抑制[78.].在我们在叶组织的研究中,在整个实验期间,JA水平抑制了两种基因型,而且在'okanese'中更多。然而,叶中的JA水平不需要与其在芽中的内容相关。此外,jaz灭活可以通过与Della蛋白的相互作用来实现[79.那80,在低温下积累,通过赤霉素下调而稳定。与JA相比,SA的含量在试验开始时有所增加,' Okanese '延长了一周。这与SA对植物耐冷性的积极作用是一致的[81.].在第3周之后,SA含量在两种品种中没有变化,然而,浓度在较冷的寒冷'沃克队的浓度较低。苯甲酸,SA和其他酚类化合物的前体在实验期间升高;在'okanese'直到休眠启动,在整个实验中的“Walker”中。这些变化在叶片衰老期间表明克隆之间的荷尔蒙动力学的差异(图。8.).
两个品种的生长素吲哚-3-乙酸(IAA)在处理60天内水平不同。然而,IAA的主要分解代谢产物Ox-IAA在‘澳生’叶片中表达上调,在‘沃克’叶片中表达下调,表明‘澳生’叶片中IAA失活较强。休眠启动,伴随生长速率的大幅抑制,并伴有IAA的下调,这在非休眠无性系中没有观察到(图2)。8.).Baldwin et al.(2000)指出,虽然芽鳞发育不需要生长素萘乙酸,但其缺失是关键[82.].
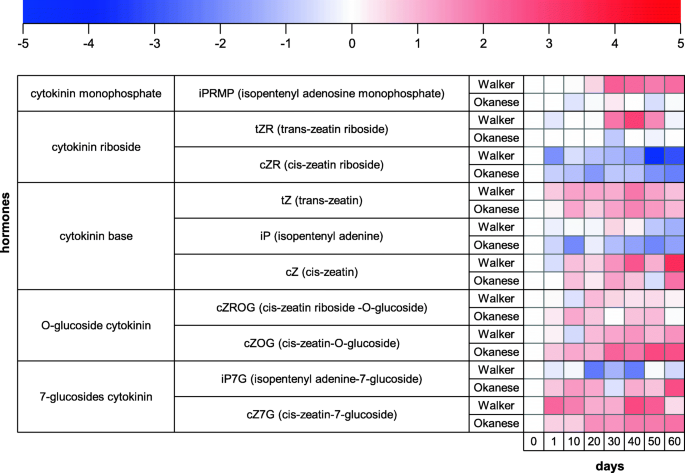
与Walker相比,整个细胞肝素途径在甘甘中下调:前体IPRMP和TZR仅在步行者中增加,活性形式(IP)仅在甘甘人中减少,并且停用形式IP7G在辣椒中积累并在沃克中累积。其他化合物没有显示两棵树之间的任何重大变化(图。9.).
Cytokinin分析清楚地表明,“奥卡南斯”促进休眠的促进与细胞素生物合成的一般性降低与叶子中的失活产物的深远升高有关(图。7.和9.,supp。数字2).这些结果为IAA和细胞分裂素等促生长激素的降解可能是诱导植物休眠的重要机制提供了新的证据。
关系之间的关系PTCBFS.和PtDAM1表达,激素水平和休眠的发展
一种CBF短光周期低夜温处理第10天,' Okanese '芽组织发生-burst,而' Walker '芽组织发生-burstCBF水平则低了一个数量级(图3)。3.).在'okanese',能够进入肺结核(图。2),CBF1在休眠开始时具有最高的相对表达。PtDAM1在相同的第10个采样日,‘Okanese’的表达达到了顶峰。6.).相比之下,没有达到巩固性的“Walker”(图。2)有一个较低的CBF表达在第1天(图。3.),而PtDAM1在实验期间表达也很低,不变(图。6.).在第3周的生长速度开始衰落,但在“奥诺伊人”中的速度很快(图。1).这些发现支持可能的关系PTCBF1那PtDAM1诱导和内休眠发育。
与休眠相关的植物激素ABA在‘Walker’叶片中显著下调,在‘Okanese’叶片中下调幅度更大。然而,ABA降解中间体相酸的浓度在‘澳生’中升高,而在‘沃克’中降低,因此,‘澳生’叶片的ABA诱导峰可能被忽略了(图2)。8.).最近的证据表明,DAM1在激活中发挥作用NCED3通过与其启动子结合,上调日本梨ABA生物合成[83.].该研究还发现,高浓度的ABA也可以在反馈调节回路中减少DAM1。DAM蛋白与SVP (Short Vegetative Phase)蛋白相似,SVP是拟南芥开花时间调节蛋白之一。在猕猴桃中,Wu et al. (2017) [84.]进行转录组分析,发现ACSVP2可能模仿ABA Action [85.].他们进一步表明,SVP2由ABA介导,以降低分类活性并预防过早芽突破。水坝还似乎在ABA信号通路中发挥监管作用[85.].因此,存在越来越多的证据CBF和大坝基因的作用与植物激素的浓度和在休眠中的作用有关。Knight等人(2004)的研究也证明了相反的情况CBF表达式[86.].singh等。(2019)报道,SVL是Aspen中SVP的直际(杨树),通过胼胝质合酶介导光周期休眠诱导,作用于ABA下游[74.].singh等。(2018)还表明ABA诱导了表达大坝/ SVL.杂交杨树的基因[87.].查看最近的优秀综述,参见Liu and Sherif (2019) [25].
在最近的一项研究中,对一种转化杂种杨树(杨树tremulaX美洲山杨)表达表达SVL低温处理后,杂交杨树芽的破芽负调节因子下调。尽管如此,有人指出,SVL类似于大坝基因,聚类更接近SVP在拟南芥和苹果的杂交比白杨和桃子的杂交更有效大坝基因(74.那87.].有趣的是,SVL诱导胼胝质合酶的表达,负调控赤霉素途径。此外,CBF14和CBF15上调Ga2ox5.使大麦中赤霉素失效的基因[88.].
众所周知,某些水果主要是由温度引起休眠的,如苹果和梨[89.].越来越多的证据强调了温度的作用,特别是在北方木本品种的情况下。虽然木本植物生长停止和休眠诱导的主要调节因子是短光周期,但它可能受到温度的调节,并与温度相互作用[17].低温诱导的直接调节作用越来越明显cbf在大坝基因表达(34.那37.那56.Niu等(2016)提供了证据并提出了CBF诱导的模型大坝和大坝下调英国《金融时报》然后抑制生长并刺激休眠的发展[38.].刘和谢瑞(2019年)进一步概述了一个模型,该模型集成了大坝调节的多种植物纪念网络[25].其中,DAM直接抑制细胞分裂素、赤霉素,直接激活ABA和胼胝质沉积是关键。我们的研究为细胞分裂素和IAA降解可能是诱导内休眠的重要调节机制提供了额外的证据。
结论
在这项研究中,在短光周期和低夜间温度处理下,两次测试的杨树品种之间的早期诱导和肺肺部肺部深度之间的差异与差异表达水平相关CBF1和PtDAM1芽中的基因以及生长促进生长的植物植物植物和叶片中的细胞蛋白的降解。但是,自其他大坝没有基因检查,就不能排除其他的可能性大坝基因参与。
方法
植物材料和休眠诱导条件
两个杂交杨树无性系,Walker (Populus deltoides var。occidentalis.×杨树petrowskyana)及澳洲人(P。“沃克”×P. Petrowskyana.)(由加拿大农业和农业食品公司Raju Soolanayakanahally提供)在与kalcits et al.(2009)相同的生长条件下被用于这项研究。[13].简单地说,硬木插枝种植在KEKKILÄ DSM 3w (Kekkilä Oy,芬兰)的繁殖介质中(富含泥炭和珍珠岩)。每个花盆(20 × 20 × 20厘米)放入大约20厘米长的插条。基部扦插苗种植前浸于INCIT-8 (Bioplant)生根刺激粉中。生根过程中培养基保持湿润。硬木扦插在PGR15生长室(Conviron PGR15, Controlled Environments Ltd, Winnipeg, MB, Canada) 22/20°C和75% RH条件下进行LD (18/6 h光照/黑暗)生长。然后移植物在20±5°C自然光下的温室中生长,每周施用Peters Professional 20-10-20 (N- p - k)肥料(稀释至100ppm N)一次。每棵植物只剩下4根最强壮、最健康的枝条。生根和生长期持续2个月。随后,当枝条长到30 - 40 cm时,转入18/3℃条件下SD条件(12/12 h,光/暗期)生长室诱导休眠30 d。 The length of the light period was then decreased further to 10-h day length for an additional 30 days (60 days in total). These temperature and light conditions ensured dormancy separation responses between Okanese and Walker [13].
休眠的评估
使用从Kalcsits等人的芽破裂方法测量休眠发育。(2009)[13].简而言之,从每个基因型的两个花盆中收集带有两个芽的小扦插。对于每个基因型和每个采样时间点,剪断20个分枝,在给定的时间点检测40个芽的发芽情况。岩屑放在玻璃管中的水中,并在连续22℃的LD条件下(18小时昼长)保存。在长达60天的实验诱导期中,每10天采集一次样品。芽苞被定义为休眠芽开始长出叶片的时刻,越长芽苞表明休眠程度越高(即更深)。休眠深度(ΔDBB)根据kalcits et al.(2009)计算,作为最后一个采样日与第一个采样日的发芽天数之差[13].
增长停止评估
生长枝条的长度从根部到顶端每周测量一次。每基因型7个花盆,4个分枝。增长率(cm *- 1),当生长率(几乎)达到零时,就认为植物已经停止生长。在这些检测中,我们使用不同的植物进行基因表达和激素分析。在整个实验过程中,这些植物都没有受伤。
基因表达研究
在光周期开始后4-6小时收集最小的完全扩展的叶子和中间分支芽样品(收集每个采样点的每次采样点,每个采样点和芽和芽),并立即在液氮中冷冻在-80°C直到RNA提取。样品通过Tissuicalser II(QIAGEN)设备(29Hz,1:30分钟)均质化。然后将700μL预热洗脱缓冲液(3%CTAB,1.4M NaCl,200mM EDTA,100mM Tris-HCl,2%PVPP,2%β-巯基乙醇和80μg/ ml蛋白酶K)加入到匀浆中。将管保持在65℃下10分钟。然后加入700μL酚 - 氯仿 - 异戊醇(25:24:1)。在12000rpm下离心5分钟离心后,将上阶段转移到新管中。加入氯仿 - 异戊醇(24:1),并在新的离心步骤(5分钟为12000rpm)后,通过加入0.1体积的Na-乙酸钠(3m,pH 5.2)和2体积沉淀RNA绝对乙醇。将混合物上载到直接ZOL™RNA MiniPREP试剂盒(Zymo Research,Corp.,Irvine,CA,USA),并根据制造商的说明完成了RNA隔离过程。 The residual DNA was digested by DNase enzyme and pure RNAs were used for cDNA synthesis. cDNAs were transcribed by M-MLV-RT enzyme (Promega Corporation, Madison, WI, USA) and Oligo (dT)18底漆(Thermo Fisher Scientific Inc.,Wilmington,Ma,USA)。将1500ng RNA以25μl终体积转录成CDNA,然后稀释至100μl的最终体积。将1.0μLcDNA溶液用于每种QRT-PCR。使用2x QPCRBIO Sygreen Blue,Mix单独的Rox(PCR Biosystems Ltd.,London,United Kingdom),用CFX96 Touch™实时PCR检测系统(Bio-Radgary Ltd.,Budapest,Hungary)测定基因表达水平。在10μl最终体积中。所有引物序列(在补充表中列出1),除了PtDAM1,收集自Menon et al. (2015) [58.].通过ΔΔCT方法计算归一化相对基因表达水平[90.].Ct值与常规Ct值归一化PT18S.rRNA基因(Supp。表1).在给定时间点测量的表达水平与每种基因型的第一天测量的表达水平进行比较。原始ΔΔct值包括在补充表中2.
将相对表达式值(折数变化)转换为对数2值,聚集和可视化与gittools软件的补充图。2[91.].
PtDAM1基因的鉴定
对于序列分析杨树trichocarpa从NCBI assembly服务器(https://www.ncbi.nlm.nih.gov/assembly.)在蛋白质组水平(GCF_000002775.4)。基于Pfam和隐马尔可夫模型(HMM)的蛋白质结构域搜索使用hmmscanHMMER 3.0软件软件包[92.].从杨树蛋白质组中收集的蛋白质使用MUSCLE比对方法进行比对(图1)。5.),并使用MEGA6软件包的最大似然系统发育树进行推断[93.].基于贝叶斯信息标准(BIC)最佳拟合,选择用于系统发育重建的Jones-Taylor-Thornton(JTT + G)替代模式。使用一千个引导型伪复制来测试推断的树的可靠性。
激素分析
根据Dobrev和Kamı́nek(2002)、Dobrev和Vankova(2012)以及Svačinova等人对最年轻的完全展开叶片样品(ca 50 mg FW)进行了纯化和分析。[94.那95.那96.].冷冻样品用冷(−20℃)甲醇/水/甲酸(15/4/1,v/v/v)均质并提取。加入以下同位素标记内标(10 pmol/样品):13C6.-IAA(剑桥同位素实验室);2H4.sa (Sigma-Aldrich);2H3.-Pa,2H3.-DPA(NRC-PTI);2H6.-Aba,2H5.-ja,2H5.-transZ,2H5.-transzr,2H5.-transZ7G,2H5.-transz9g,2H5.-transZOG,2H5.-transZROG,2H5.-transzrmp,2H3.-dz,2H3.-DZR,2H3.-DZ9G,2H6.知识产权,2H6.-ipr,2H6.-ip7g,2H6.-ip9g,2H6.-iprmp(olchemim)。通过用甲醇[菌丝,脱落酸(ABA),水杨酸(SA),茉莉酸(JA),和茉莉酸(JA)和用0.35米NH的洗脱进入基本分数4.OH在60%甲醇中[细胞分裂素(CKs)]。采用高效液相色谱(Ultimate 3000, Dionex)耦合到3200q TRAP杂交三重四极/线性离子阱质谱(应用生物系统)分析馏分。激素定量采用同位素稀释法,多水平校准曲线(r2> 0.99)。数据处理使用Analyst 1.5软件包(应用生物系统)进行。原始数据包含在附表中3..
统计分析
采用SPSS 22.0进行单因素方差分析和Scheffe事后检验。由于方差不等,使用了Levene检验,Brown-Forsythe跟踪稳健性均数检验。使用Scikit-learn Python模块(version 0.23)获得主成分分析(PCA)结果[97.和Python 3.8。在对数据集进行均值和方差标准化后,利用提取的6个分量进行奇异值分解进行线性降维。
数据和材料的可用性
所有相关数据都包含在稿件和补充材料中。
缩写
- 阿坝:
-
脱落酸
- ACC:
-
1-氨基环丙烷-1-羧酸
- 芭:
-
苯甲酸
- CBF:
-
C-repeat结合因子蛋白
- CZ:
-
cis-zeatin
- cZ7G:
-
CIS-Zeatin-7-葡糖苷
- cZOG:
-
CIS-ZEATIN-O-葡糖苷
- cZR:
-
Cis-zeatin核苷
- Czrog:
-
CIS-ZEEIN核苷-O-葡糖苷
- 坝:
-
Dormancy-associated MADS-box蛋白质
- DBB:
-
萌芽的日子
- 国际宇航科学院:
-
吲哚-3-乙酸
- 知识产权:
-
异戊烯基腺嘌呤
- IP7G:
-
异戊烯基腺嘌呤-7-葡糖苷
- IPRPM:
-
异戊烯基腺苷一磷酸酯
- 是:
-
茉莉酸
- Ox-IAA:
-
oxo-iaa.
- PA:
-
分子酸
- PCA:
-
主成分分析
- 山:
-
水杨酸
- TZ:
-
Trans-Zeatin.
- TZR:
-
反式炸素核糖苷
参考文献
- 1.
史密斯格MH,Weiser CJ。红奥西尔山茱萸气候比赛变异模式。生态。1968; 49:495-505。https://doi.org/10.2307/1934116.
- 2.
小林·杜兰特,藤上·LH。红柳山茱萸(Cornus sericea L.)断裂休息的温度效应模拟*。安机器人。1983;52:205-15。https://doi.org/10.1093/oxfordjournals.aob.a086566.
- 3.
克莱默PJ。日长变化对树木生长和休眠的影响。植物杂志。1936;11:127-37。https://doi.org/10.1104/pp.11.1.127.
- 4.
击败R,Borthwick H.光周期对树木生长的影响。BOT GAZ。1956; 117:310-26。
- 5。
木本植物的光周期现象。海洋科学1957;70:526-44。
- 6。
Weiser CJ。木质植物中的耐寒性和损伤:耐寒植物适应冻结压力的知识可能有助于我们减少冬季损害。科学。1970; 169:1269-78。https://doi.org/10.1126/science.169.3952.1269.
- 7。
海德OM。挪威云杉生态型(Picea abies)的生长与休眠I.光周期与温度的相互作用。杂志。1974;30:1-12。https://doi.org/10.1111/j.1399-3054.1974.tb04983.x.
- 8。
Juntttila O. PhotoCeriod和温度对Salix和Betula两种生长戒烟的影响。physiol植物。1980; 48:347-52。https://doi.org/10.1111/j.1399-3054.1980.tb03266.x.
- 9。
Tanino KK,Kalcsits L,Silim S,Kendall E,Gray Gr。落叶木质植物生长停滞和休眠发育中的温度驱动的可塑性:一种工作假设,旨在在休眠诱导期间温度受到温度的影响。植物mol biol。2010; 73:49-65。https://doi.org/10.1007/s11103-010-9610-y.
- 10.
Svendsen E,Wilen R,Stevenson R,Liu R,Tanino KK。与红色Osier Docwood中的休眠低温诱导相关的分子标记(山茱萸sericea).树生理。2007; 27:385-97。https://doi.org/10.1093/treephys/27.3.385.
- 11.
Olsen Je,Lee Y,Junttila O.交替的一天和夜间温度对短日诱导的芽组和随后在挪威云杉中的萌芽爆发的影响。前植物SCI。2014:1-11。https://doi.org/10.3389/fpls.2014.00691.
- 12.
Strømecb,julkunen-tiitto r,olsen je,Nybakken L.高日间温度延迟秋季芽形成杨树tremula在现场条件下。树生理。2016; 37:71-81。https://doi.org/10.1093/treephys/tpw089.
- 13.
高温加速了杂交杨树(Populus × spp.)短光周期诱导的生长停止和休眠。树木。2009;23:971-9。https://doi.org/10.1007/S00468-009-0339-7.
- 14。
Stinziano JR,Way Da。白色云杉幼苗幼苗的秋季光合下降和生长停止在变暖和光周期操纵下解耦。植物细胞环境。2017; 40:1296-316。https://doi.org/10.1111/pce.12917.
- 15.
Lang GA, Early JD, Martin GC, Darnell RL。内、对位和生态气味:休眠研究的生理学术语和分类。HortScience(美国)。1987; 22:22371-7。
- 16。
赵WS, Doğramacı M, Horvath DP, Foley ME, Anderson JV。芽和种子的休眠诱导和释放。见:植物休眠研究进展。Cham:施普林格国际出版;2015. p。235.–56.https://doi.org/10.1007/978-3-319-14451-1_14.
- 17。
Hänninen H, Tanino K.树在温暖气候中的季节性。植物学报。2011;16:412-6。https://doi.org/10.1016/j.tplants.2011.05.001.
- 18。
安德森·吉夫,霍维特DP,赵开,对我来说。常年植物中的芽休眠:生存机制。在:恶劣环境中的休眠和抵抗力;2010. p。69-90。https://doi.org/10.1007/978-3-642-12422-8_5.
- 19。
王志强,王志强,王志强,等。全球变暖背景下温带果树的休眠研究进展。Sci Hortic(阿姆斯特丹)。2011; 130:357 - 72。https://doi.org/10.1016/j.scienta.2011.07.011.
- 20。
Ding J,Nilsson O.树木中候选的分子调节 - 因为它们是季节的季节。CurrOp植物BIOL。2016; 29:73-9。https://doi.org/10.1016/j.pbi.2015.11.007.
- 21。
辛格rk,svystun t,aldahmash b,jönssonam,bhalerao rp。树木中酚类素质和温度介导的对照 - 分子视角。新植物。2017; 213:511-24。
- 22.
Maurya JP,Bhalerao RP。光周期和温度介导的树木生长戒烟和休眠控制:分子视角。Ann Bot。2017; 120:351-60。https://doi.org/10.1093/aob/mcx061.
- 23.
Beauvieux R,Wenden B,Dirlewanger E.常年果树种类的芽睡眠:氧化线索的关键作用。前植物SCI。2018:1-13。https://doi.org/10.3389/fpls.2018.00657.
- 24.
Wisniewski M,Nassuth A,Arora R.树木的冷酷质:迷你评论。前植物SCI。2018:1-9。https://doi.org/10.3389/fpls.2018.01394.
- 25.
Liu J, Sherif SM。落叶多年生木本植物芽休眠周期的激素调控。植物学报。2019:1-21。https://doi.org/10.3389/fpls.2019.01136.
- 26。
Stockinger EJ,Gilmour SJ,Thomashow MF。拟南芥CBF1编码与C重复/ RE结合的AP2域的转录活化剂,CIS作用DNA调节元件刺激响应低温和水缺损的转录。PROC NATL ACAD SCI。1997年; 94:1035-40。https://doi.org/10.1073/pnas.94.3.1035.
- 27。
刘强,徐志强,徐志强,等。DREB1和DREB2转录因子与EREBP/AP2 DNA结合域分别分离了拟南芥干旱和低温响应基因表达的两条信号转导通路。植物细胞,1998:1391 - 406http://www.plantcell.org/cgi/content/abstract/10/8/1391.
- 28。
细胞对脱水和冷胁迫的反应和耐受性的转录调控网络。植物学报2006;57:781-803。https://doi.org/10.1146/annurev.arplant.57.032905.105444.
- 29.
赵开,郎Z,朱吉岛。冷响应基因转录变得更复杂。趋势植物SCI。2015; 20:466-8。https://doi.org/10.1016/j.tplants.2015.06.001.
- 30.
王志强,王志强,王志强,等。木本植物抗寒性基因组学。植物科学学报2014;33:92-124。https://doi.org/10.1080 / 07352689.2014.870408..
- 31.
一种新的桃(Prunus persica) CBF转录因子在苹果(Malus ×家蝇)中的异位表达导致短日诱导休眠和提高抗寒性。足底。2011;233:971 - 83。
- 32.
陈志强,王志强,王志强,等。桃CBF基因在苹果中的过表达及其与木本植物生长、休眠和抗寒性整合的关系。植物科学学报2015:1-13。https://doi.org/10.3389/fpls.2015.00085.
- 33.
赵凯,周勇,谢旭东,韩勇,等。PmCBFs综合影响PMDAM6.通过替代的启动子结合和蛋白质复合物朝向芽的休眠李属却已.Sci众议员2018;8:4527。https://doi.org/10.1038/s41598-018-22537-w.
- 34.
赵克,周y,李y,zhu x,ahmad s,han y等。串然串扰PmCBFs和PmDAMs研究了冬小麦茎干在季节性冷胁迫下植物激素的变化李属却已.国际分子生物学杂志。2018;19:15。https://doi.org/10.3390/ijms19020015.
- 35.
本笃会C,Skinner JS,Meng R,Chang Y,Bhalerao R,猎人NPA等。CBF1依赖性低温信号传导途径,调节件和冻耐热的增加在杨树SPP中保守。植物细胞环境。2006; 29:1259-72。https://doi.org/10.1111/j.1365-3040.2006.01505.x.
- 36.
张志强,卓旭,赵凯,郑涛,韩勇,袁超,等。转录组分析揭示了激素和糖在梅花芽休眠中的重要作用。Sci众议员2018;8:5090。https://doi.org/10.1038/s41598-018-23108-9..
- 37.
李军,闫晓燕,杨强,马勇,杨斌,田军,等。PpCBFs选择性调节ppdam,参与梨芽内休眠过程。acta botanica sinica(云南植物学报);https://doi.org/10.1007/s11103-019-00837-7.
- 38。
牛强,李军,蔡东,钱敏,贾洪,白胜,等。休眠相关MADS-box基因和microrna共同调控梨(Pyrus pyrifolia white pear group)花蕾的休眠转变。J Exp Bot. 2016; 67:239-57。
- 39。
Horvath D.共同机制调节开花和休眠。植物SCI。2009; 177:523-31。https://doi.org/10.1016/j.plantsci.2009.09.002.
- 40。
Rodriguez AJ, Sherman WB, Scorza R, Wisniewski M, Okie WR。“常青”桃,其继承与蛰伏的行为。acta Hortic sinica, 1994; 119:789-92。
- 41。
范绍鹏,王勇,王亚东,王亚东,王亚东。影响几个候选基因的缺失在evergring.桃突变体。j hered。2004; 95:436-44。https://doi.org/10.1093/jhered/esh057.
- 42。
Bielenberg DG,Eileen Wy,Li Z,Zhebentyayeva T,Fan S,Reighard GL,等。桃子中常绿轨迹的测序和注释[碧桃(L.)Batsch]揭示了六种疯狂箱转录因子的集群,作为用于调节终端芽形成的候选基因。树遗传学基因组织。2008; 4:495-507。https://doi.org/10.1007/S11295-007-0126-9..
- 43。
霍尔维特DP。相关的疯狂箱基因:审查。在:植物休眠的进展。Cham:施普林格国际出版;2015. p。137-46。https://doi.org/10.1007/978-3-319-14451-1_7.
- 44。
Da Silveira Falavigna v,Guitton B,Cape e,Andrésf.我想要(芽)休息:大坝和SVP等基因在调节温带果树的休眠周期中的潜在作用。前植物SCI。2019:1-17。https://doi.org/10.3389/fpls.2018.01990.
- 45。
李志,Reighard GL, Abbott AG, Bielenberg DG。桃EVG位点的休眠相关MADS基因[碧桃(l)有明显的季节和光周期表达模式。J Exp Bot. 2009; 60:3521-30。https://doi.org/10.1093/jxb/erp195.
- 46.
Jiménezs,Li Z,Reighard GL,Bielenberg DG。使用休眠无能的树突变体鉴定与生长停止和芽休眠入口相关的基因。BMC植物BIOL。2010; 10:25。https://doi.org/10.1186/1471-2229-10-25.
- 47.
作者等。杏内生休眠相关PmDAM基因的功能与表达分析。植物杂志。2011;157:485 - 97。
- 48.
Mimida N,Saito T,Moriguchi T,Suzuki A,Komori S,Wada M.在苹果中表达休眠相关的疯狂箱(大坝)基因。BIOL植物。2015; 59:237-44。https://doi.org/10.1007/S10535-015-0503-4.
- 49.
引用本文:王志强,王志强,王志强,等。日本梨休眠相关MADS-box同源基因的克隆及其季节性休眠过渡阶段的特性中国科学(d辑:地球科学)2010;
- 50。
陈志强,陈志强,陈志强,等。休眠相关MADS box基因MADS13在不同冷态要求的日本梨(Pyrus pyrifolia Nakai)中的表达及基因组结构树杂志。2013;33:654 - 67。
- 51。
陈克y。II型疯子箱基因与杨树开发和休眠相关:马里兰大学;2008年。https://drum.lib.umd.edu/handle/1903/8152
- 52。
王志强,王志强,王志强,等。大叶松叶片休眠相关mds - box基因的克隆、表达及功能分析。acta botanica sinica(云南植物学报),2010;43(3):489 - 494。https://doi.org/10.1007/S11103-009-9596-5..
- 53.
Howe GT, Horvath DP, Dharmawardhana P, Priest HD, Mockler TC, Strauss SH杨树.植物学报2015;6:1-28。https://doi.org/10.3389/fpls.2015.00989.
- 54.
Balogh E,HalászJ,SoltészA,Erös-HontiZ,GutermuthÁ,Szalay L等。杏子中休眠调节剂基因的鉴定,结构和功能表征(李属armeniacaL.)。前植物SCI。2019:1-16。https://doi.org/10.3389/fpls.2019.00402.
- 55.
王志强,王志强,王志强,等。叶片DREB4A、DAM和FT的BAC文库构建及克隆特性研究大戟属eSula.识别差异剪接和保守启动子基序。杂草科学。2013;61:303-9。https://doi.org/10.1614/ws-d-12-00175.1..
- 56.
SAITO T,白S,IMAI T,ITO A,Nakajima I,Moriguchi T.在核心内发生的日本梨(Pyrus Pyrifolia)中的休眠相关的Mads-Box基因,PPMADS13-1的组蛋白修饰和信号级联。植物细胞环境。2015; 38:1157-66。
- 57.
佩里。树木在冬季的休眠。科学。1971;171:29-36。https://doi.org/10.1126/science.171.3966.29.
- 58.
黄志强,王志强,王志强,等杨树balsamifera在生长季节。新植物。2015; 207:710-22。https://doi.org/10.1111/3/13381.
- 59.
urrestarazu j,默兰蒂h,denancéc,leforestier d,ravon e,guyader a等。苹果中开花和成熟时期的基因组宽联型映射。前植物SCI。2017; 8:1923。https://doi.org/10.3389/fpls.2017.01923.
- 60.
Wells Ce,Vendramin E,Jimenez Tarodo S,Verde I,Bielenberg DG。桃子中疯子箱基因的基因组分析[蛋氏菌Perica(L.)沥青]。BMC植物BIOL。2015; 15:41。https://doi.org/10.1186/s12870-015-0436-2.
- 61.
张志强,张志强,张志强,等。黑杨的基因组,杨树trichocarpa(托。&灰色)。科学。2006;313:1596 - 604。https://doi.org/10.1126/science.1128691.
- 62.
Yamane H, Ooka T, Jotatsu H, Hosaka Y, Sasaki R, Tao R.表达调控PpDAM5和PpDAM6桃子(碧桃)休眠相关的疯饮箱基因,通过低温和休眠破坏试剂处理。J Exp Bot。2011; 62:3481-8。https://doi.org/10.1093/jxb/err028.
- 63。
Jiménez S, Reighard GL, Bielenberg DG。基因表达的达5.和达摩通过冷却温度抑制,与芽突率相反。植物mol biol。2010; 73:157-67。
- 64。
Ruttink T,Arend M,MorreeL K,Storme V,Rombauts S,Fromm J,等。杨树顶端芽形成和休眠诱导的分子时间表。植物细胞。2007; 19:2370-90。https://doi.org/10.1105/tpc.107.052811.
- 65。
Chao Ws,Foley Me,Horvath DP,Anderson JV。信号调节营养芽中的休眠。int j植物dev biol。2007; 1:49-56。
- 66。
乔木芽休眠的动态特性:环境控制和分子机制。Plant Cell Environ. 2012; 35:1707-28。https://doi.org/10.1111/j.1365-3040.2012.02552.x.
- 67。
Tanino KK。刺激植物中的激素和肺结泡诱导。J作物加速。2004; 10:157-99。https://doi.org/10.1300/J411v10n01_08.
- 68。
WINGLER A.测定每年和多年生植物增长的信号相互作用的比较响应低温。前植物SCI。2015:1-9。https://doi.org/10.3389/fpls.2014.00794.
- 69。
白蜡树顶芽的生长抑制物质。杂志。1949;2:37-44。https://doi.org/10.1111/j.1399-3054.1949.tb07646.x.
- 70.
桃花蕾中抑制剂与休止的关系。海洋科学,1961;77:107-16。
- 71.
Eagles CF,磨损PE。生长物质在芽休眠监管中的作用。physiol植物。1964年; 17:697-709。https://doi.org/10.1111/j.1399-3054.1964.tb08196.x.
- 72。
Olsen Je,Junttila O,Nilsen J,Eriksson Me,Martinussen I,Olsson O,等。Hybrid Aspen在杂种植物中的异位表达改变了临界日长的生长,防止了冷适应化。工厂J. 1997; 12:1339-50。https://doi.org/10.1046/j.1965-313x.1997.12061339.x..
- 73。
Tylewicz S,Peterle A,Marttila S,Miskolczi P,Azeez A,Singh Rk等。对季节性生长的光敏控制是由ABA作用于细胞 - 细胞通信的介导的。科学。2018; 360:212-5。https://doi.org/10.1126/science.aan8576..
- 74。
辛格,Miskolczi P, Maurya JP, Bhalerao RP。植物营养期短的树同源性花抑制因子介导芽休眠的光周期控制。咕咕叫医学杂志。2019;29:128 - 33. - e2。https://doi.org/10.1016/j.cub.2018.11.006.
- 75。
KosováK,普拉斯利,VítámvásP,Dobrev P,Motyka V,Flokovák等。寒冷耐寒性,冬季三山和春季粉末两种小麦品种寒冷适应植物植物反应。J植物理性。2012; 169:567-76。https://doi.org/10.1016/j.jplph.2011.12.013.
- 76。
dilianov DL, Dobrev PI, Moyankova DP, Vankova R, Georgieva DT, Gajdošová S,等。复活植物红景天干燥和恢复过程中内源激素的动态。植物生长调节剂。2013;32:564-74。https://doi.org/10.1007/s00344-013-9323-y.
- 77.
胡颖,姜玲,王飞,于东。茉莉酸对CBF表达诱导子- c - repeat结合因子/DRE结合因子1级联和抗冻性的调控拟南芥.植物细胞。2013;25:2907-24。https://doi.org/10.1105/tpc.113.112631.
- 78.
基于冷诱导CBF1因子依赖的信号通路通过影响赤霉素代谢调控生长抑制DELLA蛋白的积累。植物细胞。2008;20:2117-29。https://doi.org/10.1105/tpc.108.058941.
- 79.
侯旭,李丽春,夏轲,严勇,于洪辉。DELLAs通过与JAZs的竞争结合调控茉莉酸信号通路。Dev细胞。2010;19:884 - 94。https://doi.org/10.1016/j.devcel.2010.10.024.
- 80。
李海英,李淑芳,张胜,郑PJ,吴K-B,等。茉莉酸锌域蛋白9与纤细稻1相互作用介导水稻茉莉酸和赤霉酸信号之间的拮抗作用。植物学报。2018:1-11。https://doi.org/10.3389/fpls.2018.01866.
- 81。
Gondor Ok,Szalai G,Kovácsv,janda t,pálm.多胺和其他冷诱导响应机制的不同谷物物种之间的关系。J Agron作物SCI。2016; 202:217-30。https://doi.org/10.1111/jac.12144.
- 82。
Baldwin BD, Bandara MS, Tanino KK。萨斯卡通浆果的芽鳞成熟(Amelanchier alnifoliaNutt)后的植株在体外激素治疗。Acta Hortic 2000:203-8。https://doi.org/10.17660/actahortic.2000.520.21.
- 83.
团帕,白S,齐藤T,伊藤A,森口T。休眠相关的疯子盒(DAM)和脱落酸途径通过反馈机制调控梨内休眠。植物生理学报。2017;58:1378-90。https://doi.org/10.1093/pcp/pcx074.
- 84.
Wu R, Wang T, Warren BAW, Allan AC, Macknight RC, varkoni - gasic E.猕猴桃SVP2基因在休眠过程中防止早熟芽。J Exp Bot. 2017; 68:1071-82。https://doi.org/10.1093/jxb/erx014.
- 85.
吴锐,王涛,王涛,等。猕猴桃SVP2调控发育和干旱胁迫途径。植物学报。2018;96:233-44。https://doi.org/10.1007/s11103-017-0688-3.
- 86.
Knight H, Zarka DG, Okamoto H, Thomashow MF, Knight MR.脱落酸通过CRT启动子元件诱导CBF基因转录和随后的冷调节基因的诱导。植物杂志。2004;135:1710-7。https://doi.org/10.1104/pp.104.043562.
- 87。
Singh RK, Maurya JP, Azeez A, Miskolczi P, Tylewicz S, Stojkovič K,等。杂交杨树芽断调控的遗传网络。Nat Commun。2018;9:4173。https://doi.org/10.1038/s41467-018-06696-0..
- 88。
SoltészA,Smedley M,Vashegyi I,Galiba G,Harwood W,VágújfalviA。转基因大麦线证明了参与TaCBF14和TaCBF15在冷驯化过程和耐霜性方面。J Exp Bot. 2013; 64:1849-62。https://doi.org/10.1093/jxb/ert050.
- 89。
Heide OM, Prestrud AK。低温而非光周期控制苹果和梨的生长停止、休眠诱导和释放。树杂志。2005;25:109-14。https://doi.org/10.1093/treephys/25.1.109.
- 90.
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据−ΔΔCT.方法。方法。2001; 25:402-8。https://doi.org/10.1006/meth.2001.1262.
- 91.
Perez-Llamas C,Lopez-Bigas N. Gitools:使用互动热图分析和可视化基因组数据。Plos一个。2011; 6:E19541。https://doi.org/10.1371/journal.pone.0019541.
- 92.
基于概率推理的新一代同源搜索工具。基因组信息学。2009;23:205-11。https://doi.org/10.1142/9781848165632_0019.
- 93.
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析版本6.0。生物学杂志。2013;30:2725-9。https://doi.org/10.1093/molbev/mst197.
- 94.
关键词:植物生长素,细胞分裂素,固相萃取,分离纯化中国有色金属学报(英文版);https://doi.org/10.1016/s0021-9673(02)00024-9.
- 95.
盐胁迫下植物组织中脱落酸、细胞分裂素和生长素含量的测定。在:Shabala S, Cuin TA,编辑。植物耐盐。风险:胡玛纳出版社;2012.p . 251 - 61。https://doi.org/10.1007/978-1-61779-986-0_17.
- 96.
Svačinova J, Novák O, Plačková L, Lenobel R, Holík J, Strnad M,等。从拟南芥组织中分离细胞分裂素的一种新方法:移液管尖端固相萃取。工厂方法。2012;17。
- 97。
Pedregosa f,Varoquaux g,gramfort a,michel v,ripior b,grisel o等。Scikit-Learn:Python的机器学习。J Mach Learn Res。2011; 12:2825-30。https://doi.org/10.1145/2786984.2786995..
致谢
对于植物材料而言,作者想对Raju Soolanayakanahaly说,谢谢你,那些善待硬木扦插进行传播。作者想对Mónikae.Fehér说,因为她的技术援助。在统计分析中,DóraLakatos非常帮助,我们想对此表示感谢。
资金
国家科技发展与创新办公室“NKFIH”项目(no . K-111879, no . K-128575, no . PD-116564); eop -3.6.3- vekop -16-2017-00008)。关键词:岩石力学,蠕变,蠕变特性,蠕变特性该项目由欧洲联盟和欧洲社会基金共同资助。所有提到的资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中都没有发挥作用。
作者信息
隶属关系
贡献
Áb并同样贡献到这项工作,收集并分析了植物材料以及准备稿件。KT支持并控制整个项目与GG。BK建立了生物信息学分析。ZSM-T帮助实施实验。我有助于统计分析。在RV的实验室中进行了激素分析,PD的合作。所有作者都参与准备稿件并已阅读并批准稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者完全访问了所有研究数据,对数据分析的准确性承担全部责任,并对手稿准备和决定提交发布的稿件。没有任何竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:补充的图1
叶芽(A-E图)和叶(F-K图)的相对表达量PTCBF1,PTCBF2,PTCBF3,PTCBF4,PTCBF5和PTCBF6.奥帕尼斯(黑条)和步行者(白色酒吧)基因型的基因。表达水平由ΔΔCT方法确定。PT18S.rRNA基因作为家常化基因。每个基因型的平均表达值分别在零采样时间点按表达水平归一化。表达式的值在日志中显示2规模。误差条代表来自3个生物和3个技术复制的±SEM。‘nd’:未检测到表达水平。
附加文件2:补充的图2
叶片(L)中植物组合植物浓度的热爱和表达CBF年代和大坝在短光周期和低夜温60天的生长停止/休眠诱导处理下,对' Okanese ' (Ok)和' Walker ' (Wa)杨杂交品种叶片(L)和芽(B)的基因进行了研究。热图是由欧几里得距离聚集而成的。颜色条和字母代表研究基因表达和激素化合物水平之间的等级关系。
附加文件3:补充表1
引物的序列、熔融温度和GC含量。所有列出的引物序列,除了PtDAM1,收集自Menon et al. (2015) [58.].
附加文件4:补充表2
原始基因表达数据CBF基因。
附加文件5:补充表3
激素分析的原始数据。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
Boldizsar,。那Soltész, A., Tanino, K.et al。在两个对照中阐明早期生长停止和诱导内休眠的分子和激素背景杨树混合品种。BMC植物BIOL.21,111(2021)。https://doi.org/10.1186/s12870-021-02828-7
收到了:
公认:
发表:
关键字
- Endodormancy
- 增长停止
- PTCBFS.
- PtDAM1
- 基因表达
- 植物激素
- 杨树