抽象的
背景
Sainfoin(Onobrychis viciifolia是一种优质的豆科牧草,也是一种产蜜植物。因此,红花的花色是一个重要的农艺性状,但影响其花表型的因素尚不清楚。为了深入了解红豆苷中色素类化合物(类黄酮或花青素)代谢途径的调控网络,并识别关键基因,我们对红豆苷WF和AF的表型、代谢组和转录组进行了全面分析。
结果
红豆苷AF中主要的花青素类化合物为飞燕草苷、牵牛花苷和malvidin衍生物。在红豆毒的WF中未检测到这些物质。利用Illumina HiSeq4000平台获得红豆苷S1和S3期WF和AF的转录组。结果表明,在S1期和S3期(WF-VS-AF),共鉴定出10166个(4273个上调,5893个下调)和15334个(8174个上调,7160个下调)DEGs。KEGG通路注释显示,S1阶段有6396个unigenes注释到120个通路,包含866个DEGs; S3阶段有6396个unigenes注释到131个通路,包含1546个DEGs。通过RT-qPCR分析,鉴定了9个参与花色形成的“类黄酮生物合成”和“苯丙生物合成”途径的DEGs。在这些度中,4CL3.那霉那答那CHS.那DFR.和Chi2.表现出下调表达,和F3H与AF相比,在WF中表现出上调的表达,导致花青素合成减少和在苏丁素中形成WF。
结论
本研究是第一个使用转录组技术来研究塞丁福白花形成机制。我们的转录组数据将是Sainfoin遗传信息的巨大浓厚。此外,本文所呈现的数据将为遗传育种提供有价值的分子信息,并提供对Sainfoin的花色多态性的未来研究的洞察。
背景
Sainfoin(Onobrychis viciifolia铲)是一种多年生草本牧草豆类[1]广泛分布在世界北部的温带地区[2].它可以用作干草,颗粒,放牧和青贮饲料,因为它的适口性和营养的牧草特性高[2那3.那4.].特别值对于具有适当的浓缩的单宁含量,通过防止放牧动物腹胀来减少温室气体排放[2那5.那6.].研究发现,SAINFOIN也可以用作观赏植物,因为它的花卉形成了直立的RACEME,开花时期为2-3周[2].有些研究还发现,由于其美丽的花瓣和高糖含量,Sainfoin可以用作花蜜植物[7.那8.].因此,研究Sainfoin的花色对多功能应用的发展具有重要意义。
花卉颜色是自然界中植物最重要的园艺特征之一[9.].花的颜色变化可以通过吸引传粉者来发挥重要的生态功能,并影响开花植物的繁殖成功[10.]对植物演变至关重要[11.那12.].此外,鲜花的颜色直接或间接地与植物的农艺性状相关,经典的育种方法已被广泛用于开发各种颜色和强度不同的花朵的品种[13.那14.].花卉颜色受到许多因素的影响,最重要的是哪种不同种类的植物颜料,如黄酮类化合物和花青素[15.那16.].花青素是类黄酮的一部分,类黄酮是花色素的主要成分,它们是由高度保守的结构和调节成分产生的[17.那18.].在开花过程中,从隐性白色等位基因到色素可逆等位基因发生体细胞突变,花朵的杂色必然是基因表达调控差异的结果[19.].花青素生物合成途径包括涉及七种核心结构基因的多种代谢过程,例如CHS.那守护神那DFR.,答以及几种分支酶基因[20.].到目前为止,在许多植物中发现了与花色和黄酮类化合物相关的基因,例如白三叶草(Trifolium Repens.),苜蓿(紫花苜蓿), 白色的Primula Vulgaris.,草莓(Fragaria×ananassa)[14.那18.那21.那22.].然而,红豆苷花色素形成的相关候选基因的分子机制尚不清楚。
转录组技术可以在没有参考基因组的情况下为非典范植物的分子特征提供独特的见解,特别是在花色的研究中。它在许多植物中取得了成功,例如,羊草(羊草),西伯利亚野生店(Elymus sibiricus.),装饰蟹(马吕斯prunifolia)和菊花(Dendranthema Morifolium.)[23.那24.那25.那26.].据我们所知,目前还没有利用RNA-Seq来研究红豆花颜色的研究报道。因此,对红豆苷颜色突变的机制进行了研究,并对其关键基因进行了鉴定。在我们的研究中,我们以EMS处理和AF引起的红豆苷突变体WF作为实验模型。利用转录组技术、CIELAB颜色空间和UPLC评估花色苷生物合成途径中引起颜色转变的相关基因的变异和类黄酮中间体的差异。本研究结果为今后红豆苷分子育种提供了理论基础,为进一步研究彩花红豆苷提供了重要的分子基础,对了解红豆苷的颜色形成机制具有重要意义。
结果
花瓣颜色测量
Sainfoin的花瓣颜色参数如表所示1.L *值从0(黑色)到100(白色)变化,在我们的研究中,在WF和21.02的研究中,在我们的研究中,在AF中的亮度为28.67。代表发红的*值在AF和13.59中为3.58。代表蓝色的B *值在AF中的WF和2.32中为10.75。表示颜色鲜艳度的C *值为WF和13.79在AF中为11.29。代表基本颜色的H°值为WF和9.70中的71.58。总之,WF有更高(P. < 0.05) L*, b* and h°价值比af。相反,WF的A *和C *值显着低于AF(P. < 0.05). Therefore, these factors indicate that the petal colors of sainfoin are different.
索菲林花瓣中的主要着色化合物
UPLC分析显示,在WF和AF中检测到七种类黄酮及其衍生物:Kaempferol-3-O-Rhamnosyleys,Rutin,Kaempferolol-3-O-葡糖苷 - 苯丙二酸酯,槲皮素-3-O-葡糖苷,Kaempferol-3-o-rutinoside,isorhamnetin - 3-O-rutinoside和Kaempferol-3-O-葡糖苷(表2).然而,在AF但不是WF中检测到三种类黄酮(Kaempferol-3-O-葡糖苷-P-核酸酯,槲皮素-3-O-rhamnosidel-p-courmaric酯,Kaempferol)。在这些化合物中,只有Kaempferol-3-O-葡糖苷 - 苯基丙酸酯在WF中显示出较高的含量(P. < 0.05), and the other flavonoid and derivative contents were lower in WF than in AF (P. < 0.05). However, five anthocyanidins and their derivatives (delphinidin-3,5-diglucoside, petunidin-3,5-diglucoside, delphinidin-3-rutinoside, petunidin-rutinoside and malvidin-rutinoside) were only detected in AF. No anthocyanidin was detected in WF. Similarly, two procyanidins were detected in our study; only proanthocyanidin was detected in WF, while catechin hydrate was detected only in AF (Table2).总之,Sainfoin花瓣中着色化合物类型和含量的差异是颜色变化的主要原因。
De Novo组装Sainfoin转录组
在S1和S3阶段从SAINFOIN花瓣(WF和AF)提取的12种总RNA文库被构建用于转录组测序。总共获得了547,329,260种的原始读数,总共获得了82,099,389,000 NT。然后过滤出低质量的读数,总共546,658,468个清洁读数,从12个测序文库中获得了总共81,319,631,904nt以进行进一步分析(附加文件1).简而言之,在去除低质量和污染读取后,保留清洁读取以进行进一步分析。最后,使用Trinity方法组装总共53,009个unigenes,N50的N50为1587nt,长度为201至15,519 nt,平均长度为903 nt(附加文件2).
基因注释Sainfoin转录组
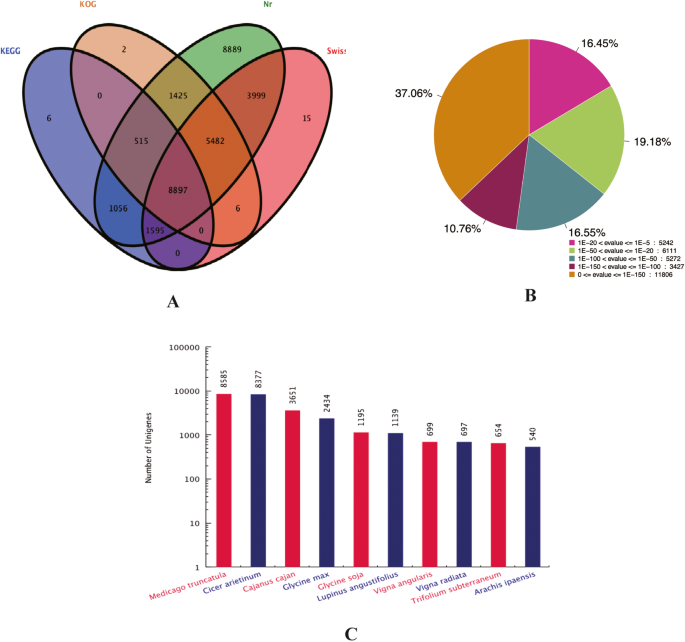
总共,31,887个unigenes(53,009个unigenes的60.15%)通过Blastx(E-Value <1×10)注释至少一个数据库- 5)(表3.).在31,858个unigenes(60.10%)中,分别向NR,Swiss-Prot,Kog和Kegg数据库分别向NR,Swiss-Prot,Kog和Kegg数据库进行19,994名3.).另外,6,2,15和8889个未分别注释kegg,Kog,Swiss-Pro和NR数据库(图。1一种)。根据NR数据库,共有5242个unigenes(占31,858个unigenes的16.45%给NR)显示了同源性(1×e- 20.< E值≤1 × E- 5),11,383(35.73%)unigenes表现出强烈的同源性(1×e- 100. < E-value ≤1E- 20.)和15,233(47.82%)unigenes表现出非常强烈的同源性(E值≤1e- 100.)(图。1b)。对于通过爆炸获得的物种命中的分布,8585 unigenes匹配同源序列Medicago Truncatula.,而8377,3651,2434,1195和1139 unigenes匹配同源序列Cicer Arietinum.那Cajanus cajan,甘氨酸最大那甘氨酸Soja.和卢比斯angustifolius分别(图。1C)。基于GO分析,共有11,558名(21.80%)的未成年人使用GO分配成功注释,并分为三个主要类别:生物过程,蜂窝分量和分子函数(附加文件3.).
探测和分析DEGS
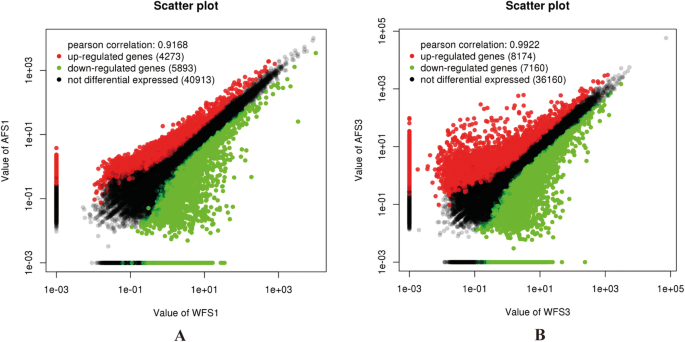
通过假发现率(FDR)<0.05的转录组中获得的基因,绝对LOG2比率≥1被选择为后续分析的显着参数(附加文件4., 图。2).为了分析WF和AF中的花色形成差异,我们比较了同一朵花发育阶段的WF和AF的次数。基于这些分析,在S1阶段,我们鉴定了4273个上调的DEG和5893(WFS1-VS-AFS1)(图。2一种)。类似地,在S3阶段,上调8174个unigenes,下调其他7160个unigenes(WFS3-Vs-AFS3)(图。2b)。S3阶段中的次数大于S1阶段的次数,表明随着生长期的延长,塞芬素的WF和AF之间的差异逐渐增加。
去分析DEGS
为了分析DEG的功能,我们在同一朵花发育阶段进行WF和AF之间的次数,以通过GO注释术语来浓缩分析。在S1阶段,总共6389只分为三种本体:生物过程,细胞组分和分子功能。对于生物过程本体论,“代谢过程”,“细胞过程”和“单生物过程”是最常见的术语,分别与801,684和557次有关。对于“代谢过程”,有376个上调的unigenes和425个下调的unigenes;对于“细胞过程”,有313个上调的unigenes和381个下调的unigenes;对于“单有机物过程”,有269个上调的未知unigenes和288个下调的外在人;和“排毒”(1个未成分),“生物粘合”(2 unigenes)和“生长”(5 ungenenes)罕见。对于细胞组分本体,该末端主要富集为“细胞部分”(155个上调的未解压,165个下调的未经成果),“细胞”(155上调的未经成人,165个下调的未经成根),“膜”(131个上调的外在人,150个下调的unigenes)和“细胞石”(109个上调的外在人,135个下调的unigenes)。对于分子函数本体学,该末端主要与“催化活性”(293上调的未知unigenes,431个下调的unigenes)和“结合”(285个上调的unigenes,344个下调的未知unigenes)子类别(附加档案5., 图。3.一种)。类似地,在S3阶段,总共将11,880次分为三个本体。对于生物过程本体学,还富集了参与“代谢过程”(797上调的未经食品,699个下调的未知),“细胞过程”(704上调的未经植物,600名下调的未知)和“单生体过程”(539上调的unigenes,450个下调的unigenes)。在细胞组分本体中,该DEG主要与“细胞部分”(384个上调的unigenes,261个下调的未经成果),“细胞”(384上调的未经成根,261个下调的unigenes)和“膜”(257个上调的unigenes,220下调,下调unigenes)子类别。对于分子函数本体学,该DEG也主要富集为“催化活性”(794个上调的未经成本,716个下调的未经成根)和“结合”(607上调的未经成根,514个下调的未经人)(附加档案5., 图。3.b)。
DEGS的Kegg途径浓缩分析
为了深入研究这些DEGs的生物学功能,我们基于KEGG数据库进行了富集分析。在WFS1-VS-AFS1比较中,共将6396个unigenes与866个DEGs分配到120个KEGG通路中,在WFS3-VS-AFS3比较中,共将6396个unigenes与1546个DEGs分配到131个KEGG通路中(附加文件)6.).在S1阶段,WF和AF之间的含量在“类黄酮生物合成”(KO00941)中,“苯丙烷生物合成”(KO00940)和“次级代谢物”(KOO1110)的“生物合成”,以及在S3中的WF和AF之间的次数在“次级代谢产物”(KOO1110),“亚油酸代谢”(KO00591)和“苯丙吡喃化生物合成”(KO00940)中,阶段显着富集。
在这些途径中,预测了与直接或间接影响花卉颜色有关的DEG。黄酮类化合物,花青素及其衍生物是主要的花卉颜色颜料,因此我们鉴定了三种代谢途径,其中11个代谢途径,用于控制黄酮类化合物和花青素的生物合成(表4.,附加文件7.).在“苯丙烷化生物合成”(KO00940)途径中,一滴(4CL3.)被注释。在“黄酮类生物合成”(KO00941)途径,八次(守护神那ANR那霉那答那CHS.那DFR.那Chi2.和F3H)被注释。在“类黄酮和黄酮和黄酮化生物合成”途径(KO00944),两次(FG3.和PMAT1)被注释。所有这些基因都用于分析索菲宁的花色变化的表达模式。
定量实时PCR分析与脱落有关的DEGS
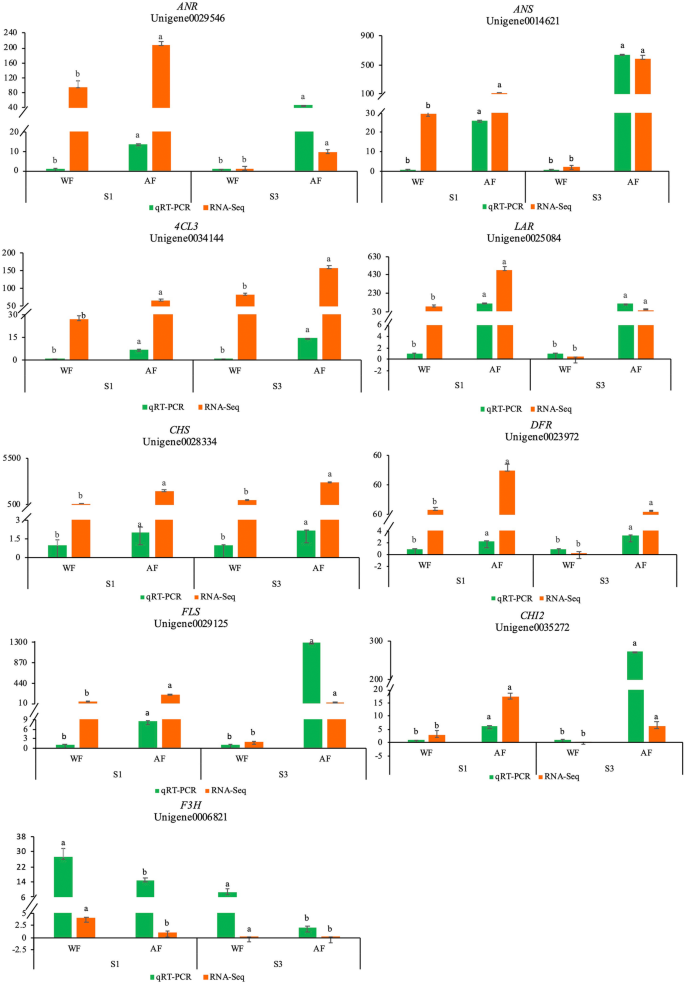
为了测试RNA-SEQ数据的可靠性和再现性,设计了基因特异性引物,用于11候选末eg。内源参考(附加文件8.)是JZ818469基因。从Sainfoin的Wf和AF的花瓣中提取的RNA样品用作模板,并且基于RT-QPCR验证了与S1和S3级的花色相关的选定基因。在候选人场中,只有F3H在WF的表达水平比AF中具有更高的表达水平,WF中的其他8个表达水平的基因均低(图。4.).通过T检验分析了在S1和S3阶段的WF和AF之间的RT-QPCR数据的显着差异,RT-QPCR的结果表现出与RNA-SEQ数据模式几乎相同的表达模式,证明了RNA-SEQ数据的可靠性。此外,另外两种基因的表达水平(FG3.和PMAT1)的RT-qPCR检测结果与RNA-Seq数据不一致,所以我们没有在图中显示。4..
讨论
AF和WF之间的花青素组分和色彩水平的变化
颜色突变体广泛用于园艺和其他作物。已经发现,导致植物中的花色突变有许多因素,例如离子束突变,γ辐射和EMS诱变[27.那28.].其中,EMS诱导的花色突变已广泛用于黄瓜[29.], 白饭 [30.]和黑孜然[31.].然而,没有关于EMS诱变的应用报告,以引起塞丁福的花色变化。在这项研究中,我们使用EMS诱变来获得WF材料,用HPLC和Clelab方法获得AF作为控制,以研究AF和WF的化学物质和表型。目前,Sainfoin中黄酮类化合物和花青素的鉴定和定量研究主要关注叶片,少于花瓣[32.那33.].regos [34.据报道,塞福素花蕾含有Isorhamnetin衍生物,槲皮素衍生物,芦丁和儿茶素。在我们的研究中,除了上述物质外,我们还检测到Kaempferol及其衍生物,德尔菲凡蛋白衍生物,喇叭蛋白衍生物,麦类衍生物和原花青素。在这项研究中,AF的总黄酮含量显着高于WF。发现了类似的结果Primula Vulgaris.[35.],Fragaia ananassa[36.] 和芍药[37.].这可能是红豆草花色变化的主要原因。同样,我们仅在红豆苷的AF中检测到花青素生物合成途径中的飞燕草苷、牵牛花苷、malvidin衍生物和儿茶素。Lou的研究也发现了类似的现象。38.,报告花青素及其衍生物未在WF中检测到穆斯卡里armeniacumF。专辑。这是因为花青素的还原导致花瓣在颜色中减轻[39.].
植物中花表型的变化与颜料的组成有关。钟发现降低了花青素Paeonia Lactiflora.导致花期L*值增加,a*值降低[40].汉族发现了一种类似的现象,他报道葡萄酒中的14个单分子花青素与L *,B *和H°值呈负相关,并与*和C *值呈正相关[41.].在我们的研究中,我们发现,WF中的花青素含量(与AF)的降低导致L *,B *和H°值增加,并降低A *和C *值。我们的研究结果与以前的研究一致。总之,花色的变化与索蛋白花瓣中着色化合物的类型和含量密切相关,并通过相关基因控制这些化合物的合成。
参与类黄酮生物合成途径的基因受到不同的调控
黄酮类化合物和花青素的生物合成是植物次生新陈代谢领域的研究热点,现在良好地了解相关信号的性质以及信号转导途径如何连接生物合成基因[42.那43.].此前的研究发现,类黄酮是许多植物花瓣中最重要的色素之一,而类黄酮生物合成途径的最终产物花青素产生的颜色范围最广,从淡黄色到蓝紫色[44.那45.].我们的结果表明,红豆苷中AF和WF的色差是由于WF中丢失了malvidin、petunidin和飞燕草苷衍生物。这是由于花青素在WF中的生物合成受阻,这在很大程度上是由基因调控的[14.].因此,通过比较AF和WF转录组中候选基因的丰度,确定了导致WF的代谢的关键基因。我们在与花色形成相关的2个代谢途径中发现了9个不同的基因,即“苯基丙氨酸”(4CL3.)及“类黄酮”(守护神那ANR那答那弗尔斯S,DFR.那Chi2.和F3H途径。在我们的研究中,4CL3.那守护神那ANR那霉那答那CHS.那DFR.和Chi2.在AF中显示出比在WF中更高的转录水平,但是F3H显示相反的表达模式。这表明这些基因表达的变化可能会影响Sainfoin的颜色变化。
“苯丙烷化生物合成”途径通过顺序作用转移到二次代谢与二次酚醛代谢的碳流朋友那C4H.和4CL.[46.].4CL.可以分别将4-香豆酸,芥酸酸,芥酸酸,芥酸酸盐分别转化为同源辅酶硫醇酯,这是黄酮类化合物和异载物的生物合成的重要步骤[47.那48.].ehlting [49.]克隆了4CL.基因家庭拟南芥并证明了这一点AT4CL3参与黄酮类化合物的生物合成途径。在我们的研究中,RNA-SEQ数据显示塞纳丁4CL.在AF和WF之间差异表达。我们的RT-QPCR结果表明,AF中的转录大约比WF中高约14倍。这是AF中的黄酮内容高于WF中的主要原因(表2).在段的研究中获得了类似的结果[14.]据报道,谁报道了转录的表达4CL.在紫花苜蓿的紫色花上高于奶油花。这表明减少了4CL.表达是伊恩福林白花瓣出现的主要原因之一。
“黄酮生物合成”途径与黄酮类化合物的生物合成和积累直接相关[50.那51.].花青素的生物合成途径是苯丙烷丙烷和黄酮途径的分支,并且在各种酶的催化下合成了花青素[52.].黄烷酮和花青素在许多植物中对花卉颜色形成和多样性起着至关重要的作用[15.].CHS.对螯合的生产至关重要,这是合成所有花青素和大多数其他黄酮代谢物的前体[53.].减少CHS.转录水平导致WF线Muscari Botryoides.那矮牵牛织布达和Parrya Nudicaulis.[54.那55.那56.].我们的结果表明CHS.AF的基因表达高于WF,这很好地证实了前人的研究结果。ch是一种涉及类黄酮合成的关键酶,也是黄酮类颜料生物合成所需的酶之一[57.].以前的研究表明,表达减少或活性不足ch将严重妨碍许多植物中的类黄酮生物合成途径,导致花青素和黄酮类化合物的含量显着降低[58.那59.], 尽管ch过度表达可以增加类黄酮含量[60.].在我们的研究中,我们发现表达了Chi2.在AF高于WF中。这是为什么AF中的黄酮和花青素含量高于WF中的主要原因。F3H催化黄芩苷生物合成所必需的黄酮类化合物的羟基化[38.].在本研究中,RT-QPCR检测到的表达F3H在WF中高于AF。苜蓿和康乃馨的研究表明,低表达F3H导致更深的花朵颜色[14.那61.].这是因为氰基代谢分支有效地限制了F3H基因[18.].有趣的是,原霉素在白花瓣中发现,表明白花瓣是由于缺乏花青素生物合成途径下游基因。霉是负责形成槲皮素和芦丁的主要酶[21.].正如QRT-PCR结果所证明的那样霉AF中的基因表达高于WF中的基因表达。这是为什么AF中的槲皮素和芦丁含量高于WF中的主要原因(表2).这DFR.基因可以将二氢烷醇减少到无色的亮藻啶蛋白;这答基因可以将无色的白藻藻胺转化为有色麦芽素,pelargonidin和delphinidin [15.].的表达答在WF低于在我们研究中在WF中检测到AF和花青素的(图。4., 桌子2);因此,ANS基因可能是在WF中不可能积累花青素的关键因素,这与Li [18.].许多研究报告说,低表达DFR.妨碍着色的色素沉着拟南芥那Dianthus Caryophyllus.和Dendranthema Morifolium.[62.那63.那64.].因此,可以推断出来的CHS.那Chi2.那DFR.那答那霉和F3H基因是导致未累积WF中着色化合物的关键因素。我们的结果与先前研究的结果一致[31.那51.那52.].
原花青素的特定生产途径包括守护神和ANR,两者都是它们合成的关键酶[65.].守护神可以将白藻藻霉素转化为儿茶素[66.].这ANR基因是一种花青素还原酶,其可以将花青素转化为在黄酮型途径中产生的原花青素所需的黄烷-3-OL [67.].在我们的研究中,儿茶素在AF而不是索芬素的WF中检测到,并且原花青素显示出相反的图案。此外,RNA-SEQ数据和RT-QPCR显示出表达的表达ANR和守护神AF中的基因高于WF的基因。总的来说,高表达守护神与WF相比,AF的基因导致AF中的高等儿茶素含量。这结果与王的结果类似[68.].然而,我们的结果与谢的结果相反[69.],谁报告过过度表达ANR在拟南芥叶片导致花青素损失和原霉素积累。因此,角色的作用ANR红豆草的花瓣基因有待进一步研究。
总之,与AF的相比,WF的黄酮类生物合成途径被抑制在上游4CL3..的表达下调4CL3.那霉那答那CH.S,DFR.,Chi2.导致类黄酮和类黄酮化合物,如芦丁、山奈酚及其衍生物的减少,减少花青素的合成。同时,表达水平较高F3H可能会破坏花青素的合成,导致形成WF。
结论
通过UPLC,RNA-SEQ和RT-QPCR比较了亚氨素中苋菜和白瓣的黄酮和花青素的内容和代谢途径。在Sainfoin的AF中的主要花青素是麦芽素,喇叭蛋白和德尔菲凡蛋白衍生物,但在WF中未检测到这些花青素。在Sainfoin中出现Wf的主要原因是与黄酮类化合物和花青素生物合成相关的多种基因的差异表达,导致黄酮类化合物和花青素的类型和含量的差异。我们的RNA-SEQ数据大大丰富了Sainfoin基因组研究。我们的结果将为遗传育种提供有价值的分子信息,并为未来对塞丁海素的花色多态性进行了参考。
方法
植物材料
sainfoin(Onobrychis viciifolia本实验中使用的SCOP'Mengnong')由内蒙古农业大学提供。这一品种是由1994年牧草品种资源登记委员会批准的,注册为新品种(品种登记号码:151)。与此同时,它还在农业部畜牧业和兽医部门进行了记录。在18小时后,产生50%Sainfoin种子杀菌(LD50)的EMS(Sigma Co.)浓度为0.9%(v / v)。将用LD50处理的种子转移到该领域中,在2013年发现WF突变体,其种子单独收集。在混合和种植另外三代后,在2017年证实了来自F4代的WF。2018年5月,在内蒙古农业大学的实验基地种植了AF和WF植物,位于华北地区蒙古(Latitude)(纬度)的呼和浩特40°8.0’N, longitude: 111°69’E, elevation: 1058 m). The four developmental stages were defined according to the petal changes: S1, calyx higher than petal; S2, calyx and petal equal in height; S3, calyx lower than petal; S4, floret in full bloom (Fig.5.).
花瓣颜色测量
花瓣颜色在S3阶段用比色仪(NH300, 3nhh,中国)与D65光源测量。颜色表示为CIELAB [70[每处理每种花卉和10朵花的平均值(L *,A *,B *,C *和H°)和平均每处理的六个测量值。L *表示颜色的亮度,从黑色(0 =黑色)到白色(100 =白色)。颜色参数a *和b *从-60到60变化;a *描述了发红和绿色,b *描述了黄色和蓝色。C *用于表示颜色的饱和度,并且C *值越高,颜色越饱和。H°表示颜色的色调,其中0°=红色和270°=蓝色[71.].
黄酮类化合物的提取与定性及定量分析
在液体氮气和粉末(20mg)中,将冷冻干燥的瓣在液氮中研磨。使用1mL 0.1%乙酸/甲醇用于在4℃下萃取样品过夜。用10分钟以10000rpm离心提取物。用超高效液相色谱仪对三重 - 四极孔质谱仪(XEVO®-TQ,水,MILFORD,MA,MA,USA)的超高型液相色谱仪进行鉴定和定量,进行了一种超高的性能液相色谱仪,具有ESI [34.].基于相应的标准化合物的强度,从特征质谱序列的离子峰的峰面积计算相对花青素和类黄酮含量。Masslynx™(V 4.1,SCN 846,Waters Corp.,UK)用于质谱数据采集和数据分析。SDS是从三个生物学重复获得的。
RNA提取,cDNA文库构建和测序
对S1和S3阶段的Sainfoin的AF和WF的花瓣进行取样,总共有12个样品,包括三种生物重复。将所有样品保存在-80℃以进行RNA提取。通过QIAGENRNEASY植物迷你套件的使用说明书提取总RNA。RNA浓度和质量由Nanodrop 2000(Thermo Fisher Scientific,Waltham,Ma,USA)确定。然后使用Ribo-Zerotm磁试剂盒(ePicenter)去除RRNA后富集mRNA。CDNA文库是基于富含NEBNEXT®ULTRA™II RNA库预备套件的富含MRNA,适用于Illumina®之后的制造商的说明书。将cDNA储存在-80℃下进行测序和RT-QPCR实验。通过Gene Denovo Biotechnology Co.,Geneovo Denovo Biotechnology Co.,RNA-SEQ图书馆测序。
De Novo转录组组件,Unigene注释和DEG分析
在Bioproject ID下,我们的转录组数据集沉积在NCBI数据库中:prjna643568。通过除去适配器,未知的核苷酸(> 10%)和低质量读取(Q值≤10),用从原始读取过滤的清洁读数进行转录组De Novo组件。然后,FASTQC(http://www.bioinformatics.babra.ham.ac.uk./ Projects / FASTQC /)用于验证序列质量,包括Q20,Q30和GC含量的清洁读数。自Sainfoin以来(O. viciifoliaSCOP)基因组信息不可用,使用参考基因组独立三位一体方法将所有12种样品的清洁读数组合用于转录组的DE Novo组装[72.].使用Trinity软件包将尺蠖、蛹和蝴蝶组件组合在一起[73.].首先,尺蠖将一定长度的短的干净读取与重叠结合形成较长的contigs。其次,根据它们的端对信息,clean read被Chrysalis映射回相应的contigs。最后,通过Butterfly分析读取和对读取所采取的路径。转录本的最终序列被定义为unigenes。使用BLASTx程序注释所有已组装的ungene (http://www.ncbi.nlm.nih.gov/blast/)对于NR数据库,e-value <0.00001的阈值(http://www.ncbi.nlm.nih.gov),Swiss-prot蛋白质数据库(http://www.expasy.ch/sprot/),kegg数据库(http://www.genome.jp/kegg.)、KOG数据库及GO (http://www.geneontology.org.)[74.].UNIGENE表达被标准化为RPKM值,并通过edger软件在样品或组中鉴定差异表达基因,具有折叠变化的标准| ≥ 2, and FDR < 0.05 (http://www.r-project.org/).接下来,对所有次数进行Go和Kegg浓缩分析,以及超高度测试P. ≤ 0.05 as a threshold were used to determine the significant enrichment of GO terms and KEGG pathways.
RT-QPCR分析
通过一步RT-QPCR测定表情合成中的11种选择的eg。使用SYBR(Takara)对ABI 7500系统(Applied Biosystems)进行实验。DEG的引物由Primer Premier 5.0(Premier,Canada)设计,参考基因是JZ818469(附加文件8.)[75.].使用2分析DEG的相对表达水平-△△CT.方法(76.].每个样品(包括三种生物重复)一式三份量化。
所有数据都使用T-Test(SPSS Ver.19.0)进行统计分析,它们作为平均值±SD表示。效果被认为是显着的P. < 0.05.
数据和材料的可用性
所有原始序列数据可在NCBI项目PRJNA643568和序列读取归档(SRA),接入号SRR12130587, SRR12130586, SRR12130585, SRR12130584, SRR12130583, SRR12130582, SRR12130581, SRR12130580, SRR12130579, SRR12130578, SRR12130577和SRR12130576。地址如下:https://submit.ncbi.nlm.nih.gov/subs/sra..
缩写
- 可见:
-
差异表达基因
- NT:
-
核苷酸
- 爆炸:
-
基本的局部比对搜索工具
- NR:
-
NCBI NOREDWORD蛋白
- Kegg:
-
Kyoto基因和基因组的百科全书
- Kog:
-
直际蛋白质群体
- 瑞士科:
-
手动注释和审查的蛋白质序列数据库
- 去:
-
基因本体论
- RPKM:
-
每百万千克读数读取
- RT-qPCR:
-
实时定量PCR
- ESI:
-
电喷雾电离
- SDS:
-
平均值和标准偏差
- 4CL.:
-
4-香豆素:COA Ligase
- 答:
-
花青素合成酶
- ch:
-
Chalcone异构酶
- CHS.:
-
查耳酮合酶
- DFR.:
-
二氢烷醇4-还原酶
- F3H:
-
黄烷酮-3-羟化酶
- 霉:
-
黄酮醇合成酶
- 守护神:
-
花青素还原酶
- ANR:
-
Leucoanthocyanidin还原酶
- FG3.:
-
黄酮-3-O-葡糖苷
- PMAT1:
-
异黄酮7-O-葡糖苷-6“-O-丙基转移酶
- UPLC:
-
超高效液相色谱 - 质量
- WF:
-
白色的花
- 房颤:
-
苋菜花
参考文献
- 1。
Klliker R, Kempf K, Malisch CS, Lüscher, Andreas。提高牧草豆类红豆素生产性能和原花青素(Onobrychis viciifolia吟游诗人)。Euphytica。2017;213(8):179。
- 2。
Bhattarai S,Coulman B,Biligetu B. Sainfoin(Onobrychis viciifolia):作为加拿大西部的一种饲料豆类重新引起了人们的兴趣。植物学报,2016;96(5):748-56。
- 3.
威尔曼D,Asiedu FHK。生长,营养价值和绵羊绵羊,红三叶草,卢塞恩和杂交黑麦草的选择。j agr sci。1983; 100(1):115-26。
- 4.
Brinkhaus AG,Wyss U,Arrigo Y,Girard M,Bee G,Zeitz Jo,Kreuzer M,Dohmemeier F.在体外瘤胃发酵特性和利用的CP供应和鸟类和鸟类的CP供应和其与其他豆类的混合物。动物。2017; 11(4):580-90。
- 5。
讨厌B,哈特·碳罗纳克,Stringano E,Sales Lf,Smith Lm,Muellerharvey I,Hendriks WH,Pellikaan WF。浓缩的单宁结构的多样性会影响索丁体外甲烷产量的瘤胃(Onobrychis viciifolia)加入。草牧草sci。2015; 70(3):474-90。
- 6。
Girard M,Dohmemeier F,Wechsler D,Goy D,Kreuzer M,Bee G. 3个香味牧草的能力修改牛奶和Gruyère型奶酪的质量。j乳制品sci。2016; 99(1):205-20。
- 7。
理查兹·吉尔兹,爱德华兹PD。索菲林粉粉粉的密度,多样性和效率,Onobrychis viciafoliaSCOP。可以entomol。1988; 120(12):1085-100。
- 8。
凯尔斯ar。Sainfoin:蜜蜂的另一种饲料作物。蜜蜂世界。2001; 82(4):192-4。
- 9。
张益,周泰,戴泽,戴XY,李文,曹mx,李克,蔡维克,吴昕,翟捷,刘祖,吴SS。比较转录组织在Pleione Limprichtii兰花人群中提供了对花色多态性的洞察力。int j mol sci。2020; 21(1):247。
- 10。
Sun T,Yuan H,Cao H,Yazdani M,Tadmor Y,Li L.类胡萝卜素代谢在植物中:塑性的作用。莫尔植物。2018; 11(1):58-74。
- 11.
戴维斯km,albert nw,schwinn ke。从降落灯到模拟:花环的分子调节和色素沉着图案化机制。Funct植物Biol。2012; 39(8):619。
- 12.
富豪FP,约翰逊SD。粉丝器介导的花卉信号的演变。趋势ECOL EVOL。2013; 28(5):307-15。
- 13。
Hanumappa M,Choi G,Ryu S,Choi G.合理设计的主干阴性Chalcone合成酶调制花色。J Exp Bot。2007; 58(10):2471-8。
- 14。
段人力资源,王立,崔gx,周Xh,段xr,杨hs。使用RNA测序分析鉴定控制苜蓿花色素沉着变化的调节网络和轮毂基因。BMC植物BIOL。2020; 20(1):1-17。
- 15.
Tanaka Y,Sasaki N,Ohmiya A.植物颜料的生物合成:花青素,玻璃苷,贝甲虫和类胡萝卜素。工厂J. 2008; 54(4):733-49。
- 16。
Tripathi Am,Niranjan A,Roya S.全球基因表达和大麻两种对比花色品种的颜色分析。植物理性生物生物。2018; 27:1-10。
- 17。
植物色素的遗传与生物化学。植物学报。2006;57(1):761-80。
- 18。
李X,王继,赵杰,郑y,王鹤,吴x,xian c,lei jj,zhong cf,张yt。基于转录组测序和代谢物分析的粉红色开花草莓花瓣中的Cyanidin代谢研究。BMC植物BIOL。2019; 19(1):1-16。
- 19。
李啊,Ma R. M YJ,Zhang F,Duan Hr,Yang Hs,Tian Fp,周Xh,王厘米。枸杞子的转录组分析。在果实成熟过程中,在花青素生物合成途径中的结构和调节基因的洞察力提供了洞察力。Plos一个。2018; 13(12):1-12。
- 20。
Holton Timothy A,Cornish EC。花青素生物合成的遗传学和生物化学。植物细胞。1995; 7(7):1071-83。
- 21。
李L,Zhai Yb,Luo XB,张YC,Shi QB。比较转录组分析揭示了紫色紫花状品种的红色和白色樱草属植物中的色素沉着的基因。physiol mol biol pla。2019; 25(4):1029-41。
- 22。
张H,Tian H,Chen M,Xiong J,Cai H,Liu Y.转录组分析揭示了在白三叶草红花突变体中参与花卉色素沉着的潜在基因(Trifolium Repens.L.)。基因组学。2018; 110(3):191-200。
- 23。
李X,刘某,元朗,赵鹏,杨,贾俊,程立,齐,陈某,刘G。比较转录组分析为羊草截然萌发的见解(羊草)在种子发展期间。植物理性生物生物。2019; 139:446-58。
- 24。
谢WG,张建国,赵诗,张玉,王子。转录组仿形物Elymus sibiricus.作为青藏高原上的一种重要牧草,它揭示了与种子落粒有关的候选基因的新见解。植物学报。2017;17(1):78。
- 25。
黄B,荣H,YE YJ,Ni ZX,徐M,张WX,徐洛。观赏蟹苹果花色变异的转录组分分析(马鲁斯SPP。)通过Illumina和PacBio续集测序的半SIB系列。植物理性生物生物。2020; 149:27-35。
- 26。
Lu C,Pu Y,Liu Y,Li Y,Qu J,Huang H,Dai S.比较转录组和加权基因共表达网络分析(WGCNA)揭示了菊花叶蛋白酶含量的类胡萝卜素积累的潜在调控机制。植物理性生物生物。2019; 142:415-28。
- 27。
使用离子束的Hirooyasu Y.突变育种观赏植物的繁殖。育种科。2018; 68(1):71-8。
- 28。
Akhtar S,Sikder S,Biswas P,Hazra P,D'Souza SF。番茄中突变的诱导(Solanum lycopersicum.L.)通过伽玛辐照和EMS。印度j群植物品种。2013; 73(4):392-9。
- 29。
2 .王振华,龚振华,田淑玲。甲基磺酸乙酯浓度和不同处理条件对中国长(9930)黄瓜种子萌发和幼苗生长的影响。中国海洋大学学报(自然科学版)。
- 30.
AWAIS A,Nualsri C,索参W.使用乙基甲烷磺酸盐(EMS)在泰国旱稻(CV.DAWK PA-YAWM和DAWK KHA 50)中产生可变性的诱变诱变。Sarhad Jagr。2019; 35(1):293-301。
- 31.
Amin R,Wani Mr,Raina A,Khursheed S,Khan S.诱导的黑孜然群体的形态和染色体多样性(Nigella SativaL.)使用γ射线和乙基甲磺酸乙酯的单一和组合处理。约旦j生物科学。2019; 12(1):23-30。
- 32.
Malisch C,Luscher A,Baert N,Engstrom MT,Studer B,Fryganas C,Suter D,Mueller-Harvey I,Salminen J.Sainfoin含量和组合物的大变异性(Onobrychis viciifolia).食品化学。2015;63(47):10234-42。
- 33.
Nigel CV,Ionela R,Geoffrey CK,Dieter T.来自饲料豆类的酰化黄酮糖苷,Onobrychis viciifolia(红豆草)。植物化学,2011;72(4 - 5):423 - 9。
- 34。
Regos I,Urbanella A,Treouter D.饲料豆类素蛋白鉴定和定量酚类化合物(Onobrychis viciifolia).j农业食品化学。2009; 57(13):5843-52。
- 35。
李岚,翟玉波,罗晓波,张永昌,石启波。比较转录组分析揭示了与红色和白色花瓣色素沉着相关的基因Primula Vulgaris.品种。physiol mol biol pla。2019; 25(4):1029-41。
- 36。
李X,王继,赵杰,郑烨,张耶。基于转录组测序和代谢物分析的粉红色开花草莓花瓣中的Cyanidin代谢研究。BMC植物BIOL。2019; 19(1)。
- 37。
郭L,王Y,Silva Ja,Fan Y,Yu X.转录组和化学分析显示涉及花色变化的推定基因芍药'珊瑚日落'。PPB。2019; 138:130-9。
- 38。
楼强,刘玉玲,齐亚宇,焦淑贞,田飞,姜玲,王永军。转录组测序和代谢产物分析揭示了飞燕草素代谢对葡萄风信子花色的影响。[J] .机器人。2014;65(12):3157-64 .]
- 39。
杨Q,元HH,太阳XB。两棵树牡丹品种开花时期花色变化的初步研究。Acta Hortic Sin。2015; 42(5)。
- 40。
钟PX,王LS,李斯,徐yj,朱ml。花卉颜色与颜料组成的变化在开花时期inpallas。Acta Horticulturae Sinica。2012; 11。
- 41。
韩佛,张文,潘Qh,郑克,陈海,段CQ。青春期赤霞珠葡萄酒中Cielab颜色与单体花青素关系的主要成分回归分析。分子。2008; 13(11):2859-70。
- 42。
植物酚类化合物的生物合成、遗传学和生态生理学研究进展。植物生理学报。2013;72(1):1 - 20。
- 43。
郝泽,刘平Sq,hu lf,s js,chen jh。转录组分析和代谢分析揭示了类胡萝卜素在花瓣着色中的关键作用LiriDendron Tulipifera.园艺研究.2020; 70(1)。
- 44。
周勇,吴晓霞,张志。桃花颜色斑纹的比较蛋白质组学分析。Biochem Bioph Res Co. 2015;464(4): 1101-6。
- 45。
王烨,王子,宋ZQ。Microrna858a和Hy5的抑制Mybl2和Hy5导致invoOcyanin生物合成途径的激活拟南芥.莫尔植物。2016; 9(10):1395-405。
- 46。
道格拉斯CJ。苯丙代谢和木质素生物合成:从杂草到树木。植物科学进展。1996;1(6):171-8。
- 47。
Gang Dr,Lavid N,Zubieta C,Chen F,Beuerle T,Lewinsohn E,Noel JP,Pichersky E.来自甜罗勒的苯并丙烯O-甲基转移酶的表征:植物O-甲基转移酶系列内底物特异性和会聚进化的容易变化。植物细胞。2002; 14(2):505-19。
- 48。
Cukovic D,Ehlting J,Vanziffle Ja,Douglas CJ。4-香豆素的结构和演化:辅酶酶酶(4CL.)基因家庭。Biol Chem。2005; 382(4):645-54。
- 49。
Ehlting J,Büttnerd,王Q,道格拉斯CJ,Somssich Ie,Kombrink E.三个4-香豆酸盐:辅酶拟南芥代表被子植物中两个进化上不同的纲。植物j . 1999; 19(1): 9-20。
- 50.
赵德克,陶报。装饰植物中花色发展和调节的最新进展。前植物SCI。2015; 6:261。
- 51.
Nakatsuka T,Nishihara MM,Mishiba K,Yamamura S.黄酮类生物合成相关基因的时间表达调节龙胆植物的花卉色素沉着。植物SCI。2005; 168(5):1309-18。
- 52.
方泽,侯zh,王泉,刘泽,魏某,张yx,宋jh,尹jl。转录组分析显示了荞麦中花青素的累积机制(Fagopyrum esculentum烟囱。)子叶和花。int j mol sci。2019; 20(6):1493。
- 53.
Achilonu CC,Maleka FM。Chalcone合成酶的表征及表达分析(CHS.)和花青素合成酶(答)基因Clivia miniata.OMICS发布组。2016; 4(2)。
- 54.
Katsumoto Y, Fukuchimizutani M,福井Y, Brugliera F,霍尔顿助教,卡兰M,中村N, Yonekurasakakibara K, Togami J, Pigeaire,道《GQ》,Nehra NS, Lu CY戴森BK,津田年代,Ashikari T, Kusumi T,梅森詹,田中Y工程的玫瑰类黄酮生物合成途径成功生成blue-hued花花翠素积累。植物学报。2007;48(11):1589-600。
- 55.
Spitzer B,ZVI MM,Ovadis M,Marhevka E,Barkai O,Edelbaum O,Marton I,Masci T,Alon M,Morin S,Rogachev I,Aharoni A,Vainstein A.逆向遗传学的逆向遗传:烟草拨浪鼓病毒的应用基因在喇叭花中沉默。植物理性。2007; 145(4):1241-50。
- 56.
辛西娅AD,杰森B,蒂莫西B,马修LC,丹尼尔JK,贾斯汀BW。北极芥菜花青素生物合成途径的阈值花瓣特异性下调控制的花色多态性。《公共科学图书馆•综合》。2011;16(4):1 - 10。
- 57.
吴毅,朱我,江y。硫酮异构酶的分子表征(ch)调节草本牡丹中的花色(Paeonia Lactiflora.颇尔。)。J Intent agr。2018; 17(1):122-9。
- 58。
van tunen aj,koes Re,拼写Ce,van dkar,Stuitje AR,Mol JN。来自Petunia hybrida的两种Chalcone黄酮异构酶基因的克隆:坐标,光调节和类黄酮基因的差异表达。Embo J. 1988; 7(5):1257-63。
- 59。
Kim S,Jones R,Yoo Ks,Pike Lm。洋葱中的金色(Allium Cepa.):Chalcone异构酶基因的自然突变导致过早的止段密码子。Mol Gen Genomics。2004; 272(4):411-9。
- 60。
Muir SR,Collins GJ,Robinson S,Hughes S,Bovy A,Ric DVCh,Van Tunen AJ,Verhoeyen Me。在番茄中培养的豆氨基酮异构酶的过度表达导致含有含水平的黄酮水平。NAT BIOTECHNOL。2001; 19(5):470-4。
- 61。
Masami M,Takashi O,Yoshihiro O,Daisuke H,Yoshio I,Tamotsu H,Hiroyuki Y,Michio S. flavonoid生物合成,粉红色开花品种源自“William Sim”康乃馨(Dianthus Caryophyllus.).J JPN SoC Hortic SCI。2001; 70(3)。
- 62。
陈Sm,李世,朱克,邓扬,太阳,王ls,陈fd,张z。黄酮类化合物的鉴定与菊花花粉中的花青素生物合成基因的表达。Biol platarum。2012; 56(3):458-64。
- 63。
Stich K,Eidenberger T,Wurst F,Forkmann G.使用花提取物将二氢酚酰胺转化为Flavan-3,4-二醇的酶促转化Dianthus Caryophyllus.L.(康乃馨)。Planta。1992年; 187(1):103-8。
- 64。
Feyissa DN,Lvdal T,Olsen Km,Slimestad R,Lillo C.内生GL3., 但不是egl3.,基因对于通过氮耗尽诱导的花青素积累是必需的拟南芥莲座舞台叶。Planta。2009; 230(4):747-54。
- 65。
朱Q,隋,林雷X,杨Z,鲁克,刘G,刘yg,李米,韩y。菌菌的异位表达的异位表达植物素型原霉素调节剂基因SsMYB3改变转基因烟草中的花色。Plos一个。2015; 10(10):E139392。
- 66。
Han YP,Vimolmangkang S,Soria-Guerra R E,Korban S.苹果介绍ANR基因导入烟草后,抑制CHI和DFR基因在花中的表达,导致花青素丢失。实验机器人。2012;(7):2437-2447。
- 67。
Syrine G,Seizic L,Olivier C,Laurence G.Sucoanthocyanidin还原酶和花青素还原酶基因表达和肺炎,幼小浆果和皮肤的幼虫和皮肤。开发期间赤霞珠。植物理性生物生物。2009; 47(4):282-90。
- 68。
王培青,刘玉军,张丽娟,王文忠,侯华,赵颖,姜新林,于军,谭海瑞,王玉英,谢大勇,高丽萍,夏涛。植物类黄酮碳正离子参与原花青素生物合成的功能研究。植物j . 2020; 101(1): 18-36。
- 69。
谢迪,沙姆达B,Paiva NL,Ferreira D,Dixon Ra。花青素还原酶在植物黄酮类生物合成中编码的植物中的作用。科学(纽约,N.Y.)。2003; 299(5605):396-399。
- 70。
张益,周Th,戴泽,戴XY,魏路,曹mx,李克,蔡WC,吴XQ,翟捷,刘ZJ,吴SS。比较转录组织在Pleione Limprichtii兰花人群中提供了对花色多态性的洞察力。int j mol sci。2020; 21(N1):247。
- 71。
崔HL,张YN,Shi XL,龚FF,Xiong X,Kang XP,兴通用,Li S。黄花菜数值分类和分级标准(Hemerocallis.)花色。Plos一个。2019; 14(6):1-16。
- 72.
Grabherr M, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Xian A, Lin F, Raktima R, Regev A.不含参考基因组的RNA-Seq数据的全长转录组组装。生物科技Nat》。2011;29(7):644 - 52。
- 73.
程QM,白SQ,GE GT,Li P,Liu Ly,Zhang CD,佳ys。基于RNA-SEQ的两种Alfalfa品种脱落性状相关基因的研究。BMC基因组学。2018; 19(1):1-8。
- 74.
陈俊,段yj,胡yl,li wm,sun dq,hu hg,xie jh。Atemoya Pericarp的转录组分析阐明了多糖代谢在收获后果实成熟和裂缝中的作用。BMC植物生物学。2019; 19(1)。
- 75.
王jj,赵y,雷我,歌曲mz。苜蓿的转录组反应与耐受耐热性放牧的耐受性相关。科学报告.2016; 6(1):19438。
- 76.
Livak KJ,Schmittgen TD。使用实时定量PCR和2-ΔΔCT方法分析相对基因表达数据。方法。2001; 25(4):402。
致谢
我们感谢植物分子生理学,中国科学院植物学院和基因Denovo生物技术有限公司(中国广州)提供技术支持。
资金
本研究得到了内蒙古自治区应用技术研究和开发基金项目(2019GG244)的支持。资金机构没有参与数据的设计和收集,分析和对数据的解释或写作稿件。
作者信息
隶属关系
贡献
FLS构思和设计了实验。YQ和YTZ进行了实验。QY和QMC写了稿件。YQ,WY和FYY进行了数据分析。所有作者审查并被视为最终手稿。作者读并批准了最终的稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
乔,Y.,Cheng,Q.,张,Y.等等。转录组和化学分析鉴定征征素花的颜色变异的候选基因。BMC植物BIOL.21,61(2021)。https://doi.org/10.1186/s12870-021-02827-8.
收到了:
公认:
发表:
关键词
- 红豆草
- 黄酮类动物
- 花青素
- 转录组
- 度
- 花色