抽象的
背景
木豆(Cajanus Cajan.L.)是印度亚大陆,非洲和东南亚广泛种植的第六次重大豆科作物。细胞质雄性不育(CMS)是开花植物在花药期间生产可行的花粉的无能。CMS广泛用于鸽子豌豆的商业杂交种子生产。然而,鸽子豌豆中的分子基础仍然不清楚和未确定。在该研究中,使用Illumina成对结束测序进行细胞质雄性无菌线(AkCMS11)与其生育恢复系(AKPR303)之间的差异表达基因(DEGS)的转录组分析。
结果
共鉴定出3167个差异表达载体,其中AKCMS11表达上调1432个,下调1390个。通过对TAIR数据库3167个基因的查询,共鉴定出34个鸽子豌豆同源基因,涉及花粉发育的基因较少(EMS1,MS1, ARF17)并编码具有较低表达在无菌芽中的MYB和BHLH转录因子,意味着它们在花粉无菌中的作用。许多这些含量涉及碳代谢,三羧酸循环(TCA),氧化磷酸化和反应性氧物质(ROS)的消除表现出降低AkCMS11(无菌)芽的表达。
结论
比较转录组结果表明这些参数在花粉发育或堕胎中的潜在作用,指向它们参与鸽子豌豆中的细胞质雄性不育。在本调查中确定的候选参数对于进一步的研究非常重要,因为它们可以在揭开鸽子豌豆中的CMS的分子机制方面提供全面的基础。
背景
细胞质雄性不育(CMS)是植物中的母体遗传性状,它们无法产生功能性花粉[1].这是由于不寻常的线粒体开放阅读框(开放源码软件)它们是嵌合体,表达蛋白,限制线粒体功能和花粉发育[2].细胞质雄性不育表型是由核基因恢复的,称为育性恢复因子(RF.),从而导致具有异常线粒体基因组的植物产生功能性花粉[3.].CMS /RF.因此,系统可以清楚地看到核基因组和线粒体基因组之间的相互作用和冲突[4].细胞质雄性不育系统随着恢复系的出现,已成为利用杂种优势或杂种优势提高作物产量的可靠工具[5].杂交种子生产技术主要涉及三种育种系统:(a)CMS线,携带雄性无菌细胞质,缺乏功能核RF.(b)保持系,包含可育细胞质与相似RF.(c)含有育种细胞质的恢复系和功能性显性RF.基因(s)。所产生的F1杂种具有显性RF.基因以恢复雄性生育率和核基因的混合物,从无菌和肥沃的系中导致杂交活力[2].在20世纪50年代,第一个用于杂交玉米生产的CMS系统是玉米CMS- texas (CMS- t)系统,它大大增加了杂交种子产量,显著提高了玉米产量[6].迄今为止,在植物CMS和育性恢复的分子基础研究方面取得了令人瞩目的进展。许多与雄性不育相关的线粒体基因已被报道,如URF.源自maize [7],PCF.与ATP9.矮牵牛基因[8,9和萝卜ATP8.ogura cms [10].然而,在鸽子豌豆中,与细胞质雄性无菌相关的基因并未探索。
在有花植物中,花药发育是一种高度受控的机制,需要适当的芽孢组织分化和及时的小孢子发生[11].没有雄性配子体(雄蕊)或缺陷的花药的发育,花粉母细胞(PMC)或Tapetum细胞的破坏,花粉异常发育,以及花药失败导致花粉堕胎[12,13].在所有情况下,由于功能障碍线粒体基因组的CMS主要负责花粉发育的破坏[14].细胞器线粒体对绒毡层和小孢子的发育至关重要[14].在花粉发育的不同阶段,对能量的需求极高,线粒体功能稍有缺陷就会产生危害,导致花粉不育[15,16,17].以往的研究已经确定了许多在花药发育中起关键作用的基因拟南芥viz。无孢子细胞(SPL) /诺佐(出处)[18,19,20.,21],多余的小孢子母细胞1(EMS1)[22,23],Tapetum Compentinant1.(TPD1)[24],夭折的小孢子(AMS公司),男性STERILITY1(MS1)[25,26,27],myb基因家族(atmyb103)[28,29],破裂的花粉粒1(RPG1),细胞色素P450.(CYP703A2),细胞色素P450.(CYP704B1),酰基-CoA合成酶5(ACOS5),LAP6.和LAP5.[30.,31,32,33,34,35,36,37]冗余促进花药开发和调用合成酶5(CALS5)对于胼lexionens至关重要[38].
木豆(Cajanus Cajan.(L.)Millsp。)属于家庭Fabaceae.并被视为世界各地的第六个主要豆科作物[39].它普遍地以其高蛋白质含量而闻名[40]和耐旱性[41].它是全球范围内的一个重要脉搏作物,主要在热带和次热带地区培养(http://faostat.fao.org.).为了满足日益增长的对木豆的需求,在过去的十年里,人们进行了广泛的研究,在开发杂交技术方面取得了突破[42].大规模杂种种子生产的预先要求是花粉转移方法和稳定的细胞质雄性无菌(CMS)系统的推进。由于自我授粉性质,其他豆类在其他豆类中无法探索雄性不育现象。然而,鸽子豌豆具有相当大的自然交叉[43].直到日期,八1到A.8)通过三角杂交,在培养的鸽豌豆核背景中转移野生亲属的细胞质,在核心杂交之后进行了几轮后横向[44].因此,基于细胞质雄性不育的杂种种子技术已经有机会通过有效地增加鸽豌豆的产量潜力来克服生产限制[45].但是,在八个系统中,一个2和一个4从野生型获得的CMS系统Cajanus scarabaeoides和cajanus cajanifolius.分别被视为高潜在的CMS系统[46,47,48].与CMS相关的基因4据报道,细胞质鸽豌豆豌豆[49].最近,鸽子豌豆中生育恢复的遗传学2细胞质进行了详细研究[47].即使是A.2细胞质在杂交制种中起着重要的作用,而在a2细胞质鸽子豌豆仍然没有知道。
目前,下一代测序技术彻底改变了生命科学领域,提供了学习基因组和转录组数据的非凡速度和成本效益[50,51].RNA-SEQ已成为转录组谱的有效方法,其提供基因表达水平的准确测量[52].转录组测序在单一分析中易于识别和评估成千上万的基因[53].先前在许多作物中报道了细胞质雄性无菌线的转录组分析,例如萝卜[54,西瓜55],大豆[56], 番茄 [57],芸苔属植物显著[58], 辣椒 [59)、棉花(60,61,62],甜橙[63]导致这些系统中的几种候选基因的鉴定。在本研究中,对比较转录组分析A.2CMS系统衍生的细胞质雄性无菌,鸽子豌豆中的生育恢复系主要是为了检测参与花粉发育的差异表达基因,这可能有助于了解本作物中的CMS机制。
结果
花粉育性分析及不育芽和可育芽的表型特征
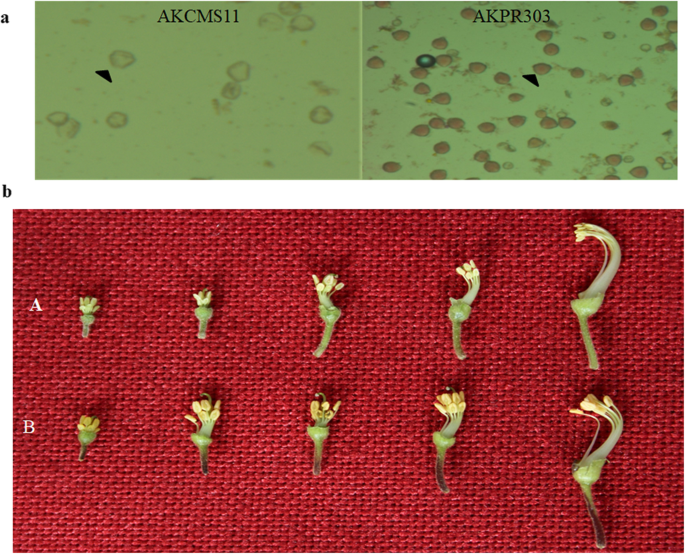
用显微镜观察雄性不育芽和育芽花粉,并对其育性进行评价。观察发现,花粉粒呈红色乙酰卡明染色,不育花粉不染色,育性强(图)。1一种)。在无菌(Akcms 11)和肥沃的表型调查期间,我们观察到与肥沃的花朵相比,无菌花的细丝和白花朵较小。清晰可见,因为肥沃线的花药比无菌线更密集(图。1b)。
转录组测序和从头组装
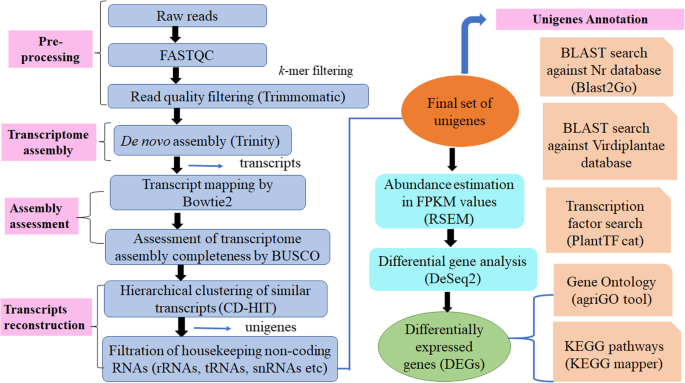
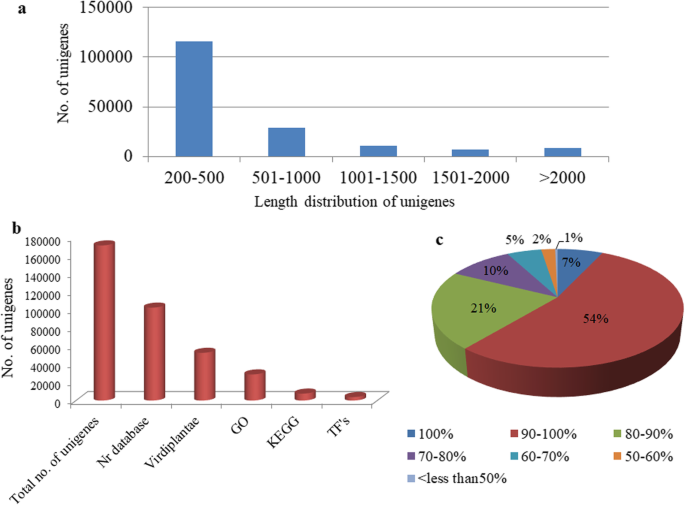
为了创造参考转录组,我们从鸽子豌豆中的雄性无菌(CMS)和肥沃(恢复剂)线的芽中制备了cDNA文库(两种重复)并进行Illumina成对结束测序。完成的分析的工作流程图如图2所示。2.高通量测序在不育芽和可育芽中分别产生了109,600,365和72,575,988个~ 100 bp的原始对端序列。同时,通过计算Pearson相关系数(R.< 0.9)使用R studio包。相关分析表明,不育系和可育系的复制数据集与Pearson的相关系数值分别为r = 0.72和r = 0.74呈正相关(附加文件1:图S1)。每个碱基序列质量和k-mer对端原始读取的内容也被确定(附加文件1:图S2和表S1)。在适配器修剪和消除质量差的读取后,分别获得101,676,579(49.5 GB)和69,481,226(32.7 GB)清洁读数,分别用于AKCMS11(无菌)和AKPR303(肥沃)线。Trinity软件进一步用于从样品中获得汇集读数(171,157,805)的De Novo组装。共有1,98,587个转录物,平均长度为641.34 bp,N50值为1009bp(l50 = 6个折叠)。我们利用Bowtie2将清洁读数与组装的转录组合将92.84和92.84%的对准得分分别用于无菌Akcms11(复制1和复制2)。类似地,对对准得分为92.61和92.05%,分别用于肥沃的AKPR303(复制1和复制2)。(附加文件1:表S2)。总体对准率为92.58%,表明装配的可靠性。BUSCO分析显示,我们的装配相对完整,98% (N = 297) of BUSCOs detected as complete sequences, just 2% (N = 6) as fragmented sequences, and none were missing in the assembly with eukaryotic lineage. Similarly, 93.5% (N = 402) of BUSCOs detected as complete sequences, 5.8% (N = 25) as fragmented sequences, and just 0.7% (N = 3) were missing in the assembly with viridiplantae lineage (Table1).通过CD-HIT软件重新组装,共获得1 72061个unigenes。这些unigenes在Rfam数据库中进行BLASTN搜索,去除非编码rna (rRNA、tRNA、snoRNAs、snRNA等)。最终,获得了1 71095个unigenes,平均长度为561.66 bp, N50为757 bp2). 单核苷酸最短、最长分别为201 bp和16008 英国石油公司。我们获得了1,15792个单核苷酸(67.7%),长度在200到500之间 英国石油公司。17692个单基因(10.3%)大于1000个 血压和8700(5.1%)大于2000 bp(图。3.a). unigenes平均GC含量为45.8%。本研究产生的RNA-Seq原始数据已存入NCBI Sequence Read Achieve (SRA)数据库(SRX3740150、SRX3740151、SRX3740153、SRX3740152),用于不育芽和可育芽。
单基因的功能注释和分类
注释结果显示,在Nr、Virdiplantae、GO和KEGG数据库中分别注释了1 02,463条(60%)、52,639条(30.6%)、28,812条(16.7%)和7653条(4.4%)unigenes。3.b).在nr数据库中共注释了102,463条(60%)unigenes,而剩余的40% unigenes与nr数据库没有任何序列相似性(附加文件2:表S1)。序列相似性分布显示,61%的对齐的unigenes的序列相似性大于90%以上,另一方面,38.6%的unigenes在50至90%之间具有相似性,并且仅0.4%的unigenes低于50%(图。3.c).总共有52,639个unigenes被唯一地映射到Virdiplantae数据库(附加文件2:表S2)。
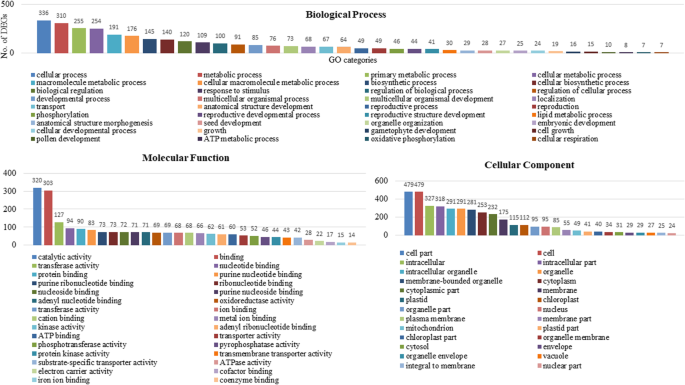
分配了28,812个未成年人,术语术语,分为53个GO类别,包括26个生物学过程,14个分子功能和13个细胞组分。在生物过程类别中,“细胞过程”(19,472 unigenes)是最主要的官能团,其次是“代谢过程”(17,365个未成年人)和“生物调节”(9627个unigenses)。在分子函数类别中,“结合”(19,531 unegenes),“催化活性”(14,7,757 unigenes)和“转录调节剂活性”是主要的官能团。关于细胞组分,“细胞”(22,732 ungigenes)和“细胞部分”(22,732个未成粒)是最大的类别,然后分别为“细胞器”(15,348个未成粒)和“大分子复杂”(附加档案2:表S3和附加文件3.:图S1)。
将7653个unigenes定位到KEGG通路数据库中,共涉及132条通路。结果表明,5条最大的途径分别是“代谢途径”(ko01100)、“次生代谢产物生物合成途径”(ko01110)、“植物激素信号转导途径”(ko04075)、“碳代谢途径”(ko01200)和“氨基酸生物合成途径”(ko01230)。7653个unigenes被划分为六个功能类别(附加文件2:表S4和附加文件3.:图S2)。在“代谢”中,在“代谢途径24.8%”(24.8%)的“二次代谢物生物合成”中涉及“代谢途径”,881(16%),870(15.8%),在“碳水化合物代谢”,665中,共有5499个unigenes(12.1%)在“氨基酸代谢”中,“脂质代谢”和其他子类别中的458(8.3%)。1222个未成年人占“遗传信息和加工”的类别,其中449(36.7%)unigenes从事“折叠,分类和退化”,其次是“翻译”446(36.5%),“转录”181(14.8%)和“复制和修复”146(11.9%)。“环境信息处理”由462个ungigenes表示,416(90%)涉及“信号转导”和“膜运输”中的46(10%)。另外,分别在“细胞过程”和“有机体系统”类别中分类了300和155个unigenes。
转录因子的鉴定
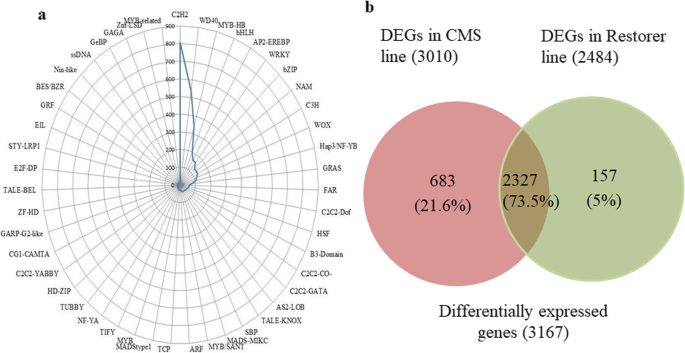
PlantTFCAT在线工具[64],用于鉴定鸽豌豆的转录因子。总共有3803个unigenes(占转录组的2.2%)(图。3.b)被编入52个公认的转录因子(TF)家族。在52个TF家族中,“C2H2”的unigenes最多,有806个(21.2%)unigenes,其次是“WD40-like”(540个,14.2%),“MYB-HB-like”(344个,9%),“bHLH”(200个,5.3%),“AP2-EREBP”(163个,4.3%),“WRKY”(161个,4.2%)和“bZIP”(129个,3.4%)。4a和附加文件2:表S5)。
AKCMS11与AKPR303差异表达基因的鉴定
在AKCMS11不育芽中,与AKPR303可育芽相比,AKCMS11不育芽中有1432个上调基因,1390个下调基因2:表S6)。另外,683个DEGs在不育基因型中唯一表达,157个DEGs在可育恢复体中有显著表达(图。4b)。
二聚物的GO和KEGG富集分析
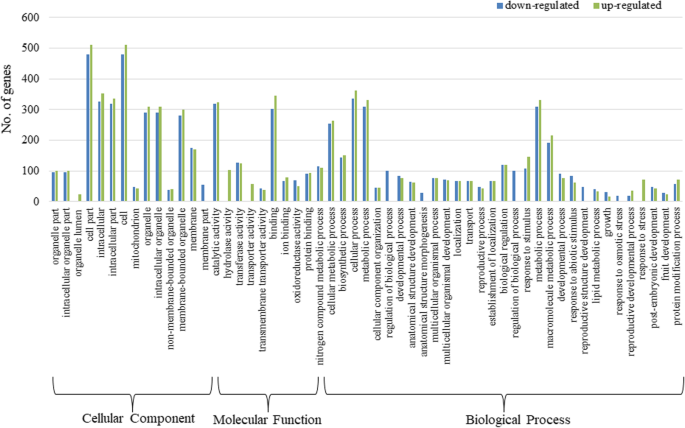
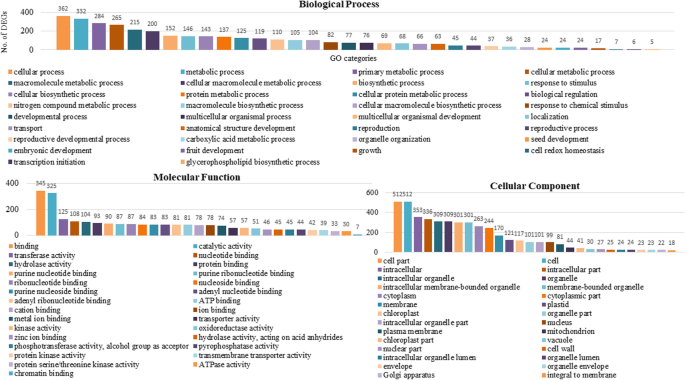
为了深入了解DEGs的功能,我们研究了DEGs中显著丰富的基因本体(GO)术语。注释的deg被划分为55大类,涵盖了三个主要本体:生物过程、细胞成分和分子功能(图1)。5).确定的GO术语进一步分为下调组和上调组。在下调的DEGs中,共有221个GO术语,其中“生物过程”、“分子功能”和“细胞成分”分别为121个、59个和41个2:表S7)。在上调的DEG中,分配了174个术语,包括78“生物过程”,53“分子函数”和43“蜂窝成分”(附加文件2:表S8)。总的来说,在生物过程类别中,氧化石墨烯的术语多为“细胞过程”,其次是“代谢过程”、“初级代谢过程”和“细胞代谢过程”。“催化活性”、“结合活性”和“转移酶活性”是分子功能类别中表达最显著的氧化石墨烯术语。在细胞成分类别中,“细胞部分”、“细胞”和“细胞内成分”是最显著的GO项(图)。6和7).有趣的是,许多GO术语是特定于监管的次数,并参与“花粉发育”(10次),“生殖结构发展”(41次),“配子染色发育”(16次)和“氧化磷酸化”(7℃,表明这些可能与AKCMS11中的男性无菌有关。在额外的文件中提供了在下调和上调的DEG的生物过程类别中过于所代价的GO术语的分层树图3.:图S3和S4。
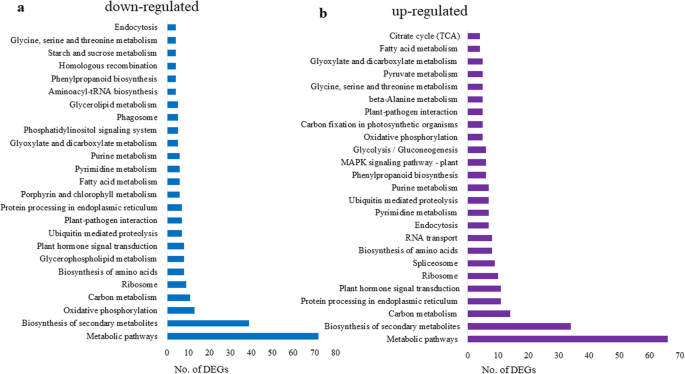
利用KEGG途径数据库进行KEGG途径富集分析,以识别涉及DEGs的代谢途径。共鉴定出110条富集途径,其中77条表达下调和上调的deg显著富集,15条和19条表达上调和下调的deg显著富集。共有377个下调的deg和396个上调的deg分别被分配到92个和96个KEGG通路2:表S9)。图2中提到了较低的下调和上调的DEG的前25个显着富集的途径。8.下调的DEGs在“代谢途径”(72个基因)、“次生代谢物的生物合成”(39个基因)、“氧化磷酸化”(13个基因)、“碳代谢”(11个基因)、“核糖体”(9个基因)和甘油磷脂代谢(8个基因)中显著多见。与氧化石墨烯分析一致,“氧化磷酸化被下调的二烷基糖苷丰富。一些下调的DEGs参与淀粉和蔗糖代谢、糖酵解、磷酸戊糖途径、活性氧(ROS)生成/清除和α -亚麻酸代谢。上调DEGs的途径中,以“代谢途径”(66个)最多,其次是“次生代谢物生物合成途径”(34个)、“碳代谢途径”(14个)、“内质网蛋白加工途径”(11个)和“植物激素信号转导途径”(11个)。此外,一些上调的基因参与了“抗坏血酸和醛糖酸代谢”、“亚麻酸代谢”和“光合作用”等2:表S9)。
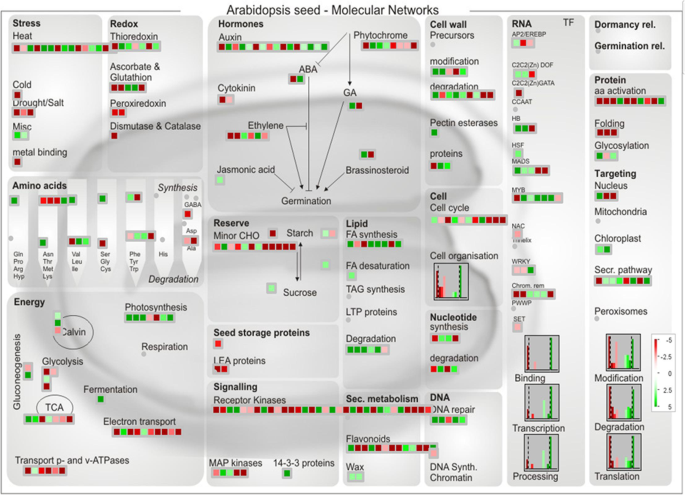
此外,Mapman Tool [65[还用于可视化涉及不同代谢途径的重要雄性不育相关的次数。所有3167无菌AkCMS11和肥沃AKPR303之间的差异表达基因被注释为TAIR数据库(http://www.arabidopsis.org)最后,鉴定出951只患者是930个拟南芥基因的同源物(附加档案2:表S10)。为了进一步探索这些deg在雄性不育中的潜在功能,我们在MapMan中对拟南芥同源基因进行了研究,以确定这些deg参与的不同代谢过程(图1)。9).在我们的网络中,最重要的差异表达基因与能量/ ATP合成,ROS代谢,激素,次生代谢和细胞周期有关。在无菌(AKCMS11)芽中,将参与'能量(糖酵解,TCA循环,电子传输链,传输P和V-ATPase)的基因的表达下调。此外,与“氧化还原”(抗坏血酸和谷胱甘肽,过氧化糖酮,歧化酶和过氧化酶)和细胞周期相关的基因也在无菌芽中下调。另外,将在“胃辘和茉莉酸合成”中涉及的基因在无菌芽中调节,而与“信号通路”有关的情况下调。一个lso, the expression of genes involved in ‘Lipid’ (Degradation & FA synthesis) and ‘Cell wall’ (degradation & modification) were mostly up-regulated, whereas genes related to ‘Secondary metabolism’ (Flavonoids) were down-regulated in the sterile buds compared to fertile buds. Among the transcription factors, NAC, WRKY (except one), CCAAT, SET, C2C2(Zn) GATA and AP2/EREBP (except one) were down-regulated in the sterile buds, whereas the majority of the MYB, MADS and C2C2(Zn) Dof transcription factors were up-regulated in comparison to the fertile buds.
与男性无菌有关的候选患者
生物信息学分析使我们更深入地了解了不育基因型(AKCMS11)和可育基因型(AKPR303)之间的差异表达基因(DEGs)。在本研究中,鉴定了几个可能与花粉发育有关的差异表达基因亚群(图1)。10).
与花粉发育有关的推定基因
在开花植物中,花粉发育是一种复杂和连续的曲S.性繁殖。拟南芥被认为是研究与花粉发育有关的假定基因的模式植物[58].为了了解雄性不育的相关机制,我们查询了TAIR数据库中所有的3167个DEGs (http://www.arabidopsis.org).此外,所有的3167个deg都被进一步与拟南芥数据库(http://www.arabidopsis.org)使用Orthodb v10识别同源物[66)(附加文件2:表S11)。在我们的研究中,发现34个deg是同源的拟南芥与花粉发育相关的基因(表3.).我们发现有10个DEG参与调控花粉发育,其中1个DEG编码多余的小孢子母细胞1(EMS1),1次编码phd-fient转录因子男性STERTILITY1(MS1), 2个DEG编码胼胝质合酶7,1个DEG编码AUXIN-RESPONSIVE因素(ARF17),4次编码细胞色素P450-like和1次编码天冬氨酸蛋白酶。与肥沃的AKPR303相比,在无菌AKCMS11中调节5℃,5℃下调5。3℃编码聚半乳糖酸酶(Pg)和腹腔 - 1,3-葡萄糖苷酶样参与花粉细胞壁重塑。编码阿拉伯酰亚胺酰胺糖蛋白(AGPS)和GPI固定的蛋白质的总共5次参与花粉管生长。存在单一应激诱导的曲面,编码晚期胚胎发生丰富的蛋白(LEA),其显示AKPR303的AKCMS11中的显着下调。我们识别出3次参与细胞划分过程。此外,还在本研究中确定了12只具有相关功能的职能(表格3.).
转录因子(TFS)具有重要性,因为它们调节植物中的基因表达。基因表达中的改变与转录因子表达的修饰相关[67].在我们的研究中,有16只代表转录因子,下调9只Degs,在AKCMS11中有7个上调。该9个下调的Degs包括2个Bhlh家族,2℃2H2锌 - 手指,2个碱性亮氨酸拉链转录因子(BZIP),1 DOF锌 - 手指和含2种NAC域的转录因子。在7个上调的次数中,1是BHLH,2个MYB转录因子,2个碱性亮氨酸拉链转录因子(BZIP),1种含NAC结构域的转录因子和1个腕骨转录因子。(附加文件2:表S5)。
代谢途径
碳固定和能量代谢是植物最主要的代谢途径,它们主要负责提供植物对能量和碳源的需求[68].在本研究中,观察到12次参与碳水化合物代谢,与糖酵解/葡糖生成途径的6次有关,分别与戊糖和葡糖醛酸酯互连有6次(表4).关于糖酵解,与AKPR303相比,在AKCMS11中调节4℃,2℃下调2℃。另外,在代表戊糖和葡糖醛酸酯互联的6次中,将3℃下调3℃,在AKCMS11中调节3℃(表4).
在本研究中,2个DEG参与了三羧酸循环(TCA), 1个DEG编码苹果酸脱氢酶,另一个DEG编码琥珀酸-辅酶a合成酶(Table .4).在AKCMS11中,我们还检测到7个参与氧化磷酸化的二磷酸腺苷,其中大部分表达下调,只有2个表达上调(表1)4).我们研究了共有15次参与消除反应性氧物质(ROS),其中2℃编码过氧化物酶样,1°编码过氧化物歧化酶和2°编码过氧化毒素-2B样的2℃,以及1°C谷胱甘肽S-谷胱甘肽过氧化物酶转移酶和1°编码。另外,为单点戊二糖苷氧化有5次编码,并且每种编码抗坏血酸氧化酶,硫叶素和戊二糖苷的编码。与AKPR303相比(表格相比,10中的DEG在AKCMS11中显示下调4).
用qRT-PCR鉴定DEGs
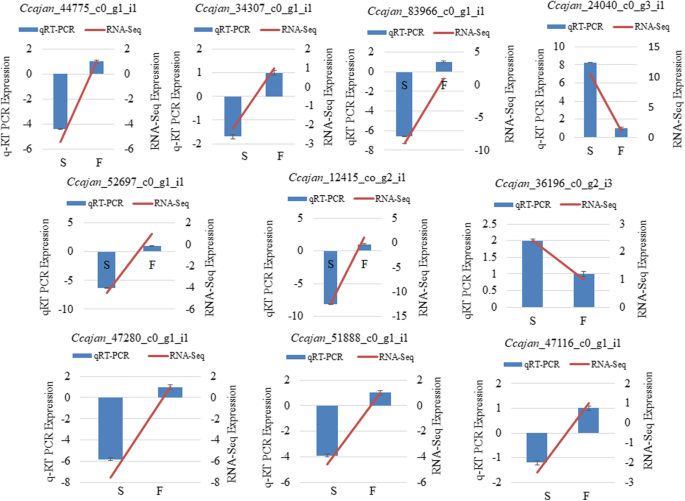
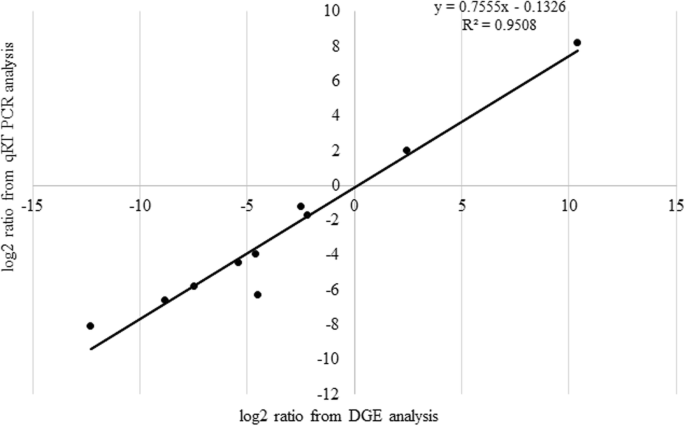
我们随机选择10个基因进行QRT-PCR分析,目的是验证通过RNA-SEQ获得的AKCMS11和AKPR303之间的表达谱。用于QRT-PCR分析的DEGS特异性引物列表在附加文件中列出2:表S12。qRT-PCR鉴定的DEGs与胼钙合酶7-like、磷酸烯醇式丙酮酸羧激酶、聚半乳糖醛酸酶、天冬氨酸蛋白酶、晚期胚胎发育丰富(LEA)、未特征线粒体蛋白、谷胱甘肽s -转移酶F10、钙调素结合受体样蛋白、有丝分裂纺锤体组装检查点蛋白(MAD1)和五磷酸肽重复含蛋白。虽然RNA-Seq分析检测到的相对基因表达量高于qRT-PCR检测到的相对基因表达量,但总体表达模式相似(图1)。11和表5).进行线性回归分析,并显示出正相关(R2= 0.9508),表明qRT-PCR分析所描述的10个基因的表达量均与DGE数据分析一致(图1)。12).这些发现证实了Illumina RNA-SEQ数据的可靠性及其分析。
讨论
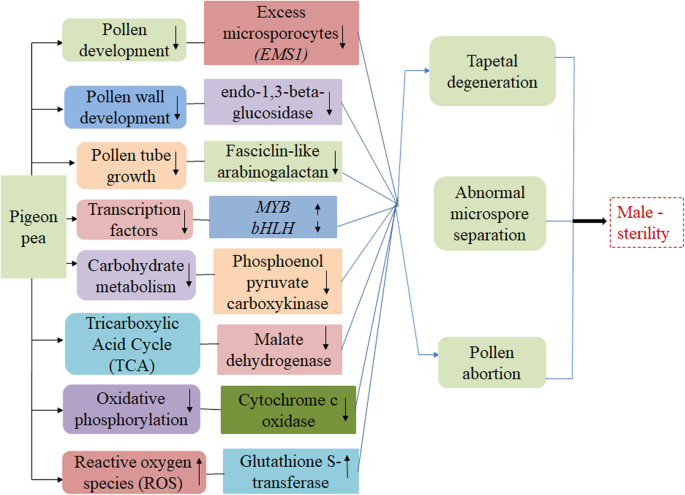
细胞质雄性不育(CMS)被认为是许多植物物种中杂种种子产生的重要工具。为了阐明鸽子豌豆中CMS的潜在机制,本研究进行了。对比较转录组测序和分析来自无菌(AKCMS11)和肥沃(AKPR303)鸽子豌豆的花粉。总共,3167个基因显示CMS和肥沃恢复剂之间的差异表达。基于功能诠释,我们确定了与先前据报道的花粉发育和新陈代谢相关的一些候选参数参与雄性不育(图。13).
参与花粉发育的二烷基糖苷可能与CMS有关
我们鉴定了34个与花粉发育相关的基因拟南芥(表3.).花粉形成是植物中的关键发育机制,其高度依赖于协调代谢途径[69].由于对绦虫发育,花粉形成,调用降解和花粉壁发育负责的基因的异常功能,发生雄性不育,发生了原因。70].在我们的研究结果中,观察到有几次具有潜在作用的花粉发育(表3.).花粉发育是一个复杂而程序化的过程,它发生在生殖细胞(小孢子细胞)的花药内部。这些小孢子(花粉)的发育依赖于孢子体组织,最终导致开花植物释放功能花粉用于受精[71.].在拟南芥,多余小孢子细胞1(EMS1)提出一种富亮氨酸重复受体蛋白激酶(LRR-RPK),它积极参与绒毡层细胞和小孢子细胞繁殖过程中的决定和分化。观察到,花药的花药ems.突变体(EMS1)显示出大量小孢子细胞,尽管缺乏绒毡层,产生无功能的花粉,导致雄性不育[22]. 我们还观察到1度(CCAJAN._10186_c0_g1_i1)编码富含亮氨酸的重复受体蛋白激酶EMS1结果表明,AKCMS11基因的表达下调(4.53倍)可能与鸽子豌豆花粉发育和育性有关。
绒毡层在花粉发育过程中,对发育中的小孢子提供营养,形成花粉壁具有重要意义[72.].在拟南芥,男性STERILITY1(MS1),男性SERILITY2(一份)基因调控绒毡层成熟和花粉壁生物合成的阶段,并随着活花粉的释放而结束[27,73.].的MS1基因对Tapetum和花粉发育至关重要的Phd-Fience转录因子表现出同源性[74.].PHD-FIRES转录因子男性STERTILITY1(MS1)在大麦中鉴定出雄性不育[75.].在这项研究中,1°(CCAJAN._34303_uC0_uG2\u i2)编码PHD手指转录因子男性STERTILITY1(MS1), AKCMS11表达下调4.27倍。在MS1突变体,在从四方孢子释放梭菌之后,绦虫突然的早产发生,导致诱导的花粉形成并导致雄性不育[27].类似的结果在男性无菌番茄突变体MS3.,MS15,MS5和MS1035由于绒毡层的失调调节[57,76.,77.].
在开花植物中,花粉在花粉颗粒内固定并受到复杂花粉细胞壁的物理保护。花粉母细胞(PMC)合成多糖,核糖(β-1,3-葡聚糖)和外部保护性胼une壁偏离新开发的微孔,并限制它们与相邻的Tapetum组织合并,给出独特的TETRAD形状[78.].最后,小孢子周围的胼胝质壁退化,将小孢子释放到花药子房[79.].胼胝质合酶是在发育中的小孢子周围合成临时胼胝质壁所必需的,12调用合成酶(Cals.)基因在拟南芥中报道[80,81.].胼胝质合酶5 (cals5)突变体显示小孢子周围没有胼胝质沉积,证实了该酶对育性降低的重要性[38].有趣的是,我们注意到2次;CCAJAN._44775c0_g1_i1和CCAJAN._52234_C0_G1_I1与AKPR303相比,AkCMS11中的胼ins合成酶表示为5.45和6.38倍的下调,因此在花粉发育中具有突出的候选者。这些结果与早期的西瓜和大豆报道一致[55,56].另外,primexine一种微生物多糖基质,对于正常发育的正常发育是重要的,并受到一个AUXIN-RESPONSIVE因素(ARF17).在拟南芥,ARF17突变体胼胝质壁形成异常,未见原菊和花粉败育[82.].一个度CCAJAN._41968_c0_g1_i1ARF72AKCMS11的表达量减少了6.21倍,是花粉发育的重要候选基因。
孢子醇是微孢子和基因的外刚性外壁的关键组成部分细胞色素P450.(CYP703A2),细胞色素P450.(CYP704B1)和酰基-CoA合成酶5(ACOS5)负责调节孢子醇的生物合成。下调CYP703A2和CYP704B1基因描述了孢粉素水平降低,缺乏具有独特剥离表面的外壁层和受损的花粉拟南芥[34,35,73.].令人惊讶的是,4个基因对应细胞色素P450-like与AKPR303相比,AKCMS11显著过表达。例如,CCAJAN._1528_c0_g3_i1(8.30倍),CCAJAN._88538_c0_g1_i1(8.23倍),CCAJAN._16351_c0_g1_i1(8.81折)和CCAJAN._55694_C0_G9_I1(6.36倍)。这一发现得到了先前在棉花上的研究支持,其中提出,因为这些基因参与了孢子醇蛋白的合成,它们的上调必须最终在不含孢子孢素蛋白和最终进行的男性无菌[83.].该基因的过度表达可能与花粉败育有关。
花药内正在发育的小孢子(花粉粒)被一层称为绒毡层的细胞包围着[84.,85.],它具有相当重要的重要性,因为它为开发的花粉提供了必要的营养,并分泌外部暴露的组分并调节花粉壁形成[86.,87.].在随后的花粉发育阶段,绒毡层经历程序性细胞死亡(PCD)的调节解体,并将花粉壁形成所需的所有细胞成分释放到花药室[88.,89.,90.].绒毡层PCD调控的任何延迟都会导致花粉致死和雄性不育[87.].以前,PCS1编码被称为天冬氨酸蛋白酶的抗细胞死亡因子的基因治理PCD拟南芥据报道(91.].的过度表达PCS1基因产生过量的天冬氨酸蛋白酶,进一步抑制花药开裂,导致雄性不育。在这项研究中,1°(CCAJAN._24040_c0_g3_i1)在无菌Akcms11中以肥沃的Akpr303的无菌Akcms11呈现10.42倍。无菌线的表达较高可能延迟了Tapetum的PCD,这对于花药裂开的必须是必须导致鸽子豌豆的花粉无菌。在大豆中看到类似的观察,因此支持本发现的支持[56].
在本研究中,我们鉴定了3个与细胞壁修饰相关的deg,与AKPR303相比,AKCMS11中所有的deg都显著下调。这些基因编码细胞壁降解酶,如聚半乳糖醛酸酶(PG),已知的水解果胶和聚半乳糖醛酸,内切-1,3- β -葡萄糖苷酶,纤维素水解酶。在早些时候的报道中拟南芥,QRT1和QRT2突变体产生的非功能性花粉,由于果孢菌素周围的果胶降解中的多糖尿酸酶效率效率92.].单次露(CCAJAN.(_83966_c0_g1_i1)表示的聚半乳糖醛酸酶(PG)与2个二磷酸脱氢酶(CCAJAN._61890__c0_g1_i1和CCAJAN._编码内胚素-1,3-β-葡萄糖苷酶样的7875_uC0_g1_UI1)分别在AKCMS11中下调4.87倍和2.20倍。结果与番茄和棉花的结果一致[11,93.].这些低于表达的基因可能参与花粉堕胎。
阿拉伯半乳糖糖蛋白(AGPs)存在于高等植物的不同细胞和组织中,积极参与生长和繁殖[94.].在拟南芥、AGP6、AGP11和fasiclin -like arabinogallactan proteins (FLA3)是参与AGPs合成的关键基因[95.,96.]并且主要在花粉颗粒和花粉管中表达,并参与微孔发育。基因的改变导致花粉管生长的障碍,从花药中释放的花粉释放,导致生育率降低[95.,96.].在我们的结果中,我们鉴定了3种差异表达的转录物编码阿拉伯半乳蛋白(AGPS),例如GPI锚定的蛋白质和筋膜样阿拉伯酰亚胺酰亚胺酰胺11(FLA11)。在编码GPI锚定的蛋白质的2次上,1为5.0倍下调(CCAJAN._38216_C1_G2_I3)在CMS基因型中,而其他基因显示上调(7.25倍)。散步Ccajan_37653_C0_G4_I5表示FLA11,在CMS系列相对于无菌线的下调9.14倍。在西瓜,棉花和芝麻中观察到类似的结果[55,61,97.].
钙离子(CA.2+)在植物中以其具有相当大的生理意义而闻名[98.]. 它们积极参与植物繁殖,特别参与花粉萌发和花粉管的生长。早些时候有报道说,足够的Ca2+离子导致正常的花粉萌发,而浓度(高或更低)的任何变化抑制花粉萌发和管伸长率[99.,100].在本研究中,2次CCAJAN._47280_c0_g1_i1和CCAJAN.鉴定出代表钙调素结合受体样蛋白_2910_c0_g1_i1, 1个表达下调4.55倍,另一个表达下调7.53倍。改变这些基因在不育AKCMS11中的表达可能抑制了花粉萌发和试管生长。西瓜、棉花和红麻的类似报道支持了目前的结果[55,93.,101].
在花粉成熟的最后阶段,花粉脱水,成熟的花粉准备发芽[102]. 晚胚发生丰富(LEA)蛋白参与花粉的干燥耐受。在莉莉,LP28是一种已知的花粉特异性lea样蛋白,在发育中的花粉中缓慢积累,水化后大量存在于萌发的花粉中,可能在花粉成熟和花粉管生长中发挥作用[103].在这项调查中,发现只有1次DEG与...有关利亚例如,类蛋白质,CCAJAN._52697_UC0_UG1 uU i1显示CMS线中的4.57倍向下调节。该基因的异常表达可能与花粉发育有关。结果与西瓜、大豆的结果一致[55,56].
雄配子体发生是开花植物中复杂的过程,通过多次有丝分裂和减数分裂形成雄配子体。调节细胞分裂的基因出现任何异常都会导致雄性不育[104].在本研究中,无菌AKCMS11中2个有丝分裂纺锤体组装检查点蛋白(MAD1)基因和1个细胞分裂蛋白基因与可育恢复系AKPR303相比表达异常。西瓜也有类似的发现[55建议它可能参与花粉发育。调查结果强烈表明这些基因负责花粉发育的潜在作用,导致鸽子豌豆的CMS。
编码与CMS可能相关的转录因子的DEG
转录因子是结合在一起的蛋白质CIS-靶基因的启动子区中调节特异性序列并调节基因表达[105].转录因子表达的任何改变导致基因表达的变化导致植物发育过程中的大量转化[106].在拟南芥,有来自34个家族的608个转录因子参与了花粉发育[107].在我们的研究中,与其肥沃的恢复剂分别相比,9和7位编码转录因子在无菌AkCMS11中显示了下调和上调。MYB蛋白质构成一个大型且功能多样化的家庭,在植物特定过程中具有重要作用[108].在拟南芥,AtMYB32和atmyb103在绒毡层中表达,通过控制绒毡层的发育、胼胝质的溶解和外壁的形成来促进花粉的发育[28,29].它们表达的任何变化都可能导致绒毡层早期退化、花粉扭曲和雄性不育[28,109].在这项研究中,2次Ccajan_30780_c0_g1_i2和CCAJAN._36059_c0_g1_i1编码MYB鉴定转录因子,在AKCMS11中识别上调(3.59倍和3.11倍)。因此指向这些差异表达基因在花粉发育中的可能作用。
像BHLH这样的转录因子是显着的,因为它们同步花药中普通绦虫的过程。BHLH型转录因子如DYT1和AMS公司在拟南芥[110] 和挂录的Tapetum.(Osudt1.)在稻米中[111]是绒毡层发育的关键,并最终主导花粉的发育。在我们的数据中,我们观察到3个编码bHLH转录因子的deg在CMS系中表达下调。例如,CCAJAN._47215_c0_g1_i1下调7.14倍CCAJAN._68741_C0_G2_I1下调2.08倍。在萝卜,芝麻和kenaf中看到了类似的结果[54,97.,101].
在拟南芥,衣衫转录因素喜欢WRKY2,WRKY34和WRKY 27在雄性配子体发生过程中,它们在花粉发育中的候选角色[112].表达的WRKY 27花粉活力有限导致雄性不育[113].在我们的研究中,有1个DEG在AKCMS11中被过度代表;CCAJAN._36686_c0_g1_i4(上调10.05倍),这符合大豆和芝麻的发现[56,97.].在本研究中公认的这些可在此研究中可能具有可能的作用,导致该作物中的CMS。
DEGs参与碳水化合物代谢与CMS潜在相关
在植物中,以糖和淀粉形式的碳水化合物是能源供应和生长的基质。足够的糖水平对花药的发育非常重要,随后花粉成熟过程中糖被转化成淀粉,后者是花粉萌发的能量来源[114,115].糖代谢功能紊乱会显著影响花粉发育,产生花粉受损,导致雄性不育[116].在辣椒和卷心菜中观察到这种情况[117,118].在本研究中,与AKPR303相比,AKCMS11中涉及糖酵解、糖异生以及戊糖和葡萄糖醛酸相互转化的基因表达发生了改变(表4).例如,总共6次参与糖酵解和葡糖生成,例如Ccajan_36409_c0_g2_i1,CCAJAN._34307_C0_G1_I1,CCAJAN._37543_c0_g2_i4,CCAJAN._34880_c0_g2_i1,CCAJAN._39910_c0_g1_i1和CCAJAN._88886_C0_G1_I1,除了显示上调的1℃外,所有这些都在无菌AKCMS11中显着下调(表4).在AKCMS11中,有6个deg与戊糖和葡萄糖酸酯的转换有关,其中3个deg下调,3个deg上调。这些参与碳水化合物代谢的基因表达量较低,表明花粉发育过程中糖的利用率较低,导致花粉无功能和雄性不育。大豆、辣椒和棉花的检测结果与之前的报道一致[56,59,62].
参与三羧酸循环(TCA)和氧化磷酸化可能与CMS有关的氧化磷酸化
线粒体是细胞的主要能量来源,具有许多重要的代谢途径,包括TCA循环、呼吸电子转移和氧化磷酸化[119,120,121].花粉形成是一种能量利用过程,其高度依赖于线粒体呼吸和发酵来满足其能量需求[102,122].我们确定了2次参加TCA周期,CCAJAN._64232_c0_g1_i1编码苹果酸脱氢酶和CCAJAN._35485_c0_g1_i1编码琥珀酸辅酶a合成酶(表4).根据以前关于棉花的报道,芸苔属植物显著和卷心菜TCA相关基因表达降低导致花粉败育和CMS [93.,123,124].这些观察表明,能量代谢途径的改变抑制了花粉发育,可能是CMS的原因。
线粒体通过使用两个主要途径,呼吸电子转移链和氧化磷酸化产生腺苷三磷酸(ATP)形式的能量[125].在该研究中,检测到与呼吸电子转移链和氧化磷酸化相关的7个基因,显示与肥沃的Akpr303相比,在无菌Akcms11中显示差异表达(表4).细胞色素c氧化酶(Cytochrome c oxidase, cox)是参与线粒体电子传递链最后阶段的关键酶,被认为是ATP合成的主要调控位点[126].水稻和棉花的文献都提出了cox基因在CMS中的重要性[127,128].两个度CCAJAN._13673_c0_g1_i1和CCAJAN.编码细胞色素C氧化酶亚基6b和亚基1的_41295_c0_g1_i1为Akcms11中的5.98倍,下调6.46倍(表4).这是根据辣椒,棉花的早期报告,芸苔属植物显著和甜菜[59,93.,123,129]. 因此,cox-6的表达改变可能导致ATP合成降低,并破坏了该作物花粉的形成。
二烷基糖苷参与清除活性氧(ROS),可能与CMS有关
在植物细胞中,反应性氧物质(ROS)是有氧呼吸的副产物,在叶绿体,线粒体和过氧化物中不断产生,并由ROS清除系统维持[130]. ROS是自由基,包括超氧化物(O)2−)、过氧化氢(H2O2)和丙二醛(MDA)及其在细胞中的过度积累可以溶解细胞凋亡[131].以前,棉花雄性不育系花药中活性氧物种的过度积累和抗氧化防御系统的显著降低会导致雄性不育[132].在水稻中,线粒体中ROS浓度异常导致花粉发育过程中的急性氧化应激,导致雄性不育[133].在这项研究中,检测到除去ROS消除的15次,用5次显示出在无菌AKCMS11线中显示出过度表达和10°下表达,与肥沃的AKPR303相比(表4).编码Akcms11中氧气清除酶的基因的下调引发了无菌芽中ROS的过度积累,导致花粉堕胎[134].在花椰菜中,谷胱甘肽s -转移酶(GST)基因的高表达诱导过多ROS,导致雄性不育[70].有趣的是,我们遇到了1次编码谷胱甘肽S转移酶(GST),CCAJAN._36196_C0_G2_I3,与AKPR303相比,在AKCMS11中显示出显着的更高表达2.41倍。我们假设,参与ROS清除的基因的表达改变可能诱导鸽子豌豆的花粉堕胎。
结论
据我们所知,这是第一次报道的转录组测序和A的花盆的比较分析2CMS系统(Cajanus scarabaeoides结果表明,该细胞质雄性不育系(AKCMS11)及其育性恢复系(AKPR303)具有较强的致病性。差异基因表达分析显示,AKCMS11与AKPR303之间存在3167个差异基因(DEGs),其中AKCMS11与AKPR303相比上调1432个,下调1390个。通过对GO、KEGG数据库中这些DEGs的功能注释和代谢途径分析,结合前人研究,我们认为AKCMS11的雄性不育性可能与一些已知的功能代谢途径异常有关,如花粉发育,编码转录因子、活性氧(ROS)的消除、碳代谢、氧化磷酸化、三羧酸循环(TCA)等对这些关键基因的进一步研究将集中于清楚地了解它们在雄性不育中的功能。因此,本报告将为进一步阐明鸽豌豆细胞质雄性不育的分子基础提供信息和支持。
方法
植物材料与RNA分离
细胞质男性无菌Akcms11(Cajanus scarabaeoides细胞质)和生育恢复系AKPR303(Cajanus Cajan.细胞质)[47]本研究采用了鸽豌豆,如前所述[135].这两种品种的种子都是从印度马哈拉施特拉邦Akola kishi Nagar的脉搏研究单位Panjabrao Deshmukh kishi Vidyapeeth博士那里获得的。种子直接在土壤中播种,植株在新德里的ICAR- NIPB实验温室中自然条件下保持。分别从AKCMS11和AKPR303的两个独立植株上采集了不同大小的花蕾。采集幼芽,用液氮冷冻,并在−80°C保存。使用Spectrum Plant Total RNA Kit (Sigma-Aldrich, USA)按照制造商的方案从两个株系(重复)的花蕾中提取总RNA。
花粉生育能力测试
进行了花粉分析以评估雄性无菌(AKCMS11)和肥沃(AKPR303)芽中的花粉生育率。从AkCMS11和AKPR303的花蕾的花香被取出并压扁在1%acetocarmine染料中的玻璃载玻片上。然后在显微镜下检查玻璃载玻片。
图书馆制备和RNA测序
在1%的变性琼脂糖凝胶上检查总RNA,并使用Nanodrop分光光度计量化(Thermo Fischer Scientific,USA)定量。使用Agilent 2100 BioAnalyzer(Agilent Technologies,USA),用RNA 6000纳米段试剂盒(Agilent Technologies,USA)分析RNA质量。使用Truseq RNA样品制备试剂盒(Illumina,USA),从育种和肥沃的芽(每次重复)构建了四种RNA文库。然后通过Illumina Hiseq 1000序列仪对Illumina成对末端测序技术进行测序的文库。
RNA-SEQ数据分析和DE NOVO转录组组件
测序原始数据以FASTQ格式接收。每碱基序列质量从无菌(41,531,572;68,068,793)和肥沃(29,618,927;42,957,061)用FastQC version 0.11.4 (http://www.bioinformatics.babraham.ac.uk/projects/)[136]. 也使用RCORRECOR软件检查k-mer在数据中的内容[137].对PHRED质量分数< 30且长度小于50 bp的原始reads进行筛选,不考虑进行进一步的转录组组装。Trimmomatic软件版本0.36 [138] was used for trimming of the raw reads to remove the adaptor sequence followed by filtering of low-quality reads (quality score ≤ 5) and reads with the unknown ‘N’ base (‘N’ ratio ≥ 10%) to finally obtain the filtered clean reads. Next, following the read orientation (R1 and R2) the total clean reads from the sterile and fertile lines were concatenated together by using an in-house shell script. A de novo assembly of the pooled clean reads was achieved by Trinity software version v2.2.0 [139]使用默认参数。此外,通过将过滤的读取映射到组装的转录组上,使用Bowtie2对准器用于通过将过滤器映射到组装的转录组上的验证。然后,我们评估了与基准通用单拷贝Orthologs工具版本3(Busco)的基准测试的完整性[140,141].Busco是评估组装完整性的理想选择,因为期望在给定的基因组中发现这些基因,因为单一副本是合理的,从进化的角度来说是合理的[140,141,142,143].在本研究中,我们使用了真核生物谱系数据库(eukaryota_orthoDB9)和绿色植物谱系数据库(viridiplantae_orthoDB10)的转录组评估模式。随后,利用CD-HIT软件版本4.6.1获得非冗余unigenes,识别参数95% (http://weizhongli-lab.org/cd-hit/)[144].然后通过对Rfam数据库进行BLASTN搜索,去除RNAs和其他内务非编码rna (tRNAs, snrna, snoRNAs等)[145].通过GC- profile工具计算总unigenes的GC含量(http://tubic.tju.edu.cn/GC-Profile/)[146].
单基因的功能注释
通过BLASTX对Nr (NCBI非冗余蛋白序列)、Virdiplantae、GO(基因本体)和KEGG(京都基因和基因组百科全书)数据库进行功能注释,严格限定e值为1e−3[147,148,149].借助Blasti2Go工具3.1.3(http://www.blast2go.org.)[150每个Unigene最多可达10个合格的爆炸点击。在10次爆炸中,序列相似度较高的爆炸点被占每个Unigene的重要匹配。在PlantTFCAT在线工具的帮助下确定转录因子(http://plantgrn.noble.org/planttfcat.)[73.].
差异基因表达分析
首先,RSEM软件[74.[将每个唯一映射的转录组的读数计算在FPKM方面计算每个唯一映射的转录组(对于每个样品)(每千克/百万千基片段)。然后,通过Deseq2检测无菌和育种基因型之间的差异表达基因(DEGS)(每次两种复制)[61])。严格的标准P-Value和FDR(假发现率)≤0.05和日志2Fc(折叠变化比无菌vs肥沃)≥2和≤-2(用于上调和下调的基因)用于确定显着的差异表达基因(DEGS)。
二聚物的GO和KEGG富集分析
所有差异表达基因(DEGs)的基因本体(GO)注释采用AgriGO软件2.0版(http://bioinfo.cau.edu.cn/agriGO/),使用默认参数[151].基于Go Encichment结果,其中P-value≤0.05为显著的GO项。然后利用WEGO软件对所有DEGs进行功能性GO分类(Wego.genomics.org.cn./),结果分为三个独立的层次;生物过程,分子功能和细胞成分。KEGG(京都基因和基因组百科全书)所有DEGs的路径富集分析由KEGG Mapper (http://www.genome.jp/kegg/mapper.html.),使用默认参数。通过超几何检测将所有内参基因与DEGs进行比较,确定了富集DEGs和aP-Value≤0.05表明了显着的途径富集。此外,Mapman版本3.3。0 [65[通过搜索,用于代谢途径分析DEGS拟南芥TAIR数据库(http://www.arabidopsis.org).
real - time-PCR (qRT-PCR)对DEGs的验证
从不育系(AKCMS11)和恢复系(AKPR303)芽中分离总RNA。根据说明书,使用RevertAid First strand cDNA合成试剂盒(Thermo Fischer Scientific, USA)从2 μg总RNA中制备cDNA第一链。将第一链cDNA再稀释10倍进行实时荧光定量PCR (qRT-PCR)反应。qRT-PCR采用KAPA SYBR FAST qPCR Master Mix (2X) (KAPA Biosystems,美国),ABI PRISM 7500 Real-Time PCR System (Applied Biosystems,美国)。每个基因型在3个独立的技术重复中进行qRT-PCR。反应混合液(20 μl)含cDNA 3 μl, 2X SYBR绿色qPCR主混合液10 μl,引物(正向和反向)0.20 μl,最终体积用无核酸酶水调节。PCR条件为94°C for 3 min, 94°C for 3 s, 60°C for 15 s, 72°C for 15 s,共40个循环。α-管蛋白用作内部参考基因。使用2计算基因表达的相对水平(-ΔΔct)算法,肥沃恢复剂(AKPR303)用作校准器。
可用性数据和材料
在目前研究期间生成和/或分析的数据集可用于无菌和肥沃的芽的NCBI SRA存储库(SRX3740150,SRX3740151,SRX3740153,SRX3740152)。(https://www.ncbi.nlm.nih.gov/sra/SRX3740153 [accn];https://www.ncbi.nlm.nih.gov/sra/SRX3740152[帐户];https://www.ncbi.nlm.nih.gov/sra/SRX3740151 [accn];https://www.ncbi.nlm.nih.gov/sra/SRX3740150 [accn].
缩写
- 这些“可信赖医疗组织”:
-
酰coa合成酶
- agp:
-
阿拉伯半乳聚糖糖蛋白
- AMS公司:
-
夭折的小孢子
- AP2:
-
Apetala2.
- 东盟地区论坛:
-
助潮响应因子
- ATP:
-
腺苷三磷酸
- bHLH:
-
基本helix-loop-helix蛋白质
- 爆炸:
-
基本的局部比对搜索工具
- bp:
-
基对
- bzip:
-
基本亮氨酸拉链
- C2H2:
-
cys2 / his2.
- cals:
-
调用合成酶
- cDNA:
-
互补DNA
- CMS:
-
细胞质雄性不育
- 考克斯:
-
细胞色素c氧化酶
- CYP703A2:
-
细胞色素P450.
- CYP704B1:
-
细胞色素P450.
- 可见:
-
差异表达基因
- ydt.:
-
功能障碍Tapetum.
- ems.:
-
多余的小孢子母细胞
- 小块土地:
-
乙烯响应因子
- 罗斯福:
-
错误发现率
- FLA:
-
筋膜样式阿拉伯乳糖
- FPKM:
-
每公斤碱基每百万的碎片
- 走:
-
基因本体论
- GST:
-
谷胱甘肽S-转移酶
- H2O2:
-
过氧化氢
- Kegg:
-
京都基因和基因组百科全书
- l:
-
聚酮合成酶
- lea:
-
胚胎晚期丰富
- 日志2FC:
-
折叠变化
- LRR-RPK:
-
富亮氨酸重复受体蛋白激酶
- 疯了:
-
有丝分裂主轴装配检查点蛋白
- MDA:
-
丙二醛
- 女士:
-
雄性不育
- NCBI:
-
国家生物技术信息中心
- NR:
-
NCBI非冗余蛋白质
- 出处:
-
诺佐
- O2:
-
超氧化物
- 开放源码软件:
-
开放阅读框
- 纤毛运动:
-
编程细胞死亡
- 聚合酶链反应:
-
聚合酶链反应
- 答:
-
polygalacturonase.
- PMC:
-
花粉母细胞
- 存在:
-
定量实时PCR
- RF.:
-
恢复生育能力的
- RNA-SEQ:
-
RNA序列
- ROS:
-
反应性氧气
- 角色扮演游戏:
-
破裂的花粉谷物
- SPL:
-
无孢子细胞
- TCA:
-
三羧酸周期
- TF:
-
转录因素
- TPD.:
-
毯行列式
- udt.:
-
挂录的Tapetum.
参考
- 1.
的时候NA。细胞质雄性不育与育性恢复。植物细胞。2006;18:515-7。
- 2.
Schnable PS,明智的RP。雄性不育与生育恢复的分子基础。植物科学,1998;3:175-80。
- 3.
Bentolila S,Alfonso AA,Hanson Mr。含有五戊肽重复的基因恢复生育能力对细胞质雄性无菌植物。Procnatlacad SCI。2002; 99:10887-92。
- 4.
陈玲,刘耀光。作物雄性不育与育性恢复。植物生物学杂志。2014;65:569 - 606。
- 5.
Mackenzie SA。线粒体遗传学对作物育种策略的影响。正确答案:Janick J,编辑。植物育种综述:Wiley;2010.115 - 38页。
- 6.
Levings CS。味瘤的德克萨斯州细胞质:细胞质雄性不育和疾病易感性。科学。1990年; 250:942-7。
- 7.
Levings CS。关于cms-T玉米细胞质雄性不育的思考。植物细胞。1993;5:1285 - 90。
- 8。
矮牵牛花cms相关线粒体蛋白的测序、加工和定位。植物j . 1994; 5:613-23。
- 9。
与细胞质雄性不育相关的线粒体融合基因是发育调控的。细胞。1987;50:41-9。
- 10
Budar F,植物中的巨粒G.雄性不育:发生,确定性,意义和使用。CR Acadsci III。2001; 324:543-50。
- 11.
Omidvar V,Mohorianu I,Dalmay T,Zheng Y,Fei Z,Pucci A等。雄性不育的转录调控7B-1败番茄突变体。《公共科学图书馆•综合》。2017;12:1-19。
- 12.
关键词:绒毡层,雄性不育,基因,比较序列,表达分析Medicago truncatula.GenetMol杂志2016;15:2。
- 13.
细胞质雄性不育:植物线粒体-核相互作用世界的窗口。趋势麝猫。2007;23:81 - 90。
- 14.
汉森先生,本托利亚。影响雄配子体发育的线粒体和核基因的相互作用。植物细胞。2004;16: 154–69。
- 15.
Bergman P,Edqvist J,FarboS I,Glimelius K.男性无菌烟草在Miticoocondrial ATP1转录物积累和减少的花卉ATP / ADP比例中发挥异常。植物mol biol。2000; 42:531-44。
- 16.
Sabar M,Gagliardi D,Balk J,Leaver CJ。ORFB是F1F0-ATP合成酶的亚基:以向日葵中的细胞质雄性不育的基础洞察。Embo Rep。2003; 4:1-6。
- 17.
Yui R,Iketani S,Mikami T,Kubo T.反义抑制在花药Tapetum中的线粒体丙酮酸脱氢酶E1Asubinit导致雄性不育。工厂J. 2003; 34:57-66。
- 18。
Liu X, Huang J, Parameswaran S, Ito T, Seubert B, Auer M,等。的Sporocyteless /喷嘴基因参与拟南芥雄蕊的同源性控制。植物生理学。2009;151:1401–11。
- 19。
Ito T、Wellmer F、Yu H、Das P、Ito H、Alves Ferreira M等。同源蛋白Agamus通过调节调控小孢子的发生无孢子细胞.自然。2004; 430:356-60。
- 20.
Schiefthaler U,Balasubramanian S,Sieber P,Chevalier D,Wisman E,Schneitz K.分子分析喷嘴,一种参与模式形成和性器的早期孢子发生的基因拟南芥.Procnatlacad SCI。1999; 96:11664-9。
- 21.
杨WC,YE D,Xu J,Sundaresan V.该无孢子细胞基因拟南芥启动孢子发生并编码新型核蛋白所必需的。基因开发。1999年; 13:2108-17。
- 22.
赵德忠,王广发,Speal B,马洪涛多余的microporocytes1基因编码调用的富含亮氨酸的重复受体蛋白激酶,其控制体细胞和生殖细胞命名拟南芥花药。基因发展,2002年;16: 2021-31年。
- 23.
贾克,刘X,欧文哈,赵达。TPD1小蛋白和EMS1受体激酶的细胞命运测定的信号传导。Procnatlacad SCI。2008; 105:2220-5。
- 24.
杨莱,谢LF,毛泽东,普拉CS,杨WC,江L等。Tapetum Compentinant1.是拟南芥花药细胞特化所必需的。植物细胞。2003;15:2792-04。
- 25。
徐j,杨c,元z,张d,gondwe我,ding z等。的夭折的小孢子调节网络是细胞内雄性减数分裂后生殖发育所必需的拟南芥.植物细胞。2010;22:91 - 107。
- 26。
Sorensen AM, Kröber S, Unte US, Huijser P, Dekker K, Saedler H. The拟南芥中止了幼儿孢子(AMS公司)基因编码MYC类转录因子。植物j . 2003; 33:413-23。
- 27。
杨C, Vizcay-Barrena G, Conner K, Wilson ZA。绒毡层发育和花粉壁生物合成需要雄性不育1。植物细胞。2007;19:3530-48。
- 28。
Preston J,Wheeler J,Hezlewood J,Li SF,Parish RW。正常花粉开发需要ATMYB32拟南芥.工厂J. 2004; 40:979-95。
- 29。
张泽,朱茹,高JF,王C,李H,李H,等。转录因子atmyb103通过调节Tapetum发育,调用溶解和拟南芥的外出形成,是制约特性的发展所必需的。工厂J. 2007; 52:528-38。
- 30.
Aarts MGM, Keijzer CJ, Stiekema WJ, Pereira A.拟南芥涉及到表皮蜡的生物合成和花粉的育性。Am SocPlant Physiol 1995; 7:2115-27。
- 31
有泉(Ariizumi T, Hatakeyama K, Hinata K, Sato S, Kato T, Tabata S,等)一种新的雄性不育突变体拟南芥,不知名的pollen-1,生产花粉,表面光滑的表面和乙酰均敏感的外部。植物mol biol。2003; 53:107-16。
- 32
关云飞,黄晓燕,朱军,高建峰,张洪翔,杨志宁。破裂的花粉粒1MtN3/唾液基因家族的成员,在拟南芥小孢子的外膜模式形成和细胞完整性中起着至关重要的作用。植物杂志。2008;147:852 - 63。
- 33
Morant M,Jorgensen K,Schaller H,Pinot F,Moller BL,Werck-Reichhart D等。CYP703是一种古代细胞色素P450在催化月桂酸的链条羟基化的土地植物中,为花粉中的孢子醇素合成提供构建块。在线植物细胞。2007; 19:1473-87。
- 34
关键词:Pinot, Pinot, Matsuno abstract:CYP704B1是拟南芥花粉中合成孢粉素所必需的长链脂肪酸ω-羟化酶。植物杂志。2009;151:574 - 89。
- 35.
de Azevedo SC, Kim SS, Koch S, Kienow L, Schneider K, McKim SM等。一种新的脂肪酸酰基辅酶A合成酶是花粉发育和孢粉素生物合成所必需的拟南芥.植物细胞。2009;21:507-25。
- 36.
Kim SS,Grienenberger E,Lallemand B,Colpitts CC,Kim Sy,Souza Cde A等。LAP6 /酮化合物合酶和LAP5 /酮化合物合酶B编码花粉发育所需的羟基烷基α-吡喃酮合成酶和孢子醇素生物合成拟南芥.植物细胞。2010;22:4045 - 66。
- 37.
Dobritsa AA, Lei Z, Nishikawa SI, Urbanczyk-Wochniak E, Huhman DV, Preuss D,等。LAP5.和LAP6.编码与拟南芥花粉外膜发育所必需的查尔酮合成酶相似的花药特异性蛋白。植物杂志。2010;153:937-55。
- 38.
东X,洪Z,西瓦拉马克里希南南部,Mahfouz M,Verma DPS。在微酰胺化期间,在拟南芥中的花粉活力需要愈伤组合酶(CALS5)。工厂J. 2005; 42:315-28。
- 39.
傅yj,刘W,zu yg,tong mh,li sm,yan mm,等。酶辅助从鸽豌豆培养的虎蛋白和Apigenin提取[Cajanus Cajan.(l)Millsp。叶子。食品化学。2008;111:508-12。
- 40。
Saxena KB,Kumar RV,Rao PV。鸽子营养及其改进。在:巴士拉as,randhawa是,编辑。野外作物的质量改进。纽约:食品媒体;2002. p。227-60。
- 41。
Odeny哒。木豆的潜力(Cajanus Cajan.(L.)Millsp。)在非洲。Nat Resour论坛。2007; 31:297-05。
- 42。
Nadarajan N,Ram SG,Petchiammal Ki。在短时间内重新编程中的生育恢复研究(Cajanus Cajan.(l)轧机)涉及cgms系统的杂种。马德拉斯农业出版社2008;95:320-7。
- 43.
Saxena KB,Sharma D. pigeonpea遗传学。in:nene yl,等人。,编辑。木豆。惠灵福:CAB INTERINAL;1990. p。137-58。
- 44.
Saxena KB。一个新来源的鸽子豌豆CMScajanus reticulatus.中国植物遗传育种杂志,2013;
- 45.
Saxena KB,Sultana R,Mallikarjuna N,Saxena RK,Kumar RV,Sawargaonkar Sl,等。鸽皮的雄性不育系统及其在提高产量的作用。植物品种。2010; 129:125-34。
- 46.
Saxena Kb,Nadarajan N.印度农业的鸽皮杂种的前景。ELEC J植物品种。2010; 1:1107-17。
- 47.
meshram mp,patil a。生育恢复的遗传学2木豆的细胞质杂种(Cajanus Cajan.(L.)Millsp。)。int j currmicrobiol app sci。2018; 6:565-71。
- 48.
Choudhary AK, Singh IP。A .比较肥力恢复的研究2和一个4细胞质及其在育种杂种钙荚膜中的含义[Cajanus Cajan.(L.)Millspaugh]。am j植物sci。2015; 6:385-91。
- 49。
Sinha P,Saxena Kb,Saxena RK,Singh VK,Suryanarayana V,SK Skcv,Mavs Kk,Khan AW,Varshney R.基因与鸽子细胞质雄性不育的基因协会。植物基因组。2015; 8。https://doi.org/10.3835/plantgenome2014.11.0084..
- 50。
舒斯特SC。下一代测序变换了今天的生物学。NAT方法。2008; 5:16-8。
- 51.
Ansorge WJ。下一代DNA测序技术。生物科技新》。2009;25:195-03。
- 52.
爱情MI,Huber W,Anders S.使用DESEQ2的RNA-SEQ数据的折叠变化和分散的调节估计。基因组Biol。2014; 15:550。
- 53。
Zenoni S,Ferrarini A,Giacomelli E,Xumerle L,Fasoli M,Malerba G,等人。浆果发育过程中转录复杂性的特征葡萄使用RNA-SEQ。植物理性。2010; 152:1787-95。
- 54。
Mei S,Liu T,王Z.萝卜细胞质男性无菌和肥沃花芽的比较转录形式剖面(萝卜l .)。国际分子科学杂志。2016;17:42。
- 55
Rhee Sj,Seo M,Jang Yj,Cho S,Lee GP。西瓜雄性无菌和育种育型差异表达基因的转录组分析。BMC基因组学。2015; 16:914。
- 56
李家,韩,丁X,他t,戴j,yang s等人。细胞质雄性无菌线NJCMS1A及其维护NJCMS1B在大豆中的比较转录体分析(大豆(L.)Merr。)。Plos一个。2015; 10:1-18。
- 57
郑HJ、康健、赵M、郭杰、崔HS、柏建华等番茄雄性不育1035对于花药的花粉发育和减数分子至关重要。J Exp Bot。2014; 65:6693-09。
- 58
一个H,Yang Z,Yi B,Wen J,Shen J,Tu J等。POL CMS肥沃和无菌花蕾的比较转录物分析显著.BMC基因组学。2014;15:2-11。
- 59.
刘超,马娜,王培培,傅娜,沈海林。辣椒一个细胞质雄性不育系及其近等基因恢复系的转录组测序和从头分析(甜椒l .)。《公共科学图书馆•综合》。2013;8:e65209。https://doi.org/10.1371/journal.pone.0065209
- 60。
吴j,张m,张b,张x,guo l,qi t等。CMS-D2的基因组对比转录组分析及其在旱地棉中的维护和恢复系。BMC基因组学。2017; 18:454。
- 61。
Suzuki H,Rodriguez-Uribe L,Xu J,张J. CMS-D8棉中细胞质雄性不育和恢复的转录组分析。植物细胞代表2013; 32:1531-42。
- 62。
Wei M,Song M,Fan S,Yu S.数字基因表达分析遗传性雄性无菌和野生型棉花种植型基因的转录组分析。BMC基因组学。2013; 14:97。
- 63。
郑碧波,吴晓明,葛xx,邓xx, Grosser JW,郭文伟。通过比较柚雄性不育杂种及其可育型的转录谱,发现与花发育相关的基因表达发生了改变。《公共科学图书馆•综合》。2012;7:1-13。
- 64。
代昕,赵鹏程,赵鹏程。PlantTFcat:一个在线植物转录因子和转录调控因子分类和分析工具。BMC生物信息学。2013;14:321。
- 65。
作者简介:Thimm O, Blasing O, Gibon Y, Nagel A, Meyer S, Kruger P等。MAPMAN:一个用户驱动的工具,将基因组数据集显示在代谢途径和其他生物过程的图表上。植物j . 2004; 37:914-39。
- 66。
Kriventseva ek等。Orthodb v10:对进化和功能注释的进化和功能注释取样动物,植物,真菌,质子,细菌和病毒基因组的多样性。nar。2018年。https://doi.org/10.1093/nar/gky1053.
- 67.
植物中的yanagisawa s.转录因子:生理功能和表达的调节。j植物res。1998; 111:363-71。
- 68.
吴Z,程J,QIN C,HU Z,YIN C,HU K.细胞质雄性不育和维护系中的花药差异蛋白质组学分析甜椒L. Int J Mol Sci。2013; 14:22982-96。
- 69.
黄志明,李建平,李建平,等。开花植物花粉壁发育的研究进展。植物学报。新植醇。2007;174:483 - 98。
- 70.
Pei X,Jing Z,Tang Z,朱Y.比较转录组分析提供了对与西兰花(Combolli)的细胞质雄性不育相关的差异表达基因的洞察力芸苔甘蓝醛。italica.).Scihortic。2017; 217:234-42。
- 71。
Gómez JM, Perfectti F, Abdelaziz M, Lorite J, Muñoz-Pajares AJ, Valverde J.传粉生态位的进化。新植醇。2015;205:440-53。
- 72。
Heslop-Harrison J,Dickinson HG。孢子蛋白合成的时间关系与Tapetum和Micropores相关的百合属植物.Planta。1969年; 84:199-14。
- 73。
Aarts Mgm,Hodge R,Kalantidis K,Florack D,Wilson Za,Mulligan Bj等。的拟南芥雄性不育2蛋白质在延伸/缩合物中与还原酶有相似之处。植物j . 1997; 12:615-23。
- 74。
Wilson ZA, Morroll SM, Dawson J, Swarup R, Tighe PJ。的拟南芥雄性不育1(MS1)基因是雄性配子体发育的转录调控因子,与PHD-finger家族的转录因子具有同源性。植物j . 2001; 28:27-39。
- 75.
Gómezjf,威尔逊za。大麦PHD手指转录因子通过影响Tapetal发育来赋予雄性不育性。植物Biotechnol J. 2014; 12:765-77。
- 76.
瑞克cm。九种雄性无菌番茄突变体的遗传与发展。希尔加德。1948年; 18:599-33。
- 77。
Gorman SW,McCormick S,Rick C.番茄中的雄性不育。CRC Crit Rev植物SCI。1997年; 16:31-53。
- 78。
陈建平,李建平。雄蕊结构与功能。北京:科学出版社。植物细胞。2004;16:46-60。
- 79
孢粉素合成与花粉外壁发育的遗传调控。植物生物学。2011;62:437-60。
- 80.
Hong Z, Delauney AJ, Verma DPS。细胞板特异性胼胝质合酶及其与Phragmoplastin的相互作用。植物细胞。2001;13:755 - 68。
- 81.
ENNS LC,Kanaoka MM,Torii Ku,Comai L,冈萨,克兰德。两个胼call1和GSL5,在植物和花粉发育和生育中起着重要和冗余的作用。植物mol biol。2005; 58:333-49。
- 82。
杨军,田玲,孙明霞,黄晓燕,朱军,关云飞,等。植物生长素应答因子17是拟南芥花粉壁模式形成的关键。植物杂志。2013;162:720-31。
- 83。
吴y,min l,吴z,杨l,zhu l,yang x等。有缺陷的花粉墙有助于棉雄性无菌线1355A中的雄性不育。SCI REP。2015; 5:1-8。
- 84。
斯科特rj。花粉外肠道:孢子醇蛋白谜和物理学。在:Scott RJ,Stead Ad,编辑。植物繁殖的分子与细胞方面。剑桥:剑桥大学出版社;1994年。49-81。
- 85。
Mascarenhas JP。雄配子体开花植物的雄配子体植物细胞。1989;1:657 - 64。https://doi.org/10.1105/TPC.1.7.657.
- 86。
Maheshwari P. Angiosperms胚胎学的介绍。纽约:麦格劳 - 山书CO INC;1950年。
- 87。
Kawanabe T,Arizumi T,Kawai-Yamada M,Uchimiya H,Toriyama K.废除Tapetum自杀程序废墟杂孢细胞。植物细胞生理。2006; 47:784-7。
- 88。
Rogers La,Dubos C,Surman C,Womplent J,Cullis If,Mansfield SD等人。三种异位抗钙化突变体中木质素沉积的比较。新植物。2005; 168:123-40。
- 89。
教区rw,li sf。Tapetum的死亡:发展利他主义计划。植物SCI。2010; 178:73-89。
- 90.
维兹卡·不莱娜G,威尔逊·扎。变型绒毡层PCD与花粉壁发育拟南芥MS1突变体。实验机器人。2006;57:2709-17。
- 91.
ge x,dietrich c,matsuno m,li g,bergh h,xia y。一个拟南芥天冬氨酸蛋白酶在繁殖和胚胎发生中用作抗细胞死亡组分。Embo Rep。2005; 6:282-8。
- 92.
Rhee Sy,Somerville Cr。四重奏突变体中的Tetrad花粉形成拟南芥与花粉母细胞壁的果胶多糖的持久性有关。工厂J. 1998; 15:79-88。
- 93.
孔欣,刘丹,廖晓,郑洁,刁勇,刘勇,等。棉花细胞质雄性不育系H276A及其保持系H276B的细胞学和转录组比较分析(Gossypium barbadense.l .)。国际分子科学杂志。2017;18:2240。
- 94.
Pennell Ri,Roberts K.豌豆中的性发育是通过改变阿拉伯酰亚胺蛋白的表达的改变。自然。1990年; 334:547-9。
- 95。
Levitin B,Richter D,Markovich I,Zik M.Asbinogalactan蛋白6和11是拟南芥中的雄蕊和花粉功能所必需的。工厂J. 2008; 56:351-63。
- 96。
李杰、于姆、耿儿、赵J。类筋膜蛋白的阿拉伯半胱氨酸蛋白基因,FLA3.参与拟南芥小孢子发育。植物J。2010;64:482–97。
- 97。
刘慧,谭敏,于慧,李玲,周峰,杨敏,等。芝麻显性核不育系可育和不育花蕾的转录组比较分析(胡麻属indicuml .)。BMC植物BIOL。2016; 16:250。
- 98。
布什DS。植物细胞中的钙调控及其在信号传导中的作用。Annu Rev植物植物植物Mol Biol。1995年; 46:95-122。
- 99.
Brewbaker JL, Kwack BH。钙离子在花粉萌发和花粉管生长中的重要作用。Am J Bot 1963; 50:859-65。
- One hundred.
Bednarska E.外源CA的效果2+离子对花粉粒萌发和花粉管生长的影响45加利福尼亚州2+与维拉帕米,路易斯安那州3+和钌红。《植物性繁殖》1988;2:53-8。
- 101.
陈P,Ran S,Li R,Huang Z,Qian J,Yu M等。转录组De Novo组件和差异表达基因与keanaf中的细胞质雄性不育有关(芙蓉大麻l .)。摩尔品种。2014;34:1879 - 91。
- 102。
泰勒LP,高手PK。花粉萌发和管生长。Annu Rev植物植物植物Mol Biol。1997年; 48:461-91。
- 103。
Mogami N,Shiota H,Tanaka I. LP28,百合花粉特异性Lea样蛋白,位于雄性配子中的胼ics壁中。性植物团体。2002; 15:57-63。
- 104。
陈驰,李伟,胡勇,等。的Arabidopsis ATK1雄性减数分裂中纺锤体形态发生所需要的基因。发展。2002;129:2401-9。
- 105。
Guilfoyle TJ。植物基因启动子的结构。正确答案:Setlow JK, editor。基因工程。纽约:增压出版社;1997.15-47页。
- 106。
Grotewold E,Chamberlin M,Snook M,Siame B,Butler L,Swenson J等人。转录因子异位表达玉米细胞中的工程二次新陈代谢。植物细胞。1998年; 10:721-40。
- 107。
HONYS D,TWELL D.单倍体男性配子体发育的转录体分析拟南芥.基因组医学杂志。2004;5:R85。
- 108。
关键词:MYB,转录因子,转录因子拟南芥.植物科学。2010;15:523 - 523。
- 109。
HIGINSON T,LI SF,Parish RW。atmyb103调节绒毡层和毛状体的发育拟南芥. 植物J。2003;35:177–92。
- 110.
张W,Sun Y,Timofejeva L,Chen C,Grossniklaus Umh。规范拟南芥绒毡层的发育和功能由功能失调的TAPETUM1(DYT1)编码公认的bHLH转录因子。发展。2006;133:3085 - 95。
- 111.
Jung Kh,Han MH,Lee Ys,Kim Yw,Hwang I,Kim MJ,等。米未开发Tapetum1是早期绒毡层发育的主要调节因子。植物细胞。2005;17:2705-22。
- 112.
关Y、孟X、卡娜R、拉蒙塔涅、刘Y、张S。MAPK对WRKY转录因子的磷酸化作用是花粉发育和功能的必需条件拟南芥.Plos Genet。2014; 10:E1004384。
- 113.
Mukhtar Ms,Liu X,Somssish Ie。阐明Wrky27在拟南芥中雄性不育中的作用。植物信号表现。2017; 12:E1363945。
- 114。
ABA调控水稻花粉外质体糖转运,是水稻冷诱导花粉不育的潜在信号。植物细胞生理学。2007;48:1319-30。
- 115。
Datta R,Chamusco KC,Chourey PS。花粉成熟期间的淀粉生物合成与玉米中的基因表达的改变模式相关。植物理疗。2002; 130:1645-56。
- 116。
Mamun EA, Alfred S, Cantrill LC, Overall RL, Sutton BG。低温对水稻雄配子体发育的影响。细胞生物学杂志2006;30:583-91。
- 117。
李益,魏益,张华,鲁杰。雄性不育辣椒新陈代谢在微孔发育中的研究。ActaAgriculturaeborali- occidentalissinica。2006; 15:134-7。
- 118.
王YF,胡cq,林紫狮,李文,金杰,等。Actawort Sin。1984; 3:7。
- 119.
植物线粒体电子转移与分子生物学。植物细胞。1995;7:821-31。
- 120。
障碍A.人体线粒体疾病的酵母模型。IUBMB生活。2003; 55:83-95。
- 121。
洛根直流。线粒体室。J实验机器人。2006;57:1225–43。
- 122.
Dickinson db。百合花粉的萌发:呼吸和管生长。科学。1965年; 150:30-1。
- 123.
杜凯,刘强,吴鑫,姜军,吴军,方勇,等。中国水稻细胞质雄性不育系的形态结构和转录组比较芸苔属植物显著(SaNa-1A)来源于体细胞杂交及其保持系SaNa-1B。植物科学与技术,2016;
- 124.
王S,王C,张XX,陈X,刘JJ,贾XF等。转录组De Novo组装和浅层表达基因的卷心子晶型母性无菌性差异。植物理性生物化学。2016; 105:224-32。
- 125.
Millar啊,Whelan J,Soole Kl,Da。植物中线粒体呼吸的组织和调节。Annu Rev植物Biol。2011; 62:79-104。
- 126。
Kadenbach B, Hüttemann M, Arnold S, Lee I, Bender E.线粒体能量代谢是通过细胞核编码的细胞色素c氧化酶亚基来调控的。中国生物医学杂志2000;29:21 - 21。
- 127。
刘Y,王X,王Y,卓D.水稻正常和细胞质雄性无菌品种的线粒体COI和COII基因的结构差异分析栽培稻.ActaGenetica罪。1988;15:348-54。
- 128。
黄杰,杨鹏,李斌,黄建林,杨鹏,等。雄性不育棉细胞质不育系几种酶活性的研究
- 129。
杜科斯E,图泽特P,布特里M。不育G野生甜菜的细胞质显示出改性的线粒体呼吸复合物。工厂J. 2001; 26:171-80。
- 130.
[11]李晓东,张建平,张建平,等。植物抗氧化损伤机制的研究进展。植物保护学报,2011,30(3):457 - 464。J机器人。2012;2012:1-26。
- 131.
研究表明,线粒体参与了诱导与病原体攻击和衰老相关基因的信号转导。植物j . 2002; 29:269 - 79。
- 132.
江普,张X,朱y,朱w,谢h,王x。棉细胞质雄性不育中反应性氧物种的新陈代谢及其恢复。植物细胞代表2007; 26:1627-34。
- 133.
关键词:水稻,氧化应激,小孢子发育,线粒体,损伤abstract:植物细胞大会2007;26:373-82。
- 134.
汉森先生。植物线粒体突变和雄性不育。Annu Rev Genet。1991年; 25:461-86。
- 135.
Junaid A,Kumar H,Rao Ar,Patil An,Singh Nk,Gaikwad K.解开父母性交之间的表观胸肉相互作用,导致鸽皮中改变的杂交甲膜。DNA Res。2018; 25:361-73。
- 136.
FastQC:一个高通量序列数据的质量控制工具。2010.网上:http://www.bioinformatics.babraham.ac.uk/projects/fastqc..
- 137.
歌曲L,Liliana F. Rcorrector:Illumina RNA-SEQ读取的高效和准确纠正。千兆科学。2015; 4:48。
- 138。
Bolger AM, Lohse M, Usadel B. Trimmomatic:用于Illumina序列数据的灵活修剪器。生物信息学。2014;30:2114-20。
- 139。
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I等。三位一体:利用RNA-Seq数据,在没有基因组的情况下重建全长转录组。生物科技Nat》。2011;29:644-52。
- 140。
Simão FA, Waterhouse RM, Ioannidis P, Kriventseva EV, Zdobnov EM. BUSCO:单拷贝同源性评估基因组组装和注释的完整性。生物信息学。2015;31:3210-2。
- 141。
Waterhouse Rm,Seppey M,SimãoFa,Manni M,Ioannidis P,Klioutchnikov G,等。BUSCO应用从质量评估到基因预测和系统源。mol Biol Evol。2017; 35:543-8。
- 142。
水屋RM,Zdobnov EM,Krivenseva EV。脊椎动物、节肢动物和真菌基因保留、序列分化、重复性和重要性的相关特征。基因组生物进化。2011;3: 75–86。
- 143。
Waterhouse Rm,Tegenfeldt F,Li J,Zdobnov Em,Kriventseva EV。Orthodb:动物,真菌和细菌矫形器的分层目录。核酸RES。2013; 41:D358-D65。
- 144。
Cd-hit:一种用于聚类和比较大组蛋白质或核苷酸序列的快速程序。生物信息学。2006;22:1658-9。
- 145。
Kalvari I,Argasinska J,Quinones-Olvera N,Nawrocki EP,RIVAS E,EDDY SR等人。RFAM 13.0:移植到非编码RNA家庭的基因组资源。核酸RES。2018; 46:D335-42。
- 146.
高峰,张廷涛。GC-profile:一个基于web的工具,用于可视化和分析基因组序列中GC含量的变化。核酸研究2006;34:686-91。
- 147.
Devani RS, Sinha S, Banerjee J, Sinha RK, Bendahmane A, Banerjee AK。雌雄异株、雌雄异株和化学雄性化雌株花蕾的从头转录组组装Coccinia茅揭示与性表达和修改相关的基因。BMC植物BIOL。2017; 17:241。
- 148.
FU Y,Esselink GD,Visser RGF,Tuyl JM,Arens P.转录组分析非洲菊矮牵牛包括在Silico.确认发现了防御基因。植物科学与技术,2016;
- 149。
Morandin C,Pulliainen U,Bos N,Schultner E.德诺维黑蚁转录组的组装及其注释胶木fusca在幼虫阶段。科学数据。2018;5:180282。
- 150.
Conesa A,Götzs,García-gómezJM,Terol J,TalónM,Robles M.Bast2Go:功能基因组学研究中的注释,可视化和分析的通用工具。生物信息学。2005; 21:3674-6。
- 151.
田涛,刘勇,严宏,尤青,易欣,杜震,等。AgriGO v2.0:面向农业社区的GO分析工具包,2017年更新。核酸杂志2017;45:W122-9。
致谢
作者感谢ICAR-国家植物生物技术研究所(NIPB),新德里,印度新德里,提供设施。作者还感谢我们的研究小组和合作者的其他成员,以获得技术援助和讨论。
资金
本研究得到了印度新德里科技部(DST)和印度新德里ICAR-作物转基因网络项目的资助。资助者没有参与研究的设计、收集、数据分析、数据解释和手稿撰写。
作者信息
从属关系
贡献
SS.1进行实验,制备cDNA文库进行测序、测序运行、qRT-PCR验证、GO、KEGG通路分析、转录因子鉴定并撰写论文。SS.2执行了读一代,de novo装配,差异表达分析,同源性搜索和注释。TK参与cDNA文库制备和测序运行。DN和PKC辅助生物信息学分析。SS.1,ss.2结果解释、分析和最终定稿涉及到TK、DN和PKC。NKS和ARR在数据分析和稿件定稿方面做出了贡献。SS.3.贡献在稿件最终确定。KG构思了这项研究,设计了实验,并协调了这项工作。所有作者都阅读并批准了最终手稿。
通讯作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1。
rcorrentor outk- 原始配对结束数据中的内容。表S2。Bowtie2无菌(AKCMS11)和肥沃恢复器(AKPR303)的对齐统计数据。图S1。不育恢复系AKCMS11(左)与可育恢复系AKPR303(右)之间的Pearson相关系数。图S2。表示每个基本序列质量的图表。一)无菌Akcms11(重复1和2)。b)肥沃的AKPR303(Repicates 1和2)。
附加文件2:表S1。
具有显著BLASTX的序列命中nr蛋白数据库。表S2。具有显着粘连性的序列对抗Virdiplantae数据库。表S3。组装底蕴的基因本体分类。表S4。KEGG分类Cajanus Cajan.unigenes。表S5。的转录组中鉴定的转录因子Cajanus Cajan..表S6。鸽豌豆不育AKCMS11与可育AKPR303差异表达基因列表。表S7。列表在下调的舞台上有明显的富裕术语。表S8。明显丰富的GO术语列表在上调的DEG。表S9。KEGG对下调和上调deg的注释总结。表S10。TAIR数据库BLASTX结果:鸽豌豆951degs在MapMan途径分析中的应用。表S11。利用TAIR数据库对3167个鸽子豌豆DEGs进行OrthoDB同源物检索。表S12。本研究中使用的QRT-PCR引物列表。
附加文件3:图S1。
组装单基因的基因本体分类。y轴表示单基因的数量,x轴表示GO类别。图S2组装单基因KEGG通路的功能分类。KEGG通路分为六大功能类:A-代谢;B-遗传信息处理;C-环境信息处理;D -细胞过程;E -有机系统;F -人类疾病。y轴表示KEGG代谢途径。x轴表示在该特定途径中注释的单基因的数量。图S3在下调的Degs的生物过程类别中过度代表的转移术语的分层树图。图中的框表示根据GO ID、术语定义和统计信息标记的GO术语。重要术语(调整P ≤ 0.05)为颜色(红色、橙色或黄色),而非显著术语显示为白色框。在图中,盒的颜色饱和度与该项的富集程度呈正相关。实心、虚线和虚线分别表示由该线连接的两端的两个、一个和零丰富的项。图的秩方向从上到下设置。图S4上调的二烷基糖苷(DEGS)生物过程类别中氧化石墨烯术语的层次树图。图中的框表示根据GO ID、术语定义和统计信息标记的GO术语。重要术语(调整P≤0.05)用颜色(红色、橙色或黄色)表示,不重要的项用白框表示。在图中,盒子的颜色饱和度与该项的富集程度呈正相关。实线、虚线和虚线分别表示两端由该线连接的两个丰富项、一个丰富项和零丰富项。图的秩方向是从上到下设置的。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
萨克森娜,S.,萨胡,美国,凯拉,T。等等。木豆细胞质雄性不育系及其育性恢复系差异表达基因的转录组分析Cajanus Cajan.l .)。BMC植物杂志20.74(2020)。https://doi.org/10.1186/s12870-020-2284-y
收到:
接受:
发表:
关键词
- 细胞质雄性不育
- 差异表达基因
- illumina测序
- 木豆
- 花粉
- 转录组分析