- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
Della蛋白与MyB21和MyB24相互作用以调节丝伸长率gydF4y2Ba拟南芥gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba64.gydF4y2Ba(gydF4y2Ba2020.gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
赤霉素(Gibberellin, GA)和茉莉酸(jasmonate, JA)是植物纤维伸长的两种重要激素gydF4y2Ba拟南芥gydF4y2Ba.GA和JA通过SCF引发Dellas和Jasmonate Zim-Domain(Jaz)蛋白的降解gydF4y2BaSLY1.gydF4y2Ba和scf.gydF4y2BaCOI1.gydF4y2Ba分别激活长丝伸长。在JA途径中,JAZs与MYB21和MYB24相互作用,控制纤维伸长。然而,很少知道della如何调节长丝伸长。gydF4y2Ba
结果gydF4y2Ba
在这里,我们发现della与MYB21和MYB24相互作用,MYB21和MYB24的R2R3域负责与della的相互作用。此外,我们还发现DELLA和JAZ蛋白协同抑制MYB21和MYB24的转录功能,从而抑制纤维的延伸。gydF4y2Ba
结论gydF4y2Ba
我们发现Dellas与MyB21和MyB24相互作用,Dellas和Jazs验证了MyB21和MyB24的转录功能,以控制细丝伸长率。本研究揭示了GA和JA在丝伸缩中的新型串扰机制gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba
背景gydF4y2Ba
雄蕊,包括灯丝和花药,是植物生殖器官之一。雄蕊开发中断,例如在长丝伸长,花药裂开或花粉成熟,可导致雄性不育[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].众多的研究表明,这些过程由植物激素控制,包括茉莉醇(JA)和吉布林蛋白(GA)[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].gydF4y2Ba
Jas,包括茉莉酸及其奥氧基素衍生物,在植物发育过程的调节中起关键作用,如根生长[gydF4y2Ba5gydF4y2Ba,雄蕊发育[gydF4y2Ba6gydF4y2Ba,毛状体的起始[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba],开花[gydF4y2Ba9gydF4y2Ba、叶片衰老[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba]和顶端钩形成[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba],并控制对非生物和生物胁迫的不同防御反应[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21.gydF4y2Ba].JAS被F箱蛋白冠状蛋白质不敏感1(COI1)感知[gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba23.gydF4y2Ba],随后诱导茉莉齐域(Jaz)蛋白的降解[gydF4y2Ba24.gydF4y2Ba,gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba].突变体中gydF4y2Ba拟南芥gydF4y2BaJA的生物合成和信号转导等gydF4y2Ba花药开裂有缺陷gydF4y2Ba(gydF4y2Badad1gydF4y2Ba),gydF4y2Ba13-lipoxygenase 3/4gydF4y2Ba(gydF4y2Balox3 lox4.gydF4y2Ba),gydF4y2Ba12-苯并氧化成酸还原酶3gydF4y2Ba(gydF4y2Baopr3gydF4y2Ba),gydF4y2Bacoi1-1gydF4y2Ba或过度表达jaz占优势形式Jaz1Δ3a或jaz10.4导致晚雄蕊发育的缺乏,包括长丝伸长,花药裂开和花粉成熟[gydF4y2Ba24.gydF4y2Ba,gydF4y2Ba27.gydF4y2Ba,gydF4y2Ba28.gydF4y2Ba,gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31.gydF4y2Ba].gydF4y2Ba
ja诱导的R2R3 MYB转录因子MYB21和MYB24 [gydF4y2Ba32.gydF4y2Ba,gydF4y2Ba33.gydF4y2Ba,gydF4y2Ba34.gydF4y2Ba]和IIIe bHLH因子(MYC2、MYC3、MYC4和MYC5) [gydF4y2Ba5gydF4y2Ba,gydF4y2Ba35.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba,gydF4y2Ba37.gydF4y2Ba]形成MyB-Myc复合物,以调节晚期雄蕊发展[gydF4y2Ba38.gydF4y2Ba]和Jaz压缩机直接抑制MyB-Myc复合物的成员[gydF4y2Ba38.gydF4y2Ba].的gydF4y2Bamyb21 myb24gydF4y2Ba双突变体花丝短,花药不裂,花粉粒无法存活13 [gydF4y2Ba32.gydF4y2Ba),gydF4y2BaMyc2 myc3 myc4 myc5gydF4y2Ba四重突变体表现出延迟的长丝伸长,花药裂开和花粉成熟[gydF4y2Ba38.gydF4y2Ba].JAs通过COI1诱导JAZ阻遏物的降解,从而增强gydF4y2BaMYB21gydF4y2Ba和gydF4y2BaMYB24gydF4y2Ba释放MYB-MYC复合体以促进雄蕊发育[gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba,gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba34.gydF4y2Ba,gydF4y2Ba38.gydF4y2Ba].gydF4y2Ba
气体是环状二萜分子,它几乎调节植物生长和发育的所有方面,包括种子萌发[gydF4y2Ba39.gydF4y2Ba,茎生长[gydF4y2Ba40gydF4y2Ba,下胚轴伸长[gydF4y2Ba41.gydF4y2Ba,gydF4y2Ba42.gydF4y2Ba,毛体发育[gydF4y2Ba43.gydF4y2Ba]、花器官发育[gydF4y2Ba44.gydF4y2Ba]和开花[gydF4y2Ba45.gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba,五种DELLA蛋白(GIBBERELLIC ACID INSENSITIVE [GAI], REPRESSOR OF GA1-3 [RGA], RGA-like1 [RGL1], RGL2,和RGL3)通过与下游转录因子相互作用,抑制多种赤霉素反应,作为负调控因子[gydF4y2Ba46.gydF4y2Ba,gydF4y2Ba47.gydF4y2Ba,gydF4y2Ba48.gydF4y2Ba,gydF4y2Ba49.gydF4y2Ba].受体嗜酸剂不敏感的矮化矮人1(GID1A / B / C)感知天然气,其通过SCF触发了Dellas ubiquitationgydF4y2BaSLY1.gydF4y2Ba26s蛋白酶体复合和降解,并激活下游转录因子以控制各自的反应[gydF4y2Ba50.gydF4y2Ba,gydF4y2Ba51.gydF4y2Ba].的gydF4y2Ba拟南芥gydF4y2BaGA生物合成和感知突变体等gydF4y2BaGA1-3gydF4y2Ba,gydF4y2BaGID1A-1 GID1B-1 GID1C-1gydF4y2Ba由于未经元丝,并且延迟了花药的雄性无菌[gydF4y2Ba4gydF4y2Ba].四倍突变体Q1 (gydF4y2BaGA1-3 GAI-T6 rgl1-1 rgl2-1gydF4y2BaRGA和RGL3的野生类型,Q3(gydF4y2BaGa1-3 ga1 -t6 rgl1-1 rga-t2gydF4y2Ba,rgl2和rgl3的野生型在雄蕊开发中仍延迟,而penta突变体(gydF4y2BaGa1-3 ga1 -t6 rga-t2 rgl1-1 rgl2-1gydF4y2Ba这表明DELLA蛋白RGA和RGL2在雄蕊发育抑制中起着重要作用[gydF4y2Ba52.gydF4y2Ba].gydF4y2Ba
气体激活表达gydF4y2BaMYB21gydF4y2Ba,gydF4y2BaMYB24gydF4y2Ba,gydF4y2BaMYB57gydF4y2Ba通过抑制DELLA蛋白和上调JA生物合成基因的表达gydF4y2BaDAD1gydF4y2Ba和gydF4y2BaLOX1gydF4y2Ba和JA生物合成介导的长丝伸长[gydF4y2Ba52.gydF4y2Ba].在本研究中,我们进一步证明MYB21和MYB24是della的直接靶点,是GA-JA在长丝伸长过程中协同作用的必要节点。我们发现DELLA蛋白通过R2R3结构域与MYB21和MYB24相互作用,并且DELLA蛋白和JAZ蛋白协同抑制MYB21和MYB24的转录功能以抑制纤维的延伸。gydF4y2Ba
结果gydF4y2Ba
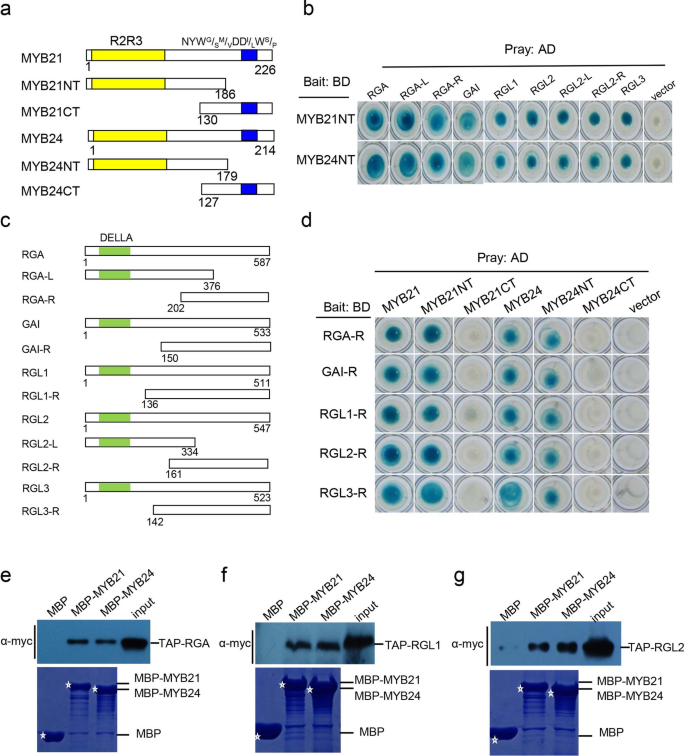
MyB21和MyB24与Della蛋白相互作用gydF4y2Ba
我们将MYB21与LexA DNA结合域(BD)融合,发现BD-MYB21在酵母中表现出很强的自激活(Additional file)gydF4y2Ba2gydF4y2Ba:图S1a)。我们进一步将MYB21截断成包含R2R3 DNA结合域的MYB21NT和包含NYW的MYB21CTgydF4y2BaGgydF4y2Ba/gydF4y2Ba年代gydF4y2Ba米gydF4y2Ba/gydF4y2BaVgydF4y2BaDDgydF4y2Ba我gydF4y2Ba/gydF4y2BalgydF4y2BaWgydF4y2Ba年代gydF4y2Ba/gydF4y2BaPgydF4y2Ba图案(图。gydF4y2Ba1gydF4y2Baa),发现myb21nt丢失了强大的自动激活(附加文件gydF4y2Ba2gydF4y2Ba:图S1a)。MyB21NT用作诱饵以筛选MyB21相互作用蛋白gydF4y2Ba拟南芥gydF4y2BaY2H系统中的cDNA文库。Della蛋白RGA是推定的相互作用克隆之一。gydF4y2Ba
della与MYB21和MYB24的相互作用。gydF4y2Ba一个gydF4y2BaMYB21和MYB24域结构示意图。R2R3守恒域,和NYWgydF4y2BaGgydF4y2Ba/gydF4y2Ba年代gydF4y2Ba米gydF4y2Ba/gydF4y2BaVgydF4y2BaDDgydF4y2Ba我gydF4y2Ba/gydF4y2BalgydF4y2BaWgydF4y2Ba年代gydF4y2Ba/gydF4y2BaPgydF4y2Ba母题分别用黄色和蓝色表示。这些数字表示结构域的第一个和最后一个氨基酸的位置。gydF4y2BabgydF4y2Ba酵母双杂交(Y2H)测定检测MyB21nt和MyB24NT与塞拉斯及其衍生物的相互作用。MyB21NT和MyB24NT与Plexa中的Lexa DNA结合结构域(BD)单独融合。戴尔斯及其衍生物与PB42AD中的激活域(AD)单独融合。MYB21NT和MYB24NT与PB42AD空向量中的AD域的相互作用用作负控。在2%Gal / 1%奖金/ SD / -URA / -HIS / -TRP / -LEU / X-β-加仑培养基上评估相互作用(由蓝色表示)。gydF4y2BacgydF4y2Ba戴尔域构造的示意图。Dellas的R部分包含保守的Della域(绿色)。这些数字表示结构域的第一个和最后一个氨基酸的位置。gydF4y2BadgydF4y2BaY2H测定检测达拉斯族域与MyB21,MyB24及其衍生物的相互作用。Dellas的R域与Plexa的BD域单独融合。MyB21,MyB24及其衍生物与PB42AD中的AD域单独融合。将Dellas与PB42AD空向量中的AD域的R域的相互作用用作阴性对照。在2%加仑/ 1%奖金/ SD / -URA / -HIS / -TRP / -LEU / X-β-加仑培养基中评估相互作用。gydF4y2Ba例如gydF4y2Ba体外下拉法检测RGA (e)、RGL1 (f)、RGL2 (gydF4y2BaggydF4y2Ba)和MYB21和MYB24。纯化的MBP、MBP- myb21和MBP- myb24融合蛋白与TAP-RGA、TAP-RGL1或TAP-RGL2转基因表达的TAP-RGA、TAP-RGL1或TAP-RGL2孵育gydF4y2Ba拟南芥gydF4y2Ba植物。洗涤结合的蛋白质,在SDS-PAGE上分离,并用抗C-MYC抗体(α-MYC)免疫润滑。输入通道显示TAP-RGA,TAP-RGL1或TAP-RGL2中的表达水平,TAP-RGA,TAP-RGL1或TAP-RGL2转基因植物中表达。SDS-PAGE上纯化的MBP,MBP-MYB21和MBP-MYB24的位置用星号表示(由Coomassie蓝色染色)。可以从附加文件查看原始数据gydF4y2Ba4gydF4y2Ba:图S3a-dgydF4y2Ba
我们进一步检测了MYB21NT与这五种基因的相互作用gydF4y2Ba拟南芥gydF4y2Ba在Y2H系统中,发现bd融合的MYB21NT与活化域(AD)融合的RGA、GAI、RGL1、RGL2和RGL3相互作用(图2。gydF4y2Ba1gydF4y2Bab),而阴性对照中未检测到交互作用(图)。gydF4y2Ba1gydF4y2Bab和附加文件gydF4y2Ba3.gydF4y2Ba:图S2A)。MyB21和MyB24是氨基酸水平的67.7%的同源物[gydF4y2Ba52.gydF4y2Ba].我们接下来研究了MYB24是否也能与della相互作用。bd融合的MYB24在酵母中表现出强烈的自激活(附加文件gydF4y2Ba2gydF4y2Ba:图S1B)。我们截断了MyB24进入MyB24NT(图。gydF4y2Ba1gydF4y2Baa),没有显示自动激活(附加文件gydF4y2Ba2gydF4y2Ba:图S1B)。如图所示。gydF4y2Ba1gydF4y2BaB,MYB24NT也与RGA,GAI,RGL1,RGL2和RGL3相互作用。gydF4y2Ba
带有BD结构域的全长DELLAs在酵母中表现出很强的自激活,因此,我们将DELLAs截短为L和R结构域(RGA-L和RGL2-L;RGA-R、GAI-R、RGL1-R、RGL2-R、RGL3-R)(图5)gydF4y2Ba1gydF4y2Bac), R域失去了强自激活。MYB21和MYB24分别与AD域融合,在酵母中未显示自激活(附文件gydF4y2Ba3.gydF4y2Ba:图开通)。Y2H的结果如图所示。gydF4y2Ba1gydF4y2Bad显示RGA-R、gae - r、RGL1-R、RGL2-R、RGL3-R在酵母中分别与MYB21和MYB24相互作用。gydF4y2Ba
接下来,我们通过下拉实验验证MYB21和MYB24与DELLAs的相互作用。表达麦芽糖结合蛋白(MBP)、融合MYB21 (MBP-MYB21)和MYB24 (MBP-MYB24)gydF4y2Ba大肠杆菌gydF4y2Ba用直链淀粉树脂纯化。提取转基因DELLA蛋白RGA、RGL1和RGL2gydF4y2Ba拟南芥gydF4y2Ba表达串联亲和纯化(TAP)标记融合DELLA蛋白(TAP- rga, TAP- rgl1和TAP- rgl2) [gydF4y2Ba41.gydF4y2Ba].MBP、MBP- myb21和MBP- myb24与表达TAP-RGA的TAP-RGA提取物孵育,SDS-PAGE分离,用抗c-myc抗体进行免疫印迹。结果表明,MBP- myb21和MBP- myb24可以有效地拉下TAP-RGA,而阴性对照MBP则不能(图5)。gydF4y2Ba1gydF4y2Bae),表明RGA与MYB21和MYB24相互作用。此外,我们还观察到DELLA蛋白RGL1和RGL2在拉下实验中与MYB21和MYB24相互作用(图。gydF4y2Ba1gydF4y2Baf和g)。gydF4y2Ba
携带的Y2H测定和下拉测定始终表明,戴拉斯与R2R3 MYB转录因子(MYB21和MYB24)相互作用,这意味着这两个转录因子是Della蛋白的直接靶标。gydF4y2Ba
MYB21和MYB24的R2R3域参与与大寮的互动gydF4y2Ba
我们进一步研究了DELLA R片段与MYB21NT、MYB24NT、MYB21CT和MYB24CT的相互作用。如图所示。gydF4y2Ba1gydF4y2Bad,rga-r,gai-r,rgl1-r,rgl2-r和rgl3-r与myb21nt和myb24nt相互作用,但不用myb21ct和myb24ct,而在阴性对照中没有检测相互作用(图。gydF4y2Ba1gydF4y2Bad和附加文件gydF4y2Ba3.gydF4y2Ba:图S2B),表明Dellas与MyB21和MyB24的R2R3 DNA结合结构域相互作用。gydF4y2Ba
我们还检查了Della蛋白的L或R结构域是否与MyB21NT和MyB24NT相互作用。Y2H结果表明,MyB21NT和MyB24NT与RGA和RGL2的L部件和R部分相互作用(图。gydF4y2Ba1gydF4y2Bab),而阴性对照中未检测到交互作用(图)。gydF4y2Ba1gydF4y2Bab和附加文件gydF4y2Ba3.gydF4y2Ba:图S2a),表示della的n端和c端都与MYB21和MYB24相互作用。gydF4y2Ba
DELLA和JAZ蛋白协同抑制MYB21和MYB24的转录功能gydF4y2Ba
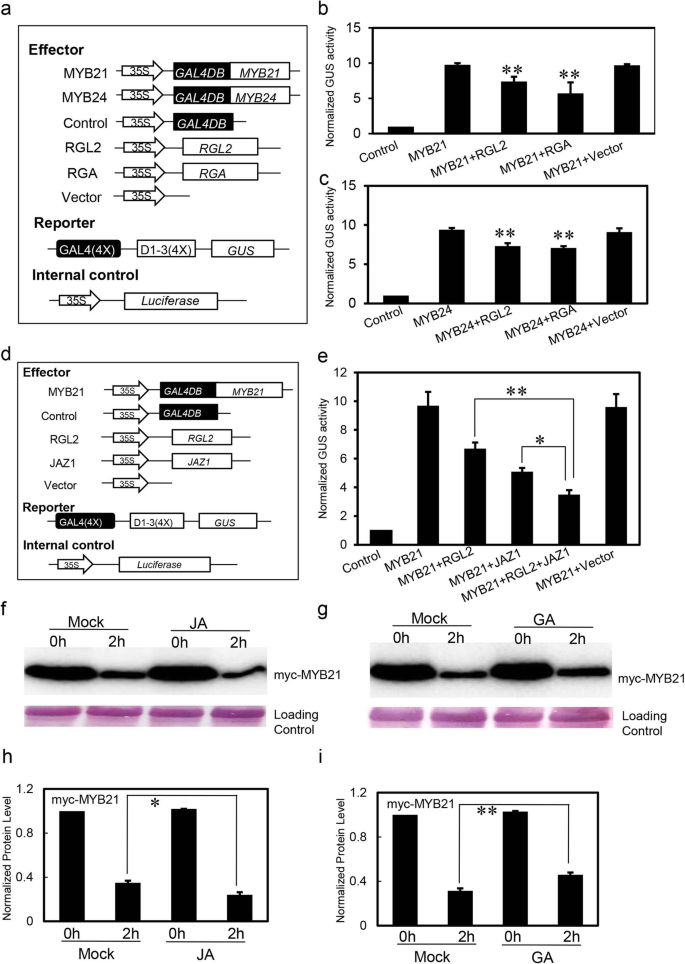
表明Dellas与MyB21和MyB24相互作用,我们执行了一个gydF4y2Ba拟南芥gydF4y2Ba原生质体瞬时表达试验[gydF4y2Ba53.gydF4y2Ba]利用GAL4 DNA结合域(GAL4DB)及其结合位点[GAL4(4X) -D1-3 (4X)]检测DELLAs是否能影响MYB21和MYB24的转录功能。gydF4y2Ba
MYB21和MYB24分别与GAL4DB载体融合并用作效果。记者是gydF4y2Ba格斯gydF4y2Ba(β-葡萄糖醛酸酶)基因由4个拷贝的GAL4 DNA结合位点[GAL4(4x) -D1-3 (4x)]控制,内控为35S启动子驱动gydF4y2Ba萤火虫荧光素酶gydF4y2Ba(LUC)基因(图。gydF4y2Ba2gydF4y2Baa).德拉的基因gydF4y2BaRGAgydF4y2Ba和gydF4y2Bargl2.gydF4y2Ba分别克隆到pGreen62载体中(图。gydF4y2Ba2gydF4y2Baa).如图。gydF4y2Ba2gydF4y2Bab,Gal4db-myb21与Gus报告者的表达可以增强GUS / LUC比,同时RGA或RG12与GAL4DB-MYB21压制抑制MYB21的转录功能。我们还观察到RGA和RGL2抑制MYB24的转录功能(图。gydF4y2Ba2gydF4y2Bac)。gydF4y2Ba
della和JAZs协同抑制MYB21的转录功能。gydF4y2Ba一个gydF4y2Ba示意图显示了瞬态表达测定中使用的构建体gydF4y2BabgydF4y2Ba和gydF4y2BacgydF4y2Ba.gydF4y2BabgydF4y2Ba和gydF4y2BacgydF4y2Ba瞬时表达测定表明,RGA和RGL2抑制了MYB21的转录功能gydF4y2BabgydF4y2Ba和myb24gydF4y2BacgydF4y2Ba.GUS记者和内部对照荧光素酶(LUC)与所示的构建体配对。数据为3个生物重复的平均值(±SE)。星号代表与MYB21相比的学生的T检验意义(**,gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2BadgydF4y2Ba瞬态表达测定中使用的构建体的示意图gydF4y2BaegydF4y2Ba.gydF4y2BaegydF4y2Ba瞬时表达分析显示,RGL2和JAZ1蛋白均能显著抑制MYB21的转录功能。数据为3个生物重复的平均值(±SE)。星号表示学生的t检验显著性,用括号(*,gydF4y2BaPgydF4y2Ba < 0.05; **,PgydF4y2Ba< 0.01)。gydF4y2BafgydF4y2Ba和gydF4y2BaggydF4y2Ba茉莉酸甲酯对MYB21蛋白质稳定性的影响。MyB21(Myc-Myb21)瞬时表达gydF4y2Ban benthamianagydF4y2Ba从烟草叶中提取,然后孵育而没有(模拟)或与茉莉酸甲酯(JA)孵育gydF4y2BafgydF4y2Ba,吉布林素(GA)gydF4y2BaggydF4y2Ba,表示时间(小时)。然后用抗c-myc抗体免疫印迹法检测myc-MYB21。PVDF膜用Memstain染色作为加载对照。可以从附加文件查看原始数据gydF4y2Ba4gydF4y2Ba:图S3e-f。gydF4y2BahgydF4y2Ba和gydF4y2Ba我gydF4y2Bamyc-MYB21蛋白水平的定量分析gydF4y2BafgydF4y2Ba和gydF4y2BaggydF4y2Ba.数据为3个生物重复的平均值(±SE)。星号表示学生的t检验显著性,用括号(*,gydF4y2BaPgydF4y2Ba < 0.05; **,PgydF4y2Ba< 0.01)。模拟处理0 h, myc-MYB21的丰度设为1.0gydF4y2Ba
jazs和dellas都与myb21和myb24相互作用(图。gydF4y2Ba1gydF4y2Ba)[gydF4y2Ba32.gydF4y2Ba],而DELLAs可以抑制这两个因子的转录功能(图。gydF4y2Ba2gydF4y2Bab和c),我们进一步研究了JAZs或della和JAZs是否协同调节MYB21和MYB24的转录功能。我们以MYB21为代表(图。gydF4y2Ba2gydF4y2Bad)并且发现rgl2或jaz1单独抑制myb21的转录活性(图。gydF4y2Ba2gydF4y2Bae)。我们进一步发现,与单独的RGL2或JAZ1相比,RGL2和JAZ1的共表达抑制myB21的转录活性更强(图。gydF4y2Ba2gydF4y2Bae)。这些结果表明,戴利斯和杰兹斯协调抑制了MYB21的转录活动。gydF4y2Ba
我们还探索了无细胞的测定系统[gydF4y2Ba54.gydF4y2Ba]来探讨MYB21蛋白水平是否受GA或JA调控gydF4y2Ban benthamianagydF4y2Ba叶瞬态表达了Myc-tyb21(Myc-myb21)。作为图1所示的结果。gydF4y2Ba2gydF4y2BaF和H,Myc-MyB21蛋白质水平在2小时内造成碎片后降至33%,而JA治疗促进了MyC-MyB21蛋白的降解(〜24%的Myc-myb21水平而没有治疗)。但是,GA可以延迟MYC融合MYB21的降解(没有治疗的MYC-MYB21级的〜46%)(图。gydF4y2Ba2gydF4y2Ba这些结果表明GA和JA可能在调节MYB21蛋白的稳定性方面起相反的作用。gydF4y2Ba
della和JAZs集中在MYB21和MYB24上调节纤维的伸长率gydF4y2Ba
由于JAZs和della均以MYB21和MYB24为靶点,我们进一步探讨了JA和GA在调节长丝伸长中的串音。gydF4y2Ba
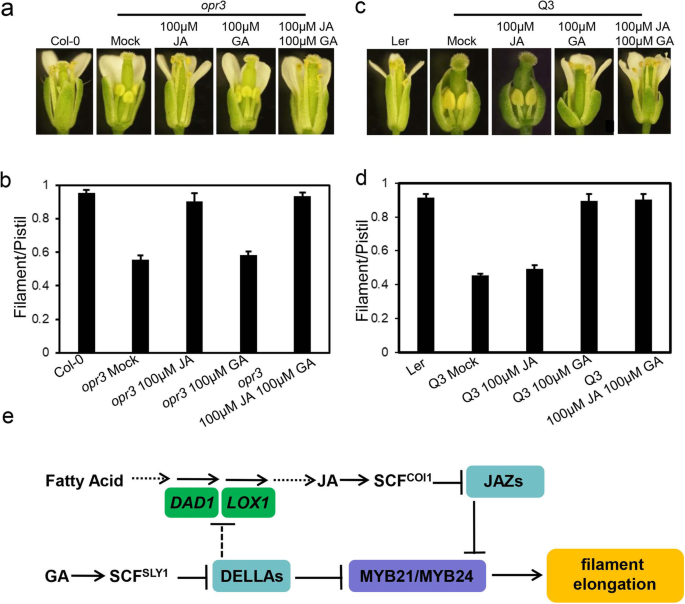
JA缺陷突变体中的长丝gydF4y2Baopr3gydF4y2Ba花期13远短于野生型,表明稳定的JAZ蛋白减弱了MYB21和MYB24抑制花丝伸长的功能,JA处理可以恢复花丝伸长gydF4y2Baopr3gydF4y2Ba(图。gydF4y2Ba3.gydF4y2Ba先前的研究表明GA可以诱导DELLA蛋白的降解[gydF4y2Ba46.gydF4y2Ba,gydF4y2Ba55.gydF4y2Ba].我们测试GA处理是否可以释放以della为靶点的MYB21和MYB24来促进细胞丝生长gydF4y2Baopr3gydF4y2Ba.进一步测定了花丝与雌蕊长度之比gydF4y2Baopr3gydF4y2Ba用ga治疗。如图所示。gydF4y2Ba3.gydF4y2Baa和b, GA处理只能轻微挽救花丝/雌蕊比gydF4y2Baopr3gydF4y2Ba,表明大部分MYB21和MYB24被JAZs抑制gydF4y2Baopr3gydF4y2Ba,并且通过GA治疗的释放的MyB21和MyB24不足以拯救灯丝伸长率gydF4y2Baopr3gydF4y2Ba,而JA和GA处理均可恢复纤维伸长率gydF4y2Baopr3gydF4y2Ba(图。gydF4y2Ba3.gydF4y2BaA和B)。gydF4y2Ba
della和JAZs集中在MYB21和MYB24上调节纤维的伸长率。gydF4y2Ba一个gydF4y2Ba在Col-0和Col-0和Coll阶段的花卉比较gydF4y2Baopr3gydF4y2Ba没有(模拟)或用甲基丙酸甲醇(JA),Gibberellin(Ga),或Ja加Ga的处理,用于所示的浓度。gydF4y2BabgydF4y2Ba在指定的基因型中的花卉阶段13中的长丝长度和雌蕊长度的比率。数据为3个生物重复的平均值(±SE)。gydF4y2BacgydF4y2Ba兰斯伯格花卉舞台13下花的比较gydF4y2Baerecta.gydF4y2Ba(ler)野生型和gydF4y2BaGa1-3 gae -t6 rga-t2 rgl1-1gydF4y2Ba(Q3)不加(Mock)或加茉莉酸甲酯(JA)、赤霉素(GA)或JA + GA处理。gydF4y2BadgydF4y2Ba在指定的基因型中的花卉阶段13中的长丝长度和雌蕊长度的比率。数据为3个生物重复的平均值(±SE)。gydF4y2BaegydF4y2Ba茉莉酸盐与赤霉素串扰调节细丝伸长的简化模型。jazs与myb21和myb24的转录功能相互作用,以抑制灯丝伸长(Song等人2011; Qi等,2015)。达拉斯抑制了Ja-Biosynthesis基因的表达gydF4y2BaDAD1gydF4y2Ba和gydF4y2BaLOX1gydF4y2Ba(Cheng et al. 2009),并与MYB21和MYB24相互作用并减弱其活性,使下游基因失活并抑制纤维伸长。JA和GA信号分别诱导JAZs和DELLAs降解,抑制MYB21和MYB24,并协同调节纤维伸长gydF4y2Ba拟南芥gydF4y2Ba
单独rgl2蛋白质可以抑制MyB21和MyB24的功能,以控制Q3中的灯丝伸长(gydF4y2BaGa1-3 ga1 -t6 rgl1-1 rga-t2gydF4y2Ba,rgl2和rgl3的野生类型[gydF4y2Ba52.gydF4y2Ba].Ga的施用可以诱导RG12降解并恢复Q3的长丝伸长(图。gydF4y2Ba3.gydF4y2Ba我们进一步探索JA处理对JAZs的降解是否能够释放足够的MYB21和MYB24来挽救Q3的灯丝生长。如图所示。gydF4y2Ba3.gydF4y2Bac和d, JA处理对Q3的花丝与雌蕊长度的比值恢复很弱,说明Q3中的RGL2单独能够显著抑制MYB21和MYB24抑制花丝伸长的功能。外源GA和JA均能恢复Q3的长丝伸长(图1)。gydF4y2Ba3.gydF4y2BaC和D)。gydF4y2Ba
讨论gydF4y2Ba
Ga和Ja两者兼作拮抗性地调节下胚轴伸长和根生长[gydF4y2Ba56.gydF4y2Ba,gydF4y2Ba57.gydF4y2Ba],并协同介绍雄蕊发育,培训症的发展和筛选培训[gydF4y2Ba43.gydF4y2Ba,gydF4y2Ba52.gydF4y2Ba,gydF4y2Ba58.gydF4y2Ba].在本研究中,我们进一步提出了一种新的模型,提供了GA和JA在长丝伸长过程中的协同信号机制。在该模型中,DELLAs和JAZs均与R2R3 MYB转录因子MYB21和MYB24相互作用,抑制其转录活性,而GA和JA则分别诱导DELLAs和JAZs降解,释放并协同激活MYB21和MYB24,协同调节纤维伸长(图)。gydF4y2Ba3.gydF4y2Bae)。gydF4y2Ba
符合这种协同监管机制,在JA Biosynthesis突变体中积累Jazs(gydF4y2Baopr3gydF4y2Ba),并且在Ga缺陷型突变体Q3中的Della蛋白RG12分别与MyB21和MyB24相互作用,并抑制细丝伸长率。外源性GA治疗gydF4y2Baopr3gydF4y2Ba或JA处理Q3均不能显著恢复长丝伸长率。gydF4y2Ba3.gydF4y2Baa-d),建议jazsgydF4y2Baopr3gydF4y2BaQ3中的RGL2可以有效抑制MYB21和MYB24控制纤维伸长的功能。gydF4y2Ba
最近的一项研究表明,IIIe bHLH转录因子(MYC2, MYC3, MYC4和MYC5)作为jas靶向蛋白冗余调控丝的延伸,并且这四个因子与MYB21和MYB24相互作用形成MYB-MYC复合体来调控丝的延伸[gydF4y2Ba38.gydF4y2Ba].已经表明,戴拉斯与MyB-Myc复合物的MYB组件的转录活性相互作用(图。gydF4y2Ba1gydF4y2Ba和gydF4y2Ba2gydF4y2Ba),研究DELLAs是否能够与MYB-MYC复合体的bHLH组分(MYC2、MYC3、MYC4和MYC5)相互作用并减弱其转录功能,以调节纤维的延伸gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba
以往的研究表明,茉莉酸诱导表达gydF4y2BaMYB21gydF4y2Ba和gydF4y2BaMYB24gydF4y2Ba[gydF4y2Ba33.gydF4y2Ba,gydF4y2Ba34.gydF4y2Ba[该GA促进JA生物合成以激活mRNA水平gydF4y2BaMYB21gydF4y2Ba和gydF4y2BaMYB24gydF4y2Ba[gydF4y2Ba52.gydF4y2Ba].我们还探讨了JA和GA是否影响MYB21蛋白的稳定性。如图所示。gydF4y2Ba2gydF4y2BaF-I,JA和GA分别可以促进或延迟MYB21的退化。它表明,MyB21的转录后调节机制是复杂的,这将有助于微妙的动态雄蕊开发,并需要进一步调查。gydF4y2Ba
结论gydF4y2Ba
总之,我们发现MyB21和MyB24是塞拉斯的直接目标,即Della和Jaz Proteins协同抑制MyB21和MyB24的转录活性,以抑制灯丝伸长率。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
的gydF4y2Ba拟南芥gydF4y2Ba突变体gydF4y2Baopr3gydF4y2Ba先前描述了Q3 [gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba52.gydF4y2Ba],并分别由约翰浏览教授(华盛顿州立大学)和金荣鹏教授(浙江大学)捐赠。的gydF4y2Ba拟南芥gydF4y2Ba先前描述了转基因植物TAP-RGA,TAP-RGL2和TAP-RGL1 [gydF4y2Ba41.gydF4y2Ba],由北京大学邓兴旺教授捐赠。gydF4y2Ba拟南芥gydF4y2Ba种子表面消毒20%漂白剂10分钟,镀Murashige和斯库(MS)中(Sigma-Aldrich)提供3%蔗糖,保持在4°C 3天在黑暗中,然后用16 h-light镀增长的房子(22°C到24°C) / 8 h-dark(16°C到19°C)光周期。将Q3种子浸泡在100 μM GA中gydF4y2Ba3.gydF4y2Ba4°C,播种前7天。gydF4y2Ba烟草benthamianagydF4y2BaYule Liu教授(清华大学)捐赠了种子,在22°C-28°C下培养,16 H光/ 8 H-深色光周期。gydF4y2Ba
Y2H筛选和Y2H测定gydF4y2Ba
Y2H筛选方法和Y2H测定方法已在前面描述[gydF4y2Ba32.gydF4y2Ba].在Y2H检测中,分别将MYB21、MYB24、RGA、GAI、RGL1、RGL2、RGL3及其相关结构域插入pLexA或pB42AD载体。将所示的构建对共转化到酵母株EGY48中,并在30°C的SD琼脂培养基上添加-His/−Trp/−Ura DO补充物(Clontech),放置4-5天。将转化酵母菌用SD/−His-Trp-Ura液体培养基重悬,在30°C下培养24 h,随后收集酵母菌并用蒸馏水重悬。将5 μl所示悬液滴入含有2% Gal/1%棉子糖/SD/−Ura/−His/−Trp/−Leu/X-β-Gal培养基的96孔板中。在30°C培养2天后进行Y2H成像。向量构造的引物列在附加文件中gydF4y2Ba1gydF4y2BaS1:表。gydF4y2Ba
下拉试验gydF4y2Ba
的编码区gydF4y2BaMYB21gydF4y2Ba,gydF4y2BaMYB24gydF4y2Ba克隆到pMAL-c5x (NEB)载体,分别生成融合MYB21和MYB24的MBP。MBP、MBP融合的MYB21和MYB24表达于gydF4y2Ba大肠杆菌gydF4y2Ba用直链淀粉树脂珠纯化。gydF4y2Ba
下拉测定方法先前描述了[gydF4y2Ba7gydF4y2Ba].下拉试验,5 g 14-d-old TAP-RGA, TAP-RGL2,和TAP-RGL1转基因幼苗分别收集,和总蛋白提取使用RB缓冲区(25毫米咪唑,100毫米氯化钠,50 mM Tris-Cl, pH值7.8,EDTA-free完成miniprotease抑制剂鸡尾酒,0.1% (v / v) Tween20, 10% (v / v)甘油,和20毫米2-mercaptoethanol),浓度为400 μL。50 mg纯化的MBP、MBP- myb21、MBP- myb24分别与200 μL直链淀粉树脂珠4℃温和旋转孵育2 h, RB缓冲液洗涤5次。随后加入含有TAP-RGA、TAP-RGL2或TAP-RGL1的浓缩总蛋白100 μL,在4℃下孵育2 h。用RB缓冲液洗涤5次后,在SDS上样缓冲液中变性。样品SDS-PAGE分离,抗c-myc抗体(Abmart)免疫印迹。gydF4y2Ba
原生质体转染试验gydF4y2Ba
在瞬时表达分析中gydF4y2Ba拟南芥myb21gydF4y2Ba和gydF4y2BaMYB24gydF4y2Ba被扩增并与Gal4DB载体融合通过gydF4y2BaSMA.gydF4y2Ba我和gydF4y2Ba萨尔gydF4y2Ba我网站,和gydF4y2BaRGAgydF4y2Ba,gydF4y2Bargl2.gydF4y2Ba和gydF4y2Bajaz1.gydF4y2Ba分别克隆到pGreenII 62-SK [gydF4y2Ba59.gydF4y2Ba].的gydF4y2Ba格斯gydF4y2Ba,gydF4y2Ba萤火虫luc.gydF4y2Ba基因分别由四个上游GAL4DB结合位点(GAL4(4X)-D1-3(4X))和35s启动子的四个拷贝控制,并分别作为报告和内部对照[gydF4y2Ba53.gydF4y2Ba].gydF4y2Ba拟南芥gydF4y2Ba叶片原生质体制备和转染如先前描述的[gydF4y2Ba60.gydF4y2Ba].用于质粒结构的引物在附加文件中列出gydF4y2Ba1gydF4y2BaS1:表。gydF4y2Ba
蛋白质降解测定gydF4y2Ba
n benthamianagydF4y2Ba叶子被浸透了gydF4y2Ba农杆菌gydF4y2Ba遏制myc-myb21。渗透后50小时,3克gydF4y2Ba农杆菌gydF4y2Ba-收集渗透的叶子。用RB缓冲液提取总蛋白,22°C孵育,不添加或添加100 μM茉莉酸甲酯(MeJA)、100 μM GAgydF4y2Ba3.gydF4y2Ba然后通过SDS-PAGE分离,转移到PVDF膜,并用抗C-MYC抗体(ABMART)检测。通过来自FluorChem M多函数(α)的软件量化MyB21的蛋白质水平。重复实验,对三个独立的生物学重复进行了重复。gydF4y2Ba
测量雌蕊和长丝长度gydF4y2Ba
在本实验中,第13花期10个花的4个较长花丝中的一个和雌蕊[gydF4y2Ba61.gydF4y2Ba收集并在显微镜下收集并测量每个基因型。年轻的花蕾gydF4y2Baopr3gydF4y2Ba和Q3分别以100 μM茉莉酸甲酯、100 μM赤霉素处理gydF4y2Ba3.gydF4y2Ba,或100 μM茉莉酸甲酯+ 100 μM GAgydF4y2Ba3.gydF4y2Ba每天2次检测花丝与雌蕊长度之比。重复实验,对三个独立的生物学重复进行了重复。gydF4y2Ba
加入号码gydF4y2Ba
拟南芥基因组启动数为GAI (AT4G02780)、RGA (AT2G01570)、RGL1 (AT1G66350)、RGL2 (AT3G03450)、RGL3 (AT5G17490)、JAZ1 (AT1G19180)、MYB21 (AT3G27810)和MYB24 (AT5G40350)。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本文结论的所有数据都包含在图和其他文件中。在合理的要求下,数据和设备材料可从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- COI1:gydF4y2Ba
-
冠状素不敏感1gydF4y2Ba
- GA:gydF4y2Ba
-
赤霉素gydF4y2Ba
- 盖:gydF4y2Ba
-
赤霉酸不敏感gydF4y2Ba
- 是:gydF4y2Ba
-
贾斯莫酸盐gydF4y2Ba
- 杰兹:gydF4y2Ba
-
JASMONATE ZIM-domaingydF4y2Ba
- MBP:gydF4y2Ba
-
麦芽糖结合蛋白gydF4y2Ba
- RGA:gydF4y2Ba
-
Ga1-3的阻遏物gydF4y2Ba
- RGL1:gydF4y2Ba
-
RGA-like1gydF4y2Ba
- 轻敲:gydF4y2Ba
-
串联亲和纯化gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Sanders PBA, Weterings K, McIntire K, Hsu Y, Lee PY, Truong MT, Beals TP, Goldberg RB。拟南芥雄性不育突变体的花药发育缺陷。《植物性繁殖》1999;11:297-322。gydF4y2Ba
- 2。gydF4y2Ba
GE X,Chang F,MA H.拟南芥生殖发育的信号和转录控制。Curr Biol。2010; 20(22):R988-97。gydF4y2Ba
- 3.gydF4y2Ba
吉贝林对雄蕊发育的控制:一个肥沃的土地。植物生态学报;2011;gydF4y2Ba
- 4。gydF4y2Ba
Marciniak K,Przedniczek K.综合洞察吉伯利林和茉莉酸族介导的雄蕊发展。基因(巴塞尔)。2019; 10(10):811。gydF4y2Ba
- 5。gydF4y2Ba
Fernandez-Calvo P, Chini A, Fernandez-Barbero G, Chico JM, Gimenez-Ibanez S, Geerinck J, Eeckhout D, Schweizer F, Godoy M, Franco-Zorrilla JM,等。的gydF4y2Ba拟南芥gydF4y2BabHLH转录因子MYC3和MYC4是JAZ阻遏子的靶标,在茉莉酸反应的激活中与MYC2共同作用。植物细胞。2011;23(2):701 - 15所示。gydF4y2Ba
- 6。gydF4y2Ba
结果表明,丙烯氧化物合酶基因的突变导致了雄性不育和损伤信号转导的缺陷gydF4y2Ba拟南芥gydF4y2Ba由于茉莉酸的生物合成受阻。植物j . 2002; 31(1): 1 - 12。gydF4y2Ba
- 7。gydF4y2Ba
齐T,歌曲,任q,吴D,黄鹤,陈y,风扇m,彭w,ren c,谢D.茉莉-zim结构域蛋白与WD重复/ BHLH / MYB复合物相互作用以调节jasmonate介导的花青素积累和培养的滴度gydF4y2Ba拟南芥gydF4y2Ba.植物细胞。2011;23(5):1795 - 814。gydF4y2Ba
- 8。gydF4y2Ba
Yoshida Y,Sano R,Wada T,Takabayashi J,Okada K.茉莉酸控制Glabra3链接诱导型防御和牵铬组图案gydF4y2Ba拟南芥gydF4y2Ba.发展。2009; 136(6):1039-48。gydF4y2Ba
- 9。gydF4y2Ba
翟Q,张X,吴F,冯H,邓L,徐L,张米,王Q,李酸盐瘤介导拟拟南芥开花时间延迟的转录机制。植物细胞。2015; 27(10):2814-28。gydF4y2Ba
- 10.gydF4y2Ba
acta botanica botanica(云南植物研究中心),2011 - 01 .戚涛,王静,黄华,刘波,高辉,刘洋,宋松,谢丹。拟南芥bHLH亚群IIIe和IIId因子拮抗茉莉酸对叶片衰老的调控。植物保护学报,2014,34(5):557 - 564。植物细胞。2015;27(6):1634 - 49。gydF4y2Ba
- 11.gydF4y2Ba
关键词:拟南芥,WRKY57,茉莉酸,生长素,信号转导植物细胞,2014,26(1):230 - 45。gydF4y2Ba
- 12.gydF4y2Ba
关键词:茉莉酸信号通路;植物细胞。2002;14:s153 - 64。gydF4y2Ba
- 13。gydF4y2Ba
宋森,黄辉,高辉,王杰,吴丹,刘鑫,杨松,翟强,李超,齐涛,等。拟南芥中MYC2与乙烯INSENSITIVE3的相互作用调节茉莉酸与乙烯信号通路的拮抗作用。植物细胞,2014,26(1):263 - 79。gydF4y2Ba
- 14。gydF4y2Ba
张X,Zhu Z,F,Hao D,Li P,Song J,Yi C,Guo H. jasMonate-iscapated MyC2抑制乙烯短暂敏感性3活性,以拮抗乙烯促进拟南芥的顶端钩形成。植物细胞。2014; 26(3):1105-17。gydF4y2Ba
- 15。gydF4y2Ba
胡锦涛,周文,程Z,风扇M,王L,谢D. JAV1控制茉莉植物防御。Mol细胞。2013; 50(4):504-15。gydF4y2Ba
- 16。gydF4y2Ba
关键词:拟南芥,CBF, c - repeat BINDING FACTOR, DRE BINDING FACTOR1,低温胁迫,诱导因子植物细胞。2013;25:2907-24。gydF4y2Ba
- 17。gydF4y2Ba
OsbHLH148与OsJAZ蛋白通过茉莉酸信号通路相互作用,导致水稻的耐旱性。植物j . 2011; 65(6): 907 - 21所示。gydF4y2Ba
- 18。gydF4y2Ba
Rao MV,Lee H,Creelman Ra,Mullet Je,Davis Kr。茉莉酸信号调节臭氧诱导的过敏细胞死亡。植物细胞。2000; 12(9):1633-46。gydF4y2Ba
- 19。gydF4y2Ba
闫C,风扇,杨米,赵杰,张W,苏y,Xiao l,邓H,谢D.损伤激活Jav1-Jaz8-Wrky51复合物的Ca(2 +)/钙调蛋白依赖性磷酸化,用于Jasmonate生物合成。Mol细胞。2018; 70(1):136-49 E137。gydF4y2Ba
- 20.gydF4y2Ba
燕C,谢D.百日咳在植物防御中:哨兵或双重药剂?植物Biotechnol J. 2015; 13(9):1233-40。gydF4y2Ba
- 21.gydF4y2Ba
王j,吴d,王y,谢D.茉莉酸盐在植物防御昆虫中的作用。J Exp Bot。2019; 70(13):3391-400。gydF4y2Ba
- 22.gydF4y2Ba
闫杰,张超,顾明,白忠,张伟,齐涛,程忠,彭伟,罗华,南飞,等。的gydF4y2Ba拟南芥gydF4y2Ba冠状素内敏感1蛋白是茉鲸属受体。植物细胞。2009; 21(8):2220-36。gydF4y2Ba
- 23.gydF4y2Ba
(1) Sheard LB, Tan X, Mao H, Withers J, Ben-Nissan G, Hinds TR, Kobayashi Y, Hsu FF, Sharon M, Browse J,等。肌醇-磷酸增强COI1-JAZ共受体对茉莉酸的感知。大自然。2010;468(7322):400 - 5。gydF4y2Ba
- 24。gydF4y2Ba
JAZ抑制蛋白是SCF的靶标蛋白gydF4y2BaCOI1.gydF4y2Ba茉莉酸信号通路中的复合体。大自然。2007;448(7154):661 - 5。gydF4y2Ba
- 25。gydF4y2Ba
Chini A, Fonseca S, Fernandez G, Adie B, Chico JM, Lorenzo O, Garcia-Casado G, Lopez-Vidriero I, Lozano FM, Ponce MR等。JAZ家族的阻遏者是茉莉酸信号传递中缺失的环节。自然。2007;448(7154):666 - 71。gydF4y2Ba
- 26。gydF4y2Ba
闫艳霞,李永平,李永平,李永平,李永平。茉莉酸途径的生长抑制肢体中的下游介质。植物细胞。2007;19(8):2470 - 83。gydF4y2Ba
- 27。gydF4y2Ba
石黑一郎,田河井oda,上田J,西田一,冈田kgydF4y2Ba花药开裂有缺陷的gydF4y2Ba基因编码新的磷脂酶A1催化茉莉酸生物合成的初始步骤,其使花粉成熟,花药裂开和花开口同步gydF4y2Ba拟南芥gydF4y2Ba.植物细胞。2001; 13(10):2191-209。gydF4y2Ba
- 28。gydF4y2Ba
Caldelari D, Wang G, Farmer EE, Dong X.拟南芥lox3 lox4双突变体是雄性不育和全球增殖抑制缺陷。中国生物医学工程学报,2011;gydF4y2Ba
- 29。gydF4y2Ba
Stintzi A, Browse J. ThegydF4y2Ba拟南芥gydF4y2Ba雄性无菌突变体,gydF4y2Baopr3gydF4y2Ba,缺乏Jasmonate合成所需的12-氧代苯甲酸还原酶。Proc Natl Acad Sci U S A. 2000; 97(19):10625-30。gydF4y2Ba
- 30.gydF4y2Ba
谢德克斯,Feys BF,James S,Nieto-Rostro M,Turner JG。gydF4y2BaCOI1.gydF4y2Ba:一个gydF4y2Ba拟南芥gydF4y2Ba茉莉酸调节防御和生育所需的基因。科学。1998;280(5366):1091 - 4。gydF4y2Ba
- 31.gydF4y2Ba
钟浩生,豪雅。在抑制茉莉酸信号通路中,TIFY基序的关键作用是通过茉莉酸zimo结构域蛋白JAZ10的稳定剪接变体gydF4y2Ba拟南芥gydF4y2Ba.植物细胞。2009; 21(1):131-45。gydF4y2Ba
- 32.gydF4y2Ba
关键词:茉莉酸,zim, R2R3-MYB,转录因子MYB21,雄蕊发育gydF4y2Ba拟南芥gydF4y2Ba.植物细胞。2011;23(3):1000 - 13所示。gydF4y2Ba
- 33.gydF4y2Ba
Mandaokar A, Browse J. MYB108与MYB24共同调控茉莉酸介导的雄蕊成熟gydF4y2Ba拟南芥gydF4y2Ba.植物杂志。2009;149(2):851 - 62。gydF4y2Ba
- 34.gydF4y2Ba
Mandaokar A,Thines B,Shin B,Lange Bm,Choi G,Koo Yj,Yoo Yj,Choi Yd,Choi G,浏览J.转录稳压器的雄蕊开发gydF4y2Ba拟南芥gydF4y2Ba通过转录分析鉴定。工厂J. 2006; 46(6):984-1008。gydF4y2Ba
- 35.gydF4y2Ba
关键词:甲酰亚胺,bHLH,转录因子,茉莉酸gydF4y2Ba拟南芥gydF4y2Ba.J Exp Bot。2011; 62(6):2143-54。gydF4y2Ba
- 36。gydF4y2Ba
关键词:bHLH, MYC3,转录因子,茉莉酸,zima -domain蛋白gydF4y2Ba拟南芥gydF4y2Ba.摩尔。2011;4:279 - 88。gydF4y2Ba
- 37。gydF4y2Ba
Figueroa P,浏览J.患有拟南芥的雄性不育,通过过表达MyC5-SRDX嵌合压缩机诱导。工厂J. 2015; 81(6):849-60。gydF4y2Ba
- 38。gydF4y2Ba
acta botanica botanica(云南植物研究中心),2011,30(5):729 - 734。植物细胞。2015;27:1-15。gydF4y2Ba
- 39。gydF4y2Ba
拟南芥赤霉酸信号抑制因子RGL2通过刺激脱落酸合成和ABI5活性抑制拟南芥种子萌发。植物细胞。2008;20(10):2729 - 45。gydF4y2Ba
- 40。gydF4y2Ba
KATO J.Gibberellin对豌豆茎切片伸长,水吸收和呼吸的影响。科学。1956; 123(3208):1132。gydF4y2Ba
- 41.gydF4y2Ba
Feng S, Martinez C, Gusmaroli G, Wang Y, Zhou J, Wang F, Chen L, Yu L, Iglesias-Pedraz JM, Kircher S, et al. .协调的监管gydF4y2Ba拟南芥gydF4y2Ba光线和吉布林素的开发。自然。2008; 451(7177):475-9。gydF4y2Ba
- 42.gydF4y2Ba
De Lucas M, Daviere JM, rodrigez - falcon M, Pontin M, Iglesias-Pedraz JM, Lorrain S, Fankhauser C, Blazquez MA, Titarenko E, Prat S.光和赤霉素控制细胞伸长的分子框架。大自然。2008;451(7177):480 - 4。gydF4y2Ba
- 43.gydF4y2Ba
齐T,黄鹤,吴D,闫杰,齐y,歌曲S,谢D。拟南芥Della和Jaz蛋白质结合了WD-Repeed / BHLH / MYB综合体,调节嗜酸甘油蛋白和茉莉酸盐信号协同作用。植物细胞。2014; 26(3):1118-33。gydF4y2Ba
- 44.gydF4y2Ba
关键词:拟南芥,拟南芥,赤霉素,DELLA蛋白,花发育发展。2004;131(5):1055 - 64。gydF4y2Ba
- 45.gydF4y2Ba
拟南芥短日照开花需要赤霉素。植物杂志。1992;100(1):403 - 8。gydF4y2Ba
- 46.gydF4y2Ba
银石AL, Jung HS, Dill A, Kawaide H, Kamiya Y, Sun TP。抑制抑制因子:赤霉素诱导的拟南芥RGA蛋白的快速减少。植物细胞。2001;13(7):1555 - 66。gydF4y2Ba
- 47.gydF4y2Ba
Lee S,Cheng H,King Ke,Wang W,Hus Y,Hussain A,Lo J,Harberd NP,Peng J.Gibberellin通过RGL2调节拟南芥种子萌发,其表达在吸收后上调。.基因开发。2002; 16(5):646-58。gydF4y2Ba
- 48.gydF4y2Ba
Peng J, Carol P, Richards DE, King KE, Cowling RJ, Murphy GP, Harberd NP。拟南芥GAI基因定义了一个负调控赤霉素反应的信号通路。基因Dev。1997;11(23):3194 - 205。gydF4y2Ba
- 49。gydF4y2Ba
江C,傅X. GA行动:打开de-della镇压信号。CurrOp植物BIOL。2007; 10(5):461-5。gydF4y2Ba
- 50。gydF4y2Ba
Hartweck LM。吉布雷林信令。Planta。2008; 229(1):1-13。gydF4y2Ba
- 51。gydF4y2Ba
太阳TP。植物GA-GID1-DELLA信号模块的分子机制和进化。咕咕叫医学杂志。2011;21 (9):R338-45。gydF4y2Ba
- 52。gydF4y2Ba
关键词:赤霉素,茉莉酸,表达,调控gydF4y2BaMYB21gydF4y2Ba,gydF4y2BaMYB24gydF4y2Ba,gydF4y2BaMYB57gydF4y2Ba促进雄蕊长丝的生长gydF4y2Ba拟南芥gydF4y2Ba.公共科学图书馆麝猫。2009;5 (3):e1000440。gydF4y2Ba
- 53.gydF4y2Ba
王学军,王学军,王学军。AUX/IAA蛋白是活性抑制因子,其稳定性和活性受生长素调控。植物细胞。2001;13(12):2809 - 22所示。gydF4y2Ba
- 54.gydF4y2Ba
王飞,朱丹,黄翔,李胜,龚毅,姚强,傅翔,范利民,邓晓伟。从无细胞检测系统中获得的拟南芥DELLA蛋白降解的生化洞见。植物细胞。2009;21(8):2378 - 90。gydF4y2Ba
- 55.gydF4y2Ba
Harberd NP,Belfiffe E,Yasumura Y. Agiosperm Gibberellin-GID1-Della生长调节机制:如何抑制剂的“抑制剂”可以灵活地响应波动环境。植物细胞。2009; 21(5):1328-39。gydF4y2Ba
- 56.gydF4y2Ba
杨德尔,姚杰,梅cs,桐xh,zeng lj,李q,小x lt,sun tp,李j,邓xw等。植物激素茉莉酸酯通过干扰吉伯塞林信号级联来优先考虑对增长的防御。Proc Natl Acad Sci U S A. 2012; 109(19):E1192-200。gydF4y2Ba
- 57.gydF4y2Ba
侯X,李莉,夏k,yan y,yu h. dellas通过竞争对手的竞争与jazs调节茉莉酸字信号传导。DEV细胞。2010; 19(6):884-94。gydF4y2Ba
- 58.gydF4y2Ba
洪光军,薛晓云,毛义波,王丽娟,陈晓云。gydF4y2Ba拟南芥gydF4y2BaMYC2与DELLA蛋白相互作用,调节倍半萜合成酶基因的表达。植物细胞,2012;24(6):2635 - 48。gydF4y2Ba
- 59.gydF4y2Ba
Hellens RP, Allan AC, Friel EN, Bolitho K, Grafton K, Templeton MD, Karunairetnam S, Gleave AP, Laing WA。植物功能基因组学、启动子活性定量和RNA沉默的瞬时表达载体。工厂方法。2005;1:13。gydF4y2Ba
- 60.gydF4y2Ba
Yoo Sd,Cho Yh,Sheen J. Arabidopsis叶片原生质体:一种用于瞬态基因表达分析的通用细胞系统。NAT PROTOC。2007; 2(7):1565-72。gydF4y2Ba
- 61。gydF4y2Ba
Smyth Dr,Bowman JL,Meyerowitz Em。早开花开发gydF4y2Ba拟南芥gydF4y2Ba.植物细胞。1990;2(8):755 - 67。gydF4y2Ba
致谢gydF4y2Ba
我们感谢邓星旺博士提供的TAP-RGA/TAP-RGL2/TAP-RGL1种子,Chong Kang博士提供的原生质体转染实验载体,以及John Browse博士提供的gydF4y2Baopr3gydF4y2Ba突变种子。gydF4y2Ba
资金gydF4y2Ba
中国天然科学基金(Grant No.6194030),中国天然科学基金(Grant No.3194030),中国天然科学基金(批准号31902026),这项工作得到了财务支持to H.H. (Grant No.66), and Scientific Research Project of Beijing Municipal Commission of Education (Grant No.KM201910020013).
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
H.H.和S.S.设计了实验,进行了研究并写了稿件;Y.G.,B.L.和D.W.协助进行实验和分析数据;M.Z.和D.X.修改了稿件。所有作者都读过并批准了稿件。gydF4y2Ba
相应的作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意gydF4y2Ba
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
额外的文件1:gydF4y2Ba
表S1。gydF4y2Ba用于向量构建的引物gydF4y2Ba
额外的文件2:gydF4y2Ba
图S1。gydF4y2BaY2H实验中MYB21、MYB21NT、MYB24和MYB24NT的自激活检测。MYB21、MYB21NT、MYB24和MYB24NT分别与pLexA中的LexA DNA结合域(BD)融合。带有BD结构域的MYB21和MYB24全长均表现为自激活,而带有BD结构域的MYB21 (MYB21NT)和MYB24 (MYB24NT)的n端则丧失自激活。在2% Gal/1%棉子糖/SD/−Ura/−His/−Trp/−Leu/X-β-Gal培养基上进行自动激活(以蓝色表示)检测。gydF4y2Ba
额外的文件3:gydF4y2Ba
图S2。gydF4y2BaY2H实验阴性对照。pB42AD-RGA/RGA-L/RGA-R/GAI/RGL1/RGL2/RGL2- l /RGL2- r /RGL3/MYB21/MYB21NT/MYB21CT/MYB24/MYB24NT/MYB24CT在pLexA空载体中与BD结构域共表达后未检测到相互作用。在2%加仑/ 1%奖金/ SD / -URA / -HIS / -TRP / -LEU / X-β-加仑培养基中评估相互作用。gydF4y2Ba
附加文件4:gydF4y2Ba
图S3。gydF4y2Ba图的源数据。gydF4y2Ba1E-G.gydF4y2Ba和gydF4y2Ba2F-G.gydF4y2Ba.(A-C)图A-C中的红色帧分别显示了图3和5的源数据。gydF4y2Ba1E-G.gydF4y2Ba.(d) SDS-PAGE凝胶全扫描如图1 -g所示。从左到右的红色框显示了图中的源数据。gydF4y2Ba1e g fgydF4y2Ba, 分别。星号表示纯化的MBP,MBP-MYB21和MBP-MYB24的位置。(e)完全扫描图1和2中所示的结果。gydF4y2Ba2F-G.gydF4y2Ba.从左到右的红色帧分别显示了图4的源数据。gydF4y2Ba2f,ggydF4y2Ba.(f)从左到右的红色帧分别显示图4和5的源数据。2f,2克。gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文在知识共享归属4.0国际许可条款下发布(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介中不受限制地使用、分发和复制,只要您给予原作者和来源适当的信任,提供知识共享许可的链接,并说明是否有更改。“创作共用公共领域”豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
黄,H.,Gong,Y.,Liu,B。gydF4y2Baet al。gydF4y2BaDella蛋白与MyB21和MyB24相互作用以调节丝伸长率gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2BaBMC植物BIOL.gydF4y2Ba20.gydF4y2Ba64(2020)。https://doi.org/10.1186/s12870-020-2274-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-2274-0gydF4y2Ba
关键字gydF4y2Ba
- 赤霉素gydF4y2Ba
- 贾斯莫酸盐gydF4y2Ba
- MYB21gydF4y2Ba
- MYB24gydF4y2Ba
- 丝伸长gydF4y2Ba