- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发布:gydF4y2Ba
转基因鹰嘴豆(gydF4y2BaCicer Arietinum.gydF4y2BaL.)窝藏gydF4y2Baatdreb1a.gydF4y2Ba在生理学上更好地适应水资源赤字gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21.gydF4y2Ba文章编号:gydF4y2Ba39.gydF4y2Ba(gydF4y2Ba2021.gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
鹰嘴豆(gydF4y2BaCicer Arietinum.gydF4y2BaL.)是第二种最广泛种植的脉冲和干旱(限制水)是主要约束之一,每年导致约40-50%的产量损失。脱水响应元件结合蛋白(DREBS)是重要的植物转录因子,其调节许多应激诱导基因的表达,并在提高非生物胁迫耐受性方面发挥关键作用。转录因子的转基因鹰嘴豆线,脱水响应元素结合蛋白1agydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba(gydF4y2Baatdreb1a.gydF4y2Ba基因)由胁迫诱导启动子驱动gydF4y2Bard29agydF4y2Ba是为了提高鹰嘴豆的耐旱性而开发的gydF4y2Ba.gydF4y2Ba基于赋予诸如植物水关系特性,叶绿素保留,光合作用,膜稳定性和水使用效率,基于赋予耐旱性耐受性的关键生理性状和对照的后代性能。gydF4y2Ba
结果gydF4y2Ba
四种转基因鹰嘴豆线窝藏压力诱导gydF4y2Baatdreb1a.gydF4y2Ba产生0.1%的转化效率。通过聚合酶链反应(PCR),Southern印迹杂交和逆转录酶聚合酶链反应(RT-PCR)证实了整合,透射和调节表达。转基因鹰嘴豆线展出gydF4y2Ba更高gydF4y2Ba相对含水量,gydF4y2Ba较长gydF4y2Ba叶绿素保留能力和gydF4y2Ba更高gydF4y2Ba与对照相比,严重干旱胁迫(胁迫水平4)下的渗透调节。转基因鹰嘴豆抗旱性增强还表现在光合作用方面,包括PSII量子产率、饱和辐照下电子传递率的提高以及在相对严重的土壤水分亏缺条件下叶片保持较高的相对含水量。此外,部分转基因鹰嘴豆品种的碳同位素辨识值较低,表明其水分利用效率较高。与对照相比,转基因鹰嘴豆在水分胁迫下的产量随胁迫时间的增加而增加。gydF4y2Ba
结论gydF4y2Ba
基于精确的表型,涉及非侵入性叶绿素荧光成像,碳同位素辨别,渗透性调节,更高的叶绿素保留和膜稳定性指数,可以得出结论gydF4y2Baatdreb1a.gydF4y2Ba通过改变重要的生理性状,转基因鹰嘴豆植物系更适应水缺损。所选转基因鹰嘴豆事件将是一个有价值的资源,可用于预育种或直接在炎前的腐殖质耐受性的品种发展方案中。gydF4y2Ba
背景gydF4y2Ba
Chickpea是一个重要的凉爽季节谷物豆类和素食主义者的丰富蛋白质来源,特别是在发展中国家,在确保营养安全方面发挥着至关重要的作用[gydF4y2Ba1gydF4y2Ba].鹰嘴豆主要在雨水农业生态系统下种植,保守土壤水分是植物生长和发育的主要水源。在雨水条件下,如果降雨不足,作物通常会经历增加干旱和高温胁迫,因为它对生殖阶段进行了进展[gydF4y2Ba2gydF4y2Ba].因此,末端干旱是鹰嘴豆生产的主要制约因素之一,导致约40-50%的产量损失[gydF4y2Ba3.gydF4y2Ba].因此,迫切需要增强鹰嘴豆的耐旱性,以维持其生产率。此外,全球变暖和预测的未来气候变化影响降水,温度,蒸发蒸腾和其他变幻无止的天气,将加剧多年来干旱的严重程度。通过各种生理和纯种适应鸡眼耐旱耐受的遗传机制已被充分记录;然而,由于高光学热过度灵敏度,各种农业气候条件的耐旱耐受性的稳定性非常低。因此,鹰嘴豆的自适应机制是生态系统特异性的。为了改善耐旱和产量稳定性,基因工程方法是必不可少的,这将不变,以确保干旱条件的持久性状的表达。干旱耐受性是一种复杂的特征,通常由涉及许多生化途径的多种基因治理。最近,a“gydF4y2BaQTL(定量特质基因座)热点gydF4y2Ba“对于第四个组装鸡肝基因组的第四伪分子已经确定了耐旱耐受性[gydF4y2Ba4gydF4y2Ba],并对其进行仔细分析,以确定可能的候选基因[gydF4y2Ba5gydF4y2Ba].此外,对来自世界45个国家的429个鹰嘴豆株系(栽培和野生基因型)进行重测序,报告了262个标记性状关联(mta)和耐旱和耐热候选基因[gydF4y2Ba6gydF4y2Ba].gydF4y2Ba
鸡眼具有狭窄的遗传基础,由独特的驯化模式产生[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba因此,鹰嘴豆植物的发展是增强的干旱耐受性是非常重要的努力。基因工程提供了引入与脉冲中的干旱耐受和其他特征相关的具体性状的手段[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].已知的基因参与转录因子(TFS),保护蛋白,Osmolyte代谢,反应性氧物质(ROS)-scavenging蛋白,信号传导因子,转化后修饰,小RNA,基因表达和荷尔蒙网络的表观遗传控制等目前正在设想增强的干旱耐受性[gydF4y2Ba10.gydF4y2Ba].脱水响应元件结合蛋白(DREBS)是重要的植物TFS,其调节许多应激诱导基因的表达,并在改善植物的非生物胁迫耐受性方面发挥着关键作用[gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba].TFS与脱水响应元件(DRE)/ C重复(CRT)相互作用gydF4y2Ba独联体gydF4y2Ba在各种非生物应激响应基因的启动子区中存在的元素,并影响其调节[gydF4y2Ba13.gydF4y2Ba].gydF4y2Baatdreb1a.gydF4y2Ba是重要的AP2 / ERF (APETALA2)/乙烯反应因子(ERF)群gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba),诱导一系列涉及各种脱落酸(ABA)依赖和独立调节机制的非生物胁迫耐受基因[gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba15.gydF4y2Ba].gydF4y2Ba
在不同作物中,利用非生物胁迫增强抗逆性的报道较多gydF4y2BaDreb.gydF4y2BaGene viz。冷冻耐受性gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba16.gydF4y2Ba]番茄中的水赤字压力[gydF4y2Ba17.gydF4y2Ba烟草中的干旱,低温和盐度耐受性[gydF4y2Ba18.gydF4y2Ba,gydF4y2Ba19.gydF4y2Ba菊花中的干旱和盐胁迫耐受性[gydF4y2Ba20.gydF4y2Ba],提高花生的蒸腾效率[gydF4y2Ba21.gydF4y2Ba]、大豆的耐旱性[gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba23.gydF4y2Ba],更好的根和射击分区和鹰嘴豆中的更高TE [gydF4y2Ba24.gydF4y2Ba].各种各样的角色gydF4y2BaDreb.gydF4y2Ba在指向其通过转基因植物中的调节或组成型表达指向其影响多个非生物应激的能力的报告中恰当地证明了基因。转基因植物的形态学表达过度表达gydF4y2BaDreb.gydF4y2Ba据报道,基因在组成型启动子下影响生长模式,因此使用应激诱导的启动子获得更广泛的偏好。随后,调节表达gydF4y2BaDreb.gydF4y2Ba水稻基因[gydF4y2Ba25.gydF4y2Ba], 土豆 [gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba27.gydF4y2Ba)、花生(gydF4y2Ba28.gydF4y2Ba,gydF4y2Ba29.gydF4y2Ba], 棉布 [gydF4y2Ba30.gydF4y2Ba鹰嘴豆[gydF4y2Ba24.gydF4y2Ba还报道了。gydF4y2Ba
在这里,我们报告发展,分子特征,详细表型的鹰嘴豆事件窝藏gydF4y2BaRD29A.gydF4y2Ba驱动gydF4y2Baatdreb1a.gydF4y2Ba基因并比较在转基因遏制设施(PBSL1)中浇水(WW)和水胁迫(WS)条件下的谷物产量(PBSL1),以了解gydF4y2Baatdreb1a.gydF4y2Ba在适应鸡眼到水赤字条件。gydF4y2Ba
结果gydF4y2Ba
生产转基因鹰嘴豆线gydF4y2Ba
在本研究中,从共同培养的外植体(带半胚轴轴)的鸡眼(gydF4y2Ba简历gydF4y2Ba.DCP 92-3),采用预标准化的遗传转化协议。将4 ~ 5次再生后的抗卡那霉素芽移栽于预发芽鹰嘴豆砧木(gydF4y2Ba无转型gydF4y2Ba)在转基因遏制设施(PBSL1)中,可以建立为成熟的肥沃植物(补充图gydF4y2Ba2gydF4y2Ba).共培养了4031个外植体gydF4y2Ba农杆菌肿瘤术gydF4y2Ba隐匿的gydF4y2Baatdreb1a.gydF4y2Ba基因和总共四种成熟的肥沃初级转化体(TgydF4y2Ba0gydF4y2Ba) (EgydF4y2Ba5gydF4y2Ba,E.gydF4y2Ba17.gydF4y2Ba,E.gydF4y2Ba19.gydF4y2Ba,E.gydF4y2Ba22.gydF4y2Ba),转化频率为0.1%。接穗种子(TgydF4y2Ba1gydF4y2Ba)是从所有四种已建立的植物中收获的。在随后的季节里,TgydF4y2Ba2gydF4y2Ba从PCR阳性T收获种子gydF4y2Ba1gydF4y2Ba用于详细分子分析的植物。此外,一个转基因事件的种子(EgydF4y2Ba17.gydF4y2Ba)被提前到了gydF4y2Ba3.gydF4y2Ba在干燥条件下进行详细表型评估的阶段。从所有四个事件中收获的种子细节(tgydF4y2Ba1gydF4y2Ba到了gydF4y2Ba3.gydF4y2Ba阶段)载于附表gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
转基因鹰嘴豆线的分子分析gydF4y2Ba
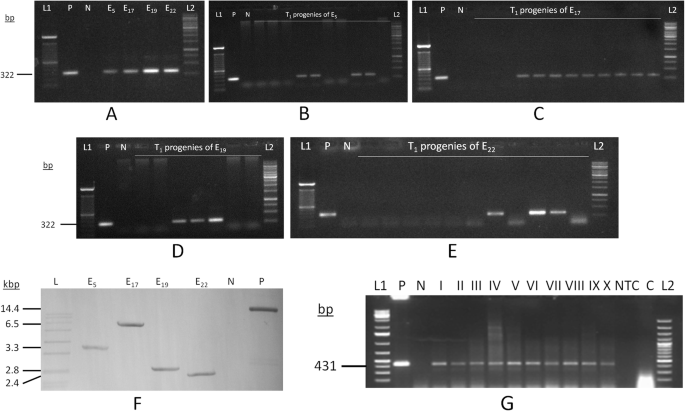
PCR分析gydF4y2Baatdreb1a.gydF4y2Ba基因和gydF4y2BanptIIgydF4y2Ba基因特异性引物显示,4个鹰嘴豆转基因事件(EgydF4y2Ba5gydF4y2Ba,E.gydF4y2Ba17.gydF4y2Ba,E.gydF4y2Ba19.gydF4y2Ba,E.gydF4y2Ba22.gydF4y2Ba)在T.gydF4y2Ba0gydF4y2Ba阶段(图。gydF4y2Ba1gydF4y2Baa). TgydF4y2Ba1gydF4y2Ba后代衍生出所有事件所示的转基因的分离模式(egydF4y2Ba5gydF4y2Ba(2:3),EgydF4y2Ba17.gydF4y2Ba(3:1), EgydF4y2Ba19.gydF4y2Ba(3:4)和egydF4y2Ba22.gydF4y2Ba(3:8)(图。gydF4y2Ba1gydF4y2Bab,c,d和e)和gydF4y2BachgydF4y2Ba-Square测试指示3:1 e的分离模式gydF4y2Ba17.gydF4y2Ba(补充表gydF4y2Ba2gydF4y2Ba).南方印迹从汇集的鹰嘴豆产后进行(TgydF4y2Ba1gydF4y2Ba阶段)四个事件呈现出存在与融合gydF4y2Baatdreb1a.gydF4y2Ba在鹰嘴豆基因组独特位置的基因(分别约3.3 kb, 6.5 kb, 2.8 kb和2.4 kb)(图。gydF4y2Ba1gydF4y2Baf)(补充图。gydF4y2Ba3.gydF4y2Ba).具有基因特异性引物的RT-PCR检测到所有四个事件中存在431个BP扩增产物(TgydF4y2Ba1gydF4y2Ba&T.gydF4y2Ba2gydF4y2Ba)表明转录gydF4y2Baatdreb1a.gydF4y2Ba在胁迫后,转基因后代的基因(图。gydF4y2Ba1gydF4y2Bag)(补充图。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
转基因鹰嘴豆线的分子分析gydF4y2Ba一个gydF4y2Ba: 4个鹰嘴豆转基因事件(TgydF4y2Ba0gydF4y2Ba);gydF4y2BabgydF4y2Ba:转基因鹰嘴豆产后的PCR分析(TgydF4y2Ba1gydF4y2Ba)来自egydF4y2Ba5gydF4y2Ba;gydF4y2BacgydF4y2Ba:转基因鹰嘴豆产后的PCR分析(TgydF4y2Ba1gydF4y2Ba)来自egydF4y2Ba17.gydF4y2Ba;gydF4y2BadgydF4y2Ba:转基因鹰嘴豆产后的PCR分析(TgydF4y2Ba1gydF4y2Ba)来自egydF4y2Ba19.gydF4y2Ba;gydF4y2BaegydF4y2Ba:转基因鹰嘴豆产后的PCR分析(TgydF4y2Ba1gydF4y2Ba)来自egydF4y2Ba22;gydF4y2Ba[L1-100 BP DNA梯子和L2-1 KB DNA梯子];gydF4y2BafgydF4y2Ba:Southern印迹分析(L:挖掘标记的DNA梯子; I-IV:四个独立的转基因鹰嘴豆线E.gydF4y2Ba5gydF4y2Ba,E.gydF4y2Ba17.gydF4y2Ba,E.gydF4y2Ba19.gydF4y2Ba和EgydF4y2Ba22.gydF4y2Ba(T1阶段);n:非转化的鸡豆(DCP 92-3);P:阳性对照(二元质粒)。gydF4y2BaggydF4y2Ba:RT-PCR分析(L1:1KB Plus DNA梯; P:阳性对照; N:阴性对照; I-IV:转基因鹰嘴豆线(TgydF4y2Ba1gydF4y2Ba阶段);V-X:转基因鹰嘴豆线(TgydF4y2Ba2gydF4y2Ba阶段);NTC:没有模板控制;C:RNA作为模板;L2:100bp DNA梯子)[均值SM 11.8%,平均值LWP -0.82 MPa]gydF4y2Ba
转基因鹰嘴豆线的表型gydF4y2Ba
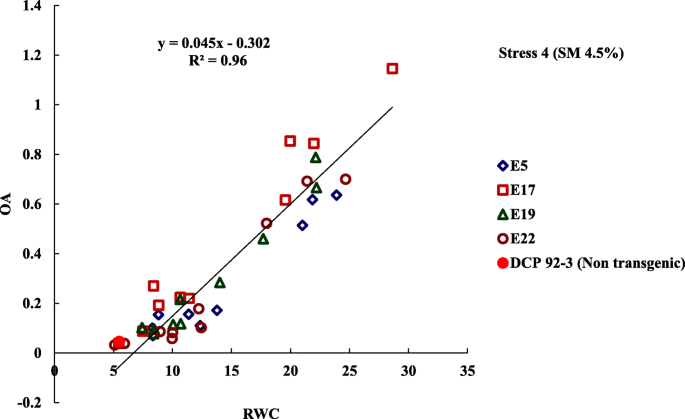
基于RWC和OA的初步表型研究在四种转基因事件的后代,总是证明了OA的改善,当受到严重的水胁迫(应力水平4)而不是其未转化的对应物,DCP 92-3(对照)。干旱反应基因的显着影响,gydF4y2Baatdreb1a.gydF4y2Ba在改变下游生化途径以赋予水限制条件下的耐受性,通过改善观察到包括RWC的植物水关系(表gydF4y2Ba1gydF4y2Ba)(补充表gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba).在测试的四个事件中,在从事件e衍生的后代观察到最大水平的OA表达gydF4y2Ba17.gydF4y2Ba,这也表现出在严重水分应激(应力水平4)下维持RWC的比例较高趋势。四个转基因事件的所有导出线的渗透(OA)数据以相应的RWC值回归以获得线性关系(RgydF4y2Ba2gydF4y2Ba在这两个特征之间的0.95)(图。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
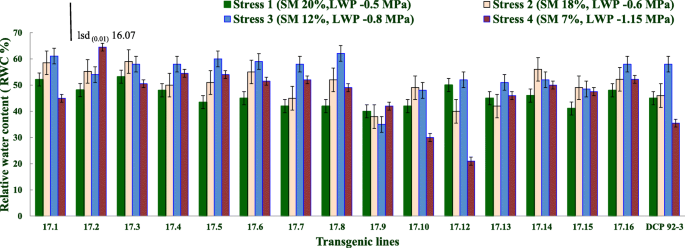
所有表型研究都使用T进行gydF4y2Ba3.gydF4y2Ba从十六岁衍生的后代gydF4y2Ba2gydF4y2Ba来源于一个转基因事件的系(EgydF4y2Ba17.gydF4y2Ba).转基因鹰嘴豆系表现出不同的RWC状态,随着平均土壤水分从20%下降至7%(应激等级4)(几乎处于现场容量,饱和水分,胁迫水平1)。转基因鹰嘴豆系在等土壤水分压力水平上表现出较高和下叶RWC。随着干旱的逐步发展,减压4(7%的土壤水分),从两种转基因系VIZ衍生的后代。17.2和17.9,与其在较低应力水平的相应RWC值相比,保持更高的RWC(应力1至3)。虽然其他转基因系在应激级别4的RWC中观察到RWC,转基因系17.10和17.12更好。转基因系保持均匀较高的RWC,水分应激(1至4)的逐渐增加(图。gydF4y2Ba3.gydF4y2Ba)(补充表gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
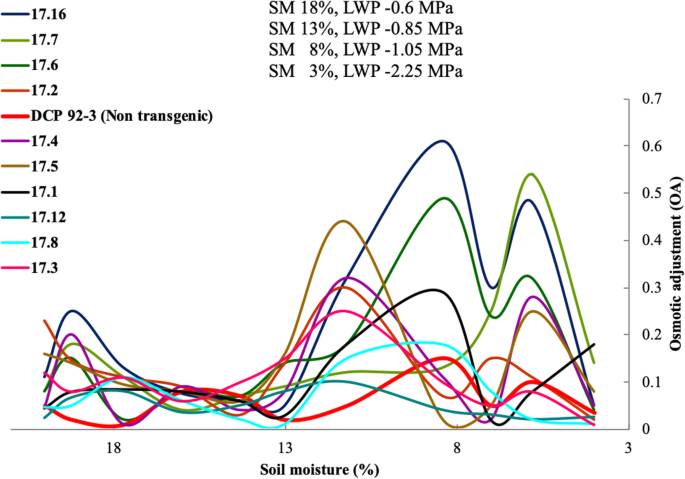
在干旱严重且土壤水分下降低于7%(胁迫水平4)的条件下,转基因鹰嘴豆株系(17.2、17.5、17.6、17.7、17.15和17.16)的OA显著高于对照,但在干旱严重且土壤水分下降低于7%(胁迫水平4)的条件下,转基因鹰嘴豆株系的OA显著高于对照。在整个应激期,OA呈周期性的增减(多相模式),SM从22下降到4%。在较高的胁迫下,OA显著诱导,但不随土壤水分的下降而增加。值得注意的是,非转基因DCP 92-3(对照)在严重胁迫(土壤湿度7%)下没有表现出显著的OA,而转基因株系(17.2、17.6、17.7和17.16)通过增加溶质积累而表现出显著的OA(图1)。gydF4y2Ba4gydF4y2Ba)(补充表gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
在较长时间(胁迫4)干旱胁迫下(叶片水势−1.03 MPa),包括对照在内的所有转基因鹰嘴豆株系的膜稳定性指标均显著低于非转基因鹰嘴豆株系(−0.53 MPa)。在相同的胁迫水平(−1.03 MPa)下,17.1、17.2、17.3、17.6、17.12、17.16的子代MSI均高于对照,其中17.6的子代MSI在胁迫水平4时最高。总体而言,在胁迫水平4时,MSI在12.8 - 24%之间,而在胁迫水平1时,MSI在24.1 - 49.3%之间徘徊gydF4y2Ba2gydF4y2Ba)(补充表gydF4y2Ba9gydF4y2Ba).gydF4y2Ba
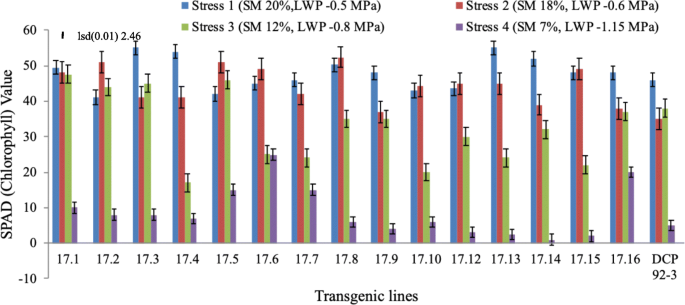
根据SPAD仪估算的叶绿素含量,包括对照在内的所有转基因株系在干旱胁迫下叶绿素含量均呈下降趋势,但下降程度在不同转基因株系之间存在差异。大多数转基因株系在胁迫水平2 (LWP,−0.6 MPa)时均未出现下降,但在胁迫水平3 (LWP,−1.15 MPa)时显著下降,在胁迫水平4 (LWP,−1.15 MPa)时显著下降。值得注意的是,两个转基因株系(17.6和17.16)即使在严重胁迫(胁迫水平4)下也表现出了更好的叶绿素保留(图。gydF4y2Ba5gydF4y2Ba)(补充表gydF4y2Ba10.gydF4y2Ba).gydF4y2Ba
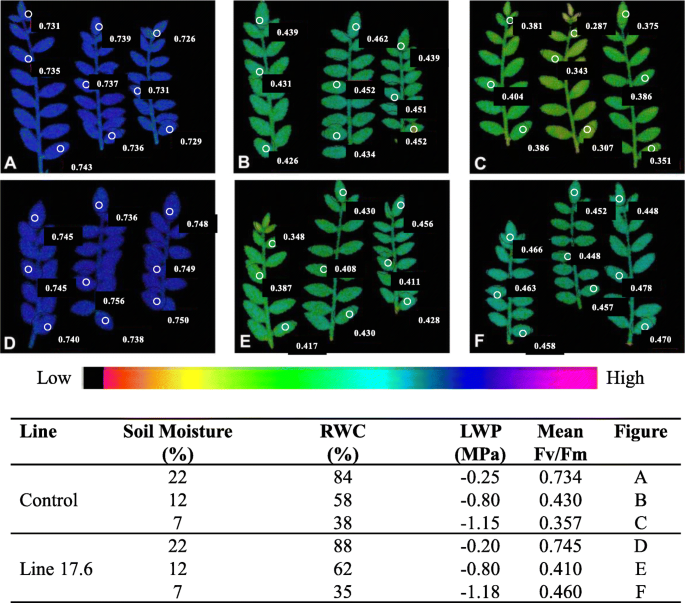
在WW和WS条件下比较对照的PSII(FV / FM)的叶片和对照的量子产率的荧光图像和一个转基因系17.6。PSII的量子产率的叶绿素荧光图像表明对照和转基因系之间的差异很少或没有差异,直到RWC下降低于60%(LWP - 0.8MPa)甚至更少。对照的PSII(FV / FM)量子产率的平均值为0.734(RWC 84%,LWP - 0.25MPa),0.44(RWC 58%,LWP - 0.80MPa)和0.35(RWC 38%,LWP - 1.15 MPa) (图。gydF4y2Ba6gydF4y2Ba一个-c), whereas, mean values of quantum yield (Fv/Fm) of transgenic line 17.6 were 0.745 (RWC 88%, LWP − 0.2 MPa), 0.41 (RWC 62%, LWP − 0.8 MPa) and 0.46 (RWC 35%, LWP − 1.18 MPa), (Fig.6gydF4y2BaD-F)分别。每片叶子进行三种选择,经过不同水平的WS。总之,在转基因管线17.6的光适应叶中的光合作用的相对增强仅在严重的水胁迫期间观察到 - 1.18MPa(RWC 35%)。量子产率(FV / FM)图像的颜色码表示量子产率的数值,其在RWC 35%的对照和转基因管中显着不同(图。gydF4y2Ba6gydF4y2BaF)。因此,可以精确评估PSII图像的量子产率(FV / FM)的光合能力以监测经受严重水胁迫的转基因鹰嘴豆线的耐受性水平。gydF4y2Ba
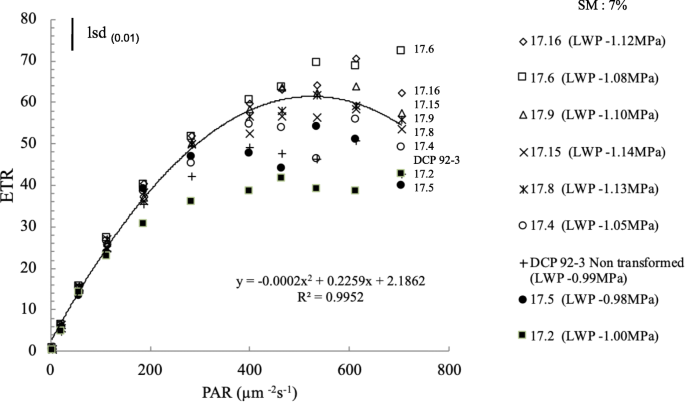
当土壤水分下降至7%(LWP - 1.0MPa)时,在应力水平4处的转基因株(ETR)的光响应显示为所有辐照度水平的增强ETR,特别是>400μmmgydF4y2Ba- 2gydF4y2Ba s- 1gydF4y2Ba(图。gydF4y2Ba7gydF4y2Ba),与对照相比。值得注意的是,转基因系(17.6,17.8,17.9,17.14,17.15和17.16)表现出比对照的更高的饱和饱和度。在光限制条件下(200μmgydF4y2Ba- 2gydF4y2Ba s- 1gydF4y2Ba),尽管干旱严重程度(-1.0MPa),转基因素和对照的ETR值没有显着差异。然而,大多数转基因系在抑制700μmm的辐照度水平下显着反应高光饱和度gydF4y2Ba- 2gydF4y2Ba s- 1gydF4y2Ba.这表明,与在高光照下表现出光抑制的对照相比,干旱和高光照联合作用改变了转基因株系的光合响应(图1)。gydF4y2Ba7gydF4y2Ba)(补充表gydF4y2Ba11.gydF4y2Ba).gydF4y2Ba
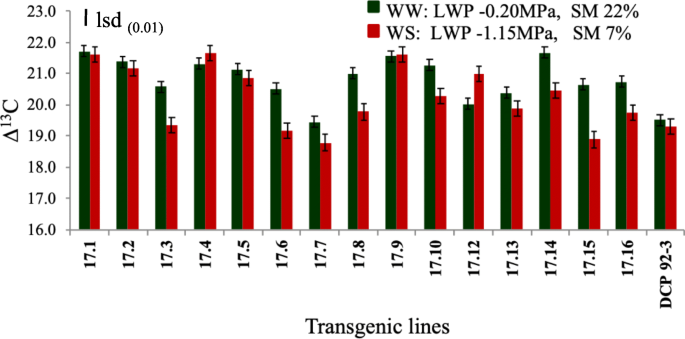
少数例外情况下,试验转基因鹰嘴豆线和控制中的CID表现出较低的水胁迫条件(胁迫水平4,LWP - 1.15MPa)而表现出降低的趋势。然而,与试论在应激水平4下转基因系的WUE增加的控制相比,在转基因系(17.3,17.6,17.7,17.8,17.17.7,17.16)中获得了CID值的显着降低(17.3,17.6,17.7,17.16,17.16)(图。gydF4y2Ba8gydF4y2Ba)(补充表gydF4y2Ba12.gydF4y2Ba).gydF4y2Ba
转基因鹰嘴豆系的产量gydF4y2Ba
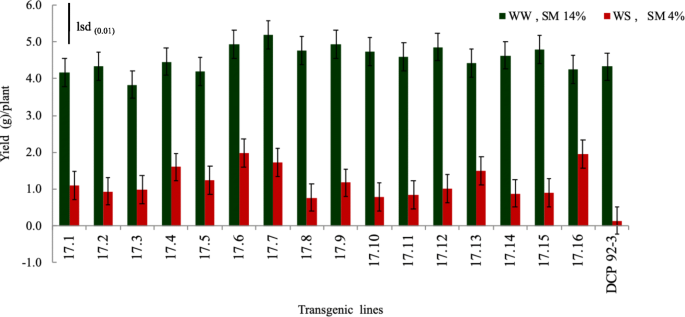
在窝水中,在转基因鹰嘴豆线中没有观察到种子产量的显着差异gydF4y2Baatdreb1a.gydF4y2Ba在WW条件下,与非转基因对照进行比较。相反,转基因株系的籽粒产量显著高于对照(gydF4y2BaPgydF4y2Ba<0.01),在水胁迫条件下(图。gydF4y2Ba9gydF4y2Ba)(补充表gydF4y2Ba13.gydF4y2Ba),表明角色gydF4y2Baatdreb1a.gydF4y2Ba在增强转基因鹰嘴豆线中的耐旱性。值得注意的是,转基因鹰嘴豆线17.6和17.16优于所有测试线。gydF4y2Ba
讨论gydF4y2Ba
植物对非生物应激的耐受性涉及影响各种生理和生化途径的多种基因的时空表达。干旱耐受被认为是多种基本的性质,并且这种特征的操纵需要在各种生理途径中相互作用。TFS是母型调节剂,其改变影响几种生化途径的多基因,通常称为gydF4y2Ba调节件gydF4y2Ba[gydF4y2Ba31.gydF4y2Ba].外源表达TF增强抗旱性,gydF4y2Baatdreb1a.gydF4y2Ba已被广泛报道作物[gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba18.gydF4y2Ba,gydF4y2Ba21.gydF4y2Ba,gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba,gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba].gydF4y2Ba
鹰嘴豆是重要的粮食豆类,一般在世界的亚热带地区种植,经常经历终端水分压力[gydF4y2Ba32.gydF4y2Ba].通过修改若干生理机制和改善鸡肉的干旱耐受性gydF4y2Baatdreb1a.gydF4y2Ba据报道,基因旨在增强许多作物中的耐旱性[gydF4y2Ba27.gydF4y2Ba,gydF4y2Ba28.gydF4y2Ba,gydF4y2Ba29.gydF4y2Ba,gydF4y2Ba33.gydF4y2Ba,gydF4y2Ba34.gydF4y2Ba].这gydF4y2BadesigydF4y2Ba鹰嘴豆品种,DCP 92-3是高输入响应,良好的农艺背景推荐灌溉条件下的栽培,对干旱敏感。品种,DCP 92-3在植物组织培养中响应良好,并且在干旱条件下表现出有限的性能,因此在本研究中使用该品种。目前研究中获得的转化效率为0.1%,但通过调节微损伤和基于基于LED的光模拟的参数,可以显着增加效率,如报道的[gydF4y2Ba35.gydF4y2Ba].转基因鹰嘴豆系gydF4y2Baatdreb1a.gydF4y2Ba由应激诱导型启动子驱动的基因gydF4y2Bard29agydF4y2Ba开发和测试各种生理参数对干旱适应至关重要。gydF4y2Ba
为了进行表型分析,盆栽容量为11.7 l,水分充分饱和,并允许充分排水,直到水池底部的水停止流动,不同深度的土壤样本的含水量测定为22%左右。在旱作试验中,通过停止灌溉,使中部地区的土壤水分下降到7%左右,这几乎是田间容量的三分之一。这足以在鹰嘴豆中创造理想的干旱水平,从而导致水分蒸发损失的最小水平。干燥实验是按照早期发展的概念设计的[gydF4y2Ba36.gydF4y2Ba,gydF4y2Ba37.gydF4y2Ba,gydF4y2Ba38.gydF4y2Ba].gydF4y2Ba
随着土壤的逐渐干燥,鹰嘴豆通常保持较高的RWC。水分胁迫下的RWC要么通过气孔关闭来调控,要么通过植物体内溶质的活性积累来调控。对照,未转化鹰嘴豆基因型,DCP 92-3屈服于胁迫;而转鹰嘴豆转基因株系则表现出增强的OA,以缓解干旱胁迫。基于RWC和OA的初步表型表明,渗透因子在叶组织中的积累是由gydF4y2BaAtDREB1AgydF4y2Ba在严重的水分胁迫(胁迫水平4)下,表达和下游激活导致了叶片水分亏缺的恢复。这反过来又通过动员组织储备到生长库来维持RWC的可持续方式。随着水分胁迫的逐渐增加,气孔开口的关闭限制了水分的流动,这是蒸腾拉力减小的结果,尽管外质体水可能是可用的[gydF4y2Ba39.gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].如果叶片组织固有地能够通过诱导表达积累渗透渗透剂,则一旦渗透浓度达到阈值水平并恢复RWC,它将具有巨大的优点。这种诱导的细胞渗透潜在建筑可能在赋予增强的耐受性并在水有限条件下产生至关重要的作用。早期在另一个脉冲作物中的研究,Pigeonpea表明OA通过防止低于32%的临界水平的RWC浸渍而保持叶子寿命[gydF4y2Ba41.gydF4y2Ba].的表达gydF4y2Baatdreb1a.gydF4y2Ba与渗透因子积累有关,在胁迫下保持叶片正膨压、维持叶绿素、增加RWC和增强MSI,如前所述[gydF4y2Ba42.gydF4y2Ba].gydF4y2Ba
相关基因表达与RWC的关系表明gydF4y2Baatdreb1a.gydF4y2Ba在发育的转基因鹰嘴豆植物中对干旱反应基因具有强烈的监管措施。转基因排17.14,17.15,17.16,17.2,17.3,17.4,17.5,17.3,17.7和17.8与应力水平4的控制相比,RWC显着更高,因为这些线路中的RWC值的差异高于16.07(LSD栏显示如图。gydF4y2Ba3.gydF4y2Ba).值得注意的是,与应力水平2和3相比,许多线在严重的应激(水平4)下的RWC增加了RWC。在应力水平4处显示出显着更高的RWC的线也增加了叶子中的OA。较高的OA倾向于在严重的压力下保持更高的RWC。转基因,gydF4y2Baatdreb1a.gydF4y2Ba可能在少数转基因中激活渗透性的基因/ s在少量转基因中发挥巨大作用,导致对照植物缺少缺乏的OA,允许RWC的迅速下降,以应对干旱的增加(4级)。有的记录,渗透调节或增加的溶质积累维持较高的RWC或延迟叶水潜力的下降随着干旱胁迫的逐步增加[gydF4y2Ba39.gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba43.gydF4y2Ba].gydF4y2Ba
值得注意的是,与转基因线(17.6)相比,除了经历相同应力水平的其他转基因水平,转基因鹰嘴豆植物中叶绿素含量在转基因鹰嘴豆线中含有转基因鹰嘴豆线(17.6)。叶绿素含量或强制成熟度的降低可能是由于氧化应激或颜料光氧化导致叶绿素的降解,这通常在施加干旱或其他非生物胁迫时迅速加速[gydF4y2Ba44.gydF4y2Ba].为了确定利用光合活性改善的耐旱性的关联,完成PSII和ETR量子产率的测量。在35%的RWC中,转基因系列(17.6)中发现PSII的量子产率,可能是因为叶绿素保留和更高的膜稳定性。同样,在番茄和小麦中还报道了转基因系的更好的光合能力[gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba45.gydF4y2Ba]建议节约下游信号传导机制。提高光合效率也同意早期的报告[gydF4y2Ba46.gydF4y2Ba,gydF4y2Ba47.gydF4y2Ba].当辐照度≥700 μmol m时,转基因株系逆境叶片的光合效率也显著提高gydF4y2Ba- 2gydF4y2Ba s- 1gydF4y2Ba)被施加为额外的压力。有趣的是,表现出高OA的转基因鹰嘴豆系可能负责通过它们的性质维持在干旱下的高光合作用,以充当渗透量,有助于在叶片脱水过程中保持膜完整性。观察到在严重干旱的转基因素中OA的能力,可能会赋予应力的耐受性,以及维持叶片膜完整性和光合作用。gydF4y2Ba
据报道,RWC是番茄,玉米,小麦等植物水状况的最佳指标,以区分耐受性和敏感的品种[gydF4y2Ba48.gydF4y2Ba].不同的是,转基因株系表现出更高的RWC从其未转化的同行。正如之前报道的,OA显著增加证明了保持高RWC的能力[gydF4y2Ba39.gydF4y2Ba].相反,品种DCP 92-3的RWC降低程度更大,原因是其不能积累渗透液或维持所需的OA水平。gydF4y2Ba
许多赋予耐旱性的生理特性在较温和的干旱条件下(如胁迫水平2和3)无法区分或表达,因此,期望的一致性在中等胁迫下可能不是很明显。以鹰嘴豆为例,渗透调节只在中等到非常严重的胁迫(如胁迫水平3和4)中表现出来,而叶绿素保留(SPAD值)和光合作用等许多相关过程在严重胁迫下被激活或维持。因此,似乎只有在干旱加剧时,才比较生理参数的差异和参数的参数。本研究发现严重干旱胁迫(4级)通过引起叶绿素的变化或光合器官的损害(减少ETR和量子产量)来影响光合作用,这与之前的报道一致[gydF4y2Ba49.gydF4y2Ba].在小麦、水稻、大麦和鹰嘴豆中也有类似的结果[gydF4y2Ba50.gydF4y2Ba,gydF4y2Ba51.gydF4y2Ba,gydF4y2Ba52.gydF4y2Ba,gydF4y2Ba53.gydF4y2Ba]在干旱压力下。在本研究中,在水胁迫转基因系中观察到较高量的OSMOLYTE或增加的OA,表明了渗透调节的有效机制,亚细胞结构稳定(更高的MSI),以及与早期达成一致的干旱的细胞适应结果 [gydF4y2Ba54.gydF4y2Ba,gydF4y2Ba55.gydF4y2Ba].相信干旱诱导代谢变化和低分了体重积累保护化合物,此外,大量的基因被激活转录导致积累新的蛋白质或氨基酸,糖醇或有机酸造成渗透调整给予宽容干旱(gydF4y2Ba56.gydF4y2Ba,gydF4y2Ba57.gydF4y2Ba].gydF4y2Ba
胁迫下细胞膜的稳定性是植物在细胞水平上维持功能的关键因素之一。在干旱条件下,膜完整性的损失是明显的。转基因鹰嘴豆株系(17.6)MSI降低最少,表明其适应干旱胁迫。干旱诱导的作为渗透保护剂的兼容溶质的积累可能与赋予膜稳定性以及关键酶和生物分子有关,这些酶和生物分子在干旱下容易发生不稳定或构象变化。干旱胁迫导致生长、叶片扩张和蒸腾作用的减少。水分胁迫诱导ABA积累,导致气孔关闭,防止水分通过蒸腾流失。同时,Rubisco活性下降也导致光合作用受限[gydF4y2Ba58.gydF4y2Ba,gydF4y2Ba59.gydF4y2Ba].气孔闭合导致细胞内有限公司的枯竭gydF4y2Ba2gydF4y2Ba水平导致产生与正常代谢过程干扰的ROS组件。gydF4y2Ba
通过CID技术测量,还修饰了转基因鹰嘴豆系的WUE(gydF4y2Ba13.gydF4y2Ba有限公司gydF4y2Ba2gydF4y2Ba/gydF4y2Ba12.gydF4y2Ba有限公司gydF4y2Ba2gydF4y2Ba).类似,改性转基因患者窝水的WUEgydF4y2BaDreb1a.gydF4y2BaTF靶向碳固定,gydF4y2BaRubisco.gydF4y2Ba其他工人报告了调节环境压力下的光合和相关代谢的酶和TFS [gydF4y2Ba60.gydF4y2Ba].转基因鹰嘴豆和花生在干旱胁迫下也有较高的TE或WUE [gydF4y2Ba21.gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba].在另一项研究中,花生转基因株系的TE或WUE与其替代性状显著相关(gydF4y2BaRD29A.gydF4y2Ba:gydF4y2Baatdreb1a.gydF4y2Ba)在压力下建立了[gydF4y2Ba61.gydF4y2Ba].gydF4y2Ba
据报道,TFS通过对气孔和非气孔组分的修改来影响光合作用和WUE。本研究局限于通过荧光成像来测量光合效率,表现出改变的碳代谢/ etr,表明转基因系通过非气孔因子的修饰增强了对干旱的光合反应。与我们的研究结果一致,转基因花生线(gydF4y2BaDreb1a.gydF4y2Ba)通过在WS条件下改变Wue来表现出对非生物胁迫的耐受性[gydF4y2Ba21.gydF4y2Ba].在转基因小麦系中也报道了类似的结果[gydF4y2Ba45.gydF4y2Ba].gydF4y2Ba
此外,转基因鹰嘴豆的种子产量与渗透调节显著相关,其中,转录因子诱导的渗透因子积累基因增强了对干旱(水分亏缺条件)的耐受性。我们的结果与之前田间试验中鹰嘴豆种子产量与渗透调节正相关的报道一致[gydF4y2Ba62.gydF4y2Ba,gydF4y2Ba63.gydF4y2Ba].如前所述,gydF4y2BadesigydF4y2Ba鹰嘴豆基因型DCP 92-3天生缺乏OA性状,根系生物量较小,经鉴定为gydF4y2Ba干旱敏感gydF4y2Ba鹰嘴豆基因型。渗透调节是限制传统育种改良抗旱性和产量的遗传不良性状。OA在维持细胞膨胀中起重要作用,使植物在逆境下维持光合作用,这从PSII和ETR的量子产率的提高可以看出。鹰嘴豆在干旱条件下,由于干旱导致蔗糖-磷酸合酶激活状态增加,其光合产物在叶片中以蔗糖而不是淀粉的形式积累[gydF4y2Ba39.gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].结果,蔗糖作为渗透剂累积,并促进碳源的转运至种子。蔗糖是糖的可运载形式及其加速合成促进颗粒填充,渗透调节较小的方式起作用:作为维持Turgor以及促进糖的运输。此外,渗透休克提高了储备碳水化合物和氮气(蛋白质)的分解,并有助于将储存的碳和氮的重新化在显影水槽中,从而有助于产生鸡豆的产量增加。目前的方法提供了通过血气产生高产增强的耐旱性鹰嘴豆品种的机会gydF4y2Baatdreb1a.gydF4y2Ba在它的亲本系中。gydF4y2Ba
鹰嘴豆作物在水分限制条件下经历了两个阶段的水分胁迫模式,即营养生长阶段的短暂轻度干旱和生殖阶段的严重终末干旱,导致籽粒产量严重损失。鹰嘴豆深层丰富的根系在很大程度上能够逃避植物经历的短暂水分胁迫,从而能够有效地从土壤中提取水分。瞬时水分胁迫对维持植物水分平衡、维持光合、蒸腾效率和提高生物量具有重要意义。在转基因事件中,改良的根长和结构与更高的用水量之间的关系已在早期的报告中明确确立[gydF4y2Ba24.gydF4y2Ba].然而,随着作物对成熟度的方法,鹰嘴豆的功能根的密度由于末端干旱土壤水分的逐渐下降而受到限制,并且由于新的根生长被限制为维持最佳植物水状况。现在gydF4y2Baatdreb1a.gydF4y2Ba转化事件本质上阐述了之前的工作,表明了适当的生理适应机制,表明转录因子如何改变使植物在系统中保持水分的渗透液积累等细胞成分,通过适当的叶片水分状况和光合作用来维持细胞的稳定,叶绿素荧光成像表明光合光反应在叶绿体水平上的修饰。目前的发现增加了关于渗透液积累有助于光合产物(渗透液包括糖、氨基酸、有机酸、氮素产品等)以可运输形式转移到生长汇中,生长汇对碳和氮的需求很大,这从转化植株的种子产量比非转化植株高就可以看出。这一结论是在高水分胁迫达到阈值后的某一阶段,渗透液急剧下降的基础上得出的。这些渗透产物可能在提高产量、维持适当水分状况和向功能根系补充碳氮等方面发挥了重要作用。转录因子可以改变根系结构、长度和蒸腾效率,在干旱不是很严重的情况下,或者在严重的最终胁迫发生之前提早成熟的短期作物中,转录因子可能是有益的。我们的调查结果与先前的报告不同[gydF4y2Ba24.gydF4y2Ba[表明靶向渗透剂的转录因子的表达增加,调节土壤 - 植物水位,并在鸡肝遇到严重的末端干旱时以交替的方式在叶绿体水平下防止光合体系的紊乱。因此,目前的研究在鹰嘴豆干旱耐受机制中增加了具有足够新颖性的鹰嘴豆干旱耐受机制的信息,而在成功建立转基因事件,在干旱下提高产量。gydF4y2Ba
结论gydF4y2Ba
改善脉冲中的耐旱性,特别是鹰嘴豆的耐受耐受性,这是跨越不同压力环境稳定谷物产量的主要目标之一。干旱耐受性鹰嘴豆的发展在气候变化视角下也非常重要。目前的研究结果证实了应力诱导的表达gydF4y2Baatdreb1a.gydF4y2Ba当施加严重干旱胁迫时,转基因鹰嘴豆线中的基因大大增强了耐旱性。许多适应性生理过程改善了赋予了增强的抗旱耐受性。在转基因素中表达的各种特征中,导致叶片渗透调节的渗透似乎是非常重要的,因为它改善了水位,稳定的膜完整性并以协调的间相互连接的方式保持光合作用,以应对干旱。所选择的转基因素是有价值的资源,可用于预育种和直接品种的发展,以改善WS条件下的鹰嘴豆干旱耐受性。gydF4y2Ba
方法gydF4y2Ba
植物材料,质粒构建和鹰嘴豆遗传转化gydF4y2Ba
育种者种子的gydF4y2BadesigydF4y2Ba鹰嘴豆品种DCP 92-3,是从伊卡尔印度脉冲研究所,坎普尔的种子单位获得。将种子用70%乙醇灭菌5分钟,然后用1%次氯酸钠(v / v)处理3分钟。将灭菌的种子用无菌条件下用无菌Milli-Q(Merck Millipore,德国)水冲洗3次,并在室温下浸泡过夜。gydF4y2Ba
农杆菌肿瘤术gydF4y2Ba应变,GV3101 [gydF4y2Ba64.gydF4y2Ba]包含包含TF的二进制载体pCAMBIA2300 (CAMBIA, Australia),gydF4y2Baatdreb1a.gydF4y2Ba由应激诱导的基因驱动gydF4y2BaRD29A.gydF4y2Ba启动子被用于遗传转型(从icar-national植物生物技术研究所获得新德里)(补充图。gydF4y2Ba1gydF4y2Ba).在含有10mg / L利福平,50mg / L kanamycin和50mg / L庆大霉素的50ml酵母提取物甘露醇(YEM)肉汤中,在28℃下在振荡器上生长过夜。收获细菌细胞,将沉淀重悬于50mL的Murashige-skoog(MS)培养基中的50ml半强度,预先诱导100μmacetosyringone(Sigma Aldrich,USA)。gydF4y2Ba
农杆菌肿瘤术gydF4y2Ba如前所述,进行了鹰嘴豆的遗传转化[gydF4y2Ba65.gydF4y2Ba].以浸泡过夜的种子为外植体,除去种皮,将胚轴在子叶间纵向剖开,制成具有半胚轴的子叶。外植体浸泡在准备好的培养基中gydF4y2Ba农杆菌属gydF4y2Ba将45分钟的悬浮液和受感染的外植体转移到共培养介质(MS Salts,BgydF4y2Ba5gydF4y2Ba维生素,1mg / L Naa,1mg / L壳体,0.8%琼脂和pH 5.8)。共培养72小时后,将外植体进行亚培养以脱枝诱导培养基1(SIM1:MS Salts,B.gydF4y2Ba5gydF4y2Ba维生素、0.5 mg/l BAP、0.5 mg/l Kinetin、0.05 mg/l NAA、10 mM MES、100 mg/l卡那霉素、250 mg/l头孢他肟、0.8%琼脂、pH 5.8)。10 - 14 d后,将带有绿色芽的外植体移去子叶,继代培养到相同的培养基上。再培养10 ~ 12 d,选择后存活的外植体移栽到低浓度的植物激素(SEM: MS盐,BgydF4y2Ba5gydF4y2Ba维生素,0.1mg / L圈,0.1mg / l kinetin,10 mm Mes,200 mg / l kanamycin,250 mg / L头孢菌,0.8%琼脂和pH 5.8)。通过将多个芽彼此分离,将体外再生的卡那霉素抗性芽脱落于相同的培养基上以4-5个选择循环为10-14d间隔。将卡那霉素选择循环的绿色健康芽被用作间隙并移植到预发芽的砧座上,最初在转基因壳体(PBSL1)中的土壤基质(土壤:蛭石:Cocopeat)中生长。移植物适应并硬化到成熟和种子(tgydF4y2Ba1gydF4y2Ba)从成熟可育植株(TgydF4y2Ba0gydF4y2Ba).在PBSL1中收获转基因鹰嘴豆系的自带种子,所有后续世代(TgydF4y2Ba1gydF4y2Ba通过T.gydF4y2Ba3.gydF4y2Ba)。gydF4y2Ba
转基因鹰嘴豆系的分子分析gydF4y2Ba
聚合酶链反应(PCR)gydF4y2Ba
对于PCR分析,基因组DNA从8-40 d植物的8至10个叶片中提取,在T处的四个独立的转基因鹰嘴豆线gydF4y2Ba0gydF4y2Ba随后的阶段,使用前面描述的方案[gydF4y2Ba66.gydF4y2Ba].DNA样本采用Biophotometer plus (Eppendorff,德国)进行定量,每个样本稀释至100 ng/μl。对所有鹰嘴豆子代进行了新霉素磷酸转移酶II (gydF4y2BanptII)gydF4y2Ba(NPTF:5'GattCCGAAGCCCCAACCTTTCATAG3'AND NPTR:5'TGCCGAATATCATGGTGGAAAATGG3')和gydF4y2Baatdreb1a.gydF4y2Ba(AtDREB1AF: 5'atgaactcattttctgctttttctg3 ' and AtDREB1AR: 5ttaataactccataacgatacgtcg3 ')特异性引物。采用1X Taq Buffer、250 μM dNTPs、每个引物10 pM、200 ng DNA模板和1个单位的DNA进行PCR, PCR时间为20 μlgydF4y2BaTaqgydF4y2BaDNA聚合酶(印度默克)。使用的热循环程序如下:初始变性在94℃下5分钟,然后进行35次94℃(变性)1分钟,60℃(退火)1分钟,72℃(延伸)为1 min, final extension at 72 °C for 10 min and held at 4 °C in thermal cycler (G-Storm GS4 Tetrad Thermal Cycler, UK). PCR products were resolved on 1.0% agarose gel, stained with Ethidium bromide in 1X TAE buffer. Gel images were documented using gel documentation system (BioRad Gel Doc XR, USA). Chi-square test was also conducted to understand the segregation pattern of transgene in all four events at T1gydF4y2Ba分期,基于PCR分析。gydF4y2Ba
南方杂交gydF4y2Ba
对于Southern blotting,从所有PCR阳性鹰嘴豆植株(TgydF4y2Ba1gydF4y2Ba使用十六烷基三甲基铵(CTAB)方法,从四个独立的转基因鹰嘴豆事件中衍生自四种独立的转基因鸡肝事件(对照)[gydF4y2Ba67.gydF4y2Ba].用酶切法对转基因株系(15.0 ~ 20.0 μg)的基因组DNA进行酶切gydF4y2BaBAMgydF4y2BaHI限制性内切酶(5 U/μg)切割T-DNA一次。同时处理未转化DCP 92-3 (15.0 ~ 20.0 μg)的质粒DNA (10.0 ng)和基因组DNA。每一株酶切片段用1%琼脂糖凝胶电泳,并在Hybond N+膜(Roche, USA)上印迹。地氧素(DIG)标记的探针特异性于gydF4y2BaRD29A.gydF4y2Ba使用挖掘标记试剂盒合成,具有化学发光基材,二氯-5-(4-甲氧基哌甲烷-3,2' - (5'-氯)三轮车[3.3.1.1] Decan} -4- yl)-1-磷酸盐(CDP-SAR)(Roche Diagnostics GmbH,Mannheim,德国)。遵循制造商的指令(Roche Diagnostics GmbH,Mannheim,Germany)进行标记,杂交和检测。在暴露时间10分钟后在X射线膜上检测信号。使用Pharos FX Plus分子成像仪(Biorad,USA)扫描X射线膜。gydF4y2Ba
逆转录酶PCR(RT-PCR)gydF4y2Ba
从所有转基因鹰嘴豆株系(TgydF4y2Ba1gydF4y2Ba和TgydF4y2Ba2gydF4y2Ba)(播种后60天)以及对照(gydF4y2Ba简历gydF4y2Ba.使用Spectrum™Plant Total RNA Kit (Sigma-Aldrich, USA),胁迫前和胁迫后(保留水10 d,平均SM 11.8%,平均LWP−0.82 MPa)。按照制造商的说明(Sigma-Aldrich,美国),使用柱上DNaseI酶切集从总RNA制备中去除基因组DNA片段。使用Nanodrop生物光度计加(Eppendorff,德国)对RNA进行定量,每个样本中等量的RNA用于两步RT-PCR反应。使用约1 μg总RNA (Verso cDNA synthesis Kit, Thermo Fischer, USA)进行第一链cDNA合成,所得产物用于第二链扩增。用管家基因(actin)特异性引物(ACTI1F: 5'acctcagcagagcgtgaaat3 '和ACTI1R: 5'ttgcaacaggacctctggac3 ')进行PCRgydF4y2Baatdreb1a.gydF4y2Ba基因特异性引物(DREB1AF:5'GTAAGTGGGTTTTGTGGTTAGAGA3'AND DREB1AR:5'TTCATGATTATGATTCCACTGTACG3')基于先前描述的PCR扩增方案。如前所述,记录RT-PCR产物在1.2%琼脂糖凝胶中,图像被记录。gydF4y2Ba
转基因鹰嘴豆线的表型gydF4y2Ba
用于初始表型,TgydF4y2Ba2gydF4y2Ba与对照相比,根据WW和WS条件的RWC和OA来评估来自四种独立的转基因鹰嘴豆线(E5,E17,E22)的后代,与对照相比。总共130个种子(30种衍生自四种转基因事件的种子)]和10种未转化的鹰嘴豆(对照)系的10种种子,每次治疗5次复制。转基因植物和对照植物分为两组。在WW条件下维持一组(65 No:60(15×4)转基因系和5种控制线),并通过扣用水对另一组(65个NoS)进行WS。gydF4y2Ba
将种子播种在装满预称重土壤和堆肥混合物(10 kg)的陶罐(容量为11.7 l)中,并给予一定量的水用于发芽。这些罐保存在自然光照的密封设施中,最高/最低温度为32°C/20°C。当土壤水分比初始水平降低50%时进行灌溉。浇水是为了保持田间的水分水平,直到所有株系达到所需的高度,树冠充分发育。从田间容量(22%)的土壤水完全饱和阶段,退出灌溉45 d后达到胁迫水平1。从胁迫水平1开始,4、12、26 d后分别达到胁迫水平2、3、4。通过定期测量15厘米深度的土壤水分,采用重量法监测水分胁迫水平[gydF4y2Ba68.gydF4y2Ba].使用中空不锈钢软木塞(2cm直径和20厘米长)从2至3个地方收集土壤样品,通过深度向下深入20cm深,缓慢抬起,以保持10厘米以下土壤表面。将汇集的土壤样品称重并在110-120℃下干燥3天。重新称重干燥土壤,使用配方计算土壤水分百分比:[土壤 - 干重的鲜重)/土壤干重] X100)。将个体植物生长到成熟度,在遏制设施中,在不同的应力水平下收集生理参数样品,并在收获阶段收益数据。压力水平已被归类如下:应激等级1(剩余土壤水分20%);压力水平2(18%残余土壤水分);压力水平3(剩余土壤水分12%);压力水平4(7%的残余土壤水分)。gydF4y2Ba
利用转基因株系(T .)叶片鲜重(FW)、膨胀重(TW)和干重(DW)测定RWCgydF4y2Ba2gydF4y2Ba在WS条件下和相应的WW条件下,4种胁迫水平下的对照植株均处于不同的胁迫水平。为了确定FW,研究人员从植物顶部收集了第四片完全展开的叶子,并将其放入一个预先称重、密封的玻璃小瓶中称重。将收集到的叶片从小瓶中取出,将切下的叶柄在去离子水中弱光浸泡12 h即可得到TW。将叶片吸干,80°C烘干3 d,测定DW。最后,用公式计算RWC: RWC = (FW-DW)/(TW-DW) [gydF4y2Ba69.gydF4y2Ba].gydF4y2Ba
通过在液氮中脱落几天,从测试植物的顶部测量OP在第五片上测量。将解冻的样品置于2mL皮下注射注射器中,过滤器,过滤的电池SAP用于使用Wescor 5520蒸气压慢速计(Wescor Inc.,Logan,USU)的OP测量。op在完整的turgor(opgydF4y2Ba100.gydF4y2Ba)使用以下公式计算:OPgydF4y2Ba100.gydF4y2Ba=(OP X RWC)/ 100 [gydF4y2Ba70gydF4y2Ba].测定了脱水叶片30 d至生理成熟150 d的渗透势,并估算了叶片OP与胁迫天数(水分胁迫递增)的关系。根据OP的差值计算渗透性调节(OA)gydF4y2Ba100.gydF4y2Ba在任何给定日期取样的叶片和非胁迫灌溉条件下OP最小的叶片之间,如前所述[gydF4y2Ba2gydF4y2Ba].估计从场容量到干燥试验的转基因鹰嘴豆叶片中OA水平(通过应力水平4)。此外,用T进行详细的表型研究gydF4y2Ba3.gydF4y2Ba从16tgydF4y2Ba2gydF4y2Ba一条转基因鹰嘴豆事件的线条(编号为17.1至17.16)(例如gydF4y2Ba17.gydF4y2Ba[总:160种种子(10个种子中的10个种子)]和10种未转化的鹰嘴豆(对照)线的10种种子。gydF4y2Ba
RWC,OP,LWP和MSI测量gydF4y2Ba
RWC和OP测量如前面章节所述。在4种胁迫水平下,取鹰嘴豆植株顶部的第5片完全展开的叶片进行LWP测定。叶片在实验现场(PMS仪器公司,美国)按基本描述的方法在压力室中切割加工[gydF4y2Ba71.gydF4y2Ba],就MPa而言。gydF4y2Ba
采用电解质漏液法(EL)测定膜稳定指数(MSI)。收集受试植物顶部的第4片叶子,用蒸馏水冲洗,表面干燥,在40°C的去离子水中浸泡1 h。用电导率仪(型号:HI2300,汉纳,美国)测定组织渗滤液的电导率。将同一叶片在100℃去离子水中浸泡1 h,测定EC。膜稳定指数(MSI)由公式计算:MSI =C1/C2,其中C1= EC (EC μS)在40°C下持续1 h, C2 = EC (EC μS)在100°C下持续1 h [gydF4y2Ba72.gydF4y2Ba].gydF4y2Ba
叶绿素估计数gydF4y2Ba
利用SPAD (Soil Plant Analysis Development;土壤植物分析开发;美能达502型,频谱技术,普莱菲尔德,伊利诺伊州。美国)。两组(WW和WS)在4种胁迫水平下均从植株顶部完全展开4叶。SPAD仪测量叶片在600 ~ 700 nm和400 ~ 500 nm两个波长的透过率,将光度计压在叶片表面记录SPAD值。较高的绿色指数/值与被监测叶片中叶绿素的增加有关。gydF4y2Ba
荧光图像分析gydF4y2Ba
转基因系17.6的叶样品,并从全凝血(LWP - 0.25MPa和RWC 84-88%),中等应力(LWP - 0.80MPa和RWC 58-60%)和严重用于叶绿素荧光研究的应力(LWP - 1.15MPa和RWC 35-38%)[gydF4y2Ba73.gydF4y2Ba].随着干旱逐步施加,使用荧光成像系统(Mass&Regeltechnik,Waltz,德国)快速评估转基因系和对照之间的光合反应。将暗叶暴露于弱调制光,其频率为2 Hz / par(光合作用辐射)0.05μm,具有100μsec脉冲,然后叠加为700μmol的蓝色光子通量的饱和脉冲为100 m / sec获得gydF4y2Ba量子产量gydF4y2Ba(FV / FM;可变/最大荧光)和相应的荧光图像被捕获。随后,叶暴露于200μmol光子M的光化光线gydF4y2Ba- 2gydF4y2Ba s- 1gydF4y2Ba为光适应2分钟。叠加相同的饱和脉冲,得到光调叶片中的量子产率。将获得具有相应量子屈服值的叶片的所选区域与暗和不同的应力水平进行比较,以评估光合性能。gydF4y2Ba
利用内置的自动软件(ImagingWin, Walz-Imaging system, GmbH, Germany)研究了在200-700 μmol m辐照范围内,代表所有转基因株系和对照叶片光合活性的ETR在WW和WS下的光响应gydF4y2Ba- 2gydF4y2Ba s- 1gydF4y2Ba.光曲线和初始荧光值(FgydF4y2BaogydF4y2Ba和FgydF4y2Ba米gydF4y2Ba计算ETR (ETR =量子子产率x PAR × 0.5 x吸收率)。吸收率描述了被吸收的入射光的比例,0.5表示只有一半被吸收的量子分布到PS II(在稳态条件下)。随着辐照度的增加,得到个体选择的光曲线,直到ETR达到光饱和。少数样品的生理状态不适合纳入ETR研究,因此实验仅限于少数选定的鹰嘴豆品系。gydF4y2Ba
碳同位素辨别(CID)测量gydF4y2Ba
为了进行CID测定,在胁迫水平1和4时分别采集了转基因鹰嘴豆株系和对照的叶片样本。收获的叶子在热风烘箱中干燥至80°C 3天,然后在磨粉机中细粉。在印度班加罗尔农业科学大学,用同位素比值质谱仪(IRMS, Model Thermo Finnigan,不来梅,德国)测定1.0 mg样品的碳同位素组成。IRMS与一个燃烧装置(Flash EA 1112)相过渡,并在连续流动模式下工作。样品应用于闪速燃烧元素分析仪(EA-1112, Carlo Erba, Milan, Italy)。适量的COgydF4y2Ba2gydF4y2Ba通过元素分析仪分离和纯化的气体引入同位素比值质谱仪(Delta XP Plus, Thermo Finnigan, Hamburg, Germany),以估计同位素组成的比例表示为δ13C (gydF4y2Ba13.gydF4y2Ba有限公司gydF4y2Ba2gydF4y2Ba/gydF4y2Ba12.gydF4y2Ba有限公司gydF4y2Ba2gydF4y2Ba)标准误差为0.1%。标准马铃薯淀粉校准针对小便Dee Banemnite碳酸盐进行比较。如前所述计算样品的CID [gydF4y2Ba74.gydF4y2Ba].gydF4y2Ba
转基因鹰嘴豆线和对照的产量gydF4y2Ba
转基因植物和对照的产量(g)(gydF4y2Ba简历gydF4y2Ba.在转基因的完全生理成熟时(播种后150天)比较了浇水水上浇水(15-20cm深度的湿度下的14%的水分)和水分(在15-20cm深度下的水分4%)遏制设施。gydF4y2Ba
统计分析gydF4y2Ba
实验设置为完全随机设计(CRD),每次治疗和数据使用标准统计软件分析数据(SPSS的社会科学统计包,gydF4y2Ba版本gydF4y2Ba.12.0)。基于对差异的分析(一种方式/两种方式ANOVA)来衍生统计解释,并且使用T-TEST以1%或5%测试具有显着水平的最小差异(LSD)。gydF4y2Ba
可用性数据和材料gydF4y2Ba
本研究期间生成或分析的所有数据都包含在本公布的文章中。该研究报告的转基因鹰嘴豆材料可用于SEED储存库,ICAR-印度脉冲研究所,印度坎普尔(印度)(gydF4y2Bahttps://iipr.icar.gov.in/gydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- atdreb1a.gydF4y2Ba:gydF4y2Ba
-
拟南芥蒂利亚纳gydF4y2Ba脱水响应元件结合蛋白1agydF4y2Ba
- PBSL1:gydF4y2Ba
-
植物生物安全级别1gydF4y2Ba
- rwc:gydF4y2Ba
-
相对含水量gydF4y2Ba
- ETR:gydF4y2Ba
-
电子传递速率gydF4y2Ba
- OA:gydF4y2Ba
-
渗透调节gydF4y2Ba
- op:gydF4y2Ba
-
渗透潜力gydF4y2Ba
- 女士:gydF4y2Ba
-
膜稳定性gydF4y2Ba
- QTL:gydF4y2Ba
-
定量特质基因座gydF4y2Ba
- CID:gydF4y2Ba
-
碳同位素歧视gydF4y2Ba
- TF:gydF4y2Ba
-
转录因子gydF4y2Ba
- te:gydF4y2Ba
-
蒸腾效率gydF4y2Ba
- ROS:gydF4y2Ba
-
反应性氧气gydF4y2Ba
- WW:gydF4y2Ba
-
好浇水gydF4y2Ba
- WS:gydF4y2Ba
-
水的压力gydF4y2Ba
- SM:gydF4y2Ba
-
土壤湿度gydF4y2Ba
- YEM:gydF4y2Ba
-
酵母提取物甘露醇gydF4y2Ba
- 女士:gydF4y2Ba
-
Murashige-SkooggydF4y2Ba
- nptIIgydF4y2Ba:gydF4y2Ba
-
新霉素磷酸转移酶IIgydF4y2Ba
- 聚合酶链反应:gydF4y2Ba
-
聚合酶链反应gydF4y2Ba
- RT:gydF4y2Ba
-
逆转录酶gydF4y2Ba
- FW:gydF4y2Ba
-
鲜重gydF4y2Ba
- tw:gydF4y2Ba
-
浮夸的重量gydF4y2Ba
- DW:gydF4y2Ba
-
干重gydF4y2Ba
- LWP:gydF4y2Ba
-
叶水潜力gydF4y2Ba
- WUE:gydF4y2Ba
-
水分利用效率gydF4y2Ba
- 帕特:gydF4y2Ba
-
照片综合有效辐射gydF4y2Ba
- CID:gydF4y2Ba
-
碳同位素歧视gydF4y2Ba
参考gydF4y2Ba
- 1。gydF4y2Ba
Jukanti AK, Gaur总理,Gowda CLL, Chibbar RN。鹰嘴豆的营养价值和健康益处(gydF4y2BaCicer Arietinum.gydF4y2BaL.):审查。英国j nutr。2012; 108:S11-26。gydF4y2Ba
- 2。gydF4y2Ba
特纳数控。渗透调节和渗透调节。正确的做法:Goodman RM,编辑。植物和作物科学百科全书。纽约:Marcel Dekker;2004.850 - 3页。gydF4y2Ba
- 3.gydF4y2Ba
Ahmad F,Gaur Pm,Croser JS。鹰嘴豆(gydF4y2BaCicer Arietinum.gydF4y2BaL.)。在:Singh RJ,Jauhar PP,编辑。遗传资源,染色体工程和作物改善粒豆类。伦敦:泰勒&弗朗西斯集团;2005. p。229-67。gydF4y2Ba
- 4.gydF4y2Ba
Varshney RK, Thudi M, Nayak SN, Gaur PM, Kashiwagi J, Krishnamurthy L, Jaganathan D, Koppolu J, Bohra A, Tripathi S, Rathore A, Jukanti AK, Jayalakshmi V, Vemula AK, Singh SJ, Yasin M, Sheshshayee MS, Viswanatha KP。鹰嘴豆抗旱性的遗传解剖(gydF4y2BaCicer Arietinum.gydF4y2BaL.)。Al Appl Genet。2014; 127:445-62。gydF4y2Ba
- 5。gydF4y2Ba
羽衣甘蓝SM,Jaganthan D,Ruperao P,Chen C,Punna R,Kudapa H,Thudi M,Roorkiwal M,Katta Ma,Doddamani D,Garg V,Kishor PBK,Gaur Pm,Nguyen H,Batley J,Edwards D,Sutton T,Sutton T,沃尔斯特河。在鸡眼的“QTL-HOTSPOT”区域中候选基因的优先级排序(gydF4y2BaCicer Arietinum.gydF4y2BaL.)。SCI REP。2015; 5:15296。gydF4y2Ba
- 6。gydF4y2Ba
Varshney RK, Thudi M, Roorkiwal M, He W, Upadhyaya HD等。对来自45个国家的429份鹰嘴豆进行重测序,为研究鹰嘴豆基因组多样性、驯化和农艺性状提供了新视角。自然麝猫。2019;51:857 - 64。gydF4y2Ba
- 7。gydF4y2Ba
Varshney RK, Song C, Saxena RK, Azam S, Yu S,等。鹰嘴豆基因组草图(gydF4y2BaCicer Arietinum.gydF4y2Ba)为特质改进提供资源。NAT BIOTECHNOL。2013; 31:240-6。gydF4y2Ba
- 8。gydF4y2Ba
三种重要的食用豆科植物的生物技术应用进展。植物生物技术代表2014;8(2):83-99。gydF4y2Ba
- 9。gydF4y2Ba
Das A,Datta S,Thakur S,Shukla A,Ansari J,Sujayanand GK,Kumar Pa,Chaturvedi Sk,Singh NP。编码杀虫晶蛋白的嵌合基因的表达gydF4y2Bacry1aabc.gydF4y2Ba的gydF4y2Ba苏云金杆菌gydF4y2Ba在鹰嘴豆(gydF4y2BaCicer Arietinum.gydF4y2BaL.)对绿荚虫(gydF4y2BaHelicoverpa ArmigeragydF4y2Ba船只。)。正面。植物SCI。2017; 8:1423。gydF4y2Ba
- 10。gydF4y2Ba
Umezawa T,Fujita M,Fujita Y,Yamaguchi-Shinozaki K,Shinozaki K.工厂的工程耐旱性:发现和剪裁基因以解锁未来。CurrOgin Biotechnol。2006; 17(2):113-22。gydF4y2Ba
- 11.gydF4y2Ba
agarwal p,agarwal pk,joshi aj,sopory sk,reddy mk。PGDREB2A转录因子的过表达增强了非生物应激耐受性并激活下游应力响应基因。Mol Biol rep.2010; 37:1125-35。gydF4y2Ba
- 12.gydF4y2Ba
关键词:脱水响应元件结合因子2gydF4y2Ba(DREB2)来自gydF4y2Ba印度小麦(gydF4y2Ba小麦gydF4y2BaL.)品种。Aust J Croc SCI。2014; 8(1):44-54。gydF4y2Ba
- 13。gydF4y2Ba
LATA C,Prasad M. Drebs在植物中非生物应激反应调节中的作用。J Exp Bot。2011; 62(14):4731-48。gydF4y2Ba
- 14。gydF4y2Ba
关键词:水稻,抗旱性,基因调控,抗旱性abstractgydF4y2Ba9-CIS-环氧丙酮蛋白二氧化酶gydF4y2Ba是植物脱落酸生物合成的关键酶gydF4y2Ba拟南芥gydF4y2Ba.植物j . 2001; 27:325-33。gydF4y2Ba
- 15.gydF4y2Ba
Chinnusamy v,Jagendrof A,Zhu JK。理解和提高植物耐盐性。农作物科学。2005; 45:437-48。gydF4y2Ba
- 16。gydF4y2Ba
Jaglo-ottosen KR,Gilmour SJ,Zarka DG,Schabenberger O,Thomashow MF。gydF4y2Ba拟南芥gydF4y2BaCBF1过表达诱导COR基因并增强冷冻耐受性。科学gydF4y2Ba.gydF4y2Ba1998年; 280:104-6。gydF4y2Ba
- 17。gydF4y2Ba
异位表达拟南芥CBF1的番茄植株对水分亏缺的抗性增强。植物杂志。2002;130:618-26。gydF4y2Ba
- 18。gydF4y2Ba
Kasuga M, Miura S, Shinozaki K, Yamaguchi-Shinozaki K. A combination of thegydF4y2Ba拟南芥gydF4y2BaDREB1A基因和应力诱导gydF4y2BaRD29A.gydF4y2Ba通过基因转移,启动子改善了烟草中的干旱和低温胁迫耐受性。植物细胞生理。2004; 45:346-50。gydF4y2Ba
- 19。gydF4y2Ba
丛林,郑兴中,张应祥,柴泰。gydF4y2Ba拟南芥DREB1AgydF4y2Ba赋予高盐度耐受性并调节Ga DiOxygenase在烟草中的表达。植物SCI。2008; 174:156-64。gydF4y2Ba
- 20.gydF4y2Ba
Hong B, Tong Z, Ma N, Li J, Kasuga M ., Yamaguchi-Shinozaki K ., Gao J.gydF4y2BaAtDREB1AgydF4y2Ba菊花基因增加了干旱和盐胁迫耐受性。科学中国塞尔C浆液科。2006; 49:436-45。gydF4y2Ba
- 21.gydF4y2Ba
Bhatnagar-Mathur P,Devi MJ,Reddy DS,Lavanya M,Vadez V,Serraj R,Yamaguchi-Shinozaki K,Sharma KK。应激诱导的表达gydF4y2Ba在DREB1AgydF4y2Ba在转基因花生(gydF4y2Ba落花生hypogaeagydF4y2Bal)在限水条件下增加蒸腾效率。植物细胞大会2007;26:2071-82。gydF4y2Ba
- 22.gydF4y2Ba
Polizel AM, Medri ME, Nakashima K, Yamanaka N, Farias JRB, De Oliveira MCN等。转基因大豆rd29A的分子解剖学和生理特性:gydF4y2BaAtDREB1AgydF4y2Ba为了改善耐旱性。genet mol res。2011; 10:3641-56。gydF4y2Ba
- 23.gydF4y2Ba
suo h,ma q,ye k,杨c,唐y,hao j,张zj,陈m,冯y,nian h.过度表达gydF4y2BaAtDREB1AgydF4y2Ba通过降低大豆内源赤霉素水平导致严重矮化表型[gydF4y2Ba大豆gydF4y2Ba(l)稳定)。《公共科学图书馆•综合》。2012;7:e45568。gydF4y2Ba
- 24.gydF4y2Ba
Anbazhagan K,Bhatnagar-Mathur P,Vadez V,Dumbala SR,Kishor PBK,Sharma KK。转基因鹰嘴豆中的Dreb1a在转基因鹰嘴豆中改变了影响植物水预算的关键特征。植物细胞批准。2015; 34:199-210。gydF4y2Ba
- 25。gydF4y2Ba
Datta K,Baisakh N,Ganguly M,Krishnan S,Yamaguchi-Shinozaki K,Datta SK。拟南芥和水稻胁迫基因的过度表达诱导转录因子赋予水稻的干旱和盐度耐受性。植物Biotechnol J. 2012; 10:579-86。gydF4y2Ba
- 26。gydF4y2Ba
Celebi-Toprak F,Behnam B,Serrano G,Kasuga M,Yamaguchi-Shinozaki K,Naka H,Watanabe Ja,Yamanaka S,Watanabe Kn。转基因四族四倍体马铃薯的盐胁迫的耐受性,gydF4y2BaSolanum tuberosum cv。gydF4y2BaDesiree似乎被Dreb1a基因和RD29A启动子诱导gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.品种sci。2005; 55:311-9。gydF4y2Ba
- 27。gydF4y2Ba
Behnam B,Kikuchi A,Celebi-Toprak F,Yamanaka S,Kasuga M,Yamaguchi-Shinozaki K,Watanabe Kn。由应力诱导的拟南芥Dreb1a基因驱动gydF4y2BaRD29A.gydF4y2Ba四体四倍体马铃薯启动子按其拷贝数的比例增加耐盐性(gydF4y2BaSolanum Tuberosum.gydF4y2Ba).植物生物技术。2006; 23:169-77。gydF4y2Ba
- 28。gydF4y2Ba
Bhatnagar-Mathur P,Rao Js,Vadez V,Dumbala SR,Rathore A,Yamaguchi-Shinozaki K,Sharma KK。在表达DREB1A转录因子的转基因花生在干旱胁迫下具有较高的产率。mol品种。2014; 33(2):327-40。gydF4y2Ba
- 29。gydF4y2Ba
Sarkar T, Thankappan R, Kumar A, Mishra GP, Dobari JR.gydF4y2BaAtDREB1AgydF4y2Ba转基因花生的基因赋予干旱和盐度应力的耐受性。Plos一个。2014; 9(12):E110507。gydF4y2Ba
- 30.gydF4y2Ba
关键词:转基因,棉花,dre-基因,转基因gydF4y2Ba捆绑gydF4y2Ba转录因子基因(gydF4y2Ba含有DREB 1gydF4y2Ba)赋予加强耐旱的耐受性。int j adv biotech res。2014; 5(4):635-48。gydF4y2Ba
- 31。gydF4y2Ba
Nakashima K,Ikto Y,Yamaguchi-Shinozaki K.转录监管网络以应对非生物胁迫gydF4y2Ba拟南芥gydF4y2Ba和草。植物理性。2009; 149:88-95。gydF4y2Ba
- 32。gydF4y2Ba
Sumpy,Sharma KD,Boora Ks,Kumar N.植物水状态,冠覆温度和叶绿素荧光与鹰嘴豆的产量改善(gydF4y2BaCicer Arietinum.gydF4y2Bal)在土壤水分胁迫环境下。J Agrometerol。2015;17(1):11:6。gydF4y2Ba
- 33。gydF4y2Ba
Xiao H,Siddiqua M,Braybrook S,Nassuth A.三葡萄CBF / DREB1基因对低温,干旱和脱钙酸作用。植物细胞环境。2006; 29:1410-21。gydF4y2Ba
- 34。gydF4y2Ba
Morran S,Eini O,Pyvovarenko T,父母B,Singh R,Ismagul A,Eliby S,Shirley N,Langridge P,Lopato S。通过调节DREB / CBF因子的表达改善小麦和大麦的应力耐受性。植物Biotechnol J1111; 9(2):230-49。gydF4y2Ba
- 35。gydF4y2Ba
Das Bhowmik SS, Cheng AY, Long H, Tan gzhh, Hoang TML, Karbaschi MR, Williams B, Higgins TJV, Mundree SG。获得非嵌合转基因鹰嘴豆的稳健遗传转化系统。中国植物科学,2019;gydF4y2Ba
- 36。gydF4y2Ba
通过保持土壤水分的次优水平来对盆栽植物施加“干旱”,可以改善植物水分关系。实验机器人。2017;68(9):2413-24。gydF4y2Ba
- 37。gydF4y2Ba
Sinclair Tr,Manandhar A,Shekoofa A,Rosas-Anderson P,Bagherzadi L,Schoppach R,Sadok W,Rufty Tw。锅结合作为可变混杂植物表型:理论衍生和实验观察。Planta。2017; 245:729-35。gydF4y2Ba
- 38。gydF4y2Ba
特纳数控。在盆栽干旱研究中施加和维持土壤水分不足。土壤植物。2019;439:45-55。gydF4y2Ba
- 39。gydF4y2Ba
Basu PS, Berger JD, Turner NC, Chaturvedi SK, Ali M, Siddique KHM。鹰嘴豆的渗透调节(gydF4y2BaCicer Arietinum.gydF4y2Ba与干旱条件下碳水化合物组成或叶片气体交换的变化无关。安·阿普尔。2007;150:217-25。gydF4y2Ba
- 40。gydF4y2Ba
干旱条件下,鹰嘴豆的渗透调节增加了水分吸收,同化物的再动员,维持了光合作用。中国生物医学工程杂志。2007;45:61 - 7。gydF4y2Ba
- 41。gydF4y2Ba
花dj,ludlow mm。渗透调节对水胁迫性鸽皮脱水耐受性的贡献(gydF4y2BaCajanus毛竹gydF4y2Ba(l)gydF4y2Ba毫克gydF4y2Ba叶子。植物细胞环境。1986;9(1):33-40。gydF4y2Ba
- 42。gydF4y2Ba
Ravikumar G,Manimaran P,Voleti SR,Subrahmanyam D,Sundaram RM,Bansal KC,Viraktamath BC,Balachandran SM。应激诱导的表达gydF4y2BaAtDREB1AgydF4y2Ba转录因子大大提高了转基因的干旱胁迫耐受性gydF4y2BaindicgydF4y2Ba大米。转基因研究》2014;23(3):421 - 39。gydF4y2Ba
- 43。gydF4y2Ba
Lecoeur J,Wery J,Ture O. Osmotic调整作为鹰嘴豆植物中脱水后期的机制(gydF4y2BaCicer Arietinum.gydF4y2BaL.)叶。植物土壤。1992年; 144:177-82。gydF4y2Ba
- 44.gydF4y2Ba
Farooq M, Wahid A, Kobayashi N, Fujita D, Basra SMA。植物干旱胁迫:效应、机制与管理。农业支持开发。2009;29:185-212。gydF4y2Ba
- 45.gydF4y2Ba
Pellegrineschi A, Reynolds M, Pacheco M, Brito RM, Almeraya R, Yamaguchi-Shinozaki K, Hoisington D. Stress-induced expression in wheatgydF4y2Ba拟南芥蒂利亚纳gydF4y2BaDREB1A基因延缓温室条件下的水分胁迫症状。基因组。2004;47:493 - 500。gydF4y2Ba
- 46.gydF4y2Ba
哦,kwon cw,choi dw,song si,金jk。大麦的表达gydF4y2BaHVCBF4.gydF4y2Ba增强转基因水稻中非生物胁迫的耐受性。植物生物科技J. 2007; 15:646-56。gydF4y2Ba
- 47.gydF4y2Ba
acta botanica botanica(云南植物研究中心),云南植物研究中心,云南植物研究中心,云南植物研究中心gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.Mol Gen Genet, 1997; 254:104-9。gydF4y2Ba
- 48.gydF4y2Ba
Sanchez-Rodriguez E,Rubio-Wilhelmi M,Cervilla LM,Blasco B,RIOS JJ,Rosales Ma,Romero L,Ruiz JM。番茄植物中温干旱下氧化应激的一些生理参数的基因型差异。植物SCI。2010; 178:30-40。gydF4y2Ba
- 49。gydF4y2Ba
Itburbe Ormaetxe I,Escuredo Pr,Arres-Igor C,BECANA M.豌豆植物暴露于水赤字或百草枯的氧化损伤。植物理性。1998年; 116:173-81。gydF4y2Ba
- 50.gydF4y2Ba
Anjum F,Yaseen M,Rasul E,Wahid A,Anjum S.在大麦中的水分压力(gydF4y2BaHordeum Vulgare L.gydF4y2Ba)。2对化学成分和叶绿素含量的影响。巴基斯坦农业科学,2003;40:45-9。gydF4y2Ba
- 51.gydF4y2Ba
Farooq M,Basra Sma,Wahid A,Cheema Za,Cheema Ma,Khalid A.外源应用甘氨酸甜菜碱在改善细粒芳烃水稻干旱耐受的生理作用(gydF4y2Ba栽培稻gydF4y2BaL.)。J Agron作物SCI。2009; 194:325-33。gydF4y2Ba
- 52.gydF4y2Ba
Massacci A,Nabiev Sm,Pietrosanti L,Nematov Sk,Chernikova TN,Thor K,Leipner J.棉花光合仪的响应(gydF4y2Bagossypium hirsutumgydF4y2Ba)通过气体交换分析和叶绿素荧光成像研究的现场条件下发生干旱胁迫的发作。植物理性生物化学。2008; 46:189-95。gydF4y2Ba
- 53.gydF4y2Ba
Nyachiro JM, Briggs KG, Hoddinott J, Johnson-Flanagan AM。春小麦叶绿素含量、叶绿素荧光和水分亏缺。谷类资源通讯2001;29:135-42。gydF4y2Ba
- 54。gydF4y2Ba
Gunes A, Inal A, Adak MS, Bagci EG, Cicek N, Eraslan F.干旱胁迫对鹰嘴豆开花前或开花后生理特性的影响。植物生理学杂志,2008;gydF4y2Ba
- 55。gydF4y2Ba
Valenvic P,Luxova M,Kolarovic L,Gasparikova O.渗透胁迫对两种玉米品种兼容溶解质,膜稳定性和水关系的影响。植物土壤环境。2006; 52(4):186-91。gydF4y2Ba
- 56。gydF4y2Ba
脱落酸调控基因表达及其与抗逆性的关系。植物生理学杂志,1994;45:13 - 41。gydF4y2Ba
- 57。gydF4y2Ba
Skriver K,Muldy J.基因表达响应脱落酸和渗透胁迫。植物细胞。1990; 2:503-12。gydF4y2Ba
- 58。gydF4y2Ba
Bota AJ, Medrano H, Felxas J.在持续水分胁迫下,光合作用是否受到rubisco活性和RuBP含量降低的限制?新植醇。2004;162:671 - 80。gydF4y2Ba
- 59。gydF4y2Ba
植物对水分亏缺的响应。植物科学,1997;2:48-54。gydF4y2Ba
- 60.gydF4y2Ba
环境胁迫下光合作用及其相关代谢的调控。记录机器人。2009;103:609-23。gydF4y2Ba
- 61.gydF4y2Ba
关键词:花生,蒸腾效率,rd29A, DREB1A,代性状中国农业科学,2011;gydF4y2Ba
- 62.gydF4y2Ba
Moinuddin,Khanna-Chopra r.鸡肝的渗透调整与种子产量和产量参数有关。农作物科学。2004; 44:449-55。gydF4y2Ba
- 63。gydF4y2Ba
摩根JM,Rodriguez-Maribona B,Knights EJ。通过Osmoregulation适应鹰嘴豆育种系的水缺水:与田间籽粒产量的关系。现场作物RES。1991; 27:61-70。gydF4y2Ba
- 64。gydF4y2Ba
Holsters M,Silva B,Van Vliet F,Genetello C,De Block M,Dhaese P,Depicker A,Inze D,Engler G,Villarroel R,Van Montagu M,Schell J.一个Nopaline的功能组织gydF4y2BaA.Tumefaciens.gydF4y2Ba质粒pTiC58。质粒。1980;3(2):212 - 30。gydF4y2Ba
- 65。gydF4y2Ba
Das A,SARMAH BK。鹰嘴豆遗传转化(gydF4y2BaCicer Arietinum.gydF4y2BaL.)。res j Contem的担忧。2005; 1:1-6。gydF4y2Ba
- 66。gydF4y2Ba
Dellaporta SL, Wood J, Hicks JB。一种植物DNA微型制剂。Plant Mol Biol Rep. 1983; 1:19-21。gydF4y2Ba
- 67。gydF4y2Ba
萨姆布鲁克J,罗素DW。分子克隆:实验室手册,第3版。纽约:冷泉港实验室出版社;2001.gydF4y2Ba
- 68.gydF4y2Ba
雷诺兹SG。土壤湿度测定部分的重量法研究了设备的研究和方法论问题。J水醇。1970; 11:258-73。gydF4y2Ba
- 69.gydF4y2Ba
Schonfeld MA, Johnson RC, Carwer BF, Mornhinweg DW。冬小麦的水分关系作为抗旱指标。作物科学。1998;28:526-31。gydF4y2Ba
- 70。gydF4y2Ba
Turner NC,Abbo S,Berger JD,Chaturvedi SK,法国RJ,Ludwig C,Mannur Dm,Singh Sj,Yadava HS。鸡豆腐的渗透调整(gydF4y2BaCicer Arietinum.gydF4y2BaL.)导致末端干旱没有收益效益。J Exp Bot。2007; 58(2):187-94。gydF4y2Ba
- 71。gydF4y2Ba
Boyer JS。用压力室测量的叶子水电位。植物理性。1967年; 42(1):133-7。gydF4y2Ba
- 72。gydF4y2Ba
Blum A,Ebercon A.细胞膜稳定,作为小麦干旱和耐热性的衡量标准。农作物科学。1981; 21:43-7。gydF4y2Ba
- 73。gydF4y2Ba
利用新型调制荧光计连续记录光化学和非光化学的叶绿素荧光猝灭。Photosynth杂志1986;10:51 - 62。gydF4y2Ba
- 74.gydF4y2Ba
Farquhar GD, Ehleringer JR, hubic KT。碳同位素识别与光合作用。植物生理学杂志。1989;40:03 - 37。gydF4y2Ba
致谢gydF4y2Ba
作者感谢机构生物安全委员会(IBSC),坎普尔,汉普尔,以批准转基因遏制设施(PBSL1)的项目和表型研究,根据现存印度生物安全法规(1989年1989年规则,重组DNA研究和生物土壤的法规和指南,2017)。谢谢是由于科学技术人员:Ajeet PRATAP Singh先生,Malkhan Singh先生和Ravi Ranjan Singh,植物生物技术,印度康尔,印度康沃尔州康沃尔州康普斯研究所,总体上有助于维持实验遏制设施,化学品和种子库存维护。Simanta Dey先生,媒体和信息单位,icar-krishi bhawan,新德里的贡献,致力于承认撰写和编辑图像。gydF4y2Ba
资金gydF4y2Ba
作者感谢位于新德里的印度农业研究委员会(Award No。IXX06368)和作物转基因网络项目(No OXX02262)为化学品和消耗品的采购提供财政支持,提供实验室和遏制设施(PBSL1)等基础设施,以及包括研究中使用的收集和分析在内的其他物流。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
AD、PSB、SD:实验构想与设计;AD、PSB、SD MK、JA、AS、ST、PS、SD、SKC、NPS:进行结果解读、编写、稿件起草、终稿审批;PSB:解释表型相关数据;KCB:提供基因构建并帮助数据分析,鹰嘴豆样品的MSS: CID分析和结果解释。所有作者阅读并批准最终稿件。gydF4y2Ba
通讯作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意gydF4y2Ba
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:sup图1. 1。gydF4y2Ba
T-DNA的gydF4y2Baatdreb1a.gydF4y2Ba构造。gydF4y2Ba图2一同坐席。gydF4y2Ba鹰嘴豆(C. arietum L.)不同遗传转化阶段gydF4y2BaA. DE-涂层DCP 92-3种子,B.制备的CWHEA外植物,C.外植体浸入其中gydF4y2Ba农杆菌属gydF4y2BaD. Whatman滤纸上的外植体,E.在SIM 1培养基中共同培养的外植体,F.在SIM 2培养基中萌发的外植体,G.有多芽的外植体,耐H.卡那霉素的芽(准备嫁接),I.小嫁接,J.成熟的可育植株。gydF4y2Ba图3一同坐席。gydF4y2Ba南方污染分析的完整形象(1F)。gydF4y2Ba一口图4。gydF4y2Ba转基因鹰嘴豆系线和对照(1g)的RT-PCR的全图。(PPT 3221 KB)gydF4y2Ba
附加文件2:Sup表1。gydF4y2Ba
转基因鹰嘴豆系及其世代进展。gydF4y2Ba表2。gydF4y2Ba种族隔离的gydF4y2Baatdreb1a.gydF4y2Ba在T.gydF4y2Ba1gydF4y2Ba四个独立鹰嘴豆事件的后代。gydF4y2Ba表3。gydF4y2Ba转基因事件E5 (TgydF4y2Ba2gydF4y2Ba).gydF4y2Ba表4吃晚饭。gydF4y2Ba转基因事件E17 (TgydF4y2Ba2gydF4y2Ba).gydF4y2Ba表5吃晚饭。gydF4y2Ba转基因事件E19 (TgydF4y2Ba2gydF4y2Ba).gydF4y2Ba表6。gydF4y2Ba转基因事件E22 (TgydF4y2Ba2gydF4y2Ba).gydF4y2Ba表7。gydF4y2Ba转鹰嘴豆(TgydF4y2Ba3.gydF4y2Ba).gydF4y2Ba表8一同坐席。gydF4y2Ba转鹰嘴豆(TgydF4y2Ba3.gydF4y2Ba).gydF4y2Ba一口表9所示。gydF4y2Ba转基因鹰嘴豆线MSI的ANOVA(TgydF4y2Ba3.gydF4y2Ba).gydF4y2Ba一口表10。gydF4y2Ba转基因鹰嘴豆线的叶绿素含量(SPAD值)的ANOVA(TgydF4y2Ba3.gydF4y2Ba).gydF4y2Basup表11。gydF4y2Ba转基因鹰嘴豆线ETR的ANOVA(TgydF4y2Ba3.gydF4y2Ba).gydF4y2Ba一口表12。gydF4y2Ba转基因鹰嘴豆线CID的ANOVA(TgydF4y2Ba3.gydF4y2Ba).gydF4y2Ba一口表13。gydF4y2Ba转基因鹰嘴豆种子产量的ANOVA,WW和WS条件下(TgydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
达斯,A,巴苏,p.s.,库马尔,M。gydF4y2Baet al。gydF4y2Ba转基因鹰嘴豆(gydF4y2BaCicer Arietinum.gydF4y2BaL.)窝藏gydF4y2Baatdreb1a.gydF4y2Ba在生理学上更好地适应水赤字。gydF4y2BaBMC植物BIOL.gydF4y2Ba21日,gydF4y2Ba39(2021)。https://doi.org/10.1186/s12870-020-02815-4gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02815-4gydF4y2Ba
关键字gydF4y2Ba
- 基因工程gydF4y2Ba
- 转录因子gydF4y2Ba
- atdreb1a.gydF4y2Ba
- 渗透调整gydF4y2Ba
- 碳同位素歧视gydF4y2Ba
- 叶绿素荧光gydF4y2Ba
- Etr.gydF4y2Ba
- 屈服gydF4y2Ba
- 表型gydF4y2Ba