- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
叶绿素合成相关基因对叶色的影响GydF4y2Ba玉簪属草本植物GydF4y2Ba(GydF4y2BaHosta plantaginea aschers.GydF4y2Ba)及烟草(GydF4y2Ba烟草L。GydF4y2Ba)GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba21GydF4y2Ba文章编号:GydF4y2Ba45GydF4y2Ba(GydF4y2Ba2021.GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
玉簪以其多色叶片而闻名,是研究叶绿体发育和颜色变化的有用资源。叶绿素生物合成相关基因的表达(GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba) 在GydF4y2Ba玉簪属草本植物GydF4y2Ba已被证明与叶子颜色相关联。在此,我们分离,测序和分析HRHEMA,HRPOR和HRCAO基因。还进行亚细胞定位以确定相应酶的位置。在质粒结构之后,进行病毒诱导的基因沉默(Vigs)以减少这些基因的表达。此外,GydF4y2BaHRHEMA-,HRPOR-GydF4y2Ba和GydF4y2Bahrcao-GydF4y2Ba使过表达烟草植物验证基因功能。转基因烟草的变化记录在2000 LX,6000 Lx和10,000 Lx光强度下。另外,酶5-氨基乙酰丙烯酸(5-ALA),卟酚(PBG),叶绿素A和B(CHLA和CHLB),类胡萝卜素(CXC),超氧化物歧化酶(SOD),过氧化物酶(POD),丙二醛(MDA)),评估不同光强度下的脯氨酸(Pro)和过氧化氢酶(猫)。GydF4y2Ba
结果GydF4y2Ba
沉默GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba基因可以诱导叶片黄变和叶绿体结构的改变GydF4y2Ba玉簪属草本植物GydF4y2Ba.具体地说,叶GydF4y2Ba玉簪属草本植物GydF4y2Ba与GydF4y2BaHrCAOGydF4y2Ba沉默是受影响最大的,而那些有GydF4y2BaHrPORGydF4y2Ba沉默是最不受影响的。三个基因在烟草中均有高表达,而在野生型(WT)中无表达。但3个基因对不同光强的敏感性不同。的最高表达水平GydF4y2BaHrHEMAGydF4y2Ba和GydF4y2BaHrPORGydF4y2Ba在10,000 lx的光照下被检测到,而GydF4y2BaHrCAOGydF4y2Ba显示了6000 Lx下最高表达水平。最后,不同转基因Tobaccos中的5 ALA,CHLA,CXC,SOD,POD,MDA,PRO和猫内容在不同的光强度下显着变化。GydF4y2Ba
结论GydF4y2Ba
这3个基因在烟草中的过表达通过积累叶绿素含量来增强光合作用,但在不同光强下影响程度不同。此外,GydF4y2BaHRHEMA-,HRPOR-GydF4y2Ba和GydF4y2Bahrcao-GydF4y2Ba在烟草中过表达可以增强植物的抗氧化能力,以应对较高光强度的应力。然而,在较低的光强度下,抗氧化能力下降GydF4y2BaHRHEMA-,HRPOR-GydF4y2Ba和GydF4y2Bahrcao-GydF4y2Baoverexpressing烟草。GydF4y2Ba
突出了GydF4y2Ba
- 1.GydF4y2Ba
沉默GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba改变了细胞渗透性并导致囊泡中的自噬积聚。GydF4y2Ba
- 2.GydF4y2Ba
过度表达GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba在烟草通过积聚叶绿素含量来增强光合作用,但在不同光强度下延迟的有影响力水平。GydF4y2Ba
- 3.GydF4y2Ba
HrCAOGydF4y2Ba过表达促进烟草植物的开花。GydF4y2Ba
- 4.GydF4y2Ba
过度表达GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba在烟草中可以增强植物的抗氧化能力,以应对较高光强度的应力。GydF4y2Ba
背景GydF4y2Ba
宿牛(宿主PlantagineaGydF4y2Ba亚瑟GydF4y2Ba)GydF4y2Ba是一个常年的草本植物和家庭的阴影植物Liliaceae [GydF4y2Ba1GydF4y2Ba].它的叶子在形状、大小、颜色和纹理上各不相同。此外,栽培和维护的费用GydF4y2Ba玉簪属草本植物GydF4y2Ba相对较低,这些都将使其在城市绿化和景观建设中得到广泛应用[GydF4y2Ba2GydF4y2Ba].尽管具有观赏价值,GydF4y2Ba玉簪属草本植物GydF4y2Ba植物也有重要的药用特性,包括清热解毒功能。例如,刘注意到从花中提取的甾体皂苷GydF4y2Ba玉簪属草本植物GydF4y2Ba显示出抗肿瘤作用[GydF4y2Ba3.GydF4y2Ba].值得注意的是,“GydF4y2Ba富豪辉煌GydF4y2Ba', 一种GydF4y2Ba玉簪属草本植物GydF4y2Ba品种繁多,以其多色叶片而闻名。杂色叶片通常由绿色和白色/黄色组成,是研究叶绿体发育和颜色变化的有用资源[GydF4y2Ba4.GydF4y2Ba].此外,杂色植物的杂色叶细胞具有不同的特征,如叶绿体超微结构[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba]、光系统I (PSI)及光系统II (PSII)的构造及功能[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba,以及叶绿素的合成和降解[GydF4y2Ba5.GydF4y2Ba,可以调节叶子的颜色变化。此外,白化病在树叶颜色的变化中起着重要作用[GydF4y2Ba10GydF4y2Ba那GydF4y2Ba11GydF4y2Ba].有研究报道,叶绿体相关各基因的表达改变可能影响叶绿体的生物发生。由此造成的叶绿素代谢和叶绿体组装的中断可导致叶片颜色异常[GydF4y2Ba12GydF4y2Ba那GydF4y2Ba13GydF4y2Ba].在叶绿素生物合成中GydF4y2Ba哈哈GydF4y2Ba基因编码谷氨酰基trna还原酶(GluTR),是编码酶5-氨基乙酰丙酸(5-ALA)的关键调控因子之一。酶5-ALA由谷氨酸经三种酶促反应合成。谷氨酸首先转化为谷氨酰腺苷酸,然后转移到特定的tRNA形成谷氨酰-tRNA。之后,GluTR催化谷氨酰基trna。通过nadph依赖反应生成谷氨酸1-半醛(GSA),从而由GSA转氨酶形成5-ALA [GydF4y2Ba14GydF4y2Ba].在其他地方,Kumar发现HEMA1功能缺失突变体呈斑点状到完全黄色,在正常生长条件下无法茁壮成长[GydF4y2Ba15GydF4y2Ba].Schmied等人的另一项研究。阐明了在光素和深种植植物中的Hema1过表达可导致蛋白氯化物积累[GydF4y2Ba16GydF4y2Ba].随后,在原叶绿素内酯氧化还原酶(POR)的催化下,原叶绿素内酯(Pchlide)还原为叶绿素内酯,是导致植物发育发生深刻转变的关键光驱动反应[GydF4y2Ba17GydF4y2Ba那GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba].作为叶绿体生物合成中光依赖过程的第一步,叶绿体的表达GydF4y2Ba运动GydF4y2Ba与叶绿素含量有关。在被子植物中,首次鉴定出两种POR亚型(PORA和PORB)GydF4y2Ba大麦芽GydF4y2Ba[GydF4y2Ba21GydF4y2Ba],GydF4y2Ba拟南芥(拟南芥蒂利亚纳)GydF4y2Ba[GydF4y2Ba22GydF4y2Ba]和一些其他植物物种。另外,Pora转录物在年轻光素的幼苗中上调,并通过光下调;虽然在深色种植的幼苗中检测到pobrobr转录物,但在光线的后续发展阶段仍然可以检测到可检测到的[GydF4y2Ba23GydF4y2Ba].Chla、NADPH和POR形成的三元复合物是白体向叶绿体转化的关键。多项研究表明,Chl合酶作用下,最终形成Chla [GydF4y2Ba24GydF4y2Ba那GydF4y2Ba25GydF4y2Ba].此外,CHLB在CHLA氧酶(CAO)催化的两步氧合反应中由CHLA合成[GydF4y2Ba26GydF4y2Ba].GydF4y2Ba丙烯酸-,为什么GydF4y2Ba和GydF4y2Ba曹GydF4y2Ba它们在叶绿素合成过程中起着至关重要的作用,并与叶色密切相关。它们的表达水平可能与植物叶片颜色的调控有关。在这里,我们试图探索的功能GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba通过基因沉默和过表达技术GydF4y2Ba玉簪属草本植物GydF4y2Ba和烟草植物。最后,在不同的光强度下研究了转基因植物对光的敏感性。本研究为杂色的叶子提供了新的证据GydF4y2Ba玉簪属草本植物GydF4y2Ba.GydF4y2Ba
结果GydF4y2Ba
HrHEMA、HrPOR、HrCAO的鉴定GydF4y2Ba
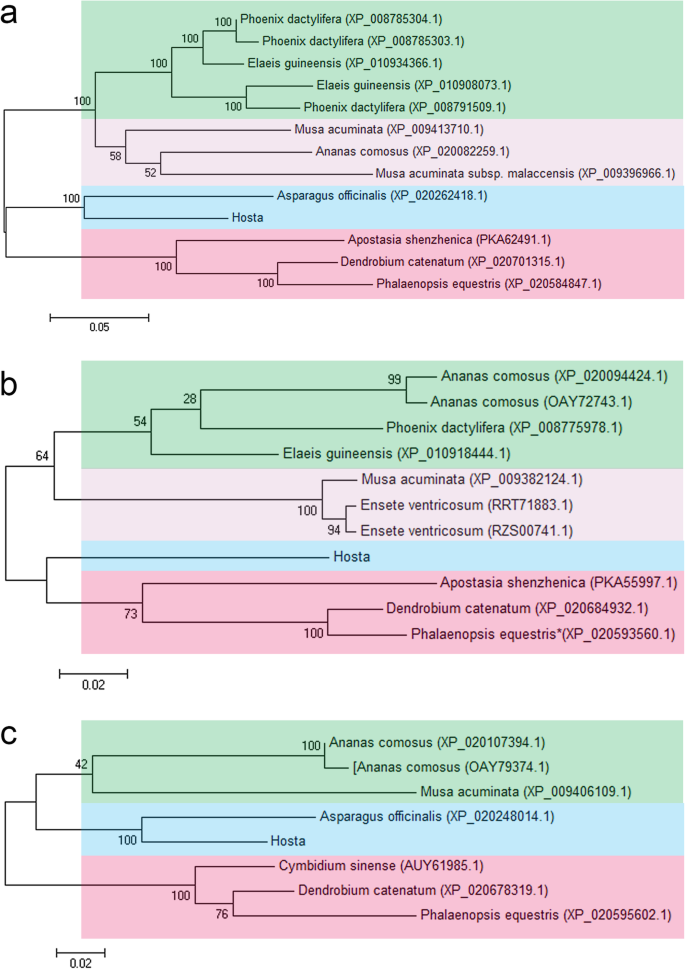
的长篇GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba分别为1608、1185及1623 bp (GydF4y2Ba桌子GydF4y2BaS1GydF4y2Ba),分别编码536,394和540个氨基酸。值得注意的是,三种基因的Sanger序列结果与NCBI的参考文献相同GydF4y2Ba(无花果。GydF4y2BaS1GydF4y2Ba那GydF4y2BaS2GydF4y2Ba和GydF4y2BaS3GydF4y2Ba).此外,利用MEGA 7.0在NCBI中获得的Sanger结果和序列构建了最大似然树(ML)。GydF4y2Ba1GydF4y2Baa - c)。系统进化树显示,所有的HrHEMA和HrCAO蛋白查询分别聚为4和3组。GydF4y2Ba玉簪属草本植物GydF4y2Ba聚集在一起GydF4y2Ba芦笋officinalis.GydF4y2Ba(百合科),表明基因GydF4y2Ba哈哈GydF4y2Ba和GydF4y2Ba曹GydF4y2Ba在GydF4y2Ba玉簪属草本植物GydF4y2Ba和GydF4y2Ba答:officinalisGydF4y2Ba比其他植物更相似。为GydF4y2BaHrPROGydF4y2Ba,将蛋白质查询聚集成四组,而没有其他植物被聚集在一起GydF4y2Ba玉簪属草本植物GydF4y2Ba.总的来说,系统发育树的结果与被子植物系统发育组(APG) IV系统的结果一致。GydF4y2Ba
亚细胞定位GydF4y2Ba
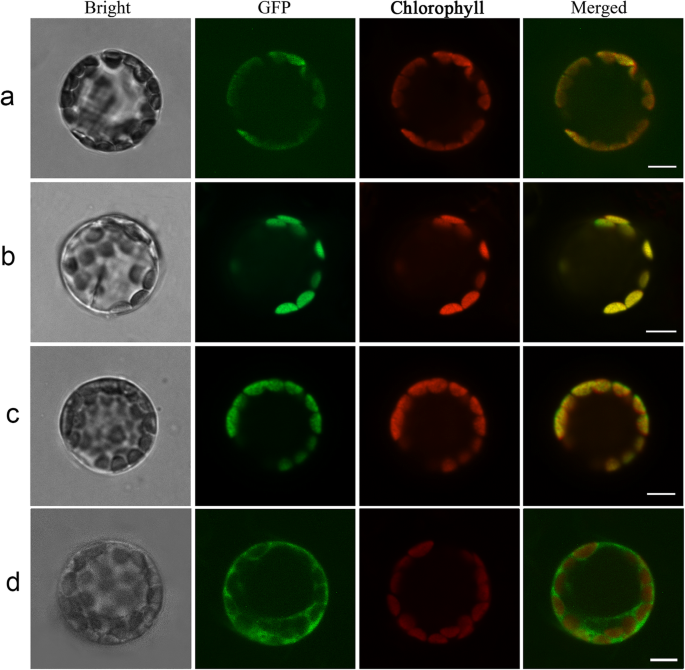
为了鉴定HRHEMA,HRPOR和HRCAO蛋白的亚细胞定位,全长编码序列(CDS)GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba将基因克隆到含有GFP标签(16,318H-GFP,35s:GFP)的表达载体中。16318 H-HRHEMA-GFP,16318 H-HRPOR-GFP和16,318 H-HRCAO-GFP融合蛋白主要分布在叶绿体中(更高亮度)(图。GydF4y2Ba2GydF4y2Baa - c)。而作为对照的空表达载体(16318 h-GFP, 35S:GFP)中表达的GFP主要分布在叶绿体和细胞核中(图2)。GydF4y2Ba2GydF4y2Bad).融合蛋白的分布表明,这3种蛋白主要分布在叶绿体中。该结果与生物信息学预测结果一致。GydF4y2Ba
亚细胞定位GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba在GydF4y2Ba拟南芥GydF4y2Ba原生质体。GydF4y2Ba一种GydF4y2Ba那GydF4y2BaB.GydF4y2Ba那GydF4y2BaCGydF4y2Ba,GydF4y2BaD.GydF4y2Ba表明GydF4y2Ba拟南芥GydF4y2Ba分别用16318 h-HrHEMA-GFP、16318 h- hrpore -GFP、16318 h-HrCAO-GFP和GFP空载体转化原生质体。分别拍摄亮场原生质体(第一柱)、绿色荧光(第二柱)和红色自荧光(第三柱)。合并后的图像显示在第四列。*明亮:明亮的领域;GFP:绿色荧光蛋白;叶绿素,叶绿素荧光GydF4y2Ba
沉默的HRHEMA,HRPOR和HRCAO的影响GydF4y2Ba玉簪属草本植物摘要GydF4y2Ba
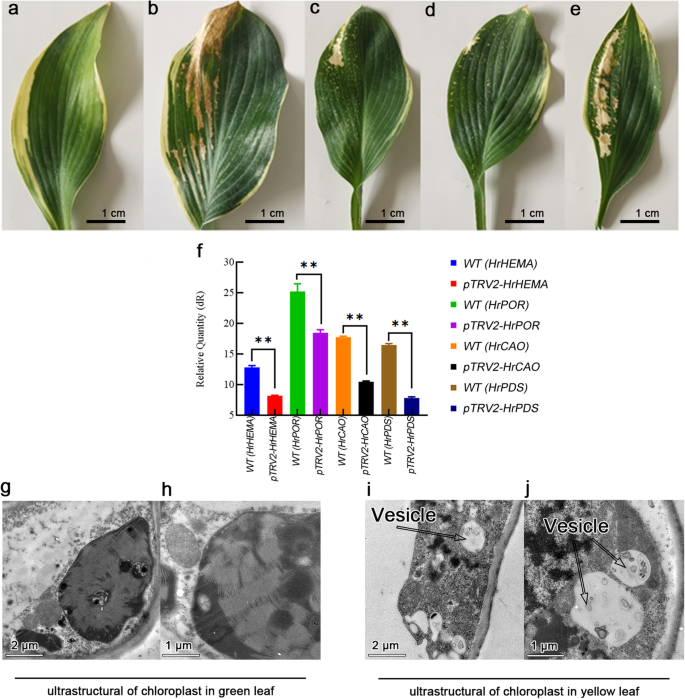
沉默GydF4y2BaHRHEMA,HRPOR和HRCAOGydF4y2Ba基因GydF4y2Ba玉簪属草本植物GydF4y2Ba导致叶片接种后40天的叶子(图。GydF4y2Ba3.GydF4y2Baa e)。的GydF4y2BaHRPDS.GydF4y2Ba以未转化叶片为阴性对照,以未转化叶片为阳性对照。研究结果表明,不同的沉默基因导致不同程度的植物白化病。具体来说,和阳性对照相似GydF4y2BaHrCAOGydF4y2Ba-沉默植物的白化病发病率最高。而GydF4y2BaHrPORGydF4y2Ba最下面的是静音装置。的表达水平GydF4y2BaHRHEMA,HRPOR和HRCAOGydF4y2Ba在与对照相比,沉默治疗后显着降低。特别是,GydF4y2BaHrHEMAGydF4y2Ba减少了36.2%,GydF4y2BaHrPORGydF4y2Ba了26.8%,GydF4y2BaHrCAOGydF4y2Ba41%和GydF4y2BaHRPDS.GydF4y2Ba52.5%(图。GydF4y2Ba3.GydF4y2Baf)。超微结构观察结果表明,细胞渗透性发生变化,并且许多囊泡(自噬体)出现在叶片的黄色部分中(图。GydF4y2Ba3.GydF4y2Bag-j)。叶绿体由正常的椭圆形变为圆形,类囊体由扁平变为膨大,内膜系统不完整。叶绿素生物合成基因沉默后,线粒体嵴聚集并发育良好。GydF4y2Ba
沉默的影响GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba在GydF4y2Ba玉簪属草本植物摘要GydF4y2Ba.GydF4y2Ba一种GydF4y2Ba来GydF4y2BaE.GydF4y2Ba注意对照(阴性对照)中叶子颜色的变化,GydF4y2BaHRPDS.GydF4y2Ba(积极的控制),GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba科学GydF4y2Ba玉簪属草本植物GydF4y2Ba植物,分别;GydF4y2BaFGydF4y2Ba显示基因表达GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPOR, HrCAOGydF4y2Ba和GydF4y2BaHRPDS.GydF4y2Ba, ** 方法GydF4y2BaP.GydF4y2Ba< 0.05与对照(未加VIGS处理的叶片)相比;GydF4y2BaGGydF4y2Ba和GydF4y2BaHGydF4y2Ba显示绿叶部分叶绿体的超微结构。在绿叶部分发现囊泡(自噬体组);GydF4y2Ba一世GydF4y2Ba和GydF4y2BajGydF4y2Ba显示黄叶部分叶绿体的超微结构。黄叶部分存在自噬小体GydF4y2Ba
不同光强下HrHEMA、HrPOR和HrCAO在烟草叶片中的表达模式GydF4y2Ba
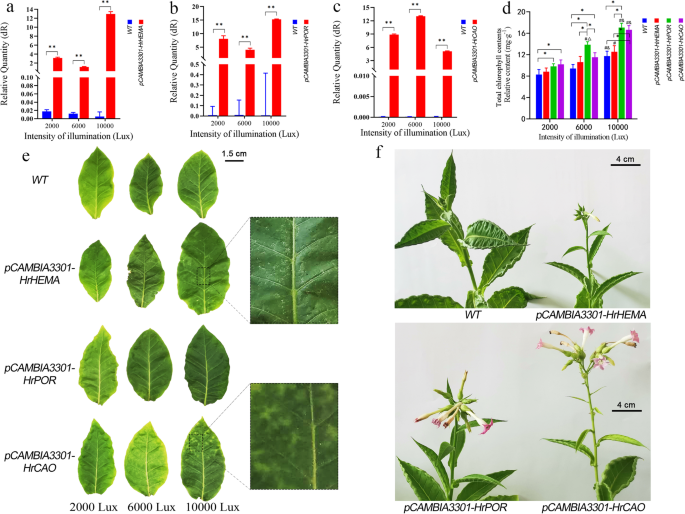
在过表达烟草植株中GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba显著高于野生植株。不同基因过表达的烟草植株表现出不同的光敏感性。的最高表达水平GydF4y2BaHrHEMAGydF4y2Ba和GydF4y2BaHrPORGydF4y2Ba在10,000 lx的光照下被检测到,而GydF4y2BaHrCAOGydF4y2Ba在6000 lx下表达量最高(图2)。GydF4y2Ba4.GydF4y2Baa - c)。此外,注意到总叶绿素含量GydF4y2BaHrPOR -GydF4y2Ba和GydF4y2Bahrcao-GydF4y2Ba烟草植株中过表达量分别在6000 lx和10000 lx以下达到峰值(图1)。GydF4y2Ba4.GydF4y2Bad)。在用不同的光强度(2000 LX,6000 Lx和10,000 Lx)处理WT和转基因烟草植物40天后,注意到所有烟草叶片表现出相当大的变化(图。GydF4y2Ba4.GydF4y2Bae).随着光照强度的增加,叶片颜色逐渐由浅绿色变为深绿色。在10000 lx时,叶片颜色与阳光下比较接近。此外,还出现栅栏和海绵状组织GydF4y2BaHrHEMAGydF4y2Ba转基因叶片的表面出现了光斑GydF4y2BaHrCAOGydF4y2Ba转基因烟草的叶子。70 d后,不同光强下植株生长差异显著,10000 lx以下生长速度最快,6000 lx和2000 lx次之。在10000 lx光照下,转基因烟草的出芽时间较对照提前。有趣的是,开花时间的顺序如下GydF4y2BaHrCAOGydF4y2Ba转基因烟草是最早的,然后是GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrHEMAGydF4y2Ba转基因烟草,最后GydF4y2BaWTGydF4y2Ba烟草(图。GydF4y2Ba4.GydF4y2Baf)。GydF4y2Ba
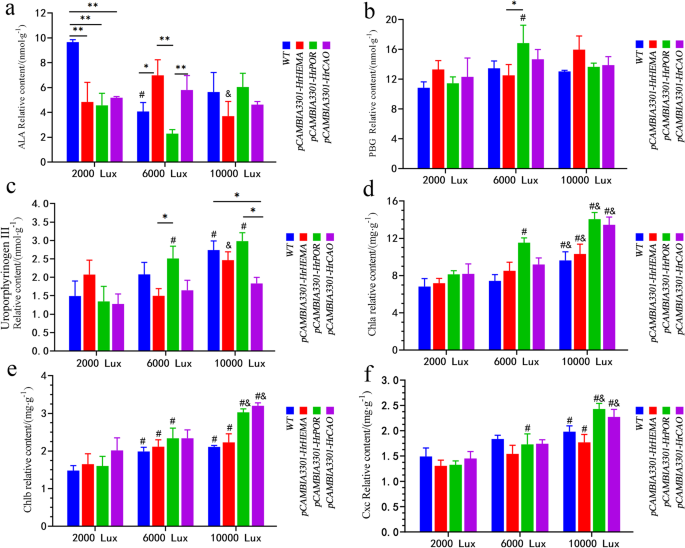
超表达的影响GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba在烟草上。GydF4y2Ba一种GydF4y2Ba来GydF4y2BaCGydF4y2Ba表现在表达上的变化GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba在转基因烟草叶片中。* *意味着GydF4y2BaP.GydF4y2Ba< 0.05;GydF4y2BaD.GydF4y2Ba所有转基因烟草叶片总叶绿素含量。*意味着GydF4y2BaP.GydF4y2Ba< 0.05;# 方法GydF4y2BaP.GydF4y2Ba<0.05与2000 LX相比;# 方法GydF4y2BaP.GydF4y2Ba<0.05与600 LX相比;GydF4y2BaE.GydF4y2Ba显示休假颜色变化GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba2000 lx、6000 lx和1000 lx光照下转基因烟草叶片。在不同光照强度40天后拍摄图像;GydF4y2BaFGydF4y2Ba70天在10,000 LX光强度下成长后展示植物状况GydF4y2Ba
HrHEMA-、HrPOR-和hrcao -过表达烟草幼苗叶绿素生物合成前体的变化GydF4y2Ba
这里,作为第一通用前体在合成叶绿素,血红素和其它四吡咯的第一通用前体,揭示了对照中的相对较高的含量,而不是2000 Lx下的转基因植物。在6000卢比照明下,GydF4y2BaHrHEMA HrCAO -GydF4y2Ba过表达植株的5-ALA含量高于过表达植株GydF4y2BaHrPORGydF4y2Ba.相反,GydF4y2BaHrPOR -GydF4y2Ba过表达植株的5-ALA含量高于过表达植株GydF4y2BaHrHEMA和HrCAOGydF4y2Ba在10,000 lx下的转基因植物(图。GydF4y2Ba5.GydF4y2Baa). porphobilinogen (PBG)在2000 lx光照下无显著差异。然而,百事装瓶集团在GydF4y2BaHrPOR -GydF4y2Ba过表达烟草叶子阐明了6000 Lx下的最高相对内容,而那个GydF4y2BaHrHEMAGydF4y2Ba转基因烟草叶片在10,000 lx以下的产量最高。GydF4y2Ba5.GydF4y2Bab)。随着光强度的增加,WT的尿量III含量,GydF4y2BaHrPOR -GydF4y2Ba和GydF4y2Bahrcao-GydF4y2Ba烟草植株表达量呈增加趋势。此外,所有植株的尿卟啉原III含量在10,000 lx光照条件下均达到峰值。另一方面,尿卟啉原IIIGydF4y2BaHrHEMAGydF4y2Ba过表达烟草呈先降低后增加的趋势。而在GydF4y2BaHrPORGydF4y2Ba转基因烟草植物,用光强度增加尿卟啉胶III(图。GydF4y2Ba5.GydF4y2Bac)。GydF4y2Ba
不同光强下5-氨基乙酰丙酸(5-ALA)、卟啉原(PBG)、尿卟啉原III、叶绿素a和b (Chla和Chlb)的含量GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba转基因烟草的叶子。GydF4y2Ba一种GydF4y2Ba来GydF4y2BaFGydF4y2Ba显示5-ALA、PBG、uroporphyrinogen III、Chla和Chlb的含量。*代表GydF4y2BaP.GydF4y2Ba< 0.05, **表示GydF4y2BaP.GydF4y2Ba< 0.01;#表示GydF4y2BaP.GydF4y2Ba< 0.05,同一基因6000(或10000)lx与2000 lx之间的比较;&表示GydF4y2BaP.GydF4y2Ba< 0.05,同一基因10000 lx与6000 lx的比较GydF4y2Ba
叶绿素生物合成基因过表达对CHLA,CHLB和CXC的影响GydF4y2Ba
Chla和Chlb含量随光照强度的增加而逐渐增加,相同光照条件下转基因烟草的Chla和Chlb含量高于野生型烟草。此外,Chla和Chlb的含量GydF4y2BaHrPOR -GydF4y2Ba和GydF4y2Bahrcao-GydF4y2Ba过表达植株数量显著增加,特别是在10,000 lx光照下(图1)。GydF4y2Ba5.GydF4y2Bad和e)。CXC的含量随着光强度的增加而增加,但在2000和6000 Lx照明下的不同组中没有发现显着差异(图。GydF4y2Ba5.GydF4y2Baf)。但是,在10,000 LX照明下,CXC内容GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba转基因烟草植株的数量显著高于野生型烟草植株。GydF4y2Ba
叶绿素生物合成基因过表达对胁迫调节化合物的影响GydF4y2Ba
表汇总了不同光照条件下SOD、POD、MDA、Pro、CAT的含量GydF4y2Ba1GydF4y2Ba.弱光下,WT中SOD含量高于其他各组。而在光照强度较高的情况下,SOD的含量增加GydF4y2BaHrCAOGydF4y2Ba和GydF4y2BaHrPORGydF4y2Ba转基因植物比其他转基因植物相对较高。POD示出了光强度的负相关,而不同的基因过表达具有不同的效果。特别是GydF4y2BaHrPORGydF4y2Ba转基因植株的POD含量显著低于其他组。对于MDA,其中的内容GydF4y2BaHrCAOGydF4y2Ba和GydF4y2BaHrPORGydF4y2Ba转基因植株和野生型植株与光照强度呈负相关,而转基因植株和野生型植株与光照强度呈负相关GydF4y2BaHrHEMAGydF4y2Ba-Tresxcressing植物显示出正相关。此外,通常,所有植物中的Pro内容物与光强度呈负相关。此外,所有烟草植物在2000和6000 LX照明下的Pro内容明显高于10,000 Lx。最后,所有转基因烟草植物中的猫内容因光强度而增加,而WT烟草显示出相反的趋势。GydF4y2Ba
讨论GydF4y2Ba
植物叶片的颜色变化是一个复杂而敏感的过程,受多种基因、转录因子和代谢途径的控制。植物叶片的颜色是由叶绿素含量决定的,叶绿素含量受多种基因的调控,包括GydF4y2BaHema,GSA,血红,POR,帽GydF4y2Ba那GydF4y2Ba码头GydF4y2Ba和GydF4y2BaChlm.GydF4y2Ba[GydF4y2Ba27GydF4y2Ba].以前的研究已经证明了在表达水平之间的关系GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba植物中的叶子颜色[GydF4y2Ba28GydF4y2Ba那GydF4y2Ba29GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba].在这方面,我们专注于GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba他们与光线的关系GydF4y2Ba玉簪属草本植物GydF4y2Ba.GydF4y2Ba
此外,GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba分离和表征编码叶绿素合成的叶绿素合成的键酶的基因。如预期的那样,三个基因的Sanger序列结果完美地匹配了参考基因序列,表明分离的基因是正确的。我们的系统发育树结果揭示了这一点GydF4y2Ba玉簪属草本植物GydF4y2Ba有更密切的关系GydF4y2Ba芦笋officinalis.GydF4y2Ba这与之前的研究一致[GydF4y2Ba31GydF4y2Ba那GydF4y2Ba32GydF4y2Ba].此外,系统发育树同意APG IV系统的分类[GydF4y2Ba33GydF4y2Ba].亚细胞定位结果表明,所有这三种蛋白质都位于叶绿体中,其符合先前研究结果的一致[GydF4y2Ba34GydF4y2Ba那GydF4y2Ba35GydF4y2Ba那GydF4y2Ba36GydF4y2Ba].GydF4y2Ba
基因沉默后的表达水平GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba被显著降低。此外,它的颜色GydF4y2Ba玉簪属草本植物GydF4y2Ba叶子显着变化,这表明表达了GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba在GydF4y2Ba玉簪属草本植物GydF4y2Ba可以直接影响叶子颜色的变化。但不同基因的沉默对叶片颜色变化的程度有不同的影响。例如,沉默GydF4y2BaHrCAOGydF4y2Ba介导了叶片中大量白斑的形成。Chlb是陆生植物、绿藻和几种蓝藻产生的主要光吸收色素之一,由Chla经人工合成而成GydF4y2Ba曹GydF4y2Ba[GydF4y2Ba37GydF4y2Ba].叶绿素循环在植物的绿化、光强适应和衰老过程中起着至关重要的作用[GydF4y2Ba38GydF4y2Ba].有研究报道,表达水平降低GydF4y2BaHrCAOGydF4y2Ba导致CHLB的减少,这可能会严重干扰叶绿素循环,从而导致叶片变色。另一方面,叶子颜色从浅绿色变为深绿色GydF4y2BaHrCAOGydF4y2Ba-过表达烟草植株,在10000 lx处出现斑纹叶片。在另一项研究中GydF4y2Ba曹GydF4y2Ba- 为较长的持续时间报告为光合的烟草植物,并保留更大的生物量[GydF4y2Ba39GydF4y2Ba].修饰过的GydF4y2Ba拟南芥GydF4y2BaCaO基因导致CHLB的过度积累[GydF4y2Ba40GydF4y2Ba那GydF4y2Ba41GydF4y2Ba].很可能过表达GydF4y2BaHrCAOGydF4y2Ba调节Chlb的积累,保持较大的生物量。因此,颜色逐渐变暗。在10000 lx时Chla、Chlb和总叶绿素含量的快速积累也支持了叶绿素的积累加深了叶片颜色的事实。的影响GydF4y2BaHrPORGydF4y2Ba3个基因中叶片颜色的基因沉默量最小,表达量下降幅度最小。值得注意的是,GydF4y2BaHrPORGydF4y2Ba沉默可以在叶子表面上引起白色斑点。相反,其过度表达使叶子颜色较暗随着光强度的增加而变暗。GydF4y2Ba
POR是所有产氧光合生物叶绿素合成途径中的关键调控酶,参与了原叶绿素内酯光催化还原为叶绿素的过程。这是依赖光的叶绿体生物合成的第一步[GydF4y2Ba42GydF4y2Ba那GydF4y2Ba43GydF4y2Ba那GydF4y2Ba44GydF4y2Ba].多项研究指出,烟草幼苗的光饱和点约为10,000升(〜178.6μmol·mGydF4y2Ba−2GydF4y2Ba·年代GydF4y2Ba−1GydF4y2Ba),而成株期烟草的叶绿素含量约为30000 lx (~ 535.7 μmol·m .)GydF4y2Ba−2GydF4y2Ba·年代GydF4y2Ba−1GydF4y2Ba)[GydF4y2Ba45GydF4y2Ba那GydF4y2Ba46GydF4y2Ba].根据我们的结果,6000 LX下的PBG含量显示出最大值,表明烟草与GydF4y2BaHrPORGydF4y2Ba过表达具有较快的光合速率,而峰值光需求较低。在植物细胞中,PBG通过尿卟啉原合成酶(UROS)转化为尿卟啉原III [GydF4y2Ba47GydF4y2Ba].在6000lx光下,尿卟啉原III的相对含量迅速增加,这是由PBG的增加介导的。这进一步支持过表达hrpo的烟草具有较高的光合速率。GydF4y2Ba
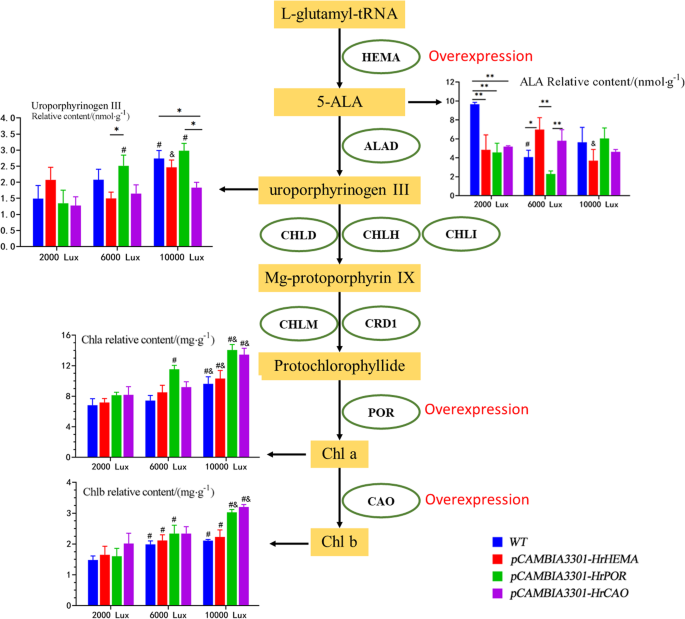
叶绿素和Chla含量GydF4y2BaHrPORGydF4y2Ba转基因烟草在6000lx下显著增加。相反,Chla、Chlb和总叶绿素含量在10000 lx以下显著增加,这可能是导致叶片颜色变深的主要原因。这些发现与之前的一项研究结果相似GydF4y2BaAtPORCGydF4y2Ba-过度表达导致更绿色的叶片表型GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba48GydF4y2Ba].最近,有几项研究报道GydF4y2Ba运动GydF4y2Ba表达是由光引起的,但对光的反应表现出不同的表达模式[GydF4y2Ba48GydF4y2Ba那GydF4y2Ba49GydF4y2Ba那GydF4y2Ba50GydF4y2Ba].在这项研究中,GydF4y2BaHrPORGydF4y2Ba在6000lx下表现出较高的表达量,而在10000lx时叶绿素的积累达到峰值,说明中等光强可能适合叶绿素的积累,而过度光强可能会引起相反的效应。ALA是Pchlide的前体,Pchlide在光照下起除草剂的作用[GydF4y2Ba51GydF4y2Ba那GydF4y2Ba52GydF4y2Ba].一项研究发现GydF4y2BaAhHEMA1 -GydF4y2Ba过表达烟草能有效提高ALA生物合成,叶绿素含量较高[GydF4y2Ba53GydF4y2Ba].在此,我们的研究结果表明GydF4y2BaHrHEMA -GydF4y2Ba过度抑制的烟草具有低于2000和10,000 Lx的5 Ala含量低于WT,但显示出较高的5-Ala含量下6000 Lx。这意味着在WT中的5-Ala内容在低光条件下保持高水平,但之后GydF4y2BaHrHEMAGydF4y2Ba过度表达,即使在低光条件下,5 Ala含量对光和迅速分解更敏感。此外,普拉迪斯和海绵状组织出现在GydF4y2BaHrHEMAGydF4y2Ba这与Schmied等人的研究结果一致[GydF4y2Ba16GydF4y2Ba]培训秋季阳光病变下的肺阳炎和差异在长的阳光条件下。叶绿体超微结构的变化揭示了下调的GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba显着影响叶绿体结构,这可能是叶子颜色变化的主要原因。与WT烟草相比,转基因植物中CHLA,CHLB和叶绿素的含量增加,这可能提高光合作用,提高光能利用率,并在一定程度上促进烟草植物的生长。此外,转移GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba可以缩短生长周期[GydF4y2Ba54GydF4y2Ba),尤其是GydF4y2BaHrCAOGydF4y2Ba转基因烟草。我们的结果与先前的发现一致[GydF4y2Ba55GydF4y2Ba].在这里,我们将我们的结果总结在图中。GydF4y2Ba6.GydF4y2Ba.GydF4y2Ba
结果摘要。椭圆形代表基因缩写。矩形表示关键化合物。直方图显示了关键因素的相对内容。野生型 (GydF4y2BaNGydF4y2Ba = 3) is shown in blue,HrHEMAGydF4y2Ba过度表达(GydF4y2BaNGydF4y2Ba= 3)用红色表示,GydF4y2BaHrPORGydF4y2Ba过度表达(GydF4y2BaNGydF4y2Ba= 3)用绿色表示,并且GydF4y2BaHrCAOGydF4y2Ba过度表达(GydF4y2BaNGydF4y2Ba= 3)用紫色表示。*代表GydF4y2BaP.GydF4y2Ba< 0.05, **表示GydF4y2BaP.GydF4y2Ba< 0.01;#表示GydF4y2BaP.GydF4y2Ba< 0.05,相比2000 lx;&表示GydF4y2BaP.GydF4y2Ba< 0.05,与6000 lx的相同基因相比。阿拉巴马州,aminolevulinic酸;Chla,叶绿素a;Chlb,叶绿素bGydF4y2Ba
反应性氧物种(ROS)在调节许多生物学过程的调节中发挥积分作用,例如生长,发育和对生物和/或非生物刺激在植物中的反应[GydF4y2Ba56GydF4y2Ba那GydF4y2Ba57GydF4y2Ba].植物细胞中ROS的平衡对于植物开发是重要的。植物细胞中的抗氧化防御系统包括所有酶如SOD,POD和猫[GydF4y2Ba58GydF4y2Ba].GydF4y2Ba
膜脂过氧化过程中产生的MDA含量常被用作氧化损伤的指标[GydF4y2Ba59GydF4y2Ba].而植物中的Pro是一种常见的应激反应指示器[GydF4y2Ba60GydF4y2Ba那GydF4y2Ba61GydF4y2Ba].SOD、POD和CAT的相对含量说明了SOD、POD和CAT的表达GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba可以极大地影响它们的相对含量。但我们注意到,转基因烟草植株在强光照条件下可以增强SOD和CAT活性,从而消除强光合作用过程中产生的ROS。此外,转基因烟草植株具有较强的光合能力,这可能导致MDA和Pro含量增加。这些发现主要是由血红素调节的,它可能被用作参与氧化稳态的辅基[GydF4y2Ba62GydF4y2Ba].全面的,GydF4y2BaHRHEMA-,HRPOR-GydF4y2Ba和GydF4y2Bahrcao-GydF4y2Ba过表达烟草可以增强植物的抗氧化能力,以应对较高光强度的应力。然而,在较低的光强度下,抗氧化能力GydF4y2BaHRHEMA-,HRPOR-GydF4y2Ba和GydF4y2Bahrcao-GydF4y2Ba烟草中的过度表达有所下降。GydF4y2Ba
结论GydF4y2Ba
总之,GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba沉默会引起叶面黄变和叶绿体结构的变化GydF4y2Ba玉簪属草本植物GydF4y2Ba.注意,树叶GydF4y2Ba玉簪属草本植物GydF4y2Ba与GydF4y2BaHrCAOGydF4y2Ba沉默是最受影响的,而GydF4y2BaHrPORGydF4y2Ba沉默的植物受到的影响最小。这3个基因在烟草中的过表达通过积累叶绿素含量来增强光合作用,但在不同光强下影响程度不同。此外,GydF4y2BaHRHEMA-,HRPOR-GydF4y2Ba和GydF4y2Bahrcao-GydF4y2Ba在烟草中过表达可以增强植物的抗氧化能力,以应对较高光强度的应力。但是,在较低的光强度下,抗氧化能力劣化GydF4y2BaHRHEMA-,HRPOR-GydF4y2Ba和GydF4y2Bahrcao-GydF4y2Baoverexpressing烟草。GydF4y2Ba
方法GydF4y2Ba
植物材料,生长和治疗GydF4y2Ba
玉簪属草本植物GydF4y2Ba(拉马克的简历。帝王的辉煌),GydF4y2Ba拟南芥GydF4y2Ba(L. Heynh CV。哥伦比亚)和烟草(GydF4y2Ba烟草GydF4y2Ba简历。NC89)植物在本研究中使用。GydF4y2Ba玉簪属草本植物GydF4y2Ba被种植在吉林农业大学长白山野生资源的苗圃中养育和开发。同时GydF4y2Ba拟南芥GydF4y2Ba烟草种植在人工气候室中,光照条件为4000 lxGydF4y2Ba拟南芥GydF4y2Ba,烟草6000 lx(不包括光照试验烟草),14 h/d],中等湿度(40-60%)。新鲜的植物叶子GydF4y2Ba玉簪属草本植物GydF4y2Ba每15天取样并保存在−80°C下。而那些的GydF4y2Ba拟南芥GydF4y2Ba用于原生质体制剂。对于烟草,用乙醇和次氯酸钠消毒种子,然后在Murashige和Skoog(MS)培养基上播种。萌发后,将种子移植在灭菌的土壤中,并在人造气候室中生长两周。GydF4y2Ba
HrHEMA、HrPOR、HrCAO的分离及序列分析GydF4y2Ba
总RNAGydF4y2Ba玉簪属草本植物GydF4y2Ba使用迷你最佳通用RNA提取套件(Takara,Shiga,Japan)提取叶子。然后,使用Primescript™RT试剂盒3.0(Takara,Shiga,日本)用于逆转录PCR(RT-PCR)。之后,GDNA橡皮擦用于从总RNA(1μg)的DNA在42℃下除去2分钟,然后加入转录反应混合物并在37℃下孵育15分钟,并在85℃下终止5 s. The PCR conditions used forHRHEMA,HRPOR和HRCAOGydF4y2Ba用配对引物进行扩增(GydF4y2Ba桌子GydF4y2BaS2GydF4y2Ba) 94°C 3 min;30个循环,98°C 10 s, 62°C 5 s, 72°C 20 s;72°C 10分钟,并保持在4°C。利用RACE Kit (TAKARA,志贺,日本)从cDNA中获得了这3个基因的5 ' -和3 ' -片段。将获得的PCR片段克隆到pEASY-Blunt简单克隆载体(TransGen Biotech, Beijing, China)中。重组质粒转化为GydF4y2Ba大肠杆菌Trans1GydF4y2Ba在含有50.0mg / ml amp,500mg / ml IPTG和20mg / ml X-GAL的LB平板上选择-T1和白色菌落。为了表征分离的基因,使用ABI 3730 XL测序仪(ABI,CA,USA),用M13引物(F:GaacacggGGGGACTCGGADGACE)进行Sanger序列。GydF4y2Ba
系统发育树的构建GydF4y2Ba
的同源序列GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba是用Blast检索的。开放阅读框(ORF)区系统发育分析GydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba分别进行序列比较,并与同源序列进行同源性分析。简单地说,使用Clustal W和默认参数进行序列多次比对。然后利用MEGA 6.0 (GydF4y2Bawww.megasoftware.net/GydF4y2Ba).最后,使用1000重复的引导分析估计ML树可靠性。GydF4y2Ba
亚细胞定位GydF4y2Ba
我们构建了表达GFP标记的融合蛋白的载体,用于HRHEMA,HRPOR和HRCAO蛋白的亚细胞定位分析。包含编码序列的cDNAGydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba克隆到含有CaMV 35S启动子:绿色荧光蛋白(35S:GFP)盒的16318 h GFP载体中,构建融合蛋白[GydF4y2Ba63GydF4y2Ba].重组载体(GydF4y2Bap35区域:16318 h-HrHEMA-GFPGydF4y2Ba那GydF4y2BaP35S:16318 H-HRPOR-GFP和P35S:16318 H-HRCAO-GFPGydF4y2Ba)通过Sanger测序证实。将配对的特定引物列入GydF4y2Ba桌子GydF4y2BaS2GydF4y2Ba.将重组载体用如前所述的聚乙二醇(PEG)介导的转化方法转化成原生质体,[GydF4y2Ba64GydF4y2Ba].在转换后,在Olympus Fluoview FV1000共聚焦激光扫描显微镜(Olympus,Japan)下检查荧光。GydF4y2Ba
玉簪叶片质粒的构建与基因沉默GydF4y2Ba
在基因沉默实验中,GydF4y2Ba玉簪属草本植物GydF4y2Ba被用作植物材料。的全长cDNAGydF4y2BaHrHEMA, HrPORGydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba插入到VIGS载体pTRV2中。随后,三个VIGS表达载体(GydF4y2BapTRV2-HrHEMA, pTRV2-HrPOR和pTRV2-HrCAOGydF4y2Ba)和阳性控制,GydF4y2BapTRV2-PDSGydF4y2Ba(植物去饱和酶)被接种到GydF4y2Ba根癌土壤杆菌GydF4y2Ba.的GydF4y2Ba农GydF4y2Ba用1ml注射器将重组载体注射到叶片和茎部,用Agro液体培养。注射后,置于16℃、相对湿度60%的培养箱中培养。24 h后,在22/18℃和16 h昼/8 h夜条件下培养。14 d后进行qRT-PCR检测基因表达,验证基因沉默的效果。最后,在40天后观察并记录植物叶片的漂白情况。GydF4y2Ba
观察叶超微结构GydF4y2Ba
观察不同颜色部分中叶绿体的变化GydF4y2Ba玉簪属草本植物GydF4y2Ba叶子,通过透射电子显微镜(TEM,Hitachi,Tokyo,Japan)观察叶的超微结构。将要检测的部件的中心切成小块(约1mmGydF4y2Ba3.GydF4y2Ba)以确保样品的均匀性。然后将叶片组织用5%戊二醛固定在0.05 M磷酸盐缓冲液(pH 7.2)中,再用2%四氧化锇固定在同一缓冲液中,用梯度丙酮系列和环氧丙烷脱水,包埋在树脂中(分析纯),在65℃聚合24 h。然后在100 kV下用透射电镜观察样品。GydF4y2Ba
质粒结构和农杆菌介导的烟草植物的转化GydF4y2Ba
的全长cdnaGydF4y2BaHrHEMA HrPOR,GydF4y2Ba和GydF4y2BaHrCAOGydF4y2Ba在CaMV 35S启动子的控制下,克隆到表达载体pCAMBIA3301 (GydF4y2Bahttp://www.cambia.org.GydF4y2Ba).gusA作为报告基因,仅在真核细胞中表达。的向量GydF4y2Ba35 s: pCAMBIA3301-HrHEMA 35 s: pCAMBIA3301-HrPOR 35 s: pCAMBIA3301-HrCAOGydF4y2Ba,以及一个控件GydF4y2BaPCAMBIA3301.GydF4y2Ba被引入GydF4y2Ba农GydF4y2Ba使用冻融方法菌株。叶盘转换是根据上一份报告完成的[GydF4y2Ba65GydF4y2Ba].2-3周后,将再生的烟草组织转移到培养基上进行生根。利用qRT-PCR筛选阳性转基因植株。GydF4y2Ba
不同光照条件下转基因烟草的变化GydF4y2Ba
采用2000 lx、6000 lx和10000 lx光照处理野生型烟草和转基因烟草苗期植株。40 d后观察叶片变化,70 d后观察植株生长情况。此外,5-ALA的内容和胆色素原(PBG)和相对的内容uroporphyrinogen三世,叶绿素a和b (Chla和Chlb),类胡萝卜素(科学家),超氧化物歧化酶(SOD)、过氧化物酶(POD)、丙二醛(MDA)、脯氨酸(Pro)和过氧化氢酶(CAT)在不同光强度评估其他地方描述(GydF4y2Ba66GydF4y2Ba那GydF4y2Ba67GydF4y2Ba].GydF4y2Ba
实时定量聚合酶链反应(qRT-PCR)分析GydF4y2Ba
定量rt - PCR是ABI 7500实时PCR系统使用SYBR上实现真正的主人(豆类、志贺、日本)混合后PCR热循环条件:变性在95°C 30年代,40周期为5 s在95°C, 58为10°C,并为10 68°C。此外,Hv-Actin和Ntβ-Actin作为内参基因GydF4y2Ba玉簪属草本植物GydF4y2Ba和烟草,分别(使用的引物概述于GydF4y2Ba桌子GydF4y2BaS2GydF4y2Ba).检测前建立无模板对照、阴性对照和单引物对照。结果显示在三个生物重复(每个技术重复)的每个样品,和2GydF4y2Ba——ΔΔCTGydF4y2Ba方法用于统计分析。GydF4y2Ba
统计分析GydF4y2Ba
统计数据分析在先前的研究之后执行[GydF4y2Ba68GydF4y2Ba那GydF4y2Ba69GydF4y2Ba].其中采用GraphPad Prism 8软件进行数据统计分析。数据分析采用单因素方差分析,然后采用Tukey检验进行多重比较。的值GydF4y2BaP.GydF4y2Ba< 0.05被认为是显著的GydF4y2BaP.GydF4y2Ba<0.01被认为是非常显着的。GydF4y2Ba
可用性数据和材料GydF4y2Ba
我们用直接链接和登录号将数据上传到GenBank:GydF4y2Bahttps://www.ncbi.nlm.nih.gov/nuccore/MW217998GydF4y2Ba,hrcao.sqn hrhema mw217998;GydF4y2Bahttps://www.ncbi.nlm.nih.gov/nuccore/MW217999GydF4y2Ba, HrCAO。sqn HrPOR MW217999;GydF4y2Bahttps://www.ncbi.nlm.nih.gov/nuccore/MW218000GydF4y2Ba, HrCAO。sqn HrCAO MW218000。保存在GenBank中的数据是公开的。GydF4y2Ba
缩写GydF4y2Ba
- PSI:GydF4y2Ba
-
光系统IGydF4y2Ba
- PSII:GydF4y2Ba
-
光系统IIGydF4y2Ba
- GluTR:GydF4y2Ba
-
谷氨酸-TRNA还原酶GydF4y2Ba
- 5-ALA:GydF4y2Ba
-
酶5-氨基乙酰丙酸GydF4y2Ba
- GSA:GydF4y2Ba
-
Glu 1-semialdehydeGydF4y2Ba
- POR:GydF4y2Ba
-
原叶绿素酸脂氧化还原酶GydF4y2Ba
- 曹:GydF4y2Ba
-
Chla加氧酶GydF4y2Ba
- APG:GydF4y2Ba
-
被子植物系统学集团GydF4y2Ba
- 百事装瓶集团:GydF4y2Ba
-
胆色素原GydF4y2Ba
- ROS:GydF4y2Ba
-
活性氧GydF4y2Ba
- 女士:GydF4y2Ba
-
Murashige和Skoog中号GydF4y2Ba
- RT-PCR:GydF4y2Ba
-
逆转录聚合酶链反应GydF4y2Ba
- PD:GydF4y2Ba
-
八氢番茄红素DesaturaseGydF4y2Ba
- Chla Chlb:GydF4y2Ba
-
叶绿素a和bGydF4y2Ba
- 科学家:GydF4y2Ba
-
类胡萝卜素GydF4y2Ba
- SOD:GydF4y2Ba
-
歧化酶GydF4y2Ba
- 圆荚体:GydF4y2Ba
-
过氧化物酶GydF4y2Ba
- MDA:GydF4y2Ba
-
丙二醛GydF4y2Ba
- 亲:GydF4y2Ba
-
脯氨酸GydF4y2Ba
- 猫:GydF4y2Ba
-
过氧化氢酶GydF4y2Ba
- QRT-PCR:GydF4y2Ba
-
实时定量聚合酶链反应GydF4y2Ba
参考GydF4y2Ba
- 1.GydF4y2Ba
施密妇女WG。素食属。波特兰:木材出版社;2009年。GydF4y2Ba
- 2.GydF4y2Ba
Leifert C,Camotta H,等待W.抗生素组合对微扑发的克里姆涂层,翠肝,富丽华,虹膜和光电效果的影响。植物细胞组织器官邪教。1992年; 29:153-60。GydF4y2Ba
- 3.GydF4y2Ba
刘建,王CF,邱m-h,胡wx。甾体皂苷从荨麻植物的鲜花及其抗肿瘤活动。中国传统和草药。2010; 41:520-6。GydF4y2Ba
- 4.GydF4y2Ba
余芳,傅爱玲,刘洪涛,刘旭,傅芳,罗德mel S.叶绿体生物发生机制的研究。植物学报2007;30:350-65。GydF4y2Ba
- 5.GydF4y2Ba
袁敏,徐明宇,袁胜,陈勇,杜军,徐飞,张志伟,郭志超,赵志勇,林慧慧。光对无叶绿素女贞叶绿素合成和质体发育的调控。acta botanica yunnanica(云南植物研究). 2010;52:809-16。GydF4y2Ba
- 6.GydF4y2Ba
黄志强:百合科百合属植物的光采色素-蛋白质复合物缺乏。足底。1978;143:275-8。GydF4y2Ba
- 7.GydF4y2Ba
关键词:枫糖,褐金突变体,漂白,类囊体系统Odessanum Var。化学学报。2008;81:89-95。GydF4y2Ba
- 8。GydF4y2Ba
王志强,王志强,王志强,等。烟草褐变突变体的遗传特性及光合作用研究。植物营养与肥料学报,2000,19(6):591 - 598。GydF4y2Ba
- 9。GydF4y2Ba
kawata ee,张艾。Aurea光合突变体(SU / SU)在烟草中的分子分子分析:LHCP耗尽导致脂肪钙突变体表型。Embo J. 1991; 9:4197-203。GydF4y2Ba
- 10.GydF4y2Ba
侯d-y,xu h,du g-y,lin j-t,duan m,guo a-g。冬小麦阶段搅拌型叶片蛋白蛋白质分析(Triticum Aestivum)Fa85555555。BMB REP。2009; 42:450-5。GydF4y2Ba
- 11.GydF4y2Ba
李Q,黄杰,刘S,李茹,杨X,刘Y,刘Z。白化茶叶三个发育阶段幼叶蛋白质组学分析。蛋白质组SCI。2011; 9:44。GydF4y2Ba
- 12.GydF4y2Ba
杨Y,陈X,徐b,李y,ma y,王g.表型和转录组分析显示叶绿体开发和颜料生物合成在一起影响了安硫伞子“超声”的突变体中的叶子颜色形成。前植物SCI。2015; 6。GydF4y2Ba
- 13.GydF4y2Ba
李勇,张智,王平,王萨,马丽,李丽,杨瑞,马勇,王强:综合转录组分析发现紫薇黄叶突变体中与叶颜色相关的新候选基因。基因与基因组学。2015;37。GydF4y2Ba
- 14.GydF4y2Ba
方y,赵某,张f,赵安,张w,张m,刘L.拟南芥谷氨酸 - trna还原酶(Glutr)形成了流感和谷氨酸结合蛋白的三元复合物。SCI REP。2016; 6:19756。GydF4y2Ba
- 15.GydF4y2Ba
Madan Kumar A,Soll D.反义Hema1 RNA表达抑制拟南芥中血红素和叶绿素生物合成。植物理性。2000; 122:49-56。GydF4y2Ba
- 16.GydF4y2Ba
Schmied J, Hedtke B, Grimm B. HEMA1编码谷氨酰基trna还原酶的过表达。acta botanica yunnanica(云南植物研究),2011;GydF4y2Ba
- 17.GydF4y2Ba
J Heyes D,Neil Hunter C:制作酶催化的轻松工作:蛋白氯化物氧化物氧化酶。趋势Biochem SCI 2005,30:642-649。GydF4y2Ba
- 18.GydF4y2Ba
Reinbothe C, El Bakkouri M, Buhr F, Muraki N, Nomata J, Kurisu G, Fujita Y, Reinbothe S.叶绿素生物合成:聚焦于原生叶绿素的还原。植物科学进展。2010;15:614-24。GydF4y2Ba
- 19。GydF4y2Ba
王志强,王志强。光驱动酶原叶绿素氧化还原酶的激发态动力学和催化机理。物理化学化学物理:PCCP。2012; 14:8818-24。GydF4y2Ba
- 20.GydF4y2Ba
光依赖的原叶绿素氧化还原酶:系统发育、调控和催化性质。生物化学。2015;54。GydF4y2Ba
- 21.GydF4y2Ba
hortorf H, Reinbothe S, Reinbothe C, Bereza B, Apel K:大麦中受光差异调节的两种叶绿素合成途径(GydF4y2Ba大麦芽GydF4y2Bal .)GydF4y2Ba.Proc Natl Acad SCI U S 1995,92:3254-3258。GydF4y2Ba
- 22.GydF4y2Ba
张志强,张志强,张志强,等。拟南芥叶绿体氧化还原酶(NADPH)在叶绿素合成中的应用。植物杂志。1995;108:1505-17。GydF4y2Ba
- 23.GydF4y2Ba
Gabruk M,Stecka A,StrzałkaW,Kruk J,Strzalka K,Beata M-K。用Pora重建光活性蛋白氯化物 - 酶复合物。薄层的PORB和PORC蛋白:荧光和催化性质PLOS。2015; 10:e0116990。GydF4y2Ba
- 24.GydF4y2Ba
周B,PENG D,LIN J,Huang X,Peng W,HE R,GUO M,TANG D,ZHAO X,LIU X.拟南芥糖尿病患者的嗜酸甘油蛋白2-氧化酶基因的异源表达增强了Brassica Napus L.杂志的光合作用力植物生物学 - J植物BIOL。2011; 54:23-32。GydF4y2Ba
- 25.GydF4y2Ba
Dijkstra C, Adams E, Bhattacharya a . F page a, Anthony P, Kourmpetli S, B Power J, C Lowe K, Thomas S, Hedden PGydF4y2Ba等GydF4y2Ba:来自phab phaulyoolussoginel1的嗜酸甘油蛋白2-氧化酶基因的过表达增强了嗜酸盐蛋白的灭活并诱导绵羊种类的侏儒症。植物细胞代表2008; 27:463-70。GydF4y2Ba
- 26.GydF4y2Ba
Pavla Novak DS。植物叶绿素合成的研究进展。作者:王莹,植物与土壤科学CHINESE。2019; 1(1):10-5。GydF4y2Ba
- 27.GydF4y2Ba
王志强,王志强,王志强,等。植物叶绿素合成与降解的研究进展。植物学报。2004;56(1):1 - 14。GydF4y2Ba
- 28.GydF4y2Ba
yangen f,秀松z,汉月w,岳岳t,qinzeng x,丽霞z:光强度对光收获颜料和光合体系的新陈代谢的影响GydF4y2Ba茶树GydF4y2Bal .品种“Huangjinya”GydF4y2Ba.环境实验机器人2019,166:103796。GydF4y2Ba
- 29.GydF4y2Ba
李杰,王义,柴俊,王升,王c,长w,王d,王y,zheng m,peng c等。叶绿素生物合成需要绿色可再助的氯化物1(GRC1)以及水稻中叶绿体的早期发育。植物生物学杂志。2013; 56(5):326-35。GydF4y2Ba
- 30.GydF4y2Ba
Liu Z, Zhang K, Shan X, Li C, Tang X, Chi M, Feng H: the Physiological properties and叶绿素biosynthesis of pakchoi (GydF4y2Ba甘蓝GydF4y2Ba黄叶突变体,皮。GydF4y2Baacta physiologiae plantarum.GydF4y2Ba2016年,39(1):22。GydF4y2Ba
- 31.GydF4y2Ba
Mckain Mr,Wickett N,Zhang Y,Ayyampalayam S,McCombie WR,Chase MW,Pires Jc,De Pamphilis Cw,Leebens-Mack J.转录组数据的系统核发科学分析阐明了古多大ploid事件的共同发生和双峰核型的起源血脂藻(Asparagaceae)。我是J机器人。2012; 99(2):397-406。GydF4y2Ba
- 32.GydF4y2Ba
Lee S-R,Kim K,Lee B-Y,Lim Ce。完全在韩国发生的所有六个宿主种类的叶绿体基因组:分子结构,比较和系统发育分析。BMC基因组学。2019; 20(1):833。GydF4y2Ba
- 33.GydF4y2Ba
引用本文:Byng J, Chase M, Christenhusz M, Fay M, Judd W, Mabberley D, Sennikov A, Soltis D, Soltis P, Stevens P. APG IV. Bot J Linn Soc. 2016;GydF4y2Ba
- 34.GydF4y2Ba
谷氨酰基- trna还原酶基因在黄瓜幼苗中表达的差异。植物杂志。1996;110:1223-30。GydF4y2Ba
- 35.GydF4y2Ba
Franck F,Sperling U,Frick G,Pochert B,Van Cleve B,Apel K,A. Armstrong G:通过光依赖性NADPH:植物氧化物氧化酶A的化学异质性来调节牙血剂颜料 - 蛋白质复合物,内膜结构和蛋白氯化物的调节和B.植物理物理2001,124:1678-1696。GydF4y2Ba
- 36.GydF4y2Ba
叶绿素b的合成:叶绿素A加氧酶的定位和催化亚基中稳定自由基的发现。BMC Plant Biol. 2004;4:5。GydF4y2Ba
- 37.GydF4y2Ba
拟南芥叶绿素A加氧酶调控缺陷突变体的特性研究。光化学学报。2008;7(10):1196-205。GydF4y2Ba
- 38.GydF4y2Ba
Meguro M,ITO H,Takabayashi A,Tanaka R,Tanaka A.鉴定拟南芥中叶绿素循环叶绿素循环的7-羟甲基叶绿素鉴定。植物细胞。2011; 23(9):3442-53。GydF4y2Ba
- 39.GydF4y2Ba
通过过表达叶绿素A加氧酶对烟草叶绿素b生物合成和光合作用的光强依赖性调节。植物杂志。2012;159:433-49。GydF4y2Ba
- 40.GydF4y2Ba
在拟南芥中,叶绿素A加氧酶的N端结构域在响应叶绿素b积累时赋予蛋白质不稳定性。植物细胞。2005;17:1585 - 97。GydF4y2Ba
- 41.GydF4y2Ba
拟南芥中Chl B的过量产生通过转录重编程抑制衰老。植物与细胞生理学。2012; 53:505-17。GydF4y2Ba
- 42.GydF4y2Ba
张志强,张志强,张志强,等。拟南芥叶绿体氧化还原酶的研究进展[j]。植物杂志。1995;108(4):1505 - 17所示。GydF4y2Ba
- 43.GydF4y2Ba
zarnecki O, Gläßer C, Chen J-G, Mayer KFX, Grimm B. ALA合成对质体到核信号的贡献的证据。植物学报2012;3:236-6。GydF4y2Ba
- 44.GydF4y2Ba
郑克华,李建军,李建军,徐玉生,曹鹏,欧阳生,安凯,等。水稻光响应基因及其家族成员的鉴定与功能分析。公共科学图书馆麝猫。2008;4 (8):e1000164-4。GydF4y2Ba
- 45.GydF4y2Ba
刘秀珍:烤烟苗期生长规律及光合特性的研究。中国烟草学报,1993,1(4)。GydF4y2Ba
- 46.GydF4y2Ba
张LJSCXDXXWLR:不同光强度对烟草光合作用的影响。GydF4y2Ba6.GydF4y2Ba。17 - 21 2000(4):区间GydF4y2Ba
- 47.GydF4y2Ba
陈志强,陈志强。先天性铁细胞性贫血的分子病理生理和基因突变。Free Radic Biol Med. 2019; 133:179-85。GydF4y2Ba
- 48.GydF4y2Ba
拟南芥叶绿体氧化还原酶C的过度表达调控氧化应激。《公共科学图书馆•综合》。2011;6:e26532。GydF4y2Ba
- 49.GydF4y2Ba
拟南芥的POR C:第三种光和nadph依赖的叶绿素氧化还原酶,受光的不同调节。acta botanica sinica(云南植物学报)2002;47:805-13。GydF4y2Ba
- 50。GydF4y2Ba
Masuda T,Fusada N,Oosawa N. Takamatsu Ki,Yamamoto Y,Ohto M,Nakamura K,Goto K,Shibata D,Shirano YGydF4y2Ba等GydF4y2Ba:NADPH中同种型的功能分析:拟南芥植物氧化物氧化酶(POR),POR和PORC。植物与细胞生理学。2003; 44:963-74。GydF4y2Ba
- 51。GydF4y2Ba
王志强,王志强,王志强,等:光动力除草剂。选择性的最新进展和分子基础。植物科学评论- CRIT REV Plant SCI。1988; 6:385 - 436。GydF4y2Ba
- 52。GydF4y2Ba
B、Chakraborty N: 5-氨基乙酰丙酸对黄瓜光合电子传递链的光动力损伤(GydF4y2BaCucumis sativusGydF4y2BalGydF4y2Ba子叶。植物营养与肥料学报,1991,26(6):491 - 497。GydF4y2Ba
- 53。GydF4y2Ba
杨胜,赵丽,闫军,张军,郭飞,耿勇,王强,杨飞,万胜,李晓刚。花生基因编码四吡咯生物合成酶AhHEMA1和AhFC1,缓解转基因烟草的盐胁迫。植物生理生化学报2019;137。GydF4y2Ba
- 54.GydF4y2Ba
巴塔那亚克,比斯瓦尔,雷迪VS,崔帕蒂。过表达叶绿素a加氧酶烟草植物中叶绿素b生物合成的光依赖调控。生物化学学报。2005;32(2):466-71。GydF4y2Ba
- 55.GydF4y2Ba
张文忠c - plx - gzy:转拟南芥CAO基因烟草的构建及其耐弱光性分析。南方农业学报,2015,46(6):951-957。GydF4y2Ba
- 56.GydF4y2Ba
Swanson S,Gilroy S. ROS在植物开发中。physiol植物。2009; 138:384-92。GydF4y2Ba
- 57.GydF4y2Ba
Baxter A, Mittler R, Suzuki N. ROS是植物胁迫信号的关键分子。J Exp Bot. 2013;65。GydF4y2Ba
- 58.GydF4y2Ba
Gunes A,Inal A,Guneri E,Coban S,Sahin O.硅增加了硼耐受性,并减少了用过量的硼在土壤中种植的小麦的氧化损伤。BIOL植物。2007; 51:571-4。GydF4y2Ba
- 59.GydF4y2Ba
抗氧化应激、抗氧化剂与应激耐受性。植物科学进展。2002;7:405-10。GydF4y2Ba
- 60.GydF4y2Ba
关键词:硼毒害,耐硼敏感品种,抗氧化反应植物科学。2003;164:925-33。GydF4y2Ba
- 61.GydF4y2Ba
Jimenez J,Becerra-Flora A,Hernández-lucero e,Rodríguez-kessler M,Acosta-Gallegos J,G.Ramírez-Pimentel J:盐胁迫下两种豆品种的脯氨酸积聚和多胺和鸟氨酸的作用。2006,50:763-766的Biol Plant。GydF4y2Ba
- 62.GydF4y2Ba
Khan A,G Quigley J:控制细胞内血红素水平:血红素转运蛋白和血红素氧合酶。Biochim Biophys Acta 2011,1813:668-682。GydF4y2Ba
- 63.GydF4y2Ba
黄雪梅GL3/EGL3蛋白对毛状体形成的调控作用。基因。2019;692:60-7。GydF4y2Ba
- 64.GydF4y2Ba
巴特R,陈M,帕克C-J,巴特利L,罗纳德PC。利用sirna沉默水稻叶片和茎源原生质体的新系统。工厂方法。2006;2:13-3。GydF4y2Ba
- 65.GydF4y2Ba
Curtis IS, david MR, Power JB。叶磁盘转换。方法:Mol Biol. 1995; 44:59-70。GydF4y2Ba
- 66.GydF4y2Ba
Jain M,Panwar M,Gadre R.硒补充对绿化玉米叶片δ-氨基纤维酸形成的影响。植物化学研究杂志。2017; 11:111-7。GydF4y2Ba
- 67.GydF4y2Ba
Barcelos JPQ, Reis HPG, Godoy CV, Gratão PL, Furlani Junior E, Putti FF, Campos M, Reis AR:叶面施镍对大豆植株脲酶活性、抗氧化代谢及白粉病(Microsphaera diffusa)防治的影响。2018年,67(7):1502 - 1513。GydF4y2Ba
- 68.GydF4y2Ba
陆志强,邓勇,Van Nostrand JD,何志强,Voordeckers J,周安,Lee YJ, Mason OU, Dubinsky EA, Chavarria KL,等。微生物基因功能在深水地平线中富集。ISME j . 2012; 6(2): 451 - 60。GydF4y2Ba
- 69.GydF4y2Ba
杨勇,吴丽,林强,袁敏,徐东,余辉,胡勇,段俊,李旭,何震,等。青藏高寒草地土壤微生物群落功能结构对放牧的响应中国科学:地球科学。2013;19(2):637-48。GydF4y2Ba
确认GydF4y2Ba
一个也没有。GydF4y2Ba
资金GydF4y2Ba
吉林省科技厅项目(no . 20190301046NY);科技部国家成果转化项目(no . 2014GB2B100007)。关键词:边坡,边坡稳定性,边坡稳定性GydF4y2Ba
资助机构在研究设计、收集、分析、解释数据和手稿写作方面没有作用。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
HZL设计了实验。JZ,SL和HML进行了实验。JZ,CS和QY准备了植物材料并分析了数据。JZ,JC和Zh准备了原稿。CS修订了原稿的结构。JZ,CS,SL,HML,HZL修改了稿件的内容。所有作者均认批准了最终手稿。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
作者宣布没有存在竞争利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意事项GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:表S1。GydF4y2Ba
基本信息GydF4y2BaHrHEMAGydF4y2Ba那GydF4y2BaHrPORGydF4y2Ba和GydF4y2BaHRCAO。GydF4y2Ba
附加文件2:表S2。GydF4y2Ba
基因克隆的底漆序列。GydF4y2Ba
附加文件3:图S1。GydF4y2Ba
不同物种的hhema比对和进化关系结果。GydF4y2Ba
附加文件4:图。S2。GydF4y2Ba
不同物种HrPOR的比对和进化关系发现。GydF4y2Ba
附加文件5:图S3。GydF4y2Ba
不同种间HrCAO的比对和进化关系结果。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
张建军,隋超,刘洪。GydF4y2Baet al。GydF4y2Ba叶绿素合成相关基因对叶色的影响GydF4y2Ba玉簪属草本植物GydF4y2Ba(GydF4y2BaHosta plantaginea aschers.GydF4y2Ba)及烟草(GydF4y2Ba烟草L。GydF4y2Ba).GydF4y2BaBMC植物杂志GydF4y2Ba21,GydF4y2Ba45(2021)。https://doi.org/10.1186/s12870-020-02805-6GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-020-02805-6GydF4y2Ba
关键字GydF4y2Ba
- HrHEMAGydF4y2Ba
- HrPORGydF4y2Ba
- HrCAOGydF4y2Ba
- 叶绿素GydF4y2Ba
- 基因转移GydF4y2Ba
- 玉簪属草本植物GydF4y2Ba
- 烟草GydF4y2Ba