摘要
背景
黑克(豇豆属曼戈(L)]种子是人类和动物消费的丰富的可消化蛋白质和膳食纤维来源。但是,质量和数量Vigna.种子在贮藏过程中受到布鲁氏菌的严重影响。因此,分析布鲁氏菌在黑荚中诱导的转录动态,将有助于理解布鲁氏菌对产卵的潜在防御机制。
结果
利用RNAseq方法,以感病品种T-9为对照,研究了中等抗性品种IC-8219种子发育过程中对鸦球蛾产卵的转录谱变化。IC-8219和T-9品种的8份(各4份)样本分别获得9608.46万份和99532,488份clean reads。通过对NR数据库进行BLASTX搜索,得到了32,584个CDSs,其中31,817个CDSs与NR显著相似Vigna Radiata.,亲密的相对豇豆属曼戈.IC-8219栽培品种具有630个显着差异表达的基因(DEG),其中304和326个基因上调,下调。然而,在T-9品种中,仅鉴定出168℃,分别上调142和26个基因。通过QPCR的表达分析10℃确认了RNA-SEQ数据的准确性。基因本体和Kegg途径分析帮助我们更好地了解这些DEG在卵形克的卵形介导的防御反应中的作用。在品种的两种品种中,响应于产卵最明显的转录组变化与诱导防御响应基因,转录因子,次生代谢物,酶抑制剂和信号转导途径有关。看来,BRUCHID过度定位介导的黑克的介导的防御反应由SA信号通路和防御基因,例如防御素,次级代谢物基因,酶抑制剂可以是抗Bruchids的潜在候选者。
结论
本研究通过从头组装的方法,获得了一个中等抗性品种黑克豆荚的未成熟豆荚的转录谱,并对其防御机制进行了研究。
背景
植物对食草昆虫有无数的防御机制来避免产量的损失。这些内在机制或在植物生长发育过程中构成性表达,或在昆虫损害时诱导。植物不仅对成年昆虫或食草动物有反应,雌性在植物表面产卵时也有反应。尽管与产卵相关的线索很少,但这种产卵反应通常是快速的,以保护未来免受新生幼虫的伤害[1.,2.].鸡蛋诱导的反应通常是过敏反应(HR)。此外,一些研究还揭示了植物对昆虫产卵的直接防御,包括肿瘤组织的生长[3.,4.]和分泌卵巢化合物以杀灭卵子[1.,5.].在间接防御反应中,卵沉积会导致挥发性化合物的释放,即产卵诱导植物挥发物(OIPV),以吸引卵寄生蜂[6.,7.,8.,9]. 植物对卵沉积的反应是通过改变叶表面的化学成分或气味来将卵寄生蜂留在叶上[10.,11.].植物表面卵沉积的最初步反应是活性氧(ROS)的产生[5.]随后形成胼胝质[12.,13.,14.]植物细胞的死亡。
Bruchids是许多豆类中臭名昭著的储藏谷物害虫,包括黑克。蚧虫在荚果形成期到达田间,雌虫在荚果壁表面产卵。然而,当收获的种子被储存起来时,就会迅速繁殖。在田间,植物被喷洒杀虫剂,以避免bruchid的侵扰,收获的种子作为种植材料也被处理过杀虫剂,以防止bruchid的繁殖。损失基本上是不可避免的,因为供人类消费的种子没有涂上杀虫剂。由于雌性bruchia产卵在荚壁;因此,黑克如何防范bruchids产卵的豆荚了解抗性机制是至关重要的。
昆虫卵介导的植物防御反应主要是由外分泌液中的诱导子引起的,外分泌液覆盖着虫卵以防止虫卵脱落和干燥。布鲁奇象甲成虫卵诱导子的化学组成(Bruchus pisorum.)被称为“Bruchin”。bruchin的活性分子是c22-C级24长链α,ω-二醇,一端或两端被3-羟基丙酸酯化。众所周知,Bruchin能提高防御反应性植物激素的水平,如茉莉酸(JA)、水杨酸(SA)和乙烯(ET)[3.,15.[随后,um-cnoualtates envertion基因。
黑革兰是印度热带和亚热带地区重要的豆类作物,其种子营养丰富,富含碳水化合物(60%)和可消化蛋白质(24%)[16.].储存条件期间的Bruchid侵扰导致在三到六个月的时间内造成重大损害,降低了种子的市场价值(既质量和数量)[17.,18.]. 少数黑革兰近缘种和野生种对布鲁氏菌表现出中等抗性;然而,杂交不亲和性阻碍了抗性育种[19.].具有中度抗性水平的栽培线[17.]可能是深入了解防御反应或鉴定抗性基因的合适来源。
我们研究了产卵介导的黑革兰转录组变化,以识别防御应答基因。之前,我们采用正向抑制消减杂交(SSH)方法对黑克虫的产卵介导的防御反应进行了概述。我们的SSH文库显示了防御反应基因的上调,如防御素、致病相关蛋白(PR)、受体丝氨酸苏氨酸激酶(RSTK)、脱水反应元件转录因子(DRE)、热休克蛋白70 (Hsp70) [20].我们的SSH文库产生了一小部分差异表达基因;因此,我们在本研究中选择了一个转录组的方法来全面了解bruchid产卵介导的黑克防御反应。结果表明,对中等抗性和中等感病品种进行转录组比较测序,发现几种防御应答基因、转录因子、次级代谢产物、蛋白激酶/磷酸酶、激素信号转导和调控通路显著上调。
结果
黑克豆荚中的产卵介导的反应性氧物种(ROS)产生
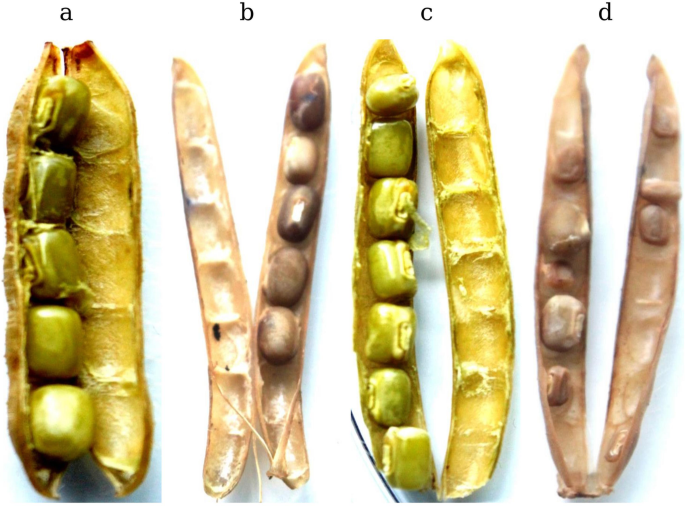
在黑革克荚上的Bruchids的卵形运动显示在从表面除去卵之后,荚上的过敏反应(HR)。HR可以通过生产产生氧化爆发活性氧(ROS),超氧化物阴离子,过氧化氢、羟基自由基和一氧化二氮。虫害部位活性氧的快速积累引发了几个致病相关基因的表达[21].因此,我们通过使用3,3-二氨基苯甲酸(DAB)染色方法在黑克荚膜上的Bruchids上邻居时测定RO的产生。生产过氧化氢(H.2.O2.)与对照相比,两个品种的产卵荚果均出现深褐色变色(图1)。1.a,b,c和d)。通过ROS生成的这种人力资源响应表明了Bruchid OvoIchion在处理过的样品中引发了防御反应。
布鲁氏菌产卵黑革兰豆荚转录本序列的测序与组装
为了了解黑革兰对布鲁氏菌产卵的潜在防御机制,从两个品种的对照和处理荚果的未成熟发育种子中提取总RNA,构建了黑革兰cDNA文库。使用NextSeq 500平台进行配对末端测序。在去除低质量的< 20分,共44880659分和51203941分(总长度13240367400分和15035372861分) IC-8219(C)和IC-8219(T)的总长度分别为51617299和47915189(总长度分别为15177630537和14054183123) 分别为T-9(C)和T-9(T)样本生成bp(表1.).
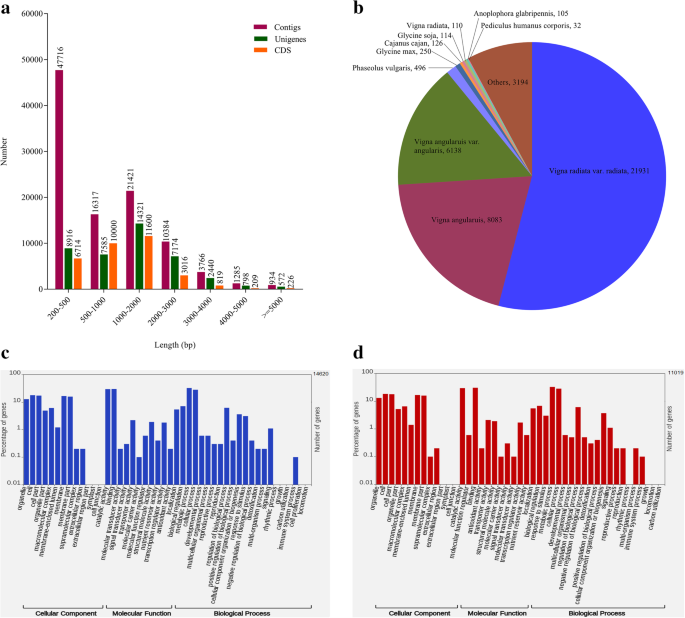
黑克的全基因组测序现在可用,但注释很差[22];因此,raw reads由Trinity de novo软件对RNAseq数据进行组装。原始reads也与可用的黑克基因组序列对齐,发现>相似度为90%(附加图。1.).将清洁读数组装成101,823个ContIG,其中读取长度为201至15,724bp,其平均长度为1057bp,具有N50值为1887 bp。总共47,716(46.86%),16,317(16.02%)和21,421-12,421(21.04%)分别在200-500bp,500-1000bp和1000-2000 bp的范围内。使用CD-HET-EST-4.5.4进一步组装成葡萄共曲面,共成41,806个ungenenes,平均长度为1498bp和N50值为2078 bp(表2.). 在所有的单基因中,8916(21.33%)、7585(18.14%)和14321(34.26%)在200-500之间 血压,500–1000 bp和1000–2000 英国石油公司。我们总共获得了32584份CDS,其中6714份(20.61%)、10000份(30.69%)和11600份(35.60%)在200-500之间 血压,500–1000 bp和1000–2000 英国石油公司。因为编码序列是高质量的;因此,进行了下游分析。重叠群、单基因和编码序列的长度分布如(图。2.一种)。对于IC-8219(C),IC-8219(T),T-9(C)和T-9(T)样品,总共22,993,14,620,29,542和11,019个CDS分别来自汇集的样品所有样本的最小CDS长度为297 BP的CD集。在对照样品中记录了15,444bp的最大CDS长度,而12,714bp是处理过的样品的最大CD的长度(表3.).
产卵引起的编码序列的注释和分类
为了获得完整的功能注释,所有组装的CDSS使用BLASTX程序(E值≤10)将所有组装的CDS与NCBI对齐非冗余(NR)蛋白质数据库− 5.).在32,584个注释的CDS中,31,817(97.65%)的注释CDS与NR数据库对齐,而767(2.35%)CDS在爆炸点击中没有代表。同源性搜索结果表明,大多数爆炸点击都来自v辐射(21931)。绿豆(v辐射)是黑克的近亲,因此黑克转录本具有较高的同源性。其余cds与序列相似V. Angularis.(8083)紧随其后V. Angularis.变量。棱角(6138)如图所示。2.湾击中的低表示V. MUNGO.表明其基因组序列在公共数据库中的信息很少。
在NR注释的基础上,分别对IC-8219 (T)和T-9 (T)样品组装的9169和7066个CDSs进行Blast2Go基因本体(GO)分类。IC-8219 (T)的CDSs分别为5879、4469和7186个,T-9 (T)的CDSs分别为4491、3428和5471个,可分为生物过程、细胞组分和分子功能3个主要领域。IC-8219品种的DEGs共分为46个亚类,其中生物过程、分子功能和细胞成分分别为20个亚类、13个亚类和13个亚类。2.c) 是的。T-9品种的DEGs分为45个亚类,其中生物学过程、细胞成分和分子功能分别为20、12和13个亚类。2.d) 是的。分类基因中最丰富的亚类包括生物过程范畴下的“代谢过程”和“细胞过程”。同样,“细胞”、“细胞部分”、“膜”和“膜部分”是细胞组分下的子类别,而“催化活性”和“结合”则是IC-8219和T-9品种分子功能下的子类别。
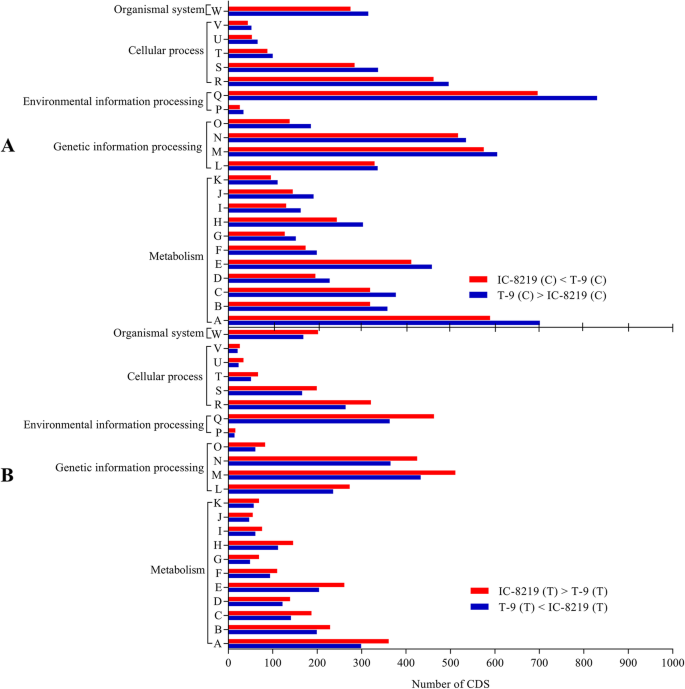
以确定V. MUNGO,预测CDSs的通路注释采用京都基因和基因组百科全书(KEGG) [23]. KEGG途径注释了IC-8219(T)中的4322和3551 cds(附加文件1.:表S1)和T-9 (T)(附加文件1.:表S1)样本分别分为代谢、遗传信息加工、环境信息加工、细胞过程和有机体系统五大类23个KEGG通路。在23条KEGG通路中,IC-8219和T-9在遗传信息处理类别下处理的样本中,最大的聚类是“翻译”(IC-8219 511个CDS, T-9 433个CDS)和“折叠”(folding)。(IC-8219 425 CDS和T-9 365 CDS),在环境信息处理下,细分为“信号转导”(IC-8219 463 CDS和T-9 363 CDS)。同样,在代谢类别下,“碳水化合物代谢”(IC-8219 361个CDS, T-9 299个CDS)是主要途径,而在细胞过程下主要途径是“运输和分解代谢”(IC-8219 321个CDS, T-9 264个CDS)。观察结果如图所示。3.并纳入附加文件表S22..
bruchid的DEGs产卵黑克
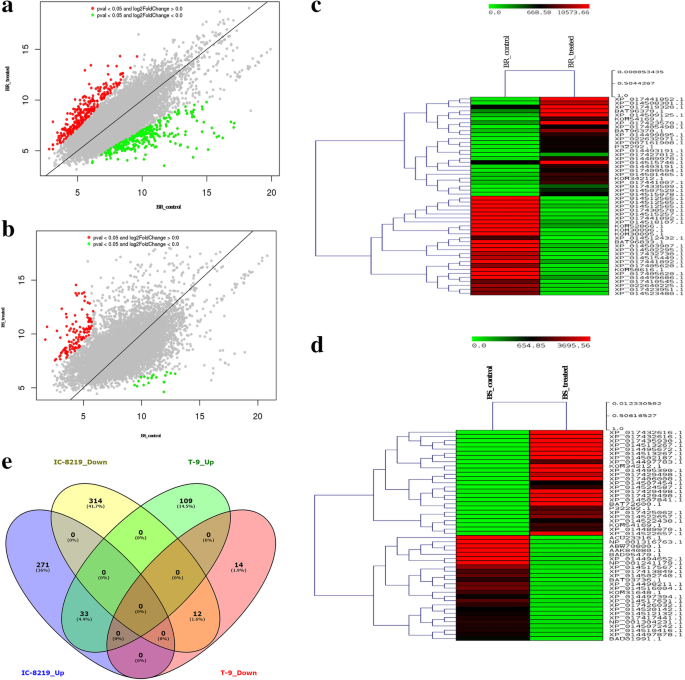
为了全面了解黑革兰氏对粗棘鱼产卵反应的转录表达,我们鉴定了几个在对照样本和产卵样本中表达差异的基因。将IC-8219和T-9两种产卵品种的转录本动态与对照进行了比较,并在散点图中进行了表达。4.A和B)。在IC-8219品种中,大量基因差异表达(附加文件3.:表S3)和T-9品种(附加文件3.:表S3)。使用DESeq软件在IC-8219品种中总共鉴定出630个显著的DEGs[24].在这些DEG中,与非产卵对照(在品种内)相比,上调304个基因并下调326个基因。对于T-9栽培品种,检测到168次,其上调142个基因,与非产卵对照(在品种内)下调下调26个基因。在热图中描绘的结果表明,与T-9栽培品种相比,IC-8219品种的DEG的数量更多(图。4.c和d)。与S(T)样品相比,IC-8219(T)样品(品种间)共鉴定出539个DEGs,其中169个基因表达上调,370个基因表达下调。因此,与T-9相比,IC-8219品种表现出169个上调基因和370个下调基因。IC-8219和T-9品种共有45个DEG,其中33个上调,12个下调(图。4.e) 是的。
富于富集
对IC-8219和T-9两种杂交品种进行了氧化石墨烯富集,得到了它们的功能分类。在IC-8219中,富集最多的氧化石墨烯类别是“代谢过程”,其次是“氧化还原过程”、“信号转导”、“氧化还原酶活性”、“细胞核”、“转录调节”、“蛋白质水解”、“水解酶活性”、“转移酶活性”、“跨膜转运”和“应激反应”(补充文件)4.:表S4)。而在T-9中,主导的GO类别是“氧化还原过程”,然后是“氧化还原过程”,“代谢过程”,“转录调节”,“线粒体”,“对压力”,“叶绿体”,“叶绿体”,“叶绿体”,“转移酶活性“,”核“,”信号转导“和”跨膜运输“(附加文件4.:表S4)。根据我们的数据,看来布鲁氏菌在黑革兰产卵介导的防御反应是一个复杂的过程。
DEGs的路径富集分析
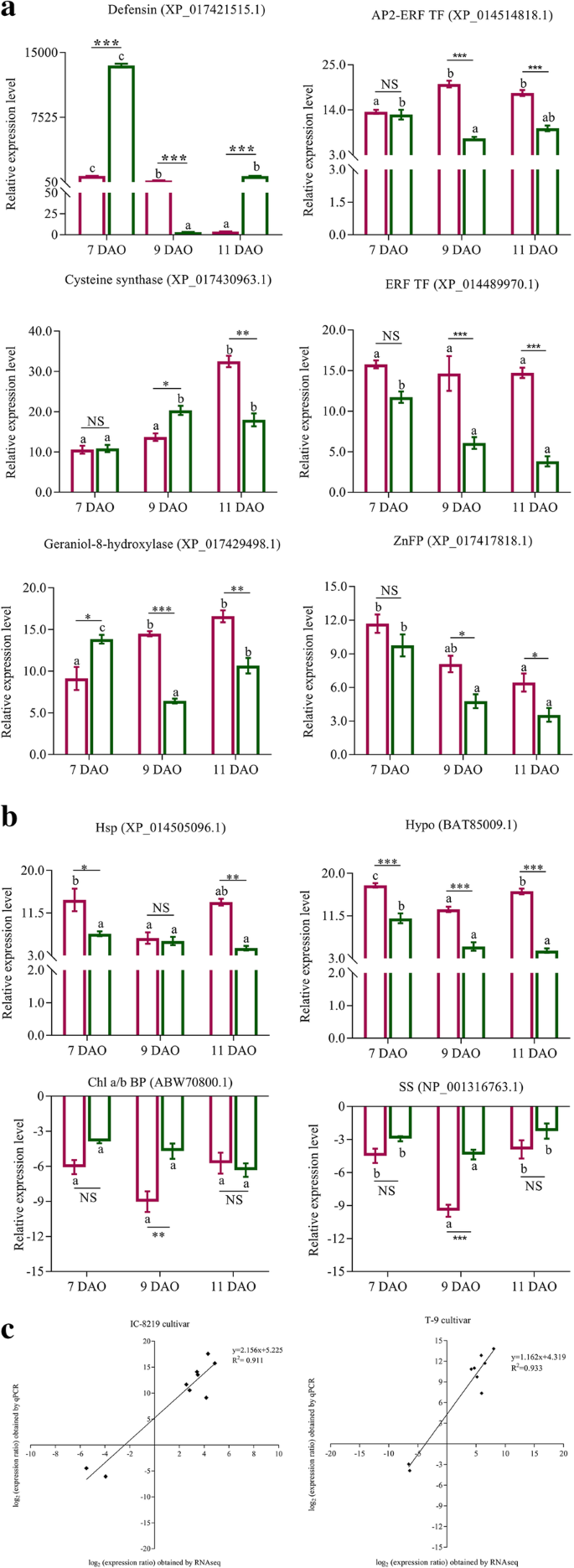
使用KEGG数据库鉴定出显示出在产卵黑克豆荚的显着变化的DEG的生物途径。途径分析显示了23例生物途径,其中10种途径在IC-8219和T-9品种之间常见。在这两个品种之间发现的常见途径主要与碳水化合物代谢(KO00051,KO00520),能量代谢(KO00196,KO00920),核苷酸代谢(KO00230),其他次生代谢物的生物合成(KO00943),翻译(KO03010),折叠,排序和劣化(KO03060,KO04141)和信号转导(KO04016)(附加文件5.:表S5)。总共23只IC-8219品种表现出参与碳水化合物代谢的涉及,其中发现22只度过22只DEG。比较地,在T-9栽培品种中显着诱导了与能量代谢相关的10°。涉及硫代谢(KO00920),异链类生物合成(KO00943)的DEGS和MAPK信号通路 - 植物(KO04016)显示出品种的显着倍差。除了在产卵时诱导的两次(KO00564,KO00600),IC-8219在与脂质代谢相关的IC-8219品种中的含量显着下调(KO00071,KO00073,KO00100,KO00100,KO00592)。脂质代谢的抑制醇与奥氧基宾生物合成和茉莉酸介导的信号级联有关。
国防相关基因的差异表达
布鲁氏菌产卵导致IC-8219中43(23诱导和20抑制)和11(10诱导和1抑制)防御相关基因的差异表达(表4.)和T-9品种(附加文件6.:表S6)。IC-8219中的这些防御基因被分为6个(4个诱导的和2个抑制的)经典水杨酸反应标记基因,如PR2、thaumatin、葡聚糖-内切-1,3-ß-葡萄糖苷酶,以及其他可能在HR期间在黑革兰豆荚中积累的PR基因。根据我们的数据,这4个诱导基因显示出> 在IC-8219中发现的大多数防御基因(9个)与转录后调控有关,其中8个基因是由于产卵引起的。这8个基因编码的五三肽重复序列蛋白(PPR)在RNA代谢中具有独特的作用。有趣的是,14个具有蛋白酶活性的防御基因(6个被诱导,8个被抑制)在IC-8219品种中高度表达。此外,两个品种的天冬氨酸蛋白酶活性(BAT85009.1)均为1度。在IC-8219中有两个编码nudix水解酶的基因被诱导或抑制,我们还观察到SA依赖的病原诱导防御基因lurpone-related8在IC-8219中的转录上调。
然而,T-9品种表现出一些防御转录物的差异表达,如内切几丁质酶、PR4(XP\u 014492850.1)、蛋白LURP-one-related 17(XP\u 014520000.1)、通用应激蛋白(XP\u 014495383.1)、蛋白霜霉病抗性6-like(XP\u 017417297.1)和天冬氨酸蛋白酶(BAT85009.1)。在T-9品种中,3种低温诱导蛋白(xp014512922.1、xp014512923.1、xp014512922.1)表达上调。
产卵黑克荚中的转录因子
转录因子(TFS)调节与特异性生理过程和基因型相关的大集下游基因的表达。我们发现分别在IC-8219和T-9品种中分别发现36(22诱导和14次抑制)和13(11诱导的和2抑制)TFS的差异表达。转录组分析显示,与T-9相比,IC-8219中表达的许多TFS基因差异(> 2倍)。在品种,AP2,乙烯响应,锌指,NAC,热应激响应性TFS系列差异表达。在IC-8219和T-9之间发现约5 TFS基因(XP_01450000160.1,XP_014489970.1,XP_01451481811.1和XP_014494652.1和XP_014494652.1。然而,MYB,Homeobox-leuucine拉链,Mad-Box TFS仅在IC-8219中表达。在IC-8219的不同TFS系列中,锌指蛋白质高度代表(8诱导和2抑制),然后得到AP2-ERF TF(3诱导),ERF转录因子(2诱导),含NAC结构域的蛋白质(1诱导和1抑制),热应激响应蛋白(2诱导),Homeobox亮氨酸拉链(1诱导和1抑制),my(1)诱导疯了箱(1)(表5.). 在不同的锌指TFs中,SNO调控基因1(SRG1)是IC-8219中最丰富的TF。
苯丙素与氧化应激通路差异表达基因
苯丙烷型途径的基因在植物防御反应中发挥着至关重要的作用对抗生物应力[25].在IC-8219栽培品种中发现了与苯丙砜途径相关的17℃(14个诱导和3抑制)(表6.).在这些含量中,咖啡酰基CoA O-甲基转移酶显示了一个原木2.折叠变化> 然而,在T-9品种中,只有7个DEGs被发现与苯丙酸途径有关(附加文件)6.:表S6)。
苯丙素、生物碱和萜类途径的各种代谢过程已知通过解毒酶细胞色素P450氧化酶(cyp450)调节。在IC-8219中发现6个CYP450基因(5个是诱导的,1个是抑制的)表达差异6.:表S6),而T-9品种中只有一个CYP450基因上调(附加文件6.:表S6)。
热休克蛋白也被报道参与植物对伤害的防御反应。在编码热休克蛋白的7个DEGs中,有5个是通过布鲁氏菌产卵诱导的,只有2个被抑制(另见文件)6.:表S6)。在T-9品种中,观察到仅编码HSP的两次进行的上调(附加文件6.:表S6)。
IC-8219和T-9的细胞壁强化相关基因在对粗粒蜂产卵的反应中也有差异表达。在IC-8219品种中,发现了16种与细胞壁重塑相关的DEGs(2种诱导,14种抑制)6.:表S6)。然而,在T-9品种中,只有一个与细胞壁修饰相关的DEG上调(附加文件6.:表S6)。
ROS作为调节人力资源介导的细胞死亡的重要信号。植物制定了复杂的机制,以最大限度地减少ROS过度积累的有害影响。我们发现16次(10诱导和6个压抑)与IC-8219品种中的ROS解毒有关(附加档案6.:表S6)。编码cystathiionine β-synthase (CBS)结构域的蛋白(CDCP)是铁氧化还原蛋白- trx系统中硫氧还蛋白的重要氧化还原调节因子,其编码的DEGs在IC-8219中表现为高度(6)诱导,其次是泛素氧化酶(1)诱导,超氧化物歧化酶铜伴蛋白(1)诱导,nifu样蛋白4(1)诱导,1- cys过氧化物还蛋白(2被抑制),超氧化物歧化酶[Fe](1被抑制),可能的谷胱甘肽s -转移酶(1被抑制),可能的过氧酶(1被抑制)和硫氧还蛋白样的1- 1(1被抑制)。在T-9品种中,3个与氧化应激相关的CBS结构域含蛋白(1诱导)和可能的2-羟戊二酸/铁(II)依赖双加氧酶(2诱导)差异表达(附加文件6.:表S6)。
转录重编程相关基因的表达谱
F-box和泛素介导的蛋白质水解是植物信号转导、细胞周期和胁迫反应(生物和非生物)等关键细胞过程的调节因子[26]. 在IC-8219品种中,23个(14个诱导和9个抑制)DEG编码假定的E3泛素蛋白连接酶、F-Box蛋白、泛素结合酶E2、蛋白AMN1同源物、含BTB/POZ结构域的蛋白、含海带重复序列的蛋白,由于布鲁氏菌产卵,F-box/kelch重复蛋白在表达上表现出显著差异(附加文件)6.:表S6)。然而,在T-9品种中,只有4个DEGs被差异表达(附加文件)6.:表S7)。
蛋白激酶/磷酸酶在响应各种应力信号时也发挥着重要作用。由于Bruchid蛋形,我们发现IC-8219中的37种差异表达的蛋白激酶/磷酸酶基因。诱导约25个激酶/磷酸酶,而12在IC-8219中抑制12。大部分编码丝氨酸/苏氨酸 - 蛋白激酶(7诱导的),其次是蛋白质磷酸酶2C(3诱导和1抑制),受体样蛋白激酶(2诱导和2抑制),可能酪氨酸 - 蛋白磷酸酶(3诱导)和CBL相互作用的丝氨酸/苏氨酸 - 蛋白激酶(附加文件6.:表S6)用IC-8219表示。分裂原活化蛋白激酶激酶3 (MAPKK3) (XP_014503615.1)是参与大多数作物抗性/易感性反应的重要激酶信号通路基因,在IC-8219中被下调。在T-9品种中,我们发现与信号转导途径相关的DEGs较少6.:表S6)。
我们还发现4个高尔基定位的Ca表达上调2+IC-8219品种的阳离子逆向转运蛋白基因对粗粒蜂产卵的响应可能与胞质Ca有关2+氧化应激期间的流入(附加文件6.:表S6)。在T-9品种中,只有3个CA2+信号传导相关基因显示出调控(附加文件6.:表S6)。
与植物激素信号转导相关的DEGs的鉴定
植物激素诱导植物对昆虫产卵的多种反应。在IC-8219中,记录到与生长素信号通路相关的8个DEG(2个诱导和6个抑制),包括吲哚-3-乙酸诱导蛋白ARG2(1个诱导)、生长素反应蛋白IAA29(1个诱导)、脱落酸不敏感5-样蛋白(2个抑制)、1-氨基环丙烷-1-羧酸氧化酶(1个抑制),吲哚-3-乙酸氨基合成酶(1抑制)和生长素反应蛋白(1抑制)(附加文件6.:表S6)。然而,只有4个参与ABA信号通路的激素相关基因在T-9中表达。吲哚-3-乙酸诱导蛋白ARG2(P32292.1)由两个品种共享(附加文件S6:表S6)。
代谢和生物合成相关基因的差异表达
为了响应布鲁氏菌的产卵,植物可能会改变其许多代谢途径。基于GO和KEGG途径富集分析,IC-8219品种分别表现出与碳水化合物代谢和脂质代谢相关的29和16个DEGs的差异表达。有趣的是,大多数(28)DEGs在IC-8219的产卵荚中被抑制(另一个文件)7.:表S7)。IC-8219的脂质代谢DEGs也出现了类似的(14个下调)趋势8.:表S8)。在品种T-9中,只有两个碳水化合物代谢的DEGs被显著抑制(额外文件9:表S9),而没有脂质代谢DEGs。
此外,GO和KEGG途径富集分析揭示了与次级代谢途径相关的几个基因的上调,包括异黄酮生物合成(ko00943)和托烷、哌啶和吡啶生物碱生物合成(ko00960)。显然,12个与次生代谢产物产生相关的基因(9个被诱导,3个被抑制)在IC-8219品种中被发现差异表达(附加文件)6.:表S6)。而在T-9品种中,这类基因有7个显著上调(附加文件6.:表S6)。
用qPCR验证DEGs的表达
为了验证转录组数据,我们使用额外文件中列出的引物(QPCR)分析通过数量PCR(QPCR)分析来定量在品种中表示的10(8个和2个和2个下调)所选基因的相对表达水平10.,表S10。这些基因编码防御素(XP\u 017421515.1)、AP2乙烯反应转录因子(XP\u 014514818.1)、IAA诱导蛋白(P32292.1)、半胱氨酸合酶(XP\u 017430963.1)、香叶醇-8-羟化酶(XP\u-17429498.1)、乙烯反应转录因子(XP\u 014489970.1)、锌指蛋白(XP\u 017417818.1)、热休克蛋白(XP\u 0145096.1),假设蛋白(BAT85009.1)、叶绿素a/b结合蛋白(ABW70800.1)和蔗糖合酶(np001316763.1)。以基因延伸因子1α(ef1α)作为内对照。研究了所选基因的时间表达模式,以了解两个品种的相对丰度。通过产卵诱导或活化AP2样乙烯反应性转录因子等转录因子表达防御素基因。qPCR分析表明,差异表达的基因遵循RNA序列数据显示的一致的折叠变化方向(图。5.A和B)。此外,线性回归分析显示QPCR和RNA-SEQ数据之间的正相关,证实RNA-SEQ数据一致或可靠(图。5.C)。
抗消化酶的定量测定
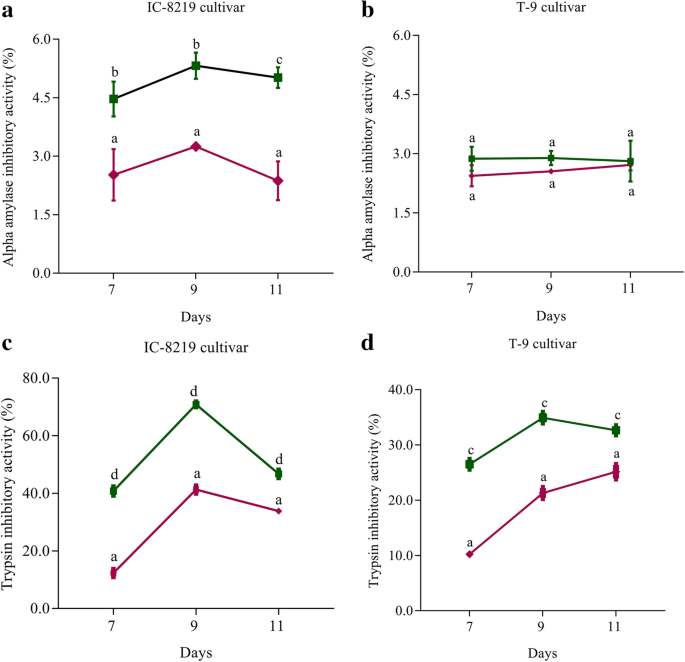
消化酶抑制剂蛋白如α-淀粉酶抑制剂(α-AI)和胰蛋白酶抑制剂(TI)的积累主要诱导昆虫草本毒理处[27]. 因此,我们对这两个品种的豆荚成熟种子中α-AI和TI的积累进行了定量研究。与对照相比,两个品种产卵荚中α-AI和TI的活性均较高。IC-8219的α-AI活性显著高于11 比T-9(图。6.a).与对照相比,产卵的T-9品种α-AI活性显著升高(图1)。6.b)。然而,与它们的对照相比,在栽培品种的Bruchid-Ovoposited豆荚中的Ti-Activity显着较高,但是在IC-8219中,与对照和T-9相比,在产卵9天后,Ti活性最高(> 70%)(图。6.c和d)。
讨论
卵代表着对寄主植物未来的威胁,因此,如果宿主植物能够预见即将到来的损害,那么防御的预先激活就是一种优势。在植物中已经观察到对产卵的直接和间接反应[1.,28]. 然而,由于雌性昆虫产卵,在寄主中发生的分子变化的信息是有限的。我们研究了未成熟黑革兰豆荚对bruchids产卵的反应,并分析了中抗(IC-8219)和感病(T-9)品种豆荚的比较转录谱。转录组分析结果表明,无论是中抗品种还是感病品种,产卵都触发了许多防御相关基因的激活。在以往对IC-8219品种bruchid黑荚产卵过程中转录动态的研究中,我们发现卵子的产卵引发了防御素、PR、脂氧合酶、信号转导通路等多种防御相关基因的上调[20]. 本研究提供了黑革兰IC-8219和T-9品种转录本变化的综合数据。差异表达基因的主要功能类别分为防御相关基因、氧化应激、次级代谢产物的产生、信号转导途径和其他几种防御反应基因。类似的反应也出现在拟南芥由于粉蝶产卵[12.和obiopositioning ofxanthogaleruca luteola.在榆树[29].
ROS积累在布鲁氏菌防御中的作用
植物防御反应的最早证据是产生ROS作为HR反应的一部分。产卵引起局部ROS积累和细胞死亡,主要由水杨酸(SA)途径介导[12.,13.].我们发现ROS积聚在卵形革兰品种的ovoposited豆荚中由于Bruchids,并且可以通过激活全身获得的阻力来参与防御响应[30,31].在龙葵,H的积累2.O2.在产卵地点Spodoptera exigua.在拟南芥,但只有最后一个物种对昆虫产卵有明显的HR-like反应[12.,13.,14.].ROS的积累导致植物激素、SA的增加,以及SA应答基因的诱导[12.,13.].在黑克豆荚中,我们发现了一种血红蛋白的途径相关基因,表明HRS的产卵引发了HRS。
Bruchid产卵诱导的防御相关基因
水杨酸(salicylic acid, SA)是植物抗虫基因表达的一种有效中介物[32].据报道,SA在对昆虫卵的反应中积累了高水平,这表明SA途径参与了对产卵的反应[33,34,35,36].我们观察到Bruchid蛋铺在卵子蛋白后,观察到PR2,葡聚糖-1,3-β-葡糖苷酶,山蛋白(PR5)和病原体相关蛋白质的表达。四个PR相关基因[病原体相关蛋白2样(XP_014509125.1),葡聚糖endo-1,3-β-葡糖苷酶(XP_014502683.1),胰岛蛋白样蛋白(XP_014520780.1)和病原体相关蛋白质(XP_017421074.1)响应于产卵,在IC-8219中显着诱导,而在T-9栽培品种中仅占调高了一个PR相关基因[Condochitinase PR4(XP_014492850.1)]。通过在其他作物中观察到的黑克中的卵巢诱导SA响应基因PR-1 [5.,12.]SA信号中未检测到其表达拟南芥突变体eds1-2, sid2-1和npr1-1 [13.].在拟南芥,ofiocipingP. Brassicae.触发SA响应基因的积累和表达[12.],并表明一个功能性的SA通路是蛋鸡诱导防御基因表达、ROS积累和局部细胞死亡所必需的[13.].
我们还发现了少量茉莉酸(JA)介导的基因,这可能是由于SA抑制了JA信号通路。IC-8219中3个氧脂素生物合成基因的下调表明,产卵介导的防御反应仅限于众多ja介导的防御性状中的一个独特子集[12.].已知SA途径的激活是在植物中对JA信号通路进行拮抗作用,然而,尚未阐明该机制。已经取得了重大进展拟南芥识别SA在JA通路中发挥拮抗作用的特定靶点[37,38].
植物蛋白酶抑制剂(PIS)构成了抗害虫的最重要的植物防御性状之一[39,40].这些蛋白酶具有不同的功能,如启动各种信号传导过程的激活,释放信号肽,并且最终调节各种信号途径触发的抗扰度,全身获得性阻力,并引起的全身性阻力。参与节肢动物消化,丝氨酸,半胱氨酸 - 和天冬氨酸蛋白酶有三个主要亚类,根据其活性位点组的反应性氨基酸对[41].我们发现在与T-9相比时,在Bruchid过度定位时,在IC-8219中诱导了几次在IC-8219中诱导了几次。IC-8219中酶抑制剂的表达可以是从Bruchid侵扰的有效保护模式。具有天冬氨酸活性酶活性的DEG的过表达由SA,JA和乙烯(ET)介导。为减少与防御相关的健身成本,植物通过在SA和JA信号通路之间进行交叉通信,通过各种群体报告了它们的诱导防御反应[37,42,43].
IC-8219的防御应答基因多为五肽重复序列(pentatricoptidrepeatcontaining proteins, PPRs),提示转录后修饰可能是黑克蜂产卵定位介导的防御应答基因的重要特征。据报道,PPRs参与了植物细胞器中多种不同的转录后过程[44,45,46]也可以通过逆行信号传导影响核基因表达[47].此外,最近的研究表明,PPRS也参与了电子传输,反应性氧物种生成和非生物胁迫性[48].在拟南芥,PPR蛋白家族基因与肿瘤的发生有关拟南芥防御生物和非生物胁迫的防御反应。例如,PPR蛋白家族的成员,MEF11 / LOI1基因,响应于伤害和病原体攻击,参与二次代谢物(异戊二烯)的线粒体RNA编辑和生物合成拟南芥[49,50].公园和他的同事[51[证明MiRNA400引导抑制PPR1和PPR2蛋白拟南芥使植物更容易受到细菌和真菌病原体的攻击。因此,在黑革兰PPRs似乎参与防御布鲁氏菌卵子。
在IC-8219品种中,我们还发现nudix水解酶的差异表达,该水解酶催化核苷二磷酸的水解,如核苷酸糖(ADP-葡萄糖)[52,53,54]和吡啶核苷酸,如NADH, NADPH和8-oxo-GTP [55,56]. 核苷二磷酸是主要的代谢中间产物和信号分子,通常对细胞有毒。因此,bruchid卵子中的nudix水解酶可能通过解毒过量的核苷酸二磷酸参与维持细胞内稳态。这些房屋清洁和氧化保护酶的功能失调导致细胞内稳态的破坏,这可能严重影响植物的病原体防御和激素信号通路[57].
转录因子在Bruchid蛋诱导防御中的作用
防御反应基因的表达是由转录因子的激活介导的;因此,识别这些TFs对于防御反应至关重要。而信号分子在TFs表达中起重要作用;例如,SA抑制JA生物合成下游的JA途径和JAZ–COI1复合物TFs以及几种TFs的表达[58,59]. 我们发现这两个品种的布鲁氏菌产卵都激活了几个乙烯反应因子(ERFs),包括AP2样ERF(APETALA2/乙烯反应转录因子)基因。GCC盒是AP2/ERF-TF成员的结合位点,包括转录因子ERF和ORA59,后者激活植物防御素基因PDF1.2[60,61]. SA对TF-ORA59有负性调节作用,但对ERF1没有负性调节作用,表明SA对JA反应的拮抗作用PDF1型.2.基因表达(59,62,63]. 在与布鲁氏菌卵子相互作用的过程中,黑革兰中也可能存在类似的串扰。
在昆虫取食过程中,一氧化氮(NO)的产生是一个众所周知的事实[64]. 在IC-8219品种中,转录因子下5个DEGs属于锌指tfsrg1。SRG1是植物免疫过程中一氧化氮(NO)活性的正调控因子[65].NO是植物中的气体亲脂性自由基和关键信号分子。与T-9相比,IC-8219中这些TFS的这些TFS的过表达可以与增强的电阻水平相关联。
转录因子NAC和MYB参与植物对昆虫食草性的防御反应[66这些TFS在IC-8219中丰富。NAC和Zn手指TFS都是诱导的Spodoptera littoralis.喂养的拟南芥[67].已经发现SA介导的MYB TFS诱导在国防反应中发挥着重要作用拟南芥[68].黑革兰中的MYB-TFs可能负责调控bruchid产卵过程中苯丙素途径的各个步骤。
苯丙素和抗氧化酶的重要性
次级代谢产物生产对于植物至关重要,因为它有助于对各种昆虫草食虫,病原体和其他竞争对手的诱导型和本构植物防御反应贡献[69,70],并吸引拟寄生物[71].苯丙素是植物中重要的次生代谢物产生途径之一,被发现与植物对昆虫食草动物和植物病原体的抗性增加呈正相关[72,73].IC-8219品种中苯丙素途径的大量基因表达量的上调表明这些基因在抗粗线蛾产卵中起重要作用。因此,次生代谢物的产生可能是黑克虫对粗鲢产卵的共同防御机制。
该植物的氧化地位与宿主植物抗性(HPR)相关,以至于许多食草动物和病原体[74]这导致由不同抗氧化酶解毒的ROS产生。总之,在IC-8219中富集具有抗氧化活性的16℃,响应于含CBS结构域的蛋白质(CDCP)的Bruchid产卵占主要比例。这些CDCPS似乎在许多抗氧化酶的调节中发挥着重要作用,从而有助于在Bruchid产卵期间维持黑克内的细胞内氧化还原平衡拟南芥和大米(75].
细胞色素P450 (CYP)超家族促进植物生长和发育,并通过多种生物合成和解毒途径来保护植物免受各种胁迫[76]. IC-8219和T-9品种在这一类别下分别表现出6和1 DEGs的差异表达,表明CYP450s可能参与防御化合物的生物合成,如酚类及其结合物、类黄酮、香豆素、木脂素、硫代葡萄糖苷、氰苷、苯并恶嗪酮、类异戊二烯、生物碱。鹰嘴豆中的一种模拟食草动物Helicoverpa Armigera研究发现了CYP450家族的几个基因的诱导[77].
此外,我们还观察到,由于bruchid甲虫产卵,sHSPs在IC-8219和T-9中的差异表达。这些sHSPs在黑革兰诱导HR非依赖性防御反应中具有独特的作用烟草对抗生物应激[78].
信号转导通路对布鲁氏菌产卵反应的影响
植物识别与草食动物相关的分子模式(HAMPs),这种模式通常依赖于与诱导子识别有关的受体,通常称为细胞表面模式识别受体(PRRs)相互作用[36]包括像受体样激酶(rlks)[79].其中4种RLKs在黑克中表达上调,表明这些RLKs可能是对产卵反应的第一道防线。拟南芥RLK,凝集素受体激酶(LECRK-I.8A),参与了认可Pieris Brassicae.鸡蛋是一种L-(豆科)类型的卵子[13.,34].
钙在植物细胞的信号网络中起重要作用,并调节植物对昆虫的反应。在IC-8219中,我们鉴定了钙皮蛋白B样蛋白(CBL) - 互换丝氨酸/苏氨酸 - 蛋白激酶,其是钙传感激酶。此外,重大诱导编码酵母GDT1的基因(GCR1依赖性翻译因子1),Golgi局部CA2+/H+逆向转运(80共享同调拟南芥(类似AtGDT的2)[81[这些激酶可能会导致IC-8219品种细胞中的钙稳态。因此,细胞内钙浓度的变化可能已激活CBL相互作用的丝氨酸/苏氨酸 - 蛋白激酶在黑色革克中。最近,发现大豆受体样激酶对大豆和拟南芥中与草本危险信号(HDSS)相关的感知信号[82].
丝裂原活化蛋白激酶(MAPK)是昆虫取食过程中参与信号转导的重要调控蛋白[83].IC-8219中MAPK基因表达下调。我们发现了3个蛋白酪氨酸-蛋白磷酸酶的DEGs,这可能是负反馈抑制MAPK基因的原因[84].
蟾蜍在黑克防范对Bruchid产卵中的作用
在我们的研究中,除了吲哚-3-乙酸(IAA)诱导的蛋白质ARG2和生长素反应蛋白IAA29在IC-8219和T-9中外,布鲁氏菌产卵并没有显著触发两个品种中各种激素相关基因的诱导,还鉴定了脱落酸β-葡萄糖基转移酶。这两个品种植物激素基因的上调可能参与了细胞分裂和肿瘤的形成,使卵从表面排出,阻止孵化幼虫的进入[3.,85,86].
初级代谢产物的下调
由于Bruchid Ofiosition在黑革克豆荚上,下调涉及细胞壁代谢,碳水化合物代谢和脂质代谢的几种基因。初级代谢过程的下调响应于黑克的产卵表明,能量被转移以保护免受布鲁克灭绝的影响。发现上述基因的下调拟南芥为了回应斑蝶的产卵[12.].
蛋白质抑制剂在产卵过程中的作用
许多来自植物的杀虫蛋白和分子都可以减缓昆虫摄入后的生长发育,包括α-AIs [87]. α-AIs不仅参与了布鲁氏菌消化酶的损伤,而且可以作为布鲁氏菌的生防菌[88]. 植物利用它们对付鳞翅目、鞘翅目、双翅目和同翅目的各种食草昆虫[89,90].
蛋白酶抑制剂(PIs)如胰蛋白酶抑制剂(TIs)的积累也会干扰昆虫肠道的正常生理过程[91].它主要抑制蛋白质的消化,从而导致必需氨基酸的缺乏,发育迟缓,死亡率和/或生殖能力下降[92].与T-9品种相比,IC-8219中的较高Ti活性可能是IC-8219的重要特征,用于对Bruchids的中度抗性。在许多Bruchid抗性品种的Mungbean中发现了胰蛋白酶抑制剂的高水平积累[93].
结论
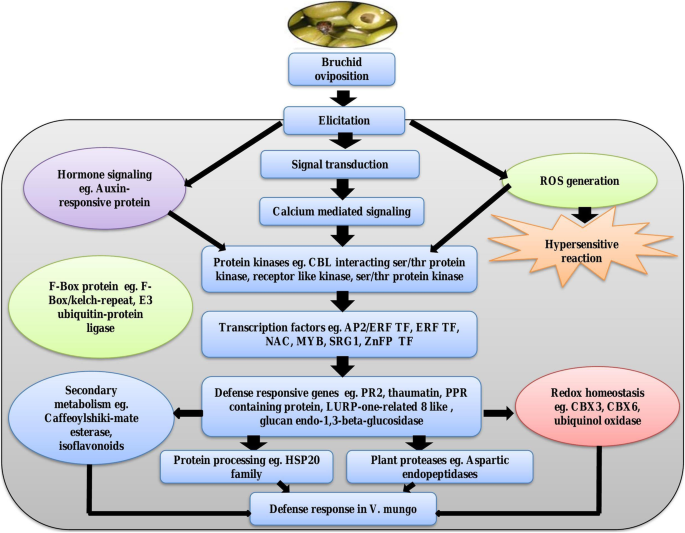
本研究采用比较转录组测序技术,研究了中度抗性品种IC-8219和敏感品种T-9的黑克豆荚对粗瘿蚊产卵的转录动态。我们的数据显示了一个有趣的发现,黑克豆荚对最初的产卵反应,并迅速重置它们的感知和信号转导系统,并为孵化的幼虫的损害做好准备。IC-8219和T-9中大部分与信号传导和下游防御相关的deg表达均上调,且差异显著。bruchid egg laying可能与一些关键DEGs的功能和代谢途径的变化有关,如参与ROS去除系统、植物激素信号通路,主要是SA通路。有趣的是,SA通过下调它们来拮抗ja介导的通路。根据转录组数据,图中显示了黑克鱼对粗鲢产卵反应的假想图。7..这些结果将有助于阐明响应Bruchid蛋置于黑革克的响应的分子机制,并提供黑革克防御基因的有价值的资源。本研究的未来挑战是研究SA / JA串扰,并确定SA如何与JA信号相互作用以抑制当前研究中观察到的JA依赖性基因转录。此外,过表达防御素对于Bruchid抗性的黑克基因是有趣的,了解抵抗程度。
目前研究的结果与最近关于鉴定QTL控制BRUCHID抗性的鉴定的报告v辐射[94].研究发现,一个包含r基因家族和TFs等多种候选基因的主效QTL负责黑克蓟的防御。其中一些基因,ERFs,植物编码受体(STPK),锌指蛋白,F-box蛋白也出现在我们的转录组谱中,这进一步证实了我们的数据。
方法
实验植物与昆虫
从印度脉冲研究所(IIPR),Kanpur和温室播种,获得两种品种(IC-8219和T-9)的黑克的种子。胼胝体布鲁氏菌在25℃和65-70%相对湿度(RH)的实验室中的塑料容器中保持在塑料容器中的干燥黑革兰片。植物在温室条件下提高到成熟度。Bruchid成年人(5名男性和10名女性)被释放在温室里的温室覆盖的荚覆盖的豆荚中,以便排卵。在昆虫释放7天后或者一旦我们看到沉积在荚壁上的鸡蛋后,就会收集样品。成熟豆荚上的成年女性鸡蛋约6-7天孵化[95].
DAB测定
Bruchid非产卵(对照; c)和产卵(处理; t)从7天产卵(Dao)后的栽培品种和浸渍在3,3“二氨基苯甲酸(DAB)溶液中(1mg / ml;pH 3.6)在37°C时用于过夜,如[96].
RNA提取和质量控制
从7日采集的两个品种的未产卵(C)和产卵(T)植株的两个生物复制体中提取总RNA 天。7天后从发育中的种子中提取RNA 利用IC-8219和T-9品种的产卵天数进行RNAseq分析。按照制造商的说明,使用PureLink®植物RNA试剂盒(Ambion)提取总RNA。提取的RNA样品分别在1%变性RNA琼脂糖凝胶和Nanodrop/Qubit荧光计上进行质量和数量检测。使用260/280比值为1.8–2.0和260/230比值为2.0–2.4的RNA样本进行进一步分析。这些RNA样本最终用于Illumina测序和基因表达分析。
Illumina测序和数据处理
总而言之,使用Illuminatruseq链状mRNA样品制剂试剂盒从总RNA样品中制备八个RNA阵挛的成对结束文库。使用使用Poly-T附着的磁珠使用从总RNA富集的mRNA产生cDNA文库,然后使用上标II和Act-D混合物进行酶促碎片和第1链cDNA转化以促进RNA依赖性合成。使用第二链混合物合成第一链CDNA至第二链。将DS CDNA纯化Ampure XP珠子,然后通过有限数量的PCR循环进行尾翼,衔接子连接和富集。使用高灵敏度D5000屏幕磁带在4200分接站系统(Agilent Technologies)中分析了PCR富集的库,根据制造商的说明,使用高灵敏度D5000屏幕磁带。在NextSeq 500(2×150bp)上测序配对结束库,以在所有八个样本中生成408bp和475 bp之间的尺寸范围的图书馆。来自IC-8219(c),IC-8219(T),T-9(C)和T-9(C)和来自每个样品的2个生物重复)的测序原始数据被加工,以获得高质量的合作读数使用Trimmomatic v0.35(http://www.usadellab.org/cms/index.php?page=trimmomatic)和适配器序列、模糊序列(未知核苷酸“N”大于5%的序列)和低质量序列(质量阈值大于10% (QV) < 20 Phred评分的序列)被内部脚本删除。得到的高质量(QV > 20),对端reads用于从头组装。上述工作是通过古吉拉特邦艾哈迈达巴德的Xeleris技术服务机构进行的。
从头转录组分析、功能注释和差异基因表达(DGE)
将所有样本过滤后的高质量reads汇集在一起,使用Trinity de novo汇编器(V2.5) (http://trinityrnaseq.github.io)[97],默认K-mer大小为25,最小contig长度为200。然后使用CD-HIT-EST-4.5.4 (http://www.bioinformatics.org/downloads/index.php/cd-hit/cd-hit-v4.5.4/)去除组装过程中产生的异构体生成单基因的软件。只有那些被发现有> 下游分析考虑80%覆盖率和3倍读取深度。利用TransDecoder-v2.0对产生的单基因进行编码序列预测。
使用DIAMOND程序(BLASTx模式)对CDS序列进行功能注释DIAMOND (BLASTx模式)(https://github.com/bbuchfink/diamond/)这有助于找到对NR的基因的同源序列(http://www.ncbi.nlm.nih.gov/)来自NCBI。为了将来自池的CDS中的每一个样本中的每一个的CDS识别,使用BWA(-mem)工具包将来自每个样本的汇集的CDSS读数映射到最终的池CDS。从得到的映射计算读数(RC)值,并且考虑了具有> 80%覆盖率和3x读取深度的CDS进行差异表达分析。DESEQ包的负二项份分布模型(版本1.22-http //用户/安德斯/ DEseq / www.huber.embl.de),计算差异基因表达。fold change (FC)值大于2的cds被认为上调,小于2的cds被认为下调。FDR值≤0.05为显著。
基因本体论与生物途径分析
BLAST2GO程序(BLAST2GOPRO)[98]用于对GO术语进行赋值,并对差异表达的基因进行注释,将其分为生物过程、分子功能和细胞成分三大类。后来,京都基因和基因组百科全书自动注释服务器KAAS:http://www.genome.jp/keg/kaas/)用于预测差异表达基因的途径。BBH(双向最佳击中)[99使用KAAS自动服务器的选项来指定KEGG同源(KO)术语。
定量PCR (qPCR)验证
在产卵后7、9和11天采集样品,从两个品种的非产卵(C)和产卵(T)植物的3个生物重复中提取总RNA。利用Oligo Perfect Designer软件程序(http://www.thermofisher.com/oligoperfect.html/)GC含量为55-60%,a tm > 50 °C,引物长度为18-22核苷酸,预期产品尺寸为100-215 英国石油公司。用于qPCR的引物及其靶基因列表在附加文件中列出10.,表S10。利用PureLink从两个品种的产卵和非产卵样品中提取总RNA™ 植物RNA试剂(Ambion)。用PrimeScript合成cDNA™ 带有gDNA擦除器的RT试剂盒(Clontech,美国),并根据SYBR®PremixExTaq中给出的制造商说明遵循实时PCR协议™ (Tli RNase H Plus(美国克朗泰克)。应用生物系统StepOnePlus中使用的温度曲线™ 实时PCR系统(美国应用生物系统公司)为95 30°C s、 ,40岁 95周 °C持续5分钟 S和60 30°C S然后在60℃进行熔融曲线阶段 °C,适用于1 以延伸因子(EF-1α)基因的引物作为内源对照。组织样本用于qPCR分析和2-ΔΔCT方法用于推导每个样品的相对定量(RQ)值,基于与参考基因的标准化。使用两个生物重复进行PCR分析,并使用所设计的基因特异性引物一式三份进行每次反应。平均RQ值用于分析。
淀粉酶(α-AI)和胰蛋白酶抑制剂(TI)测定
用20%乙醇提取了产卵(T)和非产卵(C)植物未成熟种子的总蛋白 mM磷酸盐缓冲液(pH 6.9). 对于TI活性,粗蛋白(50 μl)与20 μl牛胰蛋白酶(1 毫克 毫升− 1.)通过Nair等人描述的程序培养。[100.].
α-AI活性的测定采用还原糖定量法[101.].简而言之,根据Gupta等人所述的方案,将α-淀粉酶和粗蛋白加入淀粉和二硝基水杨酸(DNSA)试剂[101.].
统计分析
数据以平均值表示 ± 扫描电镜。组内和组间的差异通过组内和组间混合方差分析进行评估。事后分析采用Bonferroni方法,置信度为95%。用统计软件R进行分析[102.].
数据和材料的可用性
支持本文结束的数据集可在RSCADION Number PRJNA604405下的NCBI序列读取存档(SRA)中获得(http://www.ncbi.nlm.nih.gov/sra./ prjna604405)。
缩写
- 罗斯福:
-
错误发现率
- 客户尽职调查:
-
编码序列
- 度:
-
差异表达基因
- 人力资源:
-
过敏反应
- ROS:
-
活性氧
- 业务伙伴:
-
碱基对
- cDNA:
-
互补脱氧核糖核酸
- 去:
-
基因本体论
- NR:
-
冗余蛋白质数据库
- NCBI:
-
国家生物技术信息中心
- 爆破:
-
基本的局部比对搜索工具
- KEGG:
-
京都基因和基因组百科全书
- TF:
-
转录因子
- QRT-PCR:
-
定量实时聚合酶链反应
- 信使核糖核酸:
-
信使核糖核酸
- mM:
-
米尔米鼹鼠
- αai:
-
α-淀粉酶抑制剂
- TCA:
-
三氯乙酸
- DMSO:
-
二甲基亚砜
- 文学士P.拿拿淋:
-
Nα.-Benzoyl-DL-arginine p-nitroanilide盐酸盐
- O.C:
-
度摄氏
- μl:
-
微升
- ds cDNA:
-
双链互补脱氧核糖核酸
- 纳米:
-
纳米
参考文献
- 1。
Hilker M, Fatouros NE。植物对昆虫卵沉积的反应。2015;7(60): 493-515。https://doi.org/10.1146/annurev-ento-010814-020620.
- 2.
关键词:产卵,植物,感知,信号转导,分子生物学足底。2013;238(2):247 - 58。https://doi.org/10.1007/s00425-013-1908-y.
- 3.
Doss RP,Oliver JE,Proebsting WM,Potter SW,Kuy S,Clement SL等。Bruchins:刺激肿瘤形成的昆虫源性植物调节剂。PNAS公司。2000;97(11):6218–23.https://doi.org/10.1073/pnas.110054697.
- 4.
Petzold-Maxwell J, Wong S, Arellano C, Gould F.宿主植物直接防御其特殊食草动物的卵,Heliothis subflexa. 埃科埃托。2011;36(6):700–8.https://doi.org/10.1111/j.1365-2311.2011.01315.x.
- 5.
Solanum dulcamara对一种昆虫食草动物的卵的反应包括产生双氧水。植物细胞学报。2017;40(11):2663-77。https://doi.org/10.1111/pce.13015.
- 6.
梅恩斯T,希尔克M。通过植食性昆虫产卵诱导植物滑膜素。化学经济杂志。2000;26(1):221–32.https://doi.org/10.1023/a:1005453830961..
- 7.
Fatouros Ne,Dicke M,Mumm R,Meiners T,Hilker M.蛋寄生虫的觅食行为利用化学信息。表现ecol。2008; 19(3):677-89。https://doi.org/10.1093/beheco/arn011.
- 8.
Büchel K, malsky S, Mayer M, Fenning TM, Gershenzon J, Hilker M, et al.;植物如何给早期食草动物警报:挥发性萜类吸引寄生物虫卵侵染榆树。应用生态学报。2011;12(5):403-12。https://doi.org/10.1016/j.baae.2011.06.002.
- 9
Tamiru A、Bruce TJ、Woodcock CM、Caulfield JC、Midega CA、Ogol CK等。玉米地方品种根据食草动物的卵沉积招募卵和幼虫寄生蜂。Ecol Lett公司。2011;14(11):1075–83.https://doi.org/10.1111/j.1461-0248.2011.01674.x.
- 10。
Fatouros NE, Bukovinszkine'Kiss G, Kalkers LA, Gamborena RS, Dicke M, Hilker M.产卵诱导的植物线索:它们是否在寄主位置捕获赤眼蜂?昆虫学报,2005;115(1):207-15。https://doi.org/10.1111/j.1570-7458.2005.00245.x.
- 11.
Blenn B,Bandoly M,Kuffner A,Otte T,Geiselhardt S,Fatouros Ne,等。昆虫蛋沉积在拟南芥中诱导间接防御和震动蜡变化。J Chem Ecol。2012; 38(7):882-92。https://doi.org/10.1007/S101186-012-0132-8.
- 12.
小D, Gouhier-Darimont C, Bruessow F, raymond P.拟南芥中pierid butterfly的产卵触发了防御反应。植物杂志。2007;143(2):784 - 800。https://doi.org/10.1104/pp.106.090837.
- 13
Gouhier-Darimont, Schmiesing A, Bonnet C, Lassueur S, raymond p P.拟南芥(Arabidopsis thaliana)对Pieris brassicae卵的应答信号通路与pamp - p触发免疫具有相似性。实验机器人,2013;64(2):665-74。https://doi.org/10.1093/jxb/ers362.
- 14
Bittner N,Trauer-Kizilelma U,Hilker M.早期植物防御昆虫攻击:参与反应性氧气种类在植物反应对昆虫蛋沉积中的反应。Planta。2017; 245(5):993-1007。https://doi.org/10.1007/s00425-017-2654-3.
- 15
Reymond P,农民EE。茉莉酸盐和水杨酸盐作为防御基因表达的全局信号。CurrOp植物BIOL。1998; 1(5):404-11http://biomednet.com/elecref/1369526600100404.
- 16
通过不同的育种方法认识到黑克的事实和牟取暴利。IJCS。2018;6(4): 3359-69 p-issn: 2349-8528, e-issn: 2321-4902。
- 17
Duraimurugan P、Raja K、Regupathy A。一种环境友好的方法,通过印楝配方和陷阱诱捕器来管理脉纹瓢虫。豆科植物。2011;24(1):23–7 ISSN:0976-2434。
- 18
SOMTA P,AMMARANAN C,OOI PA-C,猪肉P.种子抗性对栽培Mungbean的Bruchids(Vigna Radiata.L威尔切克)。大提琴。2007;155(1–2):47–55.https://doi.org/10.1007/s10681-006-9299-9.
- 19
War Ar,Murugesan S,Boddepalli VN,Srinivasan R,Nair RM。Mungbean抗性机制[Vigna Radiata.(左)右。辐射变种]到布鲁氏科,胼胝体布鲁氏属(鞘翅目:布鲁氏科)。前植物科学。2017;20(8):1031.https://doi.org/10.3389/fpls.2017.01031.
- 20。
Baruah Ik,Panda D,M VJ,Das DJ,Acharjee S,Sen P等人。BRUCHID蛋诱导的黑克种子中的转录物动力学(豇豆属曼戈).《公共科学图书馆•综合》。2017;12 (4):e0176337。https://doi.org/10.1371/journal.pone.0176337.
- 21。
Schultheiss H, Dechert C, Király L, Fodor J, Michel K, Kogel K-H等。大麦发病相关蛋白PR-1b的功能评估。植物科学。2003;165(6):1275 - 80。https://doi.org/10.1016/S0168-9452(03)00336-4.
- 22。
potakham W, Nawae W, Naktang C, Sonthirod C, Yoocha T, Kongkachana W等。黑克的染色体规模组装(豇豆属曼戈)基因组。Mol Ecol Resour. 2020; 00:1-13。https://doi.org/10.1111/1755-0998.13243.
- 23.
Kanehisa M,Furumichi M,Tanabe M,Sato Y,Morishima K. Kegg:关于基因组,途径,疾病和药物的新观点。核酸RES。2017; 45(D1):D353-61。https://doi.org/10.1093/nar/gkw1092.
- 24.
Anders S, Reyes A, Huber W.从rna测序数据中检测外显子的差异使用。Nat Prec。2012;22(10):2008 - 17所示。https://doi.org/10.1038/npre.2012.6837.2.
- 25.
产卵诱导的拟南芥基因组表达变化:预测你的敌人?植物信号行为研究。2007;2(3):165-7。https://doi.org/10.4161/psb.2.3.3690.
- 26.
德雷赫K,卡利斯J。泛素、激素与植物的生物胁迫。安·博特。2007;99(5):787–822.https://doi.org/10.1093/aob/mcl255.
- 27.
凯斯勒,鲍德温。植物对昆虫取食的反应:新兴的分子分析。植物生物学年鉴。2002;53(1):299–328.https://doi.org/10.1146/annurev.arplant.53.100301.135207.
- 28.
早期食草动物警报:虫卵诱导植物防御。化学生态学报。2006;32(7):1379-97。https://doi.org/10.1007/s10886-006-9057-4.
- 29.
Büchel K,McDowell E,Nelson W,Descour A,Gershenzon J,Hilker M,et al.鉴定叶甲虫卵诱导防御基因的elm EST数据库。BMC基因组学。2012;13(1):242.https://doi.org/10.1186/1471-2164-13-242.
- 30
Tonónc,guevara g,oliva c,daleo g.用抗真菌活性分离马铃薯酸性39kdaβ-1,3-葡聚糖酶Phytophthora Infestans.不同田间抗性马铃薯品种的表达分析。植物病理学杂志。2002;150(4–5):189–95.https://doi.org/10.1046/j.1439-0434.2002.00729.x..
- 31
Anand A, Lei Z, Sumner LW, Mysore KS, Arakane Y, Bockus WW等。转基因小麦株系的外质体提取物具有多种致病相关的抗真菌蛋白。植物微生物学报。2004;17(12):1306-17。https://doi.org/10.1094/mpmi.2004.17.12.1306.
- 32
Zhao N, Guan J, Ferrer J- l, Engle N, Chern M, Ronald P, et al. .水杨酸甲酯和苯甲酸甲酯在水稻中的生物合成和排放。植物生理学杂志。2010;48(4):279-87。https://doi.org/10.1016/j.plaphy.2010.01.023.
- 33
昆虫卵抑制植物对咀嚼食草动物的防御。工厂j . 2010, 62(5): 876 - 85。https://doi.org/10.1111/j.1365-313x.2010.04200.x.
- 34。
Bonnet C、Lasueur S、Ponzio C、Gols R、Dicke M、Reymond P。联合生物胁迫触发类似的转录组反应,但在不同的环境中对咀嚼食草动物的抗性不同芸苔属植物黑质. BMC植物生物学。2017;17(1):127.https://doi.org/10.1186/s12870-017-1074-7.
- 35。
Lortzing V,Oberländer J,Lortzing T,Tohge T,Steppuhn A,Kunze R等。昆虫卵沉积使植物以水杨酸依赖的方式更有效地防御孵化幼虫。植物细胞环境。2019;42(3):1019–32.https://doi.org/10.1111/pce.13447.
- 36。
Gouhier Darimont C、Stahl E、Glauser G、Reymond P。拟南芥凝集素受体激酶LecRK-I。8参与昆虫卵的感知。前植物科学。2019;10:623.https://doi.org/10.3389/fpls.2019.00623.
- 37
Pieterse cm,van D,D,Zamioudis C,Leon-Reyes A,Van Wees Sc。植物免疫激素调节。Annu Rev Cell Dev Biol。2012; 28:489-521。https://doi.org/10.1146/annurev-cellbio-092910-154055.
- 38
Caarls L,Pieterse cm,van Wees S.水杨酸如何对茉莉酸信号传递进行转录控制。前植物SCI。2015; 6:170。https://doi.org/10.3389/fpls.2015.00170.
- 39
Parde VD,Sharma HC,KACHOLE MS。鸽子豌豆野生亲属的蛋白酶抑制剂对棉铃虫/豆科植物坑,Helicoverpa Armigera。am j植物sci。2012; 3:627-35 ISSN 2158-2750。
- 40.
昆虫对植物防御蛋白酶抑制剂的反应。Annu Rev Entomol. 2015; 60:233-52。https://doi.org/10.1146/annurev-ento-010814-020816..
- 41.
Terra WR,费雷拉C。消化的生物化学和分子生物学。昆虫分子生物学和生物化学:学术出版社,爱思唯尔;2012年。365–418.https://doi.org/10.1016/B978-0-12-384747-8.10011-X..
- 42.
Vos IA, Verhage A, Schuurink RC, Watt LG, Pieterse CM, Van weiss S.通过脱落酸激活草食动物诱导的系统组织的抗性。植物科学与技术,2013;4:539。https://doi.org/10.3389/fpls.2013.00539.
- 43.
Vos Ia,Moritz L,Pieterscm,van Wees S.荷尔蒙串扰对多攻击条件下植物抵抗和健身的影响。前植物SCI。2015; 6:639。https://doi.org/10.3389/fpls.2015.00639.
- 44。
Maris C, Dominguez C, Allain FH。RNA识别基元,一个调节转录后基因表达的塑料RNA结合平台。2月j . 2005; 272(9): 2118 - 31所示。https://doi.org/10.1111/j.1742-4658.2005.04653.x.
- 45。
Geddy r,棕色gg。编码戊庚二肽重复(PPR)蛋白的基因在植物基因组中的位置不保守,并且可能受到多样化选择。BMC基因组学。2007; 8(1):130。https://doi.org/10.1186/1471-2164-8-130.
- 46。
LorkovićZJ。植物rna结合蛋白在发育、应激反应和基因组组织中的作用。植物科学学报,2009;https://doi.org/10.1016/j.tplants.2009.01.007.
- 47.
Koussevitzky S,Nott A,Mockler TC,Hong F,Sachetto Martins G,Surpin M等。来自叶绿体的信号汇聚以调节核基因表达。科学。2007;316(5825):715–9.https://doi.org/10.1126/science.1.140.516.
- 48.
Zsigmond L,Rigóg,szarka a,székelyg,otvösk,darula z等。拟南芥PPR40将非生物应激反应连接到线粒体电子传输。植物理性。2008; 146(4):1721-37。https://doi.org/10.1104/pp.107.111260.
- 49.
Kobayashi K,Suzuki M,Tang J,Nagata N,Ohyama K,Seki H等.洛伐他汀不敏感1是一种新的五三肽重复序列蛋白,是拟南芥类异戊二烯生物合成的潜在调控因子。植物细胞生理学。2007;48(2):322–31.https://doi.org/10.1093/pcp/pcm005.
- 50
摘要/ abstract Tang J, Kobayashi K, Suzuki M, Matsumoto S, Muranaka T. The mitochondrial PPR protein LOVASTATIN INSENSITIVE 1通过RNA编辑在细胞质和质体内类异戊二烯生物合成中起调节作用。植物j . 2010; 61(3): 456 - 66。https://doi.org/10.1111/j.1365-313X.2009.04082.x.
- 51
Park YJ、Lee HJ、Kwak KJ、Lee K、Hong SW、Kang H。MicroRNA400引导的五三肽重复蛋白mRNA的切割拟南芥更容易受病原菌和真菌的影响。植物细胞生理。2014; 55(9):1660-8。https://doi.org/10.1093/pcp/pcu096.
- 52
贝斯曼MJ,弗里克DN,奥汉德利SF。MutT蛋白或“Nudix”水解酶,是一个多功能、分布广泛的“家庭清洁”酶家族。生物学杂志。1996;271(41):25059–62.https://doi.org/10.1074/jbc.271.41.25059..
- 53
Muñoz FJ, Baroja-Fernández E, Morán-Zorzano MT, Alonso-Casajús N, Pozueta-Romero J.一种Nudix水解酶的克隆、表达和特性分析拟南芥. 植物细胞生理学。2006;47(7):926–34.https://doi.org/10.1093/pcp/pcj065.
- 54
Ogawa T,Yoshimura K,Miyake H,Ishikawa K,Ito D,Tanabe N等.拟南芥细胞器型核苷水解酶的分子特征。植物生理学。2008;148(3):1412–24.https://doi.org/10.1104/pp.108.128413.
- 55
Yoshimura K、Ogawa T、Ueda Y、Shigeoka S。AtNUDX1是一种8-氧代-7,8-二氢-2′-脱氧鸟苷5′-三磷酸焦磷酸水解酶,负责清除拟南芥中的氧化核苷酸。植物细胞生理学。2007;48(10):1438–49.https://doi.org/10.1093/pcp/pcm112.
- 56
Jambunathan N,Penaganti A,唐y,Mahalingam R.通过Arabidopsis Nudix水解酶7. BMC植物Biol调节氧化还原稳态的调节。2010; 10(1):173。https://doi.org/10.1186/1471-2229-10-173.
- 57
功能基因组学揭示了一个真核氧化保护基因家族。《美国国家科学院学报》上。2000; 97(26): 14530 - 5。https://doi.org/10.1073/pnas.260495897.
- 58。
Leon-Reyes A, Van d, Does d, De Lange ES, Delker C, Wasternack C, Van wee SC, Ritsema T, Pieterse CM。在拟南芥中,水杨酸盐介导的茉莉酸反应基因表达的抑制是茉莉酸盐生物合成途径的下游。足底。2010;232(6):1423 - 32。https://doi.org/10.1007/s00425-010-1265-z.
- 59。
van der是D,Leon-Reyes A,Koornneef A,Van Verk MC,Rodenburg N,Pauwels L,Goossens A,KörbesAP,梅内克J,Ritricyma T.水杨酸通过靶向GCC启动子抑制SCFCOI1-JAZ下游的茉莉酸信号传导通过转录因子ORA59的图案。植物细胞。2013; 25(2):744-61。https://doi.org/10.1105/TPC.112.108548.
- 60。
Pre M,Atallah M,Chapion A,De Vos M,Pieterscm,Memelink J. AP2 / ERF域转录因子ORA59将茉莉酸和乙烯信号集成在植物防御中。植物理性。2008; 147(3):1347-57。https://doi.org/10.1104/pp.108.117523.
- 61。
Zarei A, Körbes AP, Younessi P, Montiel G, Champion A, Memelink J. J.两个GCC box和AP2/ erf域转录因子ORA59在茉莉酸/乙烯介导的PDF1激活中的作用。拟南芥的2个启动子。中国生物医学工程学报,2011;https://doi.org/10.1007/S11103-010-9728-Y..
- 62.
Zander M,Thurow C,Gatz C.TGA转录因子通过调节ORA59表达来激活乙烯诱导的防御计划的水杨酸抑制分支。植物理性。2014; 165(4):1671-83。https://doi.org/10.1104/pp.114.243360.
- 63.
Koornneef, Leon-Reyes, Ritsema, Verhage, Den Otter, Van Loon等。水杨酸盐介导的茉莉酸盐信号抑制动力学揭示了氧化还原调节的作用。植物杂志。2008;147(3):1358 - 68。https://doi.org/10.1104/pp.108.121392.
- 64.
Orozco-cárdenasml,ryan ca.一氧化氮对番茄植物中的伤口信号引起的。植物理性。2002; 130(1):487-93。https://doi.org/10.1104/pp.008375.
- 65.
acta photonica sinica, 2012, 38(5): 771 - 778 .崔斌,潘q, Clarke D, Villarreal MO, Umbreen S, Yuan B,等。锌指蛋白SRG1的s -亚硝基化调控植物免疫。Nat Commun。2018;9(1):1 - 12。https://doi.org/10.1038/s41467-018-06578-3.
- 66.
Rushton PJ, somsich IE。植物应答病原菌基因的转录调控。植物生物学杂志。1998;1(4):211 - 215http://biomednet.com/elecref/1369526600100311..
- 67.
Schweizer F、Fernández Calvo P、Zander M、Diez Diaz M、Fonseca S、Glauser G等。拟南芥碱性螺旋-环-螺旋转录因子MYC2、MYC3和MYC4调节硫代葡萄糖苷生物合成、昆虫行为和摄食行为。植物细胞。2013;25(8):3117–32.https://doi.org/10.1105/tpc.113.115139.
- 68。
SEO PJ,公园厘米。MyB96介导的脱落酸信号通过促进拟南芥中的水杨酸生物合成来诱导病原体抗性响应。新植物。2010; 186(2):471-83。https://doi.org/10.1111/j.1469-8137.2010.03183.x.
- 69。
Zhao J,Davis LC,Verpoorte R. Elicitor信号转导,导致植物次级代谢物的生产。Biotechnol Adv。2005; 23(4):283-333。https://doi.org/10.1016/j.biotechadv.2005.01.003.
- 70。
Sudha G,Ravishankar Ga。各种信号化合物对植物代谢事件对植物代谢事件的累积和相互作用,抗应力因子,次级代谢产物的形成及其分子方面。植物细胞组织org。2002; 71(3):181-212。https://doi.org/10.1023/A:1020336626361.
- 71.
关键词:昆虫产卵,草本植物,挥发性物质,诱卵器中华实验医学杂志。2004;47(1):47-53。https://doi.org/10.1242/jeb.00732.
- 72.
Ralph SG,Yueh H,Friedmann M,Aeschliman D,Zeznik Ja,Nelson CC等。针叶树防御昆虫:Sitka Prucuce的微阵列基因表达分析(云杉),由云杉芽虫(西cidentalis)或白松象甲(皮索德斯特罗比)揭示主机转录组的大规模变化。植物细胞环境。2006; 29(8):1545-70。https://doi.org/10.1111/j.1365-3040.2006.01532.x.
- 73.
Kaur H, Heinzel N, Schöttner M, Baldwin IT, Gális I. R2R3-NaMYB8调节苯丙素-多胺缀合物的积累,这是局部和系统防御昆虫食草动物野生烟草.植物杂志。2010;152(3):1731 - 47岁。https://doi.org/10.1104/pp.109.151738.
- 74
何静,陈芳,陈森,吕刚,邓勇,方伟,等。菊花叶片表皮形态及抗氧化酶和防御酶活性对蚜虫侵染的响应。植物生理学杂志。2011;https://doi.org/10.1016/j.jplph.2010.10.009.
- 75
Kushwaha HR,Singh Ak,Sopory Sk,Singla-Pareek SL,Pareek A.基因组含有蛋白质CBS结构域的宽表达分析拟南芥(L.)Heynh和奥雅萨苜蓿揭示了它们的发育和应激调控。BMC基因组学。2009;10(1):200。https://doi.org/10.1186/1471-2164-10-200.
- 76
关键词:细胞色素P450单加氧酶,抗除草剂,分子机制生物科技植物》。1998;15(4):173 - 6。https://doi.org/10.5511/plantbiotechnology.15.173.
- 77
Pandey SP, Srivastava S, Goel R, Lakhwani D, Singh P, Asif MH等。鹰嘴豆的模拟食草性在伤害后的几分钟内引起JA/乙烯/GA/生长素的防御途径和激素转录网络的快速变化。Sci众议员2017;7(1):1 - 14。https://doi.org/10.1038/srep44729.
- 78
Maimbo M,Ohnishi K,Hikichi Y,Yoshioka H,Kiba A.诱导小型热休克蛋白及其在尼古纳植物中的临床对抗Ralstonia Solanacearum的植物功能作用。植物理性。2007; 145(4):1588-99。https://doi.org/10.1104/pp.107.105353.
- 79
植物广谱抗病模式识别受体的功能、发现和开发。Annu Rev Phytopathol. 2017; 55:257-86。https://doi.org/10.1146/annurev-phyto-080614-120106.
- 80
Colinet AS, Sengottaiyan P, Deschamps A, Colsoul ML, Thines L, Demaegd D, Duchêne MC, Foulquier F, Hols P, Morsomme P.酵母Gdt1是高尔基定位的钙转运体,在应激诱导的钙信号和蛋白质糖基化过程中是必需的。Sci众议员2016;6:24282。https://doi.org/10.1038/srep24282.
- 81
Hoecker N, Leister D, Schneider A.植物含有UPF0016蛋白的小家族,包括光合作用影响的突变体71转运体。植物信号处理研究进展[j] .中国生物医学工程学报,2017;https://doi.org/10.1080/15592324.2016.1278101.
- 82。
Uemura T, Hachisu M, Desaki Y, Ito A, Hoshino R, Sano Y等。大豆和拟南芥受体样激酶响应多糖信号斜纹夜蛾物种和介导食草动物抗性。Commun杂志。2020;3(224)。https://doi.org/10.1038/s42003-020-0959-4.
- 83。
Hettenhausen C,Schuman MC,Wu J. Mapk Signaling:植物防御反应的关键要素。昆虫SCI。2015; 22(2):157-64。https://doi.org/10.1111/1744-7917.12128.
- 84。
keyse sm。蛋白质磷酸酶和丝裂原活化蛋白激酶信号传导的调节。CurrOp植物BIOL。2000; 12(2):186-92。https://doi.org/10.1016/S0955-0674(99)00075-7.
- 85。
Woodward AW,Bartel B.植物:调节,行动和互动。Ann Bot。2005; 95(5):707-35。https://doi.org/10.1093/aob/mci083.
- 86.
细胞对生长素的反应:分裂与扩张。冷泉Harb展望生物学。2010;2(5):a001446。https://doi.org/10.1101/cshperspect.a001446..
- 87.
蛋白酶抑制剂:植物源的杀虫蛋白基因,用于开发抗虫转基因植物。咕咕叫科学。2001;10:847-53https://www.jstor.org/stable/24105735.
- 88.
绿豆α-淀粉酶抑制剂的蛋白质组学研究Vigna Radiata.).NAT SCI。2008; 42:245-25。
- 89.
范登伯雷G,斯马格G,云顿格EJ。植物凝集素作为抵御植食性昆虫的防御蛋白。植物化学。2011;72(13):1538 - 50。https://doi.org/10.1016/j.phytochem.2011.02.024.
- 90。
War AR,Paulraj MG,Ahmad T,Buhroo AA,Hussain B,Ignacimuthu S,等。植物对昆虫食草动物的防御机制。电厂信号行为。2012;7(10):1306–20.https://doi.org/10.4161/psb.21663.
- 91。
Martinez M,Santamaria ME,Diaz Mendoza M,Arnaiz A,Carrillo L,Ortego F,等.植物胱抑素:植物性昆虫和蜱螨的防御蛋白。国际分子科学杂志。2016;17(10):1747.https://doi.org/10.3390/ijms17101747.
- 92。
蛋白酶抑制剂在保护转基因植物免受草食昆虫侵害中的应用前景。2011;12(5): 409-16。https://doi.org/10.2174/138920311796391142.
- 93。
Landerito EO、Mendoza EM、Laurena AC、Garcia RN。绿豆的理化和生化因子(Vigna Radiata.(L.)威尔切克)和布莱克(豇豆属曼戈)与bruchid有关(Callosobruchus chinensis.L.)抗性。菲利普j作物sci。1993; 18(3):153-63 issn 0115-463x。
- 94。
Mariyammal I,Seram D,Samyuktha Sm,Karthikeyan A,Dhasarathan M,Murukarthick J,等人。QTL映射Vigna Radiata.×赤小豆人口揭示了与抗毛发抗性相关的主要基因组区域。mol繁殖。2019; 39(7):110。https://doi.org/10.1007/s11032-019-1006-3.
- 95.
德维MB,德维NV。豇豆象甲的生物学和形态测量,callosobruchus maculatus.Fab。(鞘翅目:Chrysomelidae)绿色克。j entomol zool螺柱。2014; 2:74-6 ISSN 2320-7078。
- 96.
Liu Z,Zhang Z,Faris JD,Oliver RP,Syme R,McDonald MC,等。结瘤鹿单孢菌产生的富含半胱氨酸的坏死营养效应子SnTox1触发了Snn1小麦品系的易感性。公共科学图书馆。2012;8(1):e1002467。https://doi.org/10.1371/journal.ppat.1002467.
- 97.
Grabherr Mg,Haas Bj,Yassour M,Levin JZ,Thompson Da,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q,Chen Z,Mauceli E,Hacohen N,Gnirke A,Rhind N,Di Palma F,BirrenBW,NUSBAUM C,LINDBLAD-TOH K,Friedman N,REGEV A.来自RNA-SEQ数据的全长转录组件,没有参考基因组。NAT BIOTECHNOL。2011; 29(7):644-52。https://doi.org/10.1038/nbt.1883.
- 98
coesa A, Götz S, García-Gómez JM, Terol J, Talón M, Robles M. Blast2GO:用于功能基因组学研究的注释、可视化和分析的通用工具。生物信息学。2005;21(18):3674 - 6。https://doi.org/10.1093/bioinformatics/bti610.
- 99
Tatusov RL、Natale DA、Garkavtsev IV、Tatusova TA、Shankavaram UT、Rao BS等。COG数据库:全基因组蛋白质系统发育分类的新进展。核酸研究,2001年;29(1):22–8.https://doi.org/10.1093/nar/29.1.22.
- 100
Nair M,Sandhu SS,Babbar A。玉米种子中胰蛋白酶抑制剂的纯化Cicer Arietinum.(L.)及其对Helicoverpa Armigera(Hübner)的杀虫潜力。你。Exp。植物理性。2013; 25(2):137-48。https://doi.org/10.1590/s2197-00252013000200006..
- 101。
Gupta M, Sharma P, Nath AK。一种新型喜马拉雅豆α-淀粉酶抑制剂的纯化菜豆)朝向Bruchid害虫和人唾液淀粉酶活性的种子。J Food Scitechnol。2014; 51(7):1286-93。https://doi.org/10.1007/s13197-012-0631-1.
- 102。
团队RC。R核心团队。R:用于统计计算的语言和环境。统计计算基础;2013.https://www.r-project.org/.
致谢
我们非常感谢印度脉冲研究所(IIPR),坎普尔为我们提供了中等抗性黑克品种的种子。作者感谢DBT-AAU中心的支持,为成功开展这项工作提供了必要的设施。作者也承认了美国大学DIC的生物信息学设施。KModi为所有生物信息学研究提供帮助。作者感谢Kuntal Kumar Dey先生协助上传SRA数据库中的原始序列。
资金
作者深深感谢DBT-Necab中心提供的资金。该资助者在研究设计,数据收集和分析中没有作用,决定发布或准备手稿。
作者信息
隶属关系
贡献
SA构思和设计了实验,DD进行了所有实验和分析的数据,DP有助于生物信息学分析和RRP饲养的生物测量昆虫。DD,IKB和SA共同写了稿件。SA和BKS批准了要发布的最终版本。稿件的所有作者都贡献,阅读并同意其内容。
相应的作者
道德宣言
伦理批准和同意参与
本研究不使用动物、人类受试者、人类材料或人类数据。
同意出版物
不适用。
利益争夺
作者声明他们没有相互竞争的利益。
额外的信息
出版商说明
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充信息
附加文件1:表S1
:Kegg路径注释4322 CDSS的IC-8219品种和3551个T-9品种CDS。
附加文件2:表S2
: 23个KEGG通路下IC-8219 (C)、IC-8219 (T)、T-9 (C)和T-9 (T)样品的CDSs总数
附加文件3:表S3
:IC-8219品种为630度,T-9品种为184度
附加文件4:表S4
: IC-8219和T-9的氧化石墨烯显著富集
附加文件5:表S5
:IC-8219和T-9品种中有显着富集的Kegg途径
附加文件6:表S6
:不同类别下T-9和IC-8219品种的DEG列表
附加文件7:表S7
:响应于Bruchid产卵,IC-8219品种中初级代谢途径的下调基因的初级代谢途径
附加文件8:
表S8:响应于Bruchid产卵的IC-8219品种中的脂质代谢途径的下调基因
附加文件9:表S9
:2在响应Bruchid产卵中的T-9栽培中调节的初级代谢基因
附加文件10:表S10
:用于验证转录组数据的QPCR引物列表
权利和权限
开放存取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Das, D, Baruah, I.K, Panda, D。等等。黑克荚虫产卵介导的防御反应。BMC植物生物学21,38(2021)。https://doi.org/10.1186/s12870-020-02796-4
收到:
认可的:
发表:
关键词
- 绿豆象
- 下子
- 豇豆属曼戈
- 转录组
- 新创组装
- Callosobruchus sp
- Illumina测序