抽象的
背景
甘蔗成熟后茎中可储存大量蔗糖,是粮食和可再生能源工业的主要蔗糖来源。蔗糖是光合作用产生的主要双糖,主要储存在非光合组织细胞的液泡中。植物细胞释放蔗糖的途径有两条,一条是依赖于蔗糖磷酸合酶(SPS)和蔗糖磷酸磷酸酶(S6PP)的重新合成途径,另一条是依赖于蔗糖合酶(SuSy)活性的调控途径。对引起蔗糖磷酸酶表达的基因的分子理解,负责在最后合成步骤中释放蔗糖的磷酸酶滞后于调控苏珊基因。
结果
甘蔗基因组测序工作揭示了串联重复的存在,目前的工作进一步支持这两者S6第1页和S6PP_2D同种型在年轻的甘蔗植物中积极转录,但成熟度明显较低。两个商业杂交种(SP80-3280和R570)和两者均甜根子草(IN84-58)和S.officinarum(Badilla)在Tandem的三个月大植物中表现出转录活动S6PP_2D在叶片、茎、分生组织和根系中具有品种特异性的分布。此外,这种串联复制与其他草类共享,是该群体的祖先。
结论
检测S6PP的新同种型,由含14个外显子的转录物(S6PP_2D)将有助于了解植物中的蔗糖代谢。此外,表达量随植株发育而异,且在甘蔗品种和亲本物种之间存在差异。
背景
作为世界商品的甘蔗经济价值是由于其高糖产量,可再生能源和其他生物分子生产[1.].高糖产量源于其作为其发展方案的一部分将大量蔗糖存放在秆中的大量蔗糖。蔗糖是植物中最常用的糖形式,其分区取决于芬降合成,储存和代谢用途。蔗糖新陈代谢可分为三个步骤:合成,运输和积累。蔗糖合成在叶细胞中发生作为光合作用的一部分,是在这种细胞过程中获得的主要代谢物。蔗糖在胞质溶胶中合成并通过酶蔗糖 - 磷酸磷酸酶(EC 3.1.3.24,PF 08472)的作用释放,也称为蔗糖-6磷酸磷酸化酶(S6PP)。S6PP催化该代谢途径的最后反应步骤,其中蔗糖-6-磷酸酶(SUC6P),蔗糖磷酸合酶酶(EC 2.4.1.14)(SPS)的酶促反应的产物是脱磷和释放为蔗糖[2.,3.].
胞浆中游离蔗糖的释放促使其运输到韧皮部导管,这是碳水化合物从源组织转移到整个植物的库组织和器官的最常见形式[4.,5.].最后,将产生的蔗糖储存在所有非光合组织的实质细胞的泡沫中。在该阶段,积累,蔗糖通过酶蔗糖合成酶(EC 2.4.1.13)(EC 2.4.1.13)的妊娠或助剂途径进入细胞(苏珊),发挥调节作用,根据植物生理需要,通过可逆反应将其转化为udp -葡萄糖。或者,蔗糖也可以被SPS激活,形成中间产物Suc6P,在酶S6PP的作用下被去磷酸化[6.].库组织的去磷酸化作用为蔗糖进入液泡提供了必要的能量,在液泡中最终以葡萄糖和果糖的形式积累[7.].与大多数陆地植物所描述的能量功能不同,一些蓝藻细菌合成蔗糖是为了适应渗透胁迫[8.].
现代甘蔗品种是种间杂种(糖种)内杂交后选择糖物种,主要在Saccharum OfficinArum.l .,S. Spontaneum.L[9].这些现代栽培品种的例子是R570(在法国阵营中繁殖)和SP80-3280(在圣保罗,巴西繁殖),两者都有它们的基因组部分测序[10,11].前期工作发布了314集甘蔗细菌人工染色体(bac)来自R570品种,其中基因串联重复S6PP描述(12]. 这种串联重复在最近发布的基因组序列中得到了进一步验证[10,13].两个S6PP基因具有类似的基因结构,其中八个外显子,其中5个尺寸保守并含有蛋白质的催化位点。由630个碱基之间的终止区分开S6第1页和ATG密码子来自S6第2页(图S1).
S6PP酶存在于维管植物(肝植物、裸子植物和被子植物)和非维管植物(绿藻、苔藓)中。在一些维管植物中,S6PP酶被描述为一种约为120 KDa的同型二聚体。例如:水稻S6PP被描述为100-120 KDa的二聚体,与50 KDa单体[14,15];豌豆S6PP也形成120 KDa的二聚体,有55 KDa单体[16]; 鉴于拟南芥S6PP二聚体为90 KDA,52 kda单体[17].玉米S6PP信息仅可从变性凝胶中获得,并呈现47.2 KDA的分子量。SyneChocystis.和鱼腥藻,含有蓝藻,呈现较小(27-28kDa)和单体S6PP酶[8.,18,19,20.].尽管在细菌中,特别是在蓝藻分支中有这种单体特征,但在变形菌门中已经发现了一个包含蛋白SPS和S6PP的双域结构域Methylobacillus flagellatus,表征为336 KDa与84KDa单体的四聚体[21]. 不管这些不同的S6PP排列,所有物种的基本单元(单体)在氨基酸序列上都有显著的相似性,主要是在催化结构域[8.,15].
本作本作作品的主要目的是在分子水平上表征甘蔗S6PP,有助于植物中的蔗糖代谢知识。我们探讨了新同种型的存在,衍生自串联复制作为具有两个催化结构域的单体的替代剪接。此外S6第1页和/或S6第2页基因转录本,我们检测到一个新的亚型,由14个内含外显子的转录本(S6PP_2D).结果表明,这两种基因在不同的甘蔗组织中都有活跃的转录,且在不同的甘蔗品种和亲本之间的表达也存在差异。
结果
两个商品甘蔗品种的S6PP基因组结构
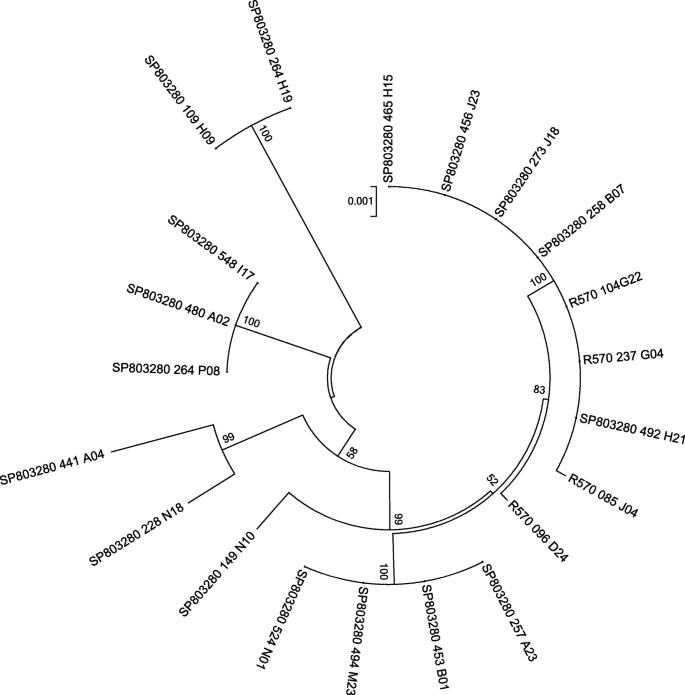
一种比较基因组方法解决了先前描述的两个BAC串联重复的存在,这21个测序片段来自两个甘蔗品种,SP80-3280和R570 [11,12].根据表1.在所有测序片段中均存在串联重复,与品种无关。此外,基因组环境支持这些基因位于一个单一的基因座上,两个品种之间共享结构基因组变体,如它们的相邻基因和转座因子插入所示,如补充图所示S2.为了提高我们对这些基因组片段的进化史的知识,由每种BAC至少5000个碱基的系统发育树是由从ATG开始的这两种串联基因的对准来构建的S6第1页直到停止密码子从S6第2页基因。数字1.描绘了这两个杂交品种的基因组区域之间的差异不会截然不同。SP80-3280中的十个基因组区域在一个一致的序列中分支,其中具有四个R570基因组区域,而其他七个基因组区域分别。将甘蔗品种分组在一个落后的甘蔗品种的高举引导中支持,这表明这些基因组区域与少数吲哚和SNP(数据未显示)非常相似。
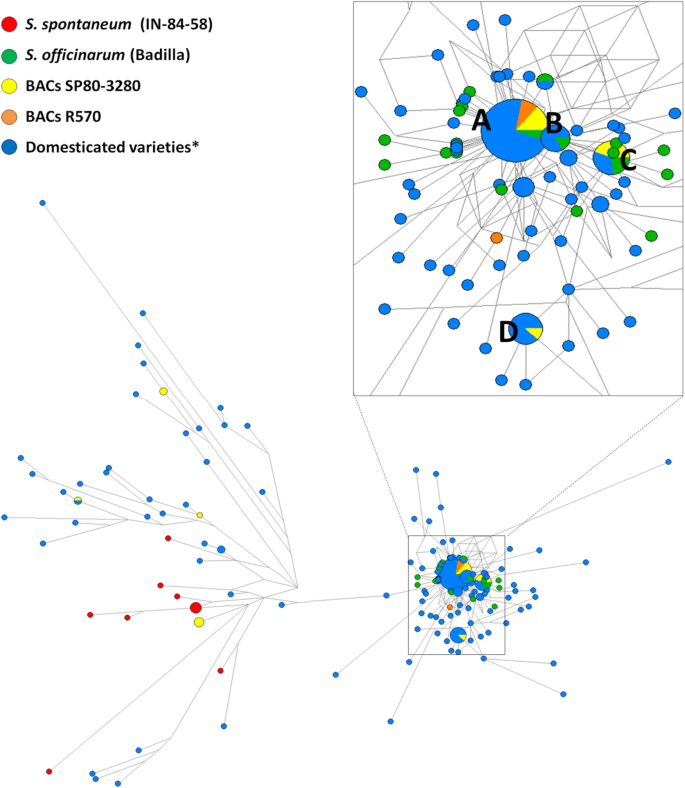
网络分析使我们能够在种群水平上解决核苷酸多样性问题。一个1539个核苷酸的片段,包括两个拷贝之间的基因间区域S6PP,在所有上述测序的BAC中都包含在De Setta等人的原始网络对齐中。[12]. 几乎所有的序列都分为四个节点,如图。2.. 除节点B外,所有节点均由驯化品种和SP80–3280 BAC组成。R570BACs普遍存在于中央节点A,由36个序列组成,包括S. Officinarum.(巴迪利亚)。少许S. Officinarum.序列与SP80–3280和巴西育种计划中使用的杂交品种进行聚类(图。2.,节点C)S. Spontaneum.用糖积聚品种发现测序片段。
网络分析的S6PP串联复制基因组区域。通过中位连接方法使用网络5软件建造网络,从一个大约1539年的各种驯化品种的甘蔗的区域的对准,用作父母在十字架中的物种(S. Spontaneum.和S.officinarum)对R570和SP80–3280的BACs进行测序。放大最大的节点以获得更好的可视化效果,并显示在正方形内。A.最大的节点由R570 BAC形成预测,以转录包含两个域的单个转录物S6PP,SP80-3280 BAC和POJ-2878,NCO-310,RB-72454,NA56-79,RB-867515,SP70-1143,MISCANTHUS,CO-290和RB-835486驯化品种的36个序列;B节点由六个序列形成;C由九个序列组成的节;D节点由八个序列组成。较小的节点仅由一个序列构成。节点(圆)的大小与单倍型中序列的数量有关。节点之间的距离与替换的次数成正比。(*)指本研究使用的驯化品种:Mandalay、SP70-1143、Miscanthus、Co-290、RB-835486、POJ-2878、Nco-310、RB-72454、NA 56-79、RB 867515、SP81-3250、R570、SP80-3280
我们研究了两者的启动子区域S6第1页和S6第2页在我们的BAC收集中发现,这两个基因在翻译起始位点ATG上游的核苷酸相似性很小。然而,在每个启动子区域内的多个核苷酸比对支持高核苷酸同一性。对620个核苷酸上游进行分析S6第1页和S6第2页ATG透露,S6第1页有一个定义和保守的TATA box,以及几个与ABA和光响应相关的重叠基元,一些干旱和生长素响应元件(图S3).除了三个之外S6第2页上游区域在预期位置没有塔塔盒,但所有均为嗜酸剂蛋白,植物素和光响应元件的结合位点。SP803280_480_A02,SP803280_548_H17和SP803280_264_P08在271-277位的负线中具有TATA盒。
S6PP串联复制是甘蔗的祖先
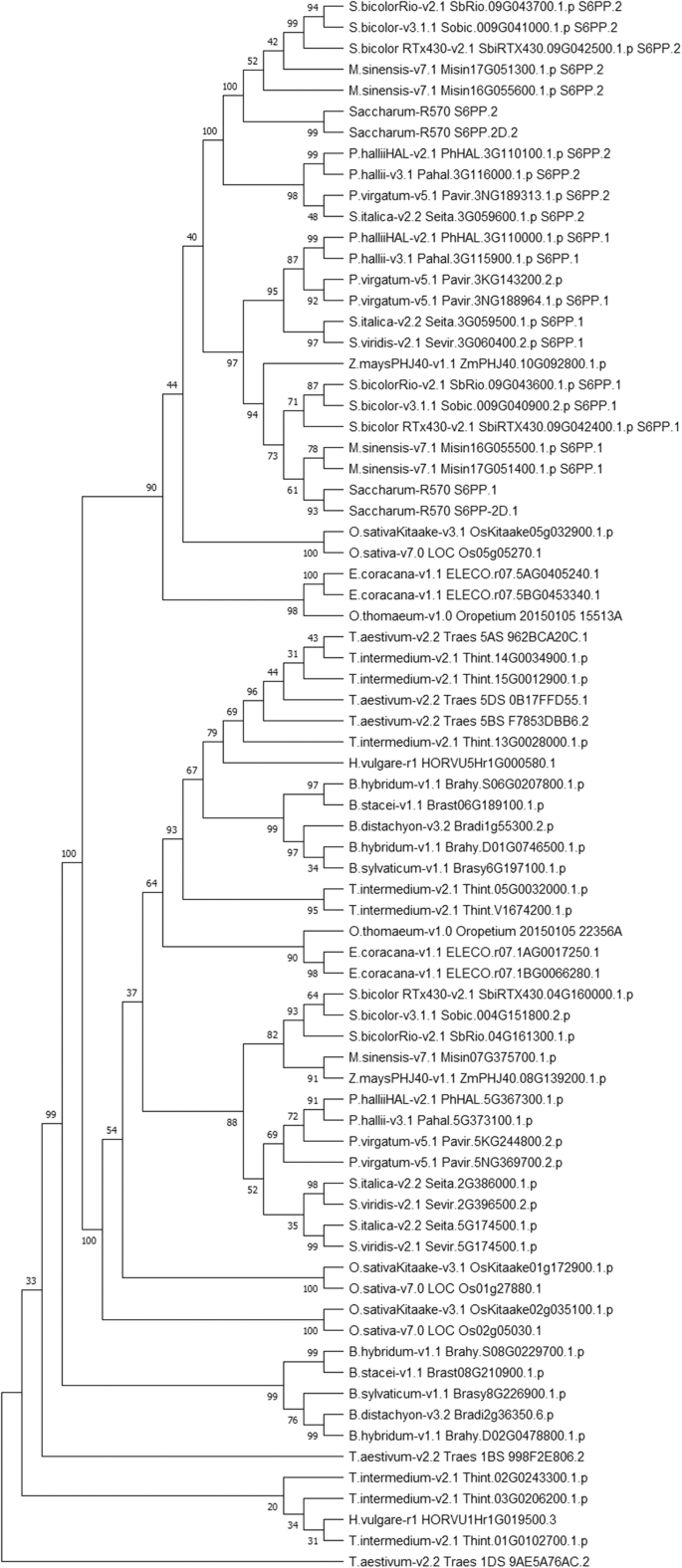
Phytozome13数据库的调查[22]的研究表明,S6PP串联重复不是甘蔗所特有的,至少也存在于两个科(禾本科和毛茛科)中。我们在不同品种的基因组中发现了串联重复高粱二色的和黍hallii,处女圆锥花序5,意大利狗尾草v2.2版,Setaria Viridis.v2.1版,miscanthus sinensis.v7.1,但不在玉米,Brachypodium distachion也不栽培稻.串联复制品位于所有分析的Poaceae中的〜5000个碱基的片段中,而在毛茛科洛矶山耧斗菜v3.1(用灰色高亮显示,表2.),包含串联重复序列的区域较大,约为8000 bp。
为了确定这种重复是否在禾本科植物中发生过多次,或者它是否是祖先的,只使用S6PP催化结构域建立了一个分子系统发育树(图。3.,图S4).的S6PP_2D.1和S6PP_2D.2注释用于探索双结构域S6PP蛋白中的每个特定结构域。两个高度支持的节点,表示S6第1页和所有S6PP.2同源物聚集在一起,每个包括相应的域S6PP_2D.这一结果支持了禾草科串联重复的祖先起源。有趣的是,玉米和水稻S6PP与甘蔗聚类S6第1页这表明它们可能已经失去了串联复制。
进一步研究甘蔗同源物的选择率,dN/dS计算[23]是在S6第1页,S6第2页,S6PP_2D,miscanthus17号染色体与玉米ZmSPP1 (ZmPHJ40 08G139200)和ZmSPP2 (ZmPHJ40 10G092800)同源。相互计算支持这些基因同样处于纯化选择下,以相似的替代率最有可能维持蛋白质功能。尽管如此,串联复制的基因彼此之间的关系比相应的基因之间的关系要远miscanthus串联正射影像(表S1).当使用玉米ZmSPP1和ZmSPP2进行dN/dS计算时,串联重复的基因与ZmSPP2更相似,这与图中ML树的结果一致。3..
表达模式S6PP甘蔗组织中的基因
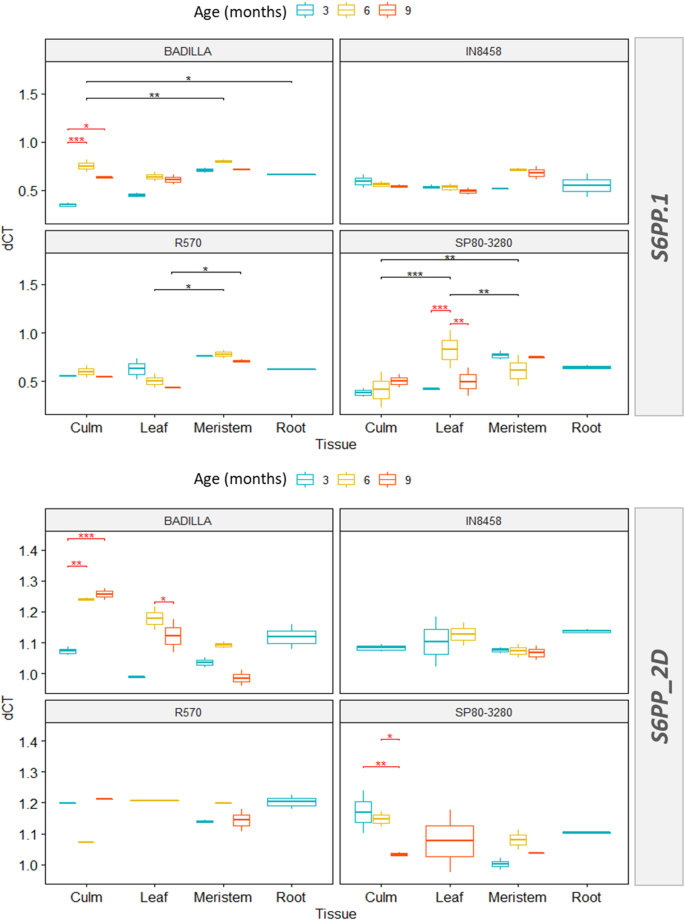
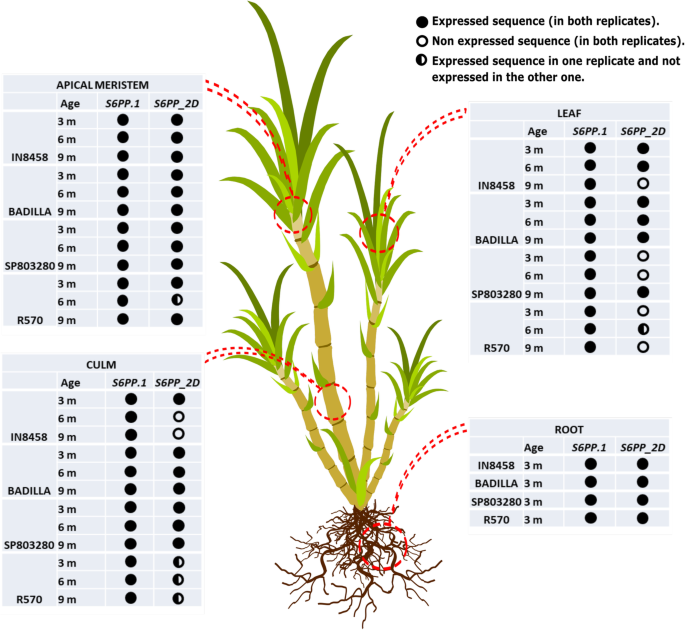
表达模式S6第1页和S6PP_2D通过用以下基本原理制造的实验验证甘蔗:蔗糖首先以成熟的叶子生产,因此是由光合作用的结果;然后它通过Phloem易于沉入组织(顶端单位和根)。我们检查了两种商业杂交品种SP80-3280和R570的表达模式,以及两个祖细胞S. Officinarum.(Badilla)和S. Spontaneum.(IN84-58)分布于叶片、茎、分生组织和根中,以及不同发育时间点(3、6、9个月)。
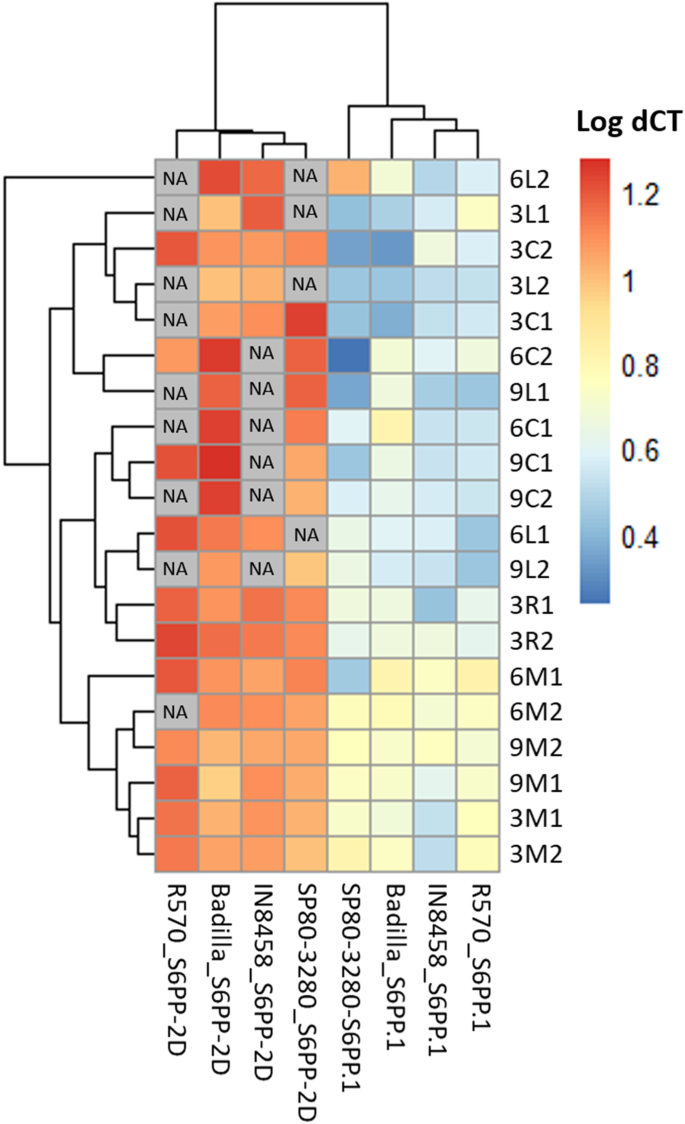
Log Delta CT值的热图(家务靶基因 - CT值的CT值)[24[呈现](图。4.)支持S6PP_2DIsoform主要在3个月时在大多数组织中表达,此外S6第1页异构体,但表达模式是可变的。商品品种的光合组织(叶和秆),S. Spontaneum.和S. Officinarum.有最高的表达水平S6第1页3个月,6个月和9个月。在表达模式上的差异S6第1页和S6PP_2D水槽组织(分生和根)中的基因在植物品种和时间上的较少明显和集群。
三因素方差分析[25]的分析以图中的箱形图表示。5.支持品种、龄期和组织间互作对表达的影响S6第1页和S6PP_2D基因.在Badilla和SP80-3280组织和年龄中观察到显著的表达差异,而在R570和IN84-58中则不明显。品种、年龄和组织之间的交互作用在统计学上得到支持P = S6PP和P= 0.007S6PP_2D.1.Badilla和SP80-3280基因的遗传背景都受到年龄和组织等因素的强烈影响。此外,对每个品种的组织和龄期进行简单的两两比较,采用Bonferroni调整(p.adjust = 0.05) [26]. 在所有条件下比较,84–58品种的非积累糖在表达模式上的变化最小。相反,商业SP80–3280变化最大,表达水平最高。
转录S6PP预期基因在叶片中,光合作用组织能够从SuC6P,蔗糖代谢途径中的S6PP酶的底物产生蔗糖。这种游离蔗糖通过针对所有非光合组织的韧皮肌的导电容器(包括水槽组织)易位,其中在一系列互连反应之后累积。从光合叶片(来源)的碳水化合物的出口为非光合营养组织(水槽)的生长和维持提供基材[27(图。6.).糖是所有真核生物的主要能量来源,碳水化合物是植物生长的基本过程所必需的,而甘蔗在接近培养周期的最后阶段生长速度较低时,会积累更多的蔗糖。
根据图中所示结果。4., S6PP基因在3月龄时在组织中表达较多,随着时间的推移表达量减少S6PP_2D在组织来源。在植物发育的早期阶段,当植物生长加快时,对蔗糖的需求更大[27].基于表达的S6PP结果表明,该基因参与合成、储存、使用和再合成之间的循环平衡,以维持植物的生长需要。因此,光养性叶片(源)通过韧皮部向异养性器官(库)的糖分运输和分配是控制作物生产力的主要参数[5.].
讨论
当甘蔗生长速度较低时,它会积累更多的蔗糖[28,当它成熟时,在10至14个月之间[29].早期体外试验表明,在50mm蔗糖的存在下,甘蔗品达品种的S6PP酶的催化活性被下调至40% [30.]. 进一步的生化研究表明,S6PP来源于甘蔗(糖spp. cv NCO310)和红甜菜在100 mM蔗糖的存在下分别受到40和59%的抑制[31].此外,S6PP来自水稻(栽培稻)对160 mM蔗糖的抑制率为15%SyneChocystis.sp. PCC 6803在200 mM和660 mM蔗糖胁迫下分别受到19和27%的抑制[15].有趣的是,在自然条件下,商业甘蔗品种的蔗糖水平可以达到高达650 mM的高浓度[32]. Carson等人报道的成熟和未成熟茎秆基因表达的比较方法[33]揭示涉及蔗糖代谢的一些酶在未成熟组织中更丰富,而在成熟组织中表达较低。
本研究结果支持了S6PP在不同组织和植物发育过程中的表达水平不同。根据(33[蔗糖的积累取决于组织的尺寸和活性。我们预计这里描述的结果支持累积蔗糖的能力可能与差异有关S6PP品种之间的基因表达水平。S. Spontaneum.(变种in -8458),总体上两者的表达变化最小S6第1页和S6PP_2D但是,本种的特点是没有积累大量的蔗糖。但是,Sspontaneum提高了对生物和非生物胁迫的耐受性和对育种计划的适应性。相反地,S. Officinarum.(Badilla),表达水平变化最大,已知在细胞中积累高水平的蔗糖,但对疾病的抵抗力较低。Wang等人[32]杂交商业品种能够积累高浓度的蔗糖,在成熟时最高650毫米或18%。因此,我们推测了减少的S6PP转录物是由于蔗糖的高积累。
结论
通过对两个商业杂种(R570和SP80-3280) BAC片段的比较,证实了21个基因组片段存在串联基因重复,其中一些片段被预测为单个转录本,因此包含两个S6PP域。系统发育分析表明,这种串联重复在禾草科中是保守的糖. 我们的RT-qPCR分析表明新的异构体,S6PP_2D,通过发展阶段差异表达,取决于所研究的甘蔗品种。总之,目前的作品描述了系统发育和表达模式S6PP甘蔗祖先和商业品种的基因。
方法
比较基因组学
21个包含S6PP分析了商业杂交甘蔗R570和SP80-3280的基因。桌子1.在手动检查和注释后列出在每个基因组片段中鉴定的名称,基因组品种来源,基因数量和转移元素(TES)。在BAC注释期间预测的所有基因均针对NCBI数据库愈合,并且在GIRI REPBASE中分析了TES [34]数据库,考虑80–80-80规则[35].利用MEGA7软件进行最大似然进化树分析[36)使用T92型 + G作为最佳模型,具有1000个自举,以确定碎片之间的系统和可能的分组和偏析。该对准包括从第一基因序列的起始密码子与第二串联重复基因的止芯钨的串联复制基因组区域包括外显子,内含子和基因状区域。对于比较目的,产生了邻近的连接和分析系统发育树,并且观察到分组的差异。表对齐序列大小在表中指示1.. 启动子分析是通过从上游提取620个核苷酸来完成的S6第1页和S6第2页起始密码子,用MEGA7进行对齐。Plantcare [37]来确定每个区域中潜在的顺式作用调节元件。PAL2NAL网上版本(http://www.bork.embl.de/pal2nal/)用于描述(通用代码;删除空白以启用DN / DS计算)的DN / DS计算用于构建表S1.
网络分析
使用大约1539个区域进行网络分析 曼德勒、SP70–1143、芒、Co-290、RB-835486、POJ-2878、Nco-310、RB-72454、NA 56–79、RB 867515、SP-81-3250等甘蔗驯化品种的bp,包括R570、SP80–3280和S. Spontaneum.和S. Officinarum.物种,通过PCR扩增来自种质组织收集并由De Setta等人测序。[12].用MEGA7软件对R570和SP80-3280 bac的同一区域进行序列比对,输出到dnasp5软件中[38]使用默认参数计算单倍型数量和分析序列之间的距离。用network5软件进行网络图形表示(网络5。系统发育网络软件网站:fluxus-engineering.com.)使用中值加入方法[39]和默认参数。可根据要求提供序列。
禾本科S6PP结构域系统发育
通过最大似然法进行系统发育分析,JTT公司利用从Phytozome13中获得的Poaceae基因组的S6PP催化域,采用1000个bootstrap伪复制。S6PP基因标记变体按其在串联区中的位置和取向分别编号为1和2。S6第1页和S6第2页表示基因组片段中的第一个基因及其在基因组中的串联重复。进化分析是在MEGAX软件中推断出来的[40].
表达谱的S6PP甘蔗组织中的基因
植物材料
本研究中使用的栽培品种保存在圣保罗市(Departamento de Botânica - IBUSP, BR)植物园的当地种质收藏中。这些品种是Eugenio Ulian博士在2000年的一个合作项目中提供的,此后一直处于无性繁殖状态。的表达式配置文件S6PP亚型中的基因S6第1页和S6PP_2D在商业品种R570和SP803280和物种中进行了研究Saccharum OfficinArum.(Badilla)和S. Spontaneum.(IN84-58)。从2018年到2019年从2018年到2019年成长季节,植物生长12个月,植物组织(叶,秆,顶尖和根系),六个,九个和12个月。最初种植在植物基质和蛭石上的侧向芽,在IBUSP温室,具有自然光线和正常环境条件的胰岛素基质和蛭石上。在芽开发后3-4周,根据植物大小转移到大盆中。使用Tissuelyzer II(QIAGEN®)将每个样品研磨成细粉末,并保持在-80℃直至使用。
RNA提取与cDNA合成
总RNA采用TRIzol®试剂(Invitrogen®)分离,按照制造商的说明,用DNAse TURBO DNA-free (Ambion®,Life Technologies™)消化,以去除任何污染的基因组DNA。用琼脂糖凝胶观察总RNA,以确定完整性。用逆转录酶法将总RNA作为cDNA模板Superscript™III(Invitrogen®)。将cDNA样品保持在-20℃直至使用。
qPCR表达定量
为了量化的表达S6第1页和S6PP_2D通过QPCR,在CD预测序列上设计了特异性引物。底漆设计涉及出口外显子结,以降低任何污染基因组DNA的误报的风险,增大尺寸为100bp。引物S6PP.1-2D_F(5'-CTC AGC CAG AGA GGA ATC AG-3')和s6pp。1-2D_R (5 ' -CAC GTT TCT CCA ACT TCT GTG-3')用于扩增两者S6第1页和S6PP_2D。虽然引物S6PP-2D_F(5'-ACA CGT TCA TCT TGG AAC CC-3′型)和s6pp-2D_R (5 ' -ATC ATA AGA CGG GCT砷化镓GC-3 ')用于表征亚型的表达S6PP_2D在外显子化的区域。
该实验与管家基因真核引发因子4-α标准化(EIF-4α.)用引物eIF4a\u F(5′)扩增- TTG TGC TGG ATG AAG CTG ATG -3')和eif4a_r(5'-GGA AGA AGC TGG AAG ATA TCA标签A -3')[41].定量PCR(qPCR)采用sso法™ 通用SYBR®绿色超级混合套件(BIO-RAD)按照制造商的说明操作。
表达数据来自两个独立的生物复制每三个技术复制QuantStudio 7 Flex实时PCR(应用生物系统公司)由2分钟变性在50°C, 30年代在98°C,然后随后40周期(98°C 15 s 60年代和60°C)。为了检查扩增子的特异性,每个基因的qRT-PCR产物均用于每个反应的熔融曲线分析(数据未示)。
数据分析
通过靶基因和内务管理基因之间的CT值差异获得dCT值(CT靶–CT内务管理)对于每个样品。对这些数据制作了热图,数值用对数标度(logdct)表示[24通过相关方法聚类。三因素方差分析[25]研究了品种、年龄和组织因素对基因表达的影响S6第1页和S6PP_2D.残差分析用于检验三因素方差分析的假设。采用夏皮罗-威尔克正态性测验评估正常程度。
可用性数据和材料
在当前研究期间生成和/或分析的数据集可在GenBank存储库中获得,检索号为PYBL01000039.1、PYBL01000047.1、PYBL01000103.1、KF184821.1、MW166195、MW166196、MW166197、MW166198、MW166199、MW166200、MW166201、MW166202、MW166203、MW166204、MW166205、MW166206、MW166207、MW166208、MW166209,MW166210和MW166211。
在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。
缩写
- S6PP:
-
蔗糖 - 磷酸磷酸酶
- SPS编号:
-
蔗糖磷酸盐合成酶
- 苏西:
-
蔗糖合酶
- BAC:
-
细菌人工染色体
- TE:
-
转座因子
- cd:
-
编码序列
参考文献
- 1.
Souza gm,维多利亚RL,Verdade Lm,等。第2章:生物能量数字。在:Souza Gm,Victoria RL,Joly Ca,Verdade LM,编辑。生物能源与可持续性:弥合差距。1 ed。巴黎:范围。ISBN 978-2-9545557-0-6;2015. p。29-57。
- 2.
Lorimer GH、Buchanan BB、Wolosiuk RA。光合作用:碳反应。在:泰兹L,泽格E,编辑。植物生理学。马萨诸塞州:美利坚合众国;2010年。199–242.
- 3.
李国强,李国强,李国强。植物生物学。北京:科学出版社。第1版。纽约:CRC出版社;ISBN 9780815340256;2009.
- 4.
关键词:玉米,光合作用,碳交换速率,同化产物出口速率,酶活性植物杂志。1987;83:283-8。
- 5.
来自叶子的碳水化合物出口:一个高度调控的过程和目标,以提高光合作用和生产力。植物杂志。2011;155:64-9。
- 6.
[15]姜世英,迟永红,王建忠,等。蔗糖代谢基因家族及其生物学功能。2015年Sci众议员。https://doi.org/10.1038/srep17583.
- 7.
甘蔗贮藏组织对糖的积累:蔗糖磷酸的作用。生物化学杂志。1964;93:521–6.
- 8。
伦杰。蔗糖合成的进化。植物生理学。2002;128:1490–500.
- 9。
D'Hont A.解开使用鱼和GISH的多倍体的基因组结构;甘蔗和香蕉的实例。CytoOgenet基因组Res。2005; 109:27-33。
- 10.
Gasmeur O, Droc G, Antonise R,等。高度复杂甘蔗基因组的镶嵌单倍体参考序列。Nat Commun。2018;9(1):2638。https://doi.org/10.1038/s41467-018-05051-5.
- 11.
Souza Gm,van Sluys Ma,Lembke CG等人。组装多倍体甘蔗基因组的373K基因空间揭示了世界领先的生物量作物中功能多样性的储层。傻瓜。2019年。https://doi.org/10.1093/gigascience/giz129.
- 12.
De Setta N、Monteiro Vitorello CB、Metcalfe CJ等。构建甘蔗生物技术基因组并确定进化趋势。BMC基因组学。2014https://doi.org/10.1186/1471-2164-15-540.
- 13.
张健,张鑫,唐华,等。同源多倍体甘蔗的等位基因定义基因组甜根子草L纳特·吉内特。2018https://doi.org/10.1038/s41588-018-0237-2.
- 14.
水稻中蔗糖-磷酸磷酸酶的性质(栽培稻树叶)。植物科学。1994;96:15-9。
- 15.
Lunn JE, Ashton AR, Hatch MD, Heldt HW。植物蔗糖- 6f -磷酸盐水解酶的纯化、分子克隆及序列分析。Proc Natl academy Sci U s.a 2000; 97:12914-9。
- 16.
惠特克DP。蔗糖-6-磷酸酶的纯化及性质豌豆竹笋。植物化学。1984;23:2429-30。
- 17.
Albi T,Ruiz MT,De Los RP,Valverde F,Romero JM。从拟南芥拟南芥中的蔗糖磷酸磷酸酶(SPP)同种型的表征及S6PPC结构域在二聚化中的作用。Plos一个。2016年。https://doi.org/10.1371/journal.pone.0166308.
- 18。
Cumino A、Ekeroth C、Salerno GL。蔗糖磷酸磷酸酶鱼腥藻sp。菌株PCC 7120:蛋白质和基因的分离显示出与高植物酶的显着结构差异。Planta。2001; 214:250-6。
- 19。
Fieulaine S,Lunn Je,Borel F,Ferrer JL。三种蔗糖蔗糖 - 磷酸酶的结构揭示了释放细胞中自由蔗糖的糖钳。植物细胞。2005; 17:2049-58。
- 20.
Fieulaine S, Lunn JE, Ferrer JL。蓝藻细菌蔗糖-磷酸酶与含糖双糖复合物的晶体结构。蛋白质。2007;68:796 - 801。
- 21.
但是,希梅列尼娜,雷舍特尼科夫,托罗森科。双功能蔗糖磷酸合成酶/磷酸酶参与蔗糖的生物合成甲基吡咯鞭毛千吨。女性微生物学。2013;347:43–51.
- 22.
等。植物基因组:绿色植物基因组学的比较平台。核酸研究2012;40:D1178-86网址:https://phytozome.jgi.doe.gov/.
- 23.
基于密码子的蛋白质编码DNA序列核苷酸替换模型。生物学报,1994,11:725 - 36。
- 24.
Schmittgen TD,Livak KJ。通过比较C(T)法分析实时PCR数据。NAT PROTOC。2008; 6:1101-8。
- 25.
Ganger MT、Dietz GD、Ewing SJ。qPCR数据分析的通用基础方法及简单分块法在qPCR实验中的应用。生物信息学。2017;18:534.
- 26.
阿姆斯特朗ra。何时使用Bonferroni校正。眼科性质选择。2014; 34:502-8。
- 27.
阮玉玲。蔗糖代谢:碳利用和糖信号传导的通路。植物生物学杂志。2014;65:33 - 37。
- 28.
Roberto GG. fisisiologia da maturação de cana-de-açúcar (糖spp):控制代谢,生产和加工。毕业论文,S·Paulo大学,2015。
- 29.
Hagos H、Mengistu L、Mequanint Y。埃塞俄比亚Tendaho热带地区新建制糖项目甘蔗品种最佳收获期的确定。《作物科技》2014;2:156.
- 30
来自植物组织的一种特殊的磷酸酶。j . 1966; 99:102-7。
- 31.
Hawker JS, Smith GM, Phillips H, Wiskich JT。红甜菜、甜菜和未成熟甘蔗茎液泡制剂相关的蔗糖磷酸酶。植物杂志。1987;84:1281 - 5.。
- 32.
Wang J,Nayak S,Koch K,Ming R。甘蔗的碳分配(糖物种)。植物科学,2013。https://doi.org/10.3389/fpls.2013.00201.
- 33.
Carson DL, Huckett BI, Botha FC。不同成熟期甘蔗叶片和节间组织的差异基因表达。黄建平。2002;
- 34.
宝W,小岛KK,大野O。REPBASE:update,真核生物基因组中重复元素的数据库。黑帮DNA。2015;6:11.https://doi.org/10.1186/s13100-015-0041-9.
- 35.
柳条t,sabot f,hua-van a等。真核转换元素的统一分类系统。NAT Rev Genet。2007; 8:973-82。
- 36.
Kumar S, Stecher G, Tamura K. Mega7:针对更大数据集的分子进化遗传学分析7.0版。《生物学报》2016;33:1870-4。
- 37.
Lescot M, Déhais P, Thijs G,等。PlantCARE,一个数据库CIS.-代理监管要素和工具门户在Silico.促进剂序列分析。核酸RES。2002; 30:325-7。
- 38.
Librado P,Rozas J。DnaSP-v5:DNA多态性数据综合分析软件。生物信息学。2009;25:1451–2.
- 39.
关键词:种内系统发育,中位连接网络,种内系统发育生物学报,1999;16:37-48。
- 40
Kumar S、Stecher G、Li M、Knyaz C、Tamura K。megax:跨计算平台的分子进化遗传学分析。分子生物学。2018;35(6):1547–9.
- 41
凌H,吴Q,郭J,许L,奎Y。实时定量RT-PCR法综合筛选甘蔗基因表达正常化的参考基因。公共科学图书馆一号。2014;9:5.
致谢
我们要感谢Tatiana Correa博士对GaTElab的技术援助。我们还要感谢经办编辑Beatriz Sabater Muñoz博士对我们的手稿进行了仔细的审查和处理。
资金
这项工作由FAPESP资助(2008/52074-8,2016 / 17545-8,2018 / 10746-3),CNPQ 308197 / 2010-0到MAV。本研究部分由Coordenaçãodeaerfeçoamentode Pessoal de Nivel高级 - Brasil(Capes) - 财务代码001 *部分提供资金。vgsp和dsmc是一斗士奖学金的接受者。HMD由FAPESP奖学金(2019/08239-9)提供支持。资助者没有参与数据的设计,分析和解释数据和写作稿件。
作者信息
从属关系
贡献
VGSP,HMD和DSMC执行了稿件中提出的所有实验;MAV设计,指导和协调研究。VGSP,HMD,DSMC和MAVS写了稿件。所有作者都读过并批准了稿件。
相应的作者
道德声明
道德认可和参与同意
不适用。
出版许可
不适用。
相互竞争的利益
本人确认已阅读BioMed Central关于竞争性利益的指南,并在手稿中包含一项声明,表明所有作者均无任何竞争性利益。
附加信息
出版商说明
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充信息
附加文件1:补充图1。
结构示意图S6PP和S6PP_2D基因(A) 在BAC-SCHRBaíu G04基因组片段中鉴定的S6PP.1和S6PP.2基因结构的表达。深蓝色和浅蓝色框代表外显子,而黑色箭头代表内含子(B) 在BAC SCHRBa_104_G22的基因组片段中鉴定的S6PP_2D基因结构的表达。深蓝色和浅蓝色框代表外显子,而黑色箭头代表内含子。红框对应于单域异构体中未发现的外显子化区域。
附加文件2:补充图2
.由S6PP基因排列的bac基因组片段的图示.所有在BAC注释过程中预测的基因都根据NCBI数据库进行整理,并且考虑到80–80-80规则(Wicker et al.2007),在GIRI RePBASE®数据库中分析TEs,如图所示。黑色矩形表示品种SP80–3280的BAC;紫色矩形代表R570品种的BAC,红色矩形代表S6PP基因,绿色矩形表示另一个性质的相邻基因,矩形内的空白箭头表示转录的方向,蓝矩形表示输液元件,矩形之间的阴影表示它是相同的基因或输液元件。
附加文件3:补充图3
.S6PP多重对齐。1上游地区。
附加文件4:补充图4。
Poaceae S6PP域多次对齐。
附加文件5:源图5。
来自甘蔗及其近亲的S6PP dNdS。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用本文
帕蒂达,v.g.s.,迪亚斯,h.m.,科尔奇诺,D.S.M.等等。甘蔗的蔗糖-磷酸磷酸酶显示了一个祖先串联重复。BMC植物杂志21,23 (2021). https://doi.org/10.1186/s12870-020-02795-5
收到了:
认可的:
出版:
关键词
- 蔗糖代谢
- 糖
- 比较基因组学
- 基因表达
- 系统发育推断
- 禾本科