摘要
背景
巨君草因其巨大的生物量,常被用作牲畜的饲料。然而,干旱胁迫通过影响植物的正常生长发育而降低饲料产量。因此,研究这种草抗旱性的分子机制将为提高其抗旱性提供重要信息。
结果
共生成干净数据144.96 Gb,并组装成144,806个转录本和93907个unigenes。在干旱胁迫7 d和14 d后,共观察到16726和46492个差异表达基因(DEGs)。与正常灌溉相比,在补液后的1,5,9天,分别观察到16,247,23,503和11598个deg。基因本体论和京都基因和基因组百科全书的途径分析揭示了与催化活性、甲基转移酶活性、转移酶活性和超氧化物代谢过程相关的非生物胁迫响应基因和途径。我们还鉴定了属于几个家族的转录因子,包括基本螺旋-环-螺旋(bHLH)、WRKY、NAM(无根尖分生组织)、ATAF1/2和CUC2(杯状子叶)(NAC)、脂肪酰基辅酶a还原酶(FAR1)、B3、成髓细胞病(MYB)相关和基本亮氨酸拉链(bZIP)家族,这些都是重要的干旱再水化反应蛋白。加权基因共表达网络分析也用于分析RNA-seq数据,预测基因间的相互关系。共获得20个模块,其中4个模块可能参与光合作用和植物激素信号转导,响应干旱和复水条件。
结论
我们的研究首次从转录组水平对不同干旱和恢复条件下巨君草干旱胁迫中涉及的DEGs进行了更全面的了解。这些结果可能揭示巨君草抗旱性的分子机制,为研究巨君草抗旱性提供丰富的遗传资源。
背景
干旱胁迫是对植物生长和产量产生不利影响的最具威胁性的环境约束之一[1].然而,随着全球气候变化,干旱的频率和强度不断增加[2,3.].干旱可引起植物细胞代谢失衡,影响植物叶片光能吸收,破坏植物的光合器官[4].而且,干旱会导致叶片中活性氧物质的积累,可能会加速生物膜脂过氧化产生有毒产物,从而抑制植物生长[5].对于遭受干旱胁迫的植物来说,总初级生产力不仅与其对干旱胁迫的抗性和耐受性密切相关,而且与植物在消除胁迫后从损伤中恢复的能力也有重要关系[6,7].因此,植物复水后的恢复能力是植物成功适应干旱环境的重要条件。补水有助于植物恢复生理功能,并能在一定程度上抵消干旱胁迫对植物的损害[7].然而,干旱胁迫后补水对植物生长的补偿往往是有限的。植物生长的恢复程度可能与植物复水前干旱胁迫的程度和持续时间有关,与植物的抗旱性有关[8].
为了应对干旱胁迫,植物在长期的进化过程中适应了各种自我保护和防御机制[9].植物通过关闭气孔来调节叶片的光合过程,从而降低叶肉的光合能力[8].植物通过调节体内抗氧化系统,消除多余的活性氧,维持体内氧化还原平衡。通过增加细胞渗透调节物质来增加细胞内水势,保持一定的膨胀,从而保护植物在干旱胁迫下的持续生长[10].植物激素通过协同或拮抗作用调节自身对干旱状态的反应机制。据报道,各种表达基因对干旱胁迫的反应[11].这些基因包括稳定膜蛋白、热休克蛋白和胚胎发生后期丰富蛋白,在稳定蛋白质结构和增强细胞的水结合能力方面发挥着重要作用。早期干旱诱导蛋白通过在干旱胁迫下产生特定的代谢蛋白并通过精确的信号转导调节基因表达来保护植物。脱氢酶基因(Dhn),是植物中最常见的蛋白质之一,可以保护细胞不缺水。此外,大量基因通过调控转录因子(transcription factors, tf)改变其表达[12].一些tf也在干旱胁迫下提供响应,包括脱落酸响应元件(ABREs)结合因子(ABFs, areb,或DPBFs) [13,14,15],脱水响应元件结合因子[16], MYB, snf1相关激酶2 [17].因此,了解在干旱胁迫条件下翻译和表达的各种基因将有助于阐明耐水亏机制,并促进新的植物栽培工具的开发,以应对气候变化。
巨君草是一种理想的禾本科植物4由于其生物量大,抗病性强,根系发达,具有保持水土、防风、固沙的作用。该植物已广泛应用于生态脆弱地区的综合环境治理[18].但干旱环境影响其产量,制约其规模化种植。为了提高巨君草在缺水条件下的生产力和生产性能,必须阐明巨君草对干旱的响应机制。近年来,分子生物学方法的发展促进了植物对环境胁迫的潜在响应机制的发现。RNA测序(RNA-seq)可以快速、全面地获得特定细胞或组织在某种状态下的基因表达,从而确定植物在非生物胁迫条件下生理代谢反应的分子机制[19].RNA-seq数据可以为新基因的发现提供见解,包括注释基因和差异表达基因(DEGs),以及分子标记[20.].与传统测序方法相比,RNA-seq可提供高通量测序结果,成本低,灵敏度高,可检测低丰度表达基因[21].通过RNA-seq已经在不同的禾草科物种中报道了大量与干旱胁迫反应相关的DEGs,如小麦[22],玉米[23],大米[24],高粱[25]、谷子[26].该方法可以获得不同发育阶段、不同组织和器官的转录本,是发现功能基因的基础和有效方法。
本研究利用Illumina测序技术,研究了巨君草对干旱胁迫和复水处理的响应基因。通过对巨君草幼苗DEGs的分析,探讨其对干旱胁迫的分子响应机制。此外,我们还利用生理指标来了解巨君草的干旱响应机制。由于只有少数研究确定了响应干旱胁迫的基因狼尾草本研究为进一步对草类进行靶向基因修饰提供了重要的转录组学数据库。
结果
巨君草幼苗对干旱和复水处理的生理评价
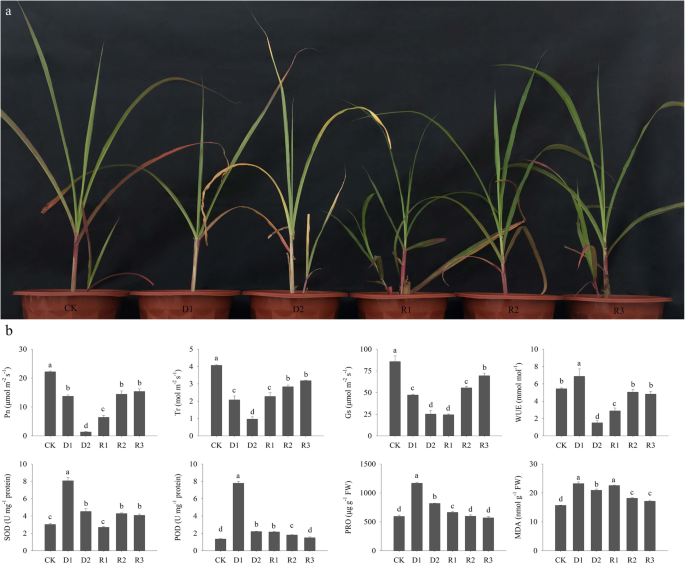
干旱胁迫和复水处理对巨军草生理指标均有影响(图2)。1a).与对照相比,干旱胁迫植株在D1和D2时Pn、Tr和Gs显著降低,而WUE在D1时升高,在D2时降低(图2)。1b).复水后除Gs外,其他各项生态指标均较干旱胁迫后14 d显著升高。随着复水时间的增加,巨君草的生态指数在复水第5天和第9天达到稳定阶段,g值稳定上升。Pn为14.43 ~ 15.40 μmol m−2年代−1在近7天的干旱胁迫下。Tr、g值为2.84 ~ 3.19 mol m−2年代−155.50 ~ 69.50 μmol m−2年代−1,均高于亏水7 d的植株。WUE增加至5.06 mmol mol−1,再浇水5天,与对照无显著差异(图;1b)。
干旱胁迫后,SOD、POD、PRO和MDA均呈上升和下降趋势。重新浇水后,SOD和PRO迅速下降(图。1b).恢复浇水1 d后POD保持稳定,MDA显著升高。随着复水时间的增加,POD、PRO、MDA呈持续下降趋势,SOD呈相反趋势。试验结束时,SOD和MDA水平分别为4.09 U mg−1蛋白质和17.16 nmol g−1FW,均显著高于非干旱胁迫下(P< 0.05),而POD和PRO与对照组相似。
转录组测序和组装
本研究共构建了18个非干旱胁迫(0 d)、干旱胁迫(7、14 d)和复水(1、5、9 d)条件下的cDNA文库,分别参考C0、D1、D2、R1、R2、R3。每种条件都有三次生物学重复。表中列出了测序的概述S1,在超过10亿个原始reads中,超过97.18%和大约94%的碱基具有a问-value分别≥20和≥30(误差概率为0.02 ~ 0.025%)。gc -含量在55.67 ~ 57.76%之间S1).所有原始FASTQ数据文件均提交给NCBI序列读取档案(SRA),登录号为PRJNA632455。
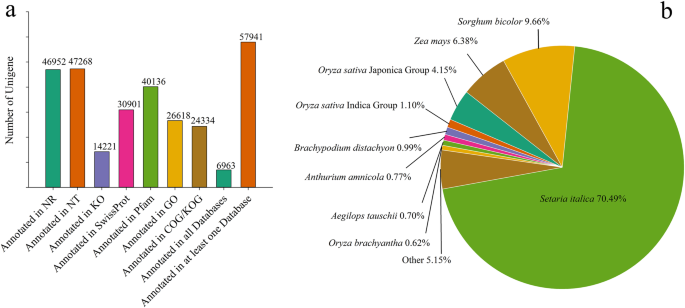
在过滤掉低质量的reads后,从六个样本中总共生成了9.67亿个干净的reads(表S1).使用Trinity生成了144,806个转录本,N50为1705 bp, N90为645 bp(表2)1).其中unigenes有93907个,其中小于300 bp有3630个unigenes, 300 - 500 bp有16003个unigenes, 500-1000 bp有35098个unigenes, 1-2 kb有25770个unigenes, > 2 kb有13406个unigenes。
基因的功能和通路注释
为了研究基因的功能,所有组装的unigenes被注释到Nr, Nt, Swiss-Prot, KOG, Pfam, GO和KEGG通路数据库中(见材料和方法)。共有57,941个unigenes在至少一个数据库中被注释,占unigenes总数的61.7%(图2)。2一、表S2).共有6963个unigenes(7.4%)在公共数据库中被注释。2a). Nr、Nt、KEGG、Swiss-Prot、Pfam、GO和KOG数据库中unigenes的数量分别为46,952(50.0%)、47,268(50.3%)、14,221(15.1%)、30,901(32.9%)、40,136(42.7%)、26,618(28.4%)和24,334(25.9%)。2一、表S2).unigenes的序列与Setaria italica,高粱二色的,玉米,粳稻组,籼稻组,Brachypodium distachyon,花烛属植物amnicola,山羊草属tauschii,选用brachyantha等(图;2b)。
干旱和复水条件下的DEGs
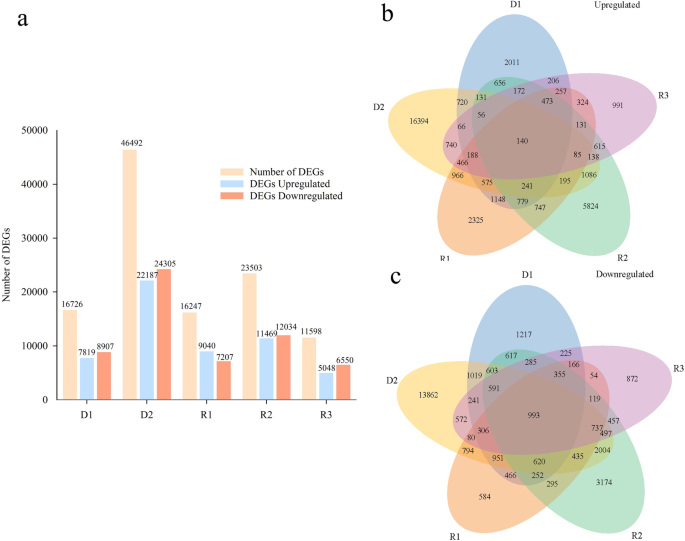
用TMM方法计算基因表达量并归一化;|log2(FoldChange)| > 1和调整p-value < 0.05为差异显著的阈值。我们发现62298个unigenes在干旱复水处理的样品中表现出差异表达。在干旱处理的第7天和第14天,共检测到16726和46492个DEGs。共上调7819和22187个DEGs,而D1和D2分别下调8907和24305个DEGs(图2)。3.a).与对照植物相比,R1、R2和R3分别检测到16247个(上调9040个和下调7207个)、23503个(上调11469个和下调12034个)和11598个(上调5048个和下调6550个)deg(图2)。3.一个)。
为了识别不同生理阶段的共同unigenes,每个比较中的重叠部分在维恩图中显示(图2)。3.b和c)。上调和下调基因的重叠量在干旱14 d与对照之间最高,显示>为70%的常见unigenes,表明强干旱后植物受到了损害(图2)。3.b和c)。上调和下调的unigenes重叠量第二高的时间是在补水5天之间,这表明在R2重新浇水后,unigenes逐渐恢复(图2)。3.b和c)。共140个上调的unigenes(图。3.b)和993个下调的unigenes(图。3.C)分别与干旱7天和14天以及补水1、5和9天与对照的基因重叠,表明一组共享的基因与对水分亏缺和补水处理条件的反应相关。
GO在DEGs中的富集
为了确定在干旱-再水化条件下表达的主要生物过程,我们在五个生理阶段根据FDR < 0.05显示了上调和下调的DEGs的每个GO富集分析(附加文件)2).在GO富集结果的基础上,我们选择了最显著的加入来解释生理变化。促进活性的过程主要富集在D1下调的DEGs中,而碳水化合物代谢过程只富集在D2和R1再浇水后下调的DEGs中。在D2下调的DEGs中,药物结合和ATP结合过程富集,在R2下调的DEGs中进一步富集,表明干旱响应下蛋白质的结合能力降低。在R1和R2上调的DEGs中,核糖体和肽代谢过程富集,而在R3上调和下调的DEGs中,核糖体的结构成分富集,提示细胞修复逐渐完成。dna结合的TF活性和转录调节活性在上调的DEGs中富集,而在R3下调的DEGs中富集细胞蛋白质代谢过程,表明复水后TF活性提高,蛋白质降解降低(表2)2).
KEGG途径富集分析
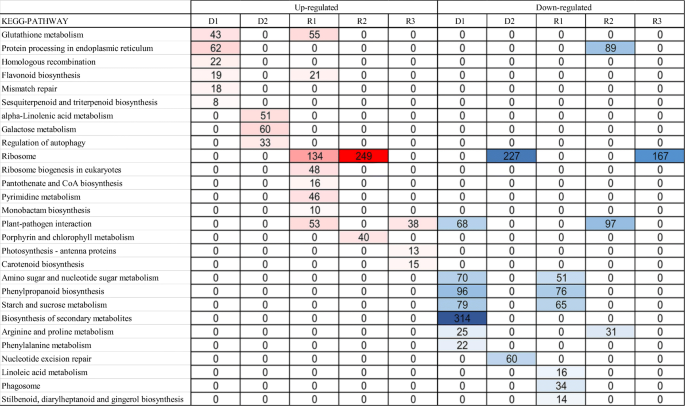
KEGG通路富集分析结果表明,干旱7 d与对照相比,巨君草中有1972个上调的deg和2337个下调的deg分别涉及117条不同的通路S3和附加文件3.).随着干旱时间的延长,有4490个上调的deg和5725个下调的deg分别通过119条和116条不同的途径被标记(表2)S3和附加文件3.).在复水1、5和9天后,2166、3106和1126个上调的deg和2096、3229和2016个下调的deg被注释到KEGG通路数据库中,其中涉及111、122和107种不同的上调通路和115、115和114种不同的下调通路(表2)S3和附加文件3.).根据KEGG通路分析,构建了反映显著富集通路中不同生物过程的热图(图2)。4).在这些通路中,在D1和R1上调的DEGs中,谷胱甘肽代谢富集,而在D1和R2下调的DEGs中,内质网中的蛋白质加工富集。在D1时,与同源重组和错配修复相关的通路被富集,而在D2时,α -亚麻酸代谢、半乳糖代谢和自噬调控被富集,这表明干旱对代谢的响应有所改善。在R1上调的DEGs中,真核生物核糖体的生物发生、泛酸盐和CoA的生物合成以及嘧啶的代谢都得到了富集,反映了再浇水后的恢复。核糖体相关通路主要富集在R1和R2上调的deg和D2和R3下调的deg中。植物病原菌相互作用富集在R1和R3上调的DEGs和D1和R2下调的DEGs中。在R2和R3上,与光合作用相关的DEGs在卟啉和叶绿素代谢、光合天线蛋白和类胡萝卜素生物合成途径中富集,表明再浇水后光合作用发挥了重要作用。在D1和R1下调的DEGs中,氨基酸糖和核苷酸糖代谢、苯丙类生物合成、淀粉和糖代谢都得到富集,而在D1和R2下调的DEGs中,精氨酸和PRO代谢得到富集。在D1和D2下调的DEGs中富集了二级代谢、苯丙氨酸代谢和核苷酸切除修复的生物合成。亚油酸代谢的相关途径; phagosome; and stilbenoid, diarylheptanoid, and gingerol biosynthesis were enriched in the downregulated DEGs at R1 (Fig.4).
KEGG分析中反映富集生物过程动态的热图。从KEGG富集中获得的实验过程中与干旱再水化相关的生理类别(见附加文件)3.).热图中包含FDR < 0.05的富集过程。红色和蓝色分别代表上调和下调的DEGs。颜色的强度反映了在每个生理阶段指示的deg的数量
关键unigenes对光合作用、抗氧化、渗透调节和植物激素信号转导过程的响应
为了进一步了解光合作用、抗氧化、渗透调节和植物激素信号转导过程对干旱和恢复过程的响应,我们选择了fpkm > 2注释的DEGs,并验证了与光合生物碳固定、光合作用、光合作用-天线蛋白、过氧化物酶体、精氨酸和PRO代谢以及植物激素信号转导等6种途径相关的功能,并将其分组(表2)3.,4而且5).在D1处理的巨君草中,与光合生物固碳、光合作用和光合-天线蛋白相关的基因分别上调了4、7和2个,下调了23、4和2个(附加文件)4).这些基因主要包括编码丙氨酸转氨酶2 (ALT2) (c116433_g3_i1)、丙氨酸转氨酶(ALT) (c111450_g1_i1)、磷酸烯醇丙酮酸羧化酶(PPC) (c114318_g2_i1、c119399_g3_i1、c98555_g1_i1)和光系统II蛋白M (PsbM) (c47941_g1_i1)和光系统I P700载脂蛋白A1 (PsaA) (c8283_g1_i1)的表达下调,以及光系统I P700载脂蛋白A1 (PsaA) (c8283_g1_i1)表达上调。随着干旱胁迫程度的增加,天冬氨酸转氨酶(AST) (c116017_g2_i1)、二磷酸果糖醛缩酶胞质同工酶(FBA) (c112618_g1_i3)、苹果酸脱氢酶(MDH) (c101919_g2_i1、c112985_g2_i3)、三磷酸异构酶(TPI1) (c111215_g2_i3)、5-磷酸核糖异构酶(RPI) (c118707_g1_i7)、醛缩酶C-2 (aldoc2) (c75858_g1_i1)基因表达上调,D2时|log2(FoldChange)|在1.5 ~ 4.1之间。而下调基因的|log2(FoldChange)|在1.1 ~ 12.5之间,尤其是|log2(FoldChange)|大于9的基因(c111709_g1_i1, c112618_g1_i1, c117517_g1_i1, c116040_g1_i1);这些基因分别编码叶绿体果糖-1,6-二磷酸醛缩酶(CpFBA)、果糖-二磷酸醛缩酶(FDA)、p -丙酮酸羧化酶(PEPC)和叶绿体核酮糖-1,5-二磷酸羧化酶/加氧酶小亚基(rbcS-Ma5)(表5)3.).
补液后,所有基因均下调,R1时|log2(FoldChange)|在1.7 ~ 2.9之间。随着复水时间的延长,更多基因在R2位点上调,其中磷酸化蛋白激酶(PRK) (c108665_g1_i1)、促氧增强子蛋白1 (OEE1) (c94338_g1_i1)、促氧增强子蛋白2 (OEE2)、光系统I反应中心亚基II (PsaD) (c108324_g1_i2)、rbcS-Ma5 (c116040_g1_i1)、促氧增强子蛋白3-1 (OEE3-1)、光系统II修复蛋白(PSB27-H1)、核酮糖-1,5-二磷酸羧化酶(rbc) (c102727_g1_i1)和TPA:苹果酸酶(c112733_g4_i4)的小亚基3.).复水结束时,由c117389_g2_i1和c119399_g3_i1编码的光系统II CP43叶绿素载脂蛋白(PsbC)和PPC表达下调,其他基因表达上调(表2 - 4)3.).
抗氧化和渗透调节过程在应对干旱胁迫中发挥重要作用。随着干旱胁迫的加剧,过氧化物酶体(S)-2-羟基酸氧化酶GLO1 (GLO1) (c119055_g1_i1)在D2处下调,在R3处上调。Cu/Zn SOD (c103167_g1_i1)和SOD [Cu-Zn] 4AP (c103687_g1_i3)在D1、D2和R1上调,但在R2和R3消失(表2)4).c104659_g2_i1、c112509_g1_i1和c105587_g1_i1分别编码Mpv17蛋白、PXMP2/4家族蛋白4和过氧化物酶体膜蛋白PMP22,在D1和D2时表达下调,而XDH (c119859_g1_i1)仅在D2时表达上调。复水后,长链酰基辅酶a合成酶1 (LACS1) (c113157_g1_i1)仅在复水阶段上调,而3-酮酰基辅酶a硫溶酶(ACAA2)在复水阶段下调(表2)4).4).
植物激素是植物的次生代谢产物。在干旱胁迫下,植物激素信号转导中大量表达上调和下调的DEGs,尤其是在干旱胁迫14 d时(附加文件)5).随着干旱胁迫的加剧,冠状蛋白不敏感1样蛋白(c117581_g1_i3)、丝氨酸/苏氨酸蛋白激酶SAPK5 (c78738_g1_i2)和a型反应调控因子ARR1 (c112083_g3_i1)下调,ABF2 (c112944_g1_i3)、ATP结合蛋白(c115628_g1_i3)、组氨酸磷转移蛋白(c102835_g2_i2)、TPA: saur56 -生长素敏感SAUR家族成员(c120116_g2_i4)上调。补水后,乙基不敏感蛋白2 (c120302_g1_i2)和a型响应调节因子ARR1 (c112083_g3_i1)在R2处上调,而ABF2、ATP结合蛋白和TPA: saur56 -生长素响应的SAUR家族成员则表现出与干旱条件下相反的表达(表2)5).
干旱胁迫和复水处理下巨君草TFs的分类
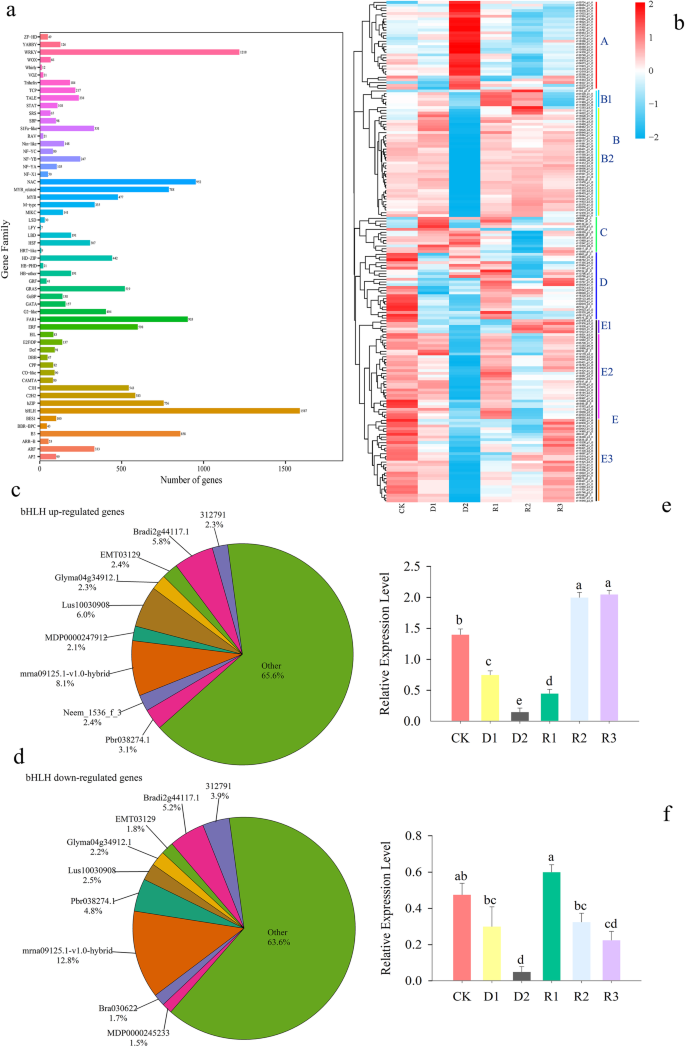
在干旱和补水期间,56个家系的tf被纳入了DEGs(补充文件)6).最大的一组tf是基本螺旋-环-螺旋(bHLH)家族,其次是WRKY,而其他tf属于NAC、FAR1、B3、myb相关和基本亮氨酸拉链(bZIP)家族(图2)。5a).在干旱和复水处理期间,bHLH家族510、1090、521、642和301个tf中的181、432、295、251和114个tf分别在D1、D2、R1、R2和R3上调(图2)。5a).干旱胁迫下,WRKY家族中91个上调因子和281个下调因子增加到398个上调因子和497个下调因子。复水后,WRKY家族中上调的tf数量呈减少趋势,而下调的tf数量呈先增加后减少的趋势(附加文件6).
在高表达水平(FPKM≥20)下,181个bHLH在水分亏缺和复水条件下进行分层聚类分析(图2)。5b).这些bHLH从A到e分为5个簇。A簇中的32个bHLH在D2期高表达,但在其他期低表达。在聚类B中,B1和B2中bHLH分别为6和40个。位于B1的基因c1132_g1_i1在R1和R2上高表达。在B2簇的D2位点发现了一些低表达基因。C簇由13个成员组成,从CK到D2高表达,但在R1到R3低表达。在D簇中,24个基因在干旱和复水条件下从高到低再回到高表达。聚类E分为E1、E2、E3 3个子聚类,分别有5个、31个、30个基因。在E1中,c107976_g3_i2和c110523_g1_i1在CK、R2和R3中表达量最高(图;5b).然而,最主要的bHLH是mrna09125.1-v1.0-hybrid,有68个上调和118个下调的tf。5C和d)。
为了验证TF测序的准确性,我们使用定量RT-PCR分析了随机选择的两种bHLH的相对表达水平(图2)。5e和f).水分亏缺后,c104644_g1_i1和c109045_g3_i1的相对表达量在干旱后14 d显著下降,在恢复后1 d显著升高。这些结果显示出与RNA-Seq结果相似的表达模式。
加权基因共表达网络分析模块生成及功能富集分析
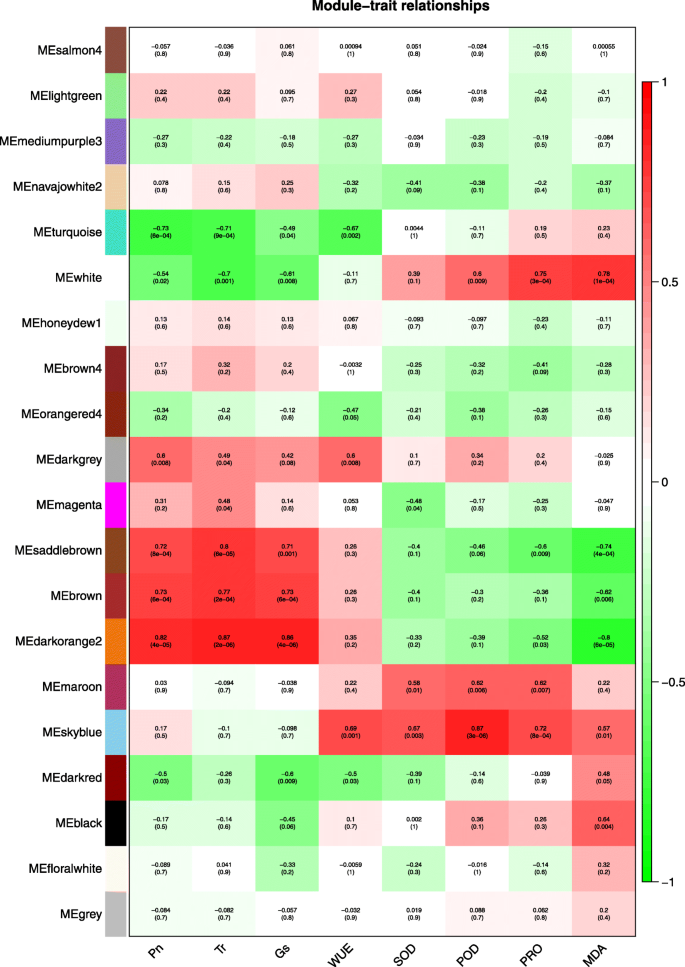
利用WGCNA分析了巨草在水分亏缺和复水条件下的基因共表达谱,检测了基因与生理指标的关系,以及调制间和调制内基因的关系。确定并获得20个共表达模块及相关系数(图2)。6).生理指标与深橙2、天蓝、白色模块呈显著正相关,相关系数在0.67 ~ 0.87之间。而Pn、Tr与绿松石模组呈负相关,MDA与深橙模组呈负相关,相关系数为0.71 ~ 0.8。
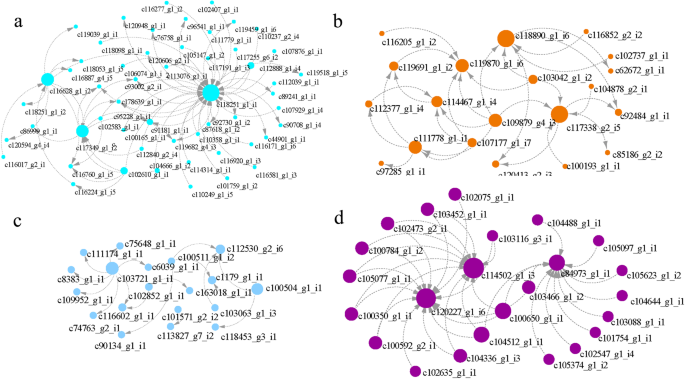
巨君草生理指标相关基因主要集中在蓝绿色、深橙色、天蓝色和白色模块。因此,我们选择每个模块中权重较高的基因进行分析并绘制网络。c118251_g1_i1、c118890_g1_i6、c103721_g1_i1和c120227_g1_i6分别编码β-葡萄糖苷酶、肽/组氨酸转运体、LOC103649875和α/β水解酶,在四个模块中度最高(图2)。7,附加文件7).
讨论
抗旱性是一个复杂的生物过程,受植物多个基因的控制和调节。本研究采用综合的方法,探讨了巨君草在干旱胁迫和恢复过程中生理反应的分子机制。高通量测序(RNA-seq)和从头转录组分析[27],研究了巨君草对干旱胁迫的分子响应。
对从头转录组组装和序列注释的洞察
由于缺乏基因组和转录组数据,巨君草的遗传背景和功能基因尚不完全清楚。因此,大量的unigenes没有被注释,只有61.7%的unigenes在至少一个数据库中被注释。这与报道的物种转录组测序的注释结果不同,例如普通野豌豆,在至少一个数据库中注释了大约5亿个干净的reads,组装了174,636个转录本和83.48%的unigenes [28].在普通荞麦中,共组装了53404个unigenes,在GO数据库中注释了39.33%的unigenes [29的8426和12642个unigenes水松在KEGG和GO数据库中分别标注了物种[30.].这表明,对于那些没有参考基因组的物种,转录组中的大量数据仍需要进一步挖掘。
光合作用及其相关过程对干旱和复水条件的响应
通过转录组数据分析,光合途径中部分基因丰度存在差异,这可能导致巨军草在不灌溉补水后光合指标发生变化(图2)。1b).在干旱胁迫开始(D1),水分利用效率呈显著上升趋势(图1)。1b).水分利用效率是植物光合和蒸腾特性的综合反映。水分亏缺期间,Pn的下降速率慢于Tr,水分利用效率呈上升趋势。然而,根据转录组数据分析,只有PsaA表达上调(表2)3.).PsaA是一种核心蛋白,对PSI的功能组装至关重要。31].PsaA的上调会使PSI保持稳定,从而延缓光合速率的下降。由此可见,编码PsaA的基因可以调节较高的水分利用效率以应对轻度干旱胁迫。随着胁迫时间的延长,Pn显著下降,这可能是由于干旱胁迫下PEPC、CpFBA、FDA和rbc - ma5蛋白表达下调所致(图2)。1b和表3.).PEPC是一种重要的C4植物光合多功能酶,可用于转入植物体内提高光合效率,成为提高作物产量的重要途径[32,33,34,35].在干旱胁迫下,转基因PEPC水稻表现出较强的耐旱耐光能力,这是因为它可以在保护细胞中积累苹果酸或草酰乙酸,促进气孔的开放,增强光合作用[32].在我们的研究中,当巨君草经历强烈的水分亏缺时,PEPC蛋白下调,导致Pn、Tr和Gs下降。这些结果表明,下调PEPC会导致气孔关闭,从而导致Tr降低,导致CO减少时Pn下降2进入叶肉细胞。CpFBA是控制光合作用速率的关键酶之一,通过提高Calvin循环中的固碳效率来增强植物的抗性[36,37].它在提高适应性方面起着非常重要的作用Sesuvium portulacastrum在盐和干旱胁迫下[38]和保持转基因烟草的高光合速率和生物量[39,40].在本研究中,干旱导致光合作用中几个关键酶调节基因的表达下调,这也是巨君草Pn显著下降的主要因素。
复水初期,Pn、Tr和WUE均显著增加,而Gs保持稳定。同时,基因表达下调(图;1b和表3.).这一发现反映了植物不能迅速从干旱胁迫中恢复,因为气孔不能立即打开。在补水5 - 9天期间,编码PRK、OEE1、PSI-LHC4、MDH、CAB、OEE2、psaD、rbc - ma5、OEE3-1、FD3、PSB27-1、rbc和TPA:苹果酸酶的基因数量上调(表2 - 1)3.).这些蛋白编码基因可能是干旱胁迫恢复的主要调控基因。当巨君草再次复水时,WUE达到对照状态(图2)。1b).转录组结果显示,OEE蛋白家族编码基因上调。oee是氧气进化和光系统II稳定性最重要的蛋白质[41].在我们的研究中,OEE基因在巨君草的干旱和复水过程中发挥了重要作用。结果与栽培小麦和挪威云杉相似,其中OEEs是光合系统中的关键酶,并在干旱胁迫下增强[42,43].
巨君草抗氧化酶和渗透调节对干旱和复水条件的响应
巨君草通过调节抗氧化剂能力和渗透调节物质的数量来提高其对干旱环境的适应能力。在本研究中,SOD、POD和PRO在干旱胁迫下先升高后降低(图2)。1b).补水后POD和PRO继续下降,SOD则相反。SOD是一种广泛存在于植物中的金属酶。根据金属亚群的不同,SOD通常分为Cu/Zn-SOD、Mn-SOD、Fe-SOD等三种不同类型[44].在我们的研究中,Cu/Zn SOD是应对干旱胁迫的主要调节蛋白。Cu/Zn-SOD是清除活性氧的第一线抗氧化体系,与植物抗逆性密切相关[45].过氧化物酶体是重要的细胞器,可能含有高度可变的调节许多重要细胞过程的酶组[46].MPV17是真核生物过氧化物酶体膜的导入蛋白之一[47].在我们的研究中,MPV17在干旱胁迫下下调,在恢复过程中消失4).这一发现可能是因为该基因在缺水条件下作为抗氧化酶形成的主要调节因子。在干旱胁迫下,PRO可能通过P5CS1上调,这支持了PRO作为渗透调节因子的功能[48].
植物激素反映了巨君草的干旱和复水条件
植物激素不仅广泛参与植物生长发育的各个阶段,而且在调节植物生长以适应各种生物或非生物胁迫方面发挥着重要作用。在我们的研究中,ABF2、ATP结合蛋白、TPA: SAUR 56-生长素响应的SAUR家族成员和a型响应调节剂ARR1 l在干旱和恢复过程中表达相反(表2)5).ABF2作为abre结合因子,是aba依赖通路的主要调控因子[49].巨君草在干旱胁迫下,ABF2在D1和D2上调。而当脱水状态消失后,ABF2在R2处开始下调,说明ABF2作为一种激素调节因子,能够快速调节植物生长以适应环境胁迫变化(表2)5).类似的结果在拟南芥和水稻中也有报道,ABF2的过表达显著提高了植物的耐旱性[14,50].这一发现也证实了ABF2在植物对干旱胁迫的反应中起着重要作用。
TFs调节巨君草的抗旱性
转录调控是植物响应胁迫的关键步骤,它通过暂时性和空间性的调控转录靶基因[51,52].tf在植物抗旱性中发挥重要作用,通过转录调控下游基因,提高植物的抗逆性[53].因此,本研究为发现和分离巨君草耐干旱因子,进一步阐明巨君草耐干旱分子机制提供了重要信息。超过15000个编码TF的DEGs分布在主要的TF家族中,包括bHLH、WRKY、NAC、myb相关、FAR1、B3和bZIP家族(图2)。5a和附加文件6).这些已确定的TF家族在植物的抗逆性方面是众所周知的[28].
bHLH家族是植物中最大的转录因子之一,在光信号、激素信号、损伤和干旱胁迫反应中起着关键作用[54].例如,bHLH家族在水稻、玉米和小麦基因组中分别有183、231和571个成员[55],共有162名成员拟南芥[56], 230个小白菜[57],共有146名成员Brachypodium distachyon[58],而apple有175名会员[59],其中大多数具有干旱胁迫响应的特征[60].此外,一个水稻结构域基因(OsbHLH148)可作为茉莉酸盐信号模块组件提供耐旱性[61].然而,小麦的过度表达TabHLH39转基因基因增强了抗旱性、耐盐性和抗霜性拟南芥[62].在我们的研究中,干旱胁迫诱导了843个属于bHLH TF基因家族的DEGs的上调和923个DEGs的下调(附加文件)6).此外,干旱14 d后,432个和658个deg分别上调和下调6).补液后,bHLH家族成员的数量下降(补充文件6).这一发现说明bHLH TF调控的基因在干旱加重条件下会发生显著变化,证明bHLH TF在干旱胁迫的调控中起着积极的作用。
在聚类分析中,我们将bHLH分为5个大类和8个亚类,每个亚类中的基因表达趋势相似(图2)。5b).位于A簇的32个bHLH在严重干旱条件下(D2)上调,但在补水后下调(图2)。5b). b簇基因在A簇中表达相反,说明位于A簇和b簇的bHLH在相应的干旱胁迫和复水条件下具有相反的功能。这一结果可能是由于bHLH基因数量众多,功能强大,从而导致它们有不同的表达。
网络分析揭示了巨君草抗旱性的关键基因
在鉴定出与巨君草抗旱性相关的4个关键模块后,通过WGCNA分析,发现各模块中的轮毂基因(图2)。6,7和附加文件7).在绿松石模块中,β-葡萄糖苷酶是与激素调节相关的中心基因。此外,在巨君草遭受严重干旱胁迫和补水修复时,也会出现上调和下调(附加文件)7).β-葡萄糖苷酶循环是决定ABA浓度的关键步骤,影响耐旱性和光合作用。β-葡萄糖苷酶同工酶对细胞ABA库有显著贡献,在气孔密度和孔径大小中起重要作用[63].在拟南芥叶片中,β-葡萄糖苷酶水解失活ABA,使ABA大量积累在叶片中,提高叶片抗旱性[64].由于β-葡萄糖苷酶在干旱胁迫下高表达,结果与本文相似。
结论
在本研究中,我们首次报道了巨君草干旱再水化相关基因的转录组数据。共组装了93,907个unigenes,通过功能数据库标注了57,941个基因。干旱胁迫下DEGs的表达和β-葡萄糖苷酶枢纽基因的鉴定有助于阐明植物在干旱胁迫下的响应机制、复水恢复和生理指标。本研究不仅为巨君草抗旱适应性的基因组学研究提供了新的视角,而且为植物发育非生物抗旱提供了候选遗传资源。
方法
植物材料及干旱复水处理
巨君草幼苗采自福建农林大学种植基地。选择芽饱满、茎粗一致的植株,种植在1:1混浊土和蛭石填充的花盆中。每个盆装2.5公斤的灰土和蛭石,一个巨君草茎节。所有材料都种植在室温(27°C)和良好灌溉的温室中。1个月后,选取生长稳定(7片叶)且生长健康的植株进行干旱试验。
由于停止灌溉,植物受到干旱胁迫。在干旱的第0天和第7天和第14天(D1和D2)分别采集第3和第4片叶片作为对照。在干旱胁迫14天后,将幼苗浇水至田间容量,并在重新浇水后的1、5和9天(R1、R2和R3)收集叶片组织。为消除开发过程对测试结果的影响,设置了统一的实验结束时间,并统一采样。收集4个独立的生物学重复进行生态和生理测试,3个重复用于RNA-Seq分析。将组织立即收集到液氮中,并在−80°C保存,直至使用。
巨君草生态生理指标的测定
本研究使用CIRAS-3便携式光合仪(PP-Systems Company, Amesbury, MA01913, USA)对幼苗的光合参数进行了观察。的有限公司2参比叶腔浓度控制在390 μmol·mol−1,光合有效辐射和空气相对湿度设置为1200 μmol m−2年代−1和75%。实验装置自动记录净光合速率(Pn, μmol m−2年代−1),蒸腾速率(Tr, mol m−2年代−1气孔导度(Gs, μmol m−2年代−1).同时,采用公式计算水分利用效率(WUE): WUE = Pn/Tr, mmol mol−1.生理指标,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)活性、丙二醛(MDA)和脯氨酸(PRO)含量,均按照先前报道的方法测定[65,66].
RNA提取
根据产品说明书,使用TRIzol试剂(TransGen, Beijing, China)从巨君草幼苗中分离和提取高质量的总RNA。RNA纯度和浓度使用NanoDrop 1000分光光度计(赛默飞世尔科学公司,威尔明顿,DE,美国)进行测试。RNA分子的完整性使用Agilent Bioanalyzer 2100系统(Agilent Technologies, Santa Clara, CA, USA)进行测量。用1%琼脂糖凝胶检测总RNA质量。
转录组测序文库制备
RNA-seq文库使用Illumina公司的TruSeq RNA样品制备试剂盒(Illumina Inc., San Diego, CA, USA)根据产品说明书构建。从总RNA中纯化与聚t低聚磁性珠连接的mRNA,用二价阳离子在NEBNext第一链合成反应缓冲液(5×)中高温裂解。随机六聚体引物和M-MuLV逆转录酶(RNase H-)用于逆转录片段mRNA的第一链cdna。然后,DNA聚合酶I和RNase H (Invitrogen, Carlsbad, CA, USA)被用于合成第二链cdna。其余分子通过外切酶/聚合酶活性转化为钝端。cDNA片段经AMPure XP系统(Beckman Coulter, Pasadena, CA, USA)纯化后,在洗脱缓冲液中进行末端修复并添加poly(a)尾,然后连接到具有合适长度片段的测序适配器。文库在Illumina HiSeq 4000平台上测序,生成150 bp的配对末端reads。
序列读取映射和汇编
对FASTQ文件中的原始数据进行初始化处理。Bowtie 2用于过滤rRNA [67].然后,通过内部Perl脚本处理原始的短读取。在这一步中,去除含有适配器的reads,去除质量分数低于5的碱基小于50%的低质量reads和N碱基大于10%的未知碱基,可以获得干净的reads和更可靠的结果。同时计算干净数据的gc含量、Q20、Q30和序列重复水平。转录组从头组装使用Trinity软件,参数Kmer = 25 [68].短读根据它们的重叠区域被组装成contig。然后,CD-HIT (http://www.bioinformatics.org/cd-hit/), 95%全局序列同一性,通过对从头组装的转录组序列进行聚类以去除冗余来获得unigenes。
基因转录本的功能注释
为了进行功能注释,我们使用核苷酸数据库(Nt)以10-5 e值阈值对组装的unigenes进行BLAST分析[69].unigenes用BLASTx工具标注,E-value < 10−5基于NCBI非冗余蛋白序列数据库(Nr)、Swiss-Prot蛋白数据库和真核聚类同源蛋白组(KOG)数据库[69].将搜索结果导入Blast2GO版本b2g4pipe_v2.5进行基因本体(GO)赋值[70].KOBAS工具(Kegg自动注释服务器)用于Kegg骨科和Kegg路径分配。此外,将unigenes作为查询序列用于Pfam (Protein family)的搜索。
基因表达定量和差异表达分析
使用Bowtie校准器和期望最大化方法(RSEM)进行基因表达量化,通过Perl脚本align_and_estimate_plenty .pl与Trinity协议中的-est_method RSEM获得读取计数的数量[71,72].将unigenes的表达水平归一化,计算为组装和聚类过程中每百万映射片段(FPKM)中每千碱基转录本的片段数[73].在使用TMM对读计数数据进行标准化之后p-通过Benjamini-Hochberg方法调整edgeR包分析的值,以确定错误发现率(FDR)并识别deg [74].然后,p-value从测试中得到的问价值。差异基因表达筛选的标准为|log2(FoldChange)| > 1和问-value < 0.05。
GO功能和KEGG通路富集分析
为了研究DEGs的生物学意义,利用GO数据库,利用GOseq (v1.22)软件对巨君草不同处理过程中DEGs的GO富集分析[75].参数设置是正确的p- value小于0.05。利用KEGG数据库分析了deg的各种代谢途径。使用KOBAS 2.0 web服务器对deg的统计富集进行了测试,并进行了校正p-value < 0.05被认为在KEGG中显著富集[76].
DEGs的TF分析
所有鉴定的DEGs均用PlantTFDB(植物转录因子数据库)4.0 (http://planttfdb.cbi.pku.edu.cn/),阈值设为1 × e−5.
加权基因共表达网络分析
利用WGCNA探讨基因与生理指标之间的关系,以及基因与基因之间的关系。筛选出FPKM小于0.5的基因,将剩余基因输入WGCNA网络构建(R中为WGCNA v1.69包)[77].利用Pearson相关矩阵和网络拓扑分析分别计算基因相关性和软阈值功率。然后,将邻接矩阵转换为拓扑重叠矩阵。在标准WGCNA网络中,power设置为7,minModuleSize设置为30,mergeCutHeight设置为0.25。使用Cytoscape v3.7.2对网络进行可视化。
定量RT-PCR验证
为了验证RNA-seq结果的准确性,在CFX Connect qPCR检测系统上进行了定量RT-PCR分析。随机选取两个bHLH转录因子,以PgACT基因作为内参基因(引物见表)S4作为补充数据)。2——∆∆CT方法计算基因的相对表达量。
生理数据的统计分析
生理数据采用SPSS20.0 (SPSS Inc., Chicago, IL, USA)进行统计分析。采用单因素方差分析(one-way ANOVA)和Duncan 's多重比较分析(P< 0.05)。
缩写
- 度:
-
差异表达基因
- TF:
-
转录因子
- bHLH:
-
基本helix-loop-helix
- 南京:
-
NAM(无顶端分生组织)、ATAF1/2和CUC2(杯状子叶);
- FAR1:
-
脂肪酸酰基辅酶a还原酶
- MYB:
-
成髓细胞瘤
- bZIP:
-
亮氨酸拉链
- SOD:
-
超氧化物歧化酶
- 圆荚体:
-
过氧化物酶
- 正方观点:
-
脯氨酸
- MDA:
-
丙二醛
- Pn:
-
净光合速率
- Tr:
-
蒸腾速率
- g:
-
气孔导度
- WUE:
-
用水效率
- WGCNA:
-
加权基因共表达网络分析
参考文献
- 1.
罗丽娟,夏华,陆斌斌。社论:抗旱性作物育种。前沿植物学报2019;10:314。
- 2.
Banks JM, Percival GC, Rose G.季节性耐旱性排名的变化。树木。2019;33(4):1063 - 72。
- 3.
李志刚,李志刚,李志刚,李志刚。欧洲山毛榉叶片弹性生理响应研究(Fagus sylvatical)对夏季干旱和干旱释放的影响.前面。植物科学,2018;9:187。
- 4.
Hein JA, Sherrard ME, Manfredi KP, Abebe T.大麦第五叶和穗器官(大麦芽L.)对干旱胁迫表现出不同的生理和代谢反应。中国生物医学工程学报。2016;16(1):248。
- 5.
Torres-Franklin ML, Gigon A,甜瓜DFD, zuilly - fodil Y, Pham-Thi AT。干旱胁迫和复水影响豇豆叶片MGDG和DGDG合成的平衡。中国生物医学工程学报。2007;29(2):326 - 326。
- 6.
傅兰,李丽娟,李丽娟,陈丽娟,陈丽娟。花生光合作用和抗氧化系统在干旱和复水循环中的动态响应。植物学报,2016;43(4):337-45。
- 7.
田瑞敏,单晓荣,王勇,郭淑云,毛波,王伟,等。紫花苜蓿分枝期抗氧化系统对干旱胁迫和复水的响应。地球科学进展,2017;29(2):344 - 344。
- 8.
徐泽泽,周广生,清水华。植物的生长和光合作用是否受到复水后干旱前的限制?中国机械工程学报,2009;26(3):457 - 457。
- 9.
法鲁克M,瓦希德A,小林N,藤田D,巴士拉SMA。植物干旱胁迫:影响、机制与管理。农业可持续发展,2009;29(1):185-212。
- 10.
郭友友,于海燕,杨敏敏,孔德生,张玉军。干旱胁迫对苜蓿叶和根脂质过氧化、渗透调节及抗氧化酶活性的影响枸杞ruthenicumMurr。幼苗。中国植物学报,2018;26(2):344 - 344。
- 11.
龚卓忠,熊丽敏,史海涛,杨硕,Herrera-Estrella LR,徐国华,等。植物非生物胁迫响应与养分利用效率。中国生命科学,2020;29(5):635-74。
- 12.
丸山K, Urano K,吉原K,森下Y,樱井N,铃木H,等。低温和脱水对水稻代谢产物、植物激素和基因转录物影响的综合分析。中国生物医学工程学报,2014;29(4):379 - 379。
- 13.
藤田Y,藤田M,佐藤R,丸山K, Parvez MM,关M,等。AREB1是一种新的abre依赖性ABA信号的转录激活子,可增强植物的干旱耐受性拟南芥.植物学报。2005;17(12):3470-88。
- 14.
马侯赛因,赵智,韩敏,安忠,全俊,安庚,等。abre结合bZIP转录因子OsABF2是水稻非生物胁迫和ABA信号的正向调节因子。植物营养学报,2010;29(4):344 - 344。
- 15.
金生,姜志勇,赵迪,朴志华,金世永。ABF2是abre结合bZIP因子,是葡萄糖信号传导的重要组成部分,其过表达影响多重应激耐受。植物学报,2004;40(1):75-87。
- 16.
Agarwal PK, Gupta K, Lopato S, Agarwal P.脱水响应元件结合转录因子及其在抗逆性工程中的应用。中国生物医学工程学报,2017;29(3):344 - 344。
- 17.
杨晓东,张晓东,张晓东,等。转录组分析松果体halepensis在干旱胁迫和恢复期间。树物理学报,2018;38(3):423-41。
- 18.
刘峰,林东,林浩,刘宏,林哲。巨君草的生理和光合响应(剩下狼尾草)对干旱胁迫的影响。费森尤斯环境通报。2017;26(6):3868-71。
- 19.
Martin LBB, Fei ZJ, Giovannoni JJ, Rose JKC。RNA-seq催化植物科学研究。中国植物科学,2013;4:1。
- 20.
张华,何磊,蔡林。转录组测序:RNA-Seq。方法Mol生物学1754;2018:15-27。
- 21.
李伟,姜涛。基于偏倚RNA-Seq reads的转录组组装和异构体表达水平估计。Bioinform。2012;28(22):2914 - 21所示。
- 22.
Camilios-Neto D, Bonato P, Wassem R, Tadra-Sfeir MZ, Brusamarello-Santos LCC, Valdameri G,等。巴西偶氮螺旋菌定殖小麦根系的双rna序列转录分析显示养分获取和细胞周期基因上调。BMC Genet 2014;15:378。
- 23.
张丽敏,刘小刚,曲晓妮,于勇,韩素萍,窦勇,等。对Na2CO3胁迫的早期转录组适应改变了玉米基因组中总基因的四分之一的表达,并在NaCl和高pH胁迫下表现出共享和独特的特征。中国生物工程学报,2013;29(4):344 - 344。
- 24.
周勇,杨鹏,崔峰,张芬芬,罗旭东,谢建科。东乡野生稻幼苗盐胁迫响应性的转录组分析选用高产稻女孩)。Plos One. 2016;11(1):e0146242。
- 25.
Fracasso A, Trindade LM, Amaducci S.通过RNA-Seq揭示两种不同WUE基因型高粱的抗旱策略。中国生物医学工程学报。2016;16(1):115。
- 26.
王永强,李林,唐松,刘建国,张海生,智华,等。结合小RNA和降解体测序鉴定谷子干旱响应中的miRNAs及其靶标。BMC Genet 2016;17:57。
- 27.
陈玉军,陈勇,史志军,金玉峰,孙海生,谢方富,等。干旱胁迫下肯塔基蓝草ABA、JA和BRs的生物合成及信号转导国际分子生物学杂志,2019;20(6):1289。
- 28.
朱永青,刘庆霞,徐文志,张建华,王霞,聂刚,等。新创野豌豆抗旱性基因的组装与发现。国际分子化学杂志,2019;20(2):328。
- 29.
吴强,赵刚,白旭,赵伟,向丹宝,万勇,等。普通荞麦转录谱的特征(Fagopyrum esculentum)在peg介导的干旱胁迫下。电子学报。2019;39:42-51。
- 30.
周涛,罗新军,余国成,张春成,张林,宋一波,等。转录组分析揭示了三个红豆杉属植物中几种紫杉醇生物合成相关基因的表达模式和序列相似性。BMC植物生物学2019;19:33。
- 31.
Leelavathi S, Bhardwaj A, Kumar S, Dass A, Pathak R, Pandey SS,等。烟草psaA和psbA缺失突变体的全基因组转录组和蛋白质组分析。植物分子生物学杂志,2011;
- 32.
顾世博,李志强,李志强,李志强,等。玉米磷酸烯醇丙酮酸羧化酶在转基因水稻植株中的高水平表达。生物技术。1999;17(1):76-80。
- 33.
李志强,李志强,李志强,等。磷酸烯醇丙酮酸羧化酶对植物叶片和种子生长的影响拟南芥.植物科学进展,2007;26(2):344 - 344。
- 34.
奥尔特DR, Merchant SS, Alric J, Barkan A, Blankenship RE, Bock R,等。重新设计光合作用,以可持续地满足全球粮食和生物能源需求。中国科学(d辑:自然科学),2015;29(4):344 - 344。
- 35.
Sánchez R, Flores A, Cejudo FJ。拟南芥磷酸烯醇丙酮酸羧化酶基因编码免疫不相关的多肽,在干旱和盐胁迫下表达差异。足底。2006;223(5):901 - 9。
- 36.
鲍勒C,艾伦AE,穆斯法A, Montsant A, Eckert A, Kroth PG.海洋光合硅藻果糖二磷酸醛缩酶基因的进化和功能多样化。分子生物学杂志,2011;29(1):367-79。
- 37.
马文敏,魏丽珍,王启祥,石德昌,陈海波。果糖-1,6-二磷酸醛缩酶、三磷酸异构酶和果糖-1,6-二磷酸酶活性增加淡水藻类的一种sp.菌株PCC 7120刺激光合作用产量。应用物理学报,2008;20(4):437-43。
- 38.
范伟,张志林,张丽丽。高盐干旱调控果糖-1,6-二磷酸醛缩酶基因的克隆及分子特性Sesuvium portulacastrum.植物细胞学报2009;28(6):975-84。
- 39.
陈晓明,陈晓明,陈晓明,陈晓明,等。烟草光合碳同化的多基因调控对烟草CO2固定和生物量的影响。中国科学(d辑),2015;
- 40.
Uematsu K, Suzuki N, Iwamae T, Inui M, Yukawa H.增加质体中果糖1,6-二磷酸醛缩酶促进烟草植物生长和光合作用。中国机械工程学报,2012;29(3):344 - 344。
- 41.
李涛,刘丽宁,姜丹东,刘玉杰,石磊。互遮光对大田高粱光合作用调节的影响。中国生物工程学报(自然科学版),2014;
- 42.
杨晓明,张志刚,张志刚。干旱对水稻针叶蛋白质组的影响挪威云杉.树物理学报。2007;27(10):1423-31。
- 43.
程志伟,董凯,葛平,边玉文,董丽文,邓霞,等。不同耐旱性小麦品种叶片蛋白质积累差异的鉴定。科学通报。2015;10(5):e0125302。
- 44.
小川K,金松S,浅田K。“胞质”cuzn -超氧化物歧化酶在菠菜叶和下胚轴的细胞内外定位。植物细胞物理。1996;37:6。
- 45.
Marikovsky M, Ziv V, Nevo N, Harris-Cerruti C, Mahler O. Cu/Zn超氧化物歧化酶在免疫应答中的重要作用。中华免疫杂志,2003;17(6):2993-3001。
- 46.
Kiel JAKW, Emmrich K, Meyer HE, Kunau WH。过氧化物酶体靶向信号1型受体pex5p的泛素化表明在过氧化物酶体基质蛋白导入过程中存在质量控制机制。中国生物医学工程学报,2005;29(3):344 - 344。
- 47.
李志强,李志强,李志强,等。植物过氧化物酶体溶质转运蛋白。中国生物医学工程学报,2019;26(7):817-35。
- 48.
韩玉生,杨华,吴美美,易海林。二氧化硫熏蒸增强谷子幼苗的耐旱性。Ecotox环境安全。2019;178:9-16。
- 49.
吴俊杰,闫国宝,段志强,王志军,康春春,郭林,等。甘蓝型油菜DELLA蛋白BnaA6的作用。RGA通过与ABA信号组分BnaA10.ABF2相互作用来调节抗旱性。前面。中国植物科学,2020;11:577。
- 50.
李晓霞,刘旭,姚勇,李永华,刘松,何春春,等。过表达花生AREB1基因通过调节ROS清除和维持内源ABA含量来增强抗旱性。中国生物医学工程学报,2013;
- 51.
魏晨,姚庆明,李松,Agarwal G,王波,李林,等。利用RNA-Seq分析干旱和洪水胁迫下大豆叶片组织基因表达差异。前沿植物科学,2016;7:1044。
- 52.
金建平,张宏,孔林,高光,罗景昌。PlantTFDB 3.0:植物转录因子功能和进化研究的门户。中国生物医学工程学报,2014;42(1):1182-7。
- 53.
Gonçalves LP, Boscariol Camargo RL, Takita MA, Machado MA, dos Soares Filho WS, Costa MGC。RNA-Seq揭示了与甜橙耐旱性相关的砧木诱导的分子反应。BMC Genomics, 2019; 20:10 10。
- 54.
Lorenzo CP, Anahit G, Irma RV, Martinez-Garcia JF, Bilbao-Castro JR, Robertson DL。拟南芥、杨树、水稻、苔藓和藻类中bHLH转录因子家族的全基因组分类和进化分析。植物科学进展。2010;
- 55.
魏凯峰,陈海峰。水稻、玉米和小麦bHLH基因家族的比较功能基因组学分析。BMC植物生物学,2018;18:309。
- 56.
贝利PC,马丁C,托莱多-奥尔蒂斯G, Quail P,胡克E,海姆M,等。基本螺旋-环-螺旋转录因子基因家族的研究进展拟南芥.植物学报。2003;15(11):2497-501。
- 57.
宋小明,黄宗忠,段伟科,任杰,刘德科,李勇,等。大白菜bHLH转录因子家族全基因组分析(油菜(Brassica rapa sp. beijing ensis) mol.中国生物医学工程学报。2014;29(1):344 - 344。
- 58.
牛X,关玉霞,陈斯克,李海峰。基本螺旋-环-螺旋(bHLH)转录因子的全基因组分析Brachypodium distachyon.BMC基因组学。2017;18(1):619。
- 59.
毛凯,董清良,李超,刘超,马伟富。苹果bHLH转录因子在干旱和盐胁迫下的全基因组鉴定和表征及表达分析中国植物科学,2017;8:1。
- 60.
崔霞,王彦宇,刘志伟,王文玲,李红,庄娟。植物中bHLH家族基因转录组范围的鉴定及表达谱分析茶树.Funct Integr Genomics. 2018;18:10。
- 61.
徐宗杰,朱杰,金兆杰,金玉凯,南波赫,宋思,等。OsbHLH148是一种基本的螺旋-环-螺旋蛋白,与茉莉酸盐信号通路中的OsJAZ蛋白相互作用,导致水稻的耐旱性。植物学报,2011;26(6):457 - 457。
- 62.
翟永强,张立龙,夏春,付少林,赵光元,贾建忠,等。小麦转录因子TabHLH39可以提高转基因植物对多种非生物胁迫的耐受性。生物化学生物物理学报。2016;473:4。
- 63.
王春林,陈松,董亚平,任仁杰,陈东峰,陈小伟。叶绿素Os3BGlu6对水稻细胞ABA库有显著贡献,并影响水稻的耐旱性和光合作用。New Phytol. 2020; 226:1042-54。
- 64.
王震,王福兴,洪玉春,姚俊杰,任志忠,石兆辉,等。开花抑制因子SVP通过调节脱落酸分解代谢赋予拟南芥抗旱性。植物学报,2018;11:1184-97。
- 65.
蒋爱玲,田素萍,徐永忠。高o_2或高co_2控制气氛对“拿破仑”甜樱桃采后生理及贮藏性的影响植物学报。2002;44(8):925-30。
- 66.
英桑加P,斯利隆V,坎拉亚纳拉特S,诺伊欣达S,麦克格拉森WB。红毛丹果实褐变与相关酶(PAL、PPO和POD)的关系(综述近10Linn) cvs。Rongrien和see-Chompoo。生物技术学报,2008;50(2):164-8。
- 67.
朗米德B,萨尔茨堡SL.快速间隙阅读对齐领结2。光子学报。2012;9(4):357-9。
- 68.
葛瑞哲,哈斯,李志刚,李志刚,李志刚,李志刚。来自RNA-seq数据的全长转录组组装,没有参考基因组。生物技术学报。2011;29(7):644-52。
- 69.
张军,张震,张志强,等。gapping BLAST和PSI-BLAST:新一代蛋白质数据库搜索程序。中国生物医学工程学报,1997;25(17):3389-402。
- 70.
阿特舒尔SF,吉什W,米勒W,迈尔斯EW,李普曼DJ。基本的本地对齐搜索工具。中华生物医学杂志,1990;215:403-10。
- 71.
李B,杜威CN。RSEM:从RNA-Seq数据中精确的转录物定量,有或没有参考基因组。生物医学工程学报。2011;12(1):323。
- 72.
李志强,李志强,李志强,等。从RNA-Seq重建转录本序列:参考生成和三位一体分析。Nat Protoc 2013;8(8): 1-43。
- 73.
Trapnell C, Williams BA, Pertea G, Mortazavi A, Kwan G, Marijke J. Van Baren,等。RNA-Seq转录本组装和定量揭示了细胞分化过程中未注释的转录本和异型转换。生物技术学报。2010;28(5):511-5。
- 74.
Smyth GK, Robinson MD, McCarthy DJ。edgeR:用于数字基因表达数据差异表达分析的生物导体包。Bioinform。2010;26(1):139 - 40。
- 75.
Young MD, Wakefield MJ, Smyth GK, Oshlack A. RNA-seq的基因本体分析:考虑选择偏差。中国生物工程学报。2010;11:R14。
- 76.
毛晓泽,蔡涛,Olyarchuk JG,魏利平。使用KEGG Orthology (KO)作为控制词汇的自动化基因组注释和途径识别。生物信息学。2005;21(19):3787 - 93。
- 77.
朗菲尔德P,霍瓦特S. WGCNA:加权相关网络分析的R包。BMC生物信息学,2008;9:559。
确认
不适用。
资金
福建省自然科学基金(2019J05053)、福建省教育厅(JT180120)、国家自然科学基金(41775105)资助。资助者在研究设计、数据收集、分析和解释以及撰写手稿方面没有任何作用,而只是提供资金支持。
作者信息
从属关系
贡献
JZ构思、设计、执行实验并撰写手稿。SQC和WJS进行部分实验。RDS对稿件进行了修改和编辑。STL和FLY对数据分析做出了重大贡献。ZXL公司构想了实验,并提供了巨型君草幼苗。所有作者均已阅读并批准最终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
周俊,陈松,史伟,李志强。et al。转录组分析揭示了巨君草抗旱性的影响。BMC植物生物学21日,2(2021)。https://doi.org/10.1186/s12870-020-02785-7
收到了:
接受:
发表:
关键字
- 巨人Juncao
- rna序列
- 转录组
- 抗旱性
- 转录因子