抽象的
背景
石榴(石榴是一种重要的商品果树,具有中等的耐盐性。氯的平衡−除了石榴组织中的其他阴离子受盐度的影响,然而,阴离子的累积模式很难理解。氯化物通道(CLC)基因家族参与进行CL−,没有3.−,HCO3.−和我−,但其特性在石榴上尚未见报道。
结果
在这项研究中,我们确定了七个PgCLC基因组成的四个逆向转运和三个频道,根据闸门的存在谷氨酸(E)和质子谷氨酸(E),系统发育分析显示,七个PgCLCs分为两个演化支,与进化枝我包含典型的保守区域GxGIPE(我),GKxGPxxH (II)和PxxGxLF (III),而进化枝二世。多序列比对显示PgCLC-B在I区有一个P[脯氨酸,Pro]残基,怀疑是NO残基3.−/H+PgCLC-C1、PgCLC-C2、PgCLC-D和PgCLC-G中含有一个S[丝氨酸,Ser]残基,对Cl有较高的亲和力−.我们确定了cl的内容−,没有3.−H2阿宝4−,所以42−在盐处理(0、100、200和300 mM NaCl) 18 d后,对石榴组织的生长有显著影响。与对照相比,Cl−石榴组织中含量急剧增加。盐度抑制了没有的吸收3.−所以42−,而是加速H2阿宝4−吸收。实时逆转录PCR(QRT-PCR)的结果显示PgCLC基因具有组织特异性表达模式。三个抗原的高表达水平PgCLC-C1,PgCLC-C2和PgCLC-D在叶子中可能有助于解密cl−进入真空。的表达水平较低PGCLCS.在根中可能与排除有关−从根细胞。同时,上调PgCLC-B叶片中NO含量较高3.−被运送到叶子中以减轻缺乏症。
结论
我们的研究结果表明PgCLC基因在平衡氯离子中起重要作用−和不3.−盐胁迫对石榴组织的影响。本研究为进一步函数表征建立了理论基础CLC.基因在石榴。
背景
石榴(石榴L.)耐盐植物,在干旱和半干旱地区广泛种植,在哪里遭受土壤盐渍化[1].Bhantana等。[2报道,石榴可用作落叶果树的模型植物,以研究对环境压力的反应。在我们以前的研究中,我们发现CL−内容比na多了两倍+不同浓度的盐度也影响石榴组织中阴离子的含量及对其他阴离子的吸收[3.].氯是植物必需的微量营养素,主要以氯的形式存在−[4,5].主要参与植物的光合作用、气孔开闭的调节、膜电位的稳定、细胞内pH梯度的调节和电兴奋性等生理活动[5].过量和/或缺乏cl−导致植株生长弱、产量低、品质差[6,7].在盐渍化环境中,主要由高NaCl引起的,一些植物的叶面盐损伤主要是由Na引起的+[8],而其他植物的烟草(如烟草)(尼科尼亚塔哈瓦姆)[7)、葡萄(vitis Vinifera)[9),柑橘类(柑橘耳兰)[10.]和大豆(大豆)[11.,12.]主要由CL引起−.以前的研究报告说,阴离子的累积模式,例如CL−,没有3.−,HCO3.−,所以42−在植物组织中与植物盐耐受相关[6].此外,没有3.−/ Cl−甚至等于k+/ Na+,被证实是植物抗盐性的关键决定因素之一[8,13.].因此,研究CL的摄取与运输下划线机制研究−在石榴组织和盐度条件下的其他阴离子有助于阐明石榴耐盐性。
氯通道(CLC)蛋白与这些阴离子(如Cl)的摄取和转运高度相关−,没有3.−,HCO3.−,我−, Br−[14.,15.,16.,17.].第一个CLC家族基因(CLC-0.)从海鳐(鱼雷marmorata)[18.]以来,从那时起,在细菌,酵母,哺乳动物和植物中发现了一些新成员[19.].在陆生植物中,第一个CLC基因,CLC-Nt1,被克隆在烟草中[20.].随后,许多CLC.基因同源物分离拟南芥[21.)、大米(栽培稻)[22.],大豆(大豆)和Trifoliate橙色(枳壳trifoliata)[23.)等。所有CLC蛋白都有一个高度保守的电压门控氯离子通道(Voltage-gate chloride channel, CLC)结构域和两个假定具有调节功能的CBS (cystathionine beta synthase)结构域[14.].此外,CLC基因家族成员含有与阴离子选择性相关的三个高度保守的区域:Gxgipe(I),GKXGPXXH(II)和PXXGXLF(III)[24.].如果保守区(I)的x残基为P[脯氨酸,Pro],则NO3.−S[丝氨酸,Ser], Cl−优先运输[25.].保守区II的第一个x残基和保守区III的下一个第四个残基都可能是E (Glu)残基,这是CLC反转运体的特征[26.,27.].然而,如果在这些位置发现任何其他氨基酸,如在AtCLCe, AtCLCf和AtCLCg,这些蛋白质可能会发挥CLC通道的活性[27.].因此,CLC蛋白可以充当CL−频道或作为cl−/H+换热器(逆向转运)19.].CL.−通道通过消散预先存在的电化学梯度来调解被动传输,而抗浆剂通过与能量消耗耦合来介导主动运输,以将基板与电化学梯度一起移动[27.].在更高的植物中,CLC蛋白在控制电兴奋性,Turgor维护,气孔运动,离子稳态以及对生物和/或非生物胁迫的反应中起重要作用[28.,29.,30.].
在拟南芥,有七个报告的CLC基因:AtCLCa~ATCLCG.,在不同的细胞器中起不同的作用[28.,31.].BarbierbrygoO等。[32.和Marmagne等[33.建议将ATCLCA〜ATCLCD和ATCLCG聚集成不同的分支,属于真核生核CLC,而ATCLCE和ATCLCF与原核CLC渠道密切相关。AtCLCaNO的代码3.−/H+位于液泡膜中的交换器,在液泡中硝酸盐的积累中起关键作用[21.].AtCLCb,编码空泡反转运蛋白,与AtCLCa,在幼根、下胚轴和子叶中高度表达[34.].AtCLCc是通过隔离Cl−进入盐胁迫下的液泡中,它在防护细胞,花粉和根中强烈表达[28.].AtCLCd和AtCLCf均定位于高尔基膜,可能在高尔基膜的酸化中发挥作用反式-GOLGI囊泡网络[31.,33.],虽然Arclce靶向叶绿体中的囊体膜[33.].ATCLCG.,最接近的同系物AtCLCc(62%的身份),在CL中发挥生理作用−NaCl压力期间的稳态[35.].在其他植物中,许多人CLC.基因参与阴离子运输和响应盐胁迫。例如,表达水平OSCLC-1在NaCl压力下在水稻上上调[22.];PtrCLC基因通过盐胁迫深受橙色诱导的[23.];GMCLC1已被发现增强转基因的耐盐性拟南芥通过减少CL的幼苗−芽中积累[36.];和GsCLC-c2过表达有助于Cl−和不3.−稳态,因此赋予野生大豆的耐盐性[37.].
然而,其特点是CLC.基因尚未在石榴上报道。因此,本研究在石榴中制定了全面,基因组的CLC基因系列。为了揭示CL的累积模式−和其他阴离子在石榴组织中的作用PGCLCS.在这些阴离子的摄取和转运中,我们还测定了这些阴离子的含量和表达水平PGCLCS.这将全面揭示NaCl胁迫下石榴组织中阴离子的积累规律,为进一步研究石榴在不同NaCl浓度下的功能提供参考CLC.基因。
结果
识别的CLC.基因在石榴
使用HMM配置文件来识别推定CLC.石榴基因组中的基因。所有七个推定CLC.基因包含一个高度保守的Volgate_CLC结构域和两个CBS结构域,并被命名PgCLC-B到PgCLC-G根据同源性ATCLCS.(桌子1).蛋白质序列分析表明,PgCLCs含有698 ~ 797个氨基酸,分子量为75.7 ~ 87.9 kDa。所有PgCLC蛋白的预测等电点(pI)范围为5.86 ~ 8.44。疏水性的grand average (GRAVY)值均为正值,说明PgCLCs为疏水性蛋白。PgCLCs中存在9 ~ 11个跨膜螺旋(TMHs),与离子传输有关。
石榴CLC基因家族的系统发育分析
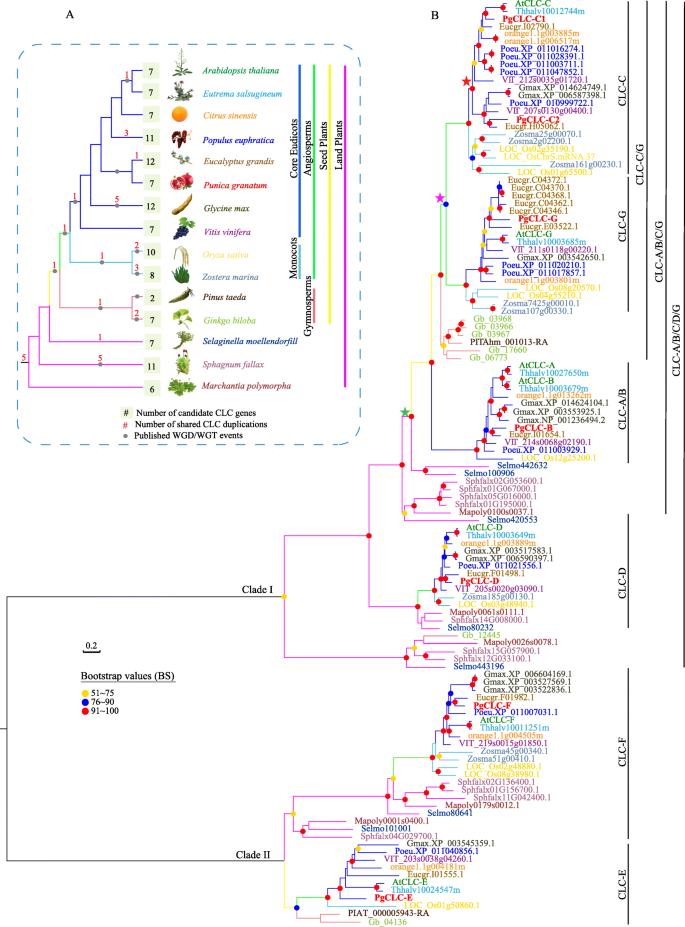
为了阐明陆生植物中CLC基因家族的进化特征,我们调查了15个有参考基因组序列的有趣物种。我们的结果显示了CLC基因树的两个明显分支,分支I是具有中等支持度的主要群体(BS = 61%,图S)1)和分支II包含两个亚群(图。1).PgCLC-E和PgCLC-F属于分支II,其他PgCLC-F属于分支I。1).系统发育分析表明,古基因发生了多轮扩增(图。1).来自不同谱系的基因拷贝数的多样性(图。1a).基因树-种树和解地鉴定了一个基因复制(图中的红色星号)。1b)与强支持(BS = 100,图s1(core eudiicots, core eudiicots)的拓扑结构,这与PgCLC-C1和PgCLC-C2之间的复制有关。基因复制(图中紫色的星)。1b)导致((core eudiicots, monocots), (core eudiicots, monocots))的拓扑被鉴定为被子植物共享的一个副本,该副本与PgCLC-C和PgCLC-G之间的复制相关。我们的系统发育分析还发现种子植物中的基因扩增,一个基因诞生于一个古老的基因复制(图中的绿色星)。1B)和随后的基因死亡。CLC-A/B/C/G基因的树状结构[(被子植物,裸子植物)被子植物]。1)在裸子植物中表现出基因丢失事件。有两个成员来自拟南芥和Eutrema在CLC-A/B亚家族中,只有一个成员来自石榴PgCLC-B。
在这里,我们的系统发育结果表明七个推定PgCLC在土地植物的分歧之前起源于六次重复之后的基因,包括至少一个古代核心销售特异性重复(PGClC-C1和PGCLC-C2)和一种高血管植物特异性膨胀(PGCLC-C1 / C2和PGCLC-G)(图。1,无花果。1).
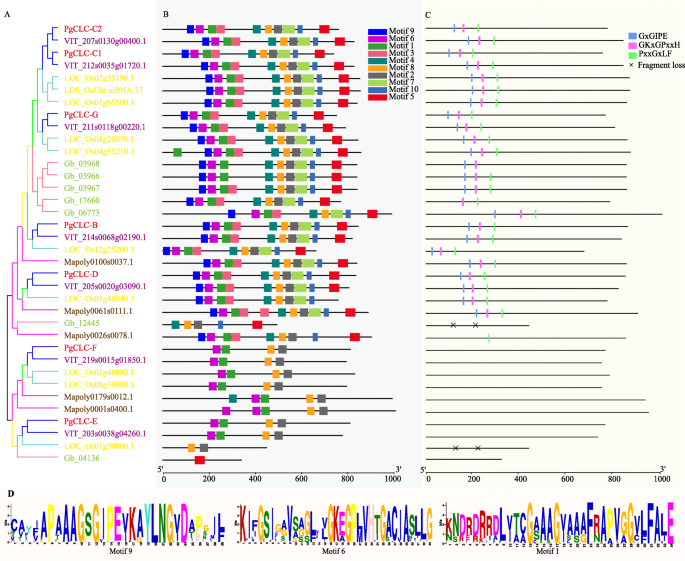
CLC基因家族的保守基序和残基
为进一步了解陆生植物中clc的结构多样性,对其保存的基序和区域进行了分析。本文共选取了10个motif,分别为motif 1-10,每个分类单元中有5个代表种(图1)。2b,无花果。S1B).如上所述,两个进化支明显观察到不同的母题模式(图2)。1b).对于进化支I,大多数clc都有10个主题(图1)。2B,C;无花果。2).对于CLADE II,大多数CLC-E和CLC-F蛋白具有四个基序:6,1,8和2,由CLADE I的所有CLC共享,其中三个保守区域GXGIPE(I),GKXGPXXH(II)和PXXGXLF(III)分别包括在基序9,基序6和基序1中(图。2B,C和D)。CLC基因家族的三个高度保守的地区被思克I的成员共享,而他们不被疏浚II成员共享(图。2B,C;无花果。2).
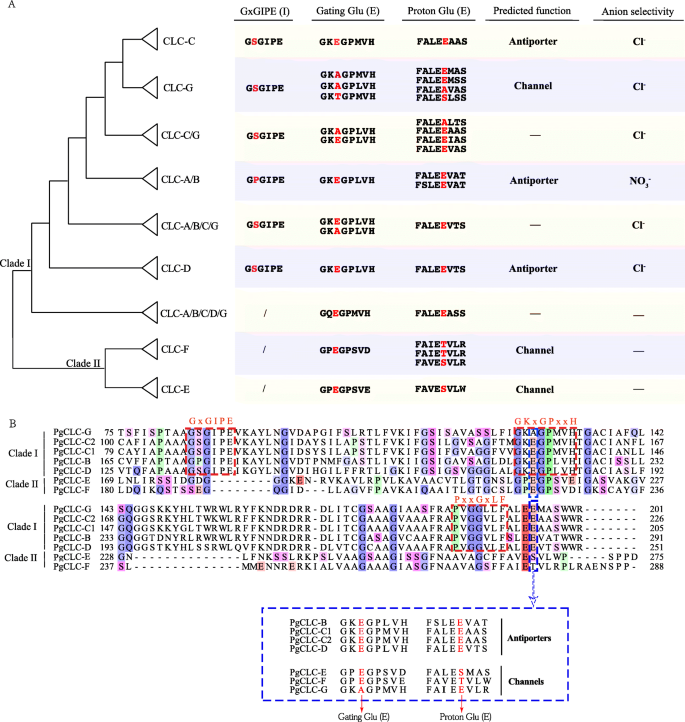
此外,为了仔细分析CLC蛋白的保守区域,我们进行了多序列比对。CLC-A/B亚家族的成员在保守区GxGIPE (I)有一个P[脯氨酸,Pro]残基,而CLC-C、CLC-G和CLC-D亚家族的其他蛋白在保守区I有一个S[丝氨酸,Ser]残基(图1)。3.一种)。这些关键残留物被认识到与阴离子选择性具有密切关系。p [脯氨酸,亲]优先运输没有3.−,而S [丝氨酸,SER]优先运输CL−(图。3.一种)。因此,PgCLC-B很可能是NO3.−/H+主要输送NO的交换器3.−,而PGCLC-C,PGCLC-D和PGCLC-G可以优先运输CL−.在保守区域(II)中存在保守门控谷氨酸(E)和在保守区域(III)的下四个残基中存在质子谷氨酸(E)残基是CLC反转运体的特征。此外,CLC-G亚家族的保守门控谷氨酸(E)和CLC-E和CLC-F亚家族的质子谷氨酸(E)残基被其他氨基酸取代(图)。3.a),这表明这三个亚属的成员可能是CLC渠道。基于这些结果,我们假设四种PGClC蛋白(PGClC-B,PGCLC-C1,PGCLC-C2和PGCLC-D)是Clc抗原型,而其他三个PGClC(PGClC-E,PGCLC-F和PGCLC-G)很可能是CLC频道(图。3.a,b)。
石榴组织中的生长特性和阴离子含量
随着盐度浓度的增加,根系和茎干的干重无明显变化(表S)4,P <0.05)。叶片干重和总干重呈先增后减的趋势,在100 mM盐度时达到峰值。
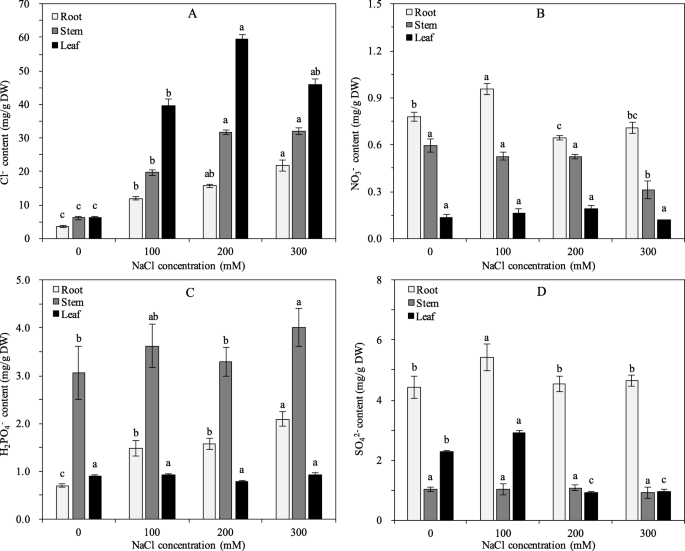
如图1所示。4a,cl的内容−在石榴根中,茎和叶片随着NaCl的浓度的增加而显着增加(P <0.05)。在300 mm NaCl压力下,CL的水平−在根,茎和叶片分别与对照相比增加了6.19,5.29和7.42倍。cl的内容−在植物组织中被排名为叶子>茎>根。与控制相比,没有3.−根系含量先增加后降低,在100 mM盐度时达到最大值。然而,没有3.−茎叶中除no外无明显变化3.−含盐量为300mm时,茎中含量(P <0.05)。第n3.−植株组织中含量依次为根>、茎>、叶(图2)。4b).相比之下,H2阿宝4−随着盐度的增加,根的含量增加,而大部分叶和茎样品的含量变化不显著(P <0.05)。此外,我们发现H2阿宝4−主要积累在茎(图;4C)。为此42−石榴根和叶片中叶绿素含量呈先增加后降低的趋势,在100 mM盐度时达到峰值。无花果。4D显示,所以42−主要积累在根系中,且SO含量较高42−在较高的盐度(> 200 mM NaCl)下,叶片的叶绿素含量急剧下降。
的表达模式PgCLCNaCl胁迫下的基因
为进一步研究其表达模式PgCLC基因,我们在石榴根和叶中进行了QRT-PCR分析。结果表明所有的PgCLC基因具有组织特异性表达模式,具有高表达水平的叶片和根部的低表达水平(图。5).值得注意的是,当植物进行盐度时,所有测试的表达水平PGCLCS.在石榴叶中上调,但在根中被下调或没有明显改变(p< 0.01)。例如,的相对表达水平PgCLC-B,PgCLC-C1,PgCLC-C1和PgCLC-D在叶片中随盐度的增加而增加;与此同时,那些PgCLC-E,PgCLC-F和PgCLC-G在高盐度(200 mM)条件下,叶片的叶绿素含量显著增加。同样,表达水平PgCLC-B,PgCLC-F和PgCLC-G在根中减少,而在PgCLC-C1,PgCLC-C2,PgCLC-D和PgCLC-E在100 mM的盐度水平下,根系的叶绿素含量先下降,然后在200 mM和/或300 mM的盐度水平下略有回升(图2)。5).低于300毫米NaCl压力,表达水平PgCLC-C1,PgCLC-C2和PgCLC-F与对照相比增加了16倍以上。
阴离子内容与表达水平之间的相关性PgCLC基因
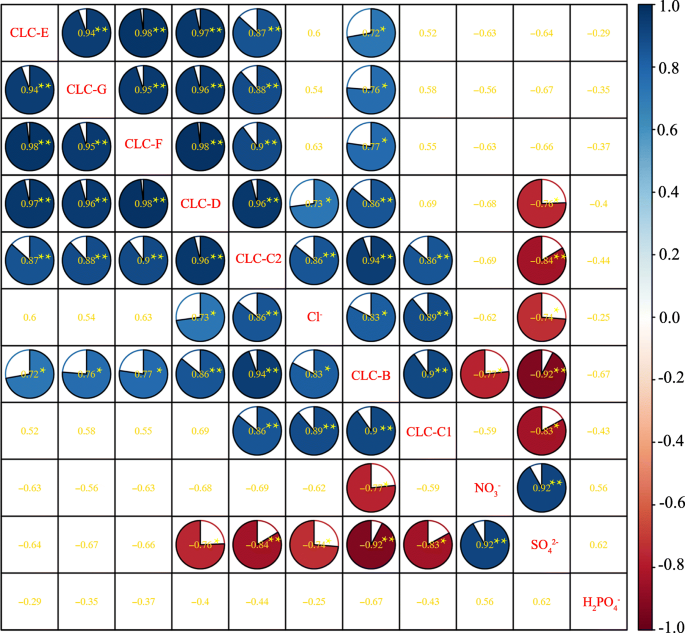
相关分析表明PgCLC基因彼此呈正相关(图。6,p< 0.05)。CL.−内容与PgCLC-B,PgCLC-C1,PgCLC-C2和PgCLC-D,虽然所以42−含量与这些基因呈显著负相关。同时,测定了Cl的含量−所以42−之间呈负相关(p< 0.05)。NO显著负相关3.−内容和表达水平PgCLC-B, SO之间显著正相关42−被发现。H2阿宝4−内容和其他索引(图。6).这些结果表明,氯的积累−,所以42−和不3.−在石榴组织中与表达水平有关PgCLC盐胁迫下的基因。
讨论
鉴定石榴中CLC基因家族
CLC基因家族是一个进化上非常保守的家族,在原核生物和真核生物中都发现过[14.,19.].CLC通道与两个单体形成双孔均二聚体,每个单体都有自己的孔Cl通过−和其他阴离子(HCO3.−,我−,没有3.−)可以进行[14.,38.].当ATP、ADP、AMP或腺苷结合在CBS结构域时,CLC转运体和通道具有调节功能[38.].在石榴中,每个CLC在n端附近包含一个电压门控CLC域,在c端包含两个CBS域。这种特殊的效果暗示单个CLC转运体和通道对细胞的代谢状态非常敏感[14.,27.].
CLC基因家族的系统发育关系
植物中许多早期全基因组复制(WGD)事件,包括core- eudiicots共享的gamma事件[39.],受神话者共享的WGD事件[40,41.,42.],以及种子植物WGD事件[40,41.,导致基因复制。不同谱系的基因拷贝数的多样性(图。1a)可能与该分类单元共享的WGD事件轮数有关[43.].基于15个土地植物中CLC基因家族的系统发育分析,将七个PGCLC分为两种枝条,其疏水板I属于属于细菌分支的真核分支和CLADE II [32.,33.].枝I和枝II的分化可能发生在陆生植物起源之前,因为每个枝都由芽植物的分类群组成(图2)。1).Clcs拓扑与之一致拟南芥[32.,33.),烟草(44.),茶(茶树)[24.]和三叶橙[23.].系统发育分析也显示了多轮古基因扩增(图。1).例如,PgCLC-C1和PgCLC-C2之间的基因复制(图中的红色星星)。1b)由核心eudicots共享的重复爆发支持[45.].CLC-C和CLC-G亚科之间的基因复制是由于被子植物共享的一个重复(图中的紫色星星)。1b) (45.].在CLC-A/B亚家族中,石榴中仅鉴定出一个成员PgCLC-B。有两名成员来自拟南芥和Eutrema由于十字花科植物共享的一种特定的基因复制[46.].我们的系统发育分析还发现种子植物中有一个基因扩增,一个基因诞生于一个古老的基因复制(图中的绿星)。1B)和随后的基因死亡。CLC-A / B / C / G亚家族(图。1)表现出裸子植物在经历种子植物WGD事件后的基因丢失事件[40,41.尽管基因的缺失可能是由于基因组组装和注释的不完全性造成的。最近的系统发育研究也发现了陆地植物规模的基因诞生和扩展,如CYP75基因家族[43.]和gh28基因家族[40].
另外,保守的主题和保守区域的分布与系统发育关系一致(图。2).CLC基因家族,GXGipe(I),GKXGPXXH(II)和PXXGXLF(III)的三个高度保守的区域由疏浚一体的成员共享,而他们不由思克二世的成员分享。这一发现表明,ID和CLADE II的分歧可能是由于这些保守区域的存在(图。2C)。我们的研究还发现,CLC-A / B亚家族的保守区域(I)中的X残留物是P [脯氨酸,亲](图。3.;无花果。2),优先运输没有3.−[25.[虽然CLC-C,CLC-D和CLC-G亚家族的虽然S [丝氨酸,SER](图。3.;无花果。2),优先运输CL−[25.].因此,PgCLC-B很可能是NO3.−/H+主要输送NO的交换器3.−而不是cl.−[21.,34.PgCLC-C、PgCLC-D和PgCLC-G可能对Cl有较高的亲和力−[21.,34.].Gating Glutamate(E)残基和质子谷氨酸(E)残基的存在是CLC抗原者的签名[26.,27.].然而,如果将一个或两个glu(e)残留物被保守区域中的任何其他氨基酸取代,则CLC蛋白可能表现出CLC通道活性[27.].因此,我们假设PgCLC-B、PgCLC-C1、PgCLC-C2、PgCLC-D为CLC的反转运体,PgCLC-E、PgCLC-F、PgCLC-G为CLC通道。我们的结果与拟南芥[26.,27.].
PGCLCS.响应NaCl压力而发挥作用
作为植物,Cl的必要性微量营养素−对培养基中低浓度的植物有益[4,5].然而,高盐度(主要是NaCl)可能引起钠的扰动+和Cl−在细胞和整个植物水平,这影响其他矿物离子的吸收和运输,如钾+、钙2+、镁2+H2阿宝4−,没有3.−所以42−[47.,48.].在这项研究中,我们专注于石榴组织中的阴离子积累。CLC蛋白在细胞膜上表达并进行CL−或其他阴离子,如HCO3.−,我−,没有3.−[14.,15.,16.,17.].与对照组相比PGCLCS.在叶片中表达上调,而在根中表达下调或无显著变化(p< 0.01)。组织特异性表达七PGCLCS.表明石榴根和叶中阴离子的转运机制不同。我们的研究发现氯−石榴组织中的含量随着叶子>茎>根的顺序大致增加(图。4A),表明石榴在关键部位运输和积累有毒离子的能力相对较强[49.].在叶片中,高表达水平PGCLCS.建议包括Cl−进入叶细胞或细胞器。单独地,三个抗糖浆的表达水平PgCLC-C1,PgCLC-C2和PgCLC-D与cl有显着阳性−内容可能导致CL的隔离−进入叶液泡[28.,50.].的表达水平较低PGCLCS.在根中表明排除了cl−从根细胞。的恢复PgCLC-C1,PgCLC-C2和PgCLC-D在根中有助于Cl的封存−在高盐度下进入根液泡[28.,50.].所以,PGCLCS.应该减轻Cl的有害影响−通过不包括CL−从根细胞和隔离氯−进入叶液泡[28.,50.].类似地,一些烟灰更喜欢在盐胁迫下的肉体部件中运输和积累有害的离子[51.,52.].另一方面,在中等盐度(≤200 mM NaCl)条件下,三种Cl的低表达量显著增加−渠道PgCLC-E,PgCLC-F和PgCLC-G在叶子中(图。5),建议石榴能够抑制CL−流入细胞或细胞器[3.,33.].
此外,没有3.−盐胁迫下,石榴根含量呈先增加后降低的趋势,而叶片含量无明显变化。4B,D)。CL的增加−含量随NO的减少而降低3.−石榴组织中的含量,这可能是由于CL之间的拮抗作用−和不3.−[53.].表达水平PgCLC-B(没有3.−/H+换热器)[21.,34.],与Cl呈显著正相关−内容,与NO显着相关3.−内容(p< 0.05)。这些结果表明,不降低的否3.−在根中可能是由于抑制作用PgCLC-B盐胁迫下的活动[21.,34.].氮吸收的抑制还与硝酸盐转运蛋白(NRT)相关[54.,55.].同时,表达水平的提高PgCLC-B叶片中氮素的转运速度加快3.−进入叶片以缓解氮缺乏[34.].Teakle等[6据报道,没有增加的浓度3.−在介质中降低了Cl−在一定程度上减轻了叶片的盐害,NO3.−/ Cl−对植物的耐盐性[8,13.].在石榴中,NO的比例较低3.−/ Cl−可能导致生长减缓[56.(数据未显示)。
总之,这些发现表明PgCLC基因在CL的摄取和运输中发挥了重要作用−和不3.−在盐胁迫下的石榴组织中[15.,16.,17.,28.].虽然所以的积累模式42−与其他基因相关,如硫酸盐转运蛋白[57.].Wei等人[23.)发现,PtrCLC基因响应于NaCl胁迫而显着诱导,PtrCLC6在三叶橙中表现出叶特异性的表达模式。Zhang等[44.观察到所有表达的NTCLC基因在盐胁迫下的烟草根部具有低表达水平。我们的调查结果与这些报告一致。此外,每个功能表征PgCLC基因需要进一步研究。
结论
在这项研究中,我们识别并描述了7个CLC.基因在石榴。系统发育分析表明,PgCLCs可分为两个不同的分支,每个分支成员的保守基序和区域分布相似。在石榴,PgCLC基因在盐胁迫下表现出组织特异性表达模式,在叶片中表达量高,在根中表达量低。PGCLCS.应该在Cl的平衡中发挥重要作用−和不3.−盐胁迫对石榴组织的影响。本研究为进一步研究该类化合物的功能特性奠定了基础PgCLC基因。
方法
鉴定石榴中CLC基因家族
用于电压氯化物通道(电压 - 栅极CLC)域(附加号NO.PF00654)的隐马尔可夫模型(HMM)轮廓用于使用软件HMMER V3.1B1从基因组序列中鉴定推定的CLC蛋白[58.根据Zhang等人的方法[43.,其截断e值≤1e−10.在土地植物中构建一个代表性的系统发育,其中10个高昂植物(八个核心销售,两种单子叶),选择了两个裸子植物和三种苔藓植物,包括拟南芥蒂利亚纳,素类,桉树茅,Eutrema salsugineum,大豆,胡杨,石榴, 和vitis Vinifera作为核心的双子体;栽培稻和目前作为单像;银杏叶和Pinus Taeda.作为裸子植物;和Marchantia polymorpha,卷柏moellendorffii和Sphagnum Realax.苔藓植物。七种CLC蛋白来自拟南芥蒂利亚纳均来自拟南芥信息资源(TAIR) (http://www.arabidopsis.org/).从URL下载14个其他物种的基因组序列(表S.1).首先,从14种的基因组鉴定所有推定的CLC蛋白。随后,使用NCBI保守的域数据库进一步分析CLC候选物,并进一步分析NCBI保守域数据库(CDD,http://www.ncbi.nlm.nih.gov/cdd/)和智能程序(http://smart.embl-heidelberg.de/)确认电压栅极CLC域的存在。使用Prot-param工具预测了七个PGCLC蛋白的疏水性(肉汁)的理论等电点(PI),分子量(肉汁)(http://web.expasy.org/protparam/).使用TMHMM Server v预测跨膜螺旋(TMHS)的数量.2.0(http://www.cbs.dtu.dk/services/TMHMM/)和TMpred (https://embnet.vital-it.ch/software/TMPRED_form.html).
CLC基因家族的系统发育分析
为了估计Clc基因的来源和分歧,使用IQ树重建这些基因的最大可能性(ml)树,并用于映射在土地的物种树上,这是寿命树的一部分在Onekp项目[40],采用Zhang等[59.].使用MUSCLE v3.8.31对所有推测的CLC蛋白进行比对[60.]随着“自动”设置。为了改善有效的系统发生信号,除去低质量取向区和具有表观剪接变体的不正确序列[61.].最后,保留了113个推定的CLC候选人,包括七个PGCLC(表S2).Gblocks v0.91b保留了保守的block [62.],然后使用iQ-TREE v2进行系统发育分析[63.使用LG + R6模型、1000个bootstrap和下田-长谷川类aLRT (SH-aLRT)测试。从包含查询基因的一个基因分支中鉴定了推定的功能同源物拟南芥而且很可能来自陆生植物的祖先基因[59.].
CLC蛋白的保守基序和残基预测
MEME工具预测了所有CLC蛋白的保守基序和区域(http://meme-suite.org/tools/meme.).最大motif数设置为10个,最适motif宽度≥6,≤50。利用MAST工具搜索CLC基因家族的3个保守区域(GxGIPE (I)、GKxGPxxH (II)和PxxGxLF (III)) (http://meme-suite.org/tools/mast)序列阈值≤30和电子值≤1e−10图案。Clustal X v2.0对CLCs进行多序列比对[64.和可视化的Jalview v1.0 [65.].
植物材料和生长条件
石榴的简历。“泰山红”插枝(一年生),采自南京林业大学石榴库。栽培6个月,昼夜温度28/22°C,湿度60%,光周期14 h /暗周期10 h。霍格兰营养液[66.]在实验开始时提供。选择24盆(每区1株),完全随机分为3个区,每个区8盆,每2盆设计为生物重复。所有植株每6天分别用含0(对照)、100、200和300 mM NaCl的半强度霍格兰溶液施肥。容器下面放了一个托盘以保持土壤湿润。根据我们之前的研究,在处理18天后,石榴植株的盐害显著[3.].因此,我们在18 d后分别采集所有植株的根、茎、叶。
阴离子内容测量
在在75℃下在加热烘箱中干燥48小时后测定石榴根,茎和叶子的干重。将干燥样品精细研磨以通过40目筛。然后用50ml去离子水处理在室温下用50ml去离子水处理物处理0.4g样品,然后使用所得提取物来确定CL的内容物−,没有3.−H2阿宝4−,所以42−使用离子色谱(ICS900离子色谱系统; AS4A-SC离子交换柱,CD M-II导电探测器,流动相:NA2有限公司3./ NaHCO3. = 1.7/1.8 mM; Dionex, Sunnyvale, USA) [67.].
表达水平PGCLCS.通过定量实时PCR(QRT-PCR)
使用BioTeke植物总RNA提取试剂盒(BioTeke Corporation, Beijing, China)从新鲜根和叶样品中根据制造商说明提取总RNA。使用逆转录试剂盒- primescript™RT试剂试剂盒和gDNA橡皮擦(TaKaRa Bio Tech Co., Ltd, Beijing, China)制备第一链cDNA。七的引物PGCLCS.采用NCBI引物blast设计(表S3.).采用7500快速实时荧光定量PCR (qRT-PCR)系统(Applied Biosystems, CA, USA)对每个cDNA样品进行3个生物学重复和3个技术重复,结果由2-ΔΔct方法 [68.].每个反应在最终体积为20 μL,含10 μL TB Green的条件下进行Premix前Taq.,0.4μl的ROX参考染料II,0.8μl上游/下游引物,1μLcDNA模板和7μLDDH2O. PCR热循环仪设定如下:在95℃下进行预热30秒;40°C的40个循环为5 s和60°C,适用于34秒;解离阶段如下:95℃,60℃,60℃,60℃,95℃。石榴Pgactin.用作内部参考基因。
数据分析
所有负离子含量和qRT-PCR数据均采用单因素方差分析(one-way ANOVA)进行分析,多重比较采用土耳其检验(P <使用SPSS程序(19.0版本)。(芝加哥,伊利诺斯州,美国)基于三个完全随机区组的值。根据离子含量和表达水平分析变量间的相关性PGCLCS.和可视化的' corrplot '包在R [69.].
可用性数据和材料
支持本文结论的数据集包含在文章(及其附加文件)中。
缩写
- CLC:
-
氯化物通道
- CBS:
-
胱硫脲β合成酶
- Glu:
-
谷氨酸
- PI:
-
理论等电点
- MW:
-
分子量
- 汤:
-
疏水性的盛大平均水平
- TMHS:
-
跨膜螺旋
- ML:
-
最大似然
- WGD:
-
全基因组复制
- onekp预涂:
-
千工厂项目
- Sh-Alt:
-
Shimodaira-Hasegawa-like aLRT
- 存在:
-
实时定量聚合酶链反应
参考
- 1。
Holl D,Hatib K,Bar-Ya'akov I.石榴:植物学,园艺,繁殖。Hortic Rev. 2009; 35(2):127-91。
- 2。
Bhantana P,Lazarovitch N.蒸发,作物系数和两个年轻石榴的生长(石榴L.)盐胁迫下的品种。农业水管理。2010; 97(5):715-22。
- 3.
关键词:盐胁迫,石榴,生长,离子稳态,盐胁迫acta Hortic sinica, 2020;85(1): 42-50。
- 4.
马氏P.马氏高等植物矿物质营养。第三版澳大利亚:学术出版社;2012.
- 5。
白PJ,宽广德先生。土壤中的氯化物及其在植物内的摄取与运动:综述。Ann Bot。2001; 88(6):967-88。
- 6。
Tekle NL,Tyerman SD。Cl.的机制−运输有助于耐盐性。植物学报。2010;33(4):566-89。
- 7。
灌溉水氯化物和氮肥形态对烤烟的影响。作物学报2005;92(1):61-74。
- 8。
植物耐盐机理研究。植物学报。2008;59(1):651-81。
- 9。
Tregeagle JM, Tisdall JM, Tester M, Walker RR, Barrettlennard EG, Setter TL. Cl−CL的不同容量葡萄砧木的摄取,运输和积累−排斥。植物生态学报。2010;37(7):665-73。
- 10。
莫亚杰。盐敏性的氯化物吸收Carrizo Citrange.和耐盐Cleopatra普通话柑橘砧木与用水有关。J Exp Bot。2003; 54(383):825-33。
- 11.
罗启云,于炳军,刘玉玲。氯离子的应力−比Na+在大豆NaCl胁迫下的幼苗。农业科学学报。2002;1(12):1404-9。
- 12.
张晓坤,周庆华,曹建华,于BJ。微分Cl−/耐盐性和NaCl诱导的组织和细胞离子通量的交替大豆,甘氨酸大豆和他们的杂种幼苗。J农业作物SCI。2011; 197(5):329-39。
- 13。
APSE MP,Blumwald E. Na+在植物中运输。费用。2007; 581(12):2247-54。
- 14。
王金勇,王金勇,王金勇,等。CDD/SPARCLE: 2020年保守域数据库。核酸Res. 2020;48(D1): D265-8。
- 15.
王志强,王志强,王志强,等。硝酸盐转运与信号转导。中国生物医学工程学报。2007;58(9):2297。
- 16。
Amtmann a,armengaud p,salt de,威廉姆斯L. n,p,k和s对新陈代谢的影响:从多级分析中获得的新知识。CurrOp植物BIOL。2009; 12(3):275-83。
- 17。
Gojon A, Nacry P, david JC。根吸收调节:植物NPS稳态的中心过程。植物学报。2009;12(3):328。
- 18。
关键词:初级结构鱼雷marmorata氯化物通道的表达克隆Xenopus oocytes..大自然。1990;348(6301):510 - 14所示。
- 19。
jestch tj。CLC氯化物通道和转运蛋白:从基因到蛋白质结构,病理和生理学。Crit Rev Biochem mol。2008; 43(1):3-36。
- 20.
LURIN C,GEELEN D,BARBIERBRYGOO H,GUERN J,MAUREL C.克隆和植物电压依赖性氯化物通道的功能表达。植物细胞。1996; 8(4):701-11。
- 21.
王志强,王志强,王志强,等。硝酸/质子转运体AtCLCa介导植物液泡中硝酸盐的积累。大自然。2006;442(7105):939 - 42。
- 22.
Nakamura A,Fukuda A,Sakai S,Tanaka Y.两种推定真空电压氯化物通道的分子克隆,功能表达和亚细胞定位在水稻中(栽培稻l .)。植物细胞生理。2006; 47(1):32-42。
- 23.
魏QJ,古QQ,王NN,杨CQ,彭S. Trifoliate橙色氯化物通道基因家族的分子克隆与鉴定。Biol platarum。2015; 59(4):645-53。
- 24.
邢Q,MA YC,Wu ZC,Nong Sh,Zhu Jj,Sun H等人。茶叶中CLC超家族基因的基因组鉴定及表达分析(茶树).功能整合基因组。2020;20:497-508。
- 25.
CLC在植物中的转运蛋白。2月。2010;584(10):2122 - 7。
- 26.
Lisal J,Maduke M.氯化物通道中的质子偶联。Philos T Roy SoC B. 2009; 364(1514):181-7。
- 27.
CLC通道和转运体:具有边缘性人格的蛋白质。生物物理学报。2010;1798(8):1457-64。
- 28.
王志强,王志强,王志强,等。的拟南芥真空阴离子运输车,AtCLCc,参与对气孔运动的调节并有助于耐盐性。工厂J.2010; 64(4):563-76。
- 29.
魏庆杰,刘永忠,周广发,李庆华,杨春青,彭胜CsCLCc,氯化物通道基因来自枳壳trifoliata,提高植物的耐盐性拟南芥.植物学报2013;31(6):1548-57。
- 30。
氯通道和转运体:结构、功能、生理和疾病。杂志启;2018 98(3):1493 - 590。
- 31。
guo w,zuo z,cheng x,sun j,li h,li l等。氯化物通道家族基因CLCd负调节病原体相关的分子模式(PAMP) - 触发免疫力拟南芥.[J] .机器人。2014;65(4):1205-15 .]
- 32。
Barbierbrygoo HLN,Angeli Ad,Filleur S,Frachisse JM,Gambale F,Thomine SB等。植物中的阴离子频道/运输车:从分子基础到监管网络。Annu Rev植物Biol。2011; 62(62):25-51。
- 33。
Marmagne A,VinaugerDouard M,Monachello D,De Longevialle AF,Charon C,Allot M等。两个成员拟南芥CLC(氯化物频道)家庭,AtCLCe和AtCLCf,分别与囊体和高尔基膜相关。J Exp Bot。2007; 58(12):3385-93。
- 34。
Fechtbartenbach JVD,Bogner M,Dynowski M,Ludewig U. Clc-B介化没有3.−/H+通过液泡膜交换拟南芥液泡。植物生理学报。2010;51(6):960-8。
- 35。
谭志强,王志强,王志强,王志强,等。氯化物通道类化合物的结构表征。ATCLCG.,涉及氯化物耐受性拟南芥蒂利亚纳.植物细胞生理。2016; 57(4):764-75。
- 36。
魏鹏,王磊,刘安,余斌,林敏敏。GMCLC1通过调节大豆中的氯化物积累来增强耐盐性。前植物SCI。2016; 7(113):1082。
- 37。
魏鹏,车斌,沈磊,崔永华,吴胜,程超,等。氯通道基因的鉴定及功能分析,GsCLC-c2来自野生大豆。BMC植物BIOL。2019; 19(1):1-15。
- 38。
Elgebali S,Mistry J,Bateman A,Eddy SR,Luciani A,Potter Sc,等。PFAM蛋白质家族数据库2019年。核酸RES。2019; 47(D1):D427-32。
- 39。
jaillon o,yury j,noel b,policriti a,clepet c,casagrande a等。葡萄树基因组序列表明祖先六倍化在主要的血症植物中。自然。2007; 449(7161):463-7。
- 40.
倡议otpt。一千种植植物转录om和绿色植物的系统染料。自然。2019; 574(7780):679-85。
- 41.
焦友,Wikeett NJ,Ayyampalayam S,Chanderbali As,Landerr L,Ralph Pe等。种子植物和贪眼的祖先多倍体。自然。2011; 473(7345):97-100。
- 42.
基因组A.琥珀属植物基因组与开花植物的进化。科学。2013;342(6165):1241089。
- 43.
张tk,刘春英,黄晓波,张海英,袁志华。陆生植物系统基因组和石榴转录组分析揭示了一种进化情景CYP75全基因组重复后的基因。J植物BIOL。2019; 62(1):48-60。
- 44.
惠Z,金杰,金升,李Z,徐G,冉W等人。烟草中氯通道基因家族成员的鉴定及分析(尼科尼亚塔哈瓦姆).基因。2018;676:56 - 64。
- 45.
任锐,王海峰,郭聪,张宁,曾玲,陈玉明,等。被子植物全基因组的广泛复制有助于提高基因组的复杂性和物种多样性。摩尔。2018;11(3):414 - 28。
- 46.
Barker Ms,Vogel H,Schranz Me。在古金过普罗伊倍的古代倍数:分析醉蝶花属转录组阐明了基因组复制的历史拟南芥和其他Brassicales。基因组生物学进展。2009;1(1):391-9。
- 47.
Silva EN, Silveira JA, Rodrigues CR, Viégas RA麻疯树对盐胁迫的生理调节与盐离子的积累、钾离子的转运和钾离子的选择性有关+,渗透调整和k+/ Na+稳态。植物BIOL。2015; 17(5):1023-9。
- 48.
易卜拉欣H.两种石榴品种的耐受性(石榴在水培条件下,对盐胁迫的响应。应用基础科学学报2016;6(4):38-46。
- 49.
盐和水分胁迫的比较生理学。植物学报。2002;25(2):239-50。
- 50。
张鹤,赵福,唐rj,yu yx,song jl,王y等。两种调色剂伴侣蛋白质用作Turgor调节氯化物通道拟南芥.美国国立科学院。2017年,114 (10):E2036-45。
- 51。
Flowers TJ, Colmer TD。盐生植物的耐盐性。新植醇。2008;179(4):945 - 63。
- 52。
Orsini F,Accorsi M,Gianquinto G,Dinelli G,Antognoni F,Carrasco KBr等。除了对盐度的离子和渗透反应之外Chenopodium藜麦:成功的盐生植物的功能要素。植物生态学报。2011;38(10):818-31。
- 53。
黄志强,王志强,王志强,等。盐碱化条件下水稻氮素营养特性的研究。杆菌的杂志。2005;49(1):99 - 104。
- 54。
王浩,张敏,郭锐,史东,刘波,林旭,等。盐胁迫对水稻老幼叶离子平衡和氮代谢的影响(栽培稻l .)。植物学报。2012;12(1):194。
- 55。
Kiba T,Feria-Bourrellier AB,Lafouge F,Lezhneva L,Boutet-Mercey S,Orsel M等。的拟南芥硝酸盐转运蛋白NRT2.4在氮饥饿植物的根部和芽中起着双重作用。植物细胞。2012; 24(1):245-58。
- 56。
陈志强,陈志强。园艺作物盐分与矿质营养的关系。Sci Hortic-Amsterdam。1998; 78(1 - 4): 127 - 57。
- 57。
Rouached H,Wirtz M,Alary R,Hell R,Arpat Ab,Davidian JC等。差异调节两种高亲和力转运蛋白,巯基1.1和巯基的表达。拟南芥.植物杂志。2008;147:897 - 911。
- 58。
HMMER网络服务器:交互式序列相似性搜索。核酸学报2011;39:29-37。
- 59。
张春飞,张tk, Luebert F,向永忠,黄春华,胡勇,等。Asterid系统基因组学/系统转录组学揭示形态学进化历史,支持大量全基因组重复的系统发育位置。中国生物医学工程学报。2012;34(11):3188-210。
- 60.
埃德加钢筋混凝土。MUSCLE:多序列比对,高精度,高通量。核酸学报2004;32(5):1792-7。
- 61.
Hartmann A,Tesch D,Nothwang Hg,Binindaemonds Orp。阳离子氯化物的进化进化:通过重复的古代起源,基因损失和子作用。mol Biol Evol。2014; 31(2):434-47。
- 62.
关键词:系统发育分析,序列分析,保守序列中国生物医学工程学报。2000;17(4):540-52。
- 63.
Minh BQ,Schmidt Ha,Chernomor O,Schrempf D,Woodhams MD,Von Haeseler A等。IQ树2:基因组时代的系统发育推论的新模型和有效方法。mol Biol Evol。2020; 37(5):1530-4。
- 64.
Larkin MA, Blackshields G, Brown NP, Chenna RM, Higgins DG。Clustal W和Clustal X版本2.0。生物信息学。2007;23(21):2947 - 8。
- 65.
夹钳M,袖口J, Searle SM, Barton GJ。Jalview Java对齐编辑器。生物信息学,2004;20(3):426 - 7。
- 66.
冯志涛,邓玉强,范华,孙庆军,隋宁,王伯生。NaCl胁迫对紫穗槐生长和光合特性的影响Ulmus pumila.L.幼苗在沙培中。Speckynthetica。2014; 52(2):313-20。
- 67.
瑞克,施吕,杨毅。萌发,生长,渗透性调节和小麦响应盐水和碱性应力的离子平衡。土壤SCI植物NUTR。2009; 55(5):667-79。
- 68.
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据——ΔΔCT方法。方法。2001; 25(4):402-8。
- 69.
Wei T, Simko V, Levy M, Xie Y, Jin Y, Zemla J. Package‘corrplot’。统计学家。2017;56:316 - 324。
确认
不适用。
资金
这项工作得到了南京林业大学人才(GXL2014070,GXL2018032)的支持,南京林业大学的博士学位基础,以及江苏高级教育机构(PAPD),国家自然科学基金会的优先学术计划中国(31901341),江苏省自然科学基金(BK20180768)。这些资助机构参与了研究和收集,分析和解释的设计,以及稿件的写作,以及开放式付款。
作者信息
从属关系
贡献
CL和YZ分析并解释了系统发育分析。YZ和JD进行了应激植物的表达水平检查。CL是确定离子含量,分析数据和写作稿件的主要贡献者,以及XZ和ZY修订了稿件。所有作者阅读并认可的终稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
刘,C.,赵,Y.,赵,X.et al。全基因组鉴定与表达分析CLC.石榴的基因家族(石榴)揭示了其在耐盐性中的作用。BMC植物BIOL.20.560(2020)。https://doi.org/10.1186/s12870-020-02771-z.
已收到:
接受:
发表:
关键字
- CLC基因家族
- 系统发育分析
- 负离子含量
- 表达式模式
- NACL压力