摘要
背景
NAC (NAM、ATAF1/ATAF2和CUC2)转录因子属于单子叶和双子叶植物特异转录因子的一个大家族。这些转录因子调节与抗逆性相关的基因的表达,保护植物免受各种非生物胁迫,包括干旱、盐碱和低温。
结果
在这项研究中,我们确定了CaNAC46转录因子基因甜椒.其开放阅读框为921 bp,编码一个由306个氨基酸组成的蛋白,等电点为6.96。系统发育分析表明CaNAC46属于ATAF亚家族。表达CaNAC46被热,冷,高盐,干旱,脱落酸,水杨酸和茉莉酸甲酸甲处理诱导。因此,CanaC46可能对干燥辣椒对非生物应激的抗性可能是重要的。亚细胞定位分析证实CanAC46在核中局部化。过度表达CaNAC46提高转基因的耐受性拟南芥植物对干旱和盐胁迫的适应能力。的CaNAC46- 在长期干旱和高盐胁迫条件下,长轴具有比野生型线更长的根和更多的侧向根。此外,CanaC46影响了活性氧(ROS)的积累。此外,Canac46促进了表达草皮,荚,RD29B.,RD20.,LDB18,ABI,IAA4,P5CS..丙二醛含量较高TRV2-CaNAC46系比野生型植物对干旱和盐胁迫的反应。此外,应激反应基因的表达水平,如ABA2,P5CS.,含有DREB,RD22.,猫,荚,被下调TRV2-CaNAC46植物。
结论
在盐渍和干旱条件下,CaNAC46是激活ros清除酶和促进根形成的积极调节因子。我们的研究结果表明CaNAC46是一个负责耐盐和耐旱的转录调控因子,并提示控制这个NAC转录因子的非生物胁迫相关基因调控机制是介于两者之间的A. Thaliana.和胡椒。
背景
胡椒(甜椒;家庭:Solanaceae)是全球培养的流行蔬菜作物。中国是辣椒最大的生产国和消费者,约占全球辣椒种植区的40%[1].干辣椒除了被广泛用作调味品外,还被用于医疗和军事工业[2].然而,一些环境条件,如盐碱化和干旱,对主要的干胡椒产区产生不利影响。
非生物胁迫,包括干旱,高盐度和极端温度,是负责干燥辣椒质量下降的主要因素[3.].为了保护植物免受环境胁迫的有害影响,植物逐渐进化出了适当的防御机制,其中基因表达的调控起着重要作用。转录因子是非生物胁迫耐受的关键调控因子[4].在植物中,大型NAC (NAM, ATAF1/ATAF2,和CUC2)转录因子家族参与了非生物胁迫反应[5].NAC转录因子的n端高度保守,相对于可变的c端[6].这个转录因子家族近年来得到了广泛的研究拟南芥、大米、烟草和大豆[7,8,9,10.].辣椒作物中的这些转录因子也越来越兴趣[11.,12.].对辣椒中104个NAC转录因子的全基因组分析和22个NAC转录因子基因的表达分析揭示了辣椒对不同胁迫的不同反应[13.].作为转录激活因子CaPLD4,CanaC1有助于降解青椒中的磷脂,响应低温[11.].胡椒CanaC2.据报道,转录水平因非生物应激处理而显着上调,但通过渗透胁迫和水杨酸(SA)处理下调[14.].
的CaNAC46在寻找辣椒cDNA文库期间鉴定基因答:芥AtNAC2/ATAF1/anac002.(AT1G01720)作为查询[14.].CaNAC46转录因子有助于调节对非生物胁迫(如干旱、盐度和低温)和植物激素的反应。如脱落酸(ABA)、茉莉酸甲酯(MeJA)和SA。我们发现CaNAC46正向调节植物对干旱和盐碱胁迫的耐受性,并建立了CaNAC46在非生物胁迫响应系统中的作用模型[15.].研究结果可能为全面分析CaNAC46与植物抗逆性相关的功能和调控网络提供基础,对植物抗逆性的应用具有潜在意义CaNAC46在未来的基因工程实验中。
结果
ATAF亚家族基因的鉴定CaNAC46在胡椒里
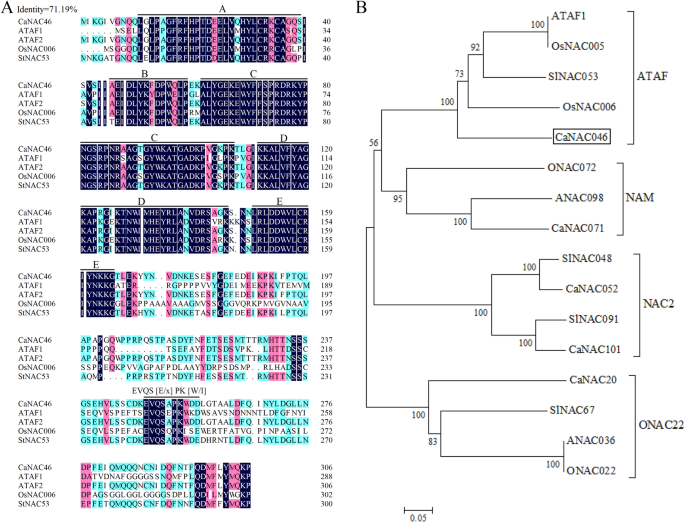
NAC转录因子参与调节植物对非生物胁迫的反应[16.,17.].的CaNAC46基因从C. annuum.var。“青仓第2号”。编码蛋白包含306个氨基酸,分子量为34.94kDa和6.96的PI(附加文件1:表S1)。此外,CaNAC46与其他模式植物中同源NAC蛋白的碱性氨基酸和酸性氨基酸比例相似。CaNAC46与其他模式植物的同源基因在其他物理和化学特征上也有相似之处。这些结果表明NAC转录因子具有保守的二级结构。
在本研究中,CaNAC46与ATAF1聚类[18.],osnac5 [19., OsNAC6 [20.]属于ATAF亚家族(图。1一种)。多序列对准显示出71.19%的序列同一性,这意味着NAC转录因子序列高度保守。CanAC46 C末端含有EVQS [E / X] PK [W / I]序列,其与典型的ATAF子家族成员的序列一致[3.].系统发育分析显示CanAC46与ATAF亚组的OSNAC5,OSNAC6和ANAC2最密切相关(图。1b)。
CanAC46转录因子的对准和系统发育分析。一个其他植物中CaNAC46和ATAF亚家族蛋白序列比对。B来自其他植物物种的CanaC46和NAC成员的系统发育树。AT / A:拟南芥,Ca:甜椒OS / O:奥雅萨苜蓿,SL:茄属植物lycopersicum.用于构建树的蛋白质序列是ATAF1(AT1G01720),ATAF2(AT5G08790),ANAC036(AT2G17040),OSNAC005(LOC_OS11G08210),OSNAC006(LOC_OS01G66120),ONAC072(LOC_OS09G3260),ONAC022(LOC_OS03G04070),SLNAC053(Solyc06g060230),SlNAC048(Solyc05g055470),SlNAC067(Solyc07g053590),SlNAC091(Solyc00g008000),StNAC53(CAC42087.1),CaNAC52(Solyc05g002477),CaNAC71(Capana07g002159),CaNAC101(Capana12g002456),CaNAC20(Capana02g000302),CaNAC46(Capana05g000569).基于使用邻近的方法基于肽序列构建系统发育树。Canac46标有固体盒子
CaNAC46定位于细胞核
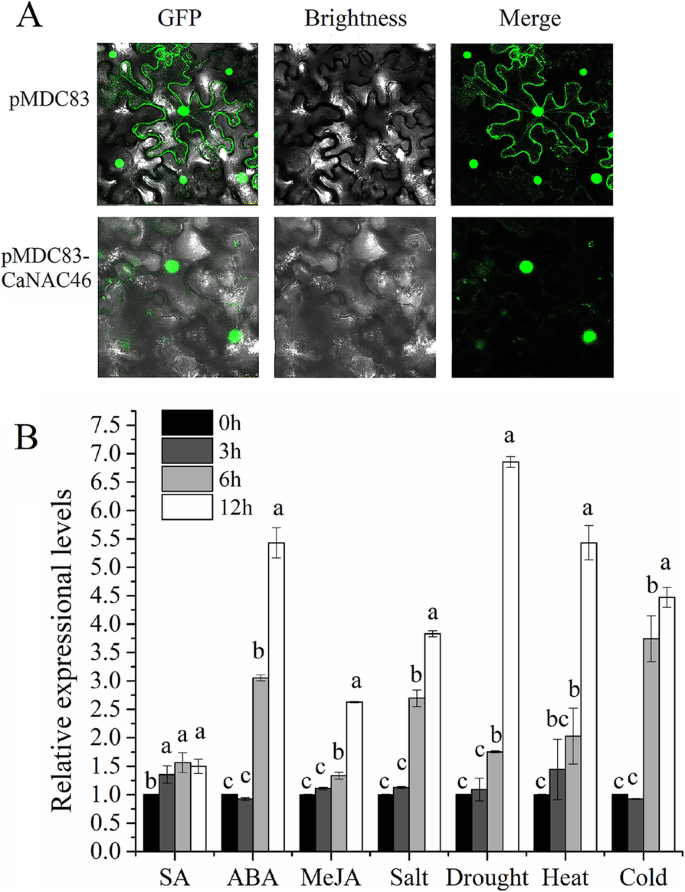
用共聚焦显微镜的烟草细胞中单独(对照)和CanAC46-GFP融合蛋白单独(对照)和CanAC46-GFP融合蛋白的荧光信号分析CanaC46是核蛋白质(图。2一种)。
CaNAC46表达由非生物胁迫和植物激素诱导
我们检查了CaNAC4612小时处理期间对各种非生物胁迫响应的表达水平。表达CaNAC46在干旱,盐,热和冷应激处理后显着上调,特别是从6-H时间点,在12小时下具有峰表达水平(图。2b)。此外,CaNAC46ABA是一种参与盐和干旱胁迫反应的植物激素。
过度表达CaNAC46提高转基因植物的耐旱性和耐盐性拟南芥
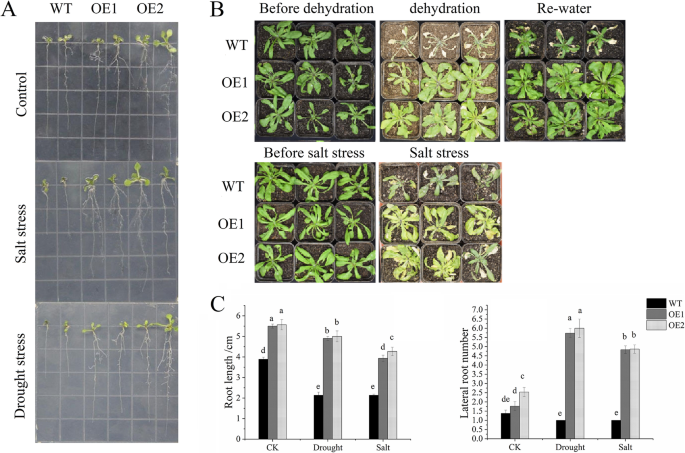
的影响CaNAC46以聚乙二醇(PEG 6000)处理的转基因植物为材料,研究了转基因植物对干旱胁迫的耐受性。评估…的效果CaNAC46在含200 mM NaCl的1/ 2ms琼脂培养基上,对耐盐性、野生型(WT)和转基因幼苗进行过表达。3.一种)。在正常情况下,WT和转基因植物的发芽率约为95%。然而,模拟干旱和盐胁迫条件下的发芽率大幅不同于WT和CaNAC46-过表达植物(附加文件2:图S1)。
耐盐碱和耐旱性CaNAC46- 在营养生长阶段进一步评估大规模的线。在干旱和高盐治疗之后,WT植物的叶子严重枯萎,但叶子CaNAC46-overexpressing植物不是(图。3.b)。并且在脱水处理后,植物重新浇水3天,WT的叶片保持枯萎,而OE线通常生长(图。3.b)。
CaNAC46过表达促进转基因植株的根系生长拟南芥
植物的根和茎系统通过改变信号传导和代谢途径来适应复杂的环境变化,维持正常的生长发育[21.].开发的根系对于改善植物应力阻力很重要。在目前的研究中,NaCl治疗抑制了WT幼苗的侧向根系发育。相比之下,两个分析的根伸长率CaNAC46-过表达株系仅受到轻微抑制,最终导致转基因植株上的侧根比野生型植株上的多(图5)。3.a和c)。这些观察结果暗示过度表达CaNAC46可以通过促进根生长来提高非生物胁迫阻力(图。3.).而且,表达水平LBD18和IAA4,参与侧根发育,在茎中显著上调CaNAC46-过表达的植物在干旱和盐碱条件下(图。4b)。
CaNAC46过表达降低活性氧积累
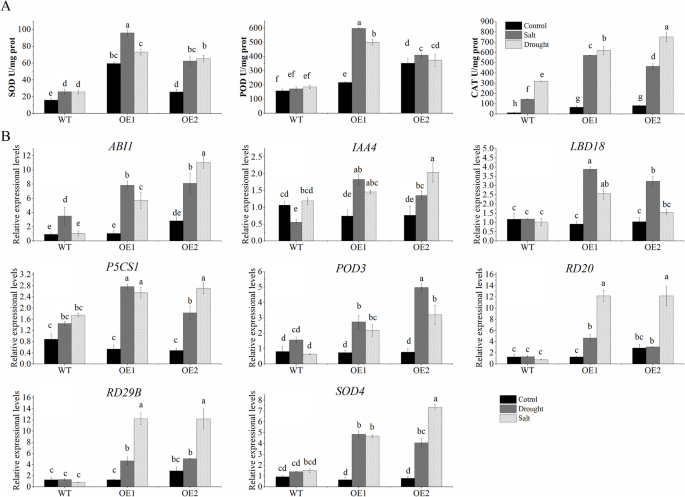
高CaNAC46表达水平CaNAC46-Overexpressing.A. Thaliana.采用实时荧光定量PCR (qRT-PCR)进行鉴定(附加文件3.:图S2)。干旱和盐胁迫通常会导致活性氧(ROS)的过度积累,最终导致不可逆的损害。我们测定了WT和CAT的SOD、POD和CAT活性CaNAC46 -过度抑制在正常和应力条件下的植物(图。4一种)。在正常条件下WT和转基因植物之间的酶活性没有严重差异。然而,对旱味和盐胁迫的暴露导致WT和WT和猫活动相当大增加CaNAC46 -过表达的植物,但增加更明显CaNAC46 -overexpressing植物。
CaNAC46过表达激活应激相关基因的表达
为了阐明CanAC46对非生物胁迫耐受性的推定调节作用,完成QRT-PCR分析以检查应激响应基因的表达模式(例如,ABI,P5CS1.,RD29B.,RD20.)在WT和CaNAC46非生物胁迫处理前后的过表达植株(图。4B)我们观察到一个相对较低的CaNAC46表达水平损害了整个植物的水赤缺响应和分离的叶子。相比之下,相对较高CaNAC46表达水平可以保护植物免受非生物胁迫的伤害。
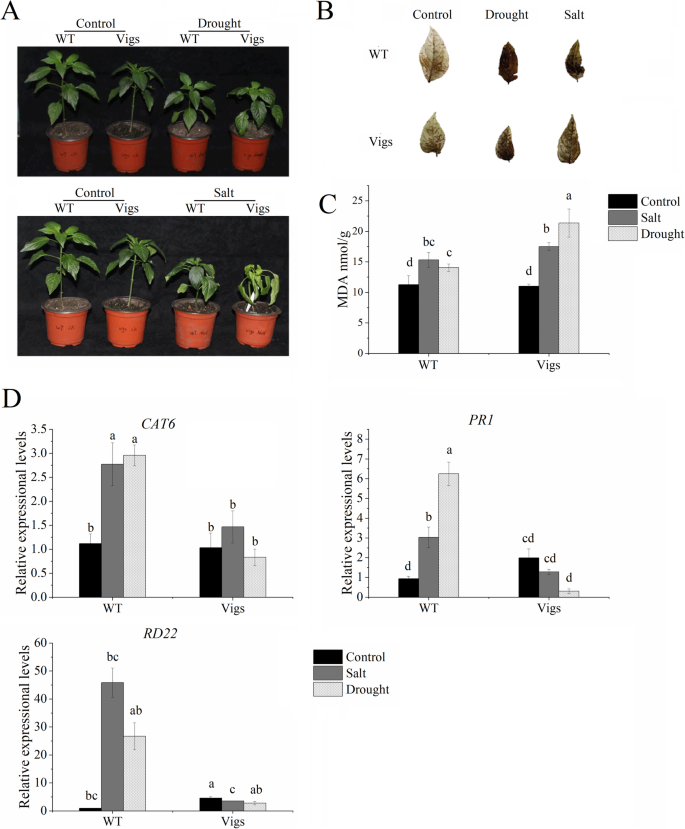
沉默的CaNAC46降低植物对高盐和干旱条件的耐受性
分析CaNAC46表达水平CaNAC46沉默(TRV2-CaNAC46)和WT植株在胁迫处理前均证实了这一点CaNAC46表达量显著下调TRV2-CaNAC46行(附加文件4:图S3)。的TRV2-CaNAC46而WT植株则分别接受干旱(即脱水)和盐胁迫(即200 mM NaCl溶液处理)。的TRV2-CaNAC46在正常和应力条件下,线的生长状态都比无消声线弱(图1)。5一种)。细胞H.2O2二氨基联苯胺(DAB)染色测定水平较高TRV2-CaNAC46在3周的盐和干旱处理后,WT叶片的叶片数量明显减少(图1)。5B).此外,丙二醛(MDA)含量显著增加,该含量可作为脂质过氧化的指标TRV2-CaNAC46在干旱和盐度处理的后期阶段,植物,但不在WT植物中(图。5C)。而且,在里面TRV2-CaNAC46植物,六类(编码对植物细胞对压力的重要性的催化酶),PR1,RD22.表达水平下调,并且ROS-清除活性低,这增加了这些植物对盐水和干旱条件的敏感性(图。5D)。
讨论
不同的胁迫对干辣椒的生长和产量产生不利影响,是主要的产量限制因素。在植物中,特定的转录因子增强了对外界胁迫的抗性[22.].我们之前鉴定了7个应激反应的CaNAC46转录因子辣椒物种。在目前的研究中,我们证明了过度表达CaNAC46增加对各种非生物胁迫的耐受性,包括干旱和盐度。
的CaNAC46基因克鲁C. annuum.'青嫩2'由921bp编码306个氨基酸残基组成。物理化学性质的分析揭示了其他植物物种的CanAC46和NAC转录因子之间的差异。这种多样性可能与NAC转录因子的未来功能性质相关。另外,CanaC46具有三种无序的氨基酸区域,但它们对转录因子的功能的影响仍然确定。OOKA [8]将NAC蛋白分类为I和II组,用群体分为14个亚组。亚群ATAF中的NAC转录因子[23.], AtNAC3 [24., OsNAC3 [25.]参与植物的胁迫反应。对其保守序列和系统发育关系进行了分析。NAC转录因子由一个内含160个氨基酸残基的NAM子结构域和其他5个保守子结构域(a、B、C、E和D)组成。子结构域C和D主要参与DNA结合。子域A的显著性来自于插入dTph1转座因子形成纳姆突变体(8].此外,NAC蛋白的亚域B和E各不等,表明它们可能与NAC转录因子的功能多样性相关[8].与NAC家族成员进行序列比对,证实CaNAC46属于ATAF亚家族,且与该亚家族关系最为密切A. Thaliana.ATAF1。
植物根系发育是一个相对复杂的过程,使植物能够适应各种环境胁迫。盐胁迫通过降低生长素水平抑制根分生组织的生长[26.],而干旱胁迫限制根的生长,抑制细胞分裂素的产生[27.].根系大小和结构影响土壤对水分和养分的吸收。在这项研究中,CaNAC46在干旱和盐胁迫下,过表达的植株比野生型植株产生更长的根和更多的侧根。直接同源的LBD18在非糖植物中是侧根发育所必需的[28.].在A. Thaliana.,侧根形成受吲哚-3-乙酸(IAA)调控[29.].我们的数据表明LBD18和IAA4表达水平上调CaNAC46- 响应干旱和高盐条件的抑制植物。因此,CanaC46可以通过上调促进横向根部形成和根伸长率LBD18和IAA4表达增强对干旱和盐碱胁迫的耐受性。发芽率CaNAC46-过表达系在盐和干旱处理后显著低于WT。这些处理也导致转基因植株的叶绿素含量高于野生型对照。
在植物中,脯氨酸是生长发育所必需的。此外,脯氨酸作为自由基清除剂和渗透剂保护细胞免受损害[15.].在TRV2-CaNAC46线条,下调表达P5CS.增加了植物对盐和干旱胁迫条件的敏感性。先前的研究表明,RD26是在受非生物应激的植物中介导ABA诱导基因表达的转录激活物[30.].水稻NAC家族转录因子OsNAP和OsNAC2通过ABA途径响应非生物胁迫[31.,32.].NAC转录因子可以最小化ROS的积累,并在干旱和高盐条件下调节应激相关基因的表达[33.].我们推测,观察到的增强对非生物胁迫的耐受性主要是由于胁迫响应基因的表达上调,包括RD20.,RD29B.,含有DREB,RD22..经过干旱和盐渍处理后,RD20.和RD29B.表达水平上调CaNAC46-overexpressing植物和含有DREB和RD22.表达水平在下调TRV2-CaNAC46线条。SOD,POD和CAT活动更高CaNAC46-过表达的植株比对照植株多。此外,MDA积累较多TRV2-CaNAC46与野生型植物相比。DAB染色结果证实,在细胞内ROS积累较多TRV2-CaNAC46植物比在对照植物中。沉默CaNAC46通过病毒诱导的基因沉默(VIGS)表达导致氧化损伤,这表明H2O2.这些结果表明CaNAC46可以激活应激信号相关基因的表达以应对非生物胁迫。在CaNAC46-过表达植物,表达水平ABI,POD3.,SOD2,P5CS1.而且涉及ROS-Scavenging系统的其他基因被上调,以促进ROS清除并降低应力引起的损害。的TRV2-CaNAC46植物具有相对较弱的ROS活动,使它们对盐和干旱胁迫比WT植物更敏感。此外,CaNAC46表达与CAT、POD、SOD活性相关,大部分与转录相关草皮和荚基因。因此,沉默CaNAC46表达可能与增加ROS积累和对盐和干旱胁迫的敏感性相关联。
结论
我们的结果表明,定位于细胞核的CaNAC46有助于调节非生物应激反应。在这项研究中,CaNAC46表达由高盐度,干旱,热,冷,ABA,SA和Meja治疗诱导。异位表达CaNAC46在A. Thaliana.导致干旱和盐胁迫治疗后的根部形成和更强的发育。此外,通过干旱和盐胁迫显着上调与ROS清除和横向根部发育有关的几种应激响应基因的表达水平。此外,CaNAC46 -沉默的线响应盐和干旱胁迫治疗而表现出相对较弱的生长和增加的ROS生产(即,更强烈的DAB染色)。此外,ROS相关基因的表达在下调CaNAC46 -沉默。说明CaNAC46可能是通过清除活性氧(ROS)来调节辣椒的耐盐性和耐旱性。
方法
植物材料,生长条件和处理
甜椒L. var。由于其对非生物胁迫的耐受性,“青嫩2”用作各种治疗和RNA分离的植物材料。该品种由青岛农业大学(青岛,中国),青岛种子站和德州农业科学院的研究人员选择。此外,它批准了山东多样性审查委员会于2015年(沉积号:2015-057-1)。青岛农业大学(中国青岛)保存了胡椒种子。经过3天的萌发后,用16-H光在28℃下在生长室中生长幼苗;8小时暗循环。所有治疗方法都使用2周龄幼苗完成。关于模拟的干旱和盐水条件,用含有20%(w / v)PEG 6000和200mM NaCl的溶液处理幼苗根。对于冷和热处理,分别将植物分别转移到设定为4和37℃的生长室中。 The phytohormone treatments involved immersing roots in an aqueous solution of 100 μM ABA, MeJA, or SA. Leaves were collected at 0, 2, 4, 8, 12, and 24 h after each treatment, immediately frozen in liquid nitrogen, ground to a powder, and then stored at − 80 °C.
隔离和序列分析CaNAC46
使用该植物总RNA套件(北京,北京,中国),从叶子中提取总RNA。然后将RNA用作模板以将CDNA合成用GDNA橡皮擦(Takara,China)用Primescript RT试剂盒合成cDNA。将CDNA稀释20倍以用于随后的TA克隆和QRT-PCR。的CaNAC46通过PCC使用以下引物扩增开放阅读框:前进:5'-ATGATCAAAGGAATCGTTGGAAA-3';反向:5'-ctaaggttttttgcatgtatagga-3'。使用DNaman 6.0完成多个序列对齐。蛋白质序列的疏水性,组成和物理化学性质用扩展在线工具(http://www.expasy.org/).另外,用Mega 6.0构建系统发育树。
定量实时聚合酶链反应
用反转录的cDNA和LightCycler®480 SYBR Green I Master kit (TAKARA)完成基因表达水平分析。反应溶液为7 μL ddH2o,10μlssbr绿色I主混合物,1μl正向底漆(10μmol/ l),1μl反向引物(10μmol/ L)和1μlcDNA。PCR程序如下:95℃3分钟;40℃为95℃,5s,60℃,20s,72℃,20秒。该程序之后是熔化曲线分析。所有反应一式三份进行。基于2确定相对基因表达水平−ΔΔCt方法。底漆序列列于表中1.
CaNAC46的亚细胞定位
的CaNAC46PCR扩增编码序列,并将其插入Spe我和ASC.我的修改后PMDC83向量的网站,克隆XPress II一步克隆套件(Vazyme,南京,中国)。测序以确认插入片段的准确性,重组质粒和空PMDC83载体(即单独的单独的GFP)被引入烟草细胞中。农杆菌肿瘤术- 介导的方法[34.].在黑暗中孵育24小时后,用Fluoview™FV300共聚焦显微镜(日本Olympus)观察转化的烟草细胞中的GFP荧光。
一代的CaNAC46-overexpressing转基因拟南芥植物
的CaNAC46PCR扩增编码序列,并将其克隆到该基因中XBA.在Cailiflower马赛克病毒(CAMV)35s启动子的控制下随后表达的PBI121向量的I位点。通过测序确认所得构建体的准确性,之后将PBI121-CanAc46重组质粒插入其中A. Thaliana.植物按花浸法涉及A. Tumefaciens.应变GV3101。在含卡那霉素的MS培养基上筛选转基因植株,并进行PCR鉴定。4 T3.纯合子CaNAC46- 选择转基因植物进行进一步分析。
的性能CaNAC46-Overexpressing.拟南芥在盐渍和干旱条件下的植物
纯合子的CaNAC46- 来自t的大规处线3.世代进行表型分析。WT和转基因株系在1/ 2ms琼脂培养基上,22℃,16小时光周期/8小时暗周期培养7天。然后将幼苗转移到1/ 2ms琼脂培养基中,添加200 mM NaCl或10% PEG 6000。秧苗孵育1周。另外,为了研究老植株的耐旱性,将幼苗在正常条件下的土壤中培养4周,之后停止浇水2周,然后恢复浇水3天。为了评估老植株对盐胁迫的耐受性,WT和转基因植株在正常土壤条件下生长4周,之后用200 mM NaCl溶液灌溉3次(间隔4天)。
丙二醛含量和抗氧化酶活性测量
MDA内容以及SOD,POD和CAT活动用商业检测套件量化(江城生物工程研究所,南京,中国)。用手持叶绿素仪测量叶绿素含量。
病毒诱导的基因沉默
使用PTRV1和PTRV2载体进行VIGS实验。的CaNAC46将序列插入PTRV2载体中。使用SGN Vigs工具确定要沉默的序列(https://vigs.solgenomics.net/),并用以下引物(TRV-CaNAC46)扩增:正向:5’- ttggtgcagcattattatttgtgc -3’;反向:5“-ATTTTTGGTTTTATTTCATCCTCAA-3”。农杆菌肿瘤术将含有PTRV1的细胞与A. Tumefaciens.用PTRV2-CANAC46转化细胞。将合并的细菌溶液渗透到辣椒植物的下叶中。在渗透后3周,沉默CaNAC46通过生理测量和组织化学测定进行评估。
统计分析
用Origin和DPS评价生物测定结果。数据差异的显著性由Student 's决定t以及(P< 0.05)。
可用性数据和材料
在本研究中产生或分析的所有数据均包含在本文(及其补充信息文件)中,或应通信作者的合理要求向其提供。本文的序列数据可在拟南芥信息资源(https://www.arabidopsis.org/),注册编号如下:ATAF1 (At1g01720), ATAF2 (AT5G08790), ANAC036 (At2g17040), ANAC098 (At5g53950)。OsNAC005 (LOC_Os11g08210)、OsNAC006 (LOC_Os01g66120)、ONAC072 (LOC_Os09g32260)和ONAC022 (LOC_Os03g04070)的序列可在水稻基因组注释项目(RGAP:http://rice.plantbiology.msu.edu/downloads_gad.shtml).此外,SlNAC053 (Solyc06g060230)、SlNAC048 (Solyc05g055470)、SlNAC067 (Solyc07g053590)和SlNAC091 (Solyc00g008000)序列均可在Sol Genomics Network (SGN:https://solgenomics.net/search/locus.)数据库和CanaC52(Capana05G002477),CanaC71(Capana07G002159),CanaC101(Capana12G002456),Canac20(Capana02G000302),CanaC46(Capana05G000569)可从辣椒基因组平台下载(PGP:http://peppergenome.snu.ac.kr/download.php).STNAC53(CAC42087.1)在国家生物技术信息中心提供(NCBI,https://www.ncbi.nlm.nih.gov/).
缩写
- 阿巴:
-
脱落酸
- ACC:
-
1-氨基环丙烷-1-羧酸 - 酸
- CaMV:
-
花椰菜马赛克病毒
- 轻拍:
-
二氨屈噻嗪
- 国际宇航科学院:
-
吲哚-3-乙酸
- 小黑裙:
-
侧器官边界域
- MDA:
-
丙二醛
- Meja:
-
茉莉酸甲酯
- NAC:
-
NAM,ATAF1 / ATAF2和CUC2
- P5CS:
-
Δ1-pyrroline-5-carboxylate合成酶
- 挂钩:
-
聚乙二醇
- 骑士:
-
磷脂酶D
- PR:
-
病因相关
- 存在:
-
定量逆转录-聚合酶链反应
- 理查德·道金斯:
-
反应脱水
- ROS:
-
反应性氧气
- SA:
-
水杨酸
- 中收取:
-
病毒诱导的基因沉默
- WT:
-
野生型
参考
- 1。
姚明,尹yx,王f,宁丽,娇ch,赵jy。中国加工辣椒育种的现状及对策。湖北农业科学。2017; 17(2):323-8(中文)。
- 2。
亚当斯·MJ,阿胡贾·卡德克,杰拉蒂DP。辣椒素和二氢辣椒素对体外凝血和血小板聚集的影响。Thromb杂志2009;124(6):721 - 3。
- 3.
关键词:NAC,转录因子,非生物胁迫,植物abstract:生物化学与生物物理学报,2012;
- 4.
Sakuma Y,Maruyama K,Qin F,Osakabe Y,Yamaguchi-Shinozaki K.拟南芥转录因子Dreb2a的双重功能在水胁迫响应和热应激响应基因表达中。Proc Natl Acad SCI U S A. 2007; 103(49):18822-7。
- 5。
Khattab嗨,emam ma,emam mm,helal nm,mohamed mr。硒和硅对水稻干旱响应基因表达的转录因子NaC5和DREB2A的影响。BIOL植物。2014; 58(2):265-73。
- 6.
NAC转录因子ANAC019的c结构域通过n结构域的组氨酸开关与ph调控的DNA结合是必需的。细胞众议员2018;22(5):1141 - 50。
- 7.
Zhong R,Lee C,周J,McCarthy R,Zheng H.拟南芥中次级细胞壁生物合成调节的转录因子电池。植物细胞。2008; 20(10):2763-82。
- 8.
OOKA H,SATOH K,DOI K,Nagata T,Otomo Y,Murakami K,Matsubara K,Osato N,Kawai J,Carninci P,Hayashizaki Y,Suzuki K,Kojima K,Takahara Y,Yamamoto K,Kikuchi S.综合分析在羚羊苜蓿和拟南芥的Nac家族基因。DNA Res。2003; 10(6):239-47。
- 9.
Le Dt,Nishiyama R,Watanabe Y,Mochida K,Yamaguchi-Shinozaki K,Shinozaki K,Tran LS。大豆植物特异性NAC转录因子家族的基因组调查与表达分析及脱水应力。DNA Res。2011; 18(4):263-76。
- 10.
刘G,李X,金S,刘X,朱L,聂y,张x。水稻Nac基因Snac1的过度表达通过增强根部发育并减少转基因棉中的蒸腾速率来提高干旱和耐盐性。Plos一个。2014; 9(1):E86895。
- 11.
哦,Sk,Lee S,Yu Sh,Choi DJ。新的NAC含结构域的转录因子(CanaC1)的表达优先于辣椒和病原体之间的不相容。Planta。2005; 222(5):876-87。
- 12.
X-M H,H-F Z,S-Y L,Wang X-K,Y-M Z,Y-C M. Luo D,Chen R-G:NAC转录因子CanAC064是辣椒中冷应激耐受性的调节器。植物SCI。2020; 291:110346-55。
- 13。
刁W,乳酸JC,王S,刘J,PAN B,GUO G,GE W.辣椒(Capsicum Anum L.)中NAC转录因子基因系列的基因组分析:染色体位置,系统发育,结构,表达模式,启动子和交互网络中的顺式元素。int j mol sci。2018; 19(4):1048-61。
- 14。
郭wl,王某,陈里,陈bh,du xh,yin yx,gong zh,zhang yy。CanaC2辣椒基因的表征及表达谱。前植物SCI。2015; 6:755。
- 15.
他L,Shi X,王Y,Guo Y,Yang K,王Y.AcaMidopsis Anac069与C [A / G] CG [T / G]序列结合,以负调节盐和渗透胁迫耐受性。植物mol biol。2017; 93(4-5):369-87。
- 16.
方y,廖k,杜,徐y,宋h,li x,xiong l。一种应激响应Nac转录因子Snac3通过水稻中反应性氧物种的调节赋予热量和耐旱性。J Exp Bot。2015; 66(21):6803-17。
- 17.
关键词:水稻,NAC, NAM, ATAF, NAC,过表达,抗旱性国家自然科学基金资助项目:国家自然科学基金资助项目。
- 18.
Mauch-mani B,Flors V.AtaF1转录因子:在ABA依赖植物防御生物和非生物胁迫的收敛点。细胞res。2009; 19(12):1322-3。
- 19.
Takasaki H,Maruyama K,Kidokoro S,ITO Y,Fujita Y,Shinozaki K,Yamaguchi-Shinozaki K,Nakashima K.中非生物胁迫响应Nac型转录因子Osnac5调节水稻中的应力诱导基因和胁迫耐受性。Mol Gen Genomics。2010; 284(3):173-83。
- 20.
关键词:水稻,非生物胁迫,转录因子,OsNAC6,转录因子51植物j . 2010;(4): 617 - 30。
- 21.
水分亏缺条件下大豆根系生长相关转录因子的高通量分析。哥伦比亚大学:密苏里-哥伦比亚大学;2009.
- 22.
Erpen L, Devi HS, groser JW, Dutt M.将DREB/ERF, MYB, NAC和WRKY转录因子用于改善转基因植物的非生物和生物胁迫。植物细胞组织器官体外培养的研究进展[J] .中国生物医学工程学报,2018;
- 23.
鲁普,陈n-z,r,su z,qi b-s,ren f,chen j,王x-c。一种新的干旱诱导基因,ATAF1编码NAC家族蛋白,负调节应激响应基因的表达inarabidopsis。植物mol biol。2007; 63(2):289-305。
- 24。
abdallat AM, Ali-Sheikh-Omar MA, Alnemer LM。过量表达两个相关基因提高了番茄(Solanum lycopersicum L.)的干旱和盐耐性。植物细胞组织器官邪教。2015;120(3):989-1001。
- 25。
周XG,陈XJ。鉴定水稻中新的NAC转录因子OSNAC3。Acta phytopathologica sin。2018; 48(1):61-9(中文)。
- 26。
刘炜,李立师,汉泰,蔡维,傅Zw,吕y-tjpp。盐胁迫通过一氧化氮介导的植物蛋白累积和拟南芥信号传导的调节减少了根系尺寸。植物理性。2015; 168(1):343-56。
- 27。
徐y,伯尼斯P,张X,黄B.通过过表达IPT的增强细胞素合成通过激活Agrostis stolonifera的ROS-清除系统来缓解对根生长的干旱抑制。J Exp Bot。2016; 67(6):1979-92。
- 28.
LBD18/ASL20上调EXPANSINA17可促进生长素响应过程中的侧根形成。植物生理学杂志。2013;54(10):1 - 7。
- 29.
吴涛、笠原、Mimura、神宫、福田。多个AUX/IAA-ARF模块调节侧根形成:拟南芥SHY2/ iaa3介导的生长素信号转导的作用。中国生物医学工程学报,2012;
- 30.
而NAC蛋白RD26在aba依赖的胁迫信号通路中起着重要作用。植物j . 2004; 39(6): 863 - 76。
- 31.
NAC家族转录因子OsNAP通过ABA途径介导非生物胁迫响应。植物生理学杂志。2014;55(3):604-19。
- 32.
Shen J,LV B,Luo L,He J,Mao C,Xi D,Ming F. NAC型转录因子OSNAC2调节水稻中的ABA依赖性基因和非生物胁迫耐受性。SCI REP。2017; 7:40641-56。
- 33.
袁X,王H,Cai J,Bi Y,生物学FSJBP。水稻NAC转录因子ONAC066用作干旱和氧化应激反应的正调节器。BMC植物BIOL。2019; 19(1):278-86。
- 34.
Kim CK,Chung JD,Park Sh,Burrell Am,Kamo Kk,Byrne DH。农杆菌肿瘤癌介导的ROSA杂交转化绿色荧光蛋白(GFP)基因。植物细胞组织器官邪教。2004; 78(2):107-11。
致谢
我们感谢青岛农业大学中心实验室提供的FluoView™FV300共聚焦显微镜。感谢青岛市园艺植物遗传改良育种重点实验室的全体师生给予的指导和帮助。我们感谢Edanz编辑中国的李文编撰(www.liwenbianji.cn/ac),以编辑该手稿草稿的英文文本。
资金
中央引导地方科学发展计划项目(no . YDZX20193700004393);山东省农业优良种子工程项目(no . 2016LZGC011)。关键词:岩石力学,岩石力学,岩石力学,岩石力学资助者没有参与研究的设计、数据的收集、分析和解释,也没有参与手稿的撰写。
作者信息
从属关系
贡献
JM,DL和LYW构思,设计和写了稿件。LYW分析数据。Lyw,JXD和YW进行了所有实验。这位作者都读到并批准了最终手稿。
相应的作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者们宣称没有相互竞争的利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1。
在其他模型植物中对其同源物Nac的Canac46转录因子的物理和化学表征的比较。
附加文件2:图S1。
WT和WT的发芽率CaNAC46-过表达植物在模拟干旱和盐条件下。
附加文件3:图S2。
表达CaNAC46通过RT-PCR(1-4代表WT植物,WT和OE植物中的基因; 5-8代表OE植物)。
附加文件4:图S3。
表达CaNAC46基因在wt和TRV-CANAC46.RT-PCR植物(A,1-4代表WT植物,5-8代表TRV-CANAC46.植物)和通过QRT-PCR(B,1表示WT,2代表TRV-CANAC46.植物)。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
马,J.,Wang,Ly。,戴,JX。等等。NAC型转录因子CanAC46调节转基因的盐和耐旱性拟南芥.BMC植物BIOL.21日,11(2021)。https://doi.org/10.1186/s12870-020-02764-y
收到了:
接受:
发表:
关键词
- 胡椒
- NAC转录因子
- 抗压力能力
- 转基因植物