摘要
背景
小孢子胚胎发生可能是获得双单倍体(DH)的最有效方法,用于育种计划,以加快新品种的生产。然而,白化植株的再生严重限制了雄激素在谷物中生产DH的利用。尽管做出了许多努力,但导致白化病再生剂发展的确切机制尚未阐明。本研究旨在揭示大麦小孢子培养中叶绿体分化过程中导致绿色再生体和白化再生体形成的基因型依赖分子差异。
结果
我们对两个大麦品种“Jersey”和“Mercada”雄激素发生的连续阶段的质体分化进行了详细分析,这两个品种产生绿色再生剂的能力不同。我们证明了cv的质体缺乏从nep依赖转录到pep依赖转录的转变。在小孢子培养中主要产生白化再生剂的' Mercada '。nep到pep过渡的失败与缺乏活动有关Sig2编码质体rRNA基因转录所必需的sigma因子的基因。一个非常低的水平16 s而且23 s rRNA转录本和受损的质体翻译机制导致再生胚胎和白化再生体的光形态建成受到抑制。此外,分化“Mercada”胚胎中存在的质体包含少量的质体副本,这些质体副本的复制并不总是完成的。与“Mercada”相反,简历。产生90%绿色再生剂的‘泽西岛’,PEP聚合酶活性高,表达量高Sig2,质体核糖体rna而且tRNAGlu,表明NEP受到抑制。增加的表达GLKs在“泽西”再生植株中也观察到编码光形态建成所需转录因子的基因。
结论
存在于产生白化病基因型的小孢子衍生胚胎中的前质体没有通过其发育的早期检查点,而这些检查点是诱导叶绿体进一步的光依赖性分化所必需的。在大麦小孢子培养中,胚分化过程中质体编码RNA聚合酶的激活失败与基因型依赖的无法再生绿色植株有关。更好地理解白化再生剂形成的分子机制可能有助于克服谷物雄激素发生中的白化问题。
背景
分离小孢子培养通过小孢子胚胎发生是单倍体/双单倍体(DH)生产方法中最有效的,用于植物育种计划,以缩短新品种开发所需的时间[1,2,3.].花粉母细胞还原分裂产生的小孢子在体内发育成花粉粒[4,5].通过暴露于饥饿或温度等胁迫因素,可诱导小孢子进入胚胎发生的途径[6].胁迫处理或预处理使小孢子发育的配子体途径重编程为孢子体途径(雄激素发生),从而诱导雄激素植物胚的形成和再生[7,8].尽管现有的诱导小孢子胚胎发生的优化方案,但该过程仍然高度依赖于基因型。此外,即使在培养中产生了足够数量的再生剂,白化植物的再生在很大程度上限制了雄激素在谷物中的有效性,这减少了雄激素在育种计划中的利用。白化病发生在雄激素培养物中,是谷类和草类所特有的一种现象,在几乎所有具有重要农艺意义的单子叶植物中都有广泛的发生频率,包括小麦[9,10],大米[11],大麦[12,13]和小黑麦[14].
当前质体包裹在小孢子中,在体内发育成淀粉体时,绿色植物就有可能再生[15],在离体培养时分化为叶绿体。然而,并不是培养的小孢子中存在的所有前质体都发育成叶绿体。它们有的在花粉体内发育过程中遵循与前质体相同的发育途径,分化为淀粉体,有的不发育为质体而退化。在这种情况下,小孢子衍生的胚胎不包含能够进行光合作用的质体,再生的白化植物无法在体外培养物外生长[16].白化是一个高度依赖基因型的过程,不同品种的白化植株再生频率在1 ~ 100%之间变化,这表明某些基因型更容易发生白化植株的再生[17].我们先前对花粉粒在体内发育过程中质体的生物发生和分化的研究表明,大麦白化植株的基因型依赖再生是由小配子体发生过程中与前质体到淀粉质体转变相关的淀粉合成装置的激活时间决定的[18].此外,大麦质体基因组的缺失是白化植株体外形成的主要原因[19,20.,21],小黑麦[22],小麦[19,22,23]和米[24,25].然而,另一项研究表明,白化和绿色再生植物之间质体编码基因的表达水平存在许多差异,但质体基因组没有变化[26].人们还尝试鉴定与大麦绿色植株再生频率相关的qtl [27,28]和小黑麦[29].然而,导致叶绿体分化受阻的详细机制尚未揭示。
叶绿体包含它们自己的基因组(质体,ptDNA),由包含在基质中的许多拷贝(每个质体10-500个拷贝)表示[30.,31].质体中大约有140个基因编码质体编码聚合酶(PEP)的亚基、核糖体亚基的蛋白质、质体rrna和trna、促进核编码蛋白质和光合装置蛋白质输入的蛋白质[32,33].然而,ptDNA只包含少量的信息,这是功能性细胞器的发展所必需的,大多数蛋白质编码在核基因组中。因此,质体的分化需要质体编码和数千个核编码基因的协调表达[34],并依赖于核-质体(顺行信号)和质体-核(逆行信号)的通信。这种交流对于叶绿体形成的所有过程都是必要的,包括质体的完整性、转录、翻译和光合复合体的组装[30.,35,36].顺行通讯包括在细胞质中合成的核编码蛋白的导入,主要由TIC/TOC复合物进行[37,38].任何敲除突变导致缺乏在输入复合体中组装的蛋白质,会阻碍叶绿体分化并导致白化表型[37].核到质体的通信也是质体中由两种RNA聚合酶进行的转录所必需的:NEP(核编码聚合酶)和PEP(质体编码聚合酶)。NEP和PEP识别特定的启动子并转录部分重合的特定基因集[39,40,41].在质体生物发生的早期,NEP在与质体生物发生相关的质体定位基因的转录中起着至关重要的作用,包括转录和翻译。NEP是一种单亚基噬菌体型RNA聚合酶RpoTp基因。双子叶含有额外的NEP聚合酶编码RpoTmp转录质体和线粒体基因的基因[42].在前质体向叶绿体的分化过程中,质体基因转录的主要作用由细菌型PEP获得,PEP由五个亚基组成:两个α和β, β’,β”分别由质体编码rpoA而且rpoB,rpoC1,rpoC2在不同操纵子中组装的基因[43].PEP的作用需要在核基因组中编码的西格玛因子Sig1-Sig6PEP全酶能够识别特定启动子并启动转录。在光照下,PEP全酶通过添加PEP相关蛋白(pap)来重建,PEP相关蛋白是PEP复合物的形成和/或稳定和转录调节所必需的。缺乏任何一种pap会导致叶绿体发育早期pep依赖转录的缺乏,从而导致突变体的白化表型[43].
在sigma因子中,SIG2和SIG6在早期质体生物发生中是必需的,光敏色素A和B对光的响应正调控[44,45,46].依赖sig2的转录包括tRNAGlu它起着双重作用:在叶绿体分化过程中作为翻译的成分,在合成叶绿素前体5-氨基乙酰丙酸(ALA)时作为底物。ALA合成与逆行信号介导的核基因表达控制相关[47,48].在质体生物发生的早期阶段,输入到质体的SIG2与PEP形成复合物并启动转录tRNAGlu.高水平的tRNAGlu转录本通过与NEP结合来抑制NEP的活性[49,50].PEP提供高水平的质体定位基因转录本,这是叶绿体有效组装所必需的[51].质体mrna由质体翻译机制翻译,包括由核和质体基因编码的蛋白质构建的70S核糖体和质体编码的rrna。在质体中发生的翻译所需的所有tRNAs都在质体中编码。在参与翻译起始、延伸和终止的因子中,只有一个是IF1(起始因子1),由一个基因(infA)定位于质体[52,53].
发生在前质体和整体质体中的适当转录和翻译是质体过程中的第一个检查点,需要诱导叶绿体进一步的光依赖性成熟,包括PEP全酶的组装,这必须在进行光形态建成之前完成[54,55].光激活光敏色素结合转录因子PIFs(光敏色素相互作用因子),PIFs是光形态建成的阻遏物,在黑暗中抑制叶绿体的分化[31,56].PIFs降解启动转录因子在PIFs控制下的表达,包括GLKs (Gloden-like)和HY5 (Long Hypocotyl5),其激活诱导光合作用相关核基因(PhANGs)和其他与叶绿素合成相关的核编码基因的表达[57,58,59].过表达GLKs诱导拟南芥叶绿体发育及根系变绿[60]和水稻愈伤组织[61].缺乏光照诱导含有原叶绿素和前板层体的黄体形成和发育[62].在黄成体中发现了许多光合作用相关蛋白,包括ATP合成酶、RubisCo和细胞色素亚单位b6f配合物(63,64].在黄化组织暴露于光下,叶绿体发育和变绿发生,这表明层状体是类囊体的前体[65].质体生物发生的改变,包括质体转录、翻译和信号传递,经常导致白化表型[34],因此,在雄激素培养过程中质体向叶绿体分化的作用似乎对小孢子质体向完全组装和功能的叶绿体的转变至关重要。
在我们之前对体内小孢子发生过程中质体分化的研究中,我们发现在雄激素发生中产生白化再生剂的大麦品种在小孢子发育过程中表现出淀粉合成基因的早期激活、前质体分化为淀粉质体和质体降解[18].利用几种表现出不同再生能力的大麦基因型,我们证实了培养前质体分化与培养中白化再生之间的相关性。然而,我们还没有分析在体外培养过程中导致绿色和白化再生剂从小孢子胚中再生的分子机制。在这里,我们首次详细分析了两个大麦品种在雄激素胚形成和植株再生的连续阶段的质体分化,这两个品种在离体小孢子培养中产生绿色再生体的能力不同。通过分析叶绿体中参与转录和翻译的基因和叶绿体分化相关基因的表达谱,确定质体拷贝数,分析质体形态和超微结构,揭示了叶绿体发育改变导致白化病植物形成的机制。我们揭示了白化病产生基因型中叶绿体转录激活失败的分子过程,并讨论了两种基因型中叶绿体形成的不同机制。
结果
“泽西”和“梅卡达”品种的雄性激素潜力
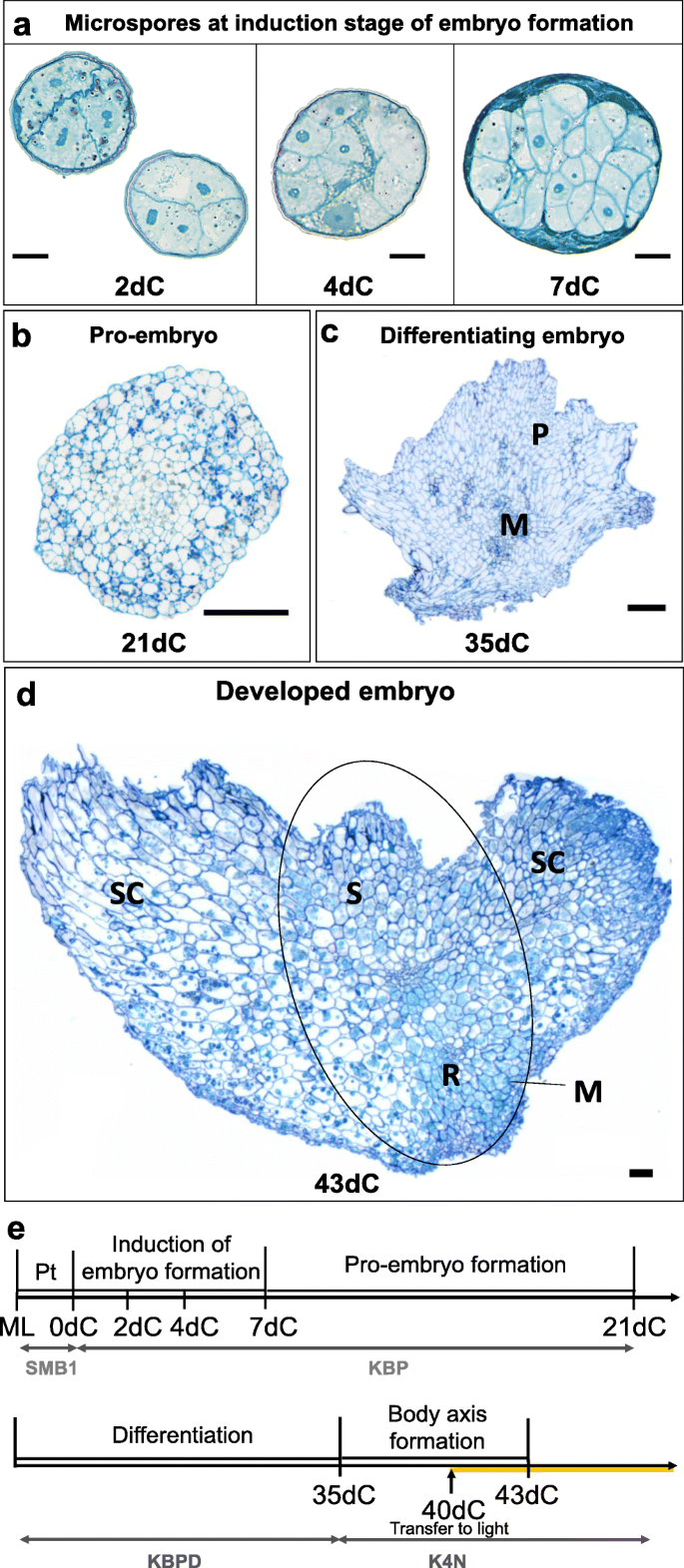
cvs离体小孢子培养的植株再生。“Jersey”和“Mercada”通过小孢子胚胎发生过程发生,在这个过程中可以区分几个阶段。前处理后的第一阶段-孢子体发育诱导,包括外壁内的细胞分裂,导致培养第7天形成多细胞结构(7dC,图。1a).外壁破裂,细胞进一步分裂,在培养第21天(21dC)可以观察到球状前胚胎(图。1b).在此阶段,将发育好的前胚转移到分化培养基上2周(图。1e).在培养第35天(35dC),可以在分化胚胎中识别分生区(图。1c).然后将胚胎转移到再生培养基上,前5天在黑暗中,后5天在光照中(图。1e).在再生培养基上培养8天后,培养43天(43dC),可检测到胚体轴(图。1d).在离体培养的第46天,可以看到发育完全的雄激素胚胎,可以转化为植物(46dC,图。2a).植物再生的进一步阶段如图所示。2A, b为本研究分子分析所用的时间点。需要强调的是,两个品种的小孢子胚在同一时间达到了相同的发育阶段。
大麦小孢子离体培养中雄激素胚的发育。“泽西”和“梅尔卡达”。模拟雄激素胚胎的切线切片,包括:胚胎形成的诱导期(一个),在21dC上形成前胚胎(b),在35dC上分化胚胎(c)和在43dC上发育完全的胚胎,并形成体轴(d).e离体小孢子培养中雄激素胚发育的研究进展。培养始于中晚期的小孢子(ML),在SMB1培养基中预处理两天,然后在黑暗中在KBP诱导培养基中培养3周。接下来,将发育好的前胚胎转移到KBPD分化培养基上分化两周。35dC时将分化胚转移到K4NB再生培养基上形成胚体轴,先在黑暗中,40dC后在光照中。dC天培养,M分生区,ML -中晚期小孢子,P -薄壁细胞,Pt预处理,R -根尖分生组织,S -梢尖分生组织,SC -鳞片。比例尺:20 μm一根;b-d为100 μm
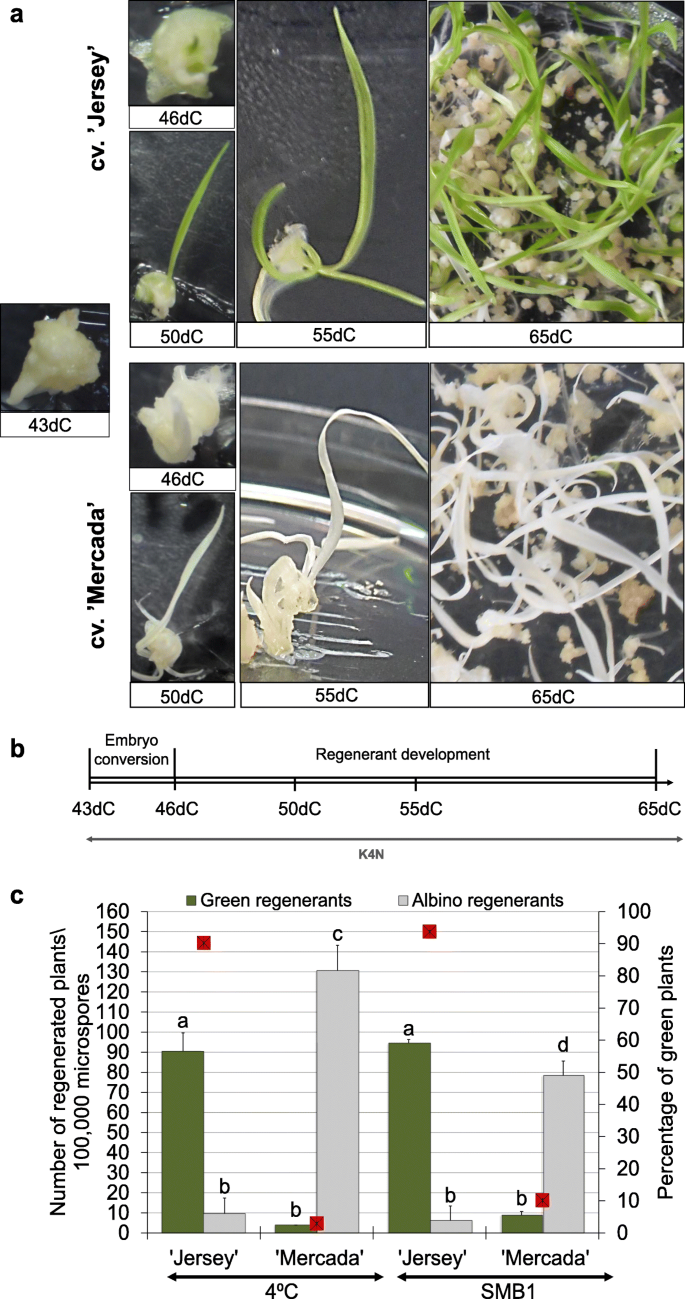
该研究选择的两个品种,' Jersey '和' Mercada ',在离体小孢子培养中表现出很高的再生潜力,每10万个微孢子可产生100多个植株。“泽西”和“梅尔卡达”再生植株的频率不同,再生植株的总体数量也较高。“Jersey”再生了90%的绿色植物,而“Mercada”只产生了5-10%的绿色再生剂,大多数再生剂都是白化的,这与用于诱导雄激素发生的胁迫处理不同(图2)。2c).在SMB1预处理后的“Mercada”培养中,观察到再生植物中绿色植物的贡献略有增加,但与冷预处理相比,它伴随着整体再生能力的降低(图。2c).这些结果表明,诱导处理的修饰并没有克服大麦雄激素发生中白化再生剂的基因型依赖形成。
小孢子胚形成和分化过程中质体的生物发生和发育
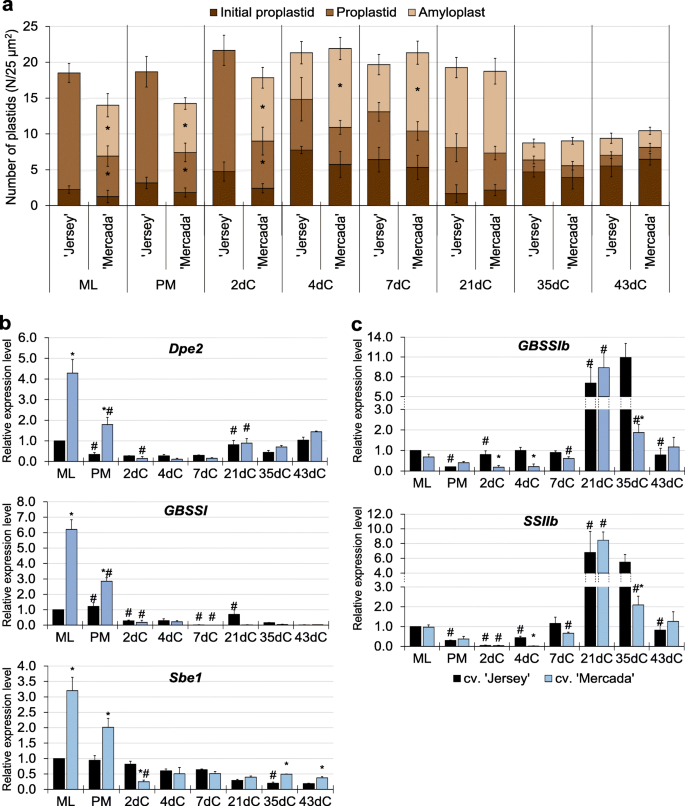
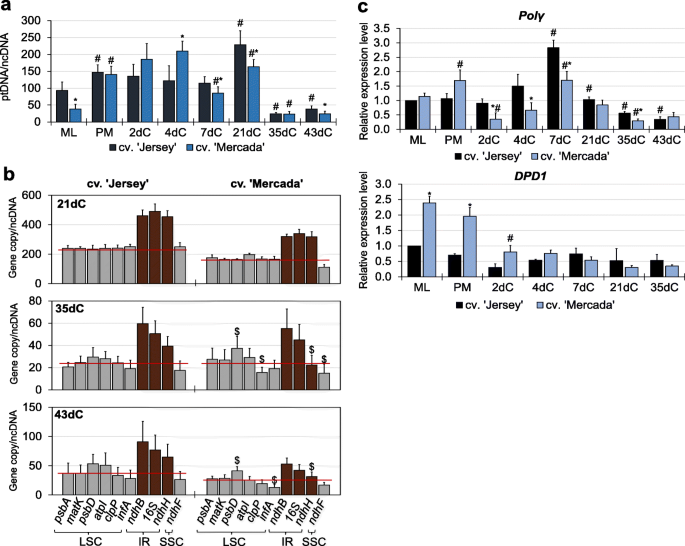
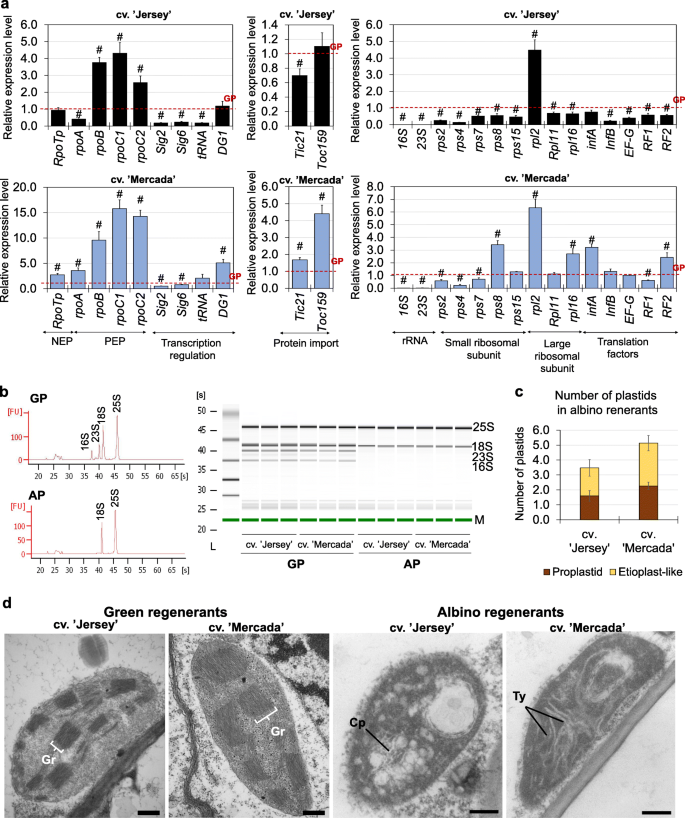
在文化启蒙阶段,cvs。“Mercada”和“Jersey”在用于启动体外培养的中晚期(ML)小孢子中显示出质体类型的差异。通过透射电镜观察,可以区分小孢子所包裹的不同类型的质体,并估计其数量。质体数量为每25 μm2小孢子细胞质,然后每25 μm2每个品种的胚细胞细胞质。简历。“Mercada”在雄激素发生中产生的大部分是白化植株,含有50%充满淀粉粒的淀粉体和50%的前质体,而cv。“泽西”只包含初始和分化前质体。初始的(未分化的)前质体表现出单一的内陷和低电子密度,而分化前质体的电子密度要高得多[18].预处理后至2dC,两个品种的质体数量和类型均无变化。在4dC上观察到前质体向淀粉质体分化。' Jersey '和cv中淀粉体数量的增加。“固定”。在21dC的前胚形成结束时,两个品种的质体数量和类型相似,淀粉质体的数量和类型约为60%。3.a).有趣的是,在分化期结束时,在35dC上,两个品种的质体数量迅速减少,初始前质体占观察到的质体的50%。在两个品种(43dC)发育完全的雄激素胚的顶端区域观察到类似数量和类型的质体,这表明雄激素胚含有相同种类的质体,而不受再生体类型的影响。
泽西岛和梅尔卡达培养胚形成过程中质体密度和淀粉合成基因的表达一个在连续培养阶段,小孢子和小孢子胚中存在的质体的类型和密度。初始前质体的特点是电子密度低,存在单一内陷的内陷,分化前质体的电子密度高得多,存在单一内陷的内陷,淀粉体充满淀粉粒。目前的平均值n≥3,SD。b,c储备淀粉相关基因的相对表达量(b)和同化淀粉(c)“泽西岛”和“梅卡达”文化的融合。的平均值n≥3 .带SEM。相对表达水平归一化至ML小孢子。“泽”。星号表示在培养的某一天,不同品种之间的数值有显著差异。哈希值表示在品种内与培养前一天显著不同的值(Tukey 's test,P< 0.05)。ML -中后期小孢子,PM -预处理小孢子,dC -培养日
考虑到两个品种的小孢子胚中存在淀粉体,我们分析了编码储备和同化淀粉合成酶的同工型的基因表达(附加文件)1:表S1)。在培养起始阶段,在ML小孢子中基因的表达水平Dpe2,GBSSI而且Sbe1参与储备淀粉合成的基因在cv中显著升高。' Mercada ',这与只在该品种的小孢子中观察到的淀粉体的存在相一致(图。3.b).在离体小孢子培养过程中,两个品种中这些基因的表达量均下降,说明胁迫处理和诱导雄激素发生抑制了储备淀粉的合成。相反,表达GBSSIb而且SSIIb在两个品种中,编码同化淀粉合成酶的基因在预处理后逐渐增加。3.c).在简历中。‘泽西岛’的表达增加了GBSSIb而且SSIIb基因已分别在2dC和4dC上观察到,这解释了该品种在4dC上观察到淀粉积累质体的存在。的最高表达水平GBSSIb而且SSIIb在两个品种发育的前胚21dC上均观察到基因。有趣的是,在7dC和21dC的胚诱导和前胚发育过程中,大多数与质体生物发生有关的基因在质体中参与转录和翻译的表达水平在供试品种之间没有显著差异。值得注意的是,这些基因的表达在cv中较高。在文化启蒙阶段,“Mercada”与“Jersey”的比较(图。4;额外的文件1:图S1)和包括NEP在内的大部分参与转录的基因的表达(RpoTpPEP亚基(由基因编码rpoA,rpoB,rpoC1,rpoC2)的cv值也更高。胚胎分化和体轴形成(35dC和43dC;无花果。4).对于大多数参与翻译的编码质体rRNA的基因,没有观察到这种差异。4c)和核糖体亚基的蛋白质(附加文件1:图S1)。
综上所述,我们认为,在雄激素胚诱导和分化阶段,绿色和白化品种在质体类型和数量上没有显著差异,但在35dC和43dC上发育的胚在质体生物发生相关基因的表达水平上存在差异。
离体小孢子培养过程中质体拷贝数的波动
结合质体数量,我们利用qPCR技术对分离小孢子培养过程中质体基因组的数量进行了评估。在培养起始和胚形成过程中,ML小孢子的质体拷贝数是cv的两倍。在两个品种中,‘Jersey’均显著高于‘Mercada’,且在21dC时达到最高值(图2)。5a).雄激素原胚分化过程中,在21dC至35dC之间,雄激素原胚分化速率迅速下降(cv为9 ~ 7倍)。分别检测到' Jersey '和' Mercada ')的质体拷贝数,与观察到的质体数量减少平行。然而,尽管两个品种在43dC上发育的雄激素胚中的质体数量保持相似,但cv。“Mercada”比cv低了两倍。“泽”(图。5a).此外,由于35dC和质体质体拷贝数的下降,在cv中观察到个体质体基因拷贝数的显著偏差。“固定”(图。5b)。
“泽西”和“麦卡达”品种分离小孢子培养期间的质体DNA含量。一个离体小孢子培养后数天内相对于核基因组的平均质体拷贝数。b在“Jersey”和“Mercada”品种的分离小孢子培养的随后几天中,质体基因组中定位的基因的个体拷贝数。c的相对表达谱波尔γ(细胞器DNA聚合酶)基因和DPD1镁基因编码2 +依赖细胞器外切酶。的平均值n≥3 . SD在一个而且b或SEMc.相对表达水平归一化至ML小孢子。“泽”。星号表示在培养的某一天,不同品种之间的数值有显著差异。哈希值表示在品种内与培养前一天显著不同的值(Tukey 's test,P< 0.05)。A $表示一个值与品种内培养某一天计算的平均质体拷贝数有显著差异(学生t检验,P< 0.05)。红线表示从所示基因的单个拷贝计算出的平均拷贝数。LSC -长单拷贝,IR -倒置重复,SSC -短单拷贝,ML -中后期小孢子,PM -预处理小孢子,dC -培养日
预处理后质体拷贝数的增加表明诱导了质体复制过程,因此我们分析了波尔γ编码细胞器DNA聚合酶的基因,也称为PolIA [66].的表达波尔γ基因在两个品种的ML小孢子中相似(图2)。5c).在胚胎诱导期,2dC至7dC波尔γcv表达水平。“Mercada”比cv低很多。但在前胚形成结束时趋于平衡(21 dC,图。5c).的表达式波尔γ两个品种胚分化和体轴形成过程中基因分布相似。自46dC以来观察到的质体副本数量增加(附加文件1:图S3)表明,两个品种的质体复制仍然活跃。
由于培养是由未成熟的花粉诱导的,我们分析了其表达水平DPD1编码细胞器外切酶的基因,在体内花粉发育过程中起作用,并在质体分化过程中降解细胞器DNA。在文化启蒙阶段,的表达水平DPD1基因在ML和预处理过的cv小孢子中升高2 ~ 2.5倍。' Mercada '而不是cv。' Jersey '和在培养开始时减少(图。5c)。DPD1基因在cv中有活性。在培养开始前,“Mercada”已经在小孢子发育的早期阶段(附加文件)1:图S2)。这表明在cv中较早激活质体降解。在培养开始前的小孢子发育过程中的' Mercada '。
cvs之间质体生物发生的差异。小孢子植物再生过程中的‘Jersey’和‘Mercada’
尽管在体轴形成阶段(43dC)结束时,两个品种的质体质体平均拷贝数相似,但特定质体基因拷贝数的偏差可能会影响进一步的质体发育,因此我们继续分析参与质体生物发生的基因表达(附加文件)1:表S1)在雄激素植物再生过程中(46dC, 50dC和55dC)。
cvs中的平均质体拷贝数。与43dC相比,' Jersey '和' Mercada '在转化胚胎和再生植物中增加,这表明质体基因组的复制与蛋白表达的增加相关波尔γcv中的基因。“泽西”(附加文件1:图S3a,c)。然而,正如我们之前在。简历。在胚胎发育期间,也在胚胎转化和再生发育期间,特定基因的拷贝数并不能代表它们在质体基因组中的定位的预期值(附加文件)1:图S3b)。
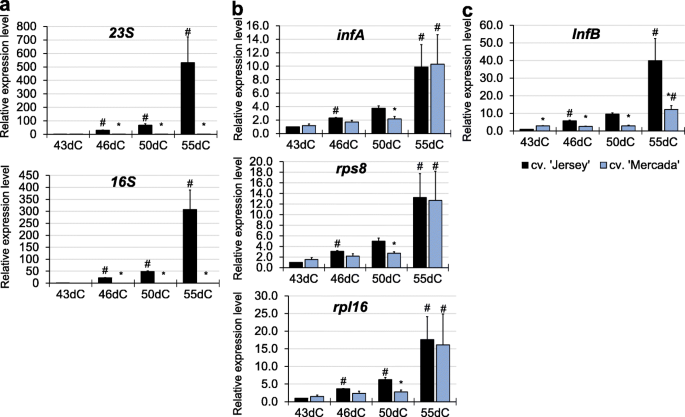
最引人注目的是,在cv的再生过程中。“泽西”植物的表达16 s而且23个年代编码质体rRNA的基因自46dC以来大幅增加(20 - 30倍),达到55dC的300-500倍。与“泽西”相比,在cv的再生过程中。在“Mercada”植物中,我们没有观察到46dC和55dC之间质体编码rRNA转录本水平有任何显著增加(图2)。6a).的表达式16 s而且23个年代在55dC上的“Mercada”白化病再生体中的基因与43天大的胚胎中的基因水平相同,后者只有可见的体轴。其他与转译相关的测试基因的表达:rps8,rpl16编码核糖体小亚基和大亚基的蛋白质infA,InfB编码翻译启动因子在两个品种的再生过程中都有所增加。6b, c)。尽管如此,在cv中观察到这种增长。“泽西”已经在46dC,而在cv。“Mercada”在55dC上开发再生剂。在55dC水平上,翻译相关基因的表达除InfB,在两个栽培品种中相似。
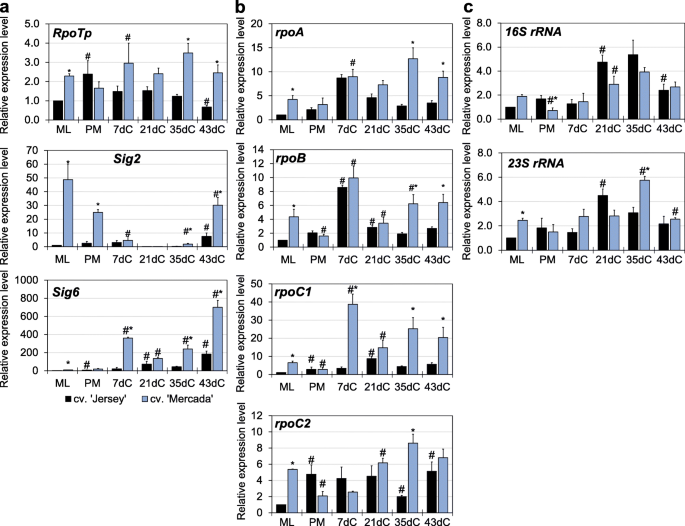
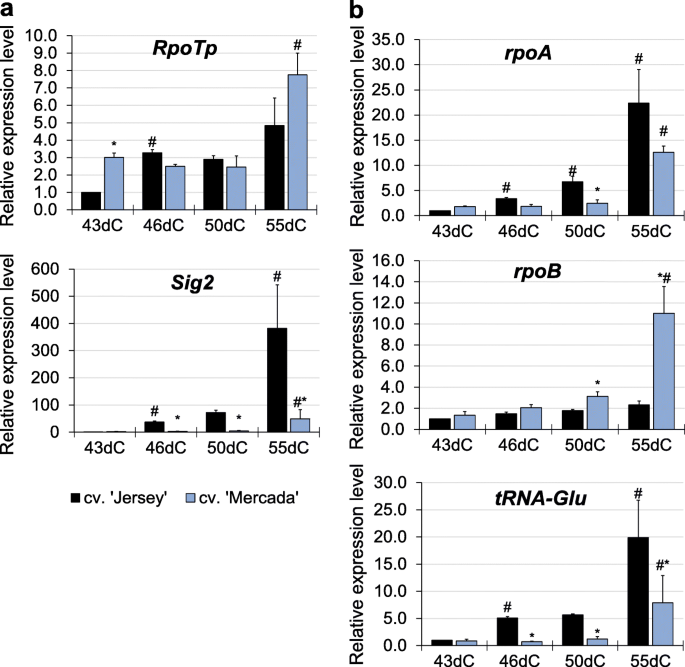
我们发现,在雄激素胚胎转化过程中,质体rRNA转录水平的大幅增加与绿色植物的再生相关。作为高水平表达的质体核糖体rna基因仅由质体编码RNA聚合酶(PEP)转录提供,我们分析了发生在质体中与转录过程相关的其他基因的表达。它们是编码蛋白质的基因,如NEP(核编码RNA聚合酶),PEP的亚单位,SIG2(参与质体tRNAs转录的sigma因子2)和trnE(tRNAGlu),均参与NEP-和pep -依赖转录之间的转换[47,49].
在雄激素胚胎的cv。“Mercada”的表达水平RpoTpNEP基因比cv高3倍。43dC频道的《泽西岛》。在后续的再生阶段,该基因在两个品种中表达相似,在cv中表达最高。55dC上的' Mercada '(图。7a).两个质体定位基因rpoA而且rpoBPEP的编码亚基α和β在cvs中表达差异显著。“泽西”和“梅尔卡达”。在简历。“Jersey”,表达rpoA在胚胎转化过程中逐渐增加,并在55dC达到最高水平,而在' Mercada '中增加rpoA只有在55dC上才能观察到转录水平(图;7b).应该注意的是,质体局部化rpoAPEP本身优先转录在绿叶中[42,67],因此其低水平的转录表明PEP在再生“Mercada”胚胎中的低活性。与rpoA,的rpoB基因编码PEP的β亚基,优先被NEP转录[39].转录水平rpoB在整个再生阶段,‘Jersey’的浓度保持在较低且不变,而‘Mercada’的浓度在55dC与43dC相比显著增加(图2)。7b)。
高水平的rpoBMercada植物的转录本和表达谱的差异RpoTp而且rpoA两个品种的基因表明NEP在再生Mercada胚和再生植株的质体中持续活跃。因此,我们进行了转录谱分析tRNAGlu而且Sig2表达变化与NEP向pep依赖转录转变相关的基因。Sig2位于细胞核内,编码PEP启动质体基因转录所必需的sigma因子。这些基因中有tRNAGlu,其转录产物达到一定水平后,会抑制质体内NEP的活性[49].两个基因:Sig2而且tRNAGlu,在再生过程中表现出相似的表达模式,但在两个品种中表现出不同。在简历。“泽西”的表达水平Sig2而且tRNAGlu基因显著高于cv。“Mercada”在植物再生的每个时间点(图。7).已经在46dC的表达水平Sig2而且tRNAGlucv中基因分别比43dC高37倍和5倍。“泽西”,而他们保持不变,直到55dC在cv。“固定”。在这个时间点上有一个非常高的增长Sig2而且tRNAGlu在“Jersey”中观察到的表达(分别是43dC的380倍和20倍)。这些结果表明,早在胚胎转化阶段,' Jersey '胚胎质体中的转录就依赖于PEP,而在' Mercada '胚胎的同一发育阶段,转录仍然主要由NEP进行。
雄激素植物再生过程中的叶绿体分化
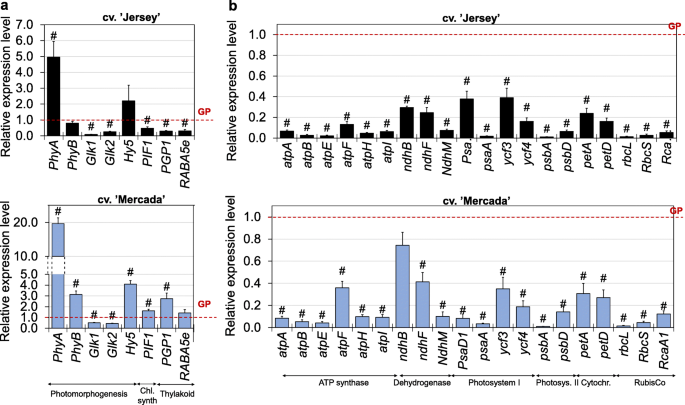
光诱导的前质体到叶绿体的转变是进一步叶绿体分化的必要步骤,这涉及到质体基因表达的有效激活,包括核糖体rna基因,光形态建成的诱导。因此,在雄激素植物的再生过程中,我们分析了与光形态建成相关的基因(编码光敏色素和调节光形态建成的转录因子的基因)的表达,以及参与叶绿体分化的基因的表达,包括叶绿素合成的调节,类囊体合成和对接(附加文件)1:表S1)。
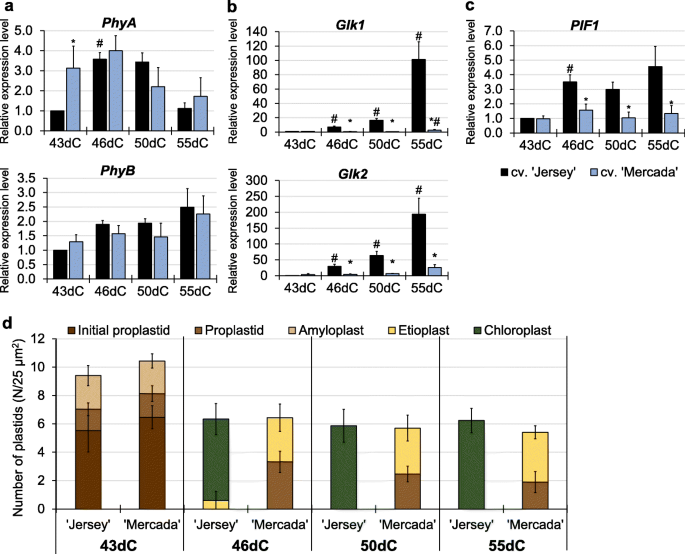
表达谱无显著差异巴而且、在cvs之间观察到编码光敏色素。除了43dC上的雄激素胚胎,再生过程中出现“Jersey”和“Mercada”。8a).然而,我们观察到,从46dC开始,两个品种在表达Glk1而且Glk2编码转录因子的基因,是光合作用相关核基因的正调节因子。在简历。' Jersey '基因的表达量均显著增加,55dC时的表达量是43dC时的100-200倍(图2)。8b).与“泽西”相反,在简历中。两者的“Mercada”表达Glk在胚胎转化和植株再生过程中,基因是恒定的。的高增长Glkcv基因表达。已经在转化胚胎中观察到的“Jersey”,表明glk依赖通路中“Jersey”质体的光形态建成被激活。缺乏增加的表达Glk基因cv。“Mercada”表明该基因型的叶绿体分化在再生阶段被抑制。
在表达谱上观察到显著差异PIF1调节叶绿素的合成也受光感知的影响。在简历。' Jersey '激活PIF1在46dC转化胚胎中观察到表达,而在cv。“Mercada”是比cv低两倍的表达。观察到' Jersey ',在整个再生期都是稳定的(图。8c).品种间没有这种差异Hy5编码另一种参与激活控制叶绿体发育的核基因的转录因子PGP1而且RABA5e这些基因分别参与类囊体膜的合成和对接,不受光感知的影响(附加文件)1:图S4)。PIF1是bHLH转录因子,是暗生苗子叶变绿的关键调控因子。PIF1通过两种途径促进幼苗绿化:一是通过调控四吡啶途径相关基因的表达抑制原叶绿素的积累;第二,PIF1直接与PORC的启动子结合,激活其转录,从而促进原叶绿素转化为叶绿素[68,69].
通过透射电镜分析,在‘Mercada’和‘Jersey’培养43、46、50和55天时,评估转化胚和再生植株叶片中质体的数量和类型。每25 μm的质体数量无差异2在随后几天的再生中,观察到' Jersey '和' Mercada '之间的胚胎细胞质的差异(图。8d).此外,在43dC上,两种基因型中相似类型的质体(初始前质体、前质体和淀粉质体)比例相似。然而,46dC以后,当转化胚的茎尖清晰可见时,各品种间质体类型存在显著差异。在“Jersey”再生体的叶肉细胞中,大多数质体由叶绿体代表,只有少量的黄体存在于46dC上(图2)。8d).叶绿体的特征是花粒发育良好,而叶绿体仅含有近层体(附加文件)1:图S5)。后来,在50dC和55dC上,“泽西”再生植株的叶片中只观察到叶绿体,其中90%是绿色的。另一方面,在cv。“Mercada”主要再生白化植物,在46dC上观察到类似比例(50%)的前质体和黄化质体样质体(图。8d).在50dC和55dC条件下,‘Mercada’再生叶片的叶肉细胞也得到了类似的结果。cv中黄质质体样质体。“Mercada”再生剂发育更早,含有单一穿孔类囊体和无组织结构的早期颗粒(附加文件)1:图S5)。
cvs白化再生剂的特征。“泽西”和“梅卡达”
简历。“Jersey”在离体小孢子培养中再生的植物大多是绿色植物,也产生少量(5-10%)白化再生剂。为了确定导致' Jersey '白化病形成的过程是否与' Mercada '中发生的过程相似,我们比较了质体生物发生、叶绿体分化、光形态建成和光合作用相关基因的表达谱(附加文件)1:表S1),以及白化和绿色两种基因型再生体的质体超微结构和质体复制。
两个品种的白化植株与相应品种的绿色再生植株在质体转录、翻译和蛋白质导入相关基因的表达谱上存在差异(图2)。9a).在cv的白化再生剂中。与绿色再生植物相比,大多数参与这些过程的测试基因表现出明显的低表达。此外,与NEP到PEP转录转变相关的基因的相对表达水平(rpoA,Sig2,tRNAGlu)降低了2 - 5倍,而PEP亚基基因(rpoB,rpoC1而且rpoC2),主要由NEP转录,显著高于绿色再生剂。这一数据表明,发生在泽西岛白化植物质体中的转录没有转变为pep依赖的过程,NEP是主要的质体RNA聚合酶,与cv中的植物再生相似。“固定”的文化。
“泽西”和“梅卡达”品种白化和绿色再生植株的比较。一个cvs白化再生体中与转录、翻译和蛋白质导入相关基因的相对表达水平。“Mercada”和“Jersey”相比较对应的绿色再生。的平均值n≥3 .带SEM。相对表达量归一化为每个品种的绿色再生因子。哈希值表示品种内绿色植物和白化植物之间的显著差异(t-Student检验,P< 0.05)。b使用Agilent 2100 Bioanalyzer从绿色(GP)和白化(AP)再生剂中分离出的rna的电泳图和凝胶图像显示核和质体rrna含量。c两个品种白化再生体叶肉细胞单横截面质体的类型和数量。d白化和绿色植物质体形态的观察。“泽西”和简历。“固定”。的平均值n≥100,SD。比例尺= 200 nm。Cp -层状体,Gr -粒状体,Ty -类囊体
cv白化再生剂。“泽西”和简历。“Mercada”显示出非常低水平的质体rRNA转录本,这是通过使用Agilent 2100生物分析仪对绿色和白化再生剂的RNA样本进行质量控制而可见的。9b).然而,与简历相反。泽西岛,cv的白化植物。' Mercada '在大多数分析基因中表现出相似甚至更高的表达水平(除了tRNAGlu,Sig2,核糖体rna)比该品种的绿色再生株系(图。9a).这些结果表明,在白化植株中,质体生物发生相关基因的转录仍在进行。“固定”。此外,当比较两个品种的白化再生材料时,大多数与质体生物发生相关的基因的相对表达量。“Mercada”比cv高。' Jersey ',独立于质体或核基因组中的基因定位(附加文件1:图S6)。例如,RT-qPCR分析显示16 s而且23 s rRNA在白化植株中降低2 - 4倍。“泽西”而不是“梅尔卡达”(附加文件1:图S6)。
白化再生植株“Jersey”和“Mercada”的参与光形态建成调节的GLK转录因子基因表达明显低于绿色植株。此外,参与叶绿体分化的其他基因的转录活性,如PIF1(调节叶绿素合成),PGP1(参与类囊体膜的合成)和RABA5e(负责类囊体膜对接)在白化再生剂cv。“泽”(图。10).有趣的是,在cv的白化再生剂中。Mercada′中,光形态建成相关基因的转录水平均与绿色植株相近或较高。这些结果与两种基因型再生体的质体超微结构观察结果一致。对白化再生体叶片叶肉细胞质体的透射电镜分析显示,“Jersey”和“Mercada”存在差异。在这两个品种的白化再生体中,我们只发现了分化的前质体和类似于原质体的质体,但处于不同的分化阶段(图2)。9c, d)。“Jersey”中的黄浆样质体仅包含前层体,未观察到类似类原囊体的结构(图。9d).而在' Mercada '中的黄浆样质体中,既存在板层体,也存在无组织的类原囊体/类囊体结构(图2)。9d).由于在两种基因型中观察到的质体都没有转化为叶绿体,这些质体不能被描述为功能叶绿体。与白化植株相反,绿色再生植株的叶绿体结构在所研究的品种之间没有差异(图2)。9d)。
由于质体到叶绿体转变失败,与相应品种的绿色再生体相比,' Jersey '和' Mercada '的白化再生体和编码光系统I和II亚单位、ATP合成酶、细胞色素f、NADH-PQ氧化还原酶和RubisCo复合物的质体和核基因表达显著降低(图2)。10).
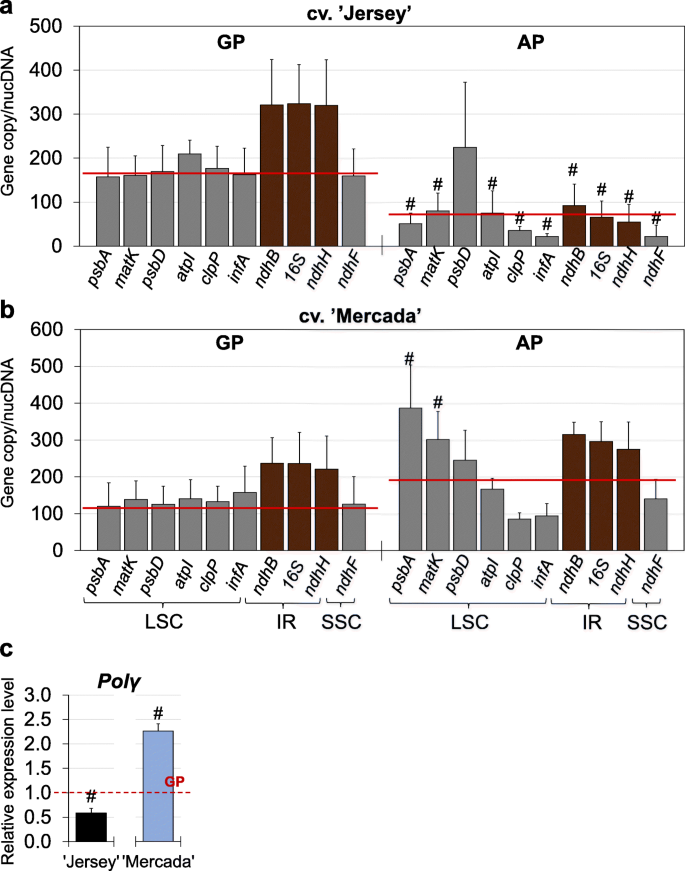
除了基因表达和质体超微结构外,我们还评估了绿色和白化再生剂中质体定位基因的拷贝数。在两个品种的绿色植株中,单个基因的拷贝数与其在质体中的定位一致。相反,两个品种的白化植株含有不同数量的单个基因拷贝,这与基于质体基因组中基因位置的预测数量不一致(图2)。11).在泽西岛,与绿色再生植株相比,白化植株的平均质体拷贝数低了三倍(图2)。11a).此外,定位于质体基因组倒重复序列的基因与定位于单拷贝区域的基因相比,并没有出现在预测的两倍拷贝数中。这说明在白化植株中,完整质体的数量和模板的数量是有限的。' Jersey ',这反过来可能导致plastidial的低表达水平核糖体rna基因,叶绿体分化的停滞和白化表型的再生体携带这些变化。
与“泽西”相反,在cv的白化再生剂中。“Mercada”的平均质体数量是绿色植物的两倍(图2)。11b).正如我们在植物再生过程中已经观察到的那样(附加文件1:图S3b),在“Mercada”白化植物中,单个基因的拷贝数与基于基因定位的预测值不一致。有趣的是基因吗psbA而且matK在白化病患者中,靠近复制起始位点的区域显示出比绿色再生细胞高3倍的拷贝数(图2)。11b).基因的拷贝数随着距离复制起始位点的距离而减少,这可能表明复制经常开始,但没有完成。
的表达分析为这一观察结果提供了额外的支持波尔γ白化植株表达量比绿色植株高2倍的基因。“固定”。相反的表达模式观察到cv。“泽西”,其中的表达波尔γ绿色植物比白化植物高两倍(图。11c)。
简历比较。“Jersey”和“Mercada”清楚地表明,绿色再生剂和白化再生剂比例相反的品种在生物发生的早期阶段表现出叶绿体分化的停滞。这种停滞与缺乏pep依赖的转录和光形态建成的抑制有关。
讨论
在本研究中使用的胁迫因子(如饥饿或寒冷)处理液泡化小孢子,可以在培养中诱导其改变发育途径并诱导小孢子胚胎发生。众所周知,在小孢子发生过程中,从配子体到孢子体的小孢子途径的重编程只可能在一个狭窄的窗口期发生,而在大麦中,有效的胚胎诱导通常是从ML(中晚期)无核小孢子开始的[70,71].ML cvs的小孢子。在我们的实验中使用的‘Jersey’和‘Mercada’成功地通过了这些重编程过程,因为它们开始了有丝分裂并以高频率形成胚胎。这两个品种表现出相似的诱导和再生潜力,每100,000个分离小孢子约100株,但它们产生绿色植物的能力存在显著差异。
绿色植物的再生依赖于叶绿体的形成,而在雄激素植物中,叶绿体起源于包裹在体外培养的小孢子中的前质体。存在于小孢子中的前质体被编程为分化成淀粉体,然而,正如我们之前所展示的,小孢子发育的激活和分化成淀粉体的阶段在不同的大麦品种中是不同的。我们证明了在小孢子培养中再生绿色植物的基因型能力取决于离体培养前小孢子质体的分子分化[18].雄激素发生过程中主要产生白化再生剂的品种,如“Mercada”,表现出淀粉合成基因的早期激活和前质体向淀粉体的早期分化。在ML无核阶段,通常用于雄激素培养的开始,充满淀粉的淀粉体占cv小孢子中存在的质体的近50%。“Mercada”在cv的小孢子中。“泽西”主要产生绿色再生体,仅观察到无明显形态的前质体。此外,在cv。' Mercada '储备淀粉合成基因的激活已经发生在发育的早中期(EM)阶段,该阶段先于用于培养起始的阶段[18].
在本研究中,我们分析了体外培养的小孢子质体分化。使用相同的两个大麦品种“Jersey”和“Mercada”,我们在体外培养的连续阶段,从预处理的小孢子,到胚诱导和胚形成阶段,再到植株再生,研究了质体的分化。如上所述,在cv的ML小孢子中。“Mercada”几乎一半的前质体已经分化成淀粉体,这在“Jersey”的ML小孢子中不存在。自培养第四天(4dC)以来,我们发现在小孢子和小孢子衍生结构的分裂中也出现了淀粉积累质体。“泽”。然而,基因表达分析显示,这些淀粉体的功能与“Mercada”不同。编码储备淀粉合成酶的基因表达显著降低,而负责同化淀粉合成的基因在离体培养开始时在‘Jersey’中被激活。储备淀粉和同化淀粉的生理功能不同:储备淀粉储存较长时间,作为下一代的能量来源,而同化淀粉则在白天暂时积累,迅速消耗,以支持生物活动[72].在两个品种中,淀粉体数量和同化淀粉合成基因的表达量在21dC前胚形成时达到最高值。
值得注意的是,cv中淀粉体数量的增加。在与同化性淀粉合成相关的基因激活之前观察到“Mercada”。因此,我们假设' Mercada ' ML小孢子中存在的大多数淀粉体在预处理和培养开始后没有降解,并且可以在淀粉积累组织中进行分裂,例如在栽培稻而且芋耐[73,74].因此,前处理并没有逆转cv. ML小孢子的质体分化过程。' Mercada ',包括淀粉合成和积累。然而,预处理导致两个品种之间大部分与质体转录和翻译相关的基因表达谱的差异减少甚至消失。它还阻碍了体内花粉粒形成过程中发生的质体降解过程.在本研究中,在Mercada小孢子中观察到的质体降解与基因表达的激活有关DPD1花粉发育过程中负责降解质体DNA的外切酶[66].“固定”DPD1自小孢子发育早期起,在整个小孢子发生过程中均有表达,而在cv中未观察到。“泽”。在连续的离体培养阶段,两个品种都表现出低表达DPD1以及质体数量的变化。
在胚胎诱导和形成阶段,两种基因型的质体拷贝数都有所增加,在21dC时达到最高值,与此时观察到的质体数量最高一致。
叶绿体分化的早期阶段受到前质体发育的检查点的调控,包括质体的稳定性和前质体中发生的有效转录和翻译过程[54,75].在与植物发育相关的叶绿体分化过程中经常观察到质体基因组数量的减少[76].对质体mrna的高需求和细胞内的rrna被大量质体和质体内的许多质体副本所覆盖[77,78].在21dC至35dC之间,即胚分化阶段,两个品种的质体拷贝数均显著下降。在简历。“泽西”,与cv相反。“Mercada”,在胚胎发育的下一阶段,即胚胎体轴形成,质体拷贝数增加。此外,在cv。“Mercada”自35dC以来,个体基因的拷贝数与质体内基因定位的预期值不同。在转换cv时。“Mercada”胚胎和再生体的进一步发展,质体的平均拷贝数增加,但单个基因的拷贝数甚至更加分散。这表明,与完整副本相比,复制质体的副本是不完整的。 The high number of proper plastid genomes is considered as a checkpoint for chloroplast differentiation [79].拟南芥质体基因组的不稳定性阻碍了原质体向叶绿体的分化[80,81].cv的质体基因组。雄激素培养中的Mercada表现出高度的不稳定性。因此,我们认为低数量的正确质体拷贝可能会影响前质体向叶绿体的分化。“固定”。
质体从NEP-到pep -依赖转录的转变是叶绿体分化的一个关键因素,因为只有质体转录系统能够提供高水平的质体编码基因的转录,包括rrna、tRNAs、参与质体翻译的一些核糖体蛋白的基因,以及编码光系统亚单位的基因[42,82].每个PEP亚基基因的突变导致烟草白化表型和光合作用的缺乏(烟草l .) [83,84],而一个击倒RpoTp(编码NEP)在拟南芥中只导致叶绿体发育延迟[85].叶绿体的分化过程涉及光,需要通过PEP进行依赖sig2的质体基因转录。在这些基因中有tRNAGlu其转录产物达到一定水平后抑制NEP活性,从而作为诱导叶绿体分化的检查点的基因[47,49,50,86].此外,带电的谷氨酰trna是5-氨基乙酰丙酸的前体,其水平与逆行信号介导的核基因控制有关[47,48].
表达式分析Sig2而且tRNAGluJersey和Mercada品种间存在显著差异,表明聚合酶NEP和PEP的转录活性不同。在简历。在46dC上的转化胚胎中已经观察到pep依赖转录的激活。在此时间点,的相对表达量Sig2而且tRNAGlu与43dC上的基因水平相比,分化“泽西”胚胎的基因分别增加了37倍和5倍。与‘Jersey’相反,在植物再生早期阶段,pep依赖的转录在cv。“Mercada”没有被观察到。的表达水平相对较低tRNAGlu在整个植物再生过程中表明NEP仍然是' Mercada '质体中的主要RNA聚合酶。对新经济政策在再生cv植物方面的持续活动的额外支持。“Mercada”被给予了高度的表达rpoB主要由NEP转录的基因。的表达谱Sig2归一化到内参基因ARF1(adp核糖化因子1样蛋白),EF1(平移伸长因子1-a),清楚地表明该核基因仅从46dC起活跃,并且仅在“泽西”胚胎中活跃(附加文件)1:图S7)。这就提出了一个问题,是什么因素引发了Sig2在“泽西”胚胎中激活,但在“梅卡达”中没有作用。我们推测导致缺乏的机制Sig2“Mercada”基因的表达可能与该品种胚形成过程中观察到的质体基因组不稳定有关。如上所述,自35dC以来,cv。“Mercada”含有不正确的质体基因组拷贝,在43dC上,它们在整个体外培养过程中基因组拷贝数最低。质体基因组的完整性被认为是早期前质体向叶绿体分化的一个检查点[87,88].叶绿体的分化依赖于有效的核-质体(顺行)和质体-核(逆行)信号,质体信号的缺乏可能导致细胞核转录激活的缺失或不足。然而,逆行信号激活的分子机制Sig2细胞核中的基因仍有待发现。
在小孢子胚胎发生过程中,RNA聚合酶的作用似乎对绿色植物的再生至关重要,因为白化病只发生在只有一种核编码聚合酶的谷物中(RpoTp) [51].双子叶在雄激素培养中不能再生白化植物,含有两种核编码聚合酶:RpoTp而且RpoTmp.后者主要活跃于线粒体[51]但它也参与转录16 s rRNA发生于质体[40,89].在“Mercada”质体中nep到PEP转化失败的主要后果是在胚胎转化和植株再生阶段PEP没有激活有效的rrna转录。在发生这种转变的“泽西岛”胚胎中,相对表达16 s而且23个年代在43dC和46dC之间,编码质体rrna的基因增加了20 - 30倍,在55dC的再生植株中增加了300-500倍。当质体表达谱核糖体rna在整个雄激素发生过程中观察到归一化为内参基因的基因,可以清楚地看到rRNA水平的增加仅发生在cv。' Jersey '并在43dC(附加文件1:图S7)。此时胚体轴可见,胚已在再生培养基上培养8天,先在黑暗中培养,3天在光照下培养。与“泽西”相比,在cv的再生过程中。在“Mercada”植物中,我们没有观察到43dC和55dC之间质体编码rRNA转录本水平有任何显著增加。核糖体组装需要16S和23S rrna,它们的缺乏导致核糖体损耗[53],而质体中发生的适当翻译对于诱导前质体向叶绿体分化是必要的[90].
由于质体生物发生不正确,编码转录因子GLKs的基因(光合作用相关核基因的正向调节因子)以及光合作用相关基因在再生Mercada胚和白化再生体时未被激活。同样,大麦albostrians质体核糖体中缺失的突变体显示光合作用相关蛋白的mrna含量降低[91].
NEP在cv白化再生剂中的持续活性。“Mercada”导致质体基因转录本的积累,其转录依赖于nep。还有其他参与质体生物生成的基因,如导入(Tic21,Toc159),质体复制保持活跃。这些基因表达的增加表明在转录水平上的反应是为了恢复质体的生物发生和维持叶绿体的分化。拟南芥研究表明,PEP亚基或sigma因子缺失导致质体中PEP活性低,从而导致依赖NEP的基因转录增加[47,84,92].PEP亚基转录本编码水平的增加rpoA,rpoB,rpoC1,rpoC2大麦中也发现了基因albostrians和玉米iojap缺乏质体70S核糖体的突变体,以及大多数其他白化突变体[42,93,94].
有趣的是,白化植株叶肉细胞中的质体。与白化植株相比,“Mercada”的分化程度更高。在重生者中偶尔出现的“泽西”。透射电镜观察显示,在Mercada的黄体质体样质体中存在着原层体和无组织的类原囊体/类囊体结构,而在Jerey的黄体质体中只存在着原层体。白化植株的cv。与绿色再生植物相比,“泽西”显示出低2倍的平均质体副本数量,并且个体基因副本数量之间存在显著偏差。低数量的质体基因拷贝,包括rrna编码基因,为质体中发生的转录提供了有限数量的模板,这反过来阻碍了光依赖性叶绿体的生物发生,导致质体在分化早期停滞。在白化植株中观察到的特定基因的不同拷贝数。' Jersey '可能是由于质体复制不完全和/或质体基因组的结构变化造成的,正如许多谷物的白化再生体所描述的那样[19,20.,21,22].
通过对cvs绿色再生剂和白化再生剂的比较。“Jersey”和“Mercada”值得注意的是,激活时间而不是特定基因的表达水平在绿色植物的再生中至关重要。许多分析基因的表达,包括tRNAGlu,Sig2,Glk1,Glk2cv增加。“Mercada”发生在培养55天,此时植物已经再生,但在白化再生体的叶肉细胞中观察到的质体已经在发育的早期阶段被阻止。前文讨论的白化植株胚分化阶段缺乏适当的质体生物发生,导致白化植株缺乏前质体向叶绿体的转化和再生。
应该强调的是,在雄激素培养中导致白化植物形成的机制是体内花粉发育过程中质体分化的结果。前质体启动了前质体向淀粉体分化的程序,在体外条件下不能逆转。因此,在培养起始阶段含有这种质体的小孢子将在雄激素发生过程中产生大部分白化再生剂。在小孢子发育的早期阶段诱导分离的小孢子培养比常规使用的小孢子培养提供了额外的支持。当小孢子只含有前质体时,大麦雄激素发生中绿色再生因子的频率可能显著增加[18].
结论
这项研究提供了在谷物雄激素发生过程中导致白化再生剂形成的分子过程的见解。我们发现,小孢子胚中存在的前质体从nep依赖转录到pep依赖转录的失败转变与雄激素植物再生过程中叶绿体分化受损、光形态发生抑制和基因型无法再生绿色植物有关。在以白化植株为主的基因型中,16S和23S rRNA转录本水平极低,且缺乏Sig2在再生胚胎中的表达表明PEP RNA聚合酶激活失败。在质体编码基因的转录中缺乏PEP活性,与缺乏PEP活性有关Sig2细胞核内基因激活,表明前质体未通过发育的早期检查点。我们认为,早在分化胚胎时就观察到的完整质体拷贝数量不足,可能是一种逆行信号,阻碍了白化病产生基因型中正确的质体生物发生和叶绿体分化。
方法
植物材料和生长条件
利用两个春大麦品种“泽西”和“麦卡达”进行实验。' Jersey '用作麦芽,而' Mercada '是饲料品种。这两个品种都是两行。这两个大麦品种的种子由波兰DANKO植物育种有限公司提供。
小孢子离体培养的供体植株在18/16°C、200 μM s光照下播种生长−1·米−2将光子通量转移到生长室,在17/14°C(白天和黑夜)的受控条件下,光照480-500 μM s−1·米−2光子通量和16/8小时光周期。
分离出的小孢子体外培养及取样
收集中晚期至晚期(ML)发育阶段含有小孢子的穗,开始体外培养,并用70%乙醇对其表面消毒。根据Coronado等人的说法,小孢子是新鲜分离的。[95].该过程先前在Gajecka等人中描述过。[18].简单地说,用Waring变速实验室搅拌机(Waring Laboratory Science)将10个尖刺均质两次,在20ml 0.4 M甘露醇中进行20秒的均质。所得匀浆经100 μm尼龙网过滤。通过离心收集小孢子(110×g;10分钟;4°C),悬浮在5 ml 0.55 M麦芽糖和2 ml 0.4 M甘露醇中,离心(110×g;10分钟;4°C)。收集存在于间期的活的小孢子,在SMB1培养基中预处理[95]在25°C下培养48小时,在培养皿中每1ml培养基中培养100,000个小孢子。将培养基交换为KBP诱导培养基[96](附加文件1:表S2)。25℃黑暗条件下培养7天。接下来,加入1毫升新鲜KBP培养基,在同样的条件下,以65转/分的速度在旋转搅拌器上继续培养14天。第21天成好的多细胞结构转移到KBPD分化培养基上[95](附加文件1:表S2)并在25°C的黑暗条件下培养。培养2周后,第35天的小孢子胚置于K4NB再生培养基上[96](附加文件1:表S2),在25°C的黑暗环境中保存5天,然后暴露到100 μM s−1·米−2光周期为16/8小时的光。
分别在3个独立的生物复制中分离小孢子,分别在培养开始当天(ML期小孢子)、SMB1预处理小孢子(PM)和连续几天的体外培养诱导阶段(第2、4、7、21天),以及第35天胚分化阶段结束和第43天雄激素胚发育阶段收集样本。雄激素植株胚形成后,在离体培养第46天胚转化时采集样品,在离体培养第50和55天发育植株时采集样品。比较两个品种的再生植株、绿植株和白化植株的再生植株。“Mercada”和“Jersey”在培养第65天取样。
RT-qPCR基因表达谱分析
根据制造商的说明,在冷冻砂浆中研磨样品之前,使用“mirVana™miRNA分离试剂盒”(赛默飞世尔科学公司)分三次独立的生物重复提取总RNA。分离样品使用ND-1000分光光度计(赛默飞世尔科学公司)和Agilent RNA 6000纳米试剂盒(安捷伦科技公司)以及Bioanalyzer 2100(安捷伦科技公司)进行评估。RT-qPCR分析如Gajecka等人先前所述[18].简单地说,每个样品用RQ1 RNase-Free DNase (Promega)处理1 μg总RNA,并使用RevertAid第一链cDNA合成试剂盒(Thermo Fisher Scientific)随机引物在20 μl的反应量中按照制造商的说明进行反转录。将cDNA用水稀释5倍,以2.5 μl的体积进行RT-qPCR。反应在10 μl的体积中进行,使用LightCycler®480 SYBR Green I Master (Roche)进行两次技术重复。分析中使用的引物(附加文件1:表S1)采用Primer3设计[97].使用LightCycler 480 (Roche)在以下反应条件下进行分析:95°C初始变性5分钟,95°C 10秒,引物特定温度20秒,72°C 10秒,重复40个循环。熔体曲线分析的变性在95°C下进行了5秒,然后在65°C下进行了1分钟,并加热到98°C(荧光测量为0.1°C/s)。通过LinRegPCR得到Ct值和qPCR效率值[98]并用于计算。相对表达量采用ΔΔCt方法计算[99],并对ML小孢子、培养第43天的胚胎或cv。“泽西”如数字描述所述。作为内部控制,两个基因,ARF1而且EF1在使用之前,使用NormFinder评估表达的稳定性[One hundred.]及BestKeeper [101].为了估计显著差异(在P< 0.05),除非特别注明,否则采用单向方差分析,然后采用Tukey 's HSD检验。
质体基因拷贝数的估计
为了提取DNA,使用FastPrep仪器(MP Biochemicals)遵循C-TAB方法,将收集的组织用玻璃微珠(Sigma Aldrich)在液氮中均质[102].10 μg RNase在37°C下处理45 min。使用ND-1000分光光度计(赛默飞世尔科学公司)对分离样品的浓度和纯度进行评估。以50 ng DNA为模板,使用LightCycler®480 SYBR Green I Master (Roche)在上述条件下,在LightCycler 480 (Roche)中进行两次技术重复,量化10 μl体积中的基因拷贝数。分析中使用的引物(附加文件1:表S2)采用Primer3设计[97].通过LinRegPCR得到Ct值和qPCR效率值[98]并用于计算。质体基因如前所述定量[18]与两个单拷贝核基因的关系:ARF1而且EF1(附加文件1:表S2)。定量的基因定位在质体基因组中,如下所示:psbA,matK,psbD,atpI,clpP,infA长单拷贝区(LSC);ndhB,16 s,ndhH在倒重复区(IR)和ndhF在短单拷贝区域(SSC,附加文件1:表S2)。位于IRs中的质体基因有两个副本。每个质体基因得到的值被用来计算平均质体拷贝数。为了估计显著差异(在P< 0.05),如图所示,采用单向方差分析(One Way Analysis of Variance),然后采用Tukey 's HSD检验或t-Student检验。
透射电子显微镜分析
使用Tecnai Sphera G2 (FEI公司)进行电子显微镜分析,如前所述[18].简单地说,将植物材料浸泡在50mm的碳酸钙缓冲液(pH值7.2)中,在RT下固定6小时,然后在碳酸钙缓冲液中洗涤,并在蒸馏水中洗涤两次。该缓冲剂含有0.5% (v/v)戊二醛和2.0% (v/v)甲醛。接下来,样品在1.0% (v/v)四氧化锇中RT固定1小时,在蒸馏水中洗涤两次,通过丙酮系列(20-100%)脱水,并用Spurr树脂(Sigma Aldrich)渗透,最初为33%,然后为66%,最后为100%。
分析在三个独立的生物重复中进行,每次重复至少100个细胞。根据常见的描述,质体的类型被识别为初始未分化的前质体,区分内膜少、基质密集的前质体、淀粉体、黄体和叶绿体。
数据和材料的可用性
在这项研究中产生或分析的所有数据都包括在这篇发表的文章及其补充信息文件中。在当前研究过程中产生的原始数据集可根据合理要求从通讯作者处获得。
缩写
- dC:
-
文化日
- ML:
-
中后期小孢子
- 棉结:
-
Nuclear-encoded聚合酶
- 动员:
-
Plastid-encoded聚合酶
- 下午:
-
预处理的小孢子
参考文献
- 1.
王晓明,王晓明。单倍体和双单倍体植物分离小孢子培养技术及其研究进展。植物细胞组织器官,2011;104:301-9。
- 2.
Dwivedi SL, Britt AB, Tripathi L, Sharma S, Upadhyaya HD, Ortiz R.单倍体:植物育种的限制和机会。生物技术,2015;33:812-29。
- 3.
Germana马。配子胚胎发生和单倍体技术是植物育种的宝贵支持。植物细胞学报2011;30:839-57。
- 4.
Honys D, Reňák D, Twell D.雄配子体发育与功能。植物科学。2006;1:209-24。
- 5.
Carrizo García C, Nepi M, Pacini E.这是一个时间问题:花粉发育期间的异步及其对被子植物花粉性能的影响-综述。原生质。2017;254:57 - 73。
- 6.
席尔瓦道明。小孢子胚胎发生。入:佐藤K-I,编辑。胚胎发生。InTech;2012.p . 573 - 596。
- 7.
Islam SMS, Tuteja N.主要作物品种的非生物胁迫和其他预处理增强雄激素发生。植物科学进展(英文版);
- 8.
王晓明,王晓明,王晓明,等。植物小孢子体外胚胎发生的胁迫重组研究。物理学报。2006;127:519-34。
- 9.
Holme IB, Olesen A, Hansen NJP, Andersen SB.西北和东欧小麦品种的花药和分离小孢子培养反应。植物育种1999;118:111-7。
- 10.
Lantos C, Páricsi S, Zofajova A, Weyen J, Pauk J.小麦小孢子分离培养(小麦L.)与匈牙利栽培品种。生物学报。2006;50:31-5。
- 11.
何涛,杨毅,涂素生,于明明,李小峰。籼稻花药培养种间杂交种的选择。植物细胞组织器官,2006;86:271-7。
- 12.
Marchand S, Fonquerne G, Clermont I, Laroche L, Huynh TT, Belzile FJ。大麦品种的雄激素反应与F1s镰刀菌素抗头疫病。植物细胞学报2008;27:43 - 51。
- 13.
冬、春大麦基因型的雄激素能力研究。植物品种。2015;134:668-74。
- 14.
兰涛斯,Bóna L,波达,波克在体外六倍体小黑麦(XTriticosecaleWittmack)的雄激素参数。Euphytica。2014;197:27-37。
- 15.
C。被子植物的花药质体。Bot Rev. 2001; 67:54-73。
- 16.
李志强,李志强,李志强。大麦小孢子胚胎发育过程中质体的差异发育。原生质。1999;208:248-56。
- 17.
大麦雄激素发生中的白化病。植物细胞,2014;33:385-92。
- 18.
Gajecka M, Marzec M, Chmielewska B, Jelonek J, Zbieszczyk J, Szarejko I.大麦小孢子培养中小配子体发生的质体分化决定绿色植株的再生。植物科学通报2020;291:110321。
- 19.
Day A, Ellis THN。谷物花药培养的白化植物中质体DNA的缺失形式。柯尔·热内,1985;9:671-8。
- 20.
Dunford R, Walden RM。白化大麦花药培养的质体基因组结构和质体相关转录本水平。柯尔·热内,1991;20:39 - 47。
- 21.
Mouritzen P, Holm PB。大麦小孢子培养中叶绿体基因组的破坏(大麦芽L.)主要发生在再生过程中。植物科学学报,1994;
- 22.
王晓明,王晓明,王晓明,等。小麦和小黑麦花药培养过程中叶绿体基因组结构的变化。谷物资源公社,2012;40:467-75。
- 23.
Day A, Ellis THN。与小麦花粉再生植株相关的叶绿体DNA缺失:叶绿体母系遗传的可能基础。细胞。1984;39:359 - 68。
- 24.
原田,佐藤,浅坂D,松川一。水稻花药培养中质体DNA的大规模缺失。应用理论。1991;81:157-61。
- 25.
白化水稻花药培养中异构质体基因组的研究。Euphytica。2002;123:67 - 74。https://doi.org/10.1023/A:1014493316433.
- 26.
李国强,李国强,李国强。寻找导致谷物白化植物形成的机制。植物学报。2005;27:651-64。
- 27.
陈晓文,Cistué L, Muñoz-Amatriaín M, Sanz M, Romagosa I, Castillo AM,等。大麦双单倍体反应的遗传标记。Euphytica。2007;158:287 - 94。
- 28.
Muñoz-Amatriaín M,卡斯蒂略AM,陈小文,Cistué L, Vallés MP。大麦绿株率qtl的鉴定与验证(大麦芽l)花药培养。Mol Breed. 2008; 22:119-29。
- 29.
Krzewska M, czyczyzo - mysza I, Dubas E, goekobowska - pikania G, Żur I.小黑麦白化植株形成相关qtl的鉴定及绿白比决定因素的一些新发现(×Triticosecale)另一种文化。Euphytica。2015;206:263 - 78。
- 30.
王志刚,王志刚,王志刚,等。叶绿体生物发生:质体发育、蛋白质导入、分裂与遗传的控制。阿拉伯B. 2008;6:e0110。
- 31.
李志刚,李志刚。叶绿体发生与发育的研究进展。生物化学学报。1847;2015:1017-24。
- 32.
质体基因组的结构、功能和遗传。进:博克·R,编辑。质体的细胞和分子生物学。施普林格,柏林:海德堡;2007.29 - 63页。
- 33.
中井M. TIC复合体的发现:蛋白质在叶绿体内膜转运的分子机制的另一种观点。中国生物工程学报(英文版)2015;
- 34.
李文杰,李志强,李志强,等。玉米叶绿体生物发生的遗传分析。中国生物工程学报(英文版),2015;
- 35.
Barajas-López JDD, Blanco NE, Strand Å。质体到细胞核的通讯,控制植物细胞运行的信号。生物化学学报。2013;1833:425-37。
- 36.
质粒与核的双向通讯:质粒蛋白输入和质粒到核的逆行信号。生物工程学报,2010;
- 37.
植物核编码蛋白对叶绿体的靶向作用。新植物,2008;179:257-85。
- 38.
Flores-Pérez Ú, Jarvis P. Molecular chaperone参与叶绿体蛋白导入。生物化学学报。2012;1833:332-40。
- 39.
Liebers M, Grübler B, Chevalier F, Lerbs-Mache S, Merendino L, Blanvillain R,等。质体转录的调控转移在植物发育过程中质体的形态转化中起着关键作用。植物科学,2017;8:23。
- 40.
叶木春,王志刚,王志刚,等。叶绿体基因表达与进化的研究进展。植物科学进展(英文版);
- 41.
Zhelyazkova P, Hammani K, Rojas M, Voelker R, Vargas-Suárez M, Börner T,等。蛋白质介导的保护是陆地植物叶绿体中定义加工后的mRNA末端的主要机制。核酸决议2012;40:3092-105。
- 42.
Börner T,阿列尼科娃AY,祖波YO,库什涅佐夫VV。叶绿体RNA聚合酶:在叶绿体生物发生中的作用。生物化学学报。1847;2015:761-9。
- 43.
Pfannschmidt T, Blanvillain R, Merendino L, Courtois F, Chevalier F, Liebers M,等。质体RNA聚合酶:在植物生命周期中,不同进化起源的酶的编排控制着叶绿体的生物发生。中国机械工程学报,2015;
- 44.
迟伟,何斌,毛娟,姜娟,张磊。质体sigma因子的个体功能及其在转录中的调控。中国生物工程学报,2015;
- 45.
Oh S, Montgomery BL.光敏色素诱导的SIG2表达有助于光敏色素信号通路和光形态建成的光调节。中国科学(d辑),2013;
- 46.
Schweer J, Türkeri H, Kolpack A, Link G.质体sigma因子在叶绿体转录中的作用和调控及其功能相互作用——来自拟南芥的最新经验。中国生物医学工程学报,2010;
- 47.
伍德森,朱志强,陈志强,陈志强,等。西格玛因子介导的质体逆行信号控制核基因表达。植物学报(英文版);
- 48.
Czarnecki O, Gläßer C,陈建国,KFX M,格林B. ALA合成在质体-核信号通路中的作用。植物学报,2012;3:1-19。
- 49.
Hanaoka M, Kanamaru K, Fujiwara M, Takahashi H, Tanaka K.谷氨酰胺- trna在叶绿体生物发生过程中介导RNA聚合酶使用的开关。EMBO代表2005;6:545-50。
- 50.
Kanamaru K, Nagashima A, Fujiwara M, Shimada H, Shirano Y, Nakabayashi K,等。拟南芥叶绿体编码tRNAs的sigma因子(SIG2)依赖表达。植物细胞物理学报,2001;42:1034-43。
- 51.
李丽丽,李伟河,李伟河,Börner T.植物线粒体和叶绿体的转录机制:组成、功能和调控。中国植物科学,2011;
- 52.
Tiller N, Weingartner M, Thiele W, Maximova E, Schöttler MA, Bock R.拟南芥质体特异性核糖体蛋白可分为非必需蛋白和真正的核糖体蛋白。植物学报,2012;
- 53.
蒂勒。N .质体的翻译装置及其在植物发育中的作用。植物学报。2014;7:1105-20。
- 54.
质质逆行信号——一个真正的“质质因子”还是仅仅是代谢物特征?植物科学进展,2010;15:427-35。
- 55.
小林Y,金崎Y,田中A,黑岩H,黑岩T,田中K.植物细胞从细胞器到细胞核DNA复制的细胞周期协调器的四吡体信号。自然科学进展(英文版);2009;
- 56.
贾维斯P, López-Juez E.叶绿体和其他质体的生物发生和稳态。中国生物医学杂志,2013;20:787-802。
- 57.
菲特DW,马丁DJ,科普利MJ,苏格兰RW,朗代尔JA。GLK基因对在不同的植物物种中调节叶绿体的发育。植物J. 2002; 31:13 - 27。
- 58.
Hernández-Verdeja T, Strand Å。逆行信号引导叶绿体发育的路径。植物学报。2018;176:967-76。
- 59.
质体对光信号传递和发育的影响。Philos Trans R Soc B. 2014;396:20130232。
- 60.
小林K,佐佐木D,野口K,藤沼D,小松H,小林M,等。过表达拟南芥根系叶绿体发生光合作用GOLDEN2-就像转录因子。中国生物医学工程学报,2013;
- 61.
中村H,村松M,博多M,上野O,长村Y,广千H,等。转录因子异位过表达OsGLK1诱导非绿色水稻细胞叶绿体发育。植物生理学报,2009;30(4):344 - 344。
- 62.
天然条件下的叶绿体和叶绿体形成:被子植物叶绿素生物合成的黑暗面。Photosynth Res. 2010; 105:143-66。
- 63.
Blomqvist LA, Ryberg M, Sundqvist C.对高纯度前层体的蛋白质组学分析揭示了它们在叶绿体发育中的意义。Photosynth Res. 2008; 96:37-50。
- 64.
Plöscher M, Reisinger V, Eichacker LA。黄成体和叶绿体蛋白质复合物的蛋白质组学比较。蛋白质组学杂志,2011;74:1256-65
- 65.
Solymosi K, Andersson MX。叶绿体及其在叶绿体生物发生中的意义。In: Biswal B, Krupinska K, Biswal UC,编辑。叶片在生长和衰老过程中的质体发育。多德雷赫特:施普林格;2013.39 - 71页。
- 66.
坂本伟,高明。叶绿体DNA动力学:拷贝数,质量控制和降解。植物细胞物理学报,2018;59:1120-7。
- 67.
芬斯特S, Eggert E, Zoschke R, Weihe A, Schmitz-Linneweber C.叶绿体编码RNA聚合酶与叶绿体DNA的光依赖性。植物学报2013;76:849-60
- 68.
文俊,朱磊,沈华,胡青。PIF1基因直接和间接调控叶绿素生物合成,优化拟南芥绿化过程。自然科学进展,2008;26(3):344 - 344。
- 69.
钟山,史涛,赵强,赵敏,安峰,史华,等。EIN3/EIL1与PIF1协同抑制光氧化,促进拟南芥幼苗变绿。自然科学进展(英文版);2009;
- 70.
Szarejko I.大麦花药培养产生双倍单倍体(大麦芽l .)。In: Maluszynski M, Kasha KJ, Forster BP, Szarejko I,编辑。作物单倍体产量加倍。多德雷赫特:Kluwer学术出版社;2003.35-42页。
- 71.
李海涛,李海涛,李海涛,等。离体小孢子培养在大麦绿色植株再生中的优势(大麦芽l .)。植物物理学报,2005;27(4 B): 611-9。
- 72.
在:中村Y,编辑。储备淀粉的生物合成。淀粉:施普林格东京;2015.p . 161 - 209。
- 73.
杨晓明,杨晓明,杨晓明,等。水稻胚乳淀粉体分裂的研究进展。植物生理学报。2009;50:1617-26。
- 74.
杜华,唐东,黄东。芋头茎尖分生组织中质体分裂的研究(芋耐).Sci Hortic(阿姆斯特丹)。2013; 150:22-4。
- 75.
Enami K, Tanaka K, Hanaoka M.逆行信号产生于质体内的相互串扰。植物学报。2012;7:142-4。
- 76.
Rowan BA, Oldenburg DJ, Bendich AJ。多种方法揭示了拟南芥在发育过程中叶绿体DNA数量的下降。植物学报。2009;9:3。
- 77.
Kumar RA, Oldenburg DJ, Bendich AJ。玉米发育过程中DNA损伤、分子完整性和质体DNA和线粒体DNA拷贝数的变化中国科学(d辑),2014;
- 78.
孙晓东,李小林,李小林,等。植物叶绿体光合作用基因转录调控的证据拟南芥的根源。植物物理学报。1997;14:623 - 30。
- 79.
Maréchal A, Brisson N.重组与植物细胞器基因组稳定性的维持。新植物学报,2010;186:299-317。
- 80.
Lepage E, Zampini E, Brisson N.拟南芥质体基因组不稳定导致活性氧产生和质体到核逆行信号。中国生物医学工程学报,2013;
- 81.
Rowan BA, Oldenburg DJ, Bendich AJ。RecA在拟南芥中维持叶绿体DNA分子的完整性。中国科学(d辑),2010;https://doi.org/10.1093/jxb/erq088.
- 82.
卡洪AB,哈里斯FM,斯特恩DB。对发育中的玉米质体的分析揭示了与RNA聚合酶类型相关的两个mRNA稳定性等级。EMBO代表2004;5:801-6。
- 83.
勒根J,肯普S,克劳斯K,普罗凡特B,赫尔曼RG,迈尔RM。烟草全质体染色体转录谱的比较分析归因于野生型和pep缺陷型转录机制。植物学报,2002;31:171-88。
- 84.
De Santis-Maciossek G, Kofer W, Bock A, Schoch S, Maier RM, Wanner G,等。质体RNA聚合酶基因的靶向破坏rpoAB和C1:分子生物学、生物化学和超微结构。植物学报1999;18:477-89。
- 85.
Hricová A, Quesada V, Micol JL。的SCABRA3核基因编码拟南芥叶绿体RpoTp RNA聚合酶,是拟南芥叶绿体生物发生和叶肉细胞增殖所必需的。植物物理学报。2006;41:942 - 56。
- 86.
高等植物质体西格玛因子的功能:调控基因表达还是仅仅保存转录?植物分子生物学杂志,2011;
- 87.
许玉珍,Arrieta-Montiel MP, Virdi KS, de Paula WBM, Widhalm JR, Basset GJ,等。Muts同源蛋白1是一种改变线粒体和质体性质以及植物对强光反应的类核蛋白。植物细胞。2011;23:3428-41。
- 88.
Maréchal A, Parent JS, Véronneau-Lafortune F, Joyeux A, Lang BF, Brisson N.旋涡蛋白维持拟南芥质体基因组稳定性。自然科学进展(英文版);2009;
- 89.
Courtois F, Merendino L, Demarsy E, Mache R, Lerbs-Mache S.噬菌体型RNA聚合酶RPOTmp转录rrn拟南芥早期发育阶段PC启动子中的操纵子。植物物理学报,2007;
- 90.
在豌豆lip1突变体中,核光合作用基因在黑暗和根部的表达需要质体翻译。植物学报。1999;11:901-10。
- 91.
Zubko M, Day A.谷物白化突变体稳定表型中核糖体缺陷质体中核编码质体RNA聚合酶转录基因的差异调控和DNA扩增。Mol Gen Genomics, 2002; 267:27-37。
- 92.
Emanuel C, Weihe A, Graner A, Hess W, Borner T.叶绿体发育影响大麦叶片噬菌体型RNA聚合酶的表达。植物J. 2004; 38:460-72。
- 93.
Hess WR, Prombona A, Fieder B, Subramanian AR, Börner T.叶绿体rps15和rpoB / C1和C2基因簇在核糖体缺陷质体中强烈转录:功能非叶绿体编码RNA聚合酶的证据。杨晓明,1993;12:563-71。
- 94.
Hess WR, Hoch B, Zeltz P, Hübschmann T, Kössel H, Börner Trpl2含核糖体缺陷质体的大麦突变体剪接。《植物细胞》1994;6:1455-65。
- 95.
Coronado MJ, Hensel G, Broeders S, Otto I, Kumlehn J.大麦未成熟花粉来源的双单倍体形成。黄金承诺作为转基因重组的工具。植物物理学报,2005;27(4 B): 591-9。
- 96.
金志强,李志强,李志强,李志强。大麦遗传转化研究(大麦芽l)通过雄激素花粉培养物感染根癌土壤杆菌.植物科学与技术,2006;4(1):61 - 61。
- 97.
张文杰,张文杰,张文杰,等。primer3 -新的功能和接口。核酸决议2012;40:1-12。
- 98.
rujter JM, Ramakers C, Hoogaars WMH, Karlen Y, Bakker O, van den Hoff MJB,等。扩增效率:在定量PCR数据分析中连接基线和偏倚。核酸研究,2009;37:e45。
- 99.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25:402-8。
- One hundred.
Andersen CL, Jensen JL, Ørntoft TF。表征缺氧区域的血管参数:人类前列腺癌模型的联合磁共振和光学成像研究。癌症法案2006;66:9929-36。
- 101.
王志强,王志强,王志强。稳定管家基因,差异调控靶基因和样本完整性的确定:BestKeeper -使用成对相关的基于excel的工具。生物技术,2004;26:509-15。
- 102.
道尔JJ,道尔JL。一种用于少量新鲜叶片组织的快速DNA分离程序。植物化学通报1987;19:11-5。
确认
不适用。
资金
这项工作得到了波兰农业和农村发展部的支持。贺南洪hn - 801/11/14 - po - 0114 - 003)。资助者没有参与研究的设计、数据的收集、分析和解释,也没有参与手稿的撰写。
作者信息
从属关系
贡献
是构思书房;IS和MG设计了实验并分析了数据;MG进行基因表达和质体拷贝数实验;MM进行细胞学和超微结构研究;MG、BC、JJ、JZ处理离体小孢子培养;MG起草了手稿;MM对写作有贡献;IS计划并最终定稿。所有作者都阅读并批准了手稿。
作者的信息
波兰卡托维兹西里西亚大学自然科学学院生物、生物技术和环境保护研究所。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
cvs离体小孢子培养中质体翻译相关基因的表达谱。“泽西”和“梅尔卡达”。图S2。的相对表达谱DPD1镁基因编码2 +-依赖细胞器外切酶在cvs小孢子发育过程中。“泽西”和“梅尔卡达”。图S3。雄激素植株再生过程中质体DNA含量。“泽西”和“梅尔卡达”。图S4。cvs植株再生过程中叶绿体分化相关基因的表达谱。“泽西”和“梅尔卡达”。图S5。在cvs的46dC转化胚胎中观察到的质体。“泽西”和“梅尔卡达”。图S6。研究了白化再生植株质体发生、叶绿体分化和光合作用相关基因的相对表达量。“Mercada”与cv白化再生剂的比较。“泽”。图S7。在雄激素植物胚形成和再生过程中对质体生物发生重要的基因的正常表达水平。表S1。用于RT-qPCR分析的基因和引物列表。表S2。分离小孢子培养所用培养基的组成。表S3。使用qPCR评估质体DNA拷贝数的基因、基因组定位和引物列表。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Gajecka, M., Marzec, M., Chmielewska, B.。et al。质体生物发生的变化导致大麦小孢子培养中白化再生体的形成。BMC植物生物学21日,22(2021)。https://doi.org/10.1186/s12870-020-02755-z
收到了:
接受:
发表:
关键字
- 白化病
- 雄性单性生殖
- 叶绿体分化
- 迄今己翻了一倍
- 大麦芽
- 分离小孢子培养
- 小孢子胚胎发生
- 质体生源论
- 质体基因组