抽象的
背景
豆类包含重要的作物,提供了主要的农艺效益,包括用根茎建立共生的能力,固定大气n2.已经证明豆科植物对硼(B)胁迫特别敏感,这导致了重要的产量损失。硼(B)在植物中缺乏或毒性会导致生长抑制和发育改变。在这种情况下,需要两个不同的蛋白家族(主要的内在蛋白家族MIP和硼转运蛋白家族BOR)的参与,以最大限度地减少B胁迫带来的不利影响。然而,在豆科植物中,对B的吸收和分配的运输机制知之甚少,特别是在缺乏B的情况下。
结果
一种Medicago Truncatula.蛋白质,MTNIP5; 1(MEDTR1G097840)(与之同源拟南芥atnip5; 1)被鉴定为缺乏缺乏的B嗜含量的新型豆科植物B型传送器。进一步的分析显示了这一点M. Truncatula.Aquaporin表达在根中被硼调节,在缺乏症下诱导并在毒性下抑制。它定位在根表皮细胞和结节的血浆膜上,其中B在共生中起枢转作用。此外,部分互补nip5; 1-1 A. ThalianaB缺乏症下的突变表型支持MTNIP5的功能作用; 1作为该豆科模型植物中的B输送器。
结论
这里的结果介绍了MTNIP5的功能作用; 1在B缺乏的吸收中,并为豆类物种的B传输机制提供了新的见解。
背景
硼(B)是植物必需的微量营养素,因为它在植物细胞壁中起着结构作用,交联两种果胶多糖鼠李胶半乳糖醛酸- ii [1那2].当B浓度低于最佳时,B缺乏症状出现并包括抑制根伸长率和降低的叶片膨胀和生育能力,这导致了世界各地的大量农业损失[3.那4.那5.].
在土壤中,B主要以不带电硼酸[B (OH)]的形式存在。3.](在25°C时Ka = 5.80x10-10(pka = 9.24))[6.].在最佳浓度下,B通过被动扩散进入植物。然而,在缺乏B的情况下,B是通过两个蛋白质家族的蛋白质协同作用进入植物体内的:主要的内在蛋白家族MIP和硼转运蛋白家族BOR [7.那8.那9.那10.].MIPs是水通道蛋白的一个超家族,由几个亚家族组成,包括结节蛋白26样固有蛋白(NIPs) [11.],这是一种小溶质的可渗透通道,包括[b(oh)3.] [12.那13.那14.那15.那16.].
在植物中,最佳表征的辊蛋白描述为B促进剂转运蛋白是拟南芥(L.)Heynh。nip5; 1,(atnip5; 1),透水到水,尿素和[b(oh)3.] [17.].atnip5; 1发现在根的表皮细胞中,其转录物在低B条件下调节上调,增加B渗透率并最大化来自B缺陷的土壤的B吸收[15.].
另一方面,Bor蛋白质构成了一家硼酸和硼酸硼出口商,其中七名成员A. Thaliana.(Atbor1-7)[18.那19.].Atbor1在低B条件下积聚在根螺旋中,并负责[B(OH)的木质荷荷载荷3.],允许B分布到植物的其余部分[7.那18.].已经证明,AtNIPs和AtBORs的协调行动是必要的,以确保工厂内适当的B分布,特别是在低B条件下,这是适当的植物成长及发展[20.].
农艺兴趣的各种作物属于豆科家族(豆科植物要么Fabaceae.),如苜蓿,豌豆或大豆[17.那21.].这些植物物种有能力与n相互作用2-固定根瘤菌,引发根瘤形成,在根瘤处进行生物固氮[22.那23.那24.].从这个意义上说,发展更有效的固氮协会是非常重要的,因为过度使用化肥带来了污染问题[25.那26.].这需要更好地理解影响共生过程成功的因素,包括营养运输[27.那28.那29.].符合这一点,已经表明,建立豆科植物 - 无论symbiase的每一步都受到B缺乏的严重影响[30.那31.那32.那33.那34.那35.].然而,B传输几乎没有于豆类和MIP蛋白质超家族似乎留下推定的B Transporter候选人。在模型豆类中Medicago Truncatula.Gaertn,这个超家族包括46个MIPs,其中18个属于NIP家族[36.].但是,到目前为止,只有一个B托管器(NIP蛋白)已经表征了[37.,在B缺乏的条件下,没有一个与B的转运有关。
在本研究中,我们使用候选基因方法结合表型分析和异源互补分析来鉴定MtNIP5;1作为一种新的B型转运体M. Truncatula.,对atnip5的同源物,1,在低硼条件下的功能。这里提出的结果将允许在豆科植物中获得关于B营养的进一步了解。
结果
硼应激会导致发育和生长缺陷M. Truncatula.
为了学习M. Truncatula.反应B可用性,进行增长测定,施加B梯度。分析了植物表型和氮酶活性(用于在共生条件下生长的植物)。
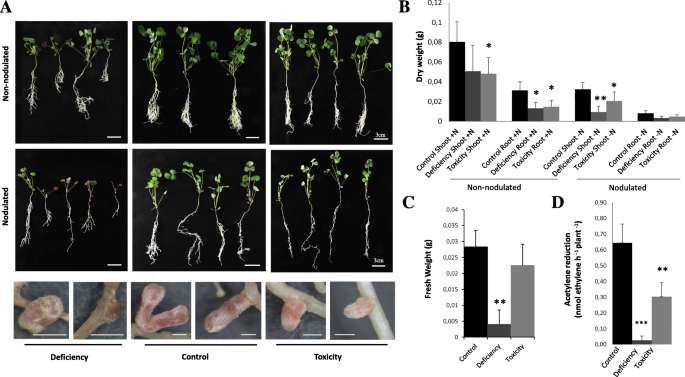
B缺乏症的植物显示氯鱼阳和叶片膨胀和根生长的抑制作用。通常,这些症状在结节植物中比在用n受精的植物中更明显(图。1).与在控制条件下生长的植物相比,这些植物中出现的结核更少、更小。1).另一方面,在B毒性下生长的植物在共生和非共生条件下表现出相当的生长抑制作用。通常,在B毒性下生长的植物结节呈现出类似的尺寸以控制结节,尽管大量的结节出现较小尺寸。生物量数据支持大多数这些观察结果(图。1a - c)。在缺B条件下,施氮和结瘤植物的根系生物量均减少(约60%)。1b)。缺b也会导致根瘤生物量减少(图2)。1C)。在B毒性下,在共生和非共生条件下,植物在芽和根生物量下降(图。1b)。尽管如此,结节在高B水平下没有显示出改变的生物质(图。1C)。
硼应力对抑制效果M. Truncatula.生长和氮酶活性。一种的照片还是M. Truncatula.图中显示了在B级梯度下生长的植物。上面板(图像的上排)显示了在B缺乏(培养基中不添加B)和对照(培养基中最终B浓度为0.1 mM B [OH])条件下生长的施氮植株(无结节植株)3.)或B毒性条件(1 mM B [OH3.])。中间的图像显示在共生条件下生长的植物(M. Truncatula.植物接种S. Meliloti.2011).下面的一排图片显示了在不同B条件下生长的植物的结节,如底部标签所示。条形= 3cm(植物图片)或1mm(根瘤图片)。B.植物生物质作为在B梯度下的根部根系的干重和枝条的非染色或染色植物。C在B梯度下结节新鲜重量。数据是两个独立实验的平均值±SD,至少有四个生物学重复(N= 4)。D.在B梯度下生长的4周龄植物中测定氮酶活性。在对照,B缺乏症或B毒性条件下生长的植物用于评估不同B条件下的氮酶活性变化。通过乙炔还原方法(每株植物每小时产生的Nmol乙烯)分析氮酶活性。使用单向分析(ANOVA)的单向分析进行分析数据,然后进行T-Custoring因果测试。星号表示与B对照处理的B应激样品进行比较时表示显着差异(T.- 学生,(“*”= p < 0.05,“**”= p < 0.01,, “***” = p < 0.001)
测定了固氮酶活性,并在每个植株上表达(图。1d)或相对于结节数量或重量(附加文件)2),给予所有类似的结果。B缺乏和B毒性生长植物的结节显示出氮酶活性显着降低。这些结果与在B缺乏症下观察到的结节缺陷一致(图。1一种)。有趣的是,即使在结节生物质的B毒性下没有观察到显着差异,在这些条件下会严重影响N固定。
AtNIP5;1同源物的鉴定M. Truncatula.
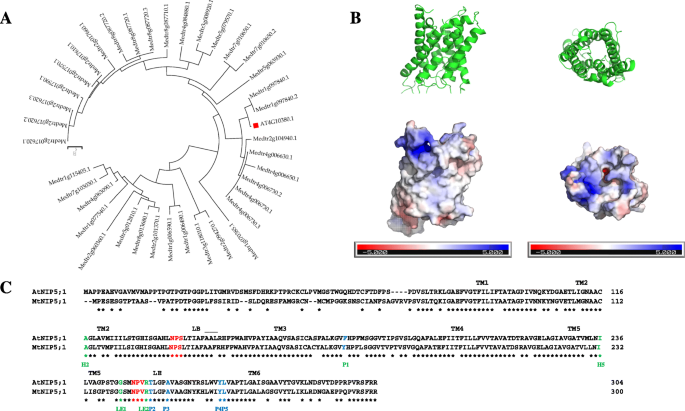
这A. Thaliana nip5; 1,编码一种属于MIP超家族的水通道蛋白,是第一个在植物中发现的涉及硼运输的水通道蛋白[15.].编码蛋白ATNIP5的序列比较; 1(AT2G47160),显示MEDTR1G097840(命名为MTNIP5; 1)是最接近的同源物A. Thaliana.B托运器M. Truncatula.,同源性为73.7%(图。2一种)。
M. Truncatula.mtnip5; 1是最接近的同源蛋白质A. Thaliana.atnip5; 1,在缺乏缺乏的A水素。一种的无根系统发生树M. Truncatula.使用MEGA7软件获得与ATNIP5; 1(由红平方表示的)的同源物。绘制树使得分支长度分离任何两个序列与进化距离成比例。B.MTNIP5; 1蛋白预测模型。面板B内的上面板表示MTNIP5的三级结构模型; 1表示表示NPS / NPV主题的黄色区域。正(蓝色)和负(红色)电荷的分布如下所示。展示了孔的外部带有带正电的残留物的位置,离开内部的负电荷。CAtNIP5;1和MtNIP5;1蛋白序列比对。灰色阴影显示的是6个跨膜螺旋,黄色标记的是形成第7个螺旋的区域。NPA基序显示为红色,Ar/R选择性过滤器的残基显示为绿色,而构成Froger位置的五个氨基酸显示为蓝色
旨在进一步表征MTNIP5; 1蛋白,如方法部分中所述进行3D蛋白质结构预测。预测的三级结构表明,编码蛋白质将是透氧蛋白质,呈现六个膜跨越螺旋,通过环路连接,并通过保守的NPS / NPV基序连接的两个短螺旋,一起形成第七跨膜螺旋(图。2b)。这七螺旋的分布将构成孔隙,是水蛋白蛋白的特征[38.].此外,蛋白质的电荷分布表明,正电荷残基位于孔的外部,负电荷残基位于孔的内部(图3)。2b)。另一方面,MTNIP5的氨基酸序列与其最近的同源物之间的比较A. Thaliana.结果显示,它们共享双npa基序(NPS/NPV)和Ar/R选择性过滤器(A-I-G-R)序列,以及属于P1-P5 Froger位点的5个氨基酸中的4个(P2-P5) (AtNIP5;1和MtNIP5;1分别为Y/F-T-A-Y-L)(图1)。2c).这支持了这两种蛋白质在穿过质膜运输硼酸方面的共同作用[36.那39.那40]..
MTNIP5; 1表达在B缺乏下诱导
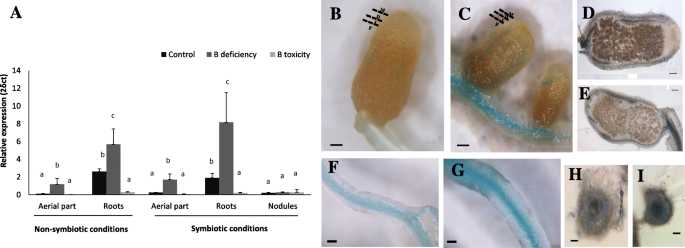
QPCR测定在三种不同的组织(根,结节和编号和非染色植物的根部部位)中进行,以便评估表达模式的可能变化mtnip5; 1在B梯度下。mtnip5; 1B缺乏症诱导了芽和根的表达,但后者的诱导更为明显。此外,与对照相比,B毒处理对根中表达有抑制作用。与茎和根相比,结核的转录水平较低,诱导在三种B条件下没有显著变化(图2)。3.一种)。基于Symbimics数据库的Silico分析[41.] 或者Medicago Truncatula.基因表达阿特拉斯([42.] ID MTR.34598.1.S1_AT)支持这些结果,与其他植物器官(包括结节或射击/空中部位)相比,在根中表达得多的表达更高(附加文件3.).
mtnip5; 1在B缺乏的情况下诱导表达。一种通过QPCR在植物的根部,芽和Noot植物的结节中量化mRNA积聚或在共生条件下生长。植物在由以下处理组成的B梯度下成长:控制条件(0.1mm B [OH3.),缺乏(0 mM B [OH3.])或B毒性(1 mm b [哦3.])。数据是两个独立实验的平均值±SD,至少四个合并植物和四个生物重复(n =4)。不同的字母表示显着差异(单向ANOVA,然后是TUKEY测试,p < 0.05).mtnip5; 1表达作为表达相对值呈现给内基因泛素羧基端水解酶1.双组织表达本地化PMTNIP5; 1 :: GUS出现在脉管系统,并在B缺乏症下诱导。蓝色GUS染色分析PMTNIP5; 1 :: GUS出现在血管系统的(是):结节和(外):根。B.那D.那f,和H显示B控制处理(0.1 mM B [OH3.), (C那E.那克,和我):B缺乏治疗。M:融合区,D:差分区,I:interzone F:n2固定区域。Bar = 0.5 cm
此外,通过融合β-葡糖醛酸酶基因来评估该基因的组织表达(格斯)到了mtnip5; 1启动子。M. Truncatula.用含有含有2kb区域的构建体转化幼苗mtnip5; 1融合,格斯.接种4周后,在对照和b缺陷植株的根和根瘤中检测到蓝色GUS染色(图。3.b)。如QPCR所示,mtnip5; 1在根中高度表达,特别是在B缺乏症下。更具体地,活动位于根脉管系统处。结节还呈现出位于脉管系统区域的GUS活动,B缺乏更强烈的信号(图。3.b)。
MtNIP5;1定位于根表皮的质膜以及结节的表皮细胞和皮层细胞
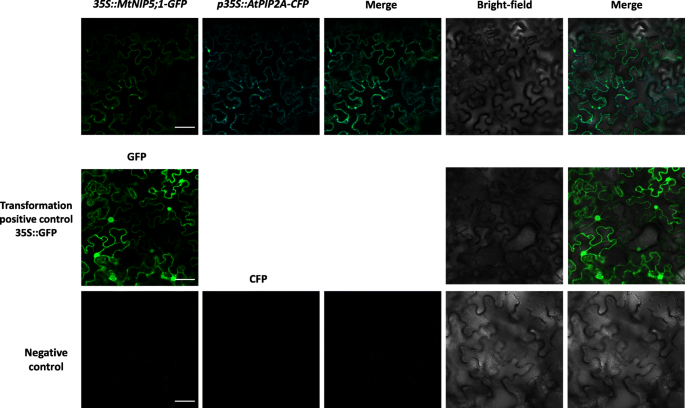
瞬态转换烟草benthamiana旨在分析MTNIP5的亚细胞位置的小伙叶; 1。农杆菌肿瘤术包含p35S::MtNIP5;1-绿色荧光蛋白(GFP)要么p35S:: atpip2a -青色荧光蛋白(CFP)如方法部分所述,共同渗透构建体。在MTNIP5之间观察到重叠信号; 1与GFP荧光团和质膜标记融合,表明MTNIP5; 1位于质膜处(图。4.).没有使用荧光团的对照组,在测量的通道中没有显示信号(图。4.).
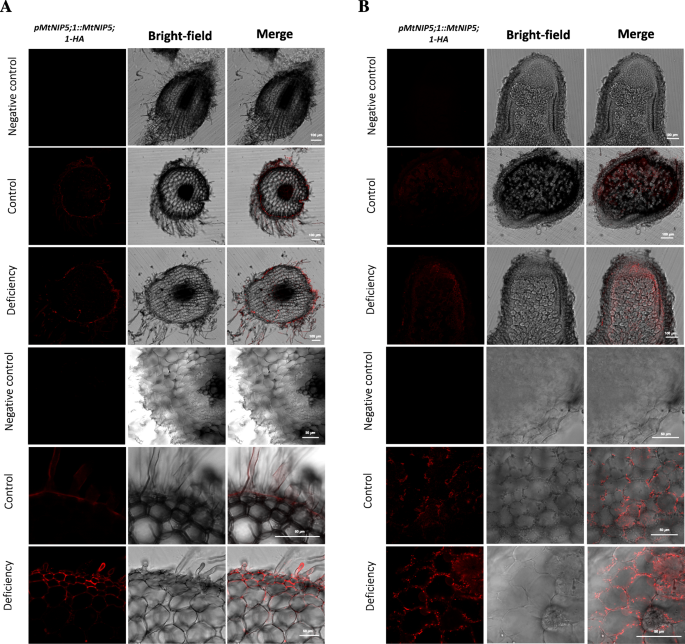
嵌合MTNIP5; 1-HA蛋白用于免疫组化研究。M. Truncatula.用基因组区域转化植物mtnip5; 1使用与用于GUS活性分析的相同的启动子区域,用三个血凝素(HA)表位与三个血凝素(HA)表位融合。用小鼠抗HA抗体和alexa594缀合的抗小鼠二抗检测(DSRED通道)(DSRED通道)。图像在根的表皮细胞(包括根毛)的表皮细胞处显示蛋白质定位(图。5.a)在两种情况下B(尽管在不足的情况下略高)。此外,在结节中,与根表皮相比,信号减弱,并出现在一些感染和未感染的结节细胞、结节皮层和脉管系统周围(图2)。5.b).有趣的是,MtNIP5;1-HA的信号分布与GUS染色检测中观察到的组织特异性表达不一致,强烈的信号只出现在根和结节的脉管系统(图)。3.).未使用Alexa 594标记抗体的对照组在测量通道中没有显示信号(图)。5.).
MtNIP5;1在根表皮和根瘤中的免疫定位Medicago Truncatula。一种通过免疫染色MTNIP5的亚细胞定位; 1-HA与抗体alexa 594的根部进行4周M. Truncatula.表达P35S :: MTNIP5; 1-HA(红色,DSRED信道)在不同的B条件下(控制和缺陷)。三个底部行显示了显示MTNIP5; 1-HA定位的根表皮和毛发根细胞的细节。B.通过免疫染色的MTNIP5的亚细胞定位; 1-HA与抗体Alexa 594进行4周龄的结节部分进行M. Truncatula.表达P35S :: MTNIP5; 1-HA(红色,DsRed通道),接种aSinorhizobium meliloti2011年菌株在不同B条件下生长(对照,中间行,缺素,底部行)。上面三排图像为10倍放大,下面三排图像为40倍放大下结节皮质和固定区细节,显示MtNIP5;1-HA定位。左列为HA信号,中列为亮场图像,右列为HA信号与亮场合并图像。在每个面板的上排显示自身荧光对照,其中不使用抗ha一抗。柱= 100 μm (10X图像)或50 μm (40X图像)
nip5的部分互补; 1A. Thaliana.突变体支持MTNIP5的作用; 1作为B运输车
目的是在功能上描述这个假定的B转运体,一个异体表达系统A. Thaliana.被使用了。就这样A. Thilala NIP5; 1-1突变体(15.)被转化为P35S :: MTNIP5; 1-GFP构建和两个独立的纯合单拷贝线(p35区域:MtNIP5; 1-GFP1和P35S :: MTNIP5; 1-GFP2)。这些系列用于测试MTNIP5; 1对吸收B的能力,从而补充突变表型。wt,nip5; 1-1和nip5; 1-1突变线过表达mtnip5; 1在两个B条件下生长,控制(100μmb[哦]3.)和缺乏(0.03μmb [哦]3.).
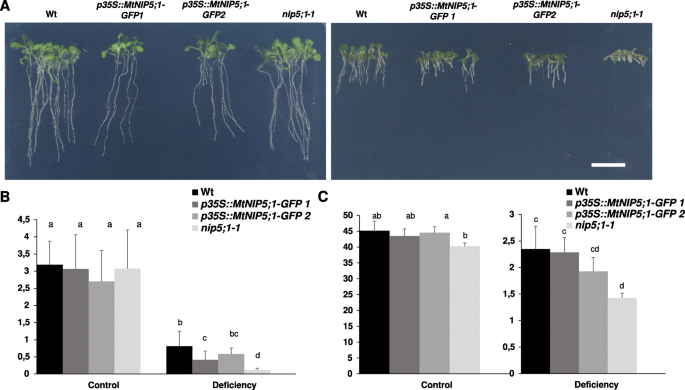
进行表型分析,以便评估B减少B可用性在根生长中减少的影响(附加文件4.).这些对原发性根长的影响在一次后3天内已经明显了nip5; 1-1与WT和过表达的两个突变线相比,根部开始显着降低mtnip5; 1.事实上,在实验结束时(萌发后10天),两个突变株都过表达mtnip5; 1在B缺陷条件下生长的突变体主根长度增加了两倍,证实了突变体通过过表达的部分互补mtnip5; 1(图。6.a和b)。
MTNIP5; 1部分补充nip5; 1-1B缺陷表型.一种幼苗的图像(野生型(WT),两个独立nip5; 1突变体线条表达P35S :: MTNIP5; 1-GFP(P35S :: MTNIP5; 1-GFP1和P35S :: MTNIP5; 1-GFP2),和nip5; 1-1)在受控条件下生长(左图)或B缺陷条件下生长(右图)。条形= 1厘米。B.WT(黑色列)的主要根长度,P35S :: MTNIP5; 1-GFP1(深灰色柱),P35S :: MTNIP5; 1-GFP2(浅灰色列),以及nip5; 1-1(白柱)测量10天后一次。CB浓度在10天大(黑色)中量化,P35S :: MTNIP5; 1-GFP1(深灰色),p35s :: mtnip5; 1-gfp2(浅灰色)nip5; 1-1(白色)在B控制和B缺乏条件下生长的幼苗。两种B处理分别为:对照(100 μM B [OH3.(0.03 μM B [OH .])3.])。不同的字母表示使用单向ANOVA分析,然后是Tukey的测试(p < 0.05)
此外,为了评价MtNIP5;1对B的吸收能力,并确定过表达系中观察到的生长挽救是否与B的增加有关,在对照和B缺乏的条件下,测定了10日龄幼苗的微量元素浓度。如图所示。6.C,两者A. Thilala MTNIP5; 1表达线条(P35S :: MTNIP5; 1-GFP1和P35S :: MTNIP5; 1-GFP2) B浓度显著增加,恢复到Wt水平。相反,钙(Ca)浓度在B缺乏的品系之间没有差异,但在对照条件下,两个过表达品系的钙(Ca)浓度都有所下降5.).
讨论
在粮食安全,可持续农业和气候变化的背景下,低估B传输和豆类的压力耐受性的利益,特别是在共生条件下,旨在尽量减少这种营养应激对产量的影响[43.那44.].因此,通过使用模型豆科植物的工作M. Truncatula.旨在进一步了解豆类的B传输,考虑到在这一农艺学重要的植物家庭的日期,在缺乏缺乏条件下没有参与B运输的B运输传输。
与由BOR家族组成的依赖能量的高亲和力B转运系统一起,MIP家族的不同成员在植物中具有转运(因此,分配)B的作用[15.那45.].这A. Thaliana.nip5; 1是第一个介于从土壤的吸收到根部的含量的第一个Aquaporin。atnip5; 1与Atbor1(较早鉴定并表征鉴定和特征)协调,以确保在缺乏条件下的摄取和正确分布B [15.那20.].在此基础上,同源性分析的使用已经允许在不同的植物物种(包括水稻、大麦或M. Truncatula.).然而,大多数在功能上与高于高B的容差增加(即MTNIP3,[22.])。
许多不同的MIP系列成员,包括那些属于调色剂膜的内在蛋白(尖端)亚家族(如AGIP5; 1 [46.)或质膜固有蛋白(PIP)亚家族(如大麦Hv-PIP1;3和Hv-PIP1 [12.],玉米zmpip1 [47.或rice OsPIP2;4, OsPIP2;7, OsPIP1;3和OsPIP2;6成员[48.]),已被发现参与植物中的B的运输。将MTNIP3鉴定为atnip6的同源蛋白质; 1(共用75%的氨基酸序列相似性)M. Truncatula.,相对于饲料豆科植物苜蓿的密切密集,广泛用作遗传和基因组研究的模型植物[49.].MTNIP3生理作用与赋予高B耐受性有关,因为它显示出B耐植物的较高叶片表达水平,其在叶片中具有较低的B浓度正相关[22.].
在本研究中,我们搜索Atnip5; 1在的同源物M. Truncatula.旨在鉴定在B缺乏情况下参与B转运的推定B转运体。通过氨基酸序列相似性分析,发现MtNIP5;1蛋白是最有可能发挥AtNIP5;1功能的候选蛋白(氨基酸同源性为73.7%,图。2一种)。此蛋白质先前指向达到达尼普5的推定的B转运蛋白同源物; 1通过Bogacki等。[22.虽然没有进行进一步的分析来证明它的功能作用,因为这项工作集中在研究另一个的作用M. Truncatula.NIP蛋白,MTNIP3(MEDTR4G006730.1),其作为B毒性下的B托管器。此以前的工作与此处呈现的结果,支持粘液蛋白在B传输中的不同作用,参与毒性和缺陷响应[14.那15.].我们的结果表明,B缺乏症诱导mtnip5; 1主要在根中表达,但也在茎中表达。3.a).此外,B毒性可以特异性抑制该基因在根中的表达,这可能支持这一作用M. Truncatula.此外,这一结果还提出了一些有趣的问题atnip5; 1B条件的表达调节。值得注意的是,如在atnip5; 1,5'未翻译区域(5'UTR)mtnip5; 1(附加文件6.),可能在控制应答B条件的转录本积累中起关键作用[50.].
进一步分析,预测了MtNIP5;1的三维结构。由此分析,根据预测的结构推断,MtNIP5;1与AtNIP5;1一样是跨膜蛋白。它呈现了水通道蛋白之间保守的特征结构(7个螺旋,中性电荷分布)([51.], 图。2b)。atnip5; 1先前被描述为位于血浆膜中的跨膜蛋白[17.].此外,在MTNIP5中存在NPA双基序(在这种情况下的NPS / NPV); 1也是水蛋白中的保守特征,其功能是在溶质通过通道时便于质子的出口[52.].此外,水通道蛋白的选择性过滤器似乎是由存在于NPA双基序中的氨基酸、Ar/R选择性过滤器组成以及5个Froger位置(P1-P5)决定的[40那53.].在T.HE.C一种se of the five amino acids located at the Froger’s positions, they may not only be involved in the discrimination between water and glycerol (distinguishing aquaporins from aquaglyceroporins), but also P2-P5 amino acids (and not P1, that is shown not conserved among MIPs for the same substrate) could be relevant discriminating other substrates due to their potential interaction with them [40].因此,在MtNIP5;1和AtNIP5;2C)提供进一步的证据来支持非水基质的可对比性,如硼酸[36.那40].
在A. Thaliana.,atnip5; 1在根表皮细胞的血浆膜中定位,其作为硼酸通道负责B在B有限条件下的B型吸收[15.那17.].在这里,蛋白质定位显示出类似的模式。MtNIP5;1定位于质膜(图。4.)和根表皮细胞(图。5.),这与确保B融合的促进蛋白的作用非常吻合。然而,当比较GUS表达模式和蛋白质定位分析时,我们得到了一个有趣的结果,因为它们的表达和定位模式存在差异(图)。3.和5.).应进行进一步分析以研究这些结果,这些结果类似于ATNIP1; 1,ATNIP5; 1同源蛋白,可能表明这些水蛋白酶的细胞类型特异性后术治疗,包括mtnip5; 1[54.].
有趣的是,表达mtnip5; 1在Cailiflower马赛克病毒35s的控制下,RNA(CAMV 35s)启动子互补部分根生长缺陷nip5; 1-1在B缺乏症(0.03μmb[OH3])(图。6.),这种部分表型救援与过表达线中的较高B含量良好相关(图。6.一方面,这些结果表明mtnip5; 1-GFP是实用的在Planta.而另一,那个mtnip5; 1与ATNIP5共享功能性相似性; 1。因此,MTNIP5; 1是第一个在豆类缺乏症下作用的第一个表征B缺陷。在这方面,几份报告显示了对B的共生依赖性[31.那33.那34.那35.那55.].在这里,当植物受到缺乏时,在结节的植物中观察到特征B应激反应,其组成的低结节数,其尺寸和呈褐色且褐色酶活性降低(图。1).这支持B在氮固定中的作用(图。1d) (30.那34.那35.].事实上,首先假设MTNIP5; 1可以在将B缺乏缺乏的结节中发挥独特作用。然而,尽管观察到MTNIP5; 1定位于该器官(图。5.b),缺乏诱导表达下的缺陷(图。3.a)不支持该转运蛋白在结节缺乏的缺陷下的缺陷中的独特作用。尽管如此,在结节中的B限制条件下,它仍然无法排除该Aquapaporin的辅助作用。
结论
总体而言,这里的研究表演旨在表征推定的B传输车M. Truncatula.属于水素咬合亚家族,在B缺乏作用。基于同源性的分析指向MTNIP5; 1作为最有前途的候选者用作atnip5; 1在这个豆科植物模型植物中。B缺乏症的诱导表达和B毒水平下的抑制,以及该蛋白质定位模式和部分互补nip5; 1突变体,支持MTNIP5的作用; 1在B缺乏下作为B障碍的功能。这些结果可能有助于更好地理解豆类的B传输,有助于培养更好地适应B缺陷的土壤的耐受品种。符合这一点,如果豆类耐受品种存在更高的表达,则进一步调查这将是有趣的mtnip5; 1(或同源候选蛋白),就像在M. Truncatula.或大麦,其中将其与基因功能相关的耐受性。
方法
植物生长条件
种子M. Truncatula.从贵族研究所获得的生态型R108被含硫酸(H.2所以4.),用漂白剂消毒,然后在0.8%的琼脂板中发芽,并按照Tejada-Jiménez等人的步骤置于4°C黑暗中48小时[56.].分层后,将培养皿移至22℃培养室培养24 h, 16 h:8 h光照:暗循环。将用于表型或RT-qPCR分析的幼苗转移到以珍珠岩为基质的盆栽中,在光照周期较长的温室中生长(18-25°C下16 h:8 h光照:暗周期)。温室植物每2天用詹纳溶液或水灌溉一次,57.].Jenner的溶液与B补充(分别达到控制或B缺乏条件)和N(以达到非共生或共生条件)。
N. Benthamiana.从González-Guerrero博士的实验室(CBGP-UPM/INIA,西班牙)获得的植物,在20-22°C的泥炭中预发芽10-15天,光周期16:8小时。然后移栽于泥炭蛭石3:1,在18-25℃、长日光周期的温室中培养3-4周。
A. Thaliana.生态型Col-0和nip5; 1-1突变种子[58.],首先在70%的乙醇中消毒,然后在50%的漂白剂中滴上Tween-20。用H2O.D., 4°C避光过夜,然后在半强度MS培养基培养皿中发芽[59.].对于分离实验,移植幼苗以泥炭:珍珠岩3:1,并在23℃下在长期的光周期中生长。
表型分析
为了研究B可用性对植物生长,接种和非接种的影响M. Truncatula.用不同浓度的B [OH]灌溉植物3..用0.1mm B灌溉控制处理的植物[OH]3.,通过用最终B的灌溉植物实现毒性条件[OH]3.浓度为1 mM,无B [OH]3.用于缺乏缺陷条件。所有灌溉介质均用Amberlite®IA743进行处理,以消除B痕迹。
在共生条件下生长的植物被接种Sinorhizobium melilotiFSM-MA应变(60.],而没有任何外部输入N(−N)。未接种的植物添加20 mM的nhh4.没有3.(+ n)。
在移植后5周(接种后4周)收集植物组织,用于生物质测量,氮酶活性和RT-QPCR测定。
生物量作为鲜重是在植物收获后立即测定的。在60°C下干燥72 h后测定生物量(干重)。
如Hardy等人所述,用乙炔还原法测定固氮酶活性[61.].简单地说,结节状植物的根被放置在30ml的小瓶中,其中3ml的空气被3ml的乙炔取代。30分钟后,提取4个重复,每次0.5 ml,用岛津GC-2014(日本)气相色谱仪测定乙烯含量。乙烯和乙炔的稀释量为0.413 mg/l。最后,对结节进行计数和称重。
候选基因的识别
识别atnip5; 1推测为编码B促进转运体的同源基因M. Truncatula.,atnip5; 1(AT4G10380)从TAIR数据库获得序列[62.]和爆炸在M. Truncatula.基因组使用Phytozome数据库[63.].
RT-QPCR的基因表达分析
通过实时RT-PCR(AppliedBiosystems®)进行基因表达研究,以分析候选基因的转录物水平。使用Rneasy Mini试剂盒(QIAGEN)进行RNA提取。使用primescript™(Takara Bio Inc.,日本)从500 ng的无DNA RNA获得cDNA。使用的引物在附加文件中指示1.通过使用的RNA水平归一化泛素羧基末端水解酶基因作为内部标准M. Truncatula.表达模式(64.].
M. Truncatula.转型
这根出杆菌根草杆菌利用含有该载体的ARqua1菌株进行转化M. Truncatula.在22℃下在生长室中发芽后18小时幼苗。通过Boisson-Dernier等人描述的协议进行转化实验。[65.].将转化的幼苗后来转移到法哈里斯培养基板,补充有卡那霉素(50μg/ ml)作为选择标记[66.].3周后,将植物移植到温室的无菌珍珠岩盆中,在18-25℃和长日光周期中置于温室中。
GUS染色
这mtnip5; 1启动子::β-葡萄糖醛酸酶(GUS)构建使用Gateway系统(Life Technologies, Carlsbad, USA)生成。候选基因的启动子片段(上游2022 kb)mtnip5; 1开始密码子,p-1174 UT848.)使用附加文件中指示的引物进行扩增1,在pDONOR27载体(Invitrogen)中克隆,转移到pGWB3质粒[67.].
在vernoud等人描述的协议后,在接种后4周在植物中进行Gus活性测定。[68.]微小修改。将根和结节部分(100μm)在GUS缓冲液中孵育(0.69%PO4.H2Na,0.5M EDTA pH8,30%甲糖基,40μlTritonX-100和H.2O),加入X-Gluc (0.1 mg/ml),在28°C黑暗中浸泡12-16小时,然后用50%漂白剂漂白,h漂洗5次2O.之后,用Leica DM IRB显微镜观察切片。
免疫组织化学和共聚焦显微镜
mtnip5; 1基因及其天然启动子(起始密码子上游的2kb)随着附加文件中所示的引物扩增1并克隆到质粒pGWB13中,使用网关系统(Life Technologies,Carlsbad,USA)融合三个C末端血凝素(HA)标签的框架。
接种转化的植物S. Meliloti.2011年。在4%多聚甲醛,2.5%蔗糖和4℃下PBS缓冲液固定在一夜之间的根和结节。在PBS中几次洗涤后,将组织嵌入6%琼脂糖中,在100μl1000加上制备100μm部分。使用甲醇系列(30,50,70,100%,PBS)脱水5分钟,然后再水化部分。在室温下在PBS中具有4%纤维素酶的储蓄植物细胞壁在PBS中,在PBS中的0.1%吐温,15分钟。在将抗HA小鼠单克隆抗体(Sigma)孵育在室温下孵育2小时,在PBS中封闭分离部分在PBS中封闭。几次洗涤后,用alexa594缀合的抗小鼠兔单克隆抗体(sigma)温育1小时。使用每个倍率(10x或40x)中的相同设置,在561nm处使用共聚焦激光扫描显微镜(Leica SP8)在561nm处获得图像,以便在组织中进行定性比较(在控制或缺陷条件下的根部和结节)中进行定性比较。
N. Benthamiana.瞬态表达测定
这mtnip5; 1使用附加文件中所示的引物扩增基因1,然后克隆到pGWB5质粒中,该质粒融合CaMV 35S启动子和GFP标签c端[67.].农C58C1 [69.[也是如此P35S :: MTNIP5; 1-GFP或建筑物p35区域:AtPIP2A-CFP[70]与番茄级速率术病毒的沉默抑制器p19 [71.].N. Benthamiana.然后按照Sparkes等人描述的方法对3周大的叶子进行渗透[72.].用共聚焦显微镜(Leica SP8),在农毒滤成后拍摄了48小时的图像。
生物信息分析
基因候选的氨基酰基酰基丙基序列从数据库Uniprot获得[73.].使用I-Tasser预测蛋白质3D模型[74.]并用软体聚类编辑。
A. Thaliana.突变体互补分析
农包含结构的菌株P35S :: MTNIP5; 1-GFP被用来改变nip5; 1-1 A. Thaliana突变体(58.]使用如Zhang等人所述的花卉浸渍变换方法。[75.].利用附加文件中的引物,通过卡那霉素筛选和PCR分析,选择包含感兴趣结构的纯合子系1.
种子A. Thaliana.Col-0(野生型,Wt),突变体nip5; 1-1,两个纯合子独立的系结合该结构P35S :: MTNIP5; 1-GFP在½ms培养基的平板中垂直生长,具有两个B治疗方法:对照(100μmb[OH]3.)和缺乏(0.03μmb [哦]3.).然后在发芽后3,5,7和10天测量原发性根长度,从根尖到缺口边界,使用在线可用软件imagej [76.].
B浓度分析遵循Gómez-Soto等[77.] 方法。简而言之,在发芽后10天收集一池幼苗(40-50幼苗),并在65℃下干燥。然后,干燥的样品(使用每行和治疗的三种复制),然后在Autónomade马德里大学(Sidi-Uam,马德里,西班牙)的跨部门调查服务实验室的元素分析单位。植物干物质在微波炉中接受酸消化,并以regaer等人所述,使用ICP-MS Nexion 300xx(Perkin Elmer Inc.,Hopkinton,MA)进行分析。[78.].
统计分析
单向分析方差(ANOVA),然后是Tukey HSD因果,以5%的概率水平进行多次比较(p < 0.05).SPSS统计信息17.0(SPSS Inc.)包用于统计分析。
数据和材料的可用性
本研究中生成或分析的所有数据均包含在本文中(及其附加文件)。尽管如此,在当前的研究中使用和/或分析的数据集可从通信作者在合理的要求。
缩写
- B:
-
硼
- 护士:
-
氮
- MIP:
-
主要内在蛋白质家庭
- 鲍尔:
-
硼酸州运输家庭
- 掐:
-
结节蛋白26样固有蛋白家族
- GFP:
-
绿色荧光蛋白
- CFP:
-
青色荧光蛋白
- CaMV:
-
35S花椰菜马赛克病毒35s RNA
参考
- 1。
WK。硼酸和硼砂对蚕豆和某些其他植物的影响。Ann Bot。牛津大学出版社。1923; 37:629-72。
- 2。
奥尼尔马,艾伯哈德S,艾尔伯斯海姆P,Darvill Ag。细胞壁rhamnogalactuRonan II的硼酸硼交联的要求进行拟南芥生长。科学。2001; 294(5543):846-9。
- 3。
Koshiba T,Kobayashi M,Matoh T.硼缺乏:细胞壁的缺陷如何损害细胞?植物信号表现。2009; 4(6):557-8。
- 4.
棕色ph,bellaloui n,wimmer ma,bassil es,ruiz j,hu h等。植物生物学中的硼。植物BIOL。2002; 4(2):205-23。
- 5。
Sween F,Nawaz Ma,Chen C,张Q,Zheng Z,Sohail H,等。硼:提高其可持续农业植物可用性的功能和方法。int j mol sci。2018; 19(7):1856。
- 6。
高等植物的矿质营养。奥福特:爱思唯尔;2012.1 - 651页。
- 7。
植物体内硼平衡机制的研究。植物学报。2017;8:1951。
- 8。
Reid R.了解植物中的硼传输网络。植物土壤。2014; 385(1-2):1-13。
- 9。
Miwa K,Tanaka M,Kamiya T,Fujiwara T.植物中硼输送的分子机制:拟南芥纳米肌瘤; 1和NIP6; 1。在:MIPS及其在商品交换中的角色。纽约:斯普林克;2010. p。83-96。
- 10。
乌鸦贾。植物中硼酸的短期和远距离运输。新植物。1980; 84(2):231-49。
- 11.
植物水甘油通道蛋白(aquaglyceroporins, aquaglyceroporins)的结构、功能和调控。生物膜生物化学学报。2006, 1758(8): 1165 - 75。
- 12.
Fitzpatrick KL,Reid RJ。Aquagyceroporins在大麦根硼运输中的参与。植物细胞环境。2009; 32(10):1357-65。
- 13。
Bhattacharjee H, Mukhopadhyay R, Thiyagarajan S, Rosen BP。水甘油oporins:古老的金属通道。J杂志。2008;7(9):1 - 6。
- 14。
Tanaka M,Wallace是,Takano J,Roberts DM,Fujiwara T. nip6; 1是优先运输硼的硼酸通道,以拟南芥生长芽组织。植物细胞。2008; 20(10):2860-75。
- 15.
拟南芥主要固有蛋白NIP5;1在硼限制条件下的高效吸收和植株发育中起重要作用。植物细胞。2006;18(6):1498 - 509。
- 16。
Bienert MD, Bienert GP。植物水通道蛋白和类金属。:植物水通道蛋白。可汗:施普林格;2017.p . 297 - 332。
- 17。
高野,田中军,丰田,田中军,葛西康,富士,等。拟南芥硼转运体的极性定位和降解。中国科学院院刊。2010;107(11):522 - 5。
- 18。
Takano J,Noguchi K,Yasumori M,Kobayashi M,Gajdos Z,Miwa K,等。拟南芥硼转运蛋白加载。自然。2002; 420(6913):337-40。
- 19。
Takano J,Miwa K,Fujiwara T.硼运输机制:渠道和运输车的合作。卷。13,植物科学趋势。elewsvier;2008. p。451-457。
- 20.
Miwa K,Fujiwara T.植物中的硼运输:转运仪的协调调节。Ann Bot。2010; 105(7):1103-8。
- 21。
沃尔斯特河,关闭TJ,Singh Nk,Hoiseton da,Cook Dr。孤儿豆科作物进入基因组学时!CurrOp植物BIOL。2009; 12(2):202-10。
- 22。
等新泽西。豆科植物根瘤的发育。《细胞生物学杂志》1991;7:191-226。
- 23。
王志强,王志强,王志强,等。细菌NH4+代谢在根瘤菌-植物共生关系中的作用。微生物学报2002;66(2):203-22。
- 24。
Jones Km,Kobayashi H,Davies BW,Taga Me,Walker GC。Rhizobial Symbionts如何入侵植物:Sinorhizobium - Medicago模型。NAT Rev Microbiol。2007; 5(8):619-33。
- 25。
波义耳E.海洋:氮污染没有边界。科学。2017;356(63399):700 - 1。
- 26。
凯特博士。氮气污染:解决气候变化的关键构建块。高涨。2018; 147(1-2):11-21。
- 27。
DENT D,致以在谷物和其他非豆科作物中建立共生氮固定:2017年更环保的氮气革命农业和粮食安全; 6(1):1-9。
- 28。
Pankievicz VCS,Irving TB,Maia Lgs,Anéjm。我们到了吗?长途走向发展氮素固定细菌和非豆科作物之间的高效共生关联。BMC BIOL。2019; 17(1):99。
- 29。
White J,Prell J,James Ek,Poole P. Symbionts之间的营养分享。植物理性。2007; 144(2):604-14。
- 30.
刘志强,王志强,王志强,等。硼对根瘤菌-豆科植物细胞表面互作和根瘤发育的影响。植物学报。植物杂志。1996;110(4):1249 - 56。
- 31.
Redondo-Nieto M,Purido L,Reguera M,Bonilla I,BolañosL。在结节硼缺陷的Pisivum中未检测到与rhamnogalactuRonan的发育型膜糖蛋白分享抗原性。植物细胞环境。2007; 30(11):1436-43。
- 32.
Reguera M,Bonilla I,BolañosL.硼缺乏导致在豆类根瘤菌相互作用期间从PR-10家族诱导病因相关蛋白质。J植物理性。2010; 167(8):625-32。
- 33。
Reguera M,Abreu I,Brubin NJ,Bonilla I,BolañosL.硼酸植物促进了豆科植物extensin和鼠李菇之间的复合物的形成,并在Pisum Sativum symbiotic根结节中的感染螺纹发育过程中增强了roizobium囊多糖的产生。植物细胞环境。2010; 33(12):2112-20。
- 34。
Reguera M,Wimmer M,Bustos P,Goldbach He,BolañosL,Bonilla I. Pisum Sativum Nodules中的硼配体参与氧浓度和根瘤菌感染的调节。植物细胞环境。2010; 33(6):1039-48。
- 35。
reguera m,espía,bolañosl,鲣鱼I,redondo-nieto m。细胞分化前的eNdoreduplication在硼缺乏豆科结节中失败。硼是细胞周期调节期间的信号传导吗?:信件.新植物。2009; 183(1):8-12。
- 36。
闵晓东,吴辉,张志伟,金旭,等。截形紫花苜蓿水通道蛋白基因家族的全基因组鉴定与特性分析。植物生态学报,2019;28(3):320-35。
- 37。
Bogacki P, Peck DM, Nair RM, Howie J, Oldach KH。豆科截叶苜蓿对硼毒性耐受性的遗传分析。植物学报。2013;13(1):54。
- 38。
Takata K,Matsuzaki T,Tajika Y. Aquaporins:细胞膜的水通道蛋白。prog组织cytochem。2004; 39(1):1-83。
- 39。
Hussain A,Tanveer R,Mustafa G,Farooq M,Amin I,Mansoor S.对比水素的对比系统介绍,对植物的基因家族扩张和演变提供了洞察力及其在抗旱和易感鹰嘴豆品种中的作用。基因组学。2020; 112(1):263-75。
- 40。
HOVE RM,Bhave M.具有非Aqua功能的植物水泡:解读签名序列。植物mol biol。2011; 75(4-5):413-30。
- 41.
融合器。https://iant.toulouse.inra.fr/symbimics/2018年3月20日。
- 42.
Medicago Truncatula.基因表达图谱。高贵的研究所.https://mtgea.noble.org/v3/2018年3月20日。
- 43.
Mattos D, Hippler FWR, Boaretto RM, Stuchi ES, Quaggio JA。土壤硼施肥:养分来源和砧木在柑橘生产中的作用。农业工程学报。2017;16(7):1609-16。
- 44.
王勇,石磊,曹旭,徐飞。硼营养与作物硼施用。动植物硼营养研究进展:施普林格荷兰;2007.p . 93 - 101。
- 45。
Noguchi K, Yasumori M, Imai T, Naito S, Matsunaga T, Oda H, et al. bor1-1,一个需要高硼水平的拟南芥突变体。植物杂志。1997;115(3):901 - 6。
- 46。
庞勇,李丽,任飞,陆鹏,魏鹏,蔡军,等。在拟南芥中,液泡膜水通道蛋白AtTIP5;1的过度表达使其对硼毒性具有耐受性。中国基因工程杂志。2010;37(6):389-97。
- 47。
朱志强,刘志强,刘志强,等。硼酸和盐分对玉米根系的影响。水通道蛋白ZmPIP1和ZmPIP2与质膜H+- atp酶对水分和养分吸收的响应杂志。2008;(4)132:479 - 90。
- 48。
Kumar k,Mosa Ka,Chhikara S,Musante C,白色JC,Dhkangher Op。两种水稻浆膜内在蛋白,OSPIP2; 4和OSPIP2; 7,参与运输并为硼毒性提供耐受性。Planta。2014; 239(1):187-98。
- 49。
烹饪Medicago truncatula医生-一个正在制作中的模型!植物学报。1999;2(4):301-4。
- 50.
田中,高野,千叶,小笠原,大内,等。拟南芥中NIP5;1 mRNA的硼依赖降解对过量硼环境的适应植物细胞。2011;23(9):3547 - 59。
- 51.
王志强,王志强,王志强,等。水通道蛋白-1渗透水的结构决定因素。自然。2000;407(6804):599 - 605。
- 52.
Wu B,Beitz E. Aquaporins,具有选择性,具有非传统渗透。细胞mol寿命。2007; 64:2413-21。
- 53.
水稻、玉米和拟南芥主要固有蛋白的同源建模:跨膜螺旋关联和芳香/精氨酸选择性过滤器的比较分析。BMC Struct Biol. 2007;7(1):27。
- 54.
Kamiya T, Fujiwara T. Arabidopsis NIP1;1转运锑并测定锑的敏感性。植物生理学报。2009;50(11):1977-81。
- 55.
Bolaños L, Esteban E, de Lorenzo C, Fernandez-Pascual M, de Felipe MR, Garate A, et al.;硼对豌豆共生固氮的重要性(Pisum一)根瘤菌结节。植物杂志。1994;104(1):85 - 90。
- 56.
Tejada-Jiménez M, Castro-Rodríguez R, Kryvoruchko I, Mercedes Lucas M, Udvardi M, Imperial J, et al。截形苜蓿天然抗性相关巨噬细胞蛋白1是被根瘤菌感染的根瘤细胞摄取铁所必需的。植物杂志。2015;168(1):258 - 72。
- 57。
Brito B,Palacios JM,Hidalgo E,Imperial J,Ruiz-Argueso T.豌豆(Pisum Sativum L.)植物的镍可用性限制了Rhizobium豆科骨肉BV的氢酶活性。通过影响氢酶结构亚基的加工来组织菌菌。J细菌。1994年; 176(17):5297-303。
- 58。
引用本文:Kato Y, Miwa K, Takano J, Wada M, Fujiwara T. enhanced expression of NIP5;1, a boric acid channel植物生理学报。2009;50(1):58-66。
- 59。
Murashige T,Skoog F.一种修订的培养基,用于快速生长和生物测定与烟草组织培养。physiol植物。1962; 15(3):473-97。
- 60。
王志强,王志强,王志强,等。截形苜蓿种质与中华根瘤菌菌株之间的特异性寄主响应关联。植物与微生物学报。2017;30(5):399-409。
- 61。
Hardy RWF,Holsten Rd,杰克逊ek,烧伤了RC。N2固定的乙炔 - 乙烯测定:实验室和场评价。植物理性。1968年; 43:1185-207。
- 62。
TAIR。拟南芥信息资源。https://www.arabidopsis.org/2017年11月20日。
- 63。
植物血统v12.1。植物基因组学资源。JGI。https:////phytozome.jgi.doe.gov/pz/portal.htmlAccessed.2017年11月20日。
- 64。
Kakar K,Wandrey M,Czechowski T,Gaertner T,Scheible WR,Stitt M等。Medicago Truncatula中转录因子基因表达的高通量定量RT-PCR分析的社区资源。植物方法。2008; 4(1):18。
- 65.
鲍森-德尔尼尔A,夏博M,加西亚F, Bécard G,罗森博格C,巴克DG。根癌农杆菌转化的紫花苜蓿根的固氮和菌根内共生关系的研究。植物与微生物学报。2001;14(6):695-700。
- 66.
文森特JM。根瘤菌实际研究手册。伦敦:IBP Handbk 15牛津和爱丁堡:Blackwell科学出版物;1970.164。
- 67.
Nakagawa T,Ishiguro S,Kimura T. Gateway植物转型载体。植物生物科技。2009; 26(3):275-84。
- 68.
Vernoud V, Journet EP, Barker DG。MtENOD20,根皮层细胞激活的点因子诱导分子标记。植物与微生物的相互作用。1999;12(7):604-14。
- 69.
基于Ti质粒的农杆菌C58C1对单子叶和双子叶植物中病毒诱导酚类化合物和可溶性因子的趋化性。J Bacteriol。1988;170(9):4181 - 7。
- 70.
杨克,荣W,齐升,李琦,魏X,张Z.Rhizoctonia casian诱导的小麦半胱氨酸的受体样激酶基因的分离与表征。SCI批准。2013; 3(1):1-10。
- 71.
关键词:番茄矮缩病毒,p19蛋白,基因沉默,瞬时表达植物j . 2003; 33(5): 949 - 56。
- 72.
荧光融合蛋白在烟草植株中的快速瞬时表达和稳定转化植株的生成。Nat Protoc。2006;1(4):2019 - 25所示。
- 73.
uniprot。长生不老药.http://www.uniprot.org/获得2018年4月9日。
- 74.
i-tasser。蛋白质结构和功能预测。张实验室.https://zhanglab.ccmb.med.umich.edu/I-TASSER/访问2018年4月16日。
- 75.
张x,亨罗基r,林ss,niu qw,chua nh。农杆菌介导用花浸法介导拟南芥的转化。NAT PROTOC。2006; 1(2):641-6。
- 76.
imagej。Java中的图像处理与分析。http://rsbweb.nih.gov/ij/.
- 77.
Gómez-soto d,Galváns,rosales e,bienert p,abreu i,Bonilla i等。植物激素调节Patnip5的角色的见解; 1拟南芥的活动和硼运输。植物SCI。2019; 287:110198。
- 78.
Reguera M,Conesa Cm,Gil-GómezA,Haros Cm,Pérez-Casasmá,Briones-Labarca v等。不同农生病症对奎奴亚藜种子营养成分的影响。peerj。2018; 6:E4442。
致谢
作者非常感谢Manuel Gonzalez-Guerrero博士的支持,帮助他们构思和计划实验。感谢Toru Fujiwara博士(东京大学),Junpei Takano博士(大阪府大学,日本)和Kyoko Miwa博士(日本北海道大学),为提供了答:芥nip5; 1 - 1本研究使用的突变种子。我们还感谢Inmaculada Rivas Ramírez和部门间调查服务(SIdI)-UAM的元素分析部门,感谢他们的技术援助,确保ICP-MS分析及时进行。作者声明没有利益冲突。
资金
提交人未收到这项工作的特定资金。
作者信息
从属关系
贡献
mr . r .构思并计划了这些实验。mr .和S.G.R.进行了实验。mr .和S.G.R.对结果的解释做出了贡献。mr . r .牵头撰写了这份手稿,由S.G.R.和L.B.贡献。所有作者都提供了关键的反馈,并帮助塑造了研究、分析和手稿。所有作者均已阅读并批准本稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1
引物列表。
附加文件2:图S1
.在4周龄植物中生长在B梯度下生长的4周龄植物中的氮酶活性:对照条件(最终B浓度为0.1mm的浓度为0,1mm B]),B缺乏(不补充到介质中的B),或B毒性条件(1mm B [OH3])。通过乙炔还原方法分析氮酶活性,并表示为每小时每小时(左面板)或每小时重量(右侧面板)产生的乙烯乙烯。数据是两个独立实验的平均值±SD,至少四个合并植物和四个生物重复(N= 4)。用星号表示B胁迫植株与B对照植株比较差异显著(t-Student,“*”=P. < 0.01, “**” = P. < 0.001).
附加文件3:图S2
.表达式Medicago Truncatula.MTNIP5; 1(MEDTR1G097840)在不同的植物器官中。a)从Symbimics数据库获得的数据(https://iant.toulouse.inra.fr/symbimics/).b)从MedicaCo基因表达Atlas获得的数据(https://mtgea.noble.org/v3/).
附加文件4:图S3
.时间Cromce实验显示初级根生长A. Thaliana.幼苗在nip5;1-1互补的化验。野生型(Wt)的主根生长(mm)(黑线),两条独立的线表达P35S :: MTNIP5; 1-GFP构建(P35S :: MTNIP5; 1-GFP 1和P35S :: MTNIP5;1-GFP 2,分别为暗灰色线和浅灰色线)和nip5;1-1(虚线)分别于萌发后3、5、7和10 d测定。幼苗在两个B处理下生长:一种)控制(100 μM B[OH],和b)缺陷(0.03 μM B[OH3])
附加文件5:图S5
.测定10天野生型(Wt)(黑色)的钙(Ca)浓度,P35S :: MTNIP5;1-GFP 1(深灰色),P35S :: MTNIP5;1-GFP 2(浅灰色),和nip; 1-1(白色)在B控制和B缺乏条件下生长的幼苗。两个B处理分别为对照(100 μM B[OH3])和缺乏性(0.03 μM B[OH3])。不同的字母表示显著差异,使用单因素方差分析,然后进行土耳其测试(p < 0.05).
附加文件6:图S6
.A)atnip5的UTR区域的序列对准; 1(AT2G47160)和MTNIP5; 1(MEDTR1G097840)。b)MTNIP5的5'未翻转区域(5'UTR)的末端; 1(MEDTR1G097840)和基因的初始序列(从ATG起始密码子开始)。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
Granado-Rodríguez,S.,Bolaños,L.&Reguera,M。mtnip5; 1, 一本小说Medicago Truncatula.缺乏诱导的硼扩散促进剂。BMC植物BIOL.20.552(2020)。https://doi.org/10.1186/s12870-020-02750-4
收到了:
公认:
发表:
关键词
- 缺硼
- Medicago Truncatula.
- 水素蛋白
- mtnip5; 1
- 硼运输
- 豆类