- 研究文章
- 开放获取
- 发布:
这SAP在大白菜中的两个等位基因突变证明了雌蕊发育的功能(Brassica Rapa.L. SSP。pekinensis.)
BMC植物生物学体积20.,商品编号:538(2020.)
抽象的
背景
雌蕊发育是植物的复杂过程,雌性无菌突变体是用于筛选和克隆雌蕊发育相关基因的理想材料。使用雌性无菌突变体(FSM1.),braa04g009730.3c被预测为不育无瓣(STERILE APETALA, SAP)转录调控的候选突变基因。在目前的研究中,一个平行的雌性不育突变体(FSM2.)来自大白菜DH线'FT'种子的EMS诱变。
结果
两个都FSM2.和FSM1.突变表型表现出雌蕊流动和较小的花器官。遗传分析表明突变体的表型FSM2.也受一个隐性核基因控制。等位性试验表明,该基因突变FSM1.和FSM2.基因是等位基因。单核苷酸突变(G到A)中的第一外显子braa04g009730.3c在突变体中引起了GAA(谷氨酸)到GGA(甘氨酸)的错义突变FSM2.植物。两者的等位基因突变braa04g009730.3c在FSM1.和FSM2.赋予了类似的雌蕊流产表型,验证了SAP在雌蕊发育中的作用。探讨其作用机理SAP- 诱导的雌蕊流产,我们比较了突变体FSM1.和野生型'ft'pistil转录om。在获得的3855个差异表达基因中,29与胚珠发育有关,16次与器官尺寸有关。
结论
我们的研究澄清了功能braa04g009730.3c揭示了它与胚珠发育和器官大小有关。这些结果为阐明大白菜雌蕊发育的分子机理奠定了基础。
背景
雌性无菌是指由于植物中雌器官的异常发育而减少或完全中止的现象。雌蕊结构是复杂的,并且异常的女性器官发育可能导致孢子体和配子体阶段的女性无菌。根据雌蕊流产的特定时期,雌性植物无菌可分为三种类型:(1)异常雌蕊,(2)异常胚珠,(3)异常卵细胞[1].无菌雌性植物在研究高等植物中的雌性器官的发育机制和遗传育种方面非常有用[2那3.那4.].
在花器官中,雌蕊结构最为复杂,其生殖生长发育过程受大量转录因子和功能基因调控[5.那6.那7.].通过映射和克隆在雌性无菌突变基因中鉴定了雌蕊流动过程中调节雌蕊发育和生理和生物化学变化的几种基因拟南芥,水稻、棉花、玉米和油菜,使人们逐渐了解雌蕊发育的形态模式和遗传规律[8.那9.那10那11那12].对雌性不育突变体进行高通量转录组测序,可以在转录水平上探索雌蕊败育过程中发生的代谢途径变化;筛选调控雌蕊发育的关键基因有助于研究雌蕊和胚珠发育及其遗传调控机制[13那14那15那16那17].
雌蕊发育是由多种基因控制的复杂过程。Coen和Meyerowitz [18]提出了花器官发育的ABC模型,随后Colombo等[19]和Theissen [20.]将ABC模型扩展到ABCD和ABCDE模型。其中,D类基因调节胚珠发育,并且ABCDE模型中的大多数基因属于疯子箱基因家族[21]. 在MADS-box基因家族中,有几个旁系同源基因共同调控花的发育[19那22那23那24].在答:芥,确定的胚珠同一性基因包括钦am(AG),贝尔1.(BEL1),Serifstick.(st),防碎1/2(SHP1/SHP2型),杯状子叶3(CUC3.), 和相当少的种子2(PFS2);这些基因与胚轴形态发生和编码蛋白质密切相关,含有保守的疯盒功能域[25那26那27那28那29那30.].与胚珠原金属形成相关的基因包括安特古门塔(蚂蚁),乌塞尔(沃斯),喷嘴(唠叨),内部没有外部(伊诺),贝尔一号,和PHABULOSA(博士) [4.那31那32那33那34].此外,一些与被皮发育相关的基因已被分离并分为两类:一类控制被皮的早期发育,包括休伦罗斯(高级语言),蚂蚁那唠叨,和伊诺[35那36那37那38];另一个控制内容的后期发展,包括短珠被1(SIN1),超人(sup),Strubbelig.(亚),拟南芥皱褶4(ACR4.),异常种皮形状(美国胸科协会),Kanadi1 / 2.(Kan1 / 2.),独角兽(UCN.), 和TSO1[39那40那41那42那43].
在我们以前的研究中,我们获得了雌性不育突变FSM.(即FSM1.这里)通过隔离的微孔培养结合大白菜(ems)诱变甲磺酸甲酯(EMS)诱变(Brassica Rapa.L. SSP。pekinensis.)双单倍体(DH)系'FT'[44].雌蕊流产FSM1.突变体是由胚珠异常引起的braa04g009730.3c(版本3.0)被认为是候选基因FSM1.基于图位克隆和全基因组重测序的突变体[12].braa04g009730.3c编码无菌Apetala(SAP),一种在花器官发展中起重要作用的转录调节因子。在答:芥那SAP不仅调节花和胚珠发育[45]但还通过影响细胞增殖来控制器官尺寸[46].
在这项研究中,DH线'FT'用作致突变性材料;用EMS溶液处理发芽的'FT'种子以开发另一个平行的雌性无菌突变体(FSM2.)其表型与突变体的表型一致FSM1..等位基因检测表明突变基因FSM1.和FSM2.是等位基因的。这两个平行突变体用于验证功能braa04g009730.3c.为了探讨卵子发育的潜在机制,使用RNA测序来比较突变体的雌蕊转录组FSM1.和野生型'ft'植物。鉴定和筛选与胚珠发育和器官尺寸相关的基因,奠定了基础,进一步揭示了大白菜中的雌蕊流动机制。
结果
与形态特征的比较FSM1.和FSM2.突变体
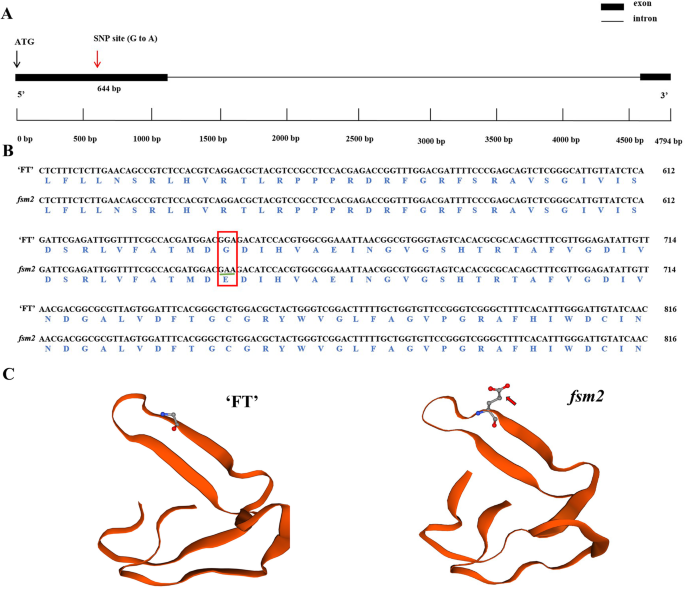
这FSM2.突变表型非常符合FSM1.变种人。与野生型‘FT’植物相比,突变体FSM2.植物表现出雌蕊流产。如图1所示。1B,卵巢薄而缩短。此外,突变体的四轮流动器官FSM2.植物显着较小,野生型植物的植物(图。1).
如表所示1中,当突变体FSM2.植物被用作女性父母,无论其花粉还是外味(野生型'Ft')花粉作为雄性父母,没有种子从后代收获。但是,当一个突变体FSM2.以植株为父本,从后代中采集种子。因此,雄蕊育性正常,雌蕊败育。此外,女性不育FSM2.突变是稳定的。
突变体的遗传分析FSM2.
当野生型的'FT'植物用作女性父母和FSM2.使用突变体作为杂交的雄性父母,所有植物的表型都与F的野生型'ft'一致1一代。在F.2生成,分离比为3:1,而BC1生成中的分离率约为1:1(F.1 × FSM2.).这些结果表明FSM2.突变表型是由单隐性核基因(控制表2).
等位性测试
彼此的互惠交叉1(‘FT’ × FSM1.)和f1(‘FT’ × FSM2.)表现出字符分离。在后代,野生型对突变植物的分离比为137:32(χ2 = 1.24 < χ20.05, 1= 3.84)和147:45 (χ2 = 0.09 < χ20.05, 1 = 3.84),符合3:1的分离比。这些结果表明突变基因FSM1.和FSM2.是由同一基因中的突变引起的等位基因。
braa04g009730.3c克隆在突变体中FSM2.
一种braa04g009730.3c克隆在突变体中FSM2.植物显示的单核苷酸突变(G到A,A04:7543809)在第一外显子,从而导致从谷氨酸(G)的氨基酸改变成甘氨酸(E),其从的突变位点不同FSM1.突变体(图。2a,b)。蛋白质的三维结构显示,野生型“FT”和突变型之间的氨基酸构象FSM2.在突变位点不同(图。2C)。这些结果表明,两种等位基因突变braa04g009730.3c授予的类似雌蕊败育表型和验证SAP在雌蕊发育中的作用。
Illumina配对结束排序和全局数据分析
这FSM1.和FSM2.植物是具有不同突变的等位基因突变体braa04g009730.3c编码SAP转录调节器。检查可能的途径SAP可以调节雌蕊的发展FSM.’FT’和‘FT’转录组比较分析FSM1.雌蕊。从“FT”和“FT”的3个生物重复中分别获得了128,643,734和130,558,248条干净readsFSM1.植物分别。在整个清洁读取中,六个文库中映射到参考基因组的读数的百分比范围为90.66%至91.76%,而映射读数的97.48%至97.88%匹配与独特的基因组位置(表3.)可用于“FT”和“FT”和差异的差异分析FSM1.植物.
另外,24,494(FT1),24,668(FT2),24,863(FT3),24,918(M2),24,860(M2)和25,418(M2)和25,418(M3)基因分别从这六个库中产生(附加文件1:表S1)。
“FT”和“DEG”之间的差异表达基因(DEG)FSM1.植物
比较'ft'vs.FSM1.植物显示3855个DEGs,其中2356个上调,1499个下调(另一个文件)2:表S2)。上调的deg数量显著高于下调的deg数量FSM1.突变体。其中106个deg被特异性表达,其中21个和85个在FT中特异性表达FSM1.植物,分别是植物(附加文件3.:表S3)。
DEGs的功能富集分析
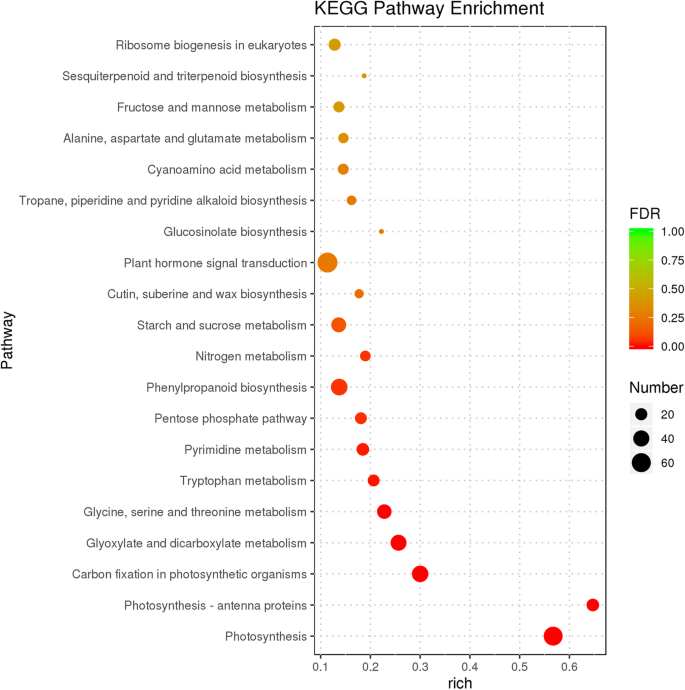
GO功能富集分析用于鉴定DEGs的生物学功能。我们确定了1304个富集的氧化石墨烯条件。其中,“生物过程”、“细胞成分”和“分子功能”类别分别有768、126和410个GO术语4.:图。S1)。确定了与花开发有关的两项术语(“花开发”(GO:0009908;四次)和“花发育的调节”(GO:0009909;一码))。此外,还鉴定了与植物激素代谢相关的许多GO术语,包括“对激素的反应”(GO:0009725; 21℃),“激素介导的信号通路”(GO:0009755;一级)和“反应”auxin“(GO:0009733; 16次)。额外的文件中显着丰富的GO术语5.:表S4。
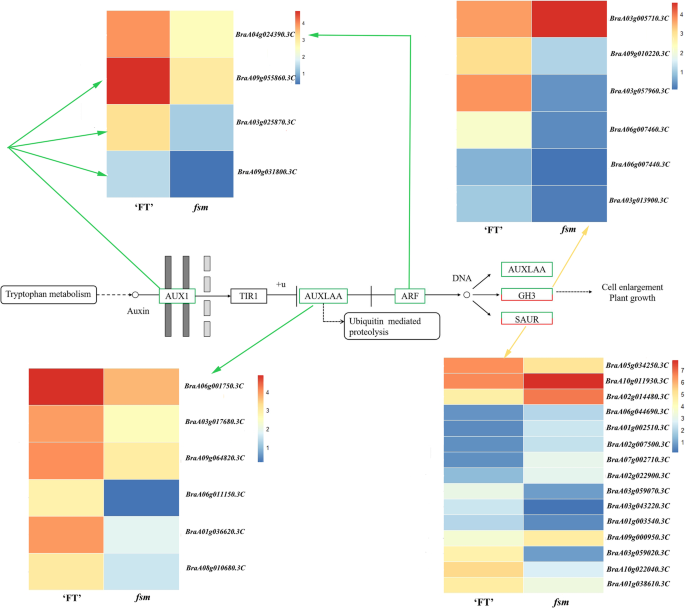
通过KEGG通路分析,确定参与代谢或信号转导通路的基因。我们鉴定了117条富集的KEGG通路。20个最显著富集的KEGG通路如图所示。3.和附加文件6.:表S5。其中,“植物激素信号转导”途径(KO04075)显着富集,其中67℃被分组成蟾蜍蛋白(IAA),细胞蛋白(CK),嗜酸性蛋白(GA),脱离酸(ABA),乙烯(Eth),芸苔类固醇(BR),茉莉酸(JA)和水杨酸(SA)信号转导途径。以前的研究表明,植物激素IAA,CK,ETH,GA,JA和BR可以影响雌蕊发育[11那47那48].这些中,31度的视角在IAA信号转导途径被富集,接着BR(7度的视角),JA(5度的视角),ETH(2度的视角),CK(1 DEG)和GA(1 DEG)(附加文件7.:表S6)。涉及IAA信号转导过程的DEG包括AUXIN1(AUX1),生长素/吲哚-3-乙酸(AUX / IAA.),助性响应因子(东盟地区论坛),GH3,和小的生长素up RNA (Saur.);这些基因的大多数是下调的FSM1.突变体(图。4.).
胚珠开发与器官尺寸的果酒分析
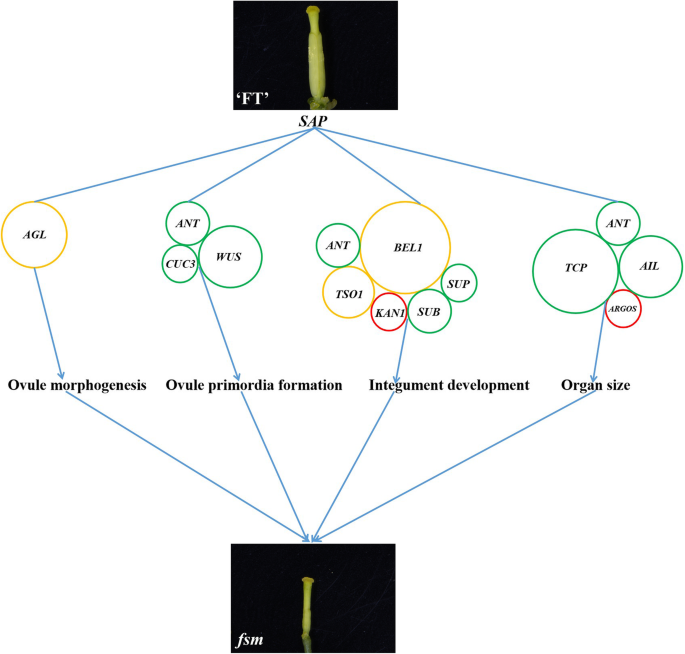
在DEGS中,29与胚珠发育有关。其中,AGAMOUS样(AGL.)基因(braa09g048000.3c那BraA03g051930.3C型那Braa03g058700.3c那braa09g006770.3c,和braa06g039170.3c)参与胚子形态发生;编码基因蚂蚁(BraA03g061040.3C和braa05g011060.3c),CUC3.(braa07g039980.3c), 和沃斯(BraA03g038230.3C那braa05g011060.3c那braa05g029540.3c,和BraA10g022260.3C)参与胚轴原序形成;和编码的基因蚂蚁那BEL1(BraA03g000480.3C型那BraA04g013970.3C那BraA03g058930.3C那BraA04g025560.3C那braa03g018820.3c那BraA10g033530.3C那braa07g027760.3c那BraA05g009430.3C那BraA04g017450.3C,和braa07g038990.3c),TSO1(braa09g005800.3c那BRAA01G01830.3C型,和braa05g024430.3c),亚(braa06g007870.3c和braa06g001180.3c),sup(braa05g002900.3c), 和凯恩1(braa02g031490.3c)参与珠被发育。这些基因可能与水稻雌蕊败育有关FSM1.突变体。
与野生型'ft'植物相比,FSM1.突变体表现出雌蕊流产,四轮的花动器官明显小。我们确定了许多与器官规范监管相关的基因,包括以下内容:蚂蚁那生长素调节基因参与了器官大小(argos.;braa09g049790.3c),Teosinte分支1 / cycloidea / PCF(传输控制协议;BraA02g042770.3C那braa05g005380.3c那braa05g032060.3c那BraA01g036950.3C那braa07g034590.3c那braa08g023460.3c那braa07g030260.3c那braa03g036760.3c,和braa05g041050.3c) 和AINTEGUMENTA-LIKE(AIL.;BraA06g029000.3C那braa03g004320.3c那BraA10g027380.3C型,和BraA02g012300.3C).大多数这些基因均在下调FSM1.突变体。这个下调可能在调节花器器官尺寸方面发挥作用FSM1.突变体。
定量反转录PCR (RT-qPCR)分析基因表达模式
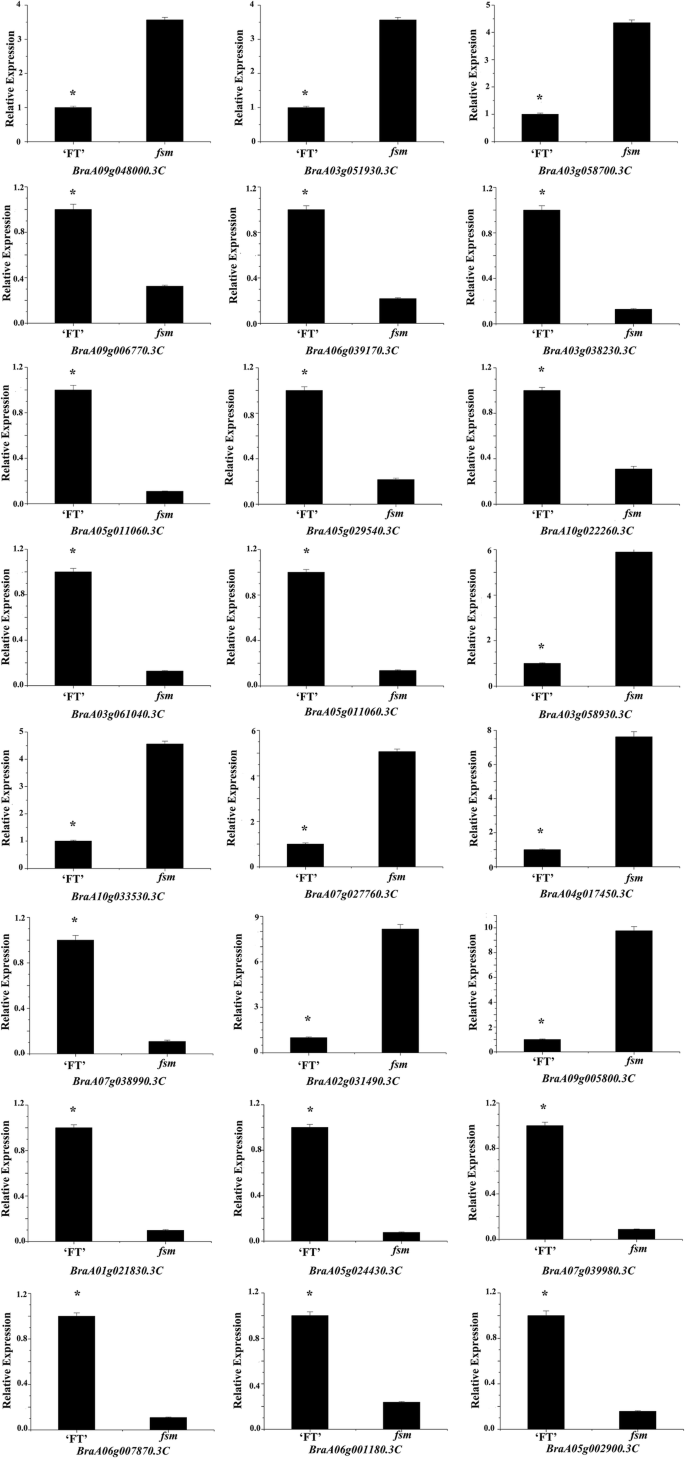
为了进一步确认DEG表达模式,选择与胚胎发育相关的24次,用于RT-QPCR分析,包括编码基因AGL.(braa09g048000.3c那BraA03g051930.3C型那Braa03g058700.3c那braa09g006770.3c,和braa06g039170.3c),沃斯(BraA03g038230.3C那braa05g011060.3c那braa05g029540.3c,和BraA10g022260.3C),蚂蚁(BraA03g061040.3C和braa05g011060.3c),BEL1(BraA03g058930.3C那BraA10g033530.3C那braa07g027760.3c那BraA04g017450.3C,和braa07g038990.3c),凯恩1(braa02g031490.3c),TSO1(braa09g005800.3c那BRAA01G01830.3C型,和braa05g024430.3c),CUC3.(braa07g039980.3c),亚(braa06g007870.3c和braa06g001180.3c), 和sup(braa05g002900.3c). 如图。5.,基因表达模式显示出与RNA-SEQ检测的那些类似的趋势,表明我们的转录组分析的可靠性。
讨论
在我们以前的研究中,我们开发了一种女性无菌突变体(FSM1.)利用离体小孢子培养结合EMS诱变DH系FT大白菜。braa04g009730.3c被预测为突变体中的候选基因FSM1.编码SAP转录调节器;编码序列braa04g009730.3c长度是1374 bp [12].在本研究中,还使用“FT”种子作为致致突变材料,并用EMS溶液处理萌发的'Ft'种子以开发另一个平行的雌性无菌突变体(FSM2.)显示与之一致的表型FSM1.突变体。等位基因测试和基因克隆分析表明FSM1.和FSM2.是否等位基因和由同一基因突变引起的SAP在雌蕊发育中的作用。探讨水稻雌蕊败育的机理SAP,对比较转录组测序的雌蕊FSM1.对突变体和野生型‘FT’植株进行了鉴定,鉴定了与胚珠发育和器官大小相关的基因。这些结果为揭示黄花苜蓿雌蕊败育机理奠定了基础SAP大白菜中的基因。
在植物中,基因过表达,RNA干扰,基因敲除,定点诱变,基因捕获和生物芯片技术是研究基因功能的方法。但是,所有这些方法都依赖于完整的转基因技术系统,并且它们是耗时的。相反,具有相似表型不同突变体中突变基因的等位质检测是一种可信的方法,以验证它们是否由等位基因基因控制,并且可以应用于澄清基因功能。张等人。[49]确定了两个圆形叶片突变体,rl-1和rl-2,与来自黄瓜EMS诱变群的类似的光滑叶缘。基于地图的克隆策略与经修饰的MutMap方法合并建议cspId.(编码丝氨酸/苏氨酸蛋白激酶)是最有可能的候选人rl-1. 杂交种间的等位性检验rl-1 F1(rl-1 × wild-type CCMC) andrl-2 F1(rl-2×野生型CCMC)植物表明,正常叶片形状到圆形叶片的分离比约为3:1,表明这一点rl-1和rl-2是同一基因中突变的等位基因突变体。这些结果表明cspId.是负责圆叶表型的基因。玉米报告了类似的结果[11[米[50].在本研究中,F之间的倒数交叉的分离率1(‘FT’ × FSM1.)和f1(‘FT’ × FSM2.)植物是3:1,这表明FSM1.和FSM2.突变体具有同一基因的等位基因突变。基于我们以前的研究[12[第一个外显子(A04:7544007)发生了SNP(C-TO-A)braa04g009730.3c,导致突变体中过早的止脚密码子FSM1.;另一个SNP(G-TO-A)位于第一个外显子(A04:7543809)中braa04g009730.3c在突变导致非同义突变FSM2..这些结果表明,等位基因突变braa04g009730.3c编码SAP转录因子负责雌蕊发育FSM1.和FSM2.突变体。
最初识别出SAP转录因子答:芥, 在哪里SAP对花的发育至关重要。这个活力突变体表现出花序,花和胚珠发育中的严重异常[45].SAP编码F型盒蛋白,这是SKP1 / CULLIN / F-BOX(SCF)E3泛素连接酶复合物的组件[46].SAP通过调节细胞增殖来影响器官大小答:芥[51].在属中Capsella.,降低的SAP活性可以通过缩短细胞增殖期并减少花瓣细胞数量来导致小花瓣[52]. Yang等人[53]发现了一个黄瓜littleaf(陆上通信线)突变体表现出较小的器官尺寸和更多侧枝。鉴定主要效果的定量特质基因座表明二在黄瓜中是一个正直的rapidopsis sap.并且它们在器官尺寸控制中发挥了类似的作用。在本研究中,FSM1.和FSM2.突变体呈现出相同的表型,与野生型'FT'植物相比,表现出雌蕊流产和小的花动器官,展示了SAP该基因与大白菜的突变表型有关。
我们之前的研究表明在braa04g009730.3c,导致突变体中过早的止脚密码子FSM1.,和braa04g009730.3c表达在'ft'之间没有明显的差异FSM1.突变植物[12]. 在本研究中,另一个SNP位于braa04g009730.3c在突变导致非同义突变FSM2..我们进一步分析的蛋白的三维结构,结果表明,氨基酸的构象是在野生型“FT”和突变型之间的突变位点不同FSM2..异常功能SAP在里面FSM.突变体主要表现在氨基酸编码上。鉴于此,我们推测单核苷酸变异对基因表达没有影响braa04g009730.3c然而,表达式变体蛋白可能影响其下游基因的表达,最终导致表型变异。我们还证明了突变体FSM1.雌蕊败育是由胚珠发育异常引起的[12那44].进一步研究胚珠发育诱导的潜在机制SAP利用RNA-Seq对突变体的雌蕊转录组进行比较FSM1.和野生型'ft'植物。植物中有两个雌蕊发育的主要调节途径。在第一个途径,沃斯-AG- 相关基因共同调节雌蕊发育和第二条途径,诺克利基因调节雌蕊发展。其中,第一个途径是主要调控途径[54那55,建议AG基因在雌蕊发育过程中起着重要作用。研究表明SAP负调控AG它们共同决定花器官的分化[45].AG属于MADS-box基因家族,并起着胚珠发育具有重要作用;其活性也有助于胚珠形态[21那29那56].作为胚珠发育中的重要调节基因,AG同源物也在雌蕊形成中起重要作用[57].例如,AGL11.在胚珠发展中发挥着重要的监管作用[58],AGL8.和AGL19.在调节花卉过渡和女性无菌方面发挥重要作用[16那59], 和AGL62.能刺激珠心退化[60].同源框基因沃斯在调节胚珠发育中起重要作用;它主要表达于胚珠原基的珠心,是珠被启动所必需的[33].蚂蚁是AP2 / ERF转录因子家族的成员,其参与胚珠发育和胚珠原序层形成[61那62].蚂蚁突变导致失败的胚珠整形形成,然后导致异常的胚珠发育和雌性无菌性[63那64].BEL1是一种同一族癌的转录因子,可以控制卵子图案,特别是在确定环境的身份和发展方面;ovules开发出一种类似的像素的结构BEL1突变体[25那65].CUC3.是一个推定的NAC结构域转录因子成员中联科利基因家族[27].CUC1.那CUC2,和CUC3.在胚珠原始发展期间表达。这些,CUC1.和CUC2.玩冗余角色在促进年轻枸杞中的胚珠发起,较少的胚珠[66].CUC2.和CUC3.也是冗余需要进行适当胚珠发育[30.].sup那亚那Kan1 / 2,和TSO1调节晚期的重新表达,并在整数形态发生的遗传控制中发挥作用[40那41那43].这些,凯恩1属于Kanadi家族,是外部项目中最重要的基因之一[67].在目前的研究中,确定了与胚芽开发有关的29次。其中,AGL.基因调节胚珠形态发生;蚂蚁那CUC3,和沃斯调节胚珠原金菊酯;和蚂蚁那BEL1那TSO1那亚那啜饮,和凯恩1调节珠被发育。这些基因在“FT”和“t”中呈现不同的表达模式FSM.突变植物;我们推测这些基因的相互作用和调控可能会影响在胚珠发育FSM.突变体(图。6.).
与野生型'ft'植物相比,FSM1.突变植物表现出雌蕊流产,花动器官小。植物器官尺寸由两种发育过程决定:细胞增殖和细胞扩张[68].在答:芥,F箱蛋白质SAP是通过促进细胞增殖调节器官尺寸的器官生长的阳性调节剂[46那51].蚂蚁不仅调控被皮的形成,还调控植物器官的大小[69].蚂蚁和argos.通过影响细胞增殖调节器官尺寸[61那70那71].丧失函数argos.或蚂蚁突变体表现出较小的叶子和花卉器官[53那72].蚂蚁和AIL6.是花发育的重要调节因子,因为它们可以调节花分生组织和器官的生长[73那74].蚂蚁那AIL5.,和AIL7.在花序分生和花开发中发挥冗余作用[75].TCP蛋白质是植物特异性转录因子,可以控制叶和花大小和形状[76].在目前的研究中,我们确定了16次参与了机构规则的调节,主要包括在内蚂蚁那argos.那传输控制协议,和AIL..这些基因的大多数是下调的FSM1.突变体。这些与器官尺寸相关的DEG的相互作用可能导致较小的花动器官观察到FSM.突变体植物(图。6.).
激素对植物的生长发育起着重要的调节作用。先前在雌性不育突变体中发现了多种参与激素信号通路的突变基因,包括IAA、CK、ETH、GA、JA和BR通路,导致雌蕊形态异常[11那34那48那77那78那79那80].雌性无菌材料的转录组分析显示,在水稻,石榴和水稻的激素信号转导途径中显着富集。油松说明激素代谢途径的改变对胚珠发育有重要影响[15那16那17].生长素在胚珠发育中起重要作用,促进Carpel启动和甘油纤维增长[81].此外,蚂蚁已提出在花卉生长和图案化的植物中的下游作用[73].疾病响应基因主要包括东盟地区论坛那GH3阿富汗二月,和AUX / IAA..ARF6和ARF8.参与胚珠adaxial / aaxial极性形成,并在胚珠和花药中发挥至关重要的作用[17那82].下调ARF6和ARF8.会导致女性无菌[77]. CK正调控胚珠的形成和雌蕊的发育[83].此外,这是BEL1转录因子在细胞蛋白信号传导途径中发挥着重要作用,用于正确的卵子图案化[34].实际上,CK水平与胚珠数呈正相关。减少的CK含量导致胚珠数和雌蕊尺寸的相应显着降低,从而导致雌性无菌[84那85那86].eth有助于雌蕊发展[78那87]和乙烯响应因子(ERF.)乙烯 - 响应信号基因属于亚太地区2正向调控ETH的基因家族。ERF蛋白也有抑制作用AG基因表达,从而影响胚珠发育[21那88那89].BR在开发胚珠外部和妇科内侧域的发展中发挥作用[79].GA在控制Ovule Integument开发和胚珠启动中发挥重要作用[90]负面调节植物中胚珠的数量[48].JA在确定雌蕊的命运时在高JA水平促进雌蕊堕胎时发挥着重要作用11]. 本研究的功能富集分析表明,与激素相关的GO项得到了富集,植物激素信号转导途径也得到了显著富集。在我们的研究中发现的DEGs参与IAA、CK、ETH、GA、JA和BR信号传导。在这些途径中,IAA信号途径的DEGs数量最多。进一步研究这些与激素信号转导有关的基因可能有助于阐明雌蕊败育的机制;不同激素对大白菜雌蕊发育可能具有协同或拮抗作用。
结论
胚珠是大白菜有性生殖的主要器官,是大白菜的雌性生殖器官。我们的研究澄清了功能braa04g009730.3c并透露,它负责胚珠发育和器官规模。进行比较转录组分析以探索调节效果SAP在胚珠发育过程中,发现了几个与胚珠发育有关的DEGs。本研究为今后对雌蕊发育的研究提供了有价值的信息,为阐明大白菜雌蕊发育的分子机理奠定了坚实的基础。
方法
植物材料和致突变性
野生型“金融时报”是由中国大白菜衍生“福田50”一个DH线,这是沉阳绿星中国的白菜研究所(沉阳,中国)筛选91].将发芽的'Ft'种子浸入0.8%EMS溶液中12小时,然后在自来水中彻底洗涤12小时。在2℃下冬季化治疗15℃后,种子在沉阳农业大学的温室中播种。所有活植物(m0.一代)是自授粉。筛选突变物质在m中筛选并鉴定1一代以获得平行的雌性无菌突变体FSM2..
观察形态特征
在全绽放阶段,观察花器官特征并比较FSM1.和FSM2.突变体和野生型'ft'植物。根据我们以前的方法[44],三个'ft'和突变体FSM2.选择植株进行人工自花授粉FSM2.突变体和“FT”与FSM2.进行了突变试验。记录并分析了各株型的结实率。
遗传分析
突变体FSM2.野生型的'FT'植物作为父母雇用以获得F.1, F2,和BC1人口。记录每代每种植物的表型以研究突变体的遗传特征FSM2.植物。
等位质测试FSM1.和FSM2.突变体
F.1(‘FT’ × FSM1.)和f1(‘FT’ × FSM2.)人群表现出正常的表型。F.1(‘FT’ × FSM1.)和f1(‘FT’ × FSM2.)人口用作母植物。进行互易逆转,以获得群体的表型分离比。使用Chi-Square进行分析人口分离比(χ2)测试。
基因克隆和测序
的编码序列braa04g009730.3c在突变体中被扩增FSM2.植物使用附加文件中显示的底漆序列8.:表S7。根据黄等人的方法进行基因克隆。[92]并通过Sanger方法由Genewiz(苏州)测序样品。使用DNAMAN软件对齐和分析序列。此外,在线软件瑞士型号(https://swissmodel.expasy.org/)用于分析野生型'Ft'和突变体的三维蛋白质结构FSM2..
RNA提取,cDNA文库构建,和Illumina测序
在全绽放的阶段,五个野生类型的'ft'和五FSM1.选择的突变体。“金融时报”的成熟的花蕾内和突变雌蕊FSM1.植物随机选择和混合;混合样品用作一个生物复制品。三个独立的生物复制的'英尺'和FSM1.使用突变体。
使用追踪制造商的指示,使用Trizol Kit(Invitrogen,USA)提取六个样品的总RNA。使用Nanodropnd-1000分光光度计(Nanodrop,USA)检查总RNA的质量和纯度,使用Agilent 2100 BioAnalyzer(Agilent,USA)检测完整性。
六个样品被指定为FT1,FT2和FT3('ft')和M1,M2和M3的三种生物重复(突变体的三种生物重复FSM1.). 从六个样本中收集等量的总RNA用于RNA-Seq文库的构建。使用Novogene(中国北京)的Illumina novaseq-PE150测序平台对6个cDNA文库进行测序。
RNA-Seq分析、差异基因表达和功能富集分析
清洁读数被映射到芸苔属植物参考基因组(http://brassicadb.org/brad/datasets/pub/genomes/brassica_rapa/v3.0/)使用HISAT2软件。
每千碱基每百万碎片(FPKM)值及DESeq软件[93用于分析差异基因表达。DEG筛选标准被定义为具有A | log2(折叠变化)| > 1和P.- value <0.05。显著富集的GO术语和使用该topGO和京都基因与基因组百科(KEGG)数据库,分别进行分析DEGS的KEGG通路。
RT-QPCR分析
选择与胚珠开发相关的二十四个基因进行RT-QPCR分析,并使用Primer Premier 5.0软件设计基因特异性引物。引物序列列于附加文件中9.:表S8。'ft'和突变体的cdnasFSM1.使用超薄混合物试剂(CWBIO,中国)和Quantstudio 6 Flex实时PCR系统(ABI,USA)作为RT-QPCR的模板,用作RT-QPCR的模板。根据制造商的说明使用反应系统和程序。2-ΔΔct方法计算相关基因表达水平[94].施和18s rrna被用作内部控制[95].所有反应均用三种技术和生物学重复进行,使用OriginPro8.0分析数据。使用该水平确定0.05级的显着差异T.- 使用SPSS 16.0软件。
可用性数据和材料
支持结果和结论的数据图表包含在文章和附加文件中。转录组测序数据已在登录号GSE147438下沉积在NCBI基因表达式OMNIBUS(GEO)数据库中(https://www.ncbi.nlm.nih.gov/geo).
缩写
- EMS:
-
甲磺酸乙酯
- DH:
-
双单倍体
- IAA:
-
养阴
- CK:
-
cytokinin.
- GA:
-
赤霉素
- 美国律师协会:
-
脱盐酸
- eth:
-
乙烯
- BR:
-
芸苔类固醇
- 青年成就组织:
-
茉莉酸
- SA:
-
水杨酸
- SNP:
-
单核苷酸多态性
参考文献
- 1.
李硕,杨立,邓QM,王Sq,吴FQ,李鹏,李普型稻米雌性无菌突变体的表型表征。J Intent Plant Biol。2006; 48:307-14。
- 2.
Bencivenga S,Colombo L,Masiero S.孢子体和兆腔间在胚珠发育过程中的交叉谈。性植物团体。2011; 24:113-21。
- 3.
Tedder A,Helling M,Pannell Jr,Shimizu-Inatsugi R,Kawagoe T,Van Campen J,Sese J,Shimizu KK。与克隆繁殖增加相关的雌性无菌表明雄性腺和群体中的一种独特的组合和人口中的无性繁殖Cardamine amara(十字花科).Ann Bot。2015; 15:763-76。
- 4.
魏B,张俊,庞卡,俞h,郭d,姜h,丁m,陈z,陶q,ug h,曲lj,qin g.的分子机制Sporocyteless /喷嘴在控制中拟南芥胚珠发育。Cell Res.2015年;25:121–34.
- 5.
贝克SC,罗宾逊啤酒K,Villanueva JM,Gaiser JC,Gasser CS。调节胚珠发育的基因之间的相互作用拟南芥. 遗传学。1997;145:1109–24.
- 6.
周慧聪,金升,李继,王XJ。改变胚胎囊突突变体的胚囊形成期间的调用沉积(mp1) 在苜蓿. Genet Mol Res.2016年;15:15027698.
- 7.
singh sk,kumar v,srinivasan r,ahuja ps,bhat sr,bhat sr,sreenivasulu y。该TRAF介导的配子发生进展(轨道滑动)该基因是大孢子母细胞和配子体发育所必需的。植物生理学。2017;175:1220–37.
- 8.
Lee JJ,Hassan OSS,Gao W,Kohel RJ,Wei Ne,Kohel RJ。棉赤裸种子突变体的发育和基因表达分析。Planta。2006; 223:418-32。
- 9.
nonomura k,morohoshi a,nakano m,Eiguchi m,miyao a,hirochika h,kurata n。一种生殖细胞特异性基因ARGONAUTE家庭对大米孢子发生过程中的预见型有丝分裂和减数分裂的进展至关重要。植物细胞。2007; 19:2583-94。
- 10
滕抄送、杜哲、肖丽、于秋林、尚国祥、赵自刚。定位和鉴定候选基因(Bnmfs公司),通过油菜全基因组重测序和RNA-Seq (甘蓝型油菜l .)。前植物SCI。2017; 8:2086。
- 11.
赵y,张yz,王lj,王克,徐w,gao xy,刘bs。玉米无丝突变体的测绘和功能分析SK-A7110. 前植物科学。2018;9:1227.
- 12.
刘白,黄静脉,刘泽,娄tx,棕褐色,王毅,冯h.一个畸打突变无菌APETALA导致大白菜中的女性无菌性(油菜SSP。pekinensis.).植物团体。2019; 32:217-28。
- 13.
Kubo T,Fujita M,Takahashi H,Nakazono M,Tsutsumi N,Kurata N.激光微粉分离出水稻中显影胚珠的转录组分析。植物细胞生理。2013; 54:750-65。
- 14.
傅哇,赵紫,葛xh,丁l,李泽。女性无菌雌钙发育的解剖学和转录性分析甘蓝型油菜由一条来自orychophragmus violaceus.BMC基因组学。2014; 15:61。
- 15.
杨丽丽,吴勇,俞敏林,毛宝刚,赵斌,王建军。水稻雌不育胚珠全基因组转录组分析揭示了其败育机制。足底。2016;244:1011-28。
- 16.
陈少,张j,李hx,牛j,xue h,刘bb,王q,罗x,张fh,zhao dg,cao sy。转录组分析揭示了石榴花中女性无菌的候选基因。前植物SCI。2017; 8:1430。
- 17.
姚y,韩兰,锣Zx,郑cx,赵yy。RNA-SEQ分析揭示了女性肥沃和无菌胚珠的基因表达谱油松雌配子体游离核有丝分裂过程中的Carr。国际分子科学杂志。2018;19:2246.
- 18.
《花轮之战:控制花发育的遗传相互作用》。大自然。1991;353:31。
- 19.
Colombo L,Franken J,Koetje E,Van Gower J,Dons HJM,Angenent GC,Van Tunen AJ。Petunia Mads Box Gene FBP11决定了胚珠同一性。植物细胞。1995年; 7:1859-68。
- 20。
Theissen G.花卉器官身份的发展:来自疯子的故事。CurrOp植物BIOL。2001; 4:75-85。
- 21。
Pinyopich A,Ditta GS,Savide B,Liljegren SJ,Baumann E,WISMAN E,Yanofsky MF。评估豆皮和胚珠发育过程中疯子箱基因的冗余。自然。2003; 424:85-8。
- 22。
TheIßeng,萨德勒H.植物生物学:花卉四重奏。自然。2001; 409:469-71。
- 23。
蔡维克,陈赫。控制花卉形态发生的兰花疯子箱基因。SCI世界J. 2006; 6:1933-44。
- 24。
Galimba KD,Di Stilio Vs.在复制花器官身份基因后对胚珠发育的副官能化。Dev Biol。2015; 405:158-72。
- 25。
Reiser L,Modrusan Z,Margossian L,Samach A,Ohad N,Haughn GW,Fischer RL。这BEL1该基因编码一种同源结构域蛋白,参与细胞内的模式形成拟南芥胚珠原始。细胞。1995年; 83:735-42。
- 26。
Favaro R,Battaglia R,Kooiker M,Borghi L,DITTA G,Yanofsky MF,Kater MM,Colombo L. Mad-Box蛋白复合物控制Carpel和Ovule开发拟南芥.植物细胞。2003; 15:2603-11。
- 27。
vroemen cw,mordhorst ap,albrecht c,kwaaitaal macj,de vries sc。这杯状子叶3基因是边界和射击单位形成所必需的拟南芥.植物细胞。2003;15:1563 - 77。
- 28。
公园,郑洋Z,奥本海默DG,豪瑟BA。这相当少的种子2基因编码拟南芥调节胚珠发育的同源结构域蛋白质。发展。2005;132:841–9.
- 29。
Ó'MaoiléidighDS,Wuest SE,Rae的L,拉加内利A,莱恩PT,Kwasniewska K,达斯P,罗汉AJ,洛夫特斯B,Graciet E,在生殖花器官身份说明书的魏默尔F.控制拟南芥由C函数调节钦am. 植物细胞。2013;25:2482–503.
- 30
Goncalves B,Hasson A,Belcram K,Cortizo M,Morin H,Nikovics K,Vialette-Guiraud A,Takeda S,Aida M,Laufs P,Arnaud N.一种守恒的作用的杯状容器子叶胚珠发育过程中的基因。工厂J. 2015; 83:732-42。
- 31
Krizek Ba,Prost V,Macias A.安特古门塔促进花瓣身份并充当负调节因素钦am.植物细胞。2000;12:1357 - 66。
- 32
Balasubramanian S,Schneitz K.喷嘴在胚珠开发期间链接近端 - 远端和Adaxial-Zaxial图案形成拟南芥.发展。2002; 129:4291-300。
- 33
Gross-Hardt r,Lenhard M,Laux T.乌塞尔在区域间通信中的信令函数拟南芥胚珠开发。基因开发。2002; 16:1129-38。
- 34
Bencivenga S,Simonini S,BenkováE,科伦坡L.转录因子BEL1和SPL.细胞分裂素和生长素信号在胚珠发育过程中是必需的拟南芥.植物细胞。2012;24:2886 - 97。
- 35.
Schneitz K,Baker Sc,Gasser Cs,Redweik A.花香组织过程中的图案形成和生长,休伦罗斯和安特古门塔形成胚珠原始的近端区域所必需的拟南芥.发展。1998;125:2555 - 63。
- 36.
Villanueva JM,Broadhvest J,Hauser Ba,Meister RJ,Schneitz K,Gasser CS。内部没有外部调节排骨 - adaxial图案化拟南芥胚珠。基因开发。1999年; 13:3160-9。
- 37.
Skinner DJ,Hill Ta,Gasser Cs。胚珠发育的调节。植物细胞。2004; 16:S32-45。
- 38.
棕色RH,Nickrent DL,Gasser CS。胚芽体减少胚珠中的胚珠和整形相关基因的表达。evol dev。2010; 12:231-40。
- 39.
郎JD,雷S,雷A.sin1一种影响女性生育能力的基因突变拟南芥,互动mod1.,它的隐性修饰符。遗传学。1994年; 137:1101-10。
- 40。
Gaiser JC,Robinson-BEERS K,Gasser CS。这拟南芥超人基因介导胚珠外形的不对称生长。植物细胞。1995年; 7:333-45。
- 41。
施耐茨·K.胚珠发育的分子和遗传控制。植物生物学,1999;2:13-7。
- 42。
Gifford ML,Dean S,Ingram GC。这拟南芥ACR4基因在胚珠整数和萼片边缘开发期间在细胞层组织中发挥作用。发展。2003; 130:4249-58。
- 43。
McAbee JM,Hill Ta,Skinner Dj,Izhaki A,Hauser Ba,Meister RJ,Venugopala Reddy G,Meyerowitz Em,Bowman JL,Gasser CS。异常testashape.编码一个Kanadi.家庭成员,将极性决定与分离和成长联系起来拟南芥ovule整形。工厂J. 2006; 46:522-31。
- 44。
黄静脉,刘泽,李海,姚瑞,李丹,刘WJ,冯H.雌性无菌突变体的转录组分析(FSM.)在大白菜(油菜SSP。pekinensis.).正面。植物SCI。2017; 8:546。
- 45。
Byzova MV, Franken J, Aarts MGM, de almeada -Engler J, Engler G, Mariani C, Van Lookeren camqne MM, Angenent GC。Arabidopsis无菌Apetala.,多功能基因调节花序,花和胚珠发育。基因开发。1999年; 13:1002-14。
- 46。
王Z、李N、江S、冈萨雷斯N、黄X、王Y、因泽德、李Y。超临界流体SAP通过针对PPD蛋白质进行降解来控制器官尺寸拟南芥. 自然公社。2016;7:11192.
- 47。
Marsch-Martínezn,De Folter S.激素控制古氏纤维的发展。CurrOp植物BIOL。2016; 29:104-14。
- 48。
Gomez Md,Barro-Trastoy D,伊斯康普e,Saura-Sanchez M,Sanchez I,Briones-Moreno A,Vera-Sirera F,Carrera e,Ripoll J,Yanofsky MF,Lopez-Diazi,Alonso JM,Perez-Amador Ma.赤霉素对植物中的胚珠数量负面调节。发展。2018; 145:163865。
- 49。
张CW,陈财年,赵ZY,胡LL,刘HQ,程ZH,翁YQ,陈平,李YH。在突变cspId.编码Ser / Thr蛋白激酶是黄瓜中的圆形叶片形状(Cucumis sativusL.)。理论应用基因。2018;131:1379–89.
- 50。
Lee G,Piao R,Lee Y,Kim B,SEO J,Lee D,Jang S,Jin Z,Lee C,Chin JH,Koh HJ。鉴定和表征大胚胎,一种控制水稻中胚胎大小的新基因(水稻l .)。大米。2019;12:22。
- 51。
Li N, Liu Z, Wang Z, Ru L, Gonzalez N, Baekelandt A, Pauwels L, Goossens A, Xu R, Zhu Z, Inzé D, Li Y。无菌APETALA调节阻遏蛋白复合物的稳定性以控制体内器官的大小拟南芥.Plos Genet。2018; 14:E1007218。
- 52。
Sicard A、Kappela C、Lee YW、Woźniak NJ、Marona C、Stinchcombe JR、Wright SI、Lenhard M。组织特异性增强子的持续遗传变异是人类自交综合征进化的基础Capsella..美国国家科学院科学Proc美国.2016; 113:13911-6。
- 53
杨敏,刘海克,赵杰,潘yp,cheng sy,lietzow镭射唱片,文尔,张xl,翁yq。LittlEleaf(LL)编码与黄瓜的器官尺寸变化相关的WD40重复域的蛋白质。植物J. 2018; 95:834-47。
- 54
陆希,曹JS,于XL。参与雌蕊发育的基因调控。中国J细胞生物学。2009;30:63–8.
- 55
Sun HL,Song J,Gao Zh,Ni ZJ,张Z.MM knat2基因的隔离与表达分析。科学科学版。2014; 47:3444-52。
- 56
鲍曼JL,德鲁兹GN,迈耶罗维茨EM。的表达拟南芥植物同源转化基因钦am仅限于花发育后期的特定细胞类型。植物细胞。1991;3:749–58.
- 57
MADS重装:进化的钦am亚家族基因。新植物。2014; 201:717-32。
- 58
Dreni l,奥斯纳托m,kater mm。米饭的内部和出水钦am亚科。摩尔。2013;6:650 - 64。
- 59.
Alvarez-Buylla ER, Liljegren SJ, Pelaz S. S. MADS-box基因在花外的进化:花粉、胚乳、保卫细胞、根和毛状体的表达。植物j . 2000; 24:457 - 66。
- 60。
珠心能告诉我们什么。植物细胞。2016;28:1234。
- 61。
Mizukami Y,Fischer RL。植物器官尺寸控制:安特古门塔在有机组织中调节生长和细胞数。Proc Natl Acad Sci U S A. 2000; 97:942-7。
- 62。
Cucinotta M,Colombo L,Roig-Villanova I. Ovule Development,侧向器官形成的新模型。前植物SCI。2014; 5:117。
- 63。
Elliott RC, Betzner AS, Huttner E, Oakes MP, Tucker WQ, Gerentes D, Perez P, Smyth DR。安特古门塔, 一个APETALA2- 麦基基因拟南芥在胚珠发育和花器官生长中起多效性作用。植物细胞。1996;8:155 - 68。
- 64。
Klucher KM、Chow H、Reiser L、Fischer RL。这个安特古门塔基因拟南芥胚珠和女性配子体发育所需的是与花卉归属基因有关APETALA2.植物细胞。1996年; 8:137-53。
- 65。
Brambilla V,Battaglia R,Colombo M,Masiero S,Bencivenga S,Kater MM,Colombo L.遗传和分子相互作用贝尔1.和疯子盒子因素支持卵子发展拟南芥.植物细胞。2007; 19:2544-56。
- 66。
Galbiati F ., Roy DS ., Simonini S ., Cucinotta M ., Ceccato L., Cuesta C ., Simaskova M ., Benkova E ., Kamiuchi Y ., Aida M ., Weijers D ., Simon R ., Masiero S ., Colombo L.,一种控制胚珠原基形成的综合模型。植物j . 2013; 76:446-55。
- 67。
鲍曼JL,Smyth Dr。螃蟹爪子,一种调节Carpel和Nentary发展的基因拟南芥,编码一种具有锌指和螺旋环结构域的新蛋白。发展。1999;126:2387–96.
- 68。
Horiguchi G,Ferjani A,Fujikura U,Tsukaya H.细胞增殖和细胞扩张的协调控制叶片尺寸拟南芥.j植物res。2006; 119:37-42。
- 69。
Randall Rs,Sornay E,Dewitte W,Murray Jah。安特古门塔d型细胞周期蛋白CYCD3;1独立有助于控制花瓣大小拟南芥:器官大小补偿是一种突发性而非确定性的证据。J实验机器人。2015;66:3991–4000.
- 70。
Krizek英航。异位表达安特古门塔在拟南芥植物的结果是增加花器官的生长。德夫吉内特。1999;25:224–36.
- 71。
Czesnick H,Lenhard M.尺寸控制在植物和鲜花的课程中。冷泉harb持猪肉。2015; 7:A019190。
- 72。
胡y,谢a,chua nh。这拟南芥生长素诱导基因argos.控制横向器官尺寸。植物细胞。2003; 15:1951-61。
- 73。
Krizek英航。安特古门塔和aintegumenta lik6.滥用职权拟南芥花的生长和图案。植物生理学。2009;150:1916–29.
- 74。
Krizek BA、Bequette CJ、Xu K、Blakley IC、Fu ZQ、Stratmann J、Loraine AE。RNA序列链接安特古门塔和aintegumenta lik6.到细胞壁改造和植物防御途径拟南芥. 植物生理学。2016;171:2069–84.
- 75。
Nole-Wilson S,Tranby T,Krizek Ba。Aintegumenta样(AIL)基因在年轻的组织中表达,可以指定共同或部门主管国家。植物mol biol。2005; 57:613-28。
- 76。
尼古拉斯M,古巴P.第16章:作用传输控制协议塑造花卉结构,叶形形态和植物建筑的转录因子。in:gonzalez dn,编辑器。植物转录因子 - 进化,结构和功能方面。剑桥:英格兰学术出版社;2016. p。249-67。
- 77。
吴MF,天Q,芦苇JW。拟南芥microRNA167控制模式ARF6和ARF8.表达并调节女性和男性繁殖。发展。2006; 133:4211-8。
- 78
布阿莱姆A、费尔甘尼M、费尔南德斯R、特罗阿德克C、马丁A、莫林H。一种乙烯生物合成酶的保守突变导致了甜瓜雄性单胞体。科学。2008;321:836–8.
- 79
Nole-Wilson S,Rueschhoff Ee,Bhatti H,Franks RG。协同中断Seuss Cyp85a2.双突变体显示雌蕊和胚珠发育过程中芸苔素合成的作用。BMC植物BIOL。2010; 10:198。
- 80。
MARSCH - 马丁内斯N,拉莫斯 - 克鲁兹d,雷耶斯-Olalde JI,洛萨诺-索托马约尔P,苏尼加梅奥VM,DE Folter S.期间细胞分裂素作用拟南芥雌蕊和水果形态和模式。植物杂志2012; 72:222-34。
- 81。
Pagnussat GC,Alandeete-Saez M,Bowman JL,Sundaresan V.依赖依赖的图案化和配子规范拟南芥雌性配子体。科学。2009; 324:1684-9。
- 82。
歌曲yl,王l,xiong lz。综合表达分析分析Osiaa.发育过程中的基因家族及其对植物激素和胁迫处理的响应。足底。2009;229:577 - 91。
- 83。
和记黄光裕、李杰、阿盖索C、冈萨雷斯M、李E、刘易斯MW、麦克斯韦BB、珀杜TD、沙勒GE、阿隆索JM、小埃克、基伯JJ。这个拟南芥组氨酸磷光酯蛋白质是细胞蛋白信号传导的多余阳性调节剂。植物细胞。2006; 18:3073-87。
- 84。
Bartriine I,Otto E,Strnad M,Werner T,SchmüllingT.Cytokinin调节生殖分泌品,花器官尺寸,卵子形成的活性,从而进行种子产量拟南芥.植物细胞。2011; 23:69-80。
- 85。
Kinoshita-Tsujimura K,Kakimoto T.孢子体中的孢子素素受体对于男性和女性功能至关重要拟南芥.植物信号行为研究2011;6:66-71。
- 86。
苏尼加·梅奥、雷耶斯·奥拉尔德、马什·马丁内斯、德·弗尔特。细胞分裂素处理可影响牙槽骨的根尖-基底模式拟南芥吉诺菌,类似于极性养羊酸输送抑制的影响。前植物SCI。2014; 5:191。
- 87。
Yamasaki S,Fujii N,Takahashi H.乙烯作用对黄瓜植物性别测定的特征。性植物团体。2003; 16:103-11。
- 88。
De Martianis D,Mariani C.乙烯形成酶的沉默基因表达导致转基因烟草植物中的胚珠发育的可逆抑制。植物细胞。1999; 11:1061-71。
- 89。
Licausi F、Ohme Takagi M、Perata P。APETALA2/乙烯反应因子(AP2/ERF)转录因子:应激反应和发育程序的介质。新植物醇。2013;199:639–49.
- 90。
Gomez MD,Ventimilla D,Sacistan R,Perez-Amador Ma。Gibberellins通过干扰转录因子来调节胚珠整数开发美国胸科协会. 植物生理学。2016;172:2403–15.
- 91。
黄森,刘志勇,李大勇,姚丽萍,孟q,冯慧。中国大白菜种质资源的筛选60孤立的微孔培养的共射线诱变。植物品种。2014; 133:480-8。
- 92。
黄森,刘志勇,姚丽萍,李大勇,张涛,李旭,侯磊,王艳红,唐晓燕,冯慧,一种花瓣变性突变体候选基因预测方法,中国生物医学工程学报,2015,34 (1):1 - 5PDM,大白菜(芸苔,SSP。pekinensis.)通过精细定位和转录组分析。摩尔品种。2016;36:26.
- 93。
Anders S,Huber W.序列计数数据的差异表达分析。基因组Biol。2010; 11:R106。
- 94。
Livak KJ,Schmittgen TD。应用实时定量PCR和2-ΔΔct方法。方法。2001; 25:402-8。
- 95。
黄斯,彭莱,刘泽,李海,棕褐色,姚rp,李诗,李x,侯l,冯h。与雄性不育突变体相关的基因的调查(MSM)在大白菜(油菜SSP。pekinensis.),使用RNA测序。Mol Gen Genomics。2020; 295:233-49。
致谢
我们要感谢编辑(www.editage.cn.)英语语言编辑。
资金
本研究得到中国国家自然科学基金(31801854)和中国农业部园艺作物生物学与遗传改良重点实验室开放项目(IVF201803)的资助。资金在研究的设计、数据的收集、分析和解释中发挥了作用。
作者信息
隶属关系
贡献
HF和SH设计了实验并监督了这项研究。SH和WL进行研究并撰写稿件。JX, ZL, CL参与了研究并对数据进行了分析。所有作者都认可了原稿。
作者的信息
2 .沈阳农业大学园艺系,辽宁沈阳110866
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者声明他们没有相互竞争的利益。
附加信息
出版商说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
在“FT”和FSM1.突变图书馆。
附加文件2:表S2。
通过比较的DEG列表FSM1.突变体和'ft'植物。
附加文件3:表S3。
特异性表达基因的列表FSM1.与“FT”植物中的突变体相比。
附加文件4:图S1。
去功能的工作分类FSM1.突变体和'ft'植物。
附加文件5:表S4。
显著丰富的氧化石墨烯术语FSM1.与“FT”植物中的突变体相比。
附加文件6:表S5。
二十个最具显着丰富的Kegg代谢途径。
附加文件7:表S6。
参与植物激素信号转导途径的DEG。
附加文件8:表S7。
底漆braa04g009730.3c编码序列。
附加文件9:表S8。
用于RT-QPCR分析的引物序列。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
黄松,刘伟,徐军。等等。这SAP在大白菜中的两个等位基因突变证明了雌蕊发育的功能(Brassica Rapa.L. SSP。pekinensis.).BMC植物杂志20,538(2020)。https://doi.org/10.1186/s12870-020-02741-5
收到:
公认:
发表:
关键词
- 大白菜
- 雌性不育
- 无菌APETALA
- RNA-SEQ.
- EMS诱变