摘要
背景
病毒是感染性病原体,植物病毒流行病可以对作物产量和质量具有毁灭性的后果。甘蔗花叶病毒(SCMV,属于家庭Potyviridae)是每年影响甘蔗作物的主要病原体之一。为了对抗病原体的攻击,植物产生反应性氧物种(ROS)作为第一道防线,其通过良好组织的抗氧化清除途径实现了复杂的平衡。
结果
在这项研究中,我们研究了抗SCMV(B-48)和感病(Badila)甘蔗基因型的ROS相关和ROS解毒途径在转录组水平上的变化甜根子草L.基因组组装作为参考基因组。转录组数据强调了SCMV致病后Badila基因型中的ROS生产基因如NADH氧化酶,母酸脱氢酶和黄素结合单氧基酶的显着上调。为了清除ROS,Badila Genotype示出了抗氧化剂的显着增强,即谷胱甘肽S-转移酶(GST),与其抗性对应相比。GST应该是植物对病原体攻击的关键指标。与Badila相比,B-48中的GST表达显着降低了GST表达,表明该基因型中的抗性的发展。此外,我们表征了赋予B-48抗性的关键转录因子(TFS)。其中Wrky,AP2,NAC,BZIP和BHLH显示出B-48基因型中的增强表达。我们的结果还证实转录组数据与酶和QPCR数据的联系。超氧化物歧化酶,过氧化氢酶,抗坏血酸过氧化物酶和苯丙氨酸氨酶的酶活性估算支持转录组数据和B-48基因型中的更高抗性。
结论
目前的研究支持B-48基因型在SCMV感染下的有效性。此外,比较转录组学数据已被提出,以强调重要的转录因子赋予抗这种基因型的作用。本研究为甘蔗防卫机制的表达谱分析提供了深入的知识。
背景
当然,植物受到许多病原体如细菌,病毒和真菌的持续感染威胁。其中,病毒是迫使细胞内寄生虫,这导致每年造成巨大的损失和质量。甘蔗花叶病毒(SCMV),高粱花叶病毒(SrMV),以及甘蔗条纹花叶病毒(SCSMV)是甘蔗的主要病原体。这些病毒导致甘蔗作物的马赛克病导致显着的产量损失。在中国,甘蔗率衰退,Pokkah Boeng,Smut,Mosaic和其他疾病负责甘蔗产量减少高达20%[1.].
植物已经进化了多种策略来规避致病感染。对这些迫使细胞内寄生虫的第一道防线是反应性氧(ROS)的快速产生,例如,,过氧化氢(H2.O2.)和超氧化物阴离子(o- 2)[2.](附加文件)1.:图S1)。叶绿体是主要细胞器,其中在光合电子传输链期间生产ROS [3.,4.].此外,它们也在有氧呼吸期间和在光呼吸期间在过氧化物中产生的线粒体[5.,6.,7.]. ROS作为一种信号分子,在植物生长和防御机制中起着至关重要的作用,因为它们参与了植物细胞产生抗氧化剂的过程[8.,9]. 在受感染的植物中,积累的ROS起着双重作用。它们可以提高致病细胞的程序性细胞死亡(PCD),并将入侵的病原体限制在感染部位。然而,在高浓度下,活性氧是极其有害的,并可能最终导致破坏细胞内稳态。活性氧产生的增加可通过脂质过氧化、蛋白质氧化、核酸降解、酶抑制和PCD途径的启动引起细胞损伤,最终导致细胞死亡[10.,11.,12.,13.].
通过良好组织的抗氧化系统进行SCHAVENTING或SOFEET ROS浓度的解毒,由非酶促和酶抗氧化剂构成。酶促抗氧化剂包括过氧化酶(CAT,EC 1.11.1.6),超氧化物歧化酶(SOD,EC 1.15.1.1),GuaiaCol过氧化物酶(GPX,EC 1.11.9),脱氢血基酸盐还原酶(DHAR,EC 1.8.5.1),单羟基血基酸盐还原酶(MDAR,EC 1.6.5.4),抗坏血酸过氧化物酶(APX,EC 1.11.11)和谷胱甘肽还原酶(GR,EC 1.8.1.7)[14.].虽然,抗坏血酸,谷胱甘肽(GSH),生育酚,酚类和类胡萝卜素被认为是细胞内的有效的非酶促抗氧化剂。在抗氧化防御机制中,SOD催化氧自由基转化为H.2.O2.,后来通过猫,豆荚和APX酶催化的生化反应将其降低到水和分子氧。通过抗氧化防御系统的这些转换保护细胞膜免受氧自由基损伤[15.].
植物正链RNA病毒[(+)RNA病毒]是寄生虫。它们的繁殖依赖于宿主的蛋白质因子和代谢物[16.,17.].虽然ROS突发与有效的植物病毒感染和疾病引发有关,但ROS影响病毒感染的机制尚未被广泛逮捕。已经确定了阳性感测RNA病毒(+ sRNA)取决于宿主蛋白机械进行复制[18.]. 随后,一旦病毒劫持了植物的细胞机制,ROS就会在植物体内爆发。Hyodo等人[16.]调查红三叶坏死花叶病毒(RCNMV)感染,并提出烟草由RCNMV复制蛋白触发,促进病毒复制并诱导细胞内ROS爆发。到目前为止,在SCMV感染后甘蔗在甘蔗中的致病性水平和ROS产生之间的相关性仅提供有限的数据。因此,有脚步需要探索ROS参与的地位以及SCMV感染后植物细胞的损害程度。
保持看来甘蔗基因组学和抗病机制数据的局限性,我们扩展了我们的研究,为SCMV抗性基因型中的抗氧化防御系统提供了深入。以前,我们通过SCMV菌株E的粒子轰击开发了转基因甘蔗线,SCMV菌株E的粒子轰炸,命名为B-48。转基因B-48线对SCMV感染具有高度抗性,具有较高的光合活动[19.]. 在本研究中,我们比较了野生型(Badila)和转基因(B-48)基因型,以了解在转录和酶水平上防御反应的调节。本研究的目的是进行比较分析,以评估活性氧的产生和抗氧化防御系统。本研究将为甘蔗SCMV的致病性及防御相关途径的研究提供有价值的信息。
结果
甘蔗感染SCMV病毒后活性氧的产生
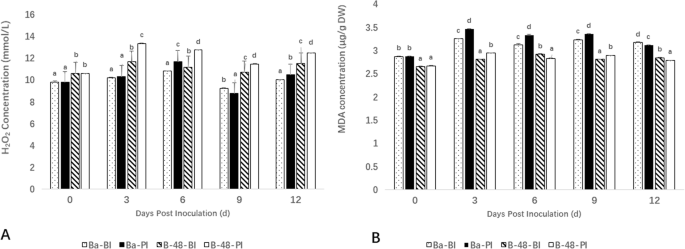
确定ROS生产,H2.O2.对Badila和B-48基因型进行了含量测定。为了评估B-48转基因对SCMV致病性的抗性水平,我们估计了H2.O2.在接种前(BI)之前的基因型(BI)以及接种后(PI)的生产。
据观察,一开始,H急剧增加2.O2.与Badila相比,B-48基因型含量较低,直到第3天。然而,H2.O2.巴迪拉基因型在第6天略有增加。在第9天,H下降幅度最大2.O2.两种基因型的含量。此外,在第12天时,H略有增加2.O2.两种基因型中的含量,但与第3天和第6天相比较低(图。1.一种)。
SCMV感染后的脂质过氧化反应
通过估计丙二醛(MDA)含量来确定脂质过氧化水平。明显的是,接种后的Badila(PI)与接种前的Badila,B-48(Bi)和B-48(PI)样品中的MDA水平较高。SCMV感染在Badila(PI)样本中的最大细胞损伤在第3天引起,这是从其MDA水平明显的。转基因系的MDA含量相对较低,特别是在测量的第6个,第9天和第12天,表明脂质过氧化较少,归因于对SCMV诱导应力的基因型耐受性(图。1.b)。
ROS生产和ROS清除途径的基因表达分析
由于不可用的Saccharum OfficinArum.L基因组序列,我们用甜根子草L.数据库作为参考基因组[20.].然而,这篇文献的主要限制是基因组大小从10个基本染色体数目减少到8个甜根子草基因组。尽管基因组减少,总体参考序列数据库代表69-74%的对齐率(附加文件2.:表S1)。我们使用京都基因和基因组百科全书(KEGG)网络数据库对ROS和抗氧化基因进行注释。采用KEGG自动标注服务器(KAAS)和KEGG绘图在线工具对KEGG数据库描述进行标注和绘制。在Badila和B-48基因型中,我们共鉴定了757个与ROS和抗氧化防御相关通路相关的转录本3.:表S2)。
在胁迫条件下,植物细胞通过各种抗氧化防御系统清除过多的ROS。抗氧化防御机制可分为两类,即。酶和非酶系统。在目前的研究中,我们将已鉴定的转录物分为ROS产生和ROS清除两类。在757个转录本中,329个与ROS产生直接或间接相关,428个参与ROS清除途径。抗氧化防御途径又分为两组,其中399个转录子参与非酶途径,29个转录子参与酶途径。
SCMV感染前后Badila和B-48中ROS基因的转录谱比较
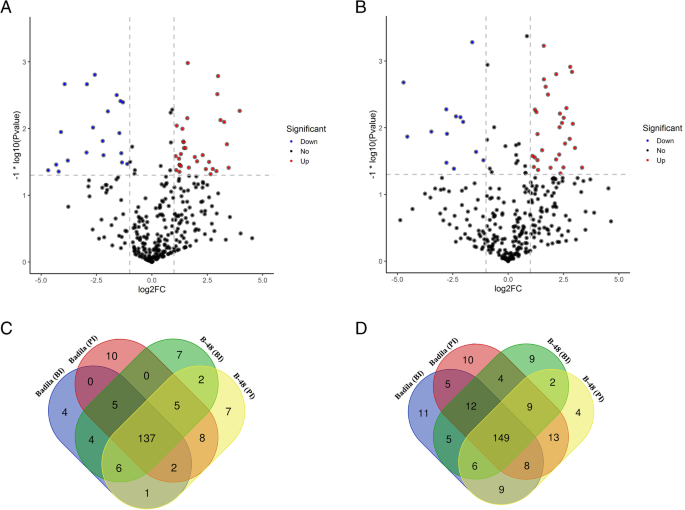
为了了解Badila和B-48基因型SCMV感染的机制,我们比较了SCMV感染前后的转录谱。在错误发现率(FDR)中,差异表达被认为是显著的 < 0.05和折叠变化> 2.差异基因表达分析表明,SCMV致病性干扰了329个与ROS产生相关的差异表达基因(DEGs)。在已鉴定的DEGs中,32个表达上调,25个表达下调,而272个基因型在SCMV感染后Badila和B-48基因型中没有表现出明显的差异反应(图。2.一种)。
Badila和B-48(SCMV感染前后)抗氧化基因转录谱的比较研究
我们对Badila和B-48基因型在SCMV感染前后的抗氧化基因转录谱进行了比较。该分析有助于确定FDR处的DEG数量 < 0.05和折叠变化> 2.SCMV感染引起Badila和B-48中197个抗氧化剂相关DEGs的差异表达,其中只有5个DEGs表达上调,20个表达下调。剩下的172个并不代表显著的差异反应(图。2.b)。
在Badila和B-48之前鉴定了与ROS和抗氧化途径相关的独特和共同转录物的数量,并在SCMV感染后鉴定出来。有趣的是,137 ROS-生成(图。2.c) 和149 ROS清除(图。2.d)转录本由Badila和B-48基因型共享。而在ROS生成途径上,Badila和B-48基因型中分别有14和16个unigenes是唯一的。而Badila和B-48基因型中分别有26和15个unigenes在ROS清除途径中具有独特性。
ROS响应SCMV感染的ROS产生转录物的差异基因表达分析
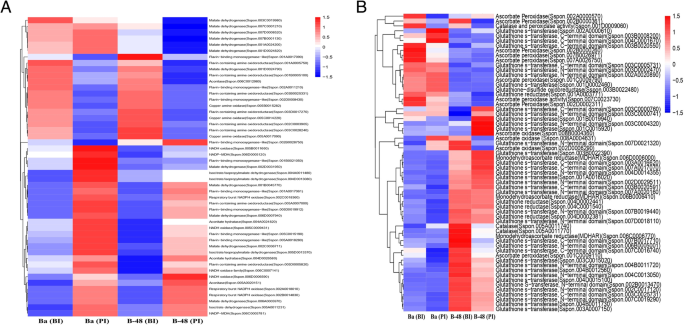
为了评价SCMV感染的效果,我们对Badila和B-48基因型进行了比较基因表达谱分析,并区分了产生ROS的DEGs。选择了大约49个高度分化的deg进行基因表达分析(图。3.一种)。在曝光病毒后,Badila和B-48上调了不同的种子生成基因。Badila基因型上调了28个ungenenes,而B-48仅上调22.接种后(PI)Badila显示出增强的NADPH氧化酶的四个unigenes的表达,Flavin结合单氧基酶的四种雌醛结合单氧化酶,其中5个苹果酸脱氢酶,其中两种NADP-MDH,四个甲酸四种,两种含有黄素的胺氧化还原酶,两种穴位水合酶,以及辅菌酶Unigene之一。类似地,接种后B-48(PI)表现出NADPH氧化酶的三种植物的增强表达,五种黄素结合单氧基酶,四种苹果酸脱氢酶,NADP-MDH,含有两种含香精胺氧化还原酶,Aconitate水合酶和aconitase Unigene之一。
负责ROS清除途径的DEGS响应SCMV感染
为了检查SCMV感染对ROS清除途径的影响,系统地分析了与抗氧化剂相关的DEG。研究了大约61只与抗氧化防御途径有关的基因表达分析(图。3.b)。
在SCMV胁迫下,Badila使38degs的表达量最大化。其中25个DEGs与GST有关,3个DEGs与谷胱甘肽还原酶有关,3个DEGs与单脱氢抗坏血酸还原酶(MDHAR)有关,2个DEGs与抗坏血酸过氧化物酶、抗坏血酸氧化酶和过氧化氢酶有关,1个DEGs与过氧化氢酶和过氧化物酶活性有关。相反,B-48显示出与抗氧化剂相关的少量DEG的增加。上调的单基因包括26个GST,3个谷胱甘肽还原酶,2个单脱氢抗坏血酸还原酶(MDHAR),1个抗坏血酸氧化酶和过氧化物酶。
参与植物病原体防御机制的转录因子(TFs)的表达谱分析
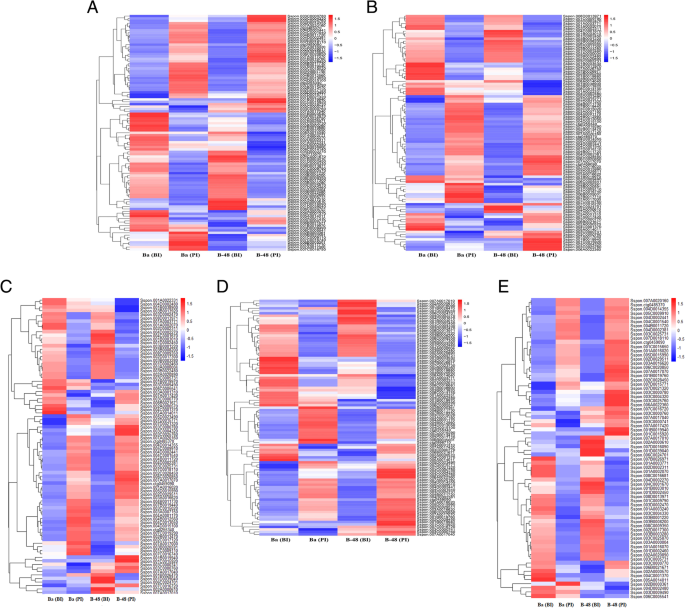
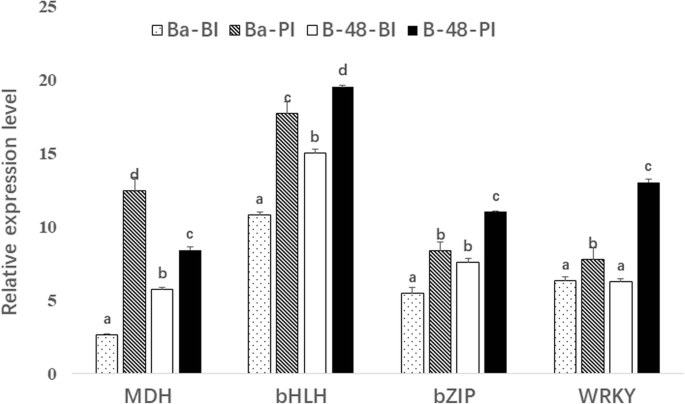
转录组分析用于鉴定参与抗SCMV感染防御反应的转录因子。我们鉴定了五种不同类型的转录因子,它们主要与抗病毒防御机制有关,如AP2、WRKY、HLH、NAC和ZIP。转录组分析显示许多WRKY基因在SCMV感染后表达(图。4.a) 是的。共鉴定出304个WRKY基因;其中随机抽取52个deg进行基因表达分析。结果发现,在SCMV感染后,B-48表达上调约40个DEGs,而在Badila,B-48表达上调约32个DEGs。
我们还分析了AP2转录因子,这使得最大的TF系列之一。已知AP2 TF将参与免受许多植物病原体的防御机制。为了了解AP2基因表达和抗病抗性之间的相关性,我们进行了所选段的表达谱。从转录组数据中鉴定了总共404个AP2°(图。4.b) 是的。在确定的与AP2相关的DEG中,我们选择85 DEG进行热图分析。总的来说,与B-48(BI)、Badila(BI)和Badila(PI)基因型相比,暴露于SCMV后,B-48基因型的AP2-DEGs数量增加。
另一个在生物和非生物胁迫条件下发挥不同功能的转录因子家族是NAC家族。对于SCMV感染,我们发现总共88个NAC转录本(图。4.c).其中,B-48在病毒感染后上调了50个NAC DEGs,表明NAC DEGs的数量最多,从而产生抗SCMV感染的抗性。
此外,还分析了pZIP(Zrt/Irt-like Protein)家族的转录因子。与其他解剖的TFs一样,pZIP-TFs也参与植物防御机制。对于pZIP-TFs,我们总共确定了323度。其中83个DEGs在不同基因型间有差异表达。与其他参与病原体抗性的TFs的表达模式类似,pZIP转录物也在病毒感染后的B-48中显示出最大表达(图。4.d)。
同样,我们研究了碱性螺旋-环-螺旋(bHLH)转录因子家族,该家族在抵御病原体和对SCMV感染后的B-48基因型产生耐药性方面也起着重要作用。共发现119例bHLH-TFs相关deg。其中,只有72个高表达的bHLH-DEGs进行了基因表达谱分析(图。4.e)。我们发现,与Badila相比,B-48基因型示出了与Bhlh Degs的更大表达。在SCMV感染后,BHLH表达水平在B-48中高,表明BHLH次数与抗病机制的关联。
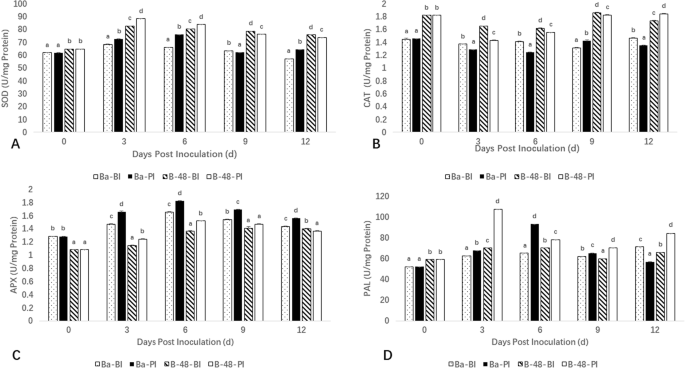
抗氧化酶活性的估算
对SOD,猫,APX和苯丙氨酸氨酶(PAL)进行抗氧化活性的估计,以研究对SCMV触发应激的基因型潜力。SOD的活性基本受到Badila和B-48基因型的SCMV感染的影响。在B-48基因型中的病毒感染后,SOD活性增加到第3天,然后在第6天,第9天连续降低。与在研究期间,观察到B-48样品中的SOD水平更高。然而,在Badila基因型的第6天在第6天看到最大SOD表达(图。5.一种)。
猫生产水平的测量描述了SCMV致病性显着影响了猫活动。猫活动是巴特达(PI)最低的第3和第6天的测量,并在第9天显着增加。发现B-48中的猫活动接近巴德拉的猫活动,在测量的第3,6,第9天和第12天几乎恒定生产(图。5.b)。
在Badila和B-48样本中也监测了APX活性的差异反应。与B-48 (BI)和Badila (BI)样本相比,B-48 (PI)和Badila (PI)样本的反应更高。APX在感染后第6天的表达量最高,随后在第9天和第12天急剧下降。5.C)。
PAL活性分析表明,B-48基因型SCMV感染后第3天PAL含量达到最高水平。相反,在巴迪拉(PI)样品中,PAL活性在测量的第6天表现出最高的表达。第9天,Badila(PI)和B-48(PI)PAL活性下降。然而,在第12天,巴迪拉(PI)的PAL活性仍然较低,而B-48(PI)的PAL产量几乎没有增加。在病毒感染之前,我们注意到Badila和B-48基因型中PAL的持续水平(图。5.D) 是的。
讨论
ROS在反应生物和非生物胁迫条件下发挥重要作用。在此,我们讨论了ROS和抗氧化防御机制在病原体感染期间的功能,突出了ROS与植物病原体抗性机制的ros连接转录因子的相互作用。此外,我们已经表明,B-48,转基因甘蔗品种是对SCMV的抗性,并在这种病毒感染后证明了降低的RO水平。
脂质过氧化的引发是氧化应激的另一个指标;它始于ROS生产高于阈值水平时。生物和非生物胁迫下的脂质过氧化在MDA的生产中延伸出来[21.]. 在这项研究中,我们观察到在H2.O2.和MDA内容,在B-48基因型中浓度持续下降。观察可能归因于B-48对SCMV的阻力,导致H的缓解2.O2.和MDA水平与相应的对照。这些发现与Radwan等人之前的报告一致[22.谁提到了更高的h2.O2.叶片MDA含量维亚比亚法瓦之后豆黄色马赛克病毒感染。
ROS在不同的发育阶段和不同的条件下,通过多种途径在多种植物组织中产生。ROS是由一组酶的活性形成的,包括细胞壁过氧化物酶、胺氧化酶、NADPH氧化酶、草酸氧化酶、脂肪氧化酶和醌还原酶[23.,24.].转录组学方法有助于解读SCMV感染应答中ROS产生和清除途径的遗传调控。在本研究中,SCMV感染后的Badila基因型中ROS的产生更为明显,表明ROS调节的DEGs的表达更高,这意味着受感染植物的细胞超微结构受到更多破坏,最终导致细胞死亡。相比之下,B-48基因型仅通过上调有限数量的ROS生成转录本来表现出对病毒感染的抗性。
这项研究强调了在SCMV感染后参与防御途径的抗氧化基因的差异表达模式。数据显示,在感染后,抗氧化防御机制被激活,以恢复氧化还原稳态。我们观察到在Badila基因型中GST的显著表达水平,而在B-48基因型中GST的表达水平相当低。先前的转录组学研究支持在细菌、真菌和病毒感染的早期阶段特异性GST组的显著诱导。同样,先前的蛋白质组学数据支持在病原体感染期间GST蛋白的上调。此外,有报道称GSTs的过表达和沉默显著降低了疾病的严重程度和病原菌的增殖[25.].
转录组学数据通过抗氧化酶分析得到进一步验证。在本研究中,在病毒感染初期提供防御的SOD活性在B-48基因型中迅速增加;PAL酶也是如此。此外,APX活性在ROS清除途径中也起着最重要的作用。如前所述,Badila和B-48基因型中APX表达增加表明对该病的耐受性增强[26.,27.]. 此外,CAT也是一种重要的酶,参与H2.O2..在整个研究期间,转基因基因型的CAT含量较高。接种病毒后,这两种基因型的CAT活性均下降,这与植物病原系统的早期报道相似[27.,28.,29.,30.].
转录因子是DNA结合蛋白。其中许多是植物防御机制的重要组成部分。诸如WRKY,APETALA2(AP2),碱性域亮氨酸 - 拉链(BZIP),NAM / ATAF / CUC(NAC)和BHLH的转录因子与植物病原体抗病机制有关[31.,32.,33.].总体而言,在这项研究中,我们在暴露于SCMV后,在B-48基因型中的防御相关转录因子表达时,我们确定了越来越大的趋势。
WRKY是最大的转录因子家族之一,其个体成员在植物防御系统中起着重要作用。此前,已有报道WRKY8基因突变导致了肿瘤的蓄积和全身感染烟草花叶病毒(TMV)拟南芥树叶。WRKY8基因通过上调脱落酸(ABA)信号通路而下调乙烯信号通路增强抗病毒防御系统[34.].涉及防御途径的另一家TFS是AP2。以前的研究表明,AP2激活与防御相关基因,例如植物防御素1.1 / 1.2(PDF 1.1 / 1.2)[35.].
在病毒感染后,植物中TFs的NAC家族的表达也受到调控。根据Nuruzzaman等人的报告[36.]在病原菌侵染后,水稻植株上调了26个NAC-TFs,从而产生了对水稻的抗性水稻条纹病毒和稻竹球形病毒.另一种众所周知的TF系列是Bzip,存在于所有真核生物中。除了调节种子发育,花卉形成和各种生物和非生物胁迫等各种生物过程,还是植物防御机制的重要组成部分[37.]. 参与植物防御的bZIP-TF被称为TGA,它与NPR1相互作用,进而上调PR基因[38.,39.].该TF是茉莉酸(JA)和乙烯依赖性途径和SA依赖性SAR抗性机制的组分。同样,BHLH系列TFS也参与了植物防御。BHLH中的一种这样的已知组由MyC TFS构成,其通过JA信号通路上调。增强的Myc水平导致尼古丁的生产野生烟草,这反过来增加了植物阻力[40,41.].
结果表明,与野生型相比,B-48基因型具有更高的抗SCMV能力。防御相关转录因子WRKY、AP2、bZIP、NAC和bHLH的表达增强支持了B-48的高抗性。与活性氧清除途径相关的基因表达水平的升高可上调抗氧化酶(如SOD、PAL、CAT和APX)的活性,从而降低活性氧自由基的水平,减少植物中的氧化应激(补充文件5.:图S2)。
结论
转SCMV基因型B-48被开发用于抗SCMV。本研究评估了其对病原菌的抗性基础,并探讨了具有缓解SCMV感染引起的生物胁迫基本特征的分子因素。我们观察到B-48基因型的脂质过氧化程度大大降低,而H2.O2.感染后3天内内容物也开始减少。活性氧产生基因和抗氧化剂基因的比较转录组分析表明,B-48和Badila之间存在显著差异。病毒感染后,Badila基因型上调了大量产生ROS的单基因。在B-48(PI)中,WRKY、AP2、NAC、bZIP和bHLH等参与抗药性机制的主要转录因子被发现高度上调。转录组学数据也符合植物的生理分析。与野生型相比,增强的防御反应使B-48基因型产生抗病性并从SCMV感染症状中恢复。本研究对甘蔗的生物抗逆性具有重要的参考价值。该研究还确定了甘蔗抗SCMV的关键因素,并阐明了这一重要商业作物的主要防御机制。
方法
植物样品与SCMV感染
在广西大学24个温室中的抗SCMV(B-48,广西大学释放)和感病(BADILA,商业品种)基因型在温室中栽培。 °C,16:8 光/暗光周期h。随后,用SCMV感染叶片粗提物制备的汁液机械接种4-6叶期各基因型的三株试验植株[42.]. 另外,以三株两种基因型的未接种植株作为对照。以未接种的Badila和B-48基因型为对照。感染(未转化)的植物在14天后产生系统感染 天。从每株植物(BI和PI)中随机采集两片叶子(第14天)用于进一步分析。
估计ROS(h2.O2.)生产
H2.O2.根据先前优化的方案测量内容[43.].冷冻叶片样品(约1 g)与4 mL 0.1% (w/v)三氯乙酸(TCA)混合。然后在12,000×g离心15分钟。然后将上清液(1 mL)与1 mL 10 mM磷酸钾缓冲液(ph7.0)和2 mL 1 M碘化钾溶液混合。H2.O2.通过测量390nm的吸光度来估计浓度。实验重复三次。
脂质过氧化定量
通过估计MDA含量来定量脂质过氧化,如前所述[44.].简而言之,冷冻叶片样品均质,用10 mL 0.25% TBA溶解在10% TCA中。得到的提取物在95°C(30分钟)加热,然后冷藏。随后,样品在5000×g离心15分钟。用分光光度计在532 nm波长下测定3个生物重复物的吸光度。
转录组分析
RNA提取
采用快速RNA技术从巴迪拉和B-48叶片中提取总RNA™ Miniprep工具包由美国Zymo Research提供。
图书馆制备和RNA测序
每个RNA样本的测序文库是使用NEB Next®Ultra制备的™ Illumina®RNA文库准备工具包。使用安捷伦2100生物分析仪(安捷伦科技公司,美国)分析每个RNA样本,并使用Illumina HiSeq 2500平台(生物标记技术公司,加利福尼亚州,美国)生成Illumina配对末端读取。每个样本有两个重复的RNA文库。为此,采用了基因组指导方法(S自发性)作为参考[20.].Raw reads质量通过FastQC (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/),在移除适配器、低质量读取和poly-N序列以获得干净的读取之后,遵循中采用的过程[45.].
功能注释
使用前面描述的方法搜索与ROS产生相关的GO术语和KEGG途径[45.].
抗氧化活性的测定
根据先前描述的方案测量抗氧化活性。将冷冻叶样品在50mM磷酸钾缓冲液(pH7.8)中均化,然后以10,000×g离心。在低温(4℃)下孵育20分钟后,使用上清液进行酶测定。每个实验进行三次。
抗坏血酸过氧化物酶(APX)活性
测定APX活性,采用中野等[46.]采用了。通过将1ml酶提取物混合,用50mM磷酸盐缓冲液,0.5mM抗坏血酸,0.1mM Na混合来计算APX活性。2.-EDTA和0.5 毫米高2.O2..在补充H后,在290nm下监测吸光度2.O2..
过氧化氢酶(猫)活动
根据Droillard等人提到的协议测量猫活性。[47.].共3 mL反应混合物,包括50 mM磷酸钾缓冲液(pH 7.0), 10 mM H2.O2.2. mM不适用2.-EDTA和0.1 mL酶提取物。在240 nm波长下测定吸光度1 min。
超氧化物歧化酶(SOD)活性
根据Droillard等人的方法分析总SOD活性。[47.].通过计算Nitroblue Tarzolium(NBT)光化学活性的抑制率,在560nm处估计SOD活性。
苯丙氨酸氨酶(PAL)活性
通过测定290℃时反式肉桂酸的形成来检测PAL活性 纳米。反应混合物(1 mL,pH值 = 8.8)由酶提取物组成,100 mM Tris HCl和40 毫米 L-苯丙氨酸。混合物在37℃孵育 °C持续30分钟 孵育后,通过添加50微升的4终止反应 M盐酸[48.].
实时定量PCR分析
叶片样品采用天根植物RNA提取试剂盒(Biotech Co., Ltd, Beijing)提取总RNA,然后合成cDNA。qPCR反应由10 μL SYBR Green Master Mix (Roche, Germany)、1 μL模板cDNA、每个引物(10 μM)各1 μL组成,水加至最终体积20 μL。RNA表达水平归一化至GADPH表达水平。在中国罗氏LightCycler 96 Real-Time PCR系统中进行3个技术重复的扩增。SYBR主混合料的标准热特性如下:95°C初始变性10分钟,然后95°C变性15秒,60°C退火和延伸60秒,共40个循环。相对表达量用2-ΔΔcQ方法,如前所述[49.].
加入号码
本文中使用的RNA测序数据可以在NCBI的短读存档中找到(https://www.ncbi.nlm.nih.gov/sra.)使用以下登录号:B-48(BI)Replicate 1:SRR10058141,B-48(BI)Replicate 2:SRR10058140,B-48(PI)Replicate 1:SRR10058139,B-48(PI)Replicate 2:SRR10058138,Badila(BI)Replicate 1:SRR10058145,Badila(BI)Replicate 2:SRR10058144,Badila(PI)Replicate 1:SRR10058143,Badila(PI)Replicate 2:SRR10058142。
数据和材料的可用性
本研究的rna测序数据已提交至NCBI的Short Read Archivehttps://www.ncbi.nlm.nih.gov/sra/?term=sugarcane+花叶病毒使用以下加入号:B-48(BI)复制1:SRR10058141,B-48(BI)复制2:SRR10058140,B-48(PI)复制1:SRR10058139,B-48(PI)复制2:SRR10058138,Badila(BI)复制1:SRR10058145,Badila(BI)复制2:SRR10058144,Badila(PI)复制1:SRR10058143,Badila(PI)复制2:SRR10058142。
缩写
- APX型:
-
抗坏血酸盐过氧化物酶
- 作为一个:
-
抗坏血酸盐
- bhlh:
-
螺旋循环螺旋
- bzip:
-
碱性亮氨酸拉链
- 类别:
-
催化剂
- 度:
-
差异表达基因
- 达尔:
-
脱氢抗坏血酸还原酶
- 罗斯福:
-
错误发现率
- 总分:
-
愈创木酚过氧化物酶
- 格:
-
谷胱甘肽还原酶
- 谷胱甘肽:
-
谷胱甘肽
- 格林威治恒星时:
-
谷胱甘肽S-转移酶
- MDA:
-
丙二醛
- 移动硬盘:
-
Monodehydroascorbate还原酶
- MDH:
-
苹果酸脱氢酶
- MDHAR公司:
-
Monodehydroascorbate还原酶
- 电视台:
-
Nitroblue Tetrazolium.
- 朋友:
-
苯丙氨酸解氨酶
- PCD:
-
程序性细胞死亡
- 活性氧:
-
反应性氧气
- 草皮:
-
超氧化物歧化酶
- TFs公司:
-
转录因子
参考
- 1。
张M,Govindaraju M。中国甘蔗生产。作者:de Oliveira AB,编辑。甘蔗技术与研究。伦敦:INTECOPEN;2018年。49–66.
- 2。
Bolwell GP,Wojtaszek P.植物防御中的活性氧物种的机制 - 广阔的视角。physiol mol植物疗法。1997年; 51(6):347-66。
- 3.
浅田K。叶绿体活性氧的产生、清除及其功能。植物生理学。2006;141(2):391–6.
- 4.
Mühlenbock P, Szechyńska-Hebda M, Płaszczyca M, Baudo M, Mateo A, Mullineaux PM,等。叶绿体信号和损伤模拟疾病调节光线驯化和免疫之间的串扰拟南芥. 植物细胞。2008;20(9):2339–56.
- 5。
Mhamdi A,Van Breusegem FJD.先生。植物发育中的活性氧。发展。2018;145(15):dev164376。
- 6。
Choudhury Fk,Rivero RM,Blumwald E,Mittler R.反应性氧气种类,非生物胁迫和应力组合。植物J. 2017; 90(5):856-67。
- 7。
德雷尔A,迪茨K-J。冷应激驯化中的活性氧和氧化还原调节网络。抗氧化剂。2018;7(11):169.
- 8.
DAT J,Vandenabeele S,Vranova E,Van Montagu M,inzéd,van Breusegem F.植物应激反应期间活性氧物种的双重作用。细胞mol寿命。2000; 57(5):779-95。
- 9.
Levine A,Tenhaken R,Dixon R,羊肉C. H2O2来自氧化突发策划植物过敏性疾病抵抗反应。细胞。1994年; 79(4):583-93。
- 10。
亚砷酸盐处理诱导水稻幼苗氧化应激,上调抗氧化系统,导致植物螯合素合成。原生质。2011;248(3):565 - 77。
- 11.
锰过量诱导水稻幼苗氧化应激,降低抗氧化剂库,提高关键抗氧化酶的活性。植物生长调节剂。2011;64(1):1 - 16。
- 12.
铅中毒诱导水稻植株的脂质过氧化和抗氧化酶活性的改变。植物科学。2003;164(4):645–55.
- 13。
Meriga B, Reddy BK, Rao KR, Reddy LA, Kishor PB。铝诱导水稻幼苗氧自由基的产生、脂质过氧化和DNA损伤(奥雅萨苜蓿)。J植物理性。2004; 161(1):63-8。
- 14。
抗坏血酸和谷胱甘肽:保持活性氧在控制之下。为基础。启植物杂志。工厂。摩尔。杂志。1998;49(1):249 - 79。
- 15.
Sharma P,JHA AB,Dubey Rs,Pessarakli M.在压力条件下植物的反应性氧物种,氧化损伤和抗氧化防御机制。Aust J Bot。2012:217037。
- 16。
Hyodo K,Hashimoto K,Kuchitsu K,Suzuki N,Okuno T.利用植物RNA病毒的鲁棒基因组复制的宿主ROS发电机。PROC NATL ACAD SCI。2017; 114(7):E1282-90。
- 17。
徐k,鸣叫。古草毒素复制蛋白的甾醇结合对于酵母和植物中的复制至关重要。J病毒。2017; 91(7):E01984-16。
- 18
王里,李克。宿主因子在正链RNA病毒的复制中。张涌医生J. 2012; 35(2):111-24。
- 19
姚W,阮M,秦L,杨C,陈R,陈B,等.抗甘蔗花叶病毒转基因甘蔗品系的田间表现。前植物科学。2017;8:104.
- 20
张j,张x,唐h,张q,hua x,ma x等。等位基因定义的自动聚合物甘蔗的基因组甜根子草L. Nat Genet。2018; 50(11):1565。
- 21。
Halliwell B,Gutteridide JMC。生物学和医学中的自由基。纽约:牛津大学Pres;2015年。
- 22。
拉德万·德姆、法耶兹·卡、马哈茂德·西、卢·G。大豆黄花叶病毒侵染和水杨酸处理对大豆叶片抗氧化活性和蛋白质组成的影响。生理植物学报。2010;32(5):891–904.
- 23。
Survila M,Davidsson Pr,Pennanen V,Kariola T,Broberg M,Sipari N等人。过氧化物酶产生的痉挛性ROS损害角质层完整性,有助于抑制引发的防御。前植物SCI。2016; 7:1945。
- 24。
KärkönenA,Kuchitsu K.在细胞壁代谢和植物发育中的活性氧。植物化学。2015; 112:22-32。
- 25。
Gullner G,Komives T,KirályL,SchröderP.植物病原体相互作用中的谷胱甘肽S-转移酶。前植物SCI。2018; 9:1836。
- 26。
吉尔党卫军,图特加。活性氧和抗氧化机制在作物非生物胁迫耐受中的作用。植物生理生化。2010;48(12):909–30.
- 27。
Hakmaoui A、Pérez Bueno M、GarcíA-Fontana B、Camejo D、Jiménez A、Sevilla F等。对抗氧化剂反应的分析烟草两株辣椒轻度斑驳病毒的侵染。J实验机器人。2012;63(15):5487–96.
- 28。
Clarke SF,Guy Pl,Burritt Dj,Jameson Pe。抗氧化酶活性响应病毒感染和激素治疗的变化。physiol植物。2002; 114(2):157-64。
- 29。
Yi S-Y,Yu S-H,Choi D.含有过氧化氢的参与在TMV感染烟草中的过氧化氢酶的抑制中。Mol细胞。2003; 15(3):364-9。
- 30
Hernandez CEM,Guerrero IEP,Hernandez Gag,Solis Es,Guzman JCT。过氧化氢酶过表达降低了萌发时间并增加了真菌的致病性Metarhizium Anisopliae.. 应用微生物生物技术。2010;87(3):1033–44.
- 31
元X,王H,Cai J,Li D,宋F. NAC转录因子植物免疫。植物疗法res。2019; 1(1):3。
- 32
Baillo EH,Kimotho RN,Zhang Z,XU P.与非生物和生物应激耐受相关的转录因子及其对农作物改善的潜力。基因。2019; 10(10):771。
- 33。
SEO E,Choi D. Choi Choi功能研究基因组学时植物防御中涉及的转录因子。简短的Funct基因组学。2015; 14:260-7。
- 34。
WRKY8转录因子通过介导脱落酸和乙烯信号转导参与TMV-cg防御反应拟南芥. 美国国家科学院学报。2013;110(21):E1963–71。
- 35。
孟X,徐茹,他,杨k-y,mordorski b,liu y等。ERF转录因子的磷酸化拟南芥MPK3 / MPK6调节植物防御基因诱导和真菌抗性。植物细胞。2013; 25(3):1126-42。
- 36。
关键词:生物力学,Nuruzzaman M, manemankalai R, Sharoni AM, saoh K, Kondoh H, Ooka H,等。水稻NAC转录因子家族的全基因组分析。基因。2010;465(1 - 2):30 - 44岁。
- 37。
Katagiri F、Lam E、Chua N-H。两种与核因子CREB同源的烟草DNA结合蛋白。自然。1989;340(6236):727–30.
- 38。
GATZ C.从先驱者到团队球员:TGA转录因子提供不同应力途径之间的分子联系。Mol植物微生物相互作用。2013; 26(2):151-9。
- 39。
Kesarwani M、Yoo J、Dong X。TGA转录因子在小鼠发病相关基因调控和抗病性中的遗传相互作用拟南芥. 植物生理学。2007;144(1):336–46.
- 40。
Pieterse CMJ, Van der Does D, Zamioudis C, Leon-Reyes A, Van wee SCM。植物免疫的激素调节。Annu Rev Cell Dev Biol. 2012;28:48 - 521。
- 41
WoldeMariam Mg,Dinh St,OH Y,Gaurle E,Baldwin It,Galis I. Namyc2转录因子调节植物防御反应的子集野生烟草.BMC植物BIOL。2013; 13(1):73。
- 42
Użarowskaa,dionisio g,sarholz b,piepho h-p,xu m,Ingvardsen Cr等。验证含有对玉米SCMV和MDMV抗性相关的候选基因(玉米通过表达谱分析。BMC植物生物学。2009;9(1):15.
- 43
MátaiA,Hidegé。比色测定检测叶提取物中过氧化氢的比较。肛门方法。2017; 9(15):2357-60。
- 44
Savicka M, Škute N.高温对小麦幼苗丙二醛含量、超氧化物产生及生长变化的影响(Triticum aestivum.L.)。Ekologija。2010; 56(1):26-33。
- 45。
Akbar S,Yao W,Yu K,Qin L,Ruan M,Powell Ca,等。甘蔗马赛克病毒(SCMV)感染的甘蔗的光合特征及表达谱。Photosynth Res。2020:1-16。
- 46。
Nakano Y,Asada K.氢过氧化氢通过菠菜叶绿体中的抗坏血酸特异性过氧化物酶清除。植物细胞生理。1981; 22(5):867-80。
- 47。
Droillard M, Paulin A, Massot JC。康乃馨切花衰老过程中自由基产生、过氧化氢酶和超氧化物歧化酶活性及膜完整性(石竹类植物caryophyllus)。physiol植物。1987年; 71(2):197-202。
- 48。
关键词:植物组织,苯丙氨酸解氨酶,酶活性,酶活性中国农业科学。2008;88(4):619-25。
- 49。
Akbar S,Tahir M,Wang M-B,Liu Q.发夹RNA携带的表达分析甘蔗花叶病毒(SCMV)在模型水稻植物中衍生的序列和转基因抗性发育。BioMed Res Int。2017年:1646140。
致谢
我们非常欣赏生物科学编辑解决方案,以批判地阅读本文并提供有用的建议。
资金
国家自然科学基金资助项目(no . 31660420);广西科技重点项目(no . AA17202042-7);国家现代农业技术专项基金资助项目(no . CARS-17)。资助机构只提供资金,并没有参与研究的设计、样本收集、数据分析和解释以及手稿的撰写。
作者信息
从属关系
贡献
构思设计实验:ZMQ和CBS。进行了YW、RMH、SA和QLF实验。分析数据:RMH、YY、SA、ZMQ。提供的试剂/材料/分析工具:ZMQ和CBS。撰写论文:SA, MTK, YW, CP, ZMQ。所有作者阅读并批准了论文的最终版本。
通讯作者
伦理宣言
道德认可和参与同意
不适用。
出版许可
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商说明
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Akbar,S.,Wei,Y.,Yuan,Y.et al。反应性氧(ROS)和抗氧化防御系统的基因表达谱甘蔗花叶病毒(SCMV)感染。BMC植物BIOL.20,532(2020)。https://doi.org/10.1186/s12870-020-02737.1.
收到:
认可的:
出版:
关键字
- 甘蔗花叶病毒
- 反应性氧气
- 转录组
- 抗氧化剂
- 转基因