抽象的
背景
这石蒜属包括许多观点和药用重要的物种。多倍化和杂交被认为是该属的形式,暗示了巨大的遗传多样性。然而,缺乏有效的分子标记限制了该属的遗传分析。
结果
在该研究中,使用转录组序列进行EST-SSR标记的开采L奥里亚而且成功设计了839对非冗余EST-SSR的引物对。随机选择60对的子集进行验证,其中44对可以放大预期尺寸的产物。60个引物对中的交叉种类可转移性石蒜对物种进行了评估L. Radiata.HREB,l . sprengeri来贝克,L中国人traub和L安徽其中有38%~77%的引物能扩增出这些酶的产物石蒜物种。选择20个和10个扩增产物进行测序验证L奥里亚和L. Radiata.分别。所有产品均按预期SSRs进行验证。此外,还筛选了15个ssr,其中10个已验证序列,5个未验证序列,对7个品种进行了遗传多样性分析L. Radiata.线条。其中,有三条无菌线,三条肥沃的线和一条由一个肥沃的线的后代代表。具有算术平均分析(UPGMA)的未加权对组方法证明了除数,L奥里亚被分开了L. Radiata.线条和七个L. Radiata.将线分为两组,与其生育率一致。有趣的是,即使是一个带有34个人的树木图,代表七个L. Radiata.线条几乎与生育力一致。
结论
本研究为遗传分析提供了一个潜在的839个非冗余SSR标记库石蒜该属具有较高的扩增率、可转移性和高效性,有利于遗传分析和育种工作的开展石蒜.
背景
属石蒜是Amaryllidaceae家族的成员,包含世界各地的30种。在中国,有15种和1种,其中包括1种,L. Radiata.和L奥里亚是分布最广的物种。物种石蒜属植物是一种药用植物,具有独特的石蒜科生物碱,具有广泛的抗病毒、抗肿瘤和乙酰胆碱酯酶抑制活性[1那2那3.那4.]. 此外,由于本属的花有各种各样的颜色和形状,有些还带有香味[5.]它们作为观赏植物很受欢迎。因此需要石蒜物种一直在增加。
多倍化和杂交被认为是该属的形态[6.那7.那8.那9.].核型调查已被广泛执行石蒜和许多核型,如2n = 发现12、13、14、15、16、17、18、19、21、22、24、25、27、30、32、33、44,分别对应二倍体、非整倍体、三倍体和四倍体[7.那8.那10.那11.那12.那13.].基本染色体数量石蒜从x = 6到x = 11 [5.],而x = 8和x = 11是主要类型。例如,L中国人那L安徽和L. Longituba.有x = 8的物种吗L. Radiata.那l . sprengeri和L. stanguinea是x = 11的种类[6.那8.]. 此外,有些种起源于两个种与x的杂交 = 11,或物种之间的x = 8和x = 11.例如,l . straminea是一种杂交L白花辐射和L中国人[6.那14.].流式细胞术分析证明,具有X = 11和X = 8的物种的基因组大小大大差异,甚至在线之间观察到的变化L. Radiata.[15.]. 根据这些观察结果,石蒜物种具有很高的遗传多样性。因此,基因分析石蒜不仅要揭示起源是重要的石蒜同时也为高效保存和开发优良种质资源。
分子标记已被证明在遗传多样性分析中有效。在遗传多样性的分析中使用了许多类型的DNA分子标记,例如RFLP,RAPDS和SSRS [16.那17.],SSRS非常受欢迎,因为他们的共同突然遗传,良好的再现性和成本效益[18.那19.]. ssr是由两类序列资源发展而来的。一种来自基因组DNA,称为基因组SSRs,另一种来自表达序列标签(EST),称为EST-SSRs或基因SSRs。与基因组ssr相比,EST-ssr在相关物种间具有更大的可转移性[20.].如今,使用下一代测序技术对越来越多的物种进行测序,因此Genbank中有大量可参考的EST。因此,开发EST-SSR标记对于许多物种将是方便的,特别是对于那些基因组研究进展缓慢的人。例如,EST-SSR标记已从转录组数据中开发Curcuma Alismatifolia[21.],Dendrobium Officinale.[22.],柳树psammophila[23.]以及刺槐[24.].
在石蒜,转录组测序L. Longituba.那L奥里亚和l . sprengeri[25.那26.那27.那28.已经获得了含有SSRS的丰富序列,为开发EST-SSRS提供了一种方便和成本有效的机会。尽管如此,只有27个EST-SSRS开发L. Longituba.[25.]以及l . sprengeri[29.]和27种基因组SSRS来自L. Radiata.以及之间的混合动力L奥里亚和L. Radiata.[30.那31.].因此,开发更多SSR石蒜属是遗传分析和种质保护育种研究的重要组成部分。之前,我们使用短读测序技术(Illumina),测序转录组L奥里亚幼苗进行茉莉酸甲酯(MJ)处理,组装59,643 unigenes [27.]. 本研究基于这些数据进行了EST-SSR挖掘。本研究的主要目的是提供大量的非冗余SSR标记,以供遗传分析之用石蒜属,并促进该属Elite种质的开发和利用。
结果
EST-SSRs的开发与鉴定
在从转录组序列组装的59,643个unigenes中L奥里亚[27.]使用MISA计划,共检测到4637个SSR。为了消除相对于相同基因的替代转录物的冗余SSR,用生物丝就进行序列比对。最后,设计了总共839SSR的引物,包括623三核苷酸重复,147个二核苷酸重复,9四核苷酸重复,13个五核苷酸重复和47个六核苷酸重复。如表所示1,三核苷酸重复是检测到的SSR的主要类型,其与使用454焦点测序的分析中的先前报告一致[26.]. 我们的数据显示,三核苷酸重复占74.25%,其中(AAG)n/(CTT)n是最常见的类型。此外,双核苷酸重复序列占17.52%,其中(AG)n/(CT)n重复序列最常见,而(GC)n/(GC)n重复序列最不常见。在EST-SSR序列中,28个EST含有2个SSR位点,4个EST含有3个SSR位点,1个EST含有8个SSR位点。利用Primer3软件设计了839对SSR特异性引物(http://bioinfo.ut.ee/primer3/),代表796个单基因(表S)1).
EST-SSRs的验证
为了验证所设计的引物,随机选取60对引物的一个子集,在实验室进行检测L奥里亚,由9个二核苷酸重复,46个三核苷酸重复,1个四核苷酸重复,2个五核苷酸重复,2个六核苷酸重复。四十四个底漆对产生符合预测尺寸的清晰带,占73.3%的有效扩增。为了确认扩增产物是否是SSRS,选择了20个放大产品,观察到高分辨率琼脂糖凝胶上的透明和强带进行了透明和强带,克隆和测序(表S.6.).结果表明,重复基序与所有20个SSR的预测序列一致,尽管一些SSR在重复数字中变化一点。如表所示2结果表明,LaES12、LaES18、LaES25、LaES36和LaES41的重复数减少,而LaES20、LaES22、LaES31和LaES53的重复数增加,其余重复数与预测的重复数一致。此外,利用20个序列验证的ssr对11个样本进行了多态性分析 L奥里亚个人(表S2).扩增了一百个清晰的条带,其中85%是多态性。结果表明,这些EST-SSRS可用于遗传分析L奥里亚.
EST-SSR标记的可移植性石蒜Genus.
验证是否根据EST序列设计引物对L奥里亚也可以有效地扩增其他基因中相同的SSR基序石蒜物种。L. Radiata.和l . sprengerix = 11以及L中国人和L安徽选择x = 8,选择进行分析。如表所示3.在60个EST-ssr中,有44个扩增出预期大小的产物L奥里亚和L. Radiata.45个、23个和30个EST-ssr可在大肠杆菌中扩增l . sprengeri那L中国人和L安徽分别占放大率38-77%。这些结果表明,在评估的物种中,扩增率大大差异,高于L. Radiata.和l . sprengeri,低L中国人和L安徽. 另外,两个标记,LaES23和LaES24没有扩增产物L奥里亚,产生的扩增子L. Radiata.和/或l . sprengeri,表示插入可能发生在L奥里亚。
进行进一步的测序验证以验证这种放大产品是否对应于这些的相同SSR石蒜物种。如表所示2,20个序列验证的SSR中的十个L奥里亚被选中并确认L. Radiata..LaES36和LaES53在5种植物中均得到了验证(表S6.).总的来说,这些重复的图案是一致的石蒜物种,尽管重复图案的数量有一个小的差异。在为L. Radiata.,重复主题在五个SSR中减少,两者增加,剩余的三个SSRS中不变(表2).同时,所有五种物种的Laes36和Laes53的序列都对齐。如图1所示。1,在Laes36的扩增中观察到多种序列缺失L. Radiata.但是,在所有五种物种中保守设计为引物序列的重复基序的侧翼序列。SSR侧翼序列的保护将占EST-SSRS的可转移性[20.]. 经序列验证的扩增产物均为SSR,说明大小合适的SSR引物可能是真实的SSR,说明该套EST-SSR具有很高的应用潜力。
Go(基因本体论)注释窝藏SSRS集的基因
EST-ssr来源于转录基因,因此对相应基因的注释将有助于其在性状相关标记选择中的应用[32.].窝藏est-ssrs的基因的注释列于表s中1根据Wang等人的注释。[27.].在839个候选EST-SSRs中,373个有GO注释。60 EST-SSRs, 52去注释,其中16 EST-SSRs (LaES1、LaES19 LaES23, LaES26, LaES29, LaES31, LaES32, LaES33, LaES34, LaES35, LaES42, LaES43, LaES46, LaES47, LaES50, LaES58)分配给信号或刺激反应,14 (LaES3、LaES16 LaES17, LaES18, LaES20, LaES22, LaES36, LaES44, LaES48, LaES51, LaES55, LaES56,LaES57、LaES59)与花器官发育有关,其中3个(LaES25、LaES49、LaES53)参与营养相变化,其余19个参与高尔基体组织和半胱氨酸合成等过程。由于转录组序列来源于L奥里亚用MJ处理,可接受的是,许多基因与刺激或信号的反应所涉及的过程有关。
中国对虾遗传多样性与种群结构分析L. Radiata.行
7 .利用新开发的SSR标记进行遗传分析L. Radiata.选择育性不同的品系进行多样性分析(表1)4.).其中3个是可育的,3个是不育的,一个系由一个可育系Pop6的后代组成。考虑到60个EST-SSR标记的GO注释和可转移性,选择15个EST-SSR标记,其中包括10个序列验证过的SSR标记和5个未验证过的SSR标记(LaES3、LaES20、LaES31、LaES46和LaES58),探讨7个SSR标记的遗传多样性L. Radiata.线条。
在中共检测到总共88个频段L. Radiata.其中80个为多态性。遗传多样性和分化参数见表5.和6.分别是。所用EST-SSR标记的多态性信息含量(PIC)值在0.374~0.850之间,但LaES18和LaES27在该区域没有表现出多态性L. Radiata.线条。验证和未经验证标记之间的平均照片值分别为0.636和0.681(表5.).此外,遗传分化(GST)和基因流(NM)参数在验证和未验转的标记之间相似(表6.)这说明这两个SSR群体都有助于遗传分析L. Radiata..
平均遗传分化参数GST为0.752 L. Radiata.线路,这意味着人口之间的多样性占总多样性的75.2%,表明人口中的高遗传多样性。然而,那些之间的遗传沟通L. Radiata.线条非常低,对于nm仅为0.172(表6.). 我们认为l radiata.既可能是由于既时繁殖,这是主要的再现模式石蒜. 因此,对植物的遗传多样性进行评价石蒜不同生境的材料对优良种质的开发具有重要的价值。
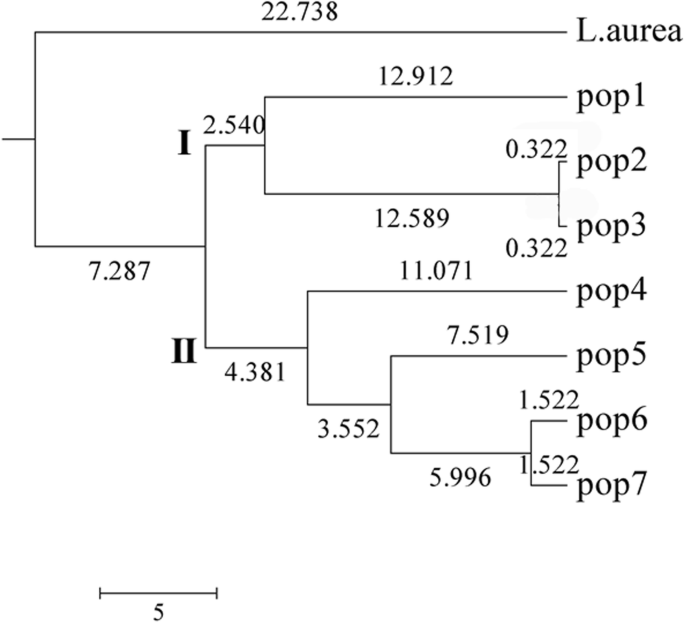
为了阐明这7个基因的遗传关系 L. Radiata.线条,L奥里亚被添加为除了基于Nei的遗传距离的树木图。如表所示7.,Nei的遗传距离在这些线之间呈现出高度,范围为0.0064至0.5568。之间的距离L奥里亚Pop4最远,Pop2和Pop3最接近,其次是Pop6和Pop7。相应地,利用算术平均分析(UPGMA)的非加权对群法(unweightedpairgroup)构建了基于遗传距离的树状图。如图。2,外群被分开了L. Radiata.,而L. Radiata.将线分为两组。有趣的是,这两组符合其生育能力。三根无菌系包括I基团,而三种肥沃的线加上后代群体形成II族。这些结果暗示了15个EST-SSR的高效率。
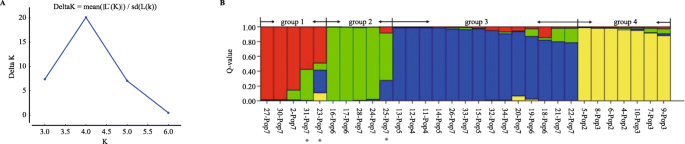
进一步评估34的关系 L. Radiata.个体,用结构2.3.4分析人口结构。ΔK方法显示最佳k值为k = 4(图。3.a) 由此推断出34个物种中有4个主要类群 L. Radiata.个人。如图。3.B,每条线的个人都有相同的祖先,除了第6和第7行,其中一些人分散在一个以上的群体中,建议将POP6和POP7的祖先混合。来自群体的Q值概况(表S.3.)结果表明,Pop6和Pop7是混合的。如图。3.b、 6个个体(其中一个来自亲本Pop6,另一个来自后代Pop7)被分配到中间群体。可以接受的是,具有混合祖先的亲本系将在其后代系中产生更大的多样性。
讨论
石蒜物种在遗传研究中奠定了落后于其他物种。到目前为止,一些分子标记如苏格兰,其,它已被用于确定遗传多样性和进化关系石蒜物种[33.那34.]. 然而,这些分子标记对于连锁群构建和标记辅助选择(MAS)等研究还不够。相反,ssr是这类研究的有力DNA标记,因为它们具有共显性遗传。虽然目前已有27个基因组SSR标记和27个基因SSR标记石蒜物种[25.那29.那30.那31.],它们远非充足,以便更好地遗传分析石蒜属。自从石蒜属具有巨大的基因组[15.],大量的DNA标记是覆盖整个基因组的必要条件。因此,本研究发布的839个潜在EST-SSR标记的列表对于遗传分析有助于遗传分析,特别是对于遗传改进石蒜.
转录组测序技术使得EST-SSRs的开发更加容易,目前有大量的EST-SSRs可供开发[35.那36.那37.]. 然而,序列冗余是EST-SSRs的一个主要缺点,因为同一基因有多个不同的转录本[21.]. 此外,一些SSR偶尔以相反的互补格式存在,但事实上它们是相同的。然而,这些来自转录组序列的EST-ssr的普遍现象在EST-ssr的开发过程中往往被忽视。因此,从转录组序列中获得的EST-ssr的实际数目应该比检测到的要少得多。此外,这种冗余会降低所开发的EST-ssr的代表性,进而降低其应用效率。Bazzo等人在考虑了macaúba棕榈转录组序列的冗余性后,从7492个检测到的EST-ssr中成功地开发出了总共418个ssr(acrocomia aculeata)[37.].在我们的研究中,从转录组序列中检测到数千个EST-SSRL奥里亚用MJ处理的幼苗,但许多这些EST-SSR是多余的重复。通过消除重复的EST-SSRS,我们将839个SSR识别为4637个检测到的EST-SSRS作为非冗余候选EST-SSR的池,这将对SSR开发有望,相应地对遗传分析。
当从转录的真核生基因开发EST-SSR时,内含子可能会影响扩增产物。此外,组装错误也可能影响SSRS的放大[35.那36.]. 因此,在本研究中,对产生预期大小清晰条带的扩增子进行测序确认,结果证实所设计的引物扩增了预期的位点。假设EST-SSRs亚群的扩增率相同L奥里亚,底漆池中会有大约615个引物对,可以作为EST-SSR标记开发L奥里亚,暗示底漆池的巨大潜力。
EST-SSRS在密切相关的物种之间具有高可转移性[35.那36.那38.那39.].当测定EST-SSRS的可转移性时,影响扩增的有效性和保真度的扩增条件是一个重要因素[19.].在该研究中,在58℃下设定退火温度,以避免在所有五种物种中进行PCR扩增时的非特异性扩增。共有23个,其中44个EST-SSRSL奥里亚可在L. Radiata.那l . sprengeri那L中国人和L安徽,其可转移性占52.27%,高于Genomic SSRS观察到的转移性[30.那31.]. 有趣的是,研究发现,在这种情况下,可转移性很高L. Radiata.和l . sprengeri,而L中国人和L安徽.众所周知L奥里亚那L中国人那L安徽那L. Radiata.和l . sprengeri是人类常见的原始物种石蒜还有一些石蒜杂交产生的物种大多是由上述物种产生的杂交物种[14.那15.].因此,本研究中观察到的EST-SSR可转移性将为应用本集EST-SSRS提供信息和实际指导石蒜.
多态性信息含量(PIC)是反映分子标记能力的一个重要参数。一般来说,PIC> 0.5标记被定义为高度多态[40]. 在我们的病例中,除LaES18和LaES27外,所使用的13个EST-SSR标记的平均PIC值为0.654,高于许多从转录组序列发展而来的EST-SSR标记,例如香榧(0.357) [41.],刺毛黧豆(0.24) [42.]以及紫薇属(0.589) [43.].我们工作中观察到的高比例值暗示了遗传分析中这些标记的高效率。
7的遗传关系 L. Radiata.线和L奥里亚通过使用15个EST-SSR标记分析。结果表明介于之间的显着遗传距离L奥里亚和L. Radiata.线,平均为0.4547。在POP2和POP3之间发现最近的遗传距离,0.0064,来自南京植物园MEM的两条线。孙中山可能是相同的换乘。结构分析的Q值配置文件也表示POP2和POP3的同一祖先(表S3.). 后代系Pop7与其亲本系Pop6之间的遗传距离为0.0304,也表明亲缘关系密切。此外,Q值分布表明Pop6和Pop7都具有第1、2和3组的混合祖先,这对于混合亲本可以产生混合后代是合理的。总的来说,基于15个EST-ssr的遗传距离和遗传结构是合理和可接受的。
由于EST-SSR标记是从转录的RNA序列中识别出来的,并且可能与可能影响重要性状的功能基因连锁,因此EST-SSR可能比基因组SSR更具优势[19.].例如,González等人。专注于来自一些特定途径的基因的EST-SSR,并且三个EST-SSR甚至能够区分水果的不同性质[32.].在我们的案例中,基于仅仅15个EST-SSRS的树木图显示了小组,L奥里亚被分开了L. Radiata.线条和7 L. Radiata.将线分成两组与其生育能力一致。此外,34的Upgma树木图 L. Radiata.利用15个EST-SSR标记将所有个体聚为两组(图1)。4.),类似于从分析中获得的7 L. Radiata.线条和小组(图。2).第一个组由来自三条无菌线的所有个人组成,加上POP7的两个人,另一组由来自肥沃线的剩余个体组成。考虑到Laes18和Laes27显示没有多态性L. Radiata.线条,树木图恰好基于13个EST-SSR标记,表明那些13个EST-SSR标记高效。并且高效率可能与这些转录基因的功能相关联。虽然生育机制L. Radiata.尚不清楚,许多研究表明凝胶酸(Ga)和养蛋白信号传导参与调节繁殖发展[44.那45.].由于亚乙基,ABA,GA和AUXIN之间的串扰无疑是[46.]这些信号可能在生殖发育中起作用。此外,我们推测花器官的发育过程以及营养相的变化,可能会影响种子的发育,最终导致一个生产性状:育性或不育性。有趣的是,在13个EST-ssr中,4个参与激素信号反应,4个与花器官发育有关,3个参与营养体的相变。相关分析表明,28个基因座(36–3,− 4.− 5.− 7.− 10, − 11、49–2、53–2、,− 3.− 8,58–1,3–1,− 4,LaES25–4,− 5.− 7.− 8,LaES34–4,S31–4,− 5.− 6,第13–2页,− 3.− 4.− 7,第20–1页,− 2.− 6) 13个EST-SSR标记与育性显著相关(表S)5.).实际上,这些基因座来自上述11个EST-SSR标记中的10个,与花器官发展,营养相变和激素信号响应相关。通常,这10个EST-SSRS的GO注释可以解释群集和生育能力之间的高一致性。尽管如此,需要更多的工作和努力来阐明生育的机制L. Radiata..
结论
这项研究包括从基因的转录组数据中挖掘EST-SSR标记L奥里亚.提供了839个非冗余EST-SSR标记的潜在池Lycoris。标记表征和验证表明,新开发的SSR标记具有高放大率和可转移性。此外,近一半的SSRS具有GO注释,这对于特性相关的标记选择是有用的石蒜. 进一步筛选出15个EST-ssr用于7个品种的遗传多样性分析 L. Radiata.行,因此是7L. Radiata.结果表明,EST-ssr具有较高的效率。这套EST-ssr将有助于植物多样性分析和育种石蒜属。
方法
植物材料
植物材料包括11L奥里亚个人和34个人L. Radiata.,每人一人l . sprengeri那L中国人和L安徽.个人L奥里亚那l . sprengeri那L中国人和L安徽从南京植物园MEM收集。Sun Yat-sen(118°83'e,32°05'n)。收集信息和特征L. Radiata.表在表中提供4.. 凭证标本经冯鹏教授鉴定,保存于江苏省植物研究所和中国科学院植物标本室。本研究所用植物材料在南京植物园苗圃栽培。孙中山,南京,中国。2017年11月从苗圃采集一个品系(Pop6)的种子,22时在发光培养箱中发芽 摄氏度,2000 lx和16 8小时 h亮/暗(L/D)循环。采集上述个体的幼叶进行DNA提取。
EST-SSR验证在L奥里亚(表S)2).EST-SSRS的交叉物种可转移性分析L. Radiata.那l . sprengeri那L中国人和L安徽. 三十四L. Radiata.属于7个品系的个体用于遗传多样性分析(表1)4.).
SSR挖掘与引物设计
misa [47.]用于微卫星筛选。通过将参数分别设置为最少6、5、4、4和4个重复,可以检测到完美的二、三、四、五和六核苷酸基序。利用BioEdit对同一基因不同转录本的SSR序列进行比对,检测重复的EST-SSR。引物对采用Primer3软件设计(http://bioinfo.ut.ee/primer3/),参数设置为:引物长度18-24个碱基,GC含量40-60%,退火温度52-60℃,PCR产物大小80-300 bp。
DNA提取
每个人的幼叶被研磨成粉末,用液氮研磨。根据植物基因组DNA迷你试剂盒(天根,北京,中国)的说明进行DNA提取,并在1%琼脂糖凝胶上检测到DNA,以评估DNA质量和浓度。将总DNA样品以20ng /μl的浓度用TE缓冲液稀释,并在-20℃下储存以进行PCR扩增。
EST-SSR验证
PCR反应在20μL反应体积中进行,含有20ng基因组DNA,每种引物的0.5μm,10μl2XTaq母料混合物(染料加)(南京,南京,中国vazyme Biotech)。使用以下程序在Eppendorf母循环EP梯度热循环仪中进行PCR反应:在94℃下3分钟,然后在94℃,30秒的55℃下的35个循环,在58°C,30 s处为72°。C,然后在72℃下最终延伸5分钟。通过2%Metaphor™琼脂糖分析PCR产物(lonza.com.)凝胶电泳,克隆到T形载体并测序具有强烈且清晰的带的产物。
遗传多样性分析L. Radiata.
PCR产物在8%非变性聚丙烯酰胺凝胶上分离进行多态性分析,银染显示。PCR产物根据等位基因大小进行人工评分,数据评分为“0”(无条带)和“1”(有条带)。二进制数据矩阵符合POPGENE1.32。7的群体遗传参数 L. Radiata.用POPGENE 1.32版评价细胞系(Na、Ne、h、I)和分化参数(Ht、Hs、Gst和Nm)[48.和PIC by PIC_CALC [49.]. 利用遗传算法构建了各品系的UPGMA树状图L奥里亚作为基于遗传相似之处的小组,允许1000复制引导。同样,用34的构建了Upgma树木图 L. Radiata.个人。
统计分析采用SPSS统计软件(版本20),采用Spearman相关系数检验。
人口结构分析
34的人口结构与血统分析 L. Radiata.使用结构v.2.3.4进行基于贝叶斯统计数据的个人,没有事先分配群体进行50.那51.].在本研究中,SSRS被应用于主要标记物,并且使用二进制数据(0,1)。由于结构2.3.4中不同倍增性模型中的输入数据不可接受,因此POP1,三倍体种群被称为二倍体群体。使用群体参数设定为混合模型(烧伤50,000;跑长度100,000),用批量参数进行相关和独立等位基因频率进行相关和独立等位基因频率。程序结构收割机(http://taylor0.biology.ucla.edu./结构收割机/#)用于估计基于平均后概率(LNP(D))值和AD HOC Evanno的ΔK统计数据的结构分析的最终k值52.].L. Radiata.如果Q值大于或等于0.70,或被视为中间或混合,则各个人被分配给群集。
数据和材料的可用性
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。
缩写
- SSR公司:
-
简单序列重复
- ests:
-
表达序列标签
- EST-SSR公司:
-
简单序列在表达序列标签中重复
- UPGMA:
-
具有算术装置的未加权对组方法
- MJ:
-
茉莉酸甲酯
- 新加坡:
-
标记辅助选择
- 去:
-
基因本体论
- GA公司:
-
赤霉酸
- 苏格兰人:
-
起始密码子目标标记
- 拿拿淋:
-
观察到的等位基因数
- NE:
-
有效数量的等位基因
- h:
-
Nei's(1973)基因多样性
- 我:
-
香农信息索引
- 热处理:
-
总遗传多样性
- HS:
-
群体内遗传多样性
- GST:
-
遗传分化系数
- 照片:
-
多态性信息内容
- NM:
-
基因流动
- 流行音乐:
-
人口
- L / D:
-
光线暗
工具书类
- 1。
uyeo s,kobayashi s。石蒜生物碱。二十四、 :甘草胺的分离和表征。法姆公牛。1953;1:139–42.
- 2。
刘杰,胡WX,贺LF,叶M,李Y。甘草碱通过阻滞细胞周期和诱导细胞凋亡对HL-60细胞的影响。费布斯莱特。2004;578:245–50.
- 3.
哈维列克R、玛蒂娜S、卡雷尔K、伦卡B、露西C、玛特卡D、吉丽娜V、玛蒂娜R、卢博米尔O、祖扎纳B。石蒜科生物碱血红素和血红素对p53阴性人白血病Jurkat细胞周期进程和凋亡的影响。植物药。2014;21:479–90.
- 4.
Doskočili,赫什拜哈哥省A,Šafratovám,贝内奇瓦,HavlíkJ,Havelek R,KunešJ,KrálovecK,Chlebek J,CahlíkováL.氨菊酯生物碱对胃肠道癌细胞的细胞毒性活动。Phytochem Lett。2015; 13:394-8。
- 5。
香楚,kurita s,yu zz,林jz。属的概要石蒜(Amaryllidaceae)。西达,植物学的贡献。1994年; 16:301-31。
- 6.
bose s,麦子ws。系统发育和核型进化研究石蒜.核。1963年; 6:141-56。
- 7.
核型的变异和进化石蒜,Amaryllidaceae vi。核心型的血管内和/或鞘内变异L. stanguinea最大限度。var。猕猴桃和L. stanguineakoreana(Nakai)Koyama最大值。细胞学。1988;53:307–21.
- 8.
Kurita S.核型的变异和进化石蒜,Amaryllidaceae VII。属核型改变的核型改变的模式及核型进化中的可能趋势。细胞学。1988; 53:323-35。
- 9。
Kurita S,Hsu PS.混合复合物石蒜Amaryllidaceae。我是J机器人。1996年; 83:207。
- 10。
Zhou Sb,Yu Bq,Luo Q,Hu JR,Bi D.六种群体的核型Lycoris Radiata.并发现四倍体。Acta Phytotaxon Sin。2007; 45:513-22。
- 11.
刘一新,郑一红,夏婷,周杰。水稻染色体组型研究Lycoris Radiata.来自中国的人口。genet mol res。2016; 15:15017357。
- 12.
邵吉兹,杨杰,张立德,聂吕。多倍体的发现Lycoris Radiata.(L'她。)草本。来自安徽。Acta Phytotaxon Sin。1994年; 6:549-52。
- 13。
秦WH,周某,王海。一种新的染色体数量和核型Lycoris Radiata.安徽省。桂花。2004; 1:29-32(中文)。
- 14。
Kurita S.核型的变异和进化石蒜石蒜科。对10个类群进行了核型分析,其中7个为中国特有类群。细胞学。1987;52:19–40.
- 15.
江烨。徐S,汉XK,王,何J,夏B,王R.核DNA含量的调查Lycori.用流式细胞仪分析了不同染色体数目的石蒜科石蒜属植物。Pak J机器人。2017;49:2197–200.
- 16
Joshi SP,Ranjekar PK,Gupta与植物基因组分析中的分子标记。Curr Sci印度。1999; 77(2):230-40。
- 17
Kumar P,Gupta VK,Misra AK,Modi DR,Pandey BK.分子标记在植物生物技术中的潜力。植物组学。2009;2:141.
- 18
Powell W,Machray GC,Provan J.多态性通过简单的序列重复揭示。趋势植物SCI。1996; 1:215-22。
- 19。
Varshney RK,Graner A,Sorrells我。植物基因微卫星标记的特点及应用。生物技术趋势。2005;23:48–55.
- 20。
Li Yc,Korol AB,Fahima T,Nevo E.基因内微卫星:结构,功能和演化。mol Biol Evol。2004; 21:991-1007。
- 21。
Taheri S,Abdullah TL,Rafii My,Harikrishna Ja,Werbrouck Spo,Teo Ch,Sahebi M,Azizi P.德诺维新型EST-SSR标记的转录om,挖掘和开发的组装Curcuma Alismatifolia(zingiberaceae家族)通过illumina测序。SCI REP。2019; 9:3047。
- 22。
徐明,刘旭,王建伟,滕赛,石建群,李YY,黄先生。铁皮石斛转录组测序及新基因SSR标记的建立。分子育种。2017;37:18.
- 23。
贾海霞、杨海峰、孙平、李建斌、张杰、郭一赫、韩学杰、张国学、陆美子、胡杰。沙漠生物量柳的从头转录组组装、EST-SSR标记开发和群体遗传分析,柳树psammophila.SCI批准。2016; 6:39591。
- 24。
郭Q,王JX,SU LZ,LV W,SUN YH,LI Y.基于黑蝗虫转录组序列的新型EST-SSR标记的开发与评价(刺槐。).基因。2017; 8:177。
- 25。
何秋林,沈勇,陈勇,周勇,贝格A,吴瑞尔,黄先生。16个多态性简单重复序列标记的建立长管石蒜从表达的序列标签。Mol Ecol Resour。2009; 9:278-80。
- 26。
王锐,徐胜,姜玉明,蒋建伟,李晓东,梁丽娟,何娟,彭峰,夏斌Lycoris Aurea转录组使用454焦点测序的GS FLX钛平台。Plos一个。2013; 8:E60449。
- 27。
王R,徐S,王N,夏B,江ym,王R.转录族代谢途径,转录因子和转运蛋白的转录体分析Lycoris Aurea. 前植物科学。2017;7:1971.
- 28
常升,陈继,萧y,夏Y. de nogo表征Lycoris Sprengeri.转录组使用Illumina Ga II。AFR J BIOTECHNOL。2011; 10:12147-55。
- 29
石y,tong zk,gao yh。EST-SSR标记的开发和遗传多样性分析Lycoris Sprengeri.. 中国农业科学杂志。2018;32:1089-96(中文)。
- 30.
轩如何平静,郑继华,王慧,高p,周某,刘k,朱庚。多态性微卫星基因座的遗传分析Lycoris Radiata.(石蒜科)和其它同源种的交叉扩增。Genet Mol Res.2011年;10:3141–5.
- 31。
陈IJ,Shii CT,Chang TL,康香港。开发17个新型微卫星标记Lycoris Aurea和L. Radiata.(石蒜科)使用下一代测序。申请。植物科学。2018;图6:e1198。
- 32。
Gonzálezm,salazare,Castillo J,Morales P,Mura-Jornet I,Maldonado J,Silva H,Carrasco B.基于EST-SSR的遗传结构:日本李子中的果子颜色选择推定工具(李属salicinaL.)育种计划。mol繁殖。2016; 36:68。
- 33。
引用本文高永红,朱永强,童正坤,徐志勇,蒋晓峰,黄春春。属间遗传多样性及亲缘关系分析石蒜基于起始密码子有针对性的(SCOT)标记。生物学习系统和ECOL。2014; 57:221-6。
- 34。
施SD,邱yx,李前,吴升,富思。系统发育关系及可能的混合起源石蒜物种(Amarylaridaceae)由其序列透露。生物摄影群。2006; 44:198-208。
- 35。
王泽,方博,陈杰,张XJ,罗紫猫,黄lf,陈XL,李怡。使用Illumina成对序列测序和Sweetpotato中CSSR标记的根部转录组的Novo组装和特征(甘薯).BMC基因组学。2010;11:726。
- 36。
魏Wl,qi xq,王lh,zhang yx,hua w,li dh,李hx,张xr。表征芝麻(芝麻纪录L.)使用Illumina成对序列测序和EST-SSR标记的发育的全局转录组。BMC基因组学。2011; 12:451。
- 37。
Bazzo BR,Carvalho LD,Carazzolle MF,Pereira GAG,加利福尼亚州科伦坡。新的EST-SSR标记在macaúba棕榈中的开发(acrocomia aculeata)利用转录组测序和跨物种转移arecaceae.物种。BMC植物BIOL。2018; 18:276。
- 38。
闫梓,吴芙,罗珂,赵一夫,闫Q,张一夫,王一年,张杰。利用基因转录组构建的EST-SSR标记的跨种转移性草木犀及其对人口遗传学研究的应用。SCI REP。2017; 7:17959。
- 39。
关键词:大蒜,微卫星,EST序列,遗传多样性,遗传多样性Mol Gen Genomics. 2018; 293:1091-106。
- 40.
Bostein D、White RL、Skolnick M、David RW。利用限制性片段长度多态性构建人类遗传连锁图谱。我是吉英。1980;32:314–31.
- 41。
曾杰,陈继,寇yx,王子。从转录组中开发的EST-SSR标记的应用香榧(Taxaceae),受到威胁的坚果的针叶树。Peer J. 2018; 6:E5606。
- 42。
Sathyanarayana n,Pittala R,Tripathi PK,Chopra R,Singh Hr,Belamkar V,Bhardwaj PK,Doyle JJ,Egan A.药豆类的转录组资源刺毛黧豆:DE Novo转录组合体组装,注释,识别和验证EST-SSR标记。BMC基因组学。2017年; 18:409。
- 43。
叶英杰,冯莉,梁旭,刘TT,蔡M,郑TR,王杰,张QX,潘浩。新开发的EST-SSR标记的鉴定、验证、种间转移及其在紫薇遗传评价中的应用(紫薇属).mol繁殖。2019; 39:26。
- 44。
Groot SPC,BNIinsma J,Karssen CM。内源性吉布林素在番茄种子和果实发育中的作用:嗜酸虫蛋白缺乏突变体的研究。physiol plantrum。1987; 71:184-90。
- 45。
Ru P,Xu L,Ma H,Huang H. MicroRNA167增强表达诱导的植物生育缺陷。细胞res。2006; 16:457-65。
- 46。
理解赤霉酸的信号传递——我们到了吗?植物生物学。2008;11:9-15。
- 47。
Thiel T,Michalek W,Varshney R,Graner A.利用EST数据库进行大麦基因衍生的SSR标记的开发和表征(Hordeum Vulgare L.). 理论应用基因。2003;106:411–22.
- 48。
叶FC。共显性、显性标记及数量性状的群体遗传分析。机器人,1997;129:157。
- 49。
Nagy S,Poczai P,Cernáki,Gorji Am,Hegedus G,Taller J. Piccalc:一个在线程序计算分子遗传研究的多态信息含量。生物摄影群。2012年; 50:670-2。
- 50.
Falush D, Stephens M, Pritchard JK。利用多位点基因型数据推断群体结构:连锁位点和相关等位基因频率。遗传学。2003;164:1567 - 87。
- 51.
Pritchard JK、Stephens M、Donnelly P。利用多位点基因型数据推断群体结构。遗传学。2000;155:945–59.
- 52.
Evanno G,Regnaut S,Goudet J.使用软件结构检测个人的簇数:模拟研究。Mol Ecol。2005; 14:261-2620。
致谢
我们要感谢山东省农业科学院玉米瑶博士,山东省农业科学院进行学术帮助。
资金
本研究得到了中国国家自然科学基金的财政支持(授予No.81603240,31770387),江苏省六个人才峰的高级人才项目(Grant No.Ny-081)和“333”项目的江苏省(赠款号Bra220082)。该资助者没有参与实验设计,数据收集和分析,准备稿件,以及发布的决定。
作者信息
隶属关系
贡献
RW设计了本研究;YMJ、SX、RW进行了大部分实验和数据分析;SX、RW进行数据挖掘分析;JYZ进行统计遗传分析;YMJ开发并筛选了EST-SSR标记,并撰写了论文草稿。JD和QY进行了调查并参与了样本收集。所有作者都已阅读并批准了最后的手稿。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者声明他们没有相互竞争的利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放访问本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用这篇文章
江,Y.,徐,S.,王,R。等。EST-SSR标记的鉴定、验证和跨物种转移Lycori.S.Aurea.及其在遗传评价中的应用石蒜物种。BMC植物BIOL.20,522(2020)。https://doi.org/10.1186/s12870-020-02727-3.
已收到:
公认:
发表:
关键词
- EST-SSR.
- 分子标记
- 遗传分析
- 多态性
- 石蒜