摘要
背景
众所周知,植物会释放多种挥发性有机化合物(VOCs),这些化合物可能是植物与其他生物体交流的信号物质。西刺参它在冬季和早春向空气中释放芳香性VOCs。这种栽培植物与其邻近植物的关系是保护生物多样性的必要条件。
结果
(−)-α-杜仲酮(60.34±5.58%)是沈阳种群VOCs的主要成分。气相色谱-质谱联用(GC-MS)技术鉴定了昆明和沈阳居群挥发油的主要成分为(−)-α-杜仲酮、芬妥酮、(+)-β-杜仲酮和(+)-希巴烯。(−)-α-thujone和(+)-hibaene经NMR鉴定。EOs和(−)-α-thujone对植物种子萌发和幼苗生长具有较高的植物毒活性蒲公英和拟南芥蒂利亚纳。此外,EOs对玉米的病原真菌有很强的抑制作用,包括Fusarium Graminearum.,Curvularia lunata., 和Bipolaris maydis以及一种人类真菌病原体白色念珠菌。定量分析结果表明,叶中(−)-α-黄酮含量较高t . occidentalis沈阳和昆明两个居群的个体。而(−)-α-thujone(0.18±0.17 μg/g)仅在植株根际0.5 m处检测到。
结论
我们的结果表明,EOS和( - ) - α-Thujone的植物毒性效应和抗真菌活动t . occidentalis当然增加了这种植物对环境的适应性。低浓度释放(−)-α-thujone表明合理的距离t . occidentalis随着其他植物物种将损害等化的影响t . occidentalis.
背景
由生物和非生物应力引发的植物挥发性有机化合物(VOC)可以作为低分子量亲脂性代谢物的复杂混合物作用[1,2].许多植物挥发性有机化合物是精油的主要成分,自古以来就已经有了商业应用,包括香料和香精[3.].从芳香植物中提取的某些挥发性有机化合物已被用于治疗因其抗菌、消炎、祛痰、抗惊厥、镇痛和解痉活性而受益的疾病[1].此外,这些物质在VOC和EOS中的主要功能已经证明是对食草动物和病原体的防御[4,5,6].在一些植物中,发射的VOC也可以用作伤口密封剂[7].此外,某些释放的VOC也是植物毒性化合物的主要前体,也可以在植物 - 植物通信中起作用[8].虽然难以研究VOC和EOS的化学功能,但由于明显的亲脂性和挥发性,植物VOC和EOS的化合物和生物学特性仍然是有趣的研究主题。
在植物VOCs中,研究最深入的物质群是萜类化合物[9].五碳异戊二烯单元,包括各种各样的单萜和倍半萜,从许多物种中释放出来[10]. 萜类化合物主要是在阳光下从植物中释放出来的,阔叶树在萜类化合物的释放上表现出很强的季节性[11].挥发性萜类化合物的主要功能被认为是有效地保护动物不受各种食草动物的侵害,同时限制食草动物进化出抗性的机会[12,13].在食草动物伤害蕨类植物后释放了一系列倍二萜素Pteris为害[14].同样,随后遭到虫害的破坏Diabrotica virgifera virgifera对于玉米根,玉米植株能够发出(E)-吸引昆虫病原线虫的β-石竹烯[15].此外,VOCs或EOs中发现的多种萜类化合物对其他植物的幼苗、根和梢生长均显示出植物毒性[16].已鉴定为衍生自几种植物物种的精油中的组分的挥发性单萜烯醇1,4-桉孔和1,8-桉溶解,对根源和芽的萌发和生长表现出显着的抑制作用echinochloa crusgalli.和桂皮obtusifolia[17].栽培植物面临着许多相同的挑战,因为野生植物,但植物常常在天然栖息地外生长,栽培涉及人类的选择。野生植物可以培养,提供足够的食物以满足立即要求或对人类的令人满意的经济回报[18].然而,许多引进的植物会对其新环境中的原生生物多样性造成破坏。例如,Eichhornia Crassipes.(Mart。)SOLMS,原产于南美洲,在中国培养为牲畜的饲料,但现在已成为滇池水生生态系统的生物多样性和可持续性的主要威胁[19].相似地,Ageratina adenophora.(Spreng)。R.M. King & H. Rob原产于墨西哥和中美洲,最初作为观赏植物传入中国,但现在已成为一种入侵杂草,严重破坏了中国西南部的原生生态系统[20.,21].因此,在这些案例中保护生物多样性要求我们研究异国情调植物和本土生态系统之间的关系。
西刺参柏科,俗称北方白杉,原产于北美[22].因为它的香味,t . occidentalis早在1540年代就被引入了欧洲作为观赏树,这是长期的[23,24].最近,t . occidentalis被引入到许多中国城市,包括沉阳和昆明,作为观赏树。树木被切屑繁殖,许多人在2000年代以这种方式种植。沉阳种植的数千种栽培植物现在近10米高,并且具有蔓延的拥挤分支,具有特色植被。但是,下面的地面t . occidentalis通常是没有任何草的裸露的土壤,而近距离这些树木的植被是散发出来的苔藓和草药,而明显抑制生长。当叶子t . occidentalis被触摸或损坏,释放了一种强烈的芳香族气味,并且在冬季和早春的风中也自然地释放。因此,据认为应该释放挥发性生长抑制剂。被发现是从叶子中提取的eos最丰富的成分t . occidentalis在波兰培养[25].有趣的是,挥发性化合物从t . occidentalis表现出对种子萌发的植物毒性活性苋属caudatus和Lepidium一[26].然而,植物毒性物质在根际土壤中的作用机理尚不清楚,对真菌和植物的化感作用有待进一步研究。本研究的目的包括分析来自t . occidentalis使用GC-MS,并研究EOS和主要VOC组件的生物学活动。
结果
使用GC-MS分析VOC和EOS中的化学成分
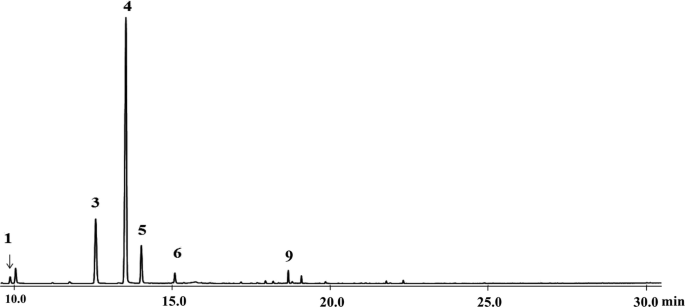
为了分析次生代谢产物t . occidentalisVOC通过闭环剥离系统获得VOC。随后,通过GC-MS直接分析收集的VOC。沉阳培养人口t . occidentalis含有六种单萜类细胞,其中( - ) - α-thujone是最丰富的单萜类(60.34±5.58%),其次是(+) - β-thujone(23.21±19.62%),然后是fenchone(14.00±3.46%)(图。1).由于VOCs的量不足以用于后续实验,EOs来自t . occidentalis然后使用氢化物方法收集沉阳和昆明[27].沈阳和昆明种群的EOs产量分别为0.61±0.03%和0.41±0.06%1).通过两种研究群体的GC-MS分析鉴定了14个萜类化合物,两种群体的EOS表现出类似的成分。发现沉阳和昆明的EOS总量的57.44±0.43%和69.22±10.43%和69.22±10.43%和69.22±10.49%。其他主要成分包括(+) - β-Thujone,Fenchone,硫代和(+) - 滨海。二萜类化合物不是非常挥发的,因此我们没有检测到VOC中的硫脲或(+) - 林。进一步确认成分的化学结构,EOSt . occidentalis在沈阳进行柱层析。有趣的是,两种主要成分(−)-α-thujone [28]和(+) - hibaene [29,通过与文献报道的核磁共振数据比较,纯化后成功鉴定[30.].
用EOS和( - ) - α-Thujone的种子萌发生物测定
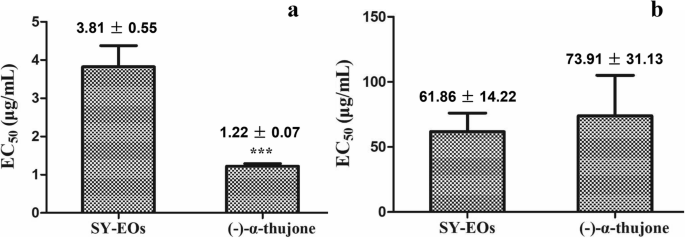
EOs的植物毒性效应t . occidentalis和大型化合物( - ) - α-thujone对种子萌发拟南芥蒂利亚纳和蒲公英被调查。如图所示。2,来自t . occidentalis沉阳(SY-EOS)的人口表现出更高的抑制性能,免受种子萌发A. Thaliana.而不是T. Mongolicum.,与欧共体50.值分别为3.81±0.55 μg/mL和61.86±14.22 μg/mL。其中,纯化合物(−)-α-图琼对种子萌发的抑制活性高于EOsA. Thaliana.,有一个ec50.值1.22±0.07μg/ ml。此外,( - ) - α-thujone也显然抑制了种子萌发T. Mongolicum.,有一个ec50.值73.91 ± 31.13 μg/mL,尽管这种作用弱于(−)-α-thujoneA. Thaliana.发芽(无花果。2).
EOS和( - ) - α-thujone的幼苗生长生物测定
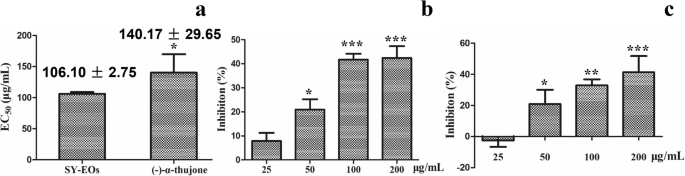
EOs来自t . occidentalis对沈阳种群和纯(−)-α-杜仲酮的生长进行了植物毒性试验T. Mongolicum.幼苗。EOs和(−)-α-thujone均能显著抑制根伸长T. Mongolicum.幼苗,eC50.值106.10 ± 2.75和140.17 ± 29.65 μg/mL(图。3.).syo - eos的抑制作用呈剂量依赖性,浓度可达100 μg/mL,最大浓度为200 μg/mL时,可使植株质量降低40-50%。化学试剂(−)-α-thujone表现出相似的抑制活性。而在25 μg/mL浓度下,(−)-α-图灵酮似乎略有促进T. Mongolicum.苗(无花果。3.).
沉阳人口EOS的抗真菌球活动
我们还对EOs进行了测试,以确定它们对四种真菌菌株是否有任何抗真菌活性。试验菌株为玉米病原菌Fusarium Graminearum.,Curvularia lunata., 和Bipolaris maydis,与一种人类真菌病原体白色念珠菌.的t . occidentalisEOS对所有四种真菌的症表现出有效的抑制活性,但比阳性对照,Nystatin(表2).
量化( - ) - 叶片中的α-thj
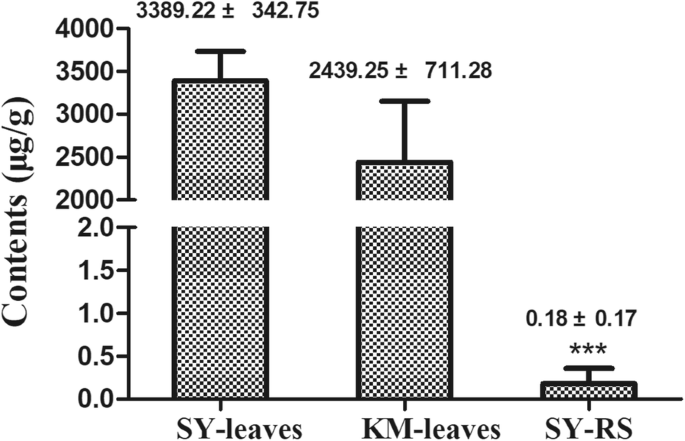
由于(−)-α-thujone是该化合物的主要化合物t . occidentalisEOS,我们进行了定量以确定其存在的浓度t . occidentalis叶子。根据外标法采用气相色谱-质谱法进行定量分析。(-)-α-杜仲酮在沈阳种群的浓度为3.39±0.34 mg/g,在昆明种群的浓度为2.44±0.71 mg/g。4).
根际土壤中EOs化合物的检测
确定来自eos的化合物是否积累在土壤周围t . occidentalis在沉阳,在0.5,1,3和5米的距离下收集根际土壤t . occidentalis植物。然后按上述方法分析土壤。结果表明(−)-α-thujone只能在0.5%的根际土壤中检测到 第m页t . occidentalis浓度为0.18±0.17 μg/g时(图5)。4).
讨论
据估计,世界上近14%的高等植物品种已被栽培[31].随着人类的干预,栽培植物能够适应新环境,包括改变气候条件,疾病和害虫。t . occidentalis作为一种观赏植物,对我国亚热带的昆明和中温带的沈阳等多种生境具有良好的适应性。用GC-MS分析了昆明和沈阳两个不同种群EOs的化学组成,共鉴定出14个相似的萜类化合物,其中两个种群EOs的主要成分为(−)-α-thujone、(+)-β-thujone、fenchone、rimune和(+)-hibaene。这表明气候条件对地球物理状态方程中的主要成分没有影响t . occidentalis.我们的结果与其他研究人员的研究结果一致Thuja.在其范围内,世卫组织列出了单萜类、倍半萜类和二萜类,尤其是(−)-以α-thujone为主要成分t . occidentalisEOs (23,32,33,34].通过气相色谱-质谱联用(GC-MS)和定量分析,我们发现(-)-α-杜仲酮含量最高,沈阳种群为3.39±0.34 mg/g,昆明种群为2.44±0.71 mg/g。4).因为EOs的主要成分和内容t . occidentalis在沉阳和昆明是相似的,eos来自新鲜的叶子t . occidentalis沉阳进一步用于分离和生物活性。( - ) - 通过经典的植物化学方法分离和鉴定α-硫穿线,得到1g纯化合物。此外,还分离了第二主要组分,二萜(+) - 滨烯,并使用NMR鉴定,并且第一次代表该化学品来自EOSt . occidentalis[35].
t . occidentalis具有广泛而迷人的生物活性。既往研究表明,该植物作为民间药物广泛用于支气管卡他炎、膀胱炎、遗尿、银屑病的治疗,并在顺势疗法和循证植物治疗中均有应用,提示该植物具有广泛的药理潜力[23].此外,已知的杀虫效果t . occidentalisEOs建议种植t . occidentalis可能有助于在引入外来昆虫的地方抵御外来昆虫[32,33,34]. 这些生物活性可能与EOs在植物体内对各种生物胁迫的自然功能有关。正如我们所料t . occidentalis果胶具有一定的抗真菌活性,可能对病原真菌的感染具有一定的保护作用。许多树木都能生产苏约恩,对许多生物都有明显的毒性[36].( - ) - α-Thujone对萌发的抑制活性A. Thaliana.种子(EC50.值为1.22±0.07 μg/mL)T. Mongolicum.发芽(EC50.值73.91±31.13μg/ ml),表明模型植物物种A. Thaliana.比野生植物更敏感到这种化学品。( - ) - α-Thujone和EOS抵抗种子萌发没有显着差异T. Mongolicum.. 此外(−)-α-thujone对小麦种子萌发的药害活性高于EOsA. Thaliana.,表明( - ) - α-thujone是EOS中的活跃组成部分t . occidentalis.然而,EOS比( - ) - α-Thujone更高的抑制活性T. Mongolicum.幼苗生长表明EOs中还存在其它植物毒性萜类化合物。
有趣的是(−)-α-thujone,植物中最丰富也是最有效的成分t . occidentalis在根际土壤中也检测到EOst . occidentalis树木,也曾在西部红杉下的土壤中检测到,t . plicata[37].这表明该化合物可以释放到环境中t . occidentalis作为一种对其他邻近竞争植物的化感物质。
结论
14种萜类化合物已被鉴定为中国产EOs的成分t . occidentalis生长在昆明和沈阳。主要成分包括(-)-α-图琼、芬琼酮、利米烯和(+)-hibaene,特别是(-)-α-图琼。EOs对4株真菌均表现出较强的抑菌活性。EOs和(−)-α- thujonone的植物毒性显著A. Thaliana.和T. Mongolicum.观察了种子萌发和幼苗生长情况。根际土壤中EOs含量最高的是(−)-α-thujone。本文的结果不仅揭示了挥发性EOs中存在的化学物质t . occidentalis在不同的气候条件下生长,而且还提供了更多的证据表明EOS和( - ) - α-Thujone抗种子萌发和幼苗生长的植物活性,以及( - ) - α-Thujone的可能作用,如同化学t . occidentalis.
方法
植物材料
的西刺参2018年4月在中国昆明(E: 102°74′,N: 25°14′,3株)和沈阳(E: 123°57′,N: 41°82′,10株)采集了植物材料。选择5岁左右的健康树收集VOCs,提取EOs。植物由崔文山教授提供鉴定,凭证标本(SYNUB013056-SYNUB013060)保存于沈阳农业大学生物科学与生物技术学院。进一步的植物材料采集自铁岭开发区北方白杉繁育中心t . occidentalis春季修剪后,可以免费获得树枝。野生型的拟南芥蒂利亚纳植物毒性测定采用(Col-0)法。的种子蒲公英Hand.-Mazz。经崔文山教授许可,从铁岭开发区北白杉繁育中心附近的一块北白杉中采集。T. Mongolicum.被博曲教授确定了T. Mongolicum.优惠券标本(同步014001-Synub014004)已存放在沉阳农业大学生物科学及生物技术学院。
从中释放的VOC集合t . occidentalis
使用如前所述的闭环剥离系统收集了沉阳栽培植物中释放的VOC。[27].简而言之,将每个植物放置在用闭环剥离装置盖上盖上盖上的玻璃室内。通过真空泵维持气流。使用150毫克超级Q陷阱(Supelco,Porapak,Bellefonte,Pa,USA)收集了1小时的VOC。然后用500μl己烷洗脱将每个集合柱加入气相色谱样品小瓶中。分析每种治疗,用五个独立的生物重复分析。
从叶子中提取eost . occidentalis
EOs是用clivenger -type装置进行水蒸馏得到的[38],选用取自昆明和沈阳两地种群的新鲜叶片25 g。提取过程持续1小时,得到的油随后在无水硫酸钠上干燥,并在黑色小瓶中冷藏,直到进行分析和测试。昆明种群设3个重复,沈阳种群设5个重复。
GC-MS分析
在配备自动注射器AOC-20IS的Shimadzu气相色谱仪 - 质谱仪(GC-MS)QP-2020(Shimadzu,日本)进行了eos,VOC和eos,VOC和ZHP-2020(Shimadzu,Japan)的定性和定量分析。使用RTX-5ms柱(30mm×0.25mm,薄膜厚度0.25μm)分离VOC,以氦气为载气,流速为1.78ml / min。将1μl的每个样品注入分割模式(分裂比为10:1),喷射器温度为250℃。烘箱温度程序如下:初始烘箱温度40℃,在5℃/ min以80℃下增加,在80℃下保持4分钟后,随后增加10°C / min。280°C和保持时间为3分钟。质量检测器,离子源,转移线和四极温度分别在230°C,250°C和150°C中设定,在70eV,扫描范围内具有电子撞击(EI)模式。m / z50 - 500。一个C8-C40分析了烷烃标准溶液(Sigma-Aldrich,USA)以计算保留指数(RIS)和监测系统性能。通过将其质谱与NIST14(Agilent Technologies,Palo Alto,CA,USA)和Wiley7n.1 MS-Libraries(Wiley Publishing,NJ)的参考光谱进行鉴定化合物,以及他们的RIS比较发表的数据(在文学中报告的非标准栏目Kováts保留指标(www.nist.gov.).采用峰面积积分法和定标法对目标化合物进行定量。
沉阳人口eos的主要成分孤立
大约50 用6 kg新鲜t . occidentalis来自沈阳的叶子。这些EOs在硅胶柱上进行色谱,用石油醚和石油醚:乙酸乙酯(V/V, 100:1)洗脱得到化合物4(约1克)和14(20毫克)。的纯度4GC-MS超过80%。
光谱数据(−)-α-thujone(4):无色油,1H NMR(丙酮-d6, 600 兆赫)δ: 0.94 (3H, d,J = 6.8 赫兹,H-8),1.01(3H,d,J= 6.8 Hz, H-9), 1.09 (3H, d,J= 7.5 Hz, H-10)。13c nmr(丙酮 -d6, 150 MHz)δ: 30.3(颈- 1),39.8 (c - 2), 219.6(颈),47.8 (c - 4), 26.2 (c - 5), 19.1(其他),33.7(即),20.2 (8),19.9 (C-9), 18.2 (C-10)。
(+)-hibaene的光谱数据(14),无色油,13c nmr(丙酮 -d6, 150 MHz)δ:39.9(C-1),19.2(C-2),42.8(C-3),33.7(C-4),56.8(C-5),20.7(C-6),38.1(C-7),49.8(C-8),53.6(C-9),38.0(C-10),20.9(C-11),33.8(C-12),44.2(C-13),62.0(C-14),136.0(C-15),136.8(C-16),25.2(C-17),34.0(C-18),22.3(C-10),15.5(C-20)。
种子萌发生物测定
消毒的种子拟南芥蒂利亚纳和T. Mongolicum.使用前在4°C冰箱中保存2天。将种子播种在MS培养基上[1.0%琼脂(w/v), pH 6.0],并以SY-EOs和(−)-α-thujone为试验样品。对这些样品进行了活性测试A. Thaliana.浓度分别为25、20、15、10、5、1和0 μg/mL。此外,结果表明,没有显著的活性T. Mongolicum.在预处理25μg/ ml浓度。因此,测试样品进行活性T. Mongolicum.浓度分别为200、100、50、25和0 μg/mL。首先将这些样品溶解在DMSO中,以使溶剂的最终浓度不超过0.5%。每次试验中,15粒种子分布在皮氏培养皿(直径6.0 cm)的湿润MS培养基上。每种物种每个浓度都有4个重复。种子在22°C(白天)和18°C(夜晚)光照16 h、黑暗8 h条件下萌发。每天检查萌发种子的数量,直至对照培养皿中的大部分种子(≥90%)已萌发。在4天内计算萌发数。欧共体50.确定抑制种子萌发。
幼苗生长生物测定
T. Mongolicum.如上所述预处理种子。根据种子萌发的结果,测试样品进行活性T. Mongolicum.浓度分别为200、100、50、25和0 μg/mL,每个浓度下4个重复。在每个测试中,15颗种子被放置在直径15厘米的培养皿中。培养皿在22°C(白天)和18°C(夜晚)条件下分别放置在光照16 h和光照8 h的生长室内。在萌发后7 d测定幼苗的根长和全苗重量。欧共体50.确定抑制幼苗根源。
抗真菌实验
根据文献中描述的肉汤微量稀释法进行抗真菌活性测定[39,稍加修改。并对其体外抗真菌活性进行了测定Fusarium Graminearum.(ACCC37120),Curvularia lunata.38967年(ACCC)Bipolaris maydis(ACCC 38948),和白色念珠菌,均摘自《中国农业文化收藏》。每个样品在DMSO中配制2倍连续稀释,范围为256 ~ 4 μg/mL,最大浓度为1% (v/v)。真菌菌株在马铃薯葡萄糖琼脂上28°C培养1周,以培养孢子。马铃薯葡萄糖肉汤标准为105孢子/ ml。然后将100μl每种孢子悬浮液加入96孔板中。将负控制板与相等体积的DMSO一起温育。Nystatin被用作抗真菌活性的阳性对照。每次治疗都会运行五次重复。在40rpm孵育瓶中48小时后,用OD的分光光度计读取微量滴定板的孔62550%抑菌浓度(IC50.)计算出来。
根际土壤中EO化合物的检测t . occidentalis
在0.5,1,3和5米的距离处收集根际土壤t . occidentalis在0 ~ 2 cm深度之间形成沈阳种群。去除植物残留后,样品(5 g土壤)加入30 mL石油醚进行石油醚萃取,室温超声培养30 min, 12000 rpm离心10 min。上清液在真空中浓缩。溶剂蒸发后,将萃取物溶解在1ml己烷中,然后使用上述GC-MS方法进行分析。每个处理有5个独立的生物重复。
( - ) - α-thujone在叶片和根际土壤中的定量t . occidentalis
(−)-α-黄酮在叶片和根际土壤中的定量t . occidentalis使用与上述相同的GC-MS方法进行,将孤立的真实样品作为外标。叶样品从沉阳和昆明群中取出,并如上所述制备,而根际土壤的样品仅从沉阳人口收集。对于样品中的( - ) - α-Thujone的定量,制备( - ) - α-Thujone的校准曲线。在五份浓度(10,5,1,0.5和0.1μg/ ml)下进行三份注射,通过绘制峰面积与浓度来获得线性校准曲线。最后,从( - ) - α-thujone的线性研究中获得的等式和相关系数(4)是y= 3 e-06x- 0.2923(右2= 0.9997)。
统计分析
数据以生物重复的平均值±标准差表示。对实验数据进行统计分析t在SPSS 19.0中进行测试运行。价值在哪里p < 0.05 were considered significant.
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文中。
缩写
- EOs:
-
精油
- DMSO溶液:
-
二甲亚砜
- 气相:
-
气相色谱 - 质谱仪
- 集成电路:
-
抑制浓度
- km:
-
昆明植物种群分布
- 核磁共振:
-
核磁共振
- SY:
-
植物种群分布在沈阳
- SY-EOs:
-
沉阳人口分布的植物精油
- SY-RS标准:
-
沉阳人口分布的植物根际土
- 挥发性有机化合物:
-
挥发性有机化合物
参考文献
- 1.
Maffei ME、Gertsch J、Appendino G。植物挥发物的产生、功能及药理作用。2011年Nat产品报告;28(8):1359–80.
- 2.
Kigathi RN, Weisser WW, Reichelt M, Gershenzon J, Unsicker SB. .植物挥发性物质的释放取决于邻近植物群落的物种组成。中国生物医学工程学报,2019;
- 3.
植物挥发物的形成和功能:吸引和防御传粉者的芳香。植物生物学杂志。2002;5(3):237-43。
- 4.
Pichersky E,Sharkey Td,Gershenzon J.植物挥发物:缺乏功能或缺乏知识?趋势植物SCI。2006; 11(9):421。
- 5。
Sokame BM、Ntiri ES、Ahuya P、Torto B、Le Ru BP、Kilalo DC等。毛虫诱导的植物挥发物在玉米植株鳞翅目茎叶螟群落内吸引同种和异种成虫产卵。化学生态学。2019;29(3):89–101.
- 6。
Yip EC, toker JF, Mescher MC, De Moraes CM。植物防御启动的成本:暴露于来自专业食草动物的挥发性线索会增加短期生长,但会减少高枝黄连的根茎产量(一枝黄花altissima).中国生物医学工程学报,2019;
- 7。
Penuelas J,LiSia J. Plant VOC排放:利用不可避免的。趋势ECOL EVOL。2004; 19(8):402-4。
- 8。
关键词:挥发性有机化合物,入侵植物,生物源性,互作效应植物生态。2009;203(2):195 - 205。
- 9。
Rahmani R,Andersson F,Andersson Mn,Yuvaraj JK,Anderbrant O,HedenströmE.在胡萝卜中的鉴定Sesquisabine B(胡萝卜胡萝卜L.)叶是一种对胡萝卜木虱有电生理活性的化合物(Trioza军。福斯特)。Chemoecology。2019;29(3):103 - 10。
- 10。
范H,Li K,Yao F,Sun LW,Liu Yj。比较转录组分析现场和山地栽培人参根萜类代谢。BMC植物BIOL。2019; 19(1):82。
- 11.
帕迪PK,瓦什尼CK。热带树种异戊二烯排放。环境污染。2005;135(1):101–9.
- 12.
Courtois EA, Baraloto C, Paine CE, Petronelli P, Blandinieres PA, Stien D,等。热带树种树皮与树叶中挥发性萜烯组成的差异。植物化学。2012;82:81-8。
- 13.
张学华,牛美,泰克谢拉·达席尔瓦·贾,张YY,袁YF,贾义新,等。三个参与植物化学防御和非生物胁迫的新萜烯合成酶基因的鉴定和功能鉴定圣塔卢姆专辑.中国生物医学工程学报,2019;
- 14.
Imbiscuso G, Trotta A, Maffei M, Bossi S. Herbivory诱导蕨类植物ROS的爆发和挥发性有机化合物的释放Pteris为害L. J植物互动。2009; 4(1):15-22。
- 15.
塞尔吉奥R,图林斯TCJ。地上和地下食草动物同时取食削弱了植物对各自天敌的吸引力。Ecol Lett公司。2010;10(10):926–36.
- 16。
Barney JN, Hay AG, LA Weston。艾蒿化感挥发物的分离与鉴定(Artemisia寻常型).J Chem Ecol。2005; 31(2):247-65。
- 17。
罗马·杰克,帝王AFE。挥发性豆果对两种杂草物种的化感作用。J Chem Ecol。2000; 26(1):303-13。
- 18。
Allard RW。植物群体遗传学的历史。Annu Rev Genet。1999年; 33(4):1-27。
- 19。
周杰,潘霞,徐辉,王强,崔磊Eichhornia Crassipes.影响沉水植物对养分的利用能力。可持续性。2017;9(4):565。
- 20。
于晓军,马克平。繁殖特征的变异紫茎泽兰不同栖息地的种群。杂草研究》2010;46(4):319 - 26所示。
- 21。
郑刚,贾勇,赵旭,张飞,罗胜,李胜,等。o- 来自侵入性的豆酸紫茎泽兰是一种强效植物毒素。Chemoecology。2012;22(2):131 - 8。
- 22。
Chang L, Song L, Park E, Luyengi L, Lee K, Farnsworth N等。生物活性成分西刺参.自然科学学报,2000;63(9):1235-8。
- 23.
Naser B,Bodinet C,Tegtmeier M,Lindequist U.西刺参(乔木vitae):综述其药物、药理和临床特性。中国生物医学工程学报。2005;2(1):69-78。
- 24.
Hofmeyer PV,Seymour Rs,Kenefic LS。生产生态学西刺参.科学通报。2010;40(6):1155-64。
- 25.
Dimitroula T, Konstantia G, Loretta POO, Miroslawa KB, Caroline S, Ioanna C.化学系统价值Thuja.在波兰栽培的菌种抗菌活性。分子。2009;14(11):4707 - 15所示。
- 26.
植物种子萌发和生长的天然抑制剂,V.可能的化感作用西刺参.Z Naturforsch C Biosci。1990; 45(7-8):835-44。
- 27。
Tholl D, Boland W, Hansel A, Loreto F, Rose US, Schnitzler JP。植物挥发性物质分析的实用方法。植物j . 2006; 45(4): 540 - 60。
- 28。
Sirisoma SN, Karin HM, John CE。α-和β-Thujones(草药和食品添加剂):羟基和脱氢代谢物的合成和分析。农业化学学报。2001;49(4):115 - 21。
- 29。
MartínSA,Rovirosa J,Becker R,Castillo M. Diterpenoids来自Baccharis拖拉.植物化学,1980;19(9):1985 - 7。
- 30.
C.内酯类:39。(−)-α-和(+)-β-苏酮内酯的化学和微生物合成。Phytochem。2012;5(2):340 - 5。
- 31。
Khoshbakht K,Hammer K.栽培多少植物物种?遗传资源作物evol。2008; 55(7):925-8。
- 32。
Szołygab,gniłkar,szczepanik m,szumny a。化学成分和杀虫活性西刺参和Tanacetum vulgare精油对小粉虱的幼虫,Alphitobius diaperinus.应用昆虫学报,2014;
- 33。
部分精油对小菜蛾幼虫的杀虫活性斜纹夜蛾.Fitoterapia。2005; 76(7):691-6。
- 34。
KéětaSM,Vincent C,Schmidt JP,Arnason JT。杀虫作用西刺参(柏科)精油。植物科学。2001;81(1):173–7.
- 35.
关键词:植物精油西刺参中国植物精油研究1993;5(2):117-22。
- 36.
拥有km,sirisoma ns,ikeda t,narahashi t,casida je。α-Thujone(Absinthe的活性成分):γ-氨基丁酸型受体调节和代谢解毒。Proc Natl Acad Sci U S A. 2000; 97(8):3826-31。
- 37.
Strobel B,Jensen PH,Rasmussen LH,Hansen HCB。Thujone在土壤下北美乔柏. 《斯堪的纳维亚森林研究杂志》,2005年;20:7–11.
- 38.
Avetisyan A,Markosian A,Petrosyan M,Sahakyan N,Babayan A,Aloyan S等人。化学成分和罗勒精油的一些生物活性发电机不同的品种。2017;17(1):60。
- 39。
Altıntop MD, Özdemir A, Turan-Zitouni G, Ilgın S, Atlı Ö, Demirel R,等。一种新型噻唑基吡唑啉衍生物的合成及抗真菌活性、细胞毒性和遗传毒性的评价。Eur J Med Chem. 2015; 92:342-52。
致谢
我们感谢Bo Bu和Wenshan Cui教授的培养和鉴定植物材料的帮助。
资金
本研究由国家重点研发计划(no . 2017YFD0201400, no . 2017YFD0201403),辽宁省振兴人才计划(no . XLYC1907151),辽宁省教育厅科学研究基金(no . LSNQN201704)资助,沈阳农业大学科研基金(880416055)。作者声明,没有任何资助机构在研究的设计或收集、分析、解释数据或撰写手稿中扮演任何角色。
作者信息
隶属关系
贡献
LPB和SHL设计了实验;LPB、WJW和JH进行了实验;ZFG和SHL撰写了手稿。SHL将处理评审、出版及出版后各阶段的函件。所有作者已阅读并批准最终稿件。
通讯作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放获取本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
白,L.,Wang,W.,Hua,J.等。中国北方白雪松挥发性有机化合物和精油的防御功能。BMC植物BIOL.20,500(2020)。https://doi.org/10.1186/s12870-020-02716-6
已收到:
接受:
发表:
关键词
- 西刺参
- 挥发性有机化合物
- 精油(EOS)
- 植物毒性效应
- 种植植物