抽象的
背景
生长调节因子(GRF)是控制器官尺寸的植物特异性转录因子。十九GRF.基因被鉴定在Populus Trichocarpa.据报道基因组和一个主要通过调节细胞扩张来控制叶片尺寸。在这项研究中,我们进一步表征了其他杨树GRF在叶子尺寸控制中以类似方式的作用。
结果
19个杨树GRF.根据系统发育关系将基因分为6类拟南芥grfs。生物信息分析,降解和瞬时转录测定显示,MiR396调节18个白杨GF,GRF12b唯一的例外。职能Paggrf6B.(Pag,Populus Alba.×P. Glandulosa.),Paggrf7a.,Paggrf12a.,Paggrf12B.代表三个不同的群体,被调查。结果表明Paggrf6B.可能在叶子尺寸控制上没有功能,而且Paggrf7a.通过调节细胞的扩张,作为叶片大小的负调节因子。相比之下,Paggrf12a.和Paggrf12B.可能通过调节细胞增殖和扩张,主要是细胞增殖来调控叶片大小。
结论
杨树GRFs在叶片大小控制上的多样性可以通过对细胞增殖和扩张的精细调节促进杨树叶片发育的特异性、协调性调控。
背景
生长调节因子(growth - regulated factors, GRFs)是植物特有的转录因子,通过调控细胞增殖或细胞扩张来调控叶、根、茎、花和种子的生长发育,从而形成更大的器官[1,2,3.,4].GRFS形成报告的植物基因组中的多尾家族:六个基因山茶花Sinensis.,八个基因vitis Vinifera, 9个基因拟南芥, 9个基因素类, 10个基因Pyrus Bretschneideri., 12个基因奥雅萨苜蓿,13个基因茄属植物lycopersicum, 14个基因玉米, 17个基因芸苔属植物拉伯,19个基因Populus Trichocarpa.和25个基因烟草[5,6,7,8,9,10,11,12,13,14].Glu-Leu-Glu (QLQ)和Trp-Arg-Cys (WRC)结构域在蛋白-蛋白相互作用中GRF的功能是必不可少的[15]和DNA结合[16),分别。全基因组分析显示GRFs和少数bZIP转录因子是miR396的主要靶点[17].
GRF对于叶子尺寸控制很重要[1,2,3.,4].过度的Atgrf1.(在,拟南芥),大rgrf2.(MiR396目标站点中的突变,MiR396抗性版本),大rug3.,大ratgrf7.,大rug9.,atgrf5.,BNGRF2.(Bn,芸苔栗鸟),或BRGRF8(Br,芸苔属植物拉伯)拟南芥和过度表达Rzmgrf1.(ZM.,玉米)玉米所有的结果都是更大的叶子,而GRF.miR396突变或过表达导致叶子变小[6,10,18,19,20.,21,22].有趣的是,大多数报道的GRF(atgrf2.,atgrf3.,atgrf5.,BNGRF2.,BRGRF8,ZmGRF1)通过调控细胞增殖来控制叶片大小[10,15,18,20.,21,22]除ZMGRF10外,通过细胞增殖和细胞扩张来调节叶片尺寸,但主要通过细胞增殖[23].以前,我们发现杨树GRF15的过度表达,GRF15也导致了更大的叶片,进一步的分析显示,这种GRF控制的叶片尺寸主要通过调节细胞扩张[24],这与报告的grf不同。自从19个grf在Populus Trichocarpa.基因组(11]叶片发育对于种类的杨树生物量产生很重要P. nigra.以及种类的干旱/耐盐性P.euphratica.,我们想知道是否以及如何以及如何在叶子尺寸控制中函数。
在这里,我们根据其系统发育关系重新命名杨树GRFs拟南芥并将其分为六组,并对其功能进行了表征Paggrf6B.,Paggrf7a.,Paggrf12a.,Paggrf12B.来自三个不同的组。研究发现,并非所有的grf都能调控叶片发育,其调控叶片大小的机制也各不相同。
结果
根据他们的杨树GRF的名称拟南芥orthologs.
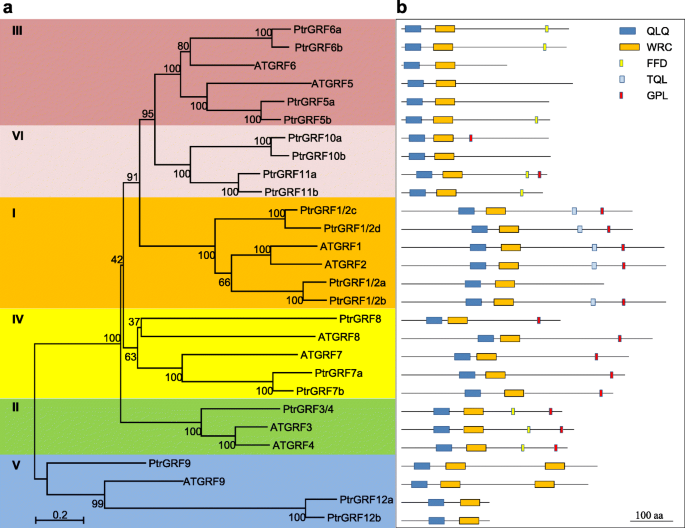
19个候选人GRF.基因被发现在Populus Trichocarpa.基因组(11].实现比较PtrGRFs(Ptr,Populus Trichocarpa.)atgrfs., 19人确认PtrGRFs按照他们的拟南芥直接同源(无花果。1, 图。S1).根据系统发生树,PtrGRFs可分为六组(图。1无花果。S2),VI组作为报告分类的补充组atgrfs.[6].在第I组,四PtrGRFs聚集Atgrf1.和atgrf2.并被命名PtrGRF1/2a,PtrGRF1/2b,PtrGRF1/2c,PtrGRF1/2d(图。1a).在第二组,只有一个PtrGRF基因与atgrf3.和atgrf4.并被命名Ptrgrf3 / 4.(图。1一种)。在第三组,atgrf5.和Atgrf6.每个都有两个杨树直滴草,相应地命名(图。1一种)。在第四组,三PtrGRFs根据他们的序列相似命名atgrf7.和atgrf8(图。1一种)。在v组,虽然三PtrGRFs聚集atgrf9., 只有一个PtrGRF有两个WRC域名命名PtrGRF9(图。1A和B)。另外,四个PtrGRFs没有关闭拟南芥orthologs聚集在VI组并命名PtrGRF10a,PtrGRF10b,PtrGRF11a,PtrGRF11b(图。1a)。这两个概念PtrGRFs聚集在一起atgrf9.,但缺少额外的WRC域名被重命名PtrGRF12a和PtrGRF12b(图。1A和B)。桌子S1显示完整的基因信息PtrGRFs和atgrfs..
系统发育关系及基因结构A. Thaliana.(在),p . trichocarpa(Ptr)平基因。一个AtGRFs和PtrGRFs的系统发育树。使用Clustal X2.1对GRF全长蛋白序列进行比对,用MEGA 5.0构建相邻连接系统发育树。根据系统发育关系将PtrGRFs分为6组(用不同的背景颜色标记)。bGRF蛋白中的保守结构域或基序。QLQ和WRC域、FFD、TQL和GPL基序(用不同颜色的盒子表示)因保守Gln-Leu-Gln (QX3.LX.2Q),TRP-ARG-CYS(WRC),PHE-PHE-ASP(FFD),THR-GLN-LEU(TQL)和序列中包含的GLY-PRO-LEU(GPL)残留物
的规定PtrGRFsMIR396
因为grf是miR396的主要靶点[17], miR396与PtrGRFs调查了。首先,序列PtrGRFs以及杨树的成熟序列miR396b上传到rnahybrid [25,26]分析是否PtrGRFs是目标mir396..这表明所有的PtrGRFs, 除了PtrGRF12b,有可能与之杂交miR396b最小自由能杂化值小于−33千卡/摩尔,表明这些PtrGRFs可能是目标mir396.(图。2一种)。为了PtrGRF12b和mir396.,错配数超过了其他杂交对,杂交能量为−28千卡/摩尔,超过了大多数内源性miRNA靶标的观测值[27),这表明PtrGRF12b不是目标mir396.(图。2一种)。然后,我们对齐目标序列PtrGRFs的成熟miR396b序列(图。S3).序列PtrGRF1/2a-ptgrf12a.和mir396.完美匹配,而胸腺嘧啶到腺嘌呤变化的3'终端PtrGRF12b导致了不匹配,说明PtrGRF12b是唯一的PtrGRF不是目标mir396.(图。S3).
此外,降解测序数据[28进行分析以鉴定mir396.裂解位点PtrGRFs(图。2b).与预期的一样,大多数miR396的裂解位点PtrGRFs是否在降级数据中发现,而在GRF12b转录物(图。2B,表格S2),证明了在体内调控表达PtrGRFs经过mir396.与RNAhybrid分析一致。
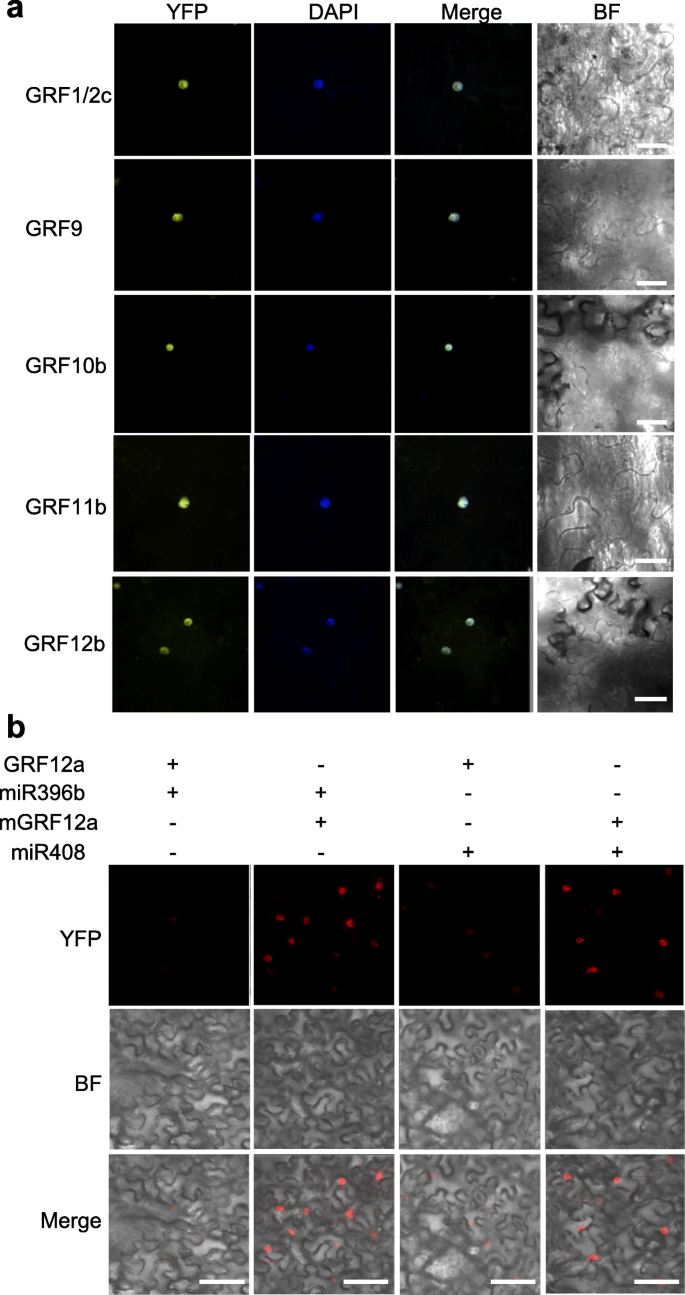
此外,利用瞬时表达试验研究了杨树的调控作用GRFS.经过mir396..在融合Paggrf1 / 2c.,PagGRF9,Paggrf10b.,Paggrf11b.,Paggrf12B.从84 K杨中分离的基因(见方法),含有YFP(黄色荧光蛋白),并在烟叶中瞬时表达,所有的PagGRF-YFP融合蛋白的荧光信号都很弱(图1)。S4)除Paggrf12b之外(图。3.a).考虑到植物miRNAs的功能保存,微弱的荧光信号可能是由于裂解Paggrfs.由烟草miR396。为了验证这一点,mir396.的-抵抗版本GRFS.,其中包含MIR396 - 互补领域内的六点突变GRF.在不改变氨基酸序列的情况下,增加错配的数量。S5).与预期的一样,mPagGRF-YFP融合蛋白的荧光信号较强,并与DAPI信号合并(图5)。3.a),表明MiR396靶向所有Paggrfs,除Paggrf12b之外。此外,进行瞬时共表达测定和PtrmiR408被用作否定对照来评估调节Paggrf.经过pagmir396b.(图。3.b)。类似于GRF1 / 2D的荧光信号[以前由CAO等人命名的GRF15。(2016)]在我们发表的结果中[24[Co-Compysted,GRF12A-YFP的荧光信号较弱PtrmiR408,但胆小而难以检测与联合表达pagmir396b.,这表明pagmir396b.可以下调表达吗Paggrf12a..相比之下,在共同表达时检测到MGRF12A-YFP的相当强荧光,突变版本pagmir396a.或PtrmiR408.这些结果证实了pagmir396b.可能的目标Paggrf.直接在体内。
过度的Paggrf6B.,Paggrf7a.,Paggrf12a.,Paggrf12B.导致了转基因杨树叶片大小的不同变化
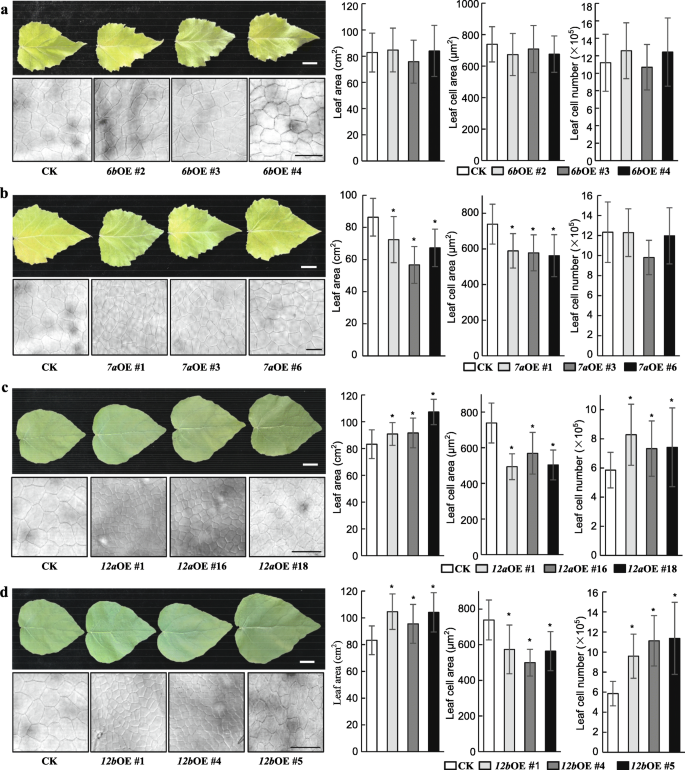
我们以前的研究中的结果[24)表明,GRF1/2a,GRF1/2b,GRF1/2c,GRF1/2d,GRF5A.,GRF5B.,GRF6B,GRF7A,GRF7B.,GRF8,GRF9,GRF10a,GRF11a,GRF11b,GRF12a在年轻的叶子中都很高度表达,这表明这些GRF可能在叶子尺寸控制中具有作用。此外,虽然其表达在所有组织中相对低,但MiR396独立的GRF,GRF12b,幼叶中的相对相对表达更高。因此,研究杨树GRFS在叶子尺寸控制中的功能,Paggrf6B.代表第三组,Paggrf7a.第四组,和Paggrf12a.和Paggrf12B.选择V组以产生用于功能性表征的转基因植物(图。1和4).变异版本的Paggrf6B.,Paggrf7a.,Paggrf12a.,用MiR396靶位点中的同义突变用于避免MiR396的降解(图。S6).三个过度表达(OE)线为mPagGRF6b,mpaggrf7a.,mpaggrf12a.,Paggrf12B.选择适量增加相应基因的表达量进行进一步研究(图。S7).叶子尺寸mPagGRF6bOE植物没有显着差异(图。4一会儿mpaggrf7a.OE植物比对照(CK)的叶子较小26.8%(图。4b)。相比之下,mpaggrf12a.和Paggrf12B.与CK相比,OE植物分别具有16.1和28.1%的叶片(图。4C和D)。
测定叶表皮细胞面积,计算叶细胞数mPagGRF6b,mpaggrf7a.,mpaggrf12a.,Paggrf12B.OE植株与CK植株比较。叶表皮细胞面积米Paggrf6B.没有显着变化(图。4答案:A米Paggrf7a.,米Paggrf12a.,Paggrf12B.OE植物(图。4B-D)。叶细胞的数量mPagGRF6b和mpaggrf7a.OE植物没有显着差异(图。4A和b),但显著增加mpaggrf12a.和Paggrf12B.OE植物(图。4C和D)。
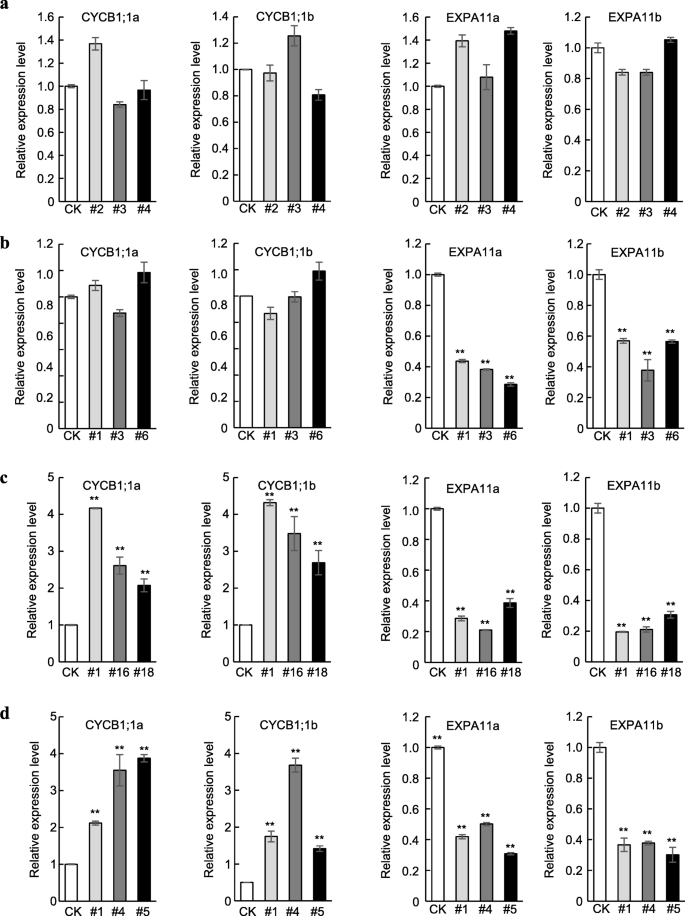
此外,细胞增殖标志物基因的表达1 CYCLINB1;和CYCLINB1; 1 b和细胞膨胀标记基因expa11a.和expa11b.(周等人。2019年)在第五个叶子中进行了检查mPagGRF6b,mpaggrf7a.,mpaggrf12a.,Paggrf12B.植物。与我们的观察结果一致,表达1 CYCLINB1;和CYCLINB1; 1 b是不变的mPagGRF6b和mpaggrf7a.OE植物,但上调在mpaggrf12a.和Paggrf12B.OE植物(图。5, 图。S8).同时,表达expa11a.和expa11b.没改变多少吗mPagGRF6bOE植物,但显着下调mpaggrf7a.,mpaggrf12a.,Paggrf12B.OE植物(图。5, 图。S8).
这些结果表明Paggrf6B.在叶子尺寸控制中没有功能;Paggrf7a.作为叶片大小的负调控因子,主要通过调控细胞的扩张;和Paggrf12a.和Paggrf12B.通过细胞增殖和细胞扩张正向调控叶片大小,但主要是通过细胞增殖。
讨论
grf在杨树他们在叶片开发中的功能多样化引起了我们的注意。我们已经重新分组了19款确定的GRFp . trichocarpa基因组根据它们的系统发育关系与他们的系统发育关系拟南芥基于正轨的同行并重命名这些杨树GRF。这有助于比较GRF成员的进化和功能多样性杨树和拟南芥.我们发现由于差异的差异GRF.序列在杨树是19岁的19个PtrGRFs,PtrGRF12b,不是MiR396的目标Paggrf6B.,Paggrf7a.,Paggrf12a.,Paggrf12B.对叶片大小的控制作用不同。
以前,我们报告说Paggrf15(在本研究中命名为Paggrf1 / 2d)可以通过主要调节细胞扩张作为叶子尺寸的正调节器[24].在这里,我们发现PagGRF7a明显作为叶片大小的负调控因子,而PagGRF6b对叶片发育没有影响,而PagGRF12a和PagGRF12b与PagGRF1/2d作为正调控因子类似,这表明不同的杨树grf成员在叶片大小控制中具有不同的作用。此外,我们发现PagGRF7a通过负向影响细胞膨胀来调节叶片大小,而PagGRF12a和PagGRF12b通过正向影响细胞增殖,负向调节细胞膨胀。所有这些grf与PagGRF1/2d表现出差异,而PagGRF1/2d对细胞扩张有积极影响。与我们之前的报告相比,不同杨树GRFs对叶片大小控制的意外多样化调控提供了更多和更多的信息。
mir396.调节表达GRFS.通过直接切割互补序列GRF.基因[18].在这里,我们发现18岁PtrGRFs是由mir396., 和PtrGRF12b唯一的例外,基于序列比较,转录物的切割位点以及体内miRNA-靶分析。相比下,mir396.没有瞄准两个grfsA. Thaliana.,atgrf5.和Atgrf6.[29,30.].PtrGRF12b属于v组,而atgrf5.和Atgrf6.属于第三组,建议MIR396条例模式GRFS.两种物种有不同的特征。最近据报道,除了叶片发展中的功能外,AtgrF5在叶绿体发育,氮信号和衰老中发挥作用[31].因此,miR396调控GRFs的丢失和获得可能导致其在植物生长发育中的功能转变。PtrGRF12b是否具有其他mir396调控的grf之外的功能有待进一步研究。
此外,我们的研究也提示了miR396对杨树GRF基因调控的重要性拟南芥[18,21,32].首先,通过瞬时表达测定来测试使用MiR396抗性版本的MiR396对GRF的调节,以获得GRF的过表达。表达细胞的荧光信号Paggrf6B.-YFP,Paggrf7a.-yfp和Paggrf12a.-yfp是微弱的,几乎没有检测到的,而信号表达了他们的mir396抗性版本是强大的,估计Paggrf12a.-yfp在图中。3.,表明这些grf受到细胞中存在的miR396的调控。其次,虽然PagGRF12a和PagGRF15(本研究中的PagGRF1/2d) [24)是叶片大小的正调节因子pagmir396b.OE植物表现出叶片较小的表型[24],暗示MiR396B对叶片尺寸调节的“简化”效应。因此,MiR396和GRF的相互作用对于叶片发育是重要的。
GRFs是叶片发育的重要调控因子[3.,4],我们发现该研究中GRF的功能分歧。Paggrf7a是一个负调节剂,而Paggrf12a和paggrf12b是叶子尺寸的正调节剂,Paggrf6b对叶子尺寸没有影响。在拟南芥、AtGRF1、AtGRF2、AtGRF3、AtGRF5和AtGRF7都是叶片大小的正调节因子[15,18,21,32],而只有AtGRF9作为叶片大小的负调控因子[33].因此,来自杨树的GRF和拟南芥表现出叶片大小的不同调控,其功能需要单独评估。此外,它感兴趣的是杨树GRF12a和GRF12b,像水稻和玉米GRF10 [23,30.],截断的C末端端。提出过度表达ZmGRF10可能会破坏明显的GRF / GIF复合物的稳态,并导致其他GRF / GIF复合物的表示改变以影响叶片生长[23],是否需要调查Poplar GRF12A和GRF12B也可以通过这种方式进行工作。
我们还注意到那棵白杨树拟南芥在同一组中分类的GRF可以以不同的方式运作叶子尺寸控制。例如,来自III组的PAGGRF6B对叶片尺寸没有影响,而III组的ATGRF5是叶子尺寸的正调节器[15].Paggrf7a.来自IV组的AtGRF7作为负调控因子,而来自同一组的AtGRF7作为叶大小的正调控因子[32].相似地,Paggrf12a.和Paggrf12B.来自V组工作作为正稳压器,同时atgrf9.来自V组是叶尺寸的负调节器[33].相比之下,尽管I组的PagGRF1/2d与I组的AtGRF1和AtGRF2相似[18,这三种植物都是叶片大小的正向调节因子[24] Paggrf1 / 2d主要通过调节细胞扩张,而AtgrF1和AtgrF2主要通过调节细胞增殖。因此,不能简单地推断出杨树中GRF控制叶片尺寸的方式拟南芥.
之前,我们报道过PagGRF1/2d主要通过调节杨树的细胞扩张来调节叶片大小[24,这与所有报道的都不一样拟南芥GRFs包括AtGRF1、AtGRF2、AtGRF5、AtGRF7、AtGRF9等,主要通过调节细胞增殖发挥作用[15,18,21,32,33].在这项研究中,我们发现Paggrf12a和Paggrf12b主要通过调节细胞增殖,而Paggrf7a和Paggrf1 / 2d分别负面或积极地,主要通过调节细胞扩张来调节叶片尺寸。因此,GRFS调节叶片尺寸的潜在机制比杨树更多样化拟南芥.叶子尺寸对于木质植物中的生物质生产非常重要[34]应该紧张控制。Poplar的GRF数量超过了两倍多拟南芥(19 vs.9),因此杨树中这些GRFS的叶片大小的多样化调节将通过细胞增殖和扩张的微调来促进叶片发育的具体和协调调节。
结论
总之,我们分析了GRF基因的系统发育关系杨树和他们的同行拟南芥以及PagGRF6b、PagGRF7a、PagGRF12a和PagGRF12b的功能特征,它们在转基因杨树叶片大小控制中起不同的作用。这种多样性可以通过对细胞增殖和扩张的精细调节促进杨树叶片发育的特异性、协调性调控。我们的研究结果为树木叶片大小的基因工程提供了丰富的资源。
方法
种系发生树结构
杨树平基因序列从杨树基因组数据库(http://www.phytozome.net/poplar.php., 3.0版本)。所有序列均根据QLQ和WRC域的注释进行确认。狼PSORT (http://wolfporport.org.)预测蛋白的亚细胞定位。用Lasergene估计pI和分子量。全长蛋白序列用ClustalX2 (ver.)进行比对。2.1) (35].使用MEGA (v5.0)和bootstrap方法(1000个bootstrap复制,泊松模型,均匀率和成对删除)构建了邻居连接系统发育树[36].使用报道的FFD、GPL和TQL基序分析PtrGRF序列的功能基序或域[8作为查询来查找相应的序列。
降级测序
降级数据来自我们之前的研究[28].的退化库p . tomentosa从再生组织中收集的总RNA样本中包含多聚(A)尾部的部分构建,以鉴定miRNAs的靶基因。然后,使用CleaveLand管道和psRNATarget (http://plantgrn.noble.org/psRNATarget/)来预测mirna的靶点p . trichocarpa基因组(V3.0)。
瞬时表达检测
瞬时表达试验是根据我们之前的报道进行的[24].GRF1/2c,GRF9,GRF10b,GRF11b,GRF12b从杂交杨树克隆84k (Populus Alba.×P. Glandulosa.,Pag中国林业科学研究院林木遗传育种国家重点实验室。使用pEarleyGate 101载体生成PagGRF-YFP结构,使用pMDC32载体过表达pagmir396b.和PtrmiR408.将各种构建组合引入1个月大的尼古利亚娜·宾夕法尼亚州(由树遗传学和育种国家重点实验室保留,中国林业学院)叶农杆菌- 渗透。使用LSM 510 AX70(Zeiss)探测荧光信号。
植物转型
植物转化工作如先前报导所述[24].GRF6B.,GRF7A,GRF12a,GRF12b采用表中所列引物从84k中克隆S3.使用pMDC32载体过表达Paggrf6B.,Paggrf7a.,Paggrf12a.,Paggrf12B..通过所有载体转化为84k叶片圆盘农杆菌介导的转化。组织培养的植物在长日条件下生长(16小时光/ 8小时暗)。通过检查相应基因的表达来确认转基因植物。
叶片表型
如我们以前的研究中所述进行叶片表型[24].简而言之,第一个完全衰弱的叶子被定义为第一叶。脱离了OE和CK植物的第五片叶子,用FAA(甲醛:醋酸:96%醇:水; 10:5:50:35),用氯溶液(200g氯水合物,20g甘油和50毫升DH.2O),并使用蔡司LSM 510 AX70共焦显微镜进行观察。用叶面积除以表皮细胞面积计算下表皮细胞数。至少6片叶子用于叶面积测量,每片叶子中100多个表皮细胞用于细胞面积测量。
RNA分离及定量RT-PCR
表达1 CYCLINB1;,CYCLINB1; 1 b,expa11a.,expa11b.根据我们之前的研究使用定量RT-PCR(QRT-PCR)分析OE和CK植物[24].简而言之,从2个月大的OE和CK植物收集第五片叶,并使用易于旋转加入RNEASY植物迷你套件(中国北京Aidlab)提取总RNA。使用上标III逆转录试剂盒(Takara,大连,中国)和少人DT引物合成第一链cDNA。所有底漆序列列于表中S3.Real-time PCR采用LightCycler 480(罗氏,巴塞尔,瑞士),使用SYBR Premix Ex Taq™Kit (TaKaRa,中国大连)进行。肌动蛋白和UBQ.被用作内部控制。
可用性数据和材料
在本研究期间生成或分析的所有数据都包含在本文(及其补充信息文件)中,或者可以从合理的请求中获取相应的作者。蛋白质序列已被沉积在Genbank(Paggrf6b,Mw014326; Paggrf7a,Mw015994; Paggrf9,Mw015997; Paggrf10b,Mw015995; Paggrf11b,Mw015996; Paggrf12a,Mw014327; Paggrf12a,Mw014328)。
缩写
- 平:
-
生长调节因子
- QLQ:
-
glu-leu-glu
- 中心:
-
Trp-Arg-Cys
- Pag:
-
Populus Alba.×P. Glandulosa.
- 在:
-
拟南芥
- Bn:
-
芸苔栗鸟
- Br:
-
芸苔属植物拉伯
- ZM.:
-
玉米
- Ptr:
-
Populus Trichocarpa.
- YFP:
-
黄色荧光蛋白
- OE:
-
过度表达
- QRT-PCR:
-
定量实时聚合酶链反应
参考文献
- 1.
鲍威尔AE,Lenhard M.在植物中的器官尺寸控制。Curr Biol。2012; 22(9):R360-7。
- 2.
植物侧器官生长与细胞数量的关系。植物生物学杂志。2014;17:36-42。
- 3.
植物生长调节因子和grf -互作因子对植物生长发育的调控。实验机器人。2015;66(20):6093-107。
- 4.
Omidbakhshfard Ma,Proost S,Fujikura U,Mueller-roeber B.生长调节因子(GRF):一个小型转录因子家庭,具有植物生物学的重要功能。莫尔植物。2015; 8(7):998-1010。
- 5。
一种新的赤霉素诱导水稻生长的基因及其在水稻生长中的调控作用。植物杂志。2000;122(3):695 - 704。
- 6。
转录因子AtGRF家族参与了植物叶和子叶的生长拟南芥.植物j . 2003; 36(1): 94 - 104。
- 7。
水稻OsGRF基因家族编码植物特异性转录激活因子的全基因组分析奥雅萨苜蓿L.)。植物细胞生理。2004; 45(7):897-904。
- 8。
张达夫,佳GQ,张特夫,戴Jr,李杰,王sc。玉米GRF转录因子和GIF转录共粘膜的基因的分离与表征(玉米L.)。植物SCI。2008; 175:9。
- 9。
Bazin J,Khan Ga,Combier JP,Bustos-Sanmamed P,Debernardi JM,Rodriguez R,Sorin C,Palatnik J,Hartmann C,Crespi M,Lelandais-BrièreC.Mir396影响了豆类中的菌根化和根系分生活动Medicago truncatula.植物j . 2013; 74(6): 920 - 34。
- 10.
王F,邱n,丁q,李j,张y,李h,高J。大白菜生长调节因子家庭的基因组鉴定与分析(芸苔属植物拉伯L. SSP。pekinensis)。BMC基因组学。2014; 15:807。
- 11.
Cao Y,Han Y,Jin Q,Lin Y,Cai Y.中梨GRF Aenes的比较基因组分析(Pyrus Bretschneideri.Rehd)、杨树(人口众多的),葡萄(vitis Vinifera),拟南芥和大米(奥雅萨苜蓿).前植物SCI。2016; 7:1750。
- 12.
刘旭,郭连祥,金丽芳,刘永忠,刘涛,范永红,彭萨。柑橘叶片和果实发育调控的生长调节因子基因的鉴定和转录谱分析Mol Biol rep 2016;43(10): 1059-67。
- 13.
Khatun K, Robin AHK, Park JI, Nath UK, Kim CK, Lim KB, nois, Chung MY。番茄GRF转录因子家族基因对非生物胁迫和植物激素响应的分子特征和表达谱分析国际化学学报。2017;18(5):1056。
- 14.
张j,李z,金j,谢x,张h,陈q,罗z,杨杰。烟草生长调节因子家庭的基因组鉴定与分析(烟草).基因。2018;639:117-27。
- 15.
Horiguchi G, Kim GT, Tsukaya H.转录因子AtGRF5和转录共激活因子AN3调控叶原基细胞增殖拟南芥.工厂J. 2005; 43(1):68-78。
- 16。
Kim JS, Mizoi J, Kidokoro S, Maruyama K, Nakajima J, Nakashima K, Mitsuda N, Takiguchi Y, Ohme-Takagi M, Kondou Y, yoshishumi T, Matsui M, Shinozaki K, yamaguchi Shinozaki K。拟南芥生长调节因子7作为脱落酸和渗透胁迫应答基因的转录抑制因子,包括DREB2A。植物细胞,2012;24(8):3393 - 405。
- 17。
Debernardi JM, Rodriguez RE, Mecchia MA, Palatnik JF。植物miR396调控网络通过不同的microrna靶标相互作用的功能特化。公共科学图书馆麝猫。2012;8 (1):e1002419。
- 18。
Rodriguez Re,Mecchia Ma,Debernardi JM,Schommer C,Weigel D,Palatnik JF。用MicroRNA miR396控制拟南芥植物细胞增殖。发展。2010; 137(1):103-12。
- 19。
王L,顾X,徐D,王W,王H,Zeng M,Chang Z,Huang H,Cui X.Mir396靶向AtgrF转录因子是细胞分裂和叶片发育过程中的分化的协调所必需的拟南芥.实验机器人。2011;62(2):761-73。
- 20。
刘杰,华伟,杨海林,詹广明,李仁杰,邓立波,王新飞,刘光辉,王兆赫。BnGRF2基因(grf2样基因来自芸苔栗鸟)通过调节细胞数量和植物光合作用来提高种子油脂产量。实验机器人,2012;63(10):3727-40。
- 21。
Debernardi JM, Mecchia MA, Vercruyssen L, Smaczniak C, Kaufmann K, Inze D, Rodriguez RE, Palatnik JF。通过microRNA miR396和GIF共激活物对GRF转录因子的转录后调控影响叶片大小和寿命。植物j . 2014; 79(3): 413 - 26所示。
- 22。
Nelissen H,Eepkhout D,Demuynck K,Persiau G,Walton A,Van Bel M,Vervoort M,Candaele J,De Block J,Aesaert S,Van LijseBettens M,Goormachtig S,Vandepoele K,Vandeheele K,Van Leene J,Muszynski M,GevaertK,Inzéd,de Jaeger G.Angustifolia3复合物组合物的动态变化显示玉米叶中的生长调节机制。植物细胞。2015; 27(6):1605-19。
- 23.
关键词:玉米,生长调节因子,截短蛋白,过表达,叶片尺寸,株高中国生物医学工程学报(英文版),2014;
- 24.
周H,Song X,Wei K,Zhao Y,Jiang C,Wang J,Tang F,Lu M.生长调节因子15是叶尺寸控制所必需的杨树.树生理。2019; 39(3):381-90。
- 25.
Rehmsmeier M,Steffen P,Hochsmann M,Giegerich R.对MicroRNA /目标双工的快速有效预测。RNA。2004; 10(10):1507-17。
- 26.
Kruger J, Rehmsmeier M. RNAhybrid。microRNA目标预测简单、快速、灵活。核酸研究2006;34(Web服务器版):W451-4。
- 27.
关键词:microrna,转录组,转录组效应,植物abstract:Dev细胞。2005;8(4):517 - 27所示。
- 28.
唐F,魏H,赵某,王L,郑H,Lu M.识别次血管系统再生中的microRnasPopulus tomentosa卡车。前植物SCI。2016; 7:724。
- 29.
Jones-Rhoades MW,Bartel DP,Bartel B. Micrornas及其在植物中的监管角色。Annu Rev植物Biol。2006; 57:19-53。
- 30.
刘H,郭某,徐y,李c,张z,张d,徐S,张c,冲K.0Smir396D调节OSGRFS在稻米上的花卉器官组织中的αmJ706和OSCR4。植物理性。2014; 165(1):160-74。
- 31.
Vercruyssen L,Tognetti VB,Gonzalez N,Van Dingenen J,De Milde L,Bielach A,De Rycke R,Van Breusegem F,Inze D.增长调节因子5刺激拟南芥叶绿体部门,光合作用和叶子长寿。植物理性。2015; 167(3):817-32。
- 32.
梁克,何H,李伊,王F,yu D. microRNA396中析脑发育的分子机制拟南芥.植物理性。2014; 164(1):249-58。
- 33.
Omidbakhshfard Ma,Fujikura U,Olas JJ,Xue GP,Banazadeh S,Mueller-roeber B.生长调节因子9负面调节拟南芥通过控制ORG3和限制叶原基细胞的增殖来促进叶的生长。公共科学图书馆麝猫。2018;14 (7):e1007484。
- 34.
Ridge Cr,Hinckley TM,Stettler RF,Van Valkenburgh E.叶片生长特性快速生长的杨树杂种Populus Trichocarpa.xp .摘要.树杂志。1986;1(2):209 - 16。
- 35.
Larkin Ma,Blackshields G,Brown NP,Chenna R,McGettigan Pa,McWilliam H,Valentin F,Wallace Im,Wilm A,Lopez R,Thompson JD,Gibson TJ,Higgins DG。Clustal W和Clustal X 2.0版。生物信息学。2007; 23(21):2947-8。
- 36.
Jones Dt,Taylor WR,Thornton JM。蛋白质序列的快速产生突变数据矩阵。计算Appl Biosci。1992年; 8(3):275-82。
确认
感谢中国医学科学院药用植物研究所陆山发教授提供PtrMiR408载体。
资金
这项工作得到了中国林业学院(RIF-2014-08)研究所(RIF-2014-08)的基础研究基金支持,中国国家自然科学基金(31570676)到X.S.该资助者没有参加学习设计,数据收集和分析,决定发布或准备稿件。
作者信息
隶属关系
贡献
M.L.和X.S.设计了实验并写了主稿件文本。J.W.进行表型分析,RNA分离和QRT-PCR。赫兹。进行转基因植物产生和瞬时表达测定。Y.Z.参与转基因植物培养。F.T. participated in degradome data analysis. P.S. participated in paper writing. All authors have reviewed the manuscript.
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图S1。
的QLQ, WRC域和FFD, TQL和GPL主题杨树grfs。
附加文件2:图S2。
系统发育关系GRF.基因p . trichocarpa(Ptr),A.Thaliana.(在),o.苜蓿(操作系统),美国二色的(SB),z梅斯(ZM),V. Vinifera(Vv),G. Max.(通用汽车)和p .金属盘(PP)。
附加文件3:图S3。
MiR396B的互补位点图到PTRGRFS。
附加文件4:图S4。
GRF1 / 2C,GRF9,GRF10B和GRF11B的亚细胞定位。条=20μm。
附加文件5:图S5。
图显示mGRF1/2c、mGRF9、mGRF10b、mGRF11b中miR396靶位点同义突变的引入。
附加文件6:图S6。
图显示了mGRF6b、mGRF7a和mGRF12a中miR396靶位点同义突变的引入。
附加文件7:图S7。
mGRF6b、mGRF7a、mGRF12a、GRF12b OE植物的照片及mGRF6b、mGRF7a、mGRF12a、GRF12b OE植物中mGRF6b、mGRF7a、mGRF12a、GRF12b的表达水平。数据以均数±标准差(n= 4 - 8)。Arunachal Pradesh,P < 0.01 determined by Student’st以及。
附加文件8:图S8。
相对表达cycb1; 1和EXP11在叶子中mGRF6b(一),mGRF7a(b),mGRF12a(c),和GRF12b(d)过表达(OE)转基因植物。UBQ被用作内部控制。数据以均数±标准差(n= 4 - 8)。*P < 0.05, **P < 0.01 determined by Student’st以及。
附加文件9:表S1。
ptrgrfs和atgrfs的完整基因信息。
附加文件10:表S2。
Tang等人(2016)的降解数据显示,miR396对PtrGRFs的裂解位点。
附加文件11:表S3。
基因克隆和QRT-PCR分析中使用的引物。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
王,J。,周,H,赵,Y。等等。杨树生长调节因子的特征及其在叶尺寸控制中的作用分析。BMC植物BIOL.20,509(2020)。https://doi.org/10.1186/s12870-020-02699-4
收到了:
接受:
发表:
关键词
- 生长调节因子
- 系统发育关系
- mir396.
- 叶发育
- 杨树