抽象的
背景
花蕾休眠是植物为了在恶劣环境中生存而进化的一种复杂策略。自然休眠是牡丹反季节栽培的主要障碍,充分低温暴露是促进牡丹等多年生植物休眠释放的有效方法。然而,人们对休眠释放的机制知之甚少,对低温诱导休眠转化过程中代谢组学的系统研究也很少。
结果
用人工冷却处理树牡丹芽,在0-4℃处理0,7,14,21和28d的0,7,12,21和28d后,在五个时间点使用代谢分析。获得总共535个代谢物并偏离11组,包括类黄酮,氨基酸及其衍生物,脂质,有机酸及其衍生物,核苷酸及其衍生物,生物碱,羟基键酰基衍生物,碳水化合物和醇,植物甾烷,香豆素和维生素。完全,118个差分代谢物(VIP≥1,P. < 0.05) during chilling treatment process were detected, and their KEGG pathways involved in several metabolic pathways related to dormancy. Sucrose was the most abundant carbohydrate in peony bud. Starch was degradation and Embden Meyerhof Parnas (EMP) activity were increased during the dormancy release process, according to the variations of sugar contents, related enzyme activities and key genes expression. Flavonoids synthesis and accumulation were also promoted by prolonged chilling. Moreover, the variations of phytohormones (salicylic acid, jasmonic acid, abscisic acid, and indole-3-acetic acid) indicated they played different roles in dormancy transition.
结论
我们的研究表明,淀粉降解,EMP活化和黄酮类积累是至关重要的,与树牡丹中的芽休眠过渡有关。
背景
木质植物的芽休眠是一种复杂的过程,使植物能够在寒冷和干旱等恶劣环境中存活,并且被归类为平行性,巩固性和eCocodormance [1],其内在休眠受到内部因素的调节[2].自然休眠对植物的维护和生产也有重要影响,如一些果树的反季节栽培。因此,对其休眠调控机制的研究引起了人们的广泛关注。昼短、低温等外部环境因素在自然休眠诱导中起着至关重要的作用,充分的低温积累是芽破的必要前提[3.那4.那5.].在Paeonia Lactiflora.,需要在5℃下的低温积聚9周,以确保芽的重新生长[6.].此外,牡丹“芦和红”的花蕾需要在0-4℃下进行21 d的低温处理,以保证以下生长条件下的正常发育[7.].此外,冷却单元的要求处于基因型依赖方式[8.],其顶芽、侧芽和柔荑之间存在显著差异(juglans regia.L.)[9.].
花蕾休眠释放机制的基因组学、转录组学、蛋白质组学和分子生物学等方面的研究已经得到了广泛的应用。这些结果表明,低温诱导的芽休眠破坏与碳水化合物相互转换和运输、脂质动员、氮代谢、激素代谢和氧化还原过程等代谢过程的巨大变化有关[8.那10.那11.那12.那13.].到目前为止,仍然仍然罕见的研究在冷却致达态转变期间代谢物的系统变化及其交联。
碳水化合物除了作为碳和能量的主要来源外,在植物的生长发育中还发挥着多种作用。在氧化磷酸化之前,EMP、TCA和戊糖磷酸盐途径(PPP)是植物的主要呼吸途径。EMP从葡萄糖开始,葡萄糖是淀粉降解的最终产物。另外,麦芽糖和果糖也参与转化为葡萄糖后的EMP途径。蔗糖的合成代谢主要由两种酶来完成,蔗糖合酶(SUS;EC 2.4.1.13)和转化酶(INV;EC3.2.1.26) [14.].SUS可逆地催化udp -葡萄糖和果糖生成蔗糖[15.]和Inv,它不可逆转地将蔗糖分解成己糖,可分为三类:细胞壁转化酶(CWIN),真空转化酶(VIN)和细胞质转化酶(CIN)[16.那17.].
据报道,EMP,TCA和PPP与不同植物中的休眠释放严格相关。例如,TCA循环增强,而PPP途径在苹果芽芽期间缓慢减少[18.].在葡萄中,发现化学和低温诱导的休眠释放与PPP,EMP和TCA循环有关[19.那20.那21].此外,碳水化合物也可以充当糖信号分子。Mason等人。(2014)发现蔗糖可以用作涉及Paradmancy释放的信号分子[22].
黄酮类化合物是植物中普遍的次生代谢产物,主要含有六个亚类:Chalcones,黄酮,黄酮醇,黄种子,花青素和原花青素或浓缩的单宁[23].类黄酮的生物合成途径是相当保守的,在一些模式植物中被很好地理解[23].一些基因参与了共同前体的产生,比如Chalcone合成酶(CHS),查耳酮异构酶(气),黄烷酮3-hydroxylase(F3H), 和黄酮类化合物3'-羟化酶(F3'H)那被称为早期生物合成基因(Ebgs)。相应地,黄酮类生物合成的下游基因称为晚期生物合成基因(LBG)。黄酮类化合物生物合成的途径可受到生物和非生物因子的影响(例如,病原体感染,温度,干旱,植物激素)[24].此外,最近的报道表明,黄酮类化合物参与植物的应激反应[25、花粉发育[26,颜色形成[27)等。然而,黄酮类化合物是否参与了休眠释放过程尚不清楚。
众所周知,在花蕾休眠释放过程中,外部因素总是通过内部因素发挥作用,激素在休眠调节中起着重要作用。随着冬眠诱导条件(短日或低温)的延长,促生长信号基因(开花轨迹T.那FT.)被抑制,导致赤霉素(gibberellins, GAs)水平降低,脱落酸(ABA, ABA)含量增加,ABA响应可诱导胞间连丝关闭,从而介导休眠的建立[28那29].GA和ABA不仅参与了生长停止的建立,而且在休眠释放中起着关键作用。在休眠释放过程中,随着GAs生物合成的增加,胞间连丝的重新打开可以恢复促生长信号的供应[30.].另一方面,ABA的降解是葡萄芽释放休眠的必要条件,而ABA在休眠建立过程中积累[31].最近的报告表明短营养期(SVP)样(SVL.)序列同源休眠相关的疯子盒(坝)基因[32,在杨树的休眠中起着至关重要的作用[33].低温降低了ABA水平SVL.表达,导致归纳FT1.表达和GA生物合成,促进休眠释放。
牡丹(牡丹Andr。)属于牡丹属的亚科芍药属,Paeoniaceae是世界上最古老的观赏性和药用植物之一。树木牡丹的芽是秋季成型的典型复合芽[34],必须经历一段低温期,以保证来年的发芽开花。由于每年花期短而集中,其反季节栽培成为牡丹产业的重要内容。到目前为止,反季节生产的主要方法是单独提供足够的低温暴露或与赤霉素应用相结合的耐寒性。因此,了解低温诱导牡丹休眠释放的机制具有重要意义。我们前期研究确定了冷积累与休眠状态的关系,将牡丹“芦和红”在低温处理14 d后的生理状态视为休眠向释放休眠的过渡阶段,将低温处理21 d后的生理状态定义为休眠释放阶段。冷却28 d后,作为生态气味的一个阶段[35].GA途径在低温诱导的自然休眠释放中起关键作用[36].PPP通路的活性也在此过程中增加,提示它在牡丹休眠释放中起作用[7.].如已知的,性状与代谢物更密切相关,这可能为理解树牡丹中的休眠过渡的理解提供了新的视角。
研究了牡丹花芽在低温诱导休眠过渡过程中的代谢变化。《京都基因与基因组百科全书》(KEGG)富集分析表明,差异代谢物参与了碳代谢、次生代谢物合成、激素代谢等多种代谢途径。结果表明,淀粉降解和EMP活性在休眠释放过程中增强。低温积累也能激活黄酮类化合物的合成,其增加可能反过来促进花芽的发育。此外,还研究了植物激素ABA、茉莉酸(JA)、水杨酸(SA)和吲哚-3-乙酸(IAA)在休眠过渡过程中的浓度。值得注意的是,黄酮类化合物在多年生植物休眠过渡过程中的作用首次得到了探讨。研究结果为牡丹休眠转化的分子机制提供了有价值的信息。
结果
冷却诱导休眠过渡期间的代谢组科分析
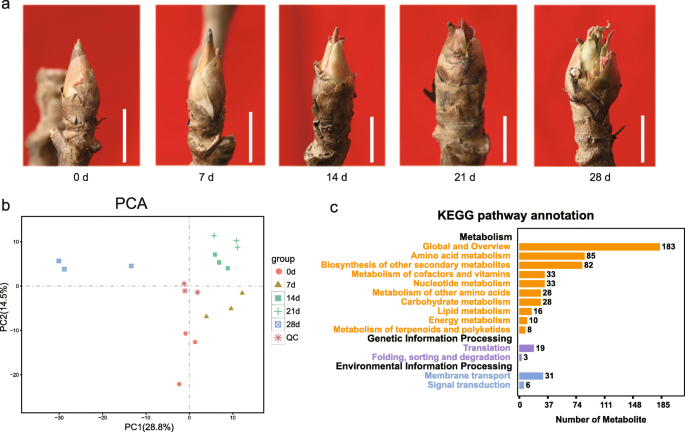
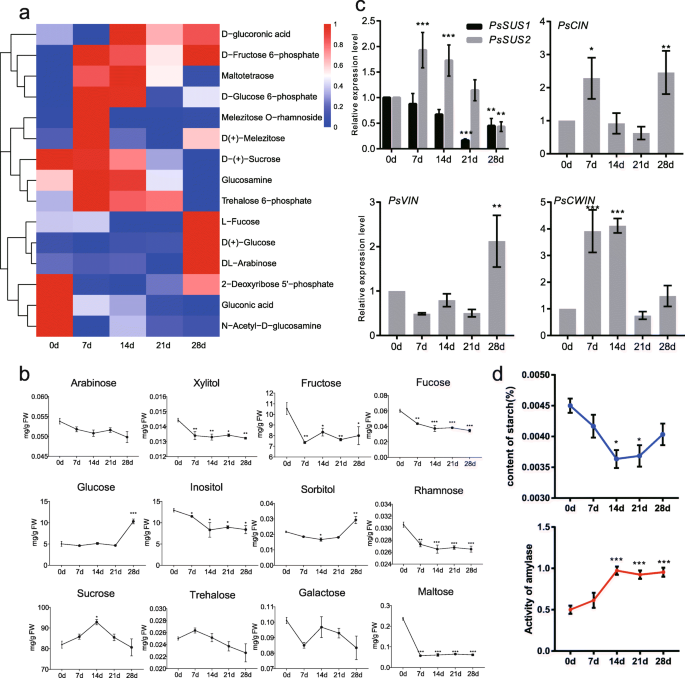
研究代谢变化在牡丹chilling-induced休眠释放,花蕾在挑选五个时间点后0 - 4°C治疗0、7、14、21、28 d,分别分析了代谢分析超高效液相色谱(UPLC)和串联质谱分析(MS / MS)(图1a).采用主成分分析(PCA)分析来评估代谢物谱的重复性(图5)。1b).如图所示,质控(QC)样品从被测样品中分离出来,两个主成分(PC)分别占总方差的28.8% (PC1)和14.5% (PC2)。PC1和PC2将样品清晰地分为5个不同的亚组(图。1b)。
代谢组学分析共检测到535个代谢物,其中511个用MassBank、KNAPSAcK、HMDB进行了注释[37]、MoTo DB和METLIN [38)(表1).代谢物分为11个基团,包括类黄酮,氨基酸及其衍生物,脂质,有机酸及其衍生物,核苷酸及其衍生物,生物碱,羟基键酰基衍生物,碳水化合物和醇,植物甾醇,香豆素和维生素(表1).说明,注释了123种黄酮类化合物和15种植物激素(表S.1),有助于分析其功能。代谢通路分析结果显示,它们被映射到14条KEGG通路上(图1)。1c),其中183个代谢物被划分为全局和概述路径,氨基酸代谢85个,其他次级代谢产物生物合成82个,辅助因子和维生素代谢33个,核苷酸代谢33个,碳水化合物代谢33个,等等(图)。1C)。
差分代谢物分析
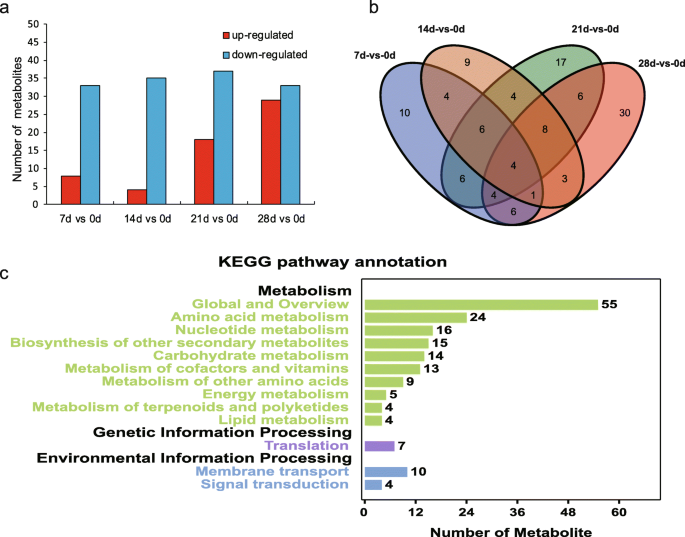
潜结构-判别分析的正交投影(OPLS-DA, VIP≥1)和学生t检验(P.< 0.05)检测不同处理间的差异代谢物(DMs)(图S1).完全,当冷却处理的基团与0d样品的样品进行比较时,获得118dms。结果还表明上调代谢物的量随着冷却天的增加而增加(图。2a). 14 d vs 0 d、21 d vs 0 d、28 d vs 0 d时,上调的代谢物分别为4、18、29个。与0 d相比,下调的代谢产物数量没有规律的变化趋势。结果表明,长时间低温暴露激活了一些代谢通路。有趣的是,差异代谢物的数量相比下降14 d vs 0 d 7 d和0 d。为了更好地理解代谢物的变化引起的不同的冷却时间,118年的维恩图建立了DMs,表明四代谢物在四个比较是很常见的,例如7 d vs 0 d, 14 d vs 0 d,21d vs 0d,和28d vs 0d(图。2b;无花果。2).此外,在28 d vs 0 d中,30个代谢物是独一无二的,这意味着该组中发生的更广泛的变化。进行118dms的Kegg途径注释,并且参与氨基酸代谢(数量),核苷酸代谢(16)的DMS,以及其他次级代谢(15)等的生物合成(图。2c).另外,两个处理之间的KEGG富集情况见图S3..糖代谢,如丙酮酸代谢、淀粉和蔗糖代谢、PPP途径等,在不同的富集分析中经常出现。植物激素信号转导在7个对照组中也有富集。除此之外,一些氨基酸代谢、嘧啶和嘌呤代谢、氮代谢等在比较中也经常被富集(图S3.).
牡丹休眠释放相关的代谢过程
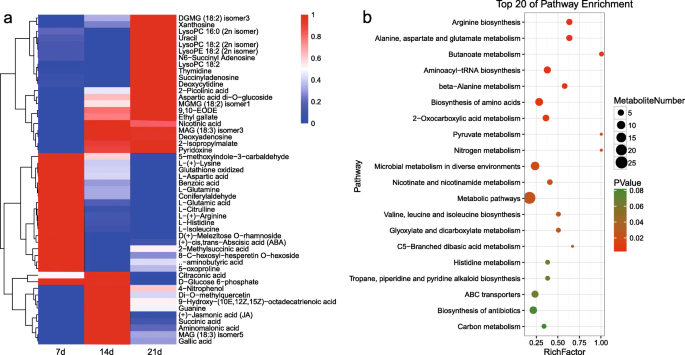
为了研究牡丹释放自然休眠的关键代谢过程,筛选了14 d vs 7d和21 d vs 7d的DMs。共获得50个DMs并呈现在聚类热图中,显示了代谢物从休眠到休眠释放的变化。3.21)。其中,DMs显著上调,18 DMs与长时间冷却enduration被抑制,和其他11 DMs波动的峰值在14 d。KEGG 50 DMs的分析表明,25 DMs参与了代谢途径,占83.33%的30带注释的代谢物(无花果。3.B,表S2).25种dm的KEGG富集分析表明,它们参与了葡萄糖代谢(葡萄糖6-磷酸)、氨基酸代谢(天冬氨酸)和激素代谢(ABA)的途径(表S3.),表明这些代谢途径可能在树牡丹中的休眠释放期间发挥着关键作用。
树牡丹中休眠过渡期间的碳代谢
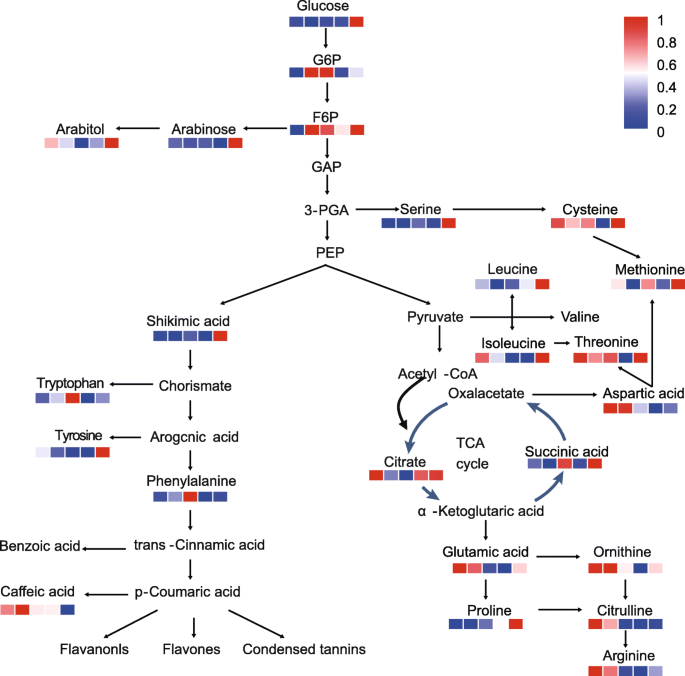
介绍了包含EMP途径,TCA循环,Shikigate途径和氨基酸代谢的代谢网络,以在树牡丹的休眠释放期间可视化碳流(图。4.).0,7,14和21d的葡萄糖水平低于28 d。然而,葡萄糖6-磷酸(G6P)和果糖6-磷酸(F6P)在7和14d中具有较高的水平(图。4.),表明EMP在冷却诱导的树形牡丹中的肺结核释放期间被激活。在TCA循环中,柠檬酸盐的水平下降至14℃,然后攀爬。琥珀酸量在14d下显示出显着的向上。就氨基酸代谢而言,一些氨基酸随着肺胚泡释放而增加,例如亮氨酸,脯氨酸等,而其他一些氨基酸减少,例如缬氨酸,天冬氨酸,谷氨酸等。(图。4.).在Shikimic酸途径中,冷却暴露后,Shikimic酸和苯丙氨酸的水平增加(图。4.).
休眠过渡期间碳水化合物的变化
糖在能量代谢和物质代谢中起着至关重要的作用,其变化可能反映了低温胁迫后芽的休眠状态。在整个休眠过程中,分析了代谢谱中15种糖类的水平。5.一种)。一些单糖(G6P,葡糖胺和海藻糖6-磷酸酯)和多糖(Maltotetrolease,Metezitose和素溶剂O.-鼠李糖苷(-鼠李糖苷)含量在低温处理7 d后呈上升趋势,随后呈下降趋势。5.a).单糖(集中糖、葡萄糖和阿拉伯糖)在生态抑臭期(冷处理28 d,图。5.a),表明以下重新增长的良好准备状态。然后采用气相色谱 - 串联质谱(GC-MS / MS)测量以进一步分析树木牡丹中冷却过程中糖的变化,结果与代谢组数据类似。果糖,葡萄糖和肌醇是三种最丰富的单糖。7 d冷冻处理后,麦芽糖的含量显着降低。值得注意的是,蔗糖的含量是所有13次测试糖的高峰,该糖显着增加,最大达到了14d冷却的最多92.9mg / g,然后迅速下降(图。5.b),建议它可能在整个过程中发挥重要作用。进一步探讨蔗糖在患有芽的休眠释放中的作用,表达模式蔗糖合酶(PSSUS1和PSSUS2),蔗糖转化酶基因分析(图。5.c,无花果。S4.).表达PSSUS1低温处理7 d后持续下降PSSUS2在7和14 d冷却时上调。表达式细胞质转化酶(Pscin.),在液泡转化酶(PsVIN), 和细胞壁转化酶(PsCWIN)在不同的冷却时期显着增加(图。5.c).综上所述,在低温过程中蔗糖的分解代谢占主导地位,为呼吸代谢和能量代谢提供足够的糖分。对牡丹休眠过渡过程中主要贮藏碳水化合物——淀粉进行了测定。结果表明,低温暴露后淀粉含量下降,在14 d达到最低,这可能与低温暴露过程中淀粉酶(AMY)的活性有关(图1)。5.d)。
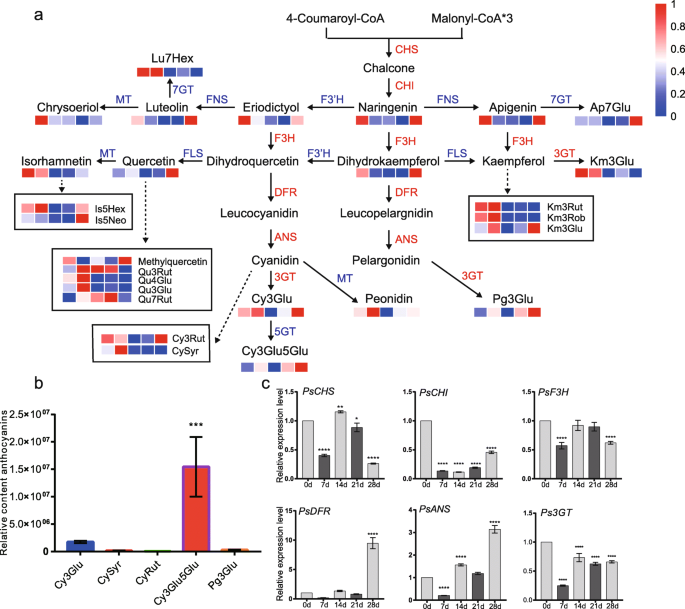
黄酮类化合物在休眠过渡中的变化
在Kegg富集的术语中,次级代谢物的生物合成占大部分(图。3.B),其中类黄酮是植物中广泛存在的次级代谢物。因此,进行了一种类黄酮代谢途径分析,以了解芽中休眠过渡期间的变化。大多数类黄酮(Naringenin,Apigenin,菱形等),黄酮醇(Kaempferol,槲皮素等)和花青素(Cyanidin 3-O.天竺葵色素3 -葡萄糖苷O.-葡萄糖苷等)在休眠早期(0-14 d)呈下调趋势,在休眠28 d时呈上调趋势,故其含量一般在28 d时最高,如花青素基花青素、花青素3-O.葡萄糖苷等(图。6.a).根据LC-ESI-MS/MS结果,在28 d时分析花青素的相对含量。结果表明,花青素中有5种花青素,包括花青素3-O.-糖苷(Cy3Glu),花青素3-O.-rutinoside (CyRut)花青色素O.-丁香酸(CySyr), cyanidin 3,5-di-O.-葡萄糖苷(Cy3Glu5Glu)和天蚕素3-O.-葡萄糖苷(Pg3Glu)在牡丹花蕾中占主导地位,其余的均相对稀少(图3。6.其中以cyanidin-base anthocyanin (Cy3Glu5Glu)为主,Cy3Glu次之(Fig. a, b)。6.a和b)EBGs(诗和psf3h.)和二lbg(斯坦斯和Ps3GT)显示了不包括的类似模式PsDFR.它们的转录本在休眠开始(0 d)时相对丰富,在低温处理7 d时显著下降,但较低温处理7 d时延长低温处理促进了它们的表达。的PsDFR保持非常低的表达水平,直到休眠释放期,但与0d比较28 d以28 d比较的十倍(图。6.c,无花果。S4.).Roltaed基因的表达模式是根据冷却持续时间过程中的含量变化。
低温过程中黄酮类化合物含量及相关基因表达的变化。一种黄酮类化合物和花青素途径。CHS、查耳酮合酶;气,查耳酮异构酶;F3H,黄烷酮3-hydroxylase;DFR, dihydroflavonol 4-reductase;答,花青素合成酶;3 gt,花青素3 -O.糖基转移酶;5 gt,花青素5 -O.糖基转移酶;太,花青素甲基转移酶;7 gt,花青素7 -O.糖基转移酶;FLS的黄酮醇合成酶;fn,黄酮合成酶;鲁木樨草素;美联社,芹黄素;是,异鼠李亭;曲,槲皮素;公里,山柰酚;Cy花青色素;Pg,天竺葵色素; Glu, glucoside; Hex, hexoside; Neo, neohesperidoside; Rut, rutinoside; Rob, robinobioside; Syr, syringic acid.B.LC-ESI-MS/MS测定牡丹花蕾低温28 d后花青素的相对含量。C花青素合成关键基因的相对表达水平。数据以三种不同测定的平均值±SD表示。星号表示差异有统计学意义(单因素方差分析,*P.< 0.05, * *P. < 0.01, ***P. < 0.001 and ****P. < 0.0001)
休眠过渡期间植物激素的变异
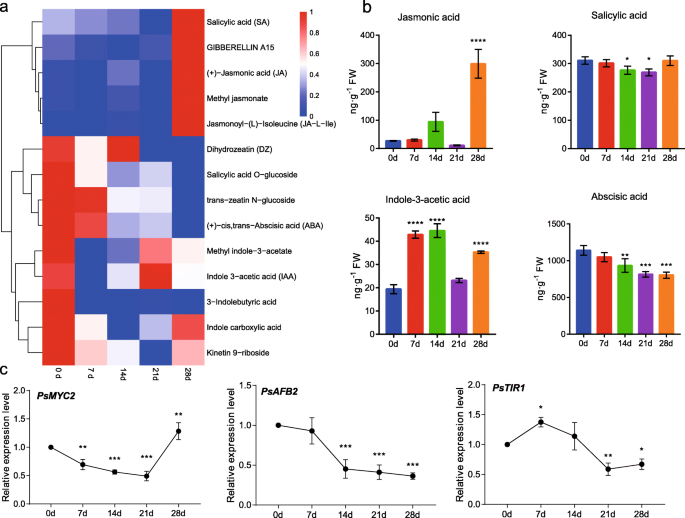
植物激素在植物生长发育、开花、胁迫反应等方面发挥着重要作用。在代谢组学分析中,在牡丹休眠芽中检测到14种植物激素或类似物,包括SA、JA、GA和ABA,并通过热图显示了它们在低温期间的含量变化(图1)。7.一种)。九个代谢物在冷却的0d(非送叉周期)上呈现最高内容物,并且在冷却的28d下达到其他五个激素(图。7.一种)。它们通过聚类分析分为三个亚组,第一个亚组显示出上调的趋势,在包括SA,GA包括SA,GA15.茉莉酸甲酯(MeJA)和茉莉酸-异亮氨酸(JA- ile)。Dihydrozeatin,水杨酸O.- 葡萄糖苷,反式扎丁N-葡萄糖苷和ABA被归为第二亚组,有明显的下调趋势。其余在冷却过程中呈波动趋势,在0 d冷却点处有峰值。
通过LC-MS / MS分析评估JA,SA,IAA和ABA的内容,结果与代谢组合数据类似。Ja水平较低,从0到21 d冷却相对较低,并且在冷却的28d下倍增到299.167 ng / g的达到299.167 ng / g(图。7.b)。Myc2(髓核瘤蛋白2)转录因子在JA信号转导中发挥着核心作用[39].与JA内容物的变异一致,转录物PSMYC2.在冷却的28d下急剧增加(图。7.c,无花果。S4.).SA的含量从0d到21d下调,然后回收初始含量为0 d。IAA的含量在冷却持续时间过程中发生波动,在14d下达到最高水平的44.57ng / g,其28d的含量也高于0和21d(图。7.b)。两种毒素受体基因的表达模式(运输抑制剂响应1 / Auxin信号传导F箱蛋白2,TiR1 / AFB2)在冷却时间内进行了分析。PsAFB2在整个过程中被下调,PsTIR1在7 d时上调,7 ~ 28 d时下调(图5)。7.c,无花果。S4.).ABA含量持续下降,从0 d的1140.37 ng/g下降到28 d的803.83 ng/g。7.b)表明ABA是树牡丹芽中休眠释放的抑制剂,并且寒冷的治疗可以逐渐减少ABA的内容物。
讨论
木本植物的休眠过渡是一个复杂的过程,受到光周期和低温的协同调控[40].冷却治疗作为促进休眠释放的有效方法已经在许多物种包括树牡丹(包括树牡丹)中核实[3.那4.那5.那9.那41].已经进行了转录组,蛋白质组学和MicroRNA分析,研究了在树牡丹中冷却诱导休眠释放的复杂机制,揭示了Ga和碳水化合物代谢的作用[7.那13.那27].本研究通过代谢组学分析检测低温诱导的休眠转化过程中的物质变化,并通过qRT-PCR分析相关基因的表达。几个代谢途径富集,118个代谢物差异的过程。
在休眠释放过程中,淀粉降解和EMP途径增强
碳水化合物是初级代谢和次生新陈代谢的基本能量。RNA-SEQ揭示了糖类代谢和涉及芽休眠过程的信号转导[42].糖代谢基因(-淀粉酶5,-类淀粉酶1,蔗糖合酶3,和trehalose-phosphatase /合酶7),糖转运蛋白基因(GT-2 like 1,蔗糖-质子转运蛋白2,蛋白o -甘露糖基转移酶5,和衰老相关基因29)和糖信号转导基因(葡萄糖敏感2和beta-fruct 4已被证明涉及杨树,葡萄的休眠释放p .却已[42那43那44].本研究连续测定了牡丹在低温诱导休眠过渡过程中碳水化合物的含量。淀粉和麦芽糖在休眠释放前均呈下降趋势,这与淀粉酶活性和糖分解代谢的增加相一致。5.B,D)。同时,艾米的酶活性逐渐增加。我们最近的结果也透露了成绩单ps和PsBMY在同一过程中被上调[7.那8.那42].这些结果表明,冷却治疗促进树木牡丹休眠释放期间淀粉的降解。在结核释放(21-28d)后,芽保持活性呼吸代谢和淀粉酶活性,但淀粉和麦芽糖的含量没有显着降低(图。5.B,D)。据推测,大量的碳水化合物从其他部位转移到芽中,例如根系(树牡丹具有发达的多汁根系),以满足花蕾的消耗。此外,重新开放材料传输通道可能是另一个重要原因,其使碳水化合物的长距离传输[30.].
在我们的研究中,由于淀粉酶活性高,淀粉在低温期开始迅速降解,蔗糖是其中的一种中间产物。结果表明,芍药中蔗糖含量最高,其蔗糖含量比山梨醇高约3200倍,说明芍药中蔗糖也可用于同化物的运输,而不是像苹果中一样用于山梨醇。GC-MS/MS检测结果显示,蔗糖浓度在14 d前呈上升趋势,14 d后则呈下降趋势。5.B),虽然蔗糖合酶基因SUS1随低温时间的延长而上调。我们的结果与蔗糖持续增加的波斯核桃不同[8.].综上所述,我们推测蔗糖主要来源于淀粉降解,并被快速用于后续的EMP途径等。研究还发现,在杨树休眠早期,蔗糖积累和蔗糖合酶基因表达均呈上升趋势p .却已[42].因此,蔗糖可以用作能量中心,以确保在树牡丹的休眠过渡中供应葡萄糖。
此外,淀粉的广泛降解应导致葡萄糖积聚,但葡萄糖和果糖处于低水平或下调,直到ecocormancy阶段(图。5.与此同时,F6P和G6P含量在低温暴露后显著增加,之后下降(图1)。4.和5.一种)。此外,我们以前的研究表明转录物(香港和G6P.)六酮酶和葡萄糖6-磷酸异构酶的酶活性也显着上调[7.那42].这些结果表明,牡丹低温暴露后EMP通路被激活。代谢组学结果表明,休眠释放是一个能量消耗过程。大量的碳水化合物被分解,产生足够的物质和能量促进休眠释放,也为次级代谢提供了碳链。
ecocodormancy阶段的黄酮类积累
黄酮类化合物作为植物的次生代谢产物,在植物生长发育的许多过程中发挥着重要的作用,如颜色形成、抗胁迫等。15.].然而,休眠过渡期间黄酮类化合物的变化和功能仍然很清楚。在我们的工作中冷却持续时间过程中分析了黄酮类化合物的变化。在黄酮类生物合成途径的早期步骤中合成了类黄酮(例如槲皮素,kaempferol和Apigenin),其在整个肺胚性阶段下调,并在28 d处急剧上调,对应于减少表达PSCHI.(无花果。6.).低温处理早期(0 d和7 d)黄酮类化合物的积累可能与抗寒性有关。人们认为黄酮类化合物生物合成途径的最初产物,如槲皮素、山奈酚、芹菜素等,抑制了极性生长素的运输以调节植物发育[45].此外,在玉米和花生中也发现了花粉育性与类黄酮的相关性[23,以及沉默Chalcone合成酶番茄单性结实的基因结果[46].黄酮醇(特别是槲皮素)是烟草花粉萌发所必需的[26].在我们的研究结果中,黄酮醇在生态气味期表现出较高的水平。6.a),当花蕾均匀分化时,雄蕊清晰可见[34].因此,推测,黄酮醇可能参与树牡丹的ecococormancy阶段的花蕾开发。
在最近的一项研究中,古等人。(2019)表明,在树木牡丹清海胡寅博'中发生了花青素的积累10次,发生了10天。[47].研究发现,牡丹“芦和红”在自然休眠释放后,花青素表达量显著上调,在生态气味期大量积累。6.).结果暗示,花卉颜料可能在芽进入肺结肠的肺炎之前开始合成和积累。基于Cy3Glu和Cy3Glu5Glu的Cyanidin基糖苷是35种瓣膜斑纹中最丰富的花青素[48],它们也是'Luhehong'的芽中最丰富的花青素(图。6.b).我们推测低温诱导的休眠释放同步激活了花青素的合成和积累。
携带的黄酮化合成和积累可以通过长时间的冷却来激活,并且休眠释放可能通过黄酮类积累加速花芽发育。据我们所知,它是第一份描述在多年生木质植物中休眠过渡期间黄酮类化的变化和作用的报告。
植物激素在休眠过渡期间的作用
在多年生的木本植物中,ABA和GA被广泛证明了调节芽休眠。最近的研究揭示了ABA和GA在芽休眠中的抗菌主义。发现GA和ABA途径是葡萄中不同休眠阶段的比较最丰富的富集49].一个疯狂的盒子(大坝)家庭基因,短植物相(SVL)已被发现在杨树中的ABA介导的芽睡眠中发挥关键作用。在SVL.RNAi菌株,表达FT1.显著上调,而GA生物合成关键酶基因GA20ox是上调的,促进芽破裂[32].进一步研究发现SVL可直接结合于GA2Ox8.和CALS1.为了诱导它们的表达,减少活性气体水平并控制闭合等离子体,从而保持休眠状态[50].冷积累降低了ABA水平,从而抑制了ABA的表达SVL.并促进天然气的生物合成,最后破坏芽睡眠[36].在我们的研究中,ABA随着低温时间的延长而持续下调(图。7.),与葡萄在显性过渡过程中相似[51].生物活性赤霉素的前体Gibberellin 15逐渐上调。7.一种)。同时,表达psga20ox.上调,气体含量随着树木牡丹的冷却积累而增加[51那52].因此,ABA和ga调控的休眠在杨树和牡丹中可能存在相似的机制。
毒素和细胞素(CKS)在许多植物的分泌中起拮抗作用[53].已有研究表明,在氰化氢诱导的葡萄芽休眠释放过程中,CKs发挥了积极作用[54]但是直到现在,IAA的仍然是暧昧的。在我们的研究中,CKS的水平(Dihydrozeatin,反式-eatin.N葡萄糖苷和激动素9.-Rboside)在冷却暴露后降低,通过通过代谢物和LC-MS / MS分析冷却来调节IAA(图。7.).运输抑制剂RESPONSE1/生长素信号转导F-BOX蛋白(TIR1/AFB)家族被称为生长素受体[55].的成绩单PsTIR1与IAA含量变化显着诱导和一致(图。7.c),表明IAA在牡丹休眠释放过程中发挥了积极作用。这些结果与上调的ks在p . kingianum和p .却已在同一过程中[56那57].因此,休眠释放中CK和IAA的规定不是不同多年生植物的常见机制,它们可能不是休眠监管的关键因素。
通常,SA和JA被视为应激反应激素,而不是在休眠调节上的功能[58那59].最近Ionescu et al.(2017)提出JA-Ile的上调诱导了表达MYB21(成髓细胞增生症病毒致癌基因同源物B21),myb108在甜樱桃的HC诱导的休眠释放过程中参与花卉开发过程[57].在我们的研究结果中,JAs在进入生态气味期后显著上调,并伴随着转录水平的增加PSMYC2.,是JA信号转导的关键转录因子(图。7.).结果表明,在冷冻积聚后激活JA信号转导。在最近的一项研究中,促进了JA的机制促进了花青素积累的作用拟南芥.当JA含量增加时,释放了jazs(茉莉甲基域)蛋白对MyB-BHLH-WD40复合物的抑制作用,这将促进表达DFR.和ANS.和花青素的积累[60.].有趣的是,PsDFR和斯坦斯在我们的研究中也显着增加,花青素在28 d冷却治疗中呈现更高的水平(图。7.).推测JA还参与了牡丹自然休眠释放后花青素的积累。此外,SA还参与了对低温应激的反应,包括低温暴露后SA和糖基SA的积累[58].外源SA的使用改善了玉米,黄瓜和米的耐寒性[59].水杨酸和水杨酸的积累O.在冷却诱导的树木牡丹中诱导休眠释放期间也观察到葡萄糖苷(图。7.),它可能是芽对低温胁迫的响应。
结论
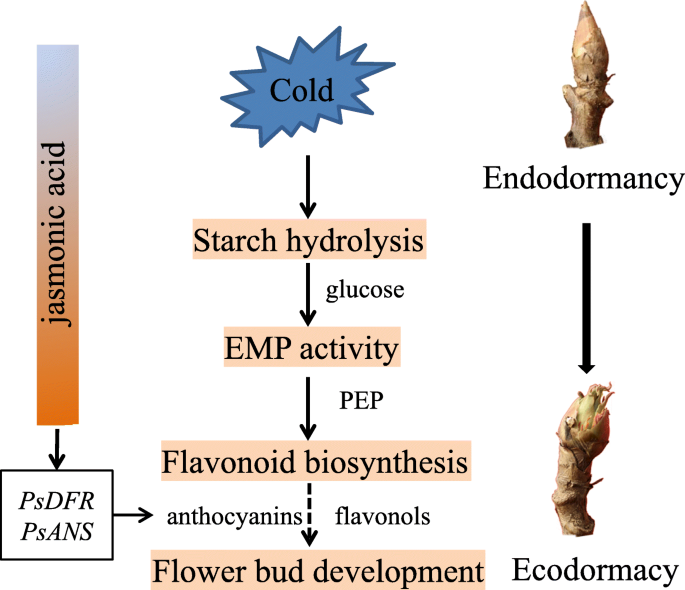
本研究系统揭示了低温诱导牡丹休眠转化过程中的代谢组学变化,共鉴定出511种物质和118种dm。低温积累促进了淀粉的降解,增强了EMP的活性,为休眠释放和芽爆发所需的次级代谢提供了足够的能量和物质。在低温条件下,随着自然休眠的释放,黄酮类化合物逐渐积累。此外,我们还报道了牡丹休眠过渡过程中植物激素的变化。长期低温暴露降低了休眠末期ABA含量,促进了JA和GA积累。综上所述,通过代谢组学分析,我们提出了低温诱导休眠过渡的工作模型(图1)。8.).本研究结果有助于更好地理解多年生植物的休眠过渡过程。
材料和方法
植物材料
四龄牡丹(牡丹简历。由中国青岛农业大学牡丹研究所提供。如前所述,这些植物从2018年11月12日开始进行连续人工冷却(0-4°C冷藏,黑暗/24小时),日平均温度低于10°C [7.].在冷藏处理后的0、7、14、21和28 d,每个时间点取芽去鳞,冷冻于液氮中,保存于−80℃,待进一步分析。从每三株植物中采集样品,并在每一处理中混合。每组设3个重复(3株/重复)。
样品制备和提取
冷冻干燥后,使用氧化锆珠(Mm 400,RetSch)的混合磨机将样品以30Hz粉碎1.5分钟。然后将粉末(100mg)与70%甲醇溶液(1ml,含有0.1mg / L利多卡因作为内标)的溶液混合过夜,过夜。离心(10,000g,10分钟)后,过滤上清液(SCAA-104,孔径0.22μm; Anpel,上海,中国)并由LC-MS / MS分析。质量控制(QC)样品与所有样品混合以测试整个实验的重复性[61.].
液相色谱电喷雾电离串联质谱(LC-ESI-MS / MS)
通过LC-ESI-MS / MS系统(UPLC,Shim-Pack UFLC Shimadzu CBM20A; MS / MS,Applied Biosystems 4500 Qtrap)进行分析所提取的化合物,中国广州生物科技有限公司62.].首先,将样品(5μl)加入到水中的水中UPLC HSS T3 C中18.色谱柱(2.1mm×100mm,1.8米),流速在40℃下0.4ml / min。用0.04%乙酸透过水和乙腈,分别用作阶段A和B的移动相。将化合物分离的相梯度是陈等人。[62.].线性离子阱(LIT)和三重四极杆线性离子阱(QQQ)在三重四极杆线性离子阱质谱仪(QTRAP)上进行扫描。然后AB Sciex QTRAP4500 (ABQ)系统配备了ESI-Turbo离子喷雾接口。ABQ在正离子模式下运行,使用Analyst 1.6.1软件(AB Sciex)按Chen等[62.].
代谢物的定性和定量测定
代谢物定性分析基于公共代谢物数据库(如MassBank和KNApSAcK)和METLIN数据库(MWDB) [37那38].重复的信号(例如K+,na+,NH.4.+,以及其他大分子量物质)在分析过程中被移除。代谢产物采用三重四极杆质谱多反应监测(MRM)进行定量。推导QC样品的总离子色谱(TIC)和提取离子色谱(EIC或Xic),总结所有样品的代谢物光谱,并计算各峰的面积。使用MultiaQuant软件(v 3.0.3)对峰进行积分和校准。
主成分分析(PCA)和潜结构正交投影-判别分析(OPLS-DA)
为了最初可视化组之间的差异,使用R包“罗尔斯”用于主成分分析(PCA)(http://biocidodder.org/packages/release/bioc/html/ropls.html.).正交投影到潜在结构-判别分析(OPLS-DA)是PLS- da的发展,它将正交信号校正(OSC)滤波器引入到PLS模型中。各组采用OPLS-DA模型进行分析。随后的模型检验和差异代谢物筛选使用OPLS-DA结果进行分析。
差异代谢物分析和KEGG分析
每两组之间最有区别的代谢产物通过根据OPLS模型的投影(VIP)评分的可变重要性排列。VIP的阈值设置为1.0。此外,学生的T检验用于筛选差分代谢物。那些有P. < 0.05 and VIP ≥ 1 were considered as differential metabolites between two groups. The KEGG Orthology software (http://kobas.cbi.pku.edu.cn/)进行KEGG通路分析。
RNA提取及实时定量PCR分析
0 ~ 4℃处理0、7、14、21、28 d后,总RNA分离得到p . suffruticosa根据RNA孤立套件的协议(Takara,China)的花蕾。DNase I(Takara,Dian,中国)用于去除基因组DNA。通过Hiscrip III RT Supermix合成第一链CDNA,用于QPCR(+ GDNA刮水器)(Vazyme,南京,中国)。QRT-PCR在制造商的协议之后使用Chamq Universal Sybr QPCR主混合物(Vazyme,南京)进行。详细的反应系统和程序与前一项研究相似[36].此外,p . suffruticosa肌动蛋白用作内部对照,基于我们以前的不同候选控制基因的结果来规范转录水平(施那beta-tubulin那alpha-tubulin和60S-L.11.)[63.].底漆总理6用于设计特定的引物(表S.4.),并根据我们之前的转录剖面选择候选基因[36,系统发育树见图S4..使用2计算相对表达水平-ΔΔct方法(64.].
糖含量的测量
在30 Hz的含有氧化锆珠粒的破碎机(MM 400,RETSCH)压碎了每次重复的三个花蕾。将总共20mg粉末加入500μl甲醇:异丙醇:水(3:3:2,v / v / v)溶液。在涡旋(3分钟)和超声处理(30分钟)后,在氮气中取出上清液(50μl)并在氮气中蒸发,加入内标。在氮气流蒸发并冷冻干燥后,将残余物进一步达到如下:首先,将小分子碳水化合物与1.5ml管中的甲氧肟盐酸甲醇溶液(100μl)混合。其次,在37℃下向溶液中加入双甘油乙酰胺(100μl)2小时。涡旋后,将混合物在37℃温育30分钟。正己烷用作稀释融合。然后,Metuke检测混合物(http://www.metware.cn/)基于Agilent7890B-7000D GC-MS / MS平台,并将参数设置为Gómez-gonzález等。[65.]。
淀粉含量及AMY酶活性测定
根据先前的方法确定了五个冷却点的淀粉含量分别几乎没有变化[66.].用7.2 mL乙醇(80%)在80°C条件下提取牡丹芽碎粒0.1 g,浸提30 min。提取液离心30分钟,沉淀物在沸水浴中凝胶15分钟。将浓硫酸加入沉淀物中,使单糖脱水成醛类化合物。用蒽酮试剂与试验溶液反应。用分光光度计(日立,日本)记录640 nm处的吸光度。
AMY酶活性的测定方法参照Huggins和Russell(1948)的方法,略有修改[67.].取牡丹不同冷却时间(0、7、14、21、28 d)的花蕾约0.2 g磨成匀浆,离心收集上清。70°C孵育30 min,使β-淀粉酶失活。样品与3,5-二硝基水杨酸反应。用分光光度计(HITACHI, Japan)记录525 nm处的吸光度。
激素含量的测量
每次重复从不同的低温处理中取大约2g的新鲜芽。植物激素含量由武汉绿剑创制科技有限公司(http://www.greenswordcreation.com.基于LC-MS / MS分析,根据先前报告的次要修改方法[68.].
统计分析
使用GraphPad Prism 7(San Diego,USA)计算了手段和标准错误。方差分析(一种方式ANOVA)用于比较治疗和对照之间基因表达的统计差异和水平。
数据和材料的可用性
在当前研究期间使用和/或分析的数据集可从相应的作者获得合理的请求。本研究中使用的基因的序列可在Genbank获得(https://www.ncbi.nlm.nih.gov/genbank/),注册编号如下:诗,JN105300.1;PSCHI.ADK55061.1;psf3h.,HQ283447.1;PsDFR,HQ283448.1;斯坦斯KJ466969.1;Ps3GT,MT702582;PsAFB2,MT702583;PsTIR1MT702589;PSMYC2.,MT702586;Pscin.,MT702584;PsCWINMT702585;PsVINMT702590;PSSUS1MT702587;PSSUS2, MT702588。
缩写
- QC:
-
质量控制
- OPLS-DA:
-
正交投影潜在结构 - 判别分析
- DMS:
-
差分代谢物
- SD:
-
标准偏差
- 贵宾:
-
项目中的变量重要性
- gc - MS / MS:
-
气相色谱分析-质谱法
- 质/女士:
-
液相色谱电喷雾电离串联质谱
- eBG:
-
黄酮类生物合成的早期生物合成基因
- LBG:
-
类黄酮生物合成晚期合成基因
- bhlh:
-
基本helix-loop-helix蛋白质
- WD40:
-
WD重复蛋白
- Anova:
-
方差分析
参考文献
- 1。
安德森·吉夫,Gesch rw,jia y,chao ws,horvath dp。休眠状态,碳水化合物新陈代谢及叶状灌注冠芽中碳水化合物代谢和相关基因表达的季节性变化。植物细胞环境。2005; 28(12):1567-78。
- 2.
Lang GA,早期JD,达纳尔·兰尔,马丁GC。endo-,段和eCocormancy:生理术语和休眠研究分类。Hortscience。1987; 22:371-7。
- 3.
rohde a,bhalerao rp。植物休眠在多年生背景下。趋势植物SCI。2007; 12(5):217-23。
- 4.
Raghuram N.知道何时成长:调节芽休眠的信号。趋势植物SCI。2003; 9(1):9-12。
- 5.
苹果mc。落叶果树的休眠释放。2011年7月7日:239-300。
- 6。
Rhie Yh,Jung Hh,Kim Ks。寒冷要求破坏休眠和开花Paeonia Lactiflora.“太白”和“Mulsurae”。环境科学学报。2012;53(4):277-82。
- 7。
碳水化合物代谢及其相关基因的动态揭示了低温诱导的牡丹芽休眠释放过程中PPP通路的激活(牡丹).Sci Hortic-Amsterdam。2018; 242:36-43。
- 8。
Gholizadeh J,Sadeghipour HR,Abdolzadeh A,Hemmati K,Hassani D,Vahdati K.氧化还原而不是碳水化合物代谢与核桃品种的肺肺芽与对比的寒冷要求不同。Sci Hortic-Amsterdam。2017; 225:29-37。
- 9。
aslani aslamarz a,Vahdati K,Rahemi M,Hasani D.估计一些波斯核桃品种和基因型的冷却和热需求。Hortscience。2009; 44(3):697-701。
- 10。
Bonhomme M,Peuch M,Ameglio T,Rageau R,Guilliot A,Decourteix M,Alves G,Sakr S,Laconinte A.从木质血管的碳水化合物摄取和核桃干组织和芽之间的分布(juglans regia.l .)。树生理。2009; 30:89-102。
- 11.
Gonzalez-roossia d,Reig C,Dovis V,Gariglio n,Agusti M.通过人工冷藏诱导的树皮组织中碳水化合物和氮含量的变化及其与休眠芽突发的关系李属Sci Hortic-Amsterdam sp。2008; 118:275 - 81。
- 12.
Takemura Y,Kuroki K,Jiang M,Matsumoto K.鉴定表达的蛋白质和变化在抗坏血酸过氧化物酶活性与肺结核中的影响Pyrus pyrifolia.植物理性生物化学。2015; 86:121-9。
- 13.
关键词:牡丹,低温诱导,休眠释放,microrna,高通量测序Sci Rep-UK。2018; 8(1): 1 - 14。
- 14.
薛茹,唐y,王某,薛y,刘x,张x。基于淀粉和蔗糖新陈代谢调节剖析牡丹瓶子质量的干湿储存评价。Postharvest Biol Tec。2019; 155:11-9。
- 15.
袁永平,周永明,阮永利。蔗糖合酶在西瓜种子发育中的定位拟南芥在开发期间揭示了Sus的不同角色。J Exp Bot。2008; 59(12):3283-95。
- 16.
Sturm A.倒置。植物开发和蔗糖分区中的主要结构,功能和作用。植物理性。1999; 121(1):1-7。
- 17。
万H,吴L,杨Y,周G,阮Y.蔗糖新陈代谢的演变:倒置酶与超越的二分法。趋势植物SCI。2018; 23(2):163-77。
- 18。
王Sy,jiao hj,Faust M.苹果癌侧侧侧颌骨诱导的杂交中代谢酶活性的变化。Hortscience。1991年; 26(2):171-3。
- 19。
Halaly T, Pang X, Batikoff T, Crane O, Keren A, Venkateswari J, Ogrodovitch A, Sadka A, Lavee S, Or E.类似的机制可能被其他外部刺激触发,诱导葡萄花蕾释放休眠。足底。2008;228(1):79 - 88。
- 20.
维加拉R, Pérez FJ。自然和化学诱导的葡萄芽自然休眠释放的相似性葡萄L. SCI Hortic-Amsterdam。2010; 125(4):648-53。
- 21.
沈超,王海波,王旭东,王宝林,郑晓春,史晓斌,刘伟伟,刘方忠。葡萄芽休眠期间的呼吸变化。中国农业科学,2013;46(6):1201-7。
- 22.
Mason Mg,Ross JJ,Babst Ba,Wienclaw BN,Beveridge Ca.糖需求,而不是植物素,是顶级优势的初步调节因素。Proc Natl Acad Sci U S A. 2014; 111(16):6092-7。
- 23.
黄酮:生物合成、生物功能和生物技术应用。植物科学,2012;
- 24.
徐W,Dubos C,Lepiniec L. myB-BHLH-WDR复合物对类黄酮生物合成的转录控制。趋势植物SCI。2015; 20(3):176-85。
- 25。
黄酮醇:老化合物的老作用。安Bot-London。2011; 7(108): 1225 - 33所示。
- 26。
马哈哈M,Ahuja PS,Yadav SK。在烟草中黄酮合成酶mRNA的转录后沉默导致饲养的种子套装。Plos一个。2011; 6:E28315。
- 27。
关键词:番茄,花青素,转录网络,生物合成abstract:摩尔。2019;13(1):42-58。
- 28。
祝福A,Palva等。树木中冷驯化的分子控制。physiol植物。2006; 127(2):167-81。
- 29。
Singh P,Dave A,Vaistij Fe,Worrall D,Holroyd GH,Wells JG,Kaminski F,Graham Ia,Roberts Mr。拟拟拟南芥孕产妇草本患者茉莉酸依赖性调节。新植物。2017; 214(4):1702-11。
- 30.
Rinne Pl,恩,Vahala J,Ripel L,Ruonala R,KangasjärviJ,Schoot C.休眠芽的寒冷开花轨迹T.并招募ga诱导的1,3-β-葡聚糖酶重新打开信号通道,释放休眠杨树.植物细胞。2011;23(1):130 - 46。
- 31.
郑C,Halaly T,Acheampong Ak,TakeBayashi Y,Jikumaru Y,Kamiya Y,Etti Yo。脱落酸(ABA)调节葡萄芽休眠,休眠释放刺激可以通过ABA代谢的改性来作用。J Exp Bot。2015; 66(5):1527-42。
- 32。
Singh RK, Maurya JP, Azeez A, Miskolczi P, Tylewicz S, Stojkovič K, Delhomme N, Busov V, Bhalerao RP。介导杂交杨树芽裂控制的遗传网络。Nat Commun。2018;9(1):4173。
- 33。
Busov vb。植物发展:杨树SVL在营养芽休眠中的双重作用。Curr Biot。2019; 29(2):R68-70。
- 34。
关键词:牡丹,低温诱导,休眠释放,形态学,解剖结构,DNA甲基化植物生理学杂志。2019;144:64-72。
- 35。
黄X,朱武,戴某,盖S,郑铮,郑C。线粒体磷酸盐转运蛋白在寒冷治疗过程中养殖芽休眠释放(牡丹).足底。2008;228(4):545 - 52。
- 36。
盖S,张Y,刘C,张Y,郑G.成绩单剖析Paoenia Ostii.在人工低温诱导的休眠过程中,释放识别GA通路的激活和碳水化合物代谢。《公共科学图书馆•综合》。2013;8:e55297。
- 37.
Liu Y, djoubou Y, Mandal R, Aziat F, Dong E,等。2013年HMDB 3.0-人类代谢组数据库。核酸科学与技术;2012;41(D1): D801-7。
- 38.
4 . Zhu Z, Schultz AW, Wang J, Johnson CH, Yannone SM, Patti GJ, Siuzdak G. Liquid chromatography quadrupole of time-of-flight mass spectrometry based on METLIN数据库。Nat Protoc。2013;8(3):451 - 60。
- 39.
Breeze E. Master Mycs:Myc2,jasMonate信令“主交换机”。植物细胞。2019; 31(1):9-10。
- 40。
Maurya JP,Bhalerao RP。光周期和温度介导的树木生长戒烟和休眠控制:分子视角。安Bot-London。2017; 120(3):351-60。
- 41。
Vahdati K,Aslamarz Aa,Rahemi M,Hassani D,Leslie C.种子休眠机制及其与芽休眠的关系波斯核桃.环境实验机器人。2012;75:74-82。
- 42。
关键词:花蕾休眠,激素,糖,转录组,转录组李属却已.Sci Rep-UK。2018; 8(1): 5090。
- 43。
Ruttink T,Arend M,Morreel K,Storme V,Rombauts S,Fromm J,Bhalaerao RP,Boerjan W,Rohde A.杨树顶部芽形成和休眠诱导的分子时间表。植物细胞。2007; 19(8):2370-90。
- 44。
Díaz-ri elme j,Grimplet J,Martínez-Zapater Jm,Carmona MJ。转录组在葡萄葡萄葡萄芽发育中的变异(葡萄l .)。中国生物医学工程学报,2012;
- 45.
Lewis DR, Ramirez MV, Miller ND, Vallabhaneni P, Ray WK, Helm RF, Winkel BSJ, Muday GK。生长素和乙烯通过不同的转录网络诱导黄酮醇的积累。植物杂志。2011;156(1):144 - 64。
- 46.
Schijlen EG、Vos CH、Martens S、Jonker HH、Rosin FM、Molthoff JW、Tikunov YM、Angenent GC、Tunen AJ、Bovy AG。查尔酮合成酶是类黄酮生物合成途径中的第一步,通过RNA干扰沉默可获得单性果实。植物杂志。2007;144(3):1520 - 30。
- 47.
顾Z,朱茹,郝q,元y,段y,男人s,王q,侯q,刘z,shuq等。通过调节器官特异性表达,新型R2R3-MYB转录因子有助于花瓣斑块形成诗在树牡丹(牡丹).植物生理学杂志。2019;60(3):599-611。
- 48.
关键词:西贝牡丹,花瓣,花青素,无斑,斑点引用本文:Sci Hortic-Amsterdam。2007; 2(114): 104 - 11所示。
- 49。
Singh Rk,Miskolczi P,Maurya JP,Bhalerao RP。一棵树的北ortholog短期营养阶段花卉压缩机介导芽休眠的光饱和环境。Curr Biot。2019; 29(1):128-33。
- 50.
孙磊,李传祥,王伟,陶建民。基于RNA-seq的葡萄芽休眠转录组分析。植物生物学学报。2017;17(1):18。
- 51.
郑克,盖特,盖W.在树牡丹中冷却休眠期间内源激素的变化。Scientia silvae sinicae。2009; 2:48-52。
- 52.
张y,张某,李伊,刘c,郑g,盖s研究psga20ox.低温处理牡丹花蕾内休眠释放的参与基因。Acta Agriculturae Boreali-Sinica。2014; 3:22-6。
- 53.
Mubayidin L,Mambro Rd,Sabatini S. cytokinin-aniNin串扰。趋势植物SCI。2009; 14(10):557-62。
- 54.
Lombard PJ, Cook NC, Bellstedt DU。单氰胺氢施用量和修剪对春芽爆发期间鲜葡萄内源细胞分裂素水平的影响。Sci Hortic-Amsterdam。2006年,109(1):92 - 6。
- 55.
Dahlke Ri,Fraas S,Ullrich Kk,Heinemann K,Romeiks M,Rickmeyer T,Klebe G,Palme K,Luethen H,Steffens B.原生质体肿胀和缺口生长取决于不同的养肝信号传导途径。植物理性。2017; 175(2):982-94。
- 56。
王y,刘x,su h,yin s,汉c,hao d,dong x。冷藏诱导的休眠从内休眠到非休眠的监管机制伟业吉安娜姆coll.et hemsl根茎芽。植物mol biol。2019; 99(3):205-17。
- 57。
Ionescu Ia,López-ortega g,Burow M,Bayo-Canha A,Junge A,Gericke O,MøllerBL,Sánchez-PérezR.转录组和代谢物在甜樱桃氢氰酰胺诱导的花芽突破期间的转录组和代谢物变化。前植物SCI。2017; 8:1233。
- 58。
Kosova K,Prasil It,Vitamvas P,Dobrev P,Motyka V,Flokova K,Novak O,Tureckova V,Rolcik J,Pesek B等。寒冷耐寒性,冬季三山和春季粉末两种小麦品种寒冷适应植物植物反应。J植物理性。2012; 169(6):567-76。
- 59。
Kang HM, Saltveit ME。水杨酸对玉米、黄瓜和水稻幼苗叶片和根系的耐寒性有显著影响。杂志。2002;115(4):571 - 6。
- 60。
拟南芥ECAP是一种新的连接JAZ抑制因子和TPR2共抑制因子的接头蛋白,它抑制茉莉酸介导的花青素积累。摩尔。2020;13(2):246 - 65。
- 61。
王安,李锐,任玲,高翔,张勇,马智,马丹,罗勇不同肉色甘薯黄酮类化合物的比较代谢组学研究(番薯甘薯(l) lam)。食品化学。2018;260:124-34。
- 62。
1 .陈伟,龚磊,郭铮,王伟,张慧,刘晓,于胜,亚伦刚。一种新型的水稻代谢组学检测、鉴定和定量方法。摩尔。2013;6(6):1769 - 80。
- 63。
张应祥,盖平生,刘春英,穆平,郑国光。牡丹芽休眠释放实时荧光定量pcr分析中控制基因的选择牡丹).分子植物育种。2011;9:1052-6。
- 64。
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据-ΔΔct方法。方法。2001; 25(4):402-8。
- 65。
Gómez-gonzálezs,ruiz-jiménezj,priego capote f,Luque de Castro Md。在超声辅助浸出后通过气相色谱 - 串联质谱(GC-MS / MS)在橄榄水果,叶和茎中定性和定量糖分析。j农业食品化学。2010; 58(23):12292-9。
- 66。
陈建平,刘建军。植物组织中淀粉和可溶性碳水化合物的渗透定量分析。肛门。1975;68(1):87 - 94。
- 67。
淀粉酶的比色法测定。安Surg. 1948; 128(4): 668 - 78。
- 68。
陈米,他x,夏l,ye t,侯s,黄y,元b,吴y,冯y。使用衍生化方法的酸性植物激素的高度敏感和定量分析耦合与纳米lc-ei-q-tof-MS分析。J Chromatogr B. 2012; 905:67-74。
致谢
作者非常感谢中国科学院植物研究所的舒庆炎,他对黄酮类化合物的分析提供了有用的指导。
资金
国家自然科学基金项目(no . 31672194, no . 31872145, no . 31972452);国家重点研发计划项目(no . 2018YFD1000403)。关键词:岩石力学,应力-应变关系,应力-应变关系资助机构没有参与研究的设计、数据的收集、分析和解释,也没有参与手稿的撰写。
作者信息
从属关系
贡献
GSP和ZYX共同构思和设计了实验方案。ZT、CXZ、ZY和LCY进行了实验。ZT和YYC写了手稿。GSP和ZYX对稿件进行了修改。所有作者阅读并批准最终稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1
由LC-ESI-MS / MS鉴定的代谢物并注释。
附加文件2:表S2。
Kegg疾病富集相关DMS的浓缩。
附加文件3:表S3。
与休眠释放相关的DMS,也涉及代谢途径。
附加文件4:表S4。
引物序列用于qRT-PCR分析。
附加文件5:表S5。
系统发育分析中使用的蛋白质的加入数。
附加文件6:图S1。
每个比较组的OPLS-DE分数图。
附加文件7:图S2。
4个比较代谢物的Venn图。(a)上调的代谢物。(b)下调的代谢物。
附加文件8:图S3。
对前20个差异代谢物进行KEGG富集分析。代谢物的P.T检验值< 0.05,VIP≥1为两处理间的差异代谢物。
附加文件9:图S4。
该研究表达分析的相关基因的系统发育分析。蛋白质的氨基酸序列与群集W对齐,并且使用以下选项的邻接方法在Mega 7中构建系统发育树:部分删除和复制引导(1000)。蛋白质登录号显示在表S中5..(a)蔗糖相关基因。(b)类黄酮类相关基因。(c)与植物激素相关的基因。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
张,T.,元,Y.,詹,y。等等。代谢组学分析揭示了牡丹休眠过渡过程中Embden Meyerhof Parnas通路的激活和黄酮类化合物的积累。BMC植物杂志20,484(2020)。https://doi.org/10.1186/s12870-020-02692-x
已收到:
公认:
发表:
关键词
- 牡丹
- 休眠的过渡
- 代谢组学
- EMP激活
- 黄酮类积累