抽象的
背景
为探索茎叶早期发育的分子调控机制,对茎细叶小的F基因型紫花苜蓿和茎粗叶大的M基因型紫花苜蓿的叶片和茎进行蛋白质组学分析。
结果
基于> 1.20或< 0.83的折变阈值(p < 0.05), a large number of proteins were identified as being differentially enriched between the M and F genotypes: 249 downregulated and 139 upregulated in stems and 164 downregulated and 134 upregulated in leaves. The differentially enriched proteins in stems were mainly involved in amino acid biosynthesis, phenylpropanoid biosynthesis, carbon fixation, and phenylalanine metabolism. The differentially enriched proteins in leaves were mainly involved in porphyrin and chlorophyll metabolism, phenylpropanoid biosynthesis, starch and sucrose metabolism, and carbon fixation in photosynthetic organisms. Six differentially enriched proteins were mapped onto the porphyrin and chlorophyll metabolism pathway in leaves of the M genotype, including five upregulated proteins involved in chlorophyll biosynthesis and one downregulated protein involved in chlorophyll degradation. Eleven differentially enriched proteins were mapped onto the phenylpropanoid pathway in stems of the M genotype, including two upregulated proteins and nine downregulated proteins.
结论
叶绿素合成增强、木质素合成降低是M基因型紫花苜蓿叶片较大、茎秆木质化程度较低的合理解释。该蛋白质组学研究旨在对差异富集的蛋白质的功能进行分类,并提供有关茎和叶发育的分子调节网络的信息。
背景
与动物相比,土地植物不断产生新的组织和器官来完成其生命周期,并且茎和叶的形成是植物生长和发育的关键方面。植物芽,包括叶,茎和鲜花,与拍摄顶端单位(SAM)的区别区分[1].叶子从山姆发起[2],是光合作用和光学的中央器官。此外,它们是植物防御的第一种障碍,保护植物免受紫外线的光化学损伤,维持植物机械性能,并防止生物和非生物因素的损害[3.].至于茎,植物干细胞是由多糖,酚类化合物和蛋白质组成的动态结构;茎通过木瓜和韧皮术连接植物器官和运输营养[4.].植物茎不仅适用于维持植物高度和刚性,而且还通过释放信号分子来响应环境压力[5.].
紫花苜蓿(Medicago Sativa.L.)是一种营养价值高、广泛种植的多年生豆类饲料[6.].与植物成熟期间苜蓿茎营养价值逐渐下降相比,苜蓿叶的营养价值在整个生长季节中仍然很高[7.].在其成长和发展过程中,苜蓿的营养价值随着茎叶的比例而变化[8.].茎叶与叶的比例是反映苜蓿品质的相关指数。嫩植物具有高叶产率,粗蛋白质含量高,营养价值高。随着植物的生长和年龄,叶比降低,干物质含量增加,纤维素含量增加,细胞壁逐渐变稠,有机糖增加。茎的相对食品值的降低是由于细胞壁部件沉积的变化[9.].为了阐明两种苜蓿基因型的细胞壁浓度和茎组成的差异,在转录物分析中鉴定了几种候选基因[10.].随着质量下降,叶子是苜蓿营养的基本来源,直接影响苜蓿干草的质量[6.那11.那12.].
近年来,已经确定了一系列广泛的参与苜蓿茎发育和叶片形态发生的基因。然而,茎发育和叶片形态发生的分子调控是一种复杂的生物过程,尚未完全揭示。经典遗传方法不足以阐明叶片形态发生和干发育的分子调控机制,蛋白质组学已被用作蛋白质功能识别的互补方法[13.].令人印象深刻的蛋白质组学工具和研究差异富集的蛋白质的方法可以深入了解负责叶子和阀杆结构差异的机制。不同茎区域的蛋白质组分析表明,纤维素生物合成中涉及的蛋白质子集在中间体和成熟基础区域中显着富集,导致更高的纤维素和木质素含量[14.].
在这里,我们报道了叶片的蛋白质组学分析和茎的叶片和茎,薄茎和小叶(表示FS和F1),以及M基因型苜蓿,厚茎和大叶(表示MS和M1)。与先前发布的同一遗传背景下的叶子和干燥发育的分子机制研究相反[10.那14.那15.[这里,这里从两种苜蓿基因型收集叶子和茎样品,其中包含从低饲料率和高屈曲产量的面板中选择的不同遗传背景。本研究旨在鉴定与叶形态发生和干燥发育相关的差异富集的蛋白质,从而进一步探索了早期茎和叶发育的调节机制。
结果
Alfalfa基因型之间的表型差异
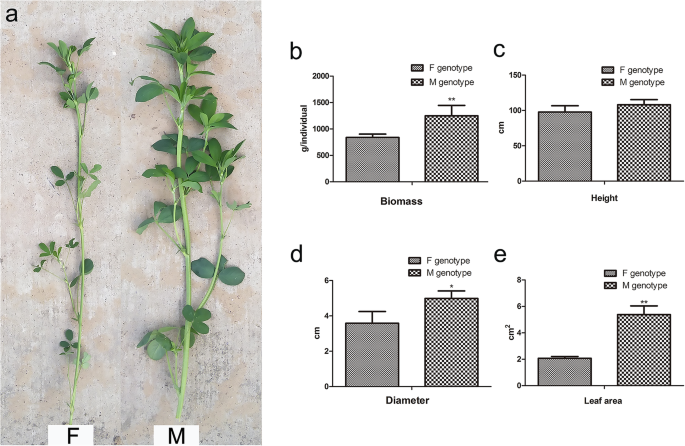
F和M基因型之间存在显著的表型差异(图。1a),特别是在生物量。M基因型苜蓿中的个体植物生物质显着高于F基因型苜蓿,与茎直径和叶面积的差异一致(图。1b)。M基因型的生物量高于F基因型的48.7%,M基因型的叶面积比F基因型高2.6倍。然而,尽管M基因型苜蓿的高度略大于F基因型苜蓿的高度,但两种基因型之间没有显着差异。近红外反射光谱(NIRS)用于测量两种基因型的营养值。M基因型具有比F基因型更高的营养价值,包括较高的粗蛋白质浓度和低纤维素和木质素含量(补充说明1).
使用ITRAQ的苜蓿茎和叶片中蛋白质的定量鉴定
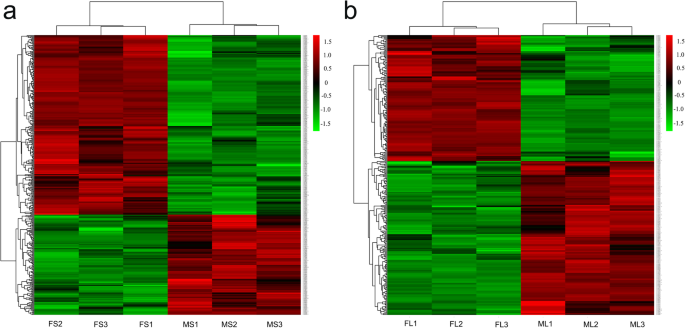
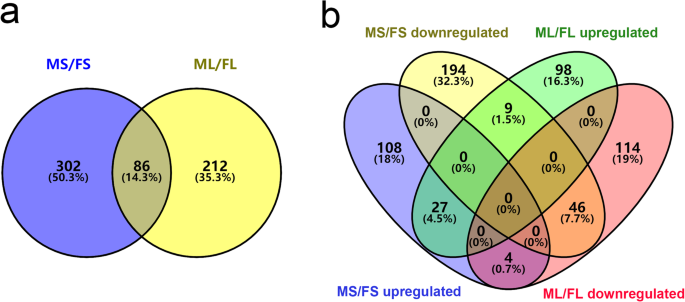
我们获得了14,315个独特的肽,其中包括3784个鉴定的蛋白质(补充表12)。折叠变化阈值> 1.20或<0.83(p < 0.05) was used to identify differentially enriched proteins (DEPs) between FS and MS and between FL and ML. Using these criteria, 388 DEPs were identified in stems, including 249 downregulated and 139 upregulated DEPs (Fig.2A,补充表3.).同样,在叶片中鉴定出298个DEPs,其中164个表达下调,134个表达上调。2B,补充表4.).与F基因型苜蓿相比,在茎和叶中鉴定了八十六个·锑(14.3%),包括二十七个上调和下调四十六(图。3.A-B)。然而,剩余的十三张Deps显示出茎和叶子的相反趋势。此外,在茎中升高了四种DEP,而在叶片中下调。相反,在叶片中上调九个Dep并在茎中下调(图。3.b)。
差异富集蛋白质的功能分类
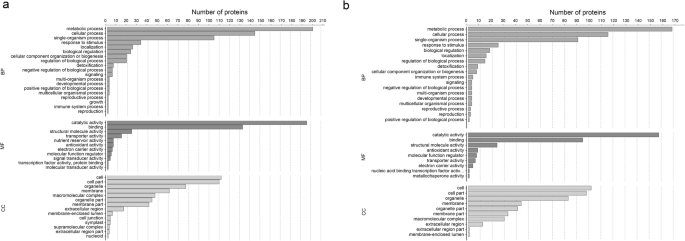
进行富集以鉴定DEPS的生物学功能,根据其生物过程,细胞组分和分子功能进行分类,(补充表5.和6.).茎和叶中的主要生物过程类别是代谢过程,细胞过程,对刺激的反应以及生物合成调控。最丰富的细胞组分类别是细胞,细胞部分和细胞器,茎中最丰富的分子功能类别(图。4.a)和叶片(图。4.b)是催化活性,结合,结构分子活性和运输活性。
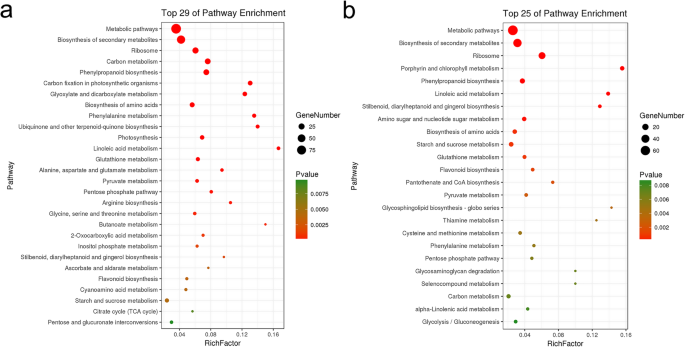
进行了KEGG分析以获得洞察所识别的DEPS的生化途径。茎中的388型DEPS映射到82个途径,叶片中的298···甲酸盐被映射到76个途径(补充表7.和8.).除了代谢途径外,次级代谢物的生物合成,源病,茎也显示出25例额外途径的显着富集,包括碳代谢,苯丙醇生物合成,光合生物中的碳固定,乙醛酸和二羧酸代谢,氨基酸生物合成,苯丙氨酸代谢,苯丙氨酸代谢,泛醌和其他三萜醌生物合成,光合作用,亚油酸代谢,谷胱甘肽代谢和丙氨酸,天冬氨酸和谷氨酸代谢(图。5.a).同样,在21个途径中,叶片显著富集,包括卟啉和叶绿素II代谢、苯丙素生物合成和亚油酸代谢(图2)。5.b)。根据Kegg途径泡沫图,鉴定的蛋白质(p< 0.01)主要映射到茎中的28个亚型,叶中的24个亚型(补充表)9.和10.).
茎叶富集代谢途径的差异
KEGG富集分析这些蛋白质显示出富集的途径中的显着重叠:61个途径在茎和叶中富集。这些途径中的十分大于富集(P <0.01),主要与碳代谢有关;phenylpropanoid生物合成;氨基酸的生物合成;磷酸戊糖途径;淀粉和蔗糖代谢;丙酮酸代谢;二苯乙烯、二芳基庚烷和姜酚的生物合成;和类黄酮的生物合成。以下途径在茎中特别富集:光合生物的固碳作用;乙醛酸和二羧酸的代谢; ubiquinone and other terpenoid-quinone biosynthesis; photosynthesis; alanine, aspartate and glutamate metabolism; arginine biosynthesis; glycine, serine and threonine metabolism; butanoate metabolism; 2-oxocarboxylic acid metabolism; inositol phosphate metabolism; ascorbate and aldarate metabolism; cyanoamino acid metabolism; citrate cycle (TCA cycle); and pentose and glucuronate interconversions. Likewise, the following pathways were specifically enriched in leaves: porphyrin and chlorophyll metabolism; amino sugar and nucleotide sugar metabolism; pantothenate and COA biosynthesis; glycosphingolipid biosynthesis; thiamine metabolism; cysteine and methionine metabolism; selenocompound metabolism; glycosaminoglycan degradation; alpha-linolenic acid metabolism; and glycolysis / gluconeogenesis.
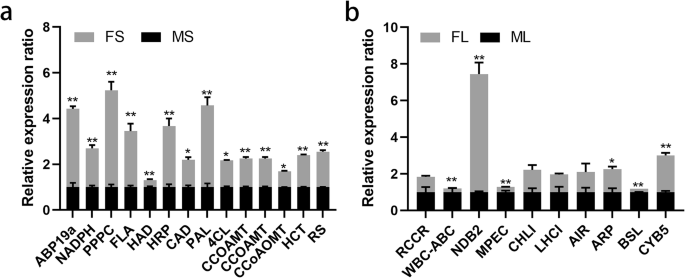
为了进一步证实蛋白质组学结果,使用QRT-PCR使用特异性引物检查随机选择的蛋白质的mRNA表达(补充表11.).与FS,十三次(包括制冷素结合蛋白ABP19A(ABP19A),NAD(P)H:醌氧化还原酶,磷酸丙酮酸羧酸酯酶(PPPC),血糖域域蛋白质,辣根过氧化物酶样蛋白(HRP),苯丙氨酸氨 - 溶酶 -与蛋白质(PAL),肉桂醇脱氢酶(CAD),Shikimal / Quinate羟基氨基酰基 - 转移酶(HCT),核黄素合酶α链,4-作用:CoA连接酶样蛋白(4Cl样)和咖啡酸O-甲基转移酶(CCOAMT)被上调,在MS中鉴定并下调咖啡酰基-COA 3-O-甲基转移酶(CCOAOMT)和具有 - 族水解酶IIa(图。6.一种)。此外,虽然CCOAMT和HAY家族水解酶IIA的mRNA水平与其蛋白质水平不一致,但11个基因的mRNA表达谱与它们的蛋白质水平一致(图。6.一、补充表3.和4.).另外,与Fl,十分之一(包括光收获络合物I叶绿素A / B结合蛋白(LHCI),营养抑制/休眠相关蛋白(ARP),白棕色复合ABC转运蛋白(WBC)(WBC-ABC),红叶绿素分子还原酶(RCCR),根培养蛋白(空气),细胞色素B5样血红液/类固醇结合结构域蛋白(CYB5)和NAD(P)H脱氢酶B2(NDB2)诱导在氟中下调。显着富集和上调镁 - 原生素IX单体甲基酯环酶(MEPC),树皮储存样蛋白(BSL)和镁切酶亚单位CHLI(CHLI)。更重要的是,九种基因的mRNA丰度与其蛋白质水平一致,而两个基因(LHCI和CHLI)的mRNA丰度与其叶子中的蛋白质水平相反(图。6.B,补充表5.).
讨论
木质素生物合成参与在茎发育和二次生长的调节中
作为间谍细节,茎木质化逐渐加深。增加茎成熟度加速干汞,随后增加茎/叶比,导致消化率降低。以前的研究表明,茎的成熟度影响了饲料的消化率,提高消化率是苜蓿育种的主要目标[16.].因此,为了监测苜蓿消化率的变化,最近的研究专注于苯丙砜生物合成途径中参与的关键基因的表达[17.那18.].细胞壁合成,包括纤维素,半纤维素和木质素的合成,是一种复杂的生物过程。纤维素生物合成通过蔗糖合成酶的膜结合的玫瑰色合成结构进行,其是整体部件[19.].木质素的存在,由三种醇单体(香豆素,Coniferol和骨髓苷)形成的复杂酚醛聚合物,是降低苜蓿消化率的主要原因[20.].木质素生物合成需要各种酶的参与,而木质素是苯丙代丙烷代谢途径的基本产物之一。单氯代酚的特异性生物合成始于Shikimate途径中苯丙氨酸的产生[21那22]并继续形成3-羟基苯基,胍基和陶氏肾上腺素,最后是木质素的合成[23].
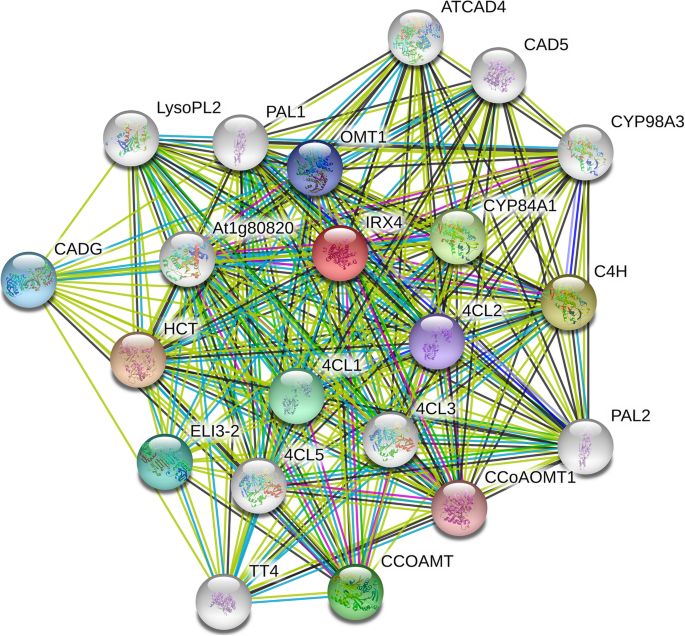
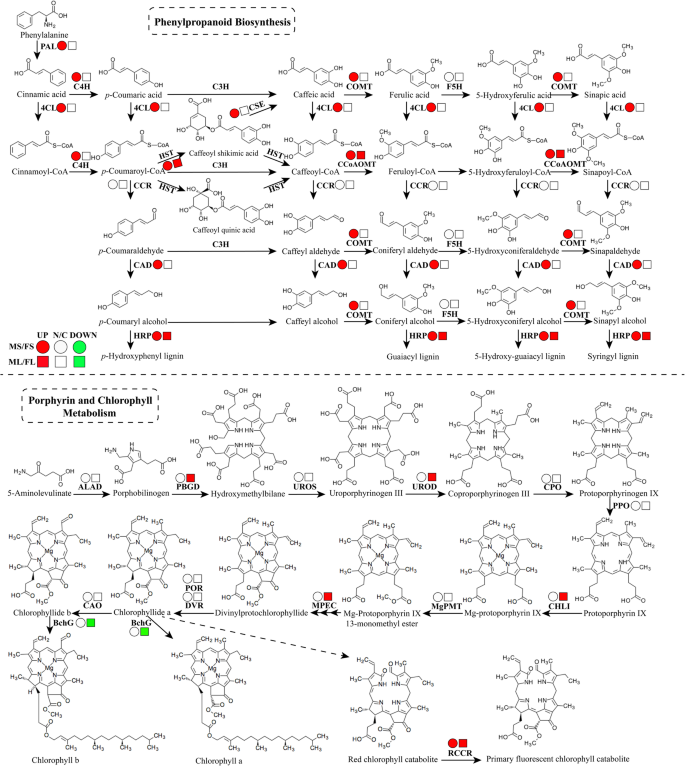
21种蛋白质的相互作用网络参与苯丙烷化生物合成(图。7.),并且在目前的研究中鉴定了苯丙烷化生物合成的大部分关键酶。总共映射到苯丙醇丙烷途径上的11℃(图。8.a)、苯丙氨酸解氨酶样蛋白(PAL)、细胞色素P450家族肉桂酸4-羟化酶(C4H)、咖啡酸o -甲基转移酶(CCoAMT)、4-香豆酸:辅酶a连接酶样蛋白(4CL)、单甘油酯脂肪酶样蛋白(MGL)、hxxxd型酰基转移酶家族蛋白(HCT)、咖啡酰辅酶a 3- o -甲基转移酶(CCoAOMT)、肉桂醇脱氢酶样蛋白(CAD)、辣根过氧化物酶样蛋白(HRP)、糖苷水解酶家族1蛋白(GH1)、细胞色素P450家族单加氧酶(F5H)。与MS相比,FS中有9个蛋白显著上调,而hxxxd型酰基转移酶家族蛋白(HCT)和细胞色素P450家族单加氧酶(F5H)下调。这些表达变化为F基因型茎秆木质化水平较高提供了合理的解释(补充图S1).
苯丙类生物合成相关DEPs的蛋白-蛋白相互作用网络。使用STRING数据库生成网络(https://string-db.org/) 和拟南芥蒂利亚纳IRX4(Cgnamoyl-CoA还原酶1)选择为输入。网络通过额外的十种蛋白质使用串接口中的“更多”按钮进行扩展,交互链路的置信截止设置为“最高”(0.900)。蛋白质相互作用网络被映射A. Thaliana.作为参考
与苯丙烷化生物合成和卟啉和叶绿素代谢相关的蛋白质的丰富变化。一种。苯丙烷化生物合成途径概述Medicago Sativa.酶的缩写如下。苯丙氨酸解氨酶样蛋白(PAL)、细胞色素P450家族肉桂酸4-羟化酶(C4H)、咖啡酸o -甲基转移酶(COMT)、4-香豆酸:辅酶a连接酶样蛋白(4CL)、单甘油酯脂肪酶样蛋白(MGL)、hxxxd型酰基转移酶家族蛋白(HCT)、咖啡酰辅酶a 3- o -甲基转移酶(CCoAOMT)、肉桂醇脱氢酶样蛋白(CAD)、辣根过氧化物酶样蛋白(HRP)、糖苷水解酶家族1蛋白(GH1)、细胞色素P450家族单加氧酶(F5H);b.卟啉和叶绿素代谢途径综述m .漂白亚麻纤维卷酶的缩写如下。卟酚脱氨基酶(PBGD),尿布卟啉脱羧酶(UPOD),菌氯基氯合酶(BCHG),红叶酚抗粘合剂还原酶(RCCR),镁 - 切氨酸酶亚单位CHLI和镁 - 原生素IX单甲酯环化酶(MPEC)。圆圈代表茎中鉴定的蛋白质,而平方则代表叶子中鉴定的蛋白质。红色表示上调,白色表明无明显变化,绿色表明在M基因型苜蓿中的下调
苯丙氨酸氨酶样蛋白(PAL),一种与初级组织中脾气相关的酶,催化苯丙氨酸的序列以引发苯丙醇醇代谢[24].PAL的表达在茎中初级生长转变期间,浓缩的单宁(CTS)积累在茎中的次生生长过渡期间相同,并且PAL主要表达于茎,叶和根的非灼热细胞中[25].在目前的研究中,PAL在MS中下调与FS相比,与茎的成熟一致(图。6.a),暗示PAL在苯丙醇丙醇蛋白代谢以及干燥发育中发挥了重要作用。先前的研究报道,香豆素3-羟化酶(C3H)和C4H涉及单氯化物生物合成的早期步骤,对茎消化率产生负面影响[18.].在目前的研究中,MS的C4H含量明显低于FS(图。6.a),与较低的单氯化物生物合成和MS的茎消化率一致。
CAD催化单甘醇合成的最终步骤,因此是合成S-,G-和H-Lignin的关键酶[26].4CL在木质素单体的生物合成中发挥作用,特别是Guaiacyl(g)lignin [27], 4CL家族基因的表达模式存在重叠[28].在目前的研究中,CAD,4CL和C4H在苯丙烷化生物合成途径中大量富集。此外,所有这些蛋白质在MS的始终如一的低蛋白质和转录水平,而不是FS(图。6.a),与FS中的更大木质素积累一致。以前的研究报道说,CCOOMT和CCOAMT的下调导致降低木质素水平和G单位的减少[29].在本研究中,MS中CCoAOMT和CCOAMT相对于FS显著下调(图)。6.a),与MS中的木质素生物合成一致。
以前的研究报道说,Shikige / Quinate HCT在木质素生物合成中起重要作用,HCT积累和木质素属性之间存在强烈的相关性[30.].在目前的研究中,蛋白质和转录物水平的Shikime / Quinate HCT的MS比FS较低,与MS中的降低木质素积累一致。此外,在茎中还富集了四种脂质转移蛋白,八种丝氨酸蛋白质和六个筋膜域蛋白(包括3个筋膜样阿拉伯酰胺蛋白,脓性),并据报道这些蛋白质参与细胞壁成熟和二次生长[31那32].
考虑到上述所有基因,参与木质素生物合成和茎发育和二次生长的调控。虽然M基因型具有较厚的茎(图。1a),与木质素合成相关的Deps的表达比在in中较低,表明m累积较少的木质素。这表明M基因型可能具有更高的生物产率和比F基因型更高的营养值(图。1B,补充图。S1).
两种苜蓿基因型叶片之间新陈代谢相关的Deps的差异
叶子从山姆发起,最终成为专门的平板器官,以方便光捕获和光合作用。叶子形态发生,这引起了各种尺寸和形状,是一种复杂的过程,其由来自多种途径的许多基因调节[33那34那35那36].早期叶发育是任意分为三个阶段:叶原始的启动,建立叶形曲线 - 轴承极性,以及叶片的膨胀[37那38].以前,据报道,Kanadi和Yabby转录因子是负责厌氧组织的发展[39那40那41.那42.].初始不对称叶片开发由极性yabby表达调节[43.].此外,Kanadi和Yabby3(YAB3)的功能增益等位基因导致径向附带的器官[40那41.[附加物组织分化分别[39那42.].
内部遗传机制和外部环境提示调节叶片发展。植物激素,尤其是植物素,调节整个叶片发展过程[44.].植物养羊酸稳态主要由三个进程维持:De Novo Iaa生物合成,IAA降解和IAA缀合/欺诈。此外,据报道,IAA羧基甲基转移酶通过IAA转化为甲基-IAA酯(MEIAA)对蟾蜍稳态调节具有重要作用45.].在本研究中,吲哚-3-乙醛氧化酶参与IAA的生物合成,ML的含量低于FL,表明在M1中产生较少的植物蛋白[46.].此外,吲哚-3-乙醛氧化酶水平的变化趋势与ARP和AIR的变化趋势一致(图2)。6.b),参与养肝稳态,并在叶发育中发挥重要作用。
光合作用是植物和其他生物用来将光能转化为化学能的过程,以后可以释放到促进生物体的活动。光系统是涉及光合作用的蛋白质复合物的功能性和结构单元,其次进行光合作用的主要光化学:光的吸收和能量和电子的转移。LHCI通过照相系统II影响光能的捕获,这是光反应中的关键步骤[47.].叶绿体NAD(P)H脱氢酶(NDH)复合物,作为电子给体,介导光线I(PSI)环状和氯仑散对电子传输[48.那49.].NDH的有效操作通过轻微的LHCI需要超复杂的地层拟南芥,两者都在光合作用中发挥基本作用[50.].在目前的研究中,LHCI和NDH相对于FL在m1中下调(图。6.b).蛋白质丰度的降低可能导致了ML单位叶面积光合速率的降低。1b)可能已经补偿了ML中光合速率的降低,这为ML中的较高叶片生物质提供了合理的解释。
绿色植物通过叶绿体(包括叶绿素A和B)的光合作用来从阳光下获得大部分能量,这给了它们它们的绿色。有趣的是,与碳固定代谢和光合作用相关的Deps在叶子中显着富集,供应植物发育的能量。叶绿素,植物叶中的主要颜料,主要参与光合作用,叶绿素生物合成在叶发育中起重要作用。将镁插入叶绿素分子的插入主要由镁切蛋白亚基Chli的活性来控制,其在叶绿素生物合成途径中进行临界步骤[51.那52.].在目前的研究中,将六个DEP被映射到卟啉和叶绿素代谢途径上,包括卟啉突酶(PBGD),尿布卟啉脱羧酶(UPOD),菌氯基吡咯烷基合酶(BCHG),红叶酚氯化物还原酶(RCCR),CHLI和镁 - 原生卟啉Ix单甲酯环酶(MPEC),其显着富含叶片(图。8.b)。此外,Chli和MPEC都是[53.相对于FL显着上调,表明ML的叶绿素生物合成和光合效率较高(图。6.b)。此外,ML中的颗粒状淀粉合酶I的较高含量也表明了更多光合产物的积累[54.],符合更高的生物量在ml中的比在v中。
在叶片衰老期间发生叶绿素降解,通过信号感知和转导通过转录因子和受体激酶调节的叶片发育的最终阶段[55.那56.].最近的研究表明叶绿素酶、镁螯合物和RCCR参与叶绿素分解[57.那58.].在目前的研究中,RCCR是细胞死亡的主要诱导剂[59., ML的蛋白和转录水平始终低于FL(图。6.b),可能导致FL中的RCCR积累。增强的叶绿素降解可能进一步降低光合速率,有助于苜蓿基因型之间观察到的生物量的差异。
叶和茎中DEPs的比较蛋白质组学分析
物质合成和能量代谢为植物提供了必要的营养供给,是植物正常生长发育所必需的。先前的研究报道了碳水化合物代谢直接影响植物的生长状态[60.].有趣的是,碳代谢和能量代谢显示茎和叶中的相似趋势。同样,苜蓿基因型之间最大的Deps组也与叶子和茎中的代谢有关。在叶片中鉴定糖酵解/葡糖生成,戊糖磷酸术和丙酮酸代谢的DEPs(图。5.b).同样,在苜蓿基因型的茎中也发现了大量参与戊糖磷酸途径、柠檬酸循环(TCA循环)、乙醛酸盐和二羧酸盐代谢的DEPs(图)。5.一种)。此外,在MS和M1中鉴定和上调的大多数DEP涉及碳水化合物代谢和氨基酸生物合成,表明初级代谢增强以促进叶片和干燥的发育,并促进M基因型中的增加的生物量。
茎和叶组织为在萌芽阶段提供了用于花卉开发的必要营养和材料储备。在目前的研究中,在茎和叶中鉴定了参与肌醇磷脂信号传导途径中涉及肌醇磷脂信号传导途径的LiNoleat 13s-脂氧合酶2-1和种子Limolate 9S-脂氧合酶。以前的研究表明,肌醇磷脂信号系统的各种组分在花粉发育期间和花粉管生长期间参与真空变化和囊泡运输[61.].在M个基因型中,Limolat 13s-脂氧酶2-1和种子Limolate 9s-脂氧合酶的蛋白质丰度降低表明该基因型可以保持较长的营养生长并避免早期的生殖生长,这有利于更多生物量的积累。
花青素生物合成在花粉发育中起着不可或缺的作用,特别是对于血清粉的苜蓿。为了避免在苜蓿中的自我授粉,花卉色素沉着是有利于吸引昆虫和传递花粉。二氢萘酚4-还原酶(DFR),催化二氢洛丹洛醇对白霉素(-delphyhynidin和-Pelargonidin)的反应催化的花青素生物合成的基本酶[62.],在M基因型苜蓿中显着下调,进一步证明M基因型苜蓿可以保持较长的营养生长。此外,作为光合产物的最终储存形式,暗储存蛋白质被上调并富集在M基因型中,为增加的M基因型的生物量增加,提供了进一步的解释。
进一步分析了仅在茎中鉴定的302 dep的生物学功能,仅在叶中鉴定在叶中。就木质素生物合成和苯丙氨酸代谢而言,尽管在叶子和茎中鉴定了DEP,但几乎所有与苯丙氨酸途径相关的酶被显着富集在茎中,而在叶片中累积有很少累积,表明木质素合成和苯丙氨酸代谢主要发挥作用在干燥的发展中。然而,两种基因型之间的生物量差异来自光合效率的差异。几种参与卟啉和叶绿素代谢(包括PBGD,UPOD,BCHG,CHLI和MPEC)和颗粒结合的淀粉合酶I的DEPs仅在叶蛋白质组中鉴定并在mL中上调,为更高的生物量提供合理的解释M基因型。
结论
叶和茎的发育是一个复杂的过程,贯穿于植物的整个生活史。尤其是紫花苜蓿,产量和质量之间总是存在着矛盾。为了获得高产优质的紫花苜蓿,研究调控紫花苜蓿茎叶发育的分子机制势在必行。在本研究中,我们将6个DEPs定位到ML中卟啉和叶绿素代谢途径,包括5个参与叶绿素生物合成的上调蛋白和1个参与叶绿素降解的下调蛋白。同时,在MS中共定位到11个DEPs,包括2个上调蛋白和9个下调蛋白。叶绿素合成增强、木质素合成降低是M基因型紫花苜蓿叶片较大、茎秆木质化程度较低的合理解释。通过对苜蓿茎叶发育过程中蛋白质表达谱的分析,可以进一步了解苜蓿茎叶发育的分子机制。
方法
植物材料
两种苜蓿基因型,F基因型苜蓿,薄茎和小叶衍生自局部品种“沧州”(CF000735)(F)和M基因型苜蓿,含有厚茎和源自栽培品种中产No.1的大叶子(CF032020)(m)分别从低屈服产量分别单独选择。由我们的实验室收集并克隆植物材料,两种苜蓿基因型的近似休眠分类为水平3.在2014年春季的早期分支阶段,每种植物被选自F和M基因型苜蓿,并被扦插克隆传播。然后将克隆植物种植在河北省廊坊的CAAS研究站领域(39.59°N,116.59°E)。随机选择来自每个基因型的十个克隆植物的三种单独的植物进行进一步分析。在2017年的自然条件下,在第一个残茬的萌芽阶段测量三种随机选择的单个植物的农艺性状:地上生物质,植物高度,叶面积和茎直径(图。1a).地上生物量通过测量三株单株的干重得到,高度通过测量三株单株最高的分枝得到。采收后,在每株茎基部随机选取5根枝条,测量其直径。叶面积是通过测量位于三株单株第三节的三叶叶末端小叶得到的。由于两种材料开花期的差异,枝条的取样时间在相同的生理阶段(即花芽尚未开放和仍处于萌芽状态时)。茎和叶在芽期同时采集。从不同基因型的3株克隆植株中采集茎(约为茎尖的前三个节间)和叶(包括叶柄和托叶,位于前三个节间内)的样本,用于蛋白质组学和基因表达分析。M基因型茎、M基因型叶、F基因型茎和F基因型叶分别标记为MS、ML、FS和FL。所有样品在提取蛋白质和RNA之前立即用液氮冷冻并保存在−80°C。随机采集两种苜蓿基因型的样品,在105℃恒重干燥48 h。将干样压碎,筛分1mm,低温、暗、隔热保存。 The quality of the dried samples was analyzed with a near infrared spectrometer system (FOSS NIR System 5000, FOSS, Denmark) over the 1100–2500 nm wavelength range at 2 nm wavelength intervals. Measurements were performed under stable working conditions at room temperature (25 °C), and WinI-SI III calibration software was used. Each sample was loaded and scanned three times, the average value was taken, and the spectral data was recorded in the form of log (1/R). Under the same working parameters and conditions, composition analysis (including crude protein, NDF, ADF, and lignin) of the two alfalfa genotypes was performed with same calibration software. All experiments were conducted with three biological replicates. The experimental design and technical process are presented as a technical roadmap in Supplementary Fig. S2.
蛋白质提取和纯化
根据我们之前的出版物提取并纯化蛋白质[63.].样品在液氮中磨成粉末,与裂解缓冲液(7 M尿素,2 M硫脲,4% CHAPS, 50 ml蛋白酶抑制剂鸡尾酒)充分混合。将混合物剧烈旋转,超声振荡60 s(开0.2 s /关2 s),振幅为22%。提取液在室温下孵育30 min,然后在15,000×g 10℃离心1 h。将上清转移到含有4×体积预冷10% (w/v)三氯乙酸(TCA)/丙酮的新微离心管中,在−20℃过夜沉淀蛋白。4℃,13,000×g离心10 min,沉淀用预冷丙酮漂洗离心。用Bradford试剂盒(Bio-Rad Laboratory)测定蛋白浓度,用牛血清白蛋白(BSA)生成标准曲线。
iTRAQ标记和LC-MS/MS分析
使用如下的过滤剂辅助样品制备(FASP)工作流程消化蛋白质[64.].对于每个样品,将DTT加入到200μg蛋白质样品中,在60℃下终浓度为25mm,1小时。将混合物在室温下用50mM碘乙酰胺烷基化10分钟,然后以12,000×g离心20分钟。加入100μL溶解缓冲液,将混合物以12,000×g离心。最终丢弃滤液,并用胰蛋白酶消化蛋白质样品在37℃下用胰蛋白酶(Promega,Madicon,Wi,USA)消化过夜。根据制造商推荐的程序,用来自ITRAQ试剂-8Plex Multiplex套件(AB Sciex,USA)的等因素标记标记肽标记[65.].然后将标记的肽混合物合并并通过真空离心干燥。以0.7ml / min的流速加载100μl样品的标记样品。从具有高pH的反相分离获得的组分在20μL2%甲醇和0.1%甲酸中重新溶解,然后以12,000×g离心。将10μL上清液以0.35ml / min的流速加载15分钟。分离速度设定为300 nl / min。
蛋白质识别和量化
数据库搜索的执行情况如本署上一份刊物所述[63.].在ProteoWizard上进行串联质谱的提取(版本3.0.8789)。使用吉祥物服务器(Matrix Science,UK;版本2.6.0)分析原始群发数据来检索Medicago truncatula数据库(版本4.0,57,693条目)根据我们以前的出版物中的描述[63.].基于标记的定量(ITRAQ,TMT,SILAC等)用支架Q进行鉴定的肽和蛋白质进行+(版本Scaffold_4.6.2,Proteome Software Inc.,Portland,Or),如上一篇文章中所述[65.].此外,多肽和蛋白质的鉴定是根据我们以前的出版物建立的[63.].蛋白质先知算法分配蛋白质概率[66.].含有类似肽的蛋白质并不能仅基于仅基于MS / MS分析来分化的蛋白质,以满足规定的原理。如前一项研究所述,常规化迭代强度[67.].手段用于差异分析。光谱数据是对数转换的,修剪匹配多个蛋白质的那些,或者缺少参考值,并由自适应强度加权算法加权。另外,折叠变化阈值> 1.20或<0.83(p < 0.05) was used to identify differentially enriched proteins based on Student’st-测试。
QRT-PCR分析
按照制造商的说明,用SV总RNA提取系统(Promega, Madison, WI, USA)分离总RNA。使用Prime Script™RT试剂盒(Takara,北京,中国)合成第一链cDNA。qRT-使用Takara TB Green™Premix EXQ™II(TLI RNASEH Plus)套件(Takara,中国)对ABI棱镜7300检测系统(应用生物系统)进行PCR。十一甲酸的mRNA转录水平(包括红叶绿素分子还原酶(XP_003617849.2),白棕色复合ABC转运蛋白(XP_003630284.1),果白酶/果酸酶抑制剂(XP_003622699.1),NAD(P)H脱氢酶B2(XP_013455573.1(+ 1)),镁 - 原生素IX单甲基酯环化酶(XP_003624856.1),镁 - 螯合酶亚单位Chli(XP_003593716.1),光收获复合物I叶绿素A / B结合蛋白(XP_013450965。1),在根培养物(XP_003626890.1)中诱导的毒素诱导,抑制抑制/休眠相关蛋白(XP_003593620.1),树皮储存样蛋白(XP_013462016.1)和细胞色素B5样血红液/类固醇 -binding domain protein (XP_003627519.1)) identified in leaves and thirteen DEPs (including 4-coumarate: CoA ligase-like protein (XP_003604127.1), auxin-binding protein ABP19a (XP_003627273.1), NAD(P)H: quinone oxidoreductase (XP_003615608.1), horseradish peroxidase-like protein (XP_003602461.1), phosphoenolpyruvate carboxylase (XP_003597124.1), phenylalanine ammonia-lyase-like protein (XP_003591877.1), fasciclin domain protein (XP_003597210.2), cinnamyl alcohol dehydrogenase (XP_003628601.1), HAD-family hydrolase IIA (XP_003608097.1), caffeoyl-CoA 3-O-methyltransferase (XP_003607927.1), riboflavin synthase alpha chain (XP_013443595.1), shikimate/quinate hydroxycinnamoyl-transferase (XP_013454529.1), and caffeic acid O-methyltransferase (XP_003602396.1)) identified in stems were measured, and the β-actin gene (mRNA, EU664318.1) was used as an internal reference. Relative gene expression was quantified using the 2-△△CT方法 [68.].分析用三种生物学重复进行,并在补充表中提供所有引物序列11.,并在补充表中列出了原始数据12.和13..
蛋白质的生物信息学分析
使用BLAST2GO软件进行功能类别分析(http://www.geneontology.org)[69.].kegg数据库(http://www.genome.jp/kegg/patpway.html.),以获取有关生物化学途径及分子相互作用的最新资讯[70].在表达丰富的标准化之后,在R(版本3.2.2)中执行分层聚类分析。使用串数据库产生涉及苯丙烷化生物合成的DEP的蛋白质 - 蛋白质相互作用网络(http://string-db.org.)[71.].使用单向ANOVA分析基因表达数据以进行统计学意义(*表示p < 0.05, ** indicatesp < 0.01, Duncan’s multiple range test) in SPSS 21.0.
可用性数据和材料
支持本文结果的数据包含在文章和提供的补充文件中。蛋白质组学原始数据被提交给IProx数据库(项目ID:IPX0002423000)。
缩写
- ITRAQ:
-
等压标签用于相对和绝对量化
- 德尼尔斯:
-
近红外反射光谱
- NDB2:
-
NAD(P)H脱氢酶B2
- 朋友:
-
苯丙氨酸氨酶样蛋白
- C4H:
-
细胞色素p450家族肉桂醛4-羟基化酶
- COMT的:
-
咖啡酸O-methyltransferase
- 4CL:
-
4-香豆酸:辅酶a连接酶样蛋白
- MGL:
-
单甘油酯脂肪酶样蛋白质
- HCT:
-
HXXXD型酰基转移酶家族蛋白质
- CCoAOMT:
-
Caffeoyl-CoA 3-O-甲基转移酶
- CAD:
-
肉桂醇脱氢酶样蛋白
- 合:
-
辣根过氧化物酶样蛋白
- GH1:
-
糖苷水解酶家庭1蛋白
- F5H:
-
细胞色素P450家族单加氧酶
- PBGD:
-
卟酚脱氨基酶
- UPOD:
-
尿卟啉原脱羧酶
- BCHG:
-
细菌叶绿素合酶
- RCCR:
-
红色叶绿素抗粘土石还原酶
- MPEC:
-
镁原激霉IX单甲酯环化酶
- BSL:
-
树皮储存蛋白质
- ARP:
-
营养抑制/休眠相关蛋白
- 空气:
-
生长素诱导的根培养蛋白
参考
- 1。
Rodriguez Re,Debernardi JM,Palatnik JF。简单叶子的形态发生:叶片尺寸和形状的调节。Wiley Interdicip Rev Biol。2014; 3:41-57。
- 2.
生长素调控植物侧枝器官的起始和径向位置。植物细胞。2000;12:507-18。
- 3.
Petridis A,Therios I,Samouris G,Koundouras S,Giannakoura A.水资源赤字对叶片酚醛组成,气体交换,氧化损伤和四个希腊橄榄(4)的抗氧化活性(齐墩果欧洲公司L.)品种。植物理性生物化学。2012; 60:1-11。
- 4.
王志强,王志强,王志强,等。干细胞在植物维管发育中的作用。EMBO j . 2009; 20:1097 - 106。
- 5。
Baluškaf,Volkmann D,Menzel D.细胞骨架 - 血浆膜 - 细胞壁连续植物。重新审视新兴的链接。植物理性。2003; 133:482-91。
- 6。
C .苜蓿茎的细胞壁分化与节间发育的关系:生物化学方面。中国农业科学(英文版)1998;46:3458-67。
- 7。
MarkovićJP。紫花苜蓿叶和茎木质素结构的变化与反刍动物营养的关系Afr J agricultural Res. 2012; 7:257-64。
- 8。
Nordkvist E,ÅmanP.在解剖学和化学成分中生长过程中的变化和葡萄糖的体外降解性。J SCI食物农业。1986; 37:1-7。
- 9.
Buxton博士,霍恩斯坦JS。苜蓿,鸟螨三叶草和红色三叶草分层檐型细胞壁浓度和组分。作物SCI。1986; 26:180-4。
- 10。
Yang SS, Xu WW, Tesfaye M, Lamb JF, Jung HG, VandenBosch KA, Vance CP, Gronwald JW。利用跨物种平台对比茎中细胞壁组成的两种苜蓿基因型的转录谱分析:通过掩蔽偏倚探针的优化分析。BMC基因组学。2010;11:323。
- 11.
恩格斯fm,jung hg。Alfalfa Stem组织:细胞墙开发和褐化。Ann Bot。1998年; 82:561-8。
- 12.
Kumar S.苜蓿改善的生物技术进步。J Appl Genet。2011; 52:111-24。
- 13.
Boschetti e,righetti pg。植物蛋白质组学方法达到低丰度蛋白。方法Mol Biol。2014; 1072:111-29。
- 14。
Printz B,Guerriero G,Serjeant K,Renaut J,Lutts S,Hausman J. Ups和Downs在苜蓿中:在生长茎中发生蛋白质组学和代谢变化。植物SCI。2015; 238:13-25。
- 15.
风扇W,GE G,刘y,王W,刘L,贾Y.与代谢组学相结合的蛋白质组学:分析不同生长阶段苜蓿营养变化的内部原因。BMC植物BIOL。2018; 18(1):78。
- 16。
Casler M.饲养营养价值增加的成就和影响。农作物科学。1999; 39:12-20。
- 17。
利用转基因技术提高作物细胞壁消化率。植物科学。2012;65:185-6。
- 18。
Reddy MSS,Chen F,Shadle G,Jackson L,Aljoe H,Dixon Ra。针对苜蓿饲料质量改善的细胞色素P450酶的下调(Medicago Sativa.L.)。Proc Natl Acad Sci U S A. 2005; 102(46):16573-8。
- 19.
蔗糖合酶是纤维素合成的重要组成部分。植物生理学杂志。2010;51:294。
- 20。
Boudet Am,Lapierre C,Grimapettenati J.生物化学和褐化分子生物学。新植物。2010; 129:203-36。
- 21。
Vanholme R,Demedts B,Morreel K,Ralph J,Boerjan W.木质素生物合成和结构。植物理性。2010; 153:895-905。
- 22。
王志强,王志强,王志强,等。生物质作物中新型木质素的代谢工程研究。新植醇。2012;196:978 - 1000。
- 23。
王Y,Maxime C,Richard S,Simon H.植物细胞壁褐煤和单醇代谢。前植物SCI。2013; 4:220。
- 24.
KINTAMURA H.苯丙氨酸氨酶中的免疫细胞化学定位杨树kitakamiensis.Planta。1996年; 200:13-9。
- 25.
kao yy,harding sa,tsai cj。两种不同苯丙氨酸氨酶基因的差异表达在凝结的单宁积累和褐煤中爆炸白杨.植物杂志。2002;130:796 - 807。
- 26。
HYRAMBIK D,GRISEBACH H.来自大豆 - 细胞悬浮培养的肉桂醇脱氢酶同工酶的纯化和性质。FEBS J. 1975; 59:9-15。
- 27。
Lee D,Meyer K,Chapple C,Douglas C.反义抑制4-香豆酸盐:辅酶酶活性拟南芥导致改变木质素亚基组合物。植物细胞。1997年; 9:1985-98。
- 28。
Moinuddin SG。推测的多基因4-香豆酸:辅酶a连接酶网络在体内和体外的特性拟南芥:丁香酰木质素和sinapate/sinapyl醇衍生物的形成。植物化学,2005;66:2072 - 91。
- 29。
郭丹,陈芳,Inoue K, Blount JW, Dixon RA。转基因苜蓿中咖啡酸3- o -甲基转移酶和咖啡酰辅酶a 3- o -甲基转移酶的下调:对木质素结构的影响及对G和S木质素生物合成的影响植物细胞。2001;13:73 - 88。
- 30.
Hoffmann L,Besseau S,Geoffroy P,Ritzenthaler C,Meyer D,Lapierre C,Pollet B,Legrand M.羟基肉桂酰基辅酶的沉默Shikime / Quinate羟基肉桂酰基转移酶影响苯丙醇酸酯生物合成。植物细胞。2004; 16:1446-65。
- 31。
Johnson KL,Jones BJ,Schultz CJ,Bacic A.非酶细胞壁(Glyco)蛋白。Ann Plant Rev Online。2018; 8:111-54。
- 32。
Nieuwland J.脂质转移蛋白增强烟草中的细胞壁延伸。植物细胞。2005; 17:2009-19。
- 33。
Uppalapati SR, Ishiga Y, Doraiswamy V, Bedair M, Mysore KS。叶背面表皮蜡质的损失Medicago Truncatula Irg1./Palm1.突变体导致炭疽病孢子瘤和非黑锈病病原菌的孢子分化降低。植物细胞。2012; 24:353-70。
- 34。
TASEGE M,Lin H,Bedair M,Berbel A,Wen J,Rojas Cm,Niu L,Tang Y,Sumner L,Ratet P. Stenofolia调节刀片外泌叶和叶血管图案Medicago Truncatula.和Nicotiana sylvestris..植物细胞。2011; 23:2125-42。
- 35。
周C,汉L,Fu C,Wen J,Cheng X,Nakashima J,MA J,Tang Y,Tan Y,Tadege M.转作短干扰RNA3途径和无顶端单位拮抗叶裕度发育和侧向器官通过分析Argonaute7 / Lobed Leaplet1突变体揭示的分离Medicago Truncatula..植物细胞。2013;25:4845 - 62。
- 36.
王H,陈J时,温家宝J, Tadege M,李G,刘Y,迈索尔KS,陈PRAR。花/叶同源单叶控制复叶发育的研究Medicago Truncatula..植物杂志。2008;146:1759 - 72。
- 37.
史密斯GL。叶片的开始和测定。植物细胞。1992年; 4:1017-27。
- 38。
筑屋叶形状:遗传控制和环境因素。Int J Dev Biol. 2005; 49:547-55。
- 39。
Eshed Y,Baum SF,Bowman AJL。明显的机制促进了心脏的极性建立拟南芥.细胞。1999;99:199 - 209。
- 40.
Eshed Y,Baum Sf,Perea JV,Bowman JL。植物侧外器官的极性建立。Curr Biol。2001; 11:1251-60。
- 41。
Kerstetter RA, Bollman K, Taylor RA, Bomblies K, Poethig RS. KANADI调节器官极性拟南芥.自然。2001; 411:706-9。
- 42。
Siegfried Kr等人。Yabby基因家族的成员指定了Zhaxial Cell Fate拟南芥.发展。1999年; 126:4117-28。
- 43。
Durufléh,clemente hs,balliau t,zivy m,dunand c,jamet e等。细胞壁蛋白质组分析拟南芥蒂利亚纳成熟茎。蛋白质组学。2017; 17:1600449。
- 44。
不对称叶1和生长素的活性共同抑制短梗花的表达,促进叶的发育拟南芥.发展。2006;133:3955 - 61。
- 45。
秦克,顾人,赵y,ma z,shi g,杨y,pichersky e,chen h,liu m,chen z.一种吲哚-3-乙酸羧基甲基转移酶调节拟南芥叶发育。植物细胞。2005; 17:2693-704。
- 46。
Ljung K,Hull Ak,Kowalczyk M,Marchant A,Celenza J,Cohen JD,Sandberg G.生物合成,缀合,分解代谢和吲哚-3-乙酸的稳态拟南芥蒂利亚纳.植物mol biol。2002; 49:249-72。
- 47。
Leutwiler Ls,Meyerowitz em,托宾em。三个光收获叶绿素A / B结合蛋白基因的结构和表达拟南芥蒂利亚纳.核酸RES。1986; 14:4051-64。
- 48.
Matsuo M,Endo T,Asada K.呼吸NAD(P)H脱氢酶的性质从蓝杆菌中分离SyneChocystis.PCC 6803.植物细胞生理。1998年; 39(3):263-7。
- 49.
Mi H,Endo T,Ogawa T,Asada K.囊糊膜结合,NADPH特异性吡啶核苷酸脱氢酶复合物在蓝藻中介导循环电子传输SyneChocystis.sp。PCC 6803.植物细胞生理。1995年; 36(4):661-8。
- 50。
关键词:NAD (P) H脱氢酶,LHCI,光系统I,超复合物拟南芥.植物细胞。2009; 21:3623。
- 51.
Gibson LC,Jensen Pe,Hunter CN。镁螯合酶乳头杆菌sphaeroides.:使用纯化的亚基和BCHI-BCHD复合物的证据初始表征酶。Biochem J. 1999; 337(2):243。
- 52.
Gibson LC, Willows RD, Kannangara CG, von Wettstein D, Hunter CN。Magnesium-protoporphyrin chelatase的乳头杆菌sphaeroides.:通过组合BCHH,-I和-D基因的产品来重建活性大肠杆菌.美国国家科学学院1995;92:1941。
- 53。
黄叶1编码叶绿素生物合成的镁-原卟啉IX单甲基酯环化酶奥雅萨苜蓿L.)。Plos一个。2017; 12:E0177989。
- 54。
黄志强,王志强,王志强,等。淀粉合成酶的研究进展[j]。
- 55。
林宝,金hj,nam hg。叶衰老。Annu Rev植物Biol。2007; 58:115-36。
- 56。
托马斯。H。欧汉。j。瓦格斯塔夫。C。定义衰老和死亡J Exp Bot. 2003; 54:1127-32。
- 57。
陈志强,陈志强。叶绿素a降解过程中镁离子脱螯合反应的研究。Photosynth杂志2002;74:217-23。
- 58。
Takamiya Ki,Tsuchiya T,OHTA H.叶绿素的降解途径:基因克隆显示出什么?趋势植物SCI。2000; 5:426-31。
- 59。
Pruzinska A,Anders I,Aubry S,Schenk N,Tapernoux-Luthi E,Muller T,Krautler B,Hortensteiner S.在叶绿素分解中的红叶叶蛋白还原酶的体内参与。植物细胞。2007; 19:369。
- 60。
Fernando C,Fernie AR。番茄果实开发的代谢调节。J Exp Bot。2006; 57:1883-97。
- 61。
Munnik T,Vermeer Jem。渗透胁迫诱导的磷酸阳性和植物中的肌醇磷信号。植物细胞环境。2010; 33:655-69。
- 62。
关键词:二氢黄酮醇4-还原酶,氨基酸,底物特异性植物j . 2010; 25:325-33。
- 63.
孙辉,龙瑞荣,张峰,张天军,康建明,王铮,曹春英,于军,杨春华。两个不同花期紫花苜蓿品种茎尖蛋白质组学分析。植物学报2019;37(4):265-76。
- 64.
Wisniewski J,Zougman A,Nagaraj N,Mann M.通用样品制备方法进行蛋白质组分析。NAT方法。2009; 6(5):359-62。
- 65。
ABDALLAH C,SERGENT K,GUILLIER C,DUMAS-GAUDOT E,LECLERCQ CC,RENAUT J. ITRAQ标记的优化与EFFGEL分级相结合,作为蛋白质组学工作流程分析微粒体蛋白Medicago truncatula根。蛋白质组SCI。2012; 10(1):37。
- 66。
Nesvizhskii AI, Keller A, Kolker E, Aebersold RA。串联质谱鉴定蛋白质的统计模型。肛门化学2003;75:4646-58。
- 67。
Oberg AL, Mahoney DW, Eckel-Passow JE, Malone CJ, Wolfinger RD, Hill EG, Cooper LT, Onuma OK, Spiro C, Therneau TM。用方差分析对复杂样品的相对标记质谱数据进行统计分析。蛋白质组学杂志2008;
- 68。
Bustin SA Benes V Garson JA。MIQE指南:实时荧光定量PCR实验发表的最低信息。中国化学2009;55:611-22。
- 69。
Blast2GO:植物基因组学功能分析的综合套件。植物基因组学杂志,2008;
- 70.
Kanehisa M,Goto S,Sato Y,Furumichi M,Tanabe M.Kegg用于集成和解释大规模分子数据集。核酸RES。2012; 40:D109-14。
- 71。
Szklarczyk D, Gable AL, Lyon D, Junge A, Wyder S, huertacepas J, Simonovic M, Doncheva NT, Morris JH, Bork P. STRING v11:覆盖范围增加的蛋白-蛋白关联网络,支持全基因组实验数据集的功能发现。核酸Res. 2019;47: D607-13。
致谢
我们感谢文山郭和长福杨在表型数据收集中的技术帮助。
资金
这项工作得到了中国农业研究系统(CARS-34),中国国家重点基础研究计划(973计划)(2015CB943500)和农业科技创新计划(ASTIP-IAS14)的专用基金支持。资金机构在研究的设计,收集,分析和解释方面没有发挥作用或稿件的写作。
作者信息
隶属关系
贡献
R.L.和Q.Y.构思和设计了实验。H.S.,J.Y.,R.L.和F.Z.进行实验。R.L.,H.S.,J.Y.,F.Z.,M.L.,W.L.,J.K.,Z.W.和J.Z.。分析了数据。H.S.,R.L.,J.Y.和Q.Y.写了这篇论文。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
作者声明没有竞争利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
M和F基因型苜蓿的营养参数。
附加文件2:图S2。
这项工作的技术路线图。
附加文件3:表S1。
ITRAQ中的总鉴定蛋白在MS和FS中。
附加文件4:表S2。
ITRAQ中的总鉴定的蛋白质在m1和FL中。
附加文件5:表S3。
使用ITRAQ在MS和FS中鉴定的差异富集的蛋白质。
附加文件6:表S4。
使用ITRAQ IN ML和FL鉴定的差异富集的蛋白质。
附加文件7:表S5。
MS和FS中差异富集的蛋白质的GO注释分析。
附加文件8:表S6。
ML和FL中差异富集蛋白质的GO注释分析。
附加文件9:表S7。
MS和FS中差异富集蛋白的KEGG富集分析。
附加文件10:表S8。
ML和FL中差异富集蛋白的KEGG富集分析。
附加文件11:表S9。
MS和FS中差异富集蛋白的KEGG显著富集分析。
附加文件12:表S10。
ML和Fl中差异富集的蛋白质的显着性富集分析。
附加文件13:表S11。
本研究中使用的引物序列。
附加文件14:表S12。
茎中QRT-PCR的原料数据。
附加文件15:表S13。
叶片中QRT-PCR的原始数据。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
太阳,H.,Yu,J.,张,F。等等。基于ITRAQ的比较蛋白质组学分析,两种苜蓿基因型茎和叶片蛋白质谱的差异。BMC植物BIOL.20,447(2020)。https://doi.org/10.1186/s12870-020-02671-2
已收到:
公认:
发表:
关键词
- 苜蓿
- 蛋白质组学
- 干
- 叶子
- 木质素综合
- 光合作用